需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
多细胞球体的生产和多参数活细胞荧光寿命成像显微镜 (FLIM)
* 这些作者具有相同的贡献
摘要
在这里,我们描述了不同的多细胞球体形成方法,以执行后续多参数活细胞显微镜检查。使用荧光寿命成像显微镜 (FLIM)、细胞自发荧光、染色染料和纳米颗粒,展示了分析活三维 (3D) 癌症和干细胞衍生球状体中细胞代谢、缺氧和细胞死亡的方法。
摘要
多细胞肿瘤球体是一种流行的 3D 组织微聚集体模型,用于复制肿瘤微环境、测试和优化药物治疗以及在 3D 环境中使用生物和纳米传感器。它们的易于生产、可预测的大小、生长以及观察到的营养和代谢物梯度对于概括 3D 生态位样细胞微环境非常重要。然而,球状体的异质性及其生产方法的可变性会影响整体细胞代谢、活力和药物反应。考虑到大小、可变性、生物制造需求以及在干细胞和癌细胞生物学中用作 体外 3D 组织模型的要求,这使得选择最合适的方法变得困难。特别是,球状体的产生会影响它们与定量活体显微镜的兼容性,例如光学代谢成像、荧光寿命成像显微镜 (FLIM)、使用纳米传感器监测球状体缺氧或活力。这里介绍了许多常规的球状体形成方案,突出了它们与活体宽场、共聚焦和双光子显微镜的兼容性。还介绍了使用多重自荧光 FLIM 以及使用各种类型的癌症和干细胞球体的后续成像到分析管道。
引言
多细胞球状体代表一组 3D 组织模型,由细胞自聚集获得,呈球形。它们广泛用于在体外模拟细胞间和细胞间基质相互作用,并在多种癌症和干细胞衍生构建体中复制 3D 环境。采用多种技术来减少细胞粘附并促进聚集。这些方法包括依赖于表面张力1 的悬滴法;细胞附着排斥方法,如超低附着板、微模具和微孔 2,3;基于声波的方法4;流动诱导聚集方法(旋转瓶、生物反应器和微流体装置)5;磁性粒子辅助形成6 以及使用促进聚集的合成和基于 ECM 的基质和支架 7,8,9。
在癌症研究、开发和新药疗法的验证中,球状体是一种有吸引力的模型,因为它们能够概括营养物质、废物和 O2 的空间扩散限制梯度,通常会导致形成坏死核心,这是实体瘤的典型特征10,11。根据动物研究的 3R 原则(替代、还原和精炼),这些更可靠、更复杂的体外模型挑战了广泛使用动物模型的需求(食品和药物管理局 [FDA] 现代化法案 2.012)。除了癌症,球状体还可用于干细胞研究。例如,多能干细胞具有形成拟胚体 (EB) 的能力,可用于诱导多能干细胞 (iPSC) 分化为难以直接从患者那里获得的特殊细胞类型,例如神经前体细胞13 或卵巢颗粒细胞13,14。此外,EB 的形成通常是开发更复杂的类器官模型的第一步,例如神经15、视网膜16、心脏17、肝脏18、胃19 和肠道类器官20。在为实验选择合适的球状体形成方法时,应考虑包括大小、重现性、通量和下游应用在内的因素。
与 2D 培养相比,3D 培养的复杂性增加会导致更高的变异性。营养成分21、介质蒸发22、粘度23、pH 控制24、球状体形成方法,甚至培养时间25,26 等因素都可能导致获得不同形态、大小、活力和不同化学抗性的球状体27,28.最近的研究表明,球体氧梯度并不总是静态的,并且受形成方法、球体大小和细胞外粘度的影响,从而影响球体异质性29。为了提高微球的可重复性和数据可访问性,我们开发了 MISpheroID 知识库26,将细胞系、培养基、形成方法和微球大小确定为可重现结果的最小信息。因此,对多种高通量(SphericalPlate 5D、实验室制造的微模具和微组织模具)和低附着方法(即 Biofloat 和 Lipidure 涂层的 96 孔板,无支架和基于支架)进行了详细比较(图 1 和表 1),包括孔大小(给定最大球体尺寸的估计)、使用的耗材、准备时间以及在不将球体运输到显微镜培养皿的情况下监测球体的可能性。 后者支持长期研究,而使用高通量方法生产的球体通常会导致终点实验。除 5DspheriPlate 的网格外,所有方法都不会带来不需要的自发荧光,因此可以直接在显微镜中使用。
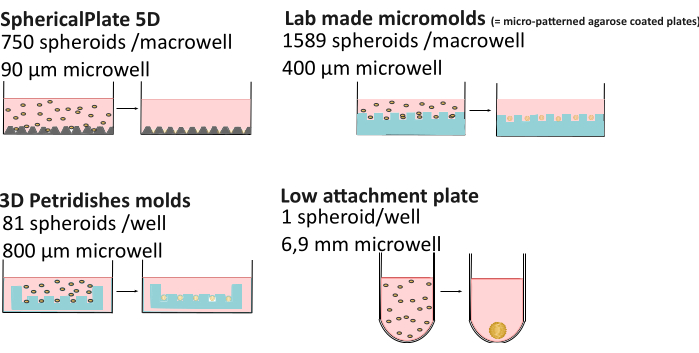
图 1:球体形成方法解释。 高通量方法,例如 SphericalPlate 5D,它在板中集成了专利微孔,而实验室生产的微模具和 MicroTissue 模具使用印章在琼脂糖(蓝色)中制作多个微孔。Lipidure (Amsbio) 和 Biofloat (Sarstedt) 等低附着板使用非粘附涂层,可抑制细胞表面粘附并促进细胞自聚集。 请单击此处查看此图的较大版本。
| 5D 球形板 | 自产微模 | 微组织 | 低附着方法 | |
| 球状体数量/孔 | 750 | 1589 | 81 | 1 |
| 直径井 | 90 微米 | 400 微米 | 800 微米 | 1 毫米 |
| 培养体积 | 1 毫升 | 5 毫升 | 1 毫升 | 200 微升 |
| 其他耗材 | / | 7 mL 3% 琼脂糖 | 500 μL 2% 琼脂糖 | / * |
| 准备时间 | 10 分钟 | 2 小时 + 3 天培养基适应 | 0.5 小时 + 15 分钟培养基适应 | 10–30 分钟 + 1 小时干燥 |
| 监测 | 是的 | 不** | 是的 | 是的 |
| 自发荧光 | 是的 | 不 | 不 | 不 |
| 可 重用 | 不 | 是的 | 是的 | 不** |
| 成本 | €€ | € | €€€€ | €€€€€: 涂层和 Matrigel |
| €€:商用 96 孔板 | ||||
| *一些细胞系需要添加 ECM(即 2%–5% Matrigel)以形成紧凑的球状体。 | ||||
| **涂层可重复使用,直到用完。但是,每个板会消耗少量介质,并且灰尘会随着时间的推移而积累。经常需要过滤器消毒。 | ||||
表 1:多种球体形成方法的比较29."监测":无需转移到显微镜培养皿中即可监测球体的能力。€: 0-50€, €€: 50-150€ , €€€: 150-500€ , €€€€: >500€
荧光显微镜能够直接监测球状体内的关键生物学方面,包括细胞死亡、活力、增殖、代谢、粘度,甚至机械特性30。荧光寿命成像显微镜 (FLIM) 为研究荧光探针在其(微)环境中的相互作用 31,32,33,34 提供了额外的定量维度,从而可以根据不同的发射寿命35,36 分辨重叠的发射光谱以及基于内在细胞自发荧光探测细胞代谢。因此,烟酰胺腺嘌呤二核苷酸磷酸 (NAD(P)H)、黄素单核苷酸 (FMN)、黄素腺嘌呤二核苷酸 (FAD)、原卟啉 IX 等广泛使用的细胞自发荧光化合物可以用单光子和双光子 FLIM 测量,并作为葡萄糖分解代谢、氧化磷酸化 (OxPhos) 的内在"传感器",并提供细胞氧化还原状态的一般概述。NAD(P)H 存在于游离细胞质中,或以蛋白质结合的线粒体形式存在37,38。同样,FAD 的氧化态是荧光的,游离形式的寿命更长。NAD(P)H 和 FAD 显微成像通常涉及双光子激发的 FLIM,旨在防止样品光损伤39。通常,"光学代谢成像"FLIM 可以与基于染料的探针、基因编码的生物传感器、磷光寿命成像显微镜 (PLIM) 和基于比率强度的测量结合使用,以提供球状体或类器官代谢、氧合、增殖和细胞活力的更完整图像 29,30,31.此外,FLIM 还可以与 Förster 共振能量转移 (FRET) 方法结合使用,以测量与受体紧密接触时供体荧光团的寿命变化,以研究药物与其靶结构域的结合 33,40,41。
通常对采集的 FLIM 图像进行分析,以逐个像素计算寿命。目前,至少有 3 种常用策略用于获得荧光寿命:半定量"快速 FLIM"42(有时称为"tau 感"43,44)、衰变曲线拟合,使用一、二或三指数拟合,以及具有相量变换和相量图分析的"无拟合"方法。根据供应商的不同,可以使用提供的(LAS X、Symphotime、SPCImage 等)或开源软件(例如 FLIMfit45、FLIMJ46 或其他47)来处理测量的 FLIM 数据。通常,供应商提供的软件可用于初步数据分析,而开源解决方案可以使用相量图和 3D 可视化等工具提供更准确的研究。
尽管 FLIM 作为研究球体的方法有用且有吸引力,但可用的实验方案很少,并且在选择最合适的形成方法以成功进行涉及 FLIM 的活体多参数显微镜实验方面普遍缺乏知识。在这里,根据它们的形态、活力和氧合,与最近验证和表征的远红外和近红外 (NIR) 氧传感纳米传感器 (MMIR1) 详细比较了常用的球状体形成方案。阳离子纳米颗粒浸渍了两种报告染料,即参比 O2 不敏感的氮杂-BODIPY(激发波长 650 nm,发射波长 675 nm)和 NIR O2 敏感的金属卟啉 PtTPTBPF(激发波长 620 nm,发射波长 760 nm)。MMIR1 能够在传统荧光显微镜(使用比率分析)或磷光寿命显微镜 (PLIM) 上实时分析氧梯度,而不会引入细胞毒性,并允许稳定的信号、长期监测和多路复用25,29。根据使用染料或纳米传感器染色的需要、球状体通量或细胞类型,可以选择最合适的形成方案。由于球体活力和氧合的研究与癌症和干细胞衍生的球体的研究相关,因此提出的方案还包括 NAD(P)H-FLIM 和 FAD-FLIM 与这些模型的示例和预期典型结果。所提出的成像和分析管道针对最流行的基于时间相关单光子计数的 FLIM 显微镜平台。
研究方案
1. 多细胞球体的产生
- 细胞培养
注:细胞培养物可从美国典型培养物保藏中心 (ATCC)、Lonza、Sigma-Aldrich 或其他供应商处收集。ATCC 提供所有必需的处理信息,包括首选生长培养基、传代培养程序、生物安全水平、生长速率和 STR 谱。在这里,将人结肠癌细胞系 HCT116 的 500 个细胞/球体用于补充有 10% FBS 和 1 mM 丙酮酸钠的 McCoy 5A 培养基 (VWR, 392-0420) 中。对于每天监测的长期实验,可以在培养基中加入 10 mM HEPES,pH 值为 7.2。- 培养细胞培养物以达到 70%-90% 汇合度。
- 用预热 (37 °C) 无菌 PBS(25 cm2 瓶为 5 mL,每 75 cm2 烧瓶为 10 mL)冲洗细胞。
- 加入 0.05% 胰蛋白酶 - 1 mM EDTA 溶液(25 cm² 为 0.5 mL,或每 75cm2 培养瓶 1 mL),并在 37 °C、5% CO2、95% 湿度下孵育 5-10 分钟,以达到细胞分离。
注意:在透射光(明场)显微镜下控制细胞分离。细胞过度暴露于解离酶溶液会影响其活力。 - 通过添加含有 10% FBS 的过量细胞培养基(每 1 mL 解离溶液至少 5 mL 培养基)来中和胰蛋白酶。
注:对于在低 FBS 或无 FBS 培养基上培养的细胞,可以通过向胰蛋白酶处理的细胞培养物中加入 0.5 mL 100% FBS,然后离心以将细胞转移到其原始培养基中来完成胰蛋白酶中和。 - 通过移液分离细胞聚集体,以获得培养基中的单细胞悬浮液。
注:使用顶部有 1000 μL 移液器吸头的血清移液器移液,可显著改善大体积悬浮细胞培养中单细胞悬液的生成。 - 使用计数室(Neubauer 规则血细胞计数器或其他替代品)计数每 1 mL 细胞悬液的细胞数。
- 稀释细胞悬液以获得每毫升所需的细胞数。
- 向细胞悬液中加入终浓度为 10 μg/mL 的浓 O2 探针(纳米颗粒)溶液,用于 O2 的比率分析。
注:为确保细胞悬液均匀(使用探针),请在球状体形成前多次重悬。如果不需要 O2 探针,请跳过此步骤并继续形成球状体。处理 iPSC 时应应用修改后的方案。简而言之,iPSC 在 Geltrex 包被板上的菌落中生长,并使用 ReLeSR 传代,如供应商提供的方案48 中所述。在球状体形成当天,菌落应大、紧凑,并表现出具有明显边界的多层中心。用预热的无菌 PBS 冲洗细胞。加入 1 mL 温和的细胞解离试剂 (GCDR) 并在 37 °C 下孵育 8-10 分钟。使用 1000 μL 吸头轻轻地从孔中分离细胞并获得单细胞悬液。将单细胞悬液转移至无菌 50 mL 锥形管中,并加入 4 mL 预热的 DMEM-F12 培养基以中和 GCDR。用 1 mL DMEM-F12 洗涤孔,并将其转移到细胞悬液的其余部分。以 300 x g 离心 5 分钟。重悬于 1 mL 的适当培养基中,用于进一步实验。对于本手稿中描述的实验,使用了 mTeSR + 10 μM Rock 抑制剂。对细胞悬液进行计数和稀释,以获得所需的每毫升细胞数。
- 球体形成方法
- 3D 培养皿微模具
注:这种高通量方法用于在直径为 800 μm、深度为 800 μm 的 9 x 9 微模具阵列中同时生成大量球状体(81 个球状体)。- 在 dH2O 中冲洗用于铸造 3D 培养皿的微模具,并放入可高压灭菌的容器中。
- 量取 2 g 电泳级琼脂糖粉末,并将其放入干燥的 200 mL 高压灭菌安全玻璃瓶中。
注:确保瓶子和琼脂糖粉末干燥,无液体或湿气。 - 用于用琼脂糖粉末在干循环中浇注 3D 培养皿和瓶子的高压灭菌微模具 30 分钟。
- 通过在 100 mL 超纯水中加入 0.9 g NaCl 制成 0.9 w/v% 盐水溶液,并通过高压灭菌灭菌。
注意:NaCl 是制造商推荐的。它增加了琼脂糖的稳定性。 - 通过将无菌盐水添加到灭菌的琼脂糖粉末中来制备琼脂糖溶液。拧上松散的盖子,以避免压力积聚。旋转瓶子以混合琼脂糖粉。
- 使用微波炉煮沸并溶解琼脂糖粉。经常停止微波炉(~每 10 秒)。旋转瓶子并重复,直到琼脂糖溶解。
注意:琼脂糖溶液很热,需要小心处理。熔化程序后立即摇晃可能会导致溶液从容器中爆裂。为避免事故,请使用装满不超过容量 50% 的足够大的容器,并使用适当的个人防护用品(手套、烤箱手套、护目镜和实验室外套)。 - 让溶解的琼脂糖溶液冷却至 60-70 °C。 使用无菌技术和条件,将熔融琼脂糖移液到微模具中(12 系列为 500 μL,24 系列为 330 μL)。
注:混合或移液琼脂糖时避免形成气泡。在琼脂糖凝固之前,通过移液或轻轻刮擦去除微模具小特征中捕获的任何小气泡。 - 让琼脂糖凝固约 2-3 分钟。然后,小心地弯曲微模具以取出 3D 培养皿并转移到 12 孔组织培养板上。
注:微模具的过度弯曲可能导致琼脂糖模具内形成裂纹。 - 为了平衡 3D 培养皿,添加 2.5 mL/孔细胞培养基。孵育 15 分钟或更长时间。去除培养基并用新鲜培养基替换。再次重复以用培养基平衡 3D 培养皿。
注意:该协议可以在此处中断,直到细胞接种。对于长期储存(在 4 °C 下长达 2 周),请使用 PBS 溶液代替培养基。 - 完全去除培养基(或 PBS)周围的 3D 培养皿,并通过倾斜组织培养板准确去除 3D 培养皿内的培养基。
- 小心地将 190 μL 含有 40,500 个细胞的细胞悬液滴加到细胞接种室中(参见步骤 1.1)。
注:琼脂糖印记中的微孔数决定了每个印记产生的球体数。在这种情况下,该琼脂糖模具包含 81 个微孔(81 x 500 个细胞/球状体)。添加到大孔中的悬浮液中细胞浓度的变化允许改变每个球体的细胞数,从而控制球体的大小。 - 让细胞沉淀到 3D Petri dsh 的特征中 ~10 分钟。然后,向 3D 培养皿的外部添加 2 mL 培养基。
- 将组织培养板放入细胞培养箱中,并根据需要更换 3D 培养皿周围的培养基。
- 低连接板
注意:此方法用于每孔生成单个球体。包被板(脂质或 Biofloat)是市售的(跳过步骤 1.2.2.1-1.2.2.4)。或者,该涂层可以单独购买,用于涂覆未经处理的多孔板。建议用无菌水或 PBS 填充 96 孔板边缘的孔,因为这些孔中的蒸发速度更快,从而将球状体的孔数限制为 60 个。如果需要较少的球体,请用水或 PBS 填充周围的空井。使用无尘吸头进行液体处理,以避免将小颗粒带入孔中,因为它们会干扰球状体的形成。- 将 0.25 g 聚合物粉末溶于玻璃瓶容器中的 50 mL 乙醇中,制备 0.5 w/v% 包被溶液。对涂层进行过滤消毒。
注:过滤器灭菌和所有后续步骤必须在层流下的无菌条件下进行。 - 向 96 U 底培养板的每个孔中加入 200 μL 包被溶液。
- 孵育 1 分钟并去除多余的涂层。
注:涂层溶液可多次使用。在室温 (RT) 下储存在玻璃容器中。不建议使用塑料容器,因为塑料会部分溶解并成为溶液的一部分。如果存在灰尘,请使用 0.22 μm 聚醚砜 (PES) 或尼龙针式过滤器进行过滤消毒。 - 让 96 孔板风干约 1 小时。
注意:如果细胞需要细胞外基质,请继续执行步骤 1.2.3。包被板包裹在铝中后可在 RT 中储存长达 1 个月。当接种较低量的细胞/孔时,以 300 g 离心板 5 分钟有助于拉低细胞。
- 将 0.25 g 聚合物粉末溶于玻璃瓶容器中的 50 mL 乙醇中,制备 0.5 w/v% 包被溶液。对涂层进行过滤消毒。
- 细胞外基质辅助形成方案
注:一些细胞系本身不能产生足够的细胞外基质 (ECM),需要添加 ECM,例如 Matrigel、Cultrex 或 Geltrex 才能形成紧凑的球体 49,50,51。对于乳腺癌 MDA-MB-231、人真皮、前列腺癌细胞等细胞类型,可以使用步骤 1.2.2 并进行以下修改52,需要添加 ECM。最好使用无尘吸头进行液体处理,以避免灰尘干扰球状体的形成。步骤 1 和 4-7 必须在生物安全柜(II 级)下进行。- 继续执行步骤 1.2.2.1-1.2.2.4(低连接板)进行表面处理。
- 将 96 孔板在冰箱中于 4 °C 预冷。
- 使用适用于 96 孔板的正确适配器准备离心机,并将其预冷 4 °C。
- 在预冷 (4 °C) 细胞培养基中制备 5% 基底膜基质 (BMM) 溶液。
注意:BMM 在 RT 处快速交联。处理时,请将原液和溶液放在冰上。 - 准备细胞悬液(参见步骤 1.1)。
- 向每个孔中加入 50 μL BMM 溶液。
- 在 BMM 溶液(25,000 个细胞/孔)上的每个孔中轻轻加入 50 μL 细胞悬液。
注意:不要将此体积喷射到孔中,否则细胞会在孔的侧面扩散,而不会聚集在底部。通过相应地调整细胞密度,可以获得较低的每孔细胞数。并非所有细胞都会在所有接种密度下形成球状体;必须根据 cell type 和 desired dimension 进行优化。在提供的体积下,BMM 的最终浓度为 2.5%。如果需要不同浓度的储备液,则必须制备较低/较高浓度的储备液。 - 将 96 孔板在 300 x g 和 4 °C 下离心 5 分钟。
注意:如果没有此步骤,细胞将无法在孔底部正确聚集,从而导致形成多个较小的聚集体。离心机必须冷却以避免在此阶段发生交联。 - 将板放入细胞培养箱中。聚集体在播种后第 4 天被视为成熟。
注:有关球体形成的其他方案,请参阅 补充文件 1。
- 3D 培养皿微模具
2. 球状体的实时显微镜检查
- 制备用于实时成像分析的球状体
注:根据实验设计(例如,长期监测或终点分析、显微镜设置或测量荧光的光谱特性)或由于球状体生产方法与显微镜的不兼容(例如,样品厚度、材料的自发荧光、成像过程中球状体的浮动)直接监测板中产生球状体的地方, 可能无法。该协议解释了用于成像的球体的制备,这些球体适用于大多数倒置宽场和共聚焦显微镜。- 准备并预热 (37 °C) 成像介质:补充有 HEPES-Na、pH 7.2 (10 mM)、丙酮酸钠 (1 mM)、L-谷氨酰胺 (2 mM) 和葡萄糖 (5 mM) 的 DMEM,不含酚红。
注:如果在成像过程中提供 CO2 控制,则可以单独使用碳酸氢钠或与 HEPES-Na 结合使用24。某些细胞培养类型不能耐受 HEPES 的存在。根据实验设计,可以修改丙酮酸、谷氨酰胺和葡萄糖含量。 - 准备无菌显微镜培养皿(市售或实验室制造),带有涂层(用于强球体粘附力)或非涂层(低球体粘附力)盖玻片表面(厚度 #1.5)。
注:涂层的需求和类型取决于细胞类型、球体的粘附特性以及它们从 3D 到 2D 培养界面的细胞迁移速率。这一点很重要,因为涂层会促进 3D 组织的损失,改变球状体中微梯度的形状,从而改变细胞行为。对于某些实验(例如,成像分析对药物刺激的反应),需要对表面的球状体有很强的粘附性,并且最好涂有明胶、BMM、胶原蛋白、胶原蛋白/多聚-D-赖氨酸或多聚-D-赖氨酸的涂层。 - 从微图案琼脂糖或 96 孔板的微孔中轻轻洗出 O2 探针染色的球状体,并将仍然漂浮的球状体转移到 2 mL 样品瓶中。
注:为确保从高通量方法中收集所有球状体,请用额外体积的培养基冲洗模具 1-3 次,将所有球状体悬浮液混合在一个小瓶中。对于低连接板中的球体,如果少量球体足以进行实验,则将球体从单个孔逐个收集到小瓶或直接收集到显微镜培养皿中。转移大球状体时,切开移液管尖端的末端,以确保移液过程中不会损坏。 - 将样品瓶垂直放置长达 5 分钟,让球体沉淀在样品瓶底部,形成可见的颗粒。
- 从试管中取出培养基,保持球体不受干扰,然后轻轻地将它们重悬于足够量的新鲜培养物中。
注意:为了方便球体处理,也可以在此阶段小批量将球体转移到成像介质中;请参阅步骤 2.1.7 和 2.1.8。应平等对待来自不同实验组的球体,因为培养基成分和培养基预处理时间会影响其代谢。 - 当球体漂浮时,在显微镜培养皿的每个孔中转移等体积的球状体悬浮液。
- 将球体在 CO2 培养箱中于 37 °C 孵育 1-2 小时,以确保它们附着在显微镜培养皿/孔的表面。对于成像,请继续执行步骤 2.1.9。对于使用其他探针对球体进行染色,请继续执行步骤 2.1.8。
注意:单元从 3D 球体迁移到 2D 表面界面的速率是时间的函数。为避免 3D 组织损失,必须根据细胞类型、表面涂层类型和实验设计优化孵育时间。例如,HCT116 取决于球体大小,需要至少 2 小时才能将球体正确附着到胶原 IV/poly-D-赖氨酸包被的表面,而 hDPSC 附着和迁移到 2D 界面非常快,导致 3D 组织在 1-2 小时内丢失。为避免由于过度扩散而对"2D 球体"进行成像,使用未镀膜的玻璃表面,以减少孵育时间。 - 将推荐或经验优化浓度的荧光探针添加到已知体积的球状体悬浮液中。成像前在 37 °C CO2 培养箱中孵育 1 小时。
注:对于活/死测定,使用标准终浓度为 1 μg/mL 的碘化丙啶和钙黄绿素 Green-AM。为避免碘化丙啶染色对 iPSC 拟形体的毒性作用,碘化丙啶的最终浓度为 0.5 μg/mL。如果由于球体尺寸大而导致探针的扩散效率不高,则探针加载时间可能会延长。加载时间应始终被视为球体附着到表面所需的总孵育时间的一部分。如果球体附着需要更长的时间,则应在此期间结束时安排染色程序。请注意,较长的孵育时间可能会导致 3D 组织丢失。 - 去除细胞培养基或含有荧光探针的培养基,并将其更换为必要体积的成像培养基。为确保球体成像途中没有培养基荧光背景,重复培养基更换(洗涤)步骤最多 5 次。
注:为避免在培养基更换过程中去除球状体,建议使用 200 μL 移液器从显微镜培养皿的边缘小心吸出培养基,并在显微镜培养皿中沿壁或侧面添加培养基。 - 立即继续执行成像协议的步骤 2.2.1。
注:从制备到成像和实际成像采集之间的过长间隔会影响细胞代谢(例如,通过改变培养基成分)、活力(一些用于终点分析的荧光探针具有毒性作用,在长时间孵育后会刺激细胞死亡)并导致 3D 组织丢失。如果必须比较多组球体或实验条件,则必须相应地制定实验设计,以保持分析组之间治疗、预处理和成像程序的时间尽可能相等。
- 准备并预热 (37 °C) 成像介质:补充有 HEPES-Na、pH 7.2 (10 mM)、丙酮酸钠 (1 mM)、L-谷氨酰胺 (2 mM) 和葡萄糖 (5 mM) 的 DMEM,不含酚红。
- 图像采集
注意:该协议描述了使用 Stellaris 8 Falcon (Leica) 共聚焦显微镜和 Leica Application Suite X (LAS X) 软件版本 4.7 对活球体进行多参数成像。但是,只需进行微小的修改即可在替代显微镜平台上进行此类分析。- 成像前 30-60 分钟打开温度气候控制装置。设置必要的通风速度和温度 (35-37 °C)。
注意:如果除了温度控制之外,成像过程中还必须控制气体浓度(例如 CO2 或 O2),则还应提前启动相应的设备,以达到成像前的必要条件。 - 打开显微镜和连接的设备(即 WLL 激光器、计算机、水浸物镜的水泵和其他操作电子块)。启动与精确显微镜设置一起提供的显微镜控制软件(例如,LAS X 机器模式 或 带环境控制的机器模式)并初始化载物台校准。
- 在软件中选择所需的物镜,并根据需要应用浸入液。
注意:对于实时显微镜,建议使用具有足够("长")工作距离的水或甘油浸没物镜,例如 HC Fluotar L 25x/0.95 W VIS IR(2.4 mm 工作距离)、HC PL Apo 40x/1.25 GLYC(0.35 mm 工作距离)或至少 NA = 0.4 或更高的空气物镜。放大倍率和工作距离的选择取决于成像样品的性质和大小以及测得的荧光信号(亮度、量子产率、染色效率,参见例如,关于染料和纳米颗粒的讨论53)。大型物体(球状体或类器官,>500 μm 大小)、"生物反应器"或微流控芯片需要长工作距离物镜和较低的放大倍率,而单个细胞或细胞器的分析需要高放大倍率,通常通过"马赛克"成像实现。 - 在载物台上设置带有球体的显微镜培养皿。调整焦点并查找目标/感兴趣区域 (ROI)。
注意:如果必须找到小的、微弱的荧光、对比度差或稀有的物体并且很难找到焦点,建议预先聚焦在显微镜培养皿的壁上,并通过蛇形石"筛选"感兴趣的物体表面,从孔的一个角落开始。 - 选择 Open Project 窗口,然后单击相应的图标 Create a New Project。为研究项目文件指定一个标准名称(例如,从"YY-MM-DD+ 描述"开始)。在成像过程中,所有生成的图像将自动保存到创建的项目 .lif 文件中。
- 打开 Acquisition 窗口。根据测量荧光的已知光谱特性(激发/吸光度和发射光谱),设置白光激光 (WLL) 激发波长和混合或共振扫描检测器(HyD S、HyD X 或 HyD R 型)的所需范围。选择 Line (行 ) 或 Frame types of scan(扫描的 Line 或 Frame types of scan)。
注:对于大多数市售荧光染料,光谱特性可以在 LAS X Dye Assistant 包中找到(或添加)。选择具有与探针光谱特性兼容的适当光谱灵敏度范围的探测器,并且在 FLIM 的情况下,与光子计数兼容(即 HyD X 或 HyD R)。对于多参数成像,将 WLL 设置在多个激发位置(例如,对于 FAD/Flavins 和比率 MMIR1 O2 探针的两个荧光通道的同时成像 - 参考和敏感,激发/发射设置可能是 460 nm/510-590 nm HyD X1 和 614 nm/631-690 HyD X3 和 724-800 nm HyD R相应地在一个或两个连续扫描序列中)。分配适当的探测器来收集发射很重要,因为探测器可能具有不同的光谱灵敏度54。 - (对于 FLIM 是可选的)在 Acquisition 窗口中,选择 FLIM 模式以执行结合光子计数(衰变收集)的成像。将立即打开一个额外的"LAS X 软件中的 FLIM 模块"来导航和分析 FLIM 数据。
- (对于 FLIM 是可选的)根据预期的荧光团平均寿命选择 WLL 脉冲重复率。
注意:必须调整激光脉冲的频率以收集完整的荧光衰减。这可以使用安装在显微镜上的 Pulse Picker 功能来完成。荧光衰减与激光脉冲的重叠将导致估计的荧光寿命缩短。建议的脉冲间隔比预期的平均荧光寿命长 4-5 倍(例如,寿命长达 5 ns,为 25 ns/40 MHz)。许多脉冲激光器具有固定的 80 MHz 重复频率(仅适用于高达 2-3 ns 的范围)。这对于为实验选择正确的荧光基团非常重要。 - 使用 FAST LIVE 模式开始预览成像,并调整成像对象在感兴趣部分上的精细焦距。
注意: 严格遵守激光安全规则。始终考虑激光安全规则,并等到成像停止后再打开透射灯,观察目镜或样品。
注意:在 FAST LIVE 模式下,600 Hz(如果使用双向 X 扫描模式,则对应于最大帧速率 4.43/s)的高速扫描会自动应用于图像,以 256 x 256 像素的分辨率,以防止荧光发生光漂白。如果荧光信号太弱而无法聚焦在物体上,则打开针孔(例如,至 3-4 AU)和/或增加激光强度。避免不完整的腐烂收集。 - (对于 FLIM 是可选的)通过在 FLIM 模块 窗口(实时 模式)中查看成像过程中出现的像素强度直方图,调整适当的激光强度/针孔大小和分辨率,以实现计数率 ~1 光子/激光脉冲限制(红线)。避免明显高于 1 以排除堆积效应的风险。如果需要,调整 WLL 脉冲重复率,以便在衰减窗口中获得完整的衰减收集(为避免不完整的衰减收集,请参阅步骤 2.2.8)。
注意:如果光子数量(强度)不足以重建可靠的衰减以进行拟合分析或相量图云,请应用多次扫描重复(帧或线,或设置扫描时间),增加激光强度和/或牺牲分辨率(扫描的 ROI 大小)。请注意,降低激光重复率需要收集更多的光子才能实现可靠的衰变重建,并且可能需要对成像参数进行额外的校正。注意强光和长时间连续照明对细胞活力和代谢的潜在影响55。在每种情况下,对活力和代谢的负面影响可能不同,具体取决于激发光的强度、持续时间和波长,以及成像方式(例如,单光子共聚焦与多光子成像)。相应地调整成像参数,并在必要时,在中试实验中通过钙黄绿素 Green-AM 或碘化丙啶强度控制细胞活力/死亡56。在可能的情况下,应考虑进一步优化荧光探针染色方案,以在实时显微镜检查期间达到足够的荧光信号。 - (对于 3D z 堆栈,可选)在 Fast Live 模式下,设置坐标、扫描方向,并将其归因于 Z 堆栈窗口(XYZ 扫描模式)中的 Begin 和 End。选择 Z 步长或步长数。
注意:虽然软件会根据使用的分辨率和扫描参数自动计算"最佳"步数,但实时 3D 重建通常需要较少的步骤来实现快速采集,例如,1-2 μm 步长、50-100 μm 堆栈大小、双向扫描,需要 2-3 分钟的总扫描时间。请注意,亚细胞器、细胞和 3D 细胞模型在测量过程中也会移动。此外,由于光穿透深度和散射极限,通常只能在共聚焦 FLIM 上实现 50-100 μm 的扫描深度。 - 应用所有必要的设置后,开始映像。
- 为图像指定适当的名称。
- 在透射光模式下搜索下一个成像对象,并使用先前优化的成像设置重复成像过程(步骤 2.2.8-2.2.12)。
注意:对于基于强度的比较或强度比分析(例如,基于 MMIR O2 探针的氧合分析),请始终对所有分析对象保持相同的成像设置(放大倍率和物镜类型、激光强度、功率和脉冲频率、激发波长、探测器范围、针孔、扫描速度、像素停留时间和分辨率)。然而,由于荧光寿命不取决于荧光强度,并且需要收集适当数量的光子才能进行可靠计算,因此可以在实验过程中重新调整 FLIM 成像参数,以保持收集的光子数在不同处理或实验条件之间具有可比性。因此,对于需要基于强度和基于荧光寿命的分析的多参数分析,必须对比较实验组中的所有对象应用优化的通用成像设置。对于"仅 FLIM"比较,可以将采集的图像与成像设置略有不同进行比较,因为 LAS X 软件提供了单个图像测量的 IRF 计算42。但是,对于 LAS X 之外的 FLIM 拟合分析(例如 FLIMfit45),应针对每种不同的成像条件测量仪器响应函数 (IRF),因为它无法从成像软件中导出。因此,为了简化实验设计和工作负载,建议对数据集中的所有图像应用相同的成像设置。然后,可以使用具有被测光谱通道 57,58,59 发射特性的淬灭或快速荧光寿命荧光团(在 ps 范围内)进行相应的 IRF 测量,通过金纳米颗粒发光60 或通过多光子 FLIM61 的二次谐波产生信号.在 LAS X 软件中,可以通过右键单击感兴趣的文件并选择 Apply Image Settings 来为新项目加载先前优化的成像参数。 - 映像会话完成后,保存映像项目。为了完成成像过程,请从显微镜载物台中取出样品,并根据成像设施中实施的标准程序从浸没液(如果使用)中清洁物镜。关闭项目和软件。关闭显微镜、激光器和所有连接的设备。
- 继续进行成像数据分析(步骤 2.3)。
- 成像前 30-60 分钟打开温度气候控制装置。设置必要的通风速度和温度 (35-37 °C)。
- 使用 LAS X FLIM 模块和 FIJI 进行 NAD(P)H/FAD-FLIM 相量图像处理
注意:该协议描述了 NAD(P)H 和 FAD/Flavins 自发荧光 FLIM 实例上频域数据的成像球体的荧光寿命分析。NAD(P)H 自发荧光测量成为代谢分析的金标准,其中短和长 NAD(P)H 自荧光寿命成分分别与糖酵解或氧化磷酸化 (OxPhos) 相关。这可以通过相量图上沿代谢轨迹向游离 NAD(P)H 或蛋白质结合的 NAD(P)H 的测量标准品的偏移来分析31,62.为了分析代谢变化的轨迹,以及比较实验组之间图上相量云的位置(参见步骤2.3.6下面的注释),基于相量云的几何中心(质心)的计算,实施了简化的相量坐标分析29.所描述的协议演示了斐济中质心坐标的计算,并使用坐标测量相量图上两点之间的距离(例如,从球体 NAD(P)H 自荧光相量云的质心到"游离 NAD(P)H"理论点的距离)。同样,可以分析 FAD 和其他自发荧光信号。数据集 1 .lif (需要 LAS X 软件)或 .ptu 提供了用于学习此过程的文件格式 (补充文件 2, 补充文件 3, 补充文件 4, 补充文件 5, 补充文件 6, 补充文件 7, 补充文件 8, 补充文件 9, 和 补充文件 10).- 在 LAS X 中打开 FLIM 模块,选择打开项目,然后加载球状体图像文件 (.lif) 以进行自发荧光 NAD(P)H/FAD 分析。
注意:由于 FLIM 模块中存在潜在错误和中间数据丢失,请使用原始球状体图像文件 (.lif) 的副本进行 NAD(P)H/FAD 分析,同时保持原始文件不变。 - 选择单个图像并导航到 FLIM 分析界面。点击 Phasor 以访问相量图并激活相量分析模式。应用过滤器(中位数 或 小波)并设置 阈值 ,以最小化噪声并提高所有相量分析的数据可见性。选择谐波。对于基于 NAD(P)H 数据的代谢变化分析,请继续执行步骤 2.3.3-2.3.5。对于相量图的一般比较,请从步骤 2.3.6 开始。
注意:将分析设置(滤波器类型、谐波、阈值、合并和相量 ROI)均匀应用于比较数据集中的所有图像。 - (NAD(P)H 分析可选)选择任何与数据集相关的图像,并使用 Draw Ratio Cursor for Two Components 选项来准确定位标准相量绘图空间的通用圆上 0.45 ns 的位置。该位置将被分配给游离 NAD(P)H 的纯均相溶液的平均荧光寿命,该溶液通常接近单指数衰减62。
注:游离 NADH 和游离 NAD(P)H 在水溶液中具有相似的光谱特性和相似的荧光寿命值,具有两个短寿命分量,0.3 ns 和 0.7 ns63。因此,为了基于相量的分析的简单性,并且由于寿命分量之间的微小差异,它们的荧光衰减被认为是单指数的,这允许在宇宙圆上分配相量云。游离 NAD(P)H 形式的参考平均寿命也可以在相量空间中测量和绘制,以进行类似的分析。参考寿命是根据文献62 选择的;请注意,在其他来源中,可以发现溶液中游离 NAD(P)H 的值略有不同 (0.4 ns64)。 - (NAD(P)H 分析可选)通过右键单击图并选择 导出数据,导出具有分配的游离 NAD(P)H 寿命的相量图(参见步骤 2.3.3)。将相量图作为 .tiff 格式文件导出到指定的存储文件夹。
注意:从 LAS X FLIM 模块导出的相量图图像的原始像素大小始终为 1024 x 600 像素。如果使用其他软件进行数据导出和预分析,请确保以相同的大小和分辨率导出所有相量图图像。 - 要导出与球体相关的相量云,请使用 LAS X FLIM 模块中的 Draw Cursor 工具选择图像上的球体 ROI。如步骤 2.3.4 中所述导出生成的相量图。
注意:相量空间的相应 g 和 s(类似于 x 和 y)坐标将根据它们的寿命分配给所选 ROI 的每个像素,并转换为频域数据集64,65。具有相似 tf (相位寿命)和 tm (调制寿命) 值的像素簇将在图上形成云图案(相量云),其中颜色编码(范围从深蓝色到红色)将反映寿命值的丰富性。通过云在宇宙圆上或内部的位置,可以区分单指数或多指数衰减。一些测量介质表现出强(自)荧光,导致在相量图上出现相应的云,这不能简单地用强度阈值来去除。此模式将影响质心坐标计算,并且必须从导出的相量图中排除。使用球状体 ROI 可以从进一步的相量分析中排除不相关的像素。 - 对数据集中的所有球状体 ROI 重复相量图导出过程(参见步骤 2.3.4 和 2.3.6)。此外,检查导出的 .tiff 图像集,以保证完整的数据集以进行进一步的比较分析,并确保所有导出的图像具有相同的像素大小(请参阅步骤 2.3.4 中的注释)。
注意:在协议的这个阶段,图像集必须包括具有游离 NAD(P)H 位置的相量(基于文献或经验获得的数据)和所有球状体 ROI(或替代 ROI 模式,如果特定分析需要)相量图。从此步骤开始,将在斐济进行进一步分析,然后在电子表格中进行分析。使用 分析工具 窗口,在 FIJI 中设置 比例 选项,并确保所有相量图图像都使用相同的单位类型进行校准,例如,仅以像素为单位。如果没有,请在 Set Scale 窗口中为所选单位设置长度(例如,对于基于像素的缩放,在 Distance in Pixels 字段中输入 1,并将长度单位设置为 Pixel)。为了进一步比较,请使用相同的单位类型测量所有导出的数据。 - (NAD(P)H 分析可选)确定相应导出的相量图图像上游离 NAD(P)H 平均荧光寿命的像素点位置(参见步骤 2.3.3):用 FIJI 打开相量图像,放大图像以像素分辨率清楚地可视化通用半圆和 双分量比率光标 线之间的交点;使用 Rectangle ROI 工具选择交点。
注意:确保矩形选择是交点周围的小区域,以便在下一步(步骤 2.3.9)中准确确定其坐标。 - (NAD(P)H 分析可选)打开 Analyze 工具,选择 Set Measurements 窗口,然后选择质心作为测量参数。单击分析工具窗口中的测量以确定游离 NAD(P)H 参考点的质心坐标。将这些坐标导出到电子表格。
注意:Free-NAD(P)H坐标将用作参考点,以比较从该点到数据集中球体相量云位置的距离(在NAD(P)H FLIM自发荧光分析中表征糖酵解和OxPhos之间代谢变化的方法) - 使用 FIJI 打开椭球体相量云的图像。打开 图像窗口 工具,选择 调整,然后选择 颜色阈值 在工具栏中。选择所选的阈值方法(例如,Otsu),并设置色相值和亮度值,以缩小选择具有最丰富像素坐标的相量云部分的参数。单击 Select 以定义集群区域。
注意:对于必须分析的所有相量图图像,请保持相同的阈值参数。对于呈现的 NAD(P)H-FLIM 数据,选择了设置色相值 9 和亮度值 160 的阈值方法 Otsu 并将其应用于所有相量图像。或者,可以将所选区域复制到 ROI Manager(按照路径 Edit > Selection > Add to Manager) 创建相量 ROI 库以进行进一步分析。 - 在保持选择的同时,按照步骤 2.3.9 中描述的过程计算所选区域的质心坐标。将这些坐标导出到电子表格文件。
- 重复步骤 2.3.9 和 2.3.10 以确定所有 ROI 相量图像的质心坐标,以在电子表格中创建数据集。
注意:使用 ROI Manager ROI 库有助于简化和组织 ROI 分析(请参阅步骤 2.3.10) - (NAD(P)H 分析可选)打开包含来自不同比较组的导出的无参考 NAD(P)H 和球状体 ROI 坐标的电子表格。使用确定的坐标和以下等式计算每个单独的球体相量质心之间的距离,以参考游离 NAD(P)H 位置:
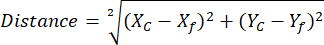
其中,Xc 和 Yc 是质心坐标,Xf 和 Yf 是参考坐标。
注意:仅当数据集中的所有质心都位于朝向参考点的同一线性轨迹上时,才适合应用质心参数来确定向参考寿命的偏移。为了检查这一点,必须将数据集中的所有质心与同一坐标空间中的参考点一起绘制,并执行线性趋势对齐。如果通过所有点绘制的线性趋势线的 R2 系数接近 1(例如,R2 为 0.8-0.99),则假定距离分析是合适的。 - 相应地组织所有数据以进行比较,并使用任何相应的软件(例如 Origin、MatLab)进行统计分析。根据数据集特征(分布正态性、统计单位数等)选择合适的统计检验。
注意:对于 NAD(P)H 分析,根据实验条件比较距离值以表征代谢变化。要比较实验组之间的任何相量图,请执行 ROI 相量云质心坐标的比较。
- 在 LAS X 中打开 FLIM 模块,选择打开项目,然后加载球状体图像文件 (.lif) 以进行自发荧光 NAD(P)H/FAD 分析。
结果
选择合适的球体形成方法
所选的球状体形成方法可以极大地影响球状体的大小、形状、细胞密度、活力和药物敏感性(图 2)。以前,比较了多种高通量(SphericalPlate 5D、实验室制造的微模具和微组织模具)和"中等通量"低附着(Biofloat 和 Lipidure 涂层的 96 孔板)方法对球体活力和氧合的影响29。
在这里,不同的形成方法?...
讨论
多细胞球状体正在成为肿瘤和干细胞生态位微环境研究、药物发现和生物制造"组织构建块"开发的首选方法。球状体的异质性内部结构、营养物质梯度和氧合可以在相对简化和可访问的环境中模拟体内组织和肿瘤的梯度。由于需要更高的方法透明度26,28 和标准化71,这些协议有望帮助研究人员为实时定量荧光寿命成像显微镜实验?...
披露声明
没什么可透露的。
致谢
这项工作得到了根特大学特别研究基金 (BOF) 资助 (BOF/STA/202009/003;BOF/IOP/2022/058)、佛兰德斯研究基金会(FWO,I001922N)和欧盟,fliMAGIN3D-DN Horizon Europe-MSCA-DN No. 101073507。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 10 mL serological pipets | VWR | 612-3700 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3D Petri Dish micromolds | Microtissue | Z764000-6EA | |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 70% ethanol | ChemLab | CL02.0537.5000 | |
| Biofloat | Sarstedt | 83.3925.400 | Commercial available coated 96-well plate for spheroid formation |
| Calcein Green-AM | Tebubio | AS-89201 | Apply in dilution 1:1000 |
| CellSens Dimension software | Olympus | version 3 | |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Confocal FLIM Microscope | Leica Microsystems | N/A | Stellaris 8 Falcon inverted microscope with white-light laser, HyD X detectors, climate / T control chamber (OkoLab), 25x/0.95 W objective |
| D(+)-Glucose | Merck | 8342 | Prepare 1 M stock solution, 1:100 for preparation of imaging medium (final concentration 10 mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Fetal Bovine Serum (FBS) | Gibco | 10270-098 | Also available from Sigma. Needs to be heat-inactivated before use. |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10 mM) |
| Human colon cancer cells HCT116 | ATCC | ||
| ImageJ | NIH | version 1.54f | |
| Leica Application Suite X (LAS X) | Leica Microsystems | version 4.6.1.27508 | |
| L-glutamine | Gibco | 25030 | Also available from Sigma. Apply in dilution 1:100. |
| Lipidure-CM5206 | Amsbio | AMS.52000034GB1G | |
| McCoy's 5A, need addition of 1 mM Sodium Pyruvate and 10 mM HEPES | VWR | 392-0420 | Standard growth medium for HCT116 cells |
| micro-patterned 3D-printed PDMS stamps | N/A | N/A | Provided by the Centre for Microsystems Technology, Professor Dr. Jan Vanfleteren, Ghent University |
| NaCl | Chemlab | CL00.1429.100 | |
| Neubauer couting chamber | Fisher Scientific | 15980396 | |
| O2 probes: MMIR1 | N/A | N/A | Full characterization, validation and some applications can be found at: https://www.biorxiv.org/content/10.1101/2023.12.11.571110 v1 |
| PBS | Fisher scientific | Gibco18912014 | Dissolve PBS tablet in 500 mL of distilled water. |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma. Apply in dilution 1:100. |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Propidium Iodide | Sigma-Aldrich | 25535-16-4 | Cell death staining, use 1 µg/mL at 1h incubation |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SphericalPlate 5D 24-well | Kugelmeiers | SP5D-24W | |
| sterile petridish | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (25 cm² ) | VWR | 734-2311 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (75 cm²) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| U-bottom 96-well plate | VWR | 10062-900 | Similar products are also available from Sarstedt, Corning, Greiner Bio-one and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
参考文献
- Foty, R. A simple hanging drop cell culture protocol for generation of 3d spheroids. J Vis Exp. (51), e2720 (2011).
- Moskovits, N., et al. Establishing 3-dimensional spheroids from patient-derived tumor samples and evaluating their sensitivity to drugs. J Vis Exp. (190), e64564 (2022).
- Griner, L. M., et al. Generation of high-throughput three-dimensional tumor spheroids for drug screening. J Vis Exp. (139), e57476 (2018).
- Qian, Y., Wei, X., Chen, K., Xu, M. Three-dimensional acoustic assembly device for mass manufacturing of cell spheroids. J Vis Exp. (200), e66078 (2023).
- He, H., et al. Dynamic formation of cellular aggregates of chondrocytes and mesenchymal stem cells in spinner flask. Cell Prolif. 52 (4), e12587 (2019).
- Perez, J. E., Nagle, I., Wilhelm, C. Magnetic molding of tumor spheroids: Emerging model for cancer screening. Biofabrication. 13 (1), 015018 (2020).
- Kingsley, D. M., et al. Laser-based 3d bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomater. 95, 357-370 (2019).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Danilevicius, P., et al. laser-made 3D microscaffolds for tissue spheroid encagement. Biointerphases. 10 (2), 021011 (2015).
- Jamieson, L. E., Harrison, D. J., Campbell, C. Chemical analysis of multicellular tumour spheroids. Analyst. 140 (12), 3910-3920 (2015).
- Dmitriev, R., Borisov, S., Jenkins, J., Papkovsky, D. Multiparametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. SPIE BiOS. 9328, (2015).
- Zushin, P. -. J. H., Mukherjee, S., Wu, J. C. FDA Modernization Act 2.0: transitioning beyond animal models with human cells, organoids, and AI/ML-based approaches. J Clin Invest. 133 (21), e175824 (2023).
- Kim, D. -. S., et al. Robust enhancement of neural differentiation from human es and ips cells regardless of their innate difference in differentiation propensity. Stem Cell Rev Rep. 6 (2), 270-281 (2010).
- Hart, D., Gutiérrez, D. R., Biason-Lauber, A. Generation of a human ovarian granulosa cell model from induced pluripotent stem cells. bioRxiv. , 2022 (2022).
- Chiaradia, I., et al. Tissue morphology influences the temporal program of human brain organoid development. Cell Stem Cell. 30 (10), 1351-1367 (2023).
- Wagstaff, E. L., Ten Asbroek, A. L., Ten Brink, J. B., Jansonius, N. M., Bergen, A. A. An alternative approach to produce versatile retinal organoids with accelerated ganglion cell development. Sci Rep. 11 (1), 1101 (2021).
- Thavandiran, N., et al. Design and formulation of functional pluripotent stem cell-derived cardiac microtissues. Proc Natl Acad Sci U S A. 110 (49), E4698-E4707 (2013).
- Harrison, S. P., et al. Scalable production of tissue-like vascularized liver organoids from human pscs. Exp Mol Med. 55 (9), 2005-2024 (2023).
- Noguchi, T. -. A. K., Kurisaki, A. Formation of stomach tissue by organoid culture using mouse embryonic stem cells. Methods Mol Biol. 2017, 217-228 (2017).
- Takahashi, J., et al. Suspension culture in a rotating bioreactor for efficient generation of human intestinal organoids. Cell Reports Methods. 2 (11), 100337 (2022).
- Lagziel, S., Gottlieb, E., Shlomi, T. Mind your media. Nat Metab. 2 (12), 1369-1372 (2020).
- Das, V., Fürst, T., Gurská, S., Džubák, P., Hajdúch, M. Reproducibility of uniform spheroid formation in 384-well plates: The effect of medium evaporation. J Biomol Screen. 21 (9), 923-930 (2016).
- Bera, K., et al. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 611 (7935), 365-373 (2022).
- Michl, J., Park, K. C., Swietach, P. Evidence-based guidelines for controlling ph in mammalian live-cell culture systems. Commun Biol. 2, 144 (2019).
- Okkelman, I. A., Vercruysse, C., Kondrashina, A. V., Borisov, S. M., Dmitriev, R. I. Affordable oxygen microscopy-assisted biofabrication of multicellular spheroids. J Vis Exp. (182), e63403 (2022).
- Peirsman, A., et al. Mispheroid: A knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Froehlich, K., et al. Generation of multicellular breast cancer tumor spheroids: Comparison of different protocols. J Mammary Gland Biol Neoplasia. 21 (3-4), 89-98 (2016).
- Debruyne, A. C., et al. Live microscopy of multicellular spheroids with the multimodal near-infrared nanoparticles reveals differences in oxygenation gradients. ACS Nano. 18 (19), 12168-12186 (2024).
- Debruyne, A. C., Okkelman, I. A., Dmitriev, R. I. Balance between the cell viability and death in 3D. Semin Cell Dev Biol. 144, 55-66 (2023).
- Barroso, M., Monaghan, M. G., Niesner, R., Dmitriev, R. I. Probing organoid metabolism using fluorescence lifetime imaging microscopy (flim): The next frontier of drug discovery and disease understanding. Adv Drug Deliv Rev. 201, 115081 (2023).
- Becker, W. Fluorescence lifetime imaging-techniques and applications. J Microsc. 247 (2), 119-136 (2012).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. J Cell Sci. 134 (9), 1-17 (2021).
- Sarder, P., Maji, D., Achilefu, S. Molecular probes for fluorescence lifetime imaging. Bioconjug Chem. 26 (6), 963-974 (2015).
- Alfonso-Garcia, A., et al. Mesoscopic fluorescence lifetime imaging: Fundamental principles, clinical applications and future directions. J Biophotonics. 14 (6), e202000472 (2021).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: Fundamentals and advances in instrumentation, analysis, and applications. J Biomed Opt. 25 (7), 1-43 (2020).
- Yellen, G. Fueling thought: Management of glycolysis and oxidative phosphorylation in neuronal metabolism. J Cell Biol. 217 (7), 2235-2246 (2018).
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med. 4 (2), 241-263 (2010).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of nad (p) h and fad. Antioxid Redox Signal. 30 (6), 875-889 (2019).
- Verma, A., et al. Fluorescence lifetime imaging for quantification of targeted drug delivery in varying tumor microenvironments. bioRxiv. , 2024 (2024).
- Smith, J. T., et al. In vivo quantitative fret small animal imaging: Intensity versus lifetime-based fret. Biophys Rep. 3 (2), 100110 (2023).
- Alvarez, L. A., et al. Application Note: SP8 Falcon: A novel concept in fluorescence lifetime imaging enabling video-rate confocal flim. Nat Methods. , (2019).
- Roberti, M. J., et al. TauSense: A fluorescence lifetime-based tool set for everyday imaging. Nat. Methods. , (2020).
- Auer, J. M. T., Murphy, L. C., Xiao, D., Li, D. U., Wheeler, A. P. Non-fitting flim-fret facilitates analysis of protein interactions in live zebrafish embryos. J Microsc. 291 (1), 43-56 (2023).
- Warren, S. C., et al. Rapid global fitting of large fluorescence lifetime imaging microscopy datasets. PLoS One. 8 (8), e70687 (2013).
- Gao, D., et al. Flimj: An open-source imagej toolkit for fluorescence lifetime image data analysis. PloS One. 15 (12), e0238327 (2020).
- Tullis, I. D. C., Ameer-Beg, S. M., Barber, P. R., Rankov, V., Vojnovic, B. Mapping femtosecond pulse front distortion and group velocity dispersion in multiphoton microscopy. Proc. SPIE 6089, Multiphoton Microscopy in the Biomedical Sciences VI. , 60890 (2006).
- Zhou, Y., et al. One-step derivation of functional mesenchymal stem cells from human pluripotent stem cells. Bio Protoc. 8 (22), e3080 (2018).
- Benton, G., Arnaoutova, I., George, J., Kleinman, H. K., Koblinski, J. Matrigel: From discovery and ECM mimicry to assays and models for cancer research. Adv Drug Deliv Rev. 79-80, 3-18 (2014).
- Badea, M. A., et al. Influence of matrigel on single-and multiple-spheroid cultures in breast cancer research. SLAS Discov. 24 (5), 563-578 (2019).
- Lang, S., Sharrard, R., Stark, M., Villette, J., Maitland, N. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Barra, J., et al. DMT1-dependent endosome-mitochondria interactions regulate mitochondrial iron translocation and metastatic outgrowth. Oncogene. 43 (9), 650-667 (2024).
- Dmitriev, R. I., Papkovsky, D. B. Intracellular probes for imaging oxygen concentration: How good are they. Methods Appl Fluoresc. 3 (3), 034001 (2015).
- Schweikhard, V., et al. Application Note: The power HyD family of detectors for confocal microscopy. Nat Methods. , (2020).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon flim microscopy. Sci Rep. 12 (1), 11938 (2022).
- Bush, P. G., Wokosin, D. L., Hall, A. C. Two-versus one photon excitation laser scanning microscopy: Critical importance of excitation wavelength. Front Biosci. 12, 2646-2657 (2007).
- Liu, M., et al. Instrument response standard in time-resolved fluorescence spectroscopy at visible wavelength: Quenched fluorescein sodium. Appl Spectrosc. 68 (5), 577-583 (2014).
- Szabelski, M., et al. Collisional quenching of erythrosine b as a potential reference dye for impulse response function evaluation. Appl Spectrosc. 63 (3), 363-368 (2009).
- Chib, R., et al. Standard reference for instrument response function in fluorescence lifetime measurements in visible and near infrared. Meas Sci Technol. 27 (2), 027001 (2015).
- Talbot, C. B., et al. Application of ultrafast gold luminescence to measuring the instrument response function for multispectral multiphoton fluorescence lifetime imaging. Opt Express. 19 (15), 13848-13861 (2011).
- Recording the instrument response function of a multiphoton flim system. Becker & Hickl Available from: https://www.becker-hickl.com/literature/application-notes/recording-the-instrument-response-function-of-a-multiphoton-flim-system/ (2007)
- Leben, R., Köhler, M., Radbruch, H., Hauser, A. E., Niesner, R. A. Systematic enzyme mapping of cellular metabolism by phasor-analyzed label-free nad (p) h fluorescence lifetime imaging. Int J Mol Sci. 20 (22), 5565 (2019).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using nadh and nadph autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Gottlieb, D., Asadipour, B., Kostina, P., Ung, T. P. L., Stringari, C. FLUTE: A python gui for interactive phasor analysis of flim data. Biol Imaging. 3, e21 (2023).
- Malacrida, L., Ranjit, S., Jameson, D. M., Gratton, E. The phasor plot: A universal circle to advance fluorescence lifetime analysis and interpretation. Annu Rev Biophys. 50, 575-593 (2021).
- Okkelman, I., Vandenberghe, W., Dmitriev, R. Role of preconditioning with oxygen and glucose deprivation in promoting differentiation of dental pulp stem cells in 3D culture. Mol Biol Cell. 34 (2), 1212 (2022).
- Park, J. H., et al. The effect of bmp-mimetic peptide tethering bioinks on the differentiation of dental pulp stem cells (DPSCs) in 3D bioprinted dental constructs. Biofabrication. 12 (3), 035029 (2020).
- Pașca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Bryanskaya, E. O., et al. High levels of FAD autofluorescence indicate pathology preceding cell death. Biochim Biophys Acta Gen Subj. 1868 (1), 130520 (2024).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 152 (2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (flim) and extracellular flux analyses. Redox Biol. 30, 101420 (2020).
- Gstraunthaler, G., Seppi, T., Pfaller, W. Impact of culture conditions, culture media volumes, and glucose content on metabolic properties of renal epithelial cell cultures: Are renal cells in tissue culture hypoxic. Cell Physiol Biochem. 9 (3), 150-172 (1999).
- Glickman, R. D. Phototoxicity to the retina: Mechanisms of damage. Int J Toxicol. 21 (6), 473-490 (2002).
- Golub, A. S., Pittman, R. N. Monitoring Parameters of Oxygen Transport to Cells in the Microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , (2018).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41 (2), 191-197 (2006).
- Penjweini, R., Loew, H. G., Hamblin, M. R., Kratky, K. W. Long-term monitoring of live cell proliferation in presence of pvp-hypericin: A new strategy using ms pulses of led and the fluorescent dye cfse. J Microsc. 245 (1), 100-108 (2012).
- Carrasco Kind, M., et al. flimview: A software framework to handle, visualize and analyze flim data. F1000Research. 9, 574 (2020).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. Pam: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophys J. 114 (7), 1518-1528 (2018).
- Chen, S. -. J., Sinsuebphon, N., Barroso, M., Intes, X., Michalet, X. . Optical Molecular Probes, Imaging and Drug Delivery. , (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。