Method Article
تطوير الفحص لفحص الأدوية عالي الإنتاجية ضد البكتيريا الفطرية
In This Article
Summary
طورت هذه الدراسة اختبارا للفحص عالي الإنتاجية ضد خراج المتفطرة مع سلالة مراسل مزدوجة تم إنشاؤها مؤخرا ، باستخدام التألق واللألؤ لتقييم صلاحية البكتيريا بسرعة. سيكون هذا البروتوكول مناسبا للباحثين الذين يهدفون إلى فحص الأدوية الجديدة ضد هذه البكتيريا المقاومة للأدوية.
Abstract
يصعب علاج عدوى المتفطرة الخراجية (Mab) بسبب مقاومة الأدوية الجوهرية العالية ، والتي يمكن مقارنتها بالسل المقاوم للأدوية المتعددة. العلاجات غير فعالة للغاية وتستند إلى نظام متعدد الأدوية ، مما يؤدي إلى انخفاض امتثال المريض. وبالتالي ، يتم حث المجتمع العلمي على تحديد أدوية جديدة وفعالة لعلاج هذه العدوى. تتمثل إحدى الاستراتيجيات المستخدمة لتحقيق هذه الغاية في إعادة استخدام الأدوية - وهي عملية تحديد الفرص العلاجية الجديدة للأدوية الموجودة في السوق ، والتحايل على الوقت اللازم لإنشاء ملفات تعريف الدوائية والسلامة للأدوية الجديدة. مع اعتماد معظم الدراسات حول تطوير الأدوية ضد Mab على الطرق التقليدية والمستهلكة للوقت ، تم تطوير اختبار لفحص الأدوية عالي الإنتاجية ضد البكتيريا الفطرية باستخدام سلالة مراسل مزدوج مطورة داخليا من Mab. باستخدام روبوتات معالجة السوائل ، والفحص المجهري الآلي ، والتحليل ، جنبا إلى جنب مع سلالات المراسل المزدوج المطورة داخليا ، يمكن قياس صلاحية البكتيريا بسرعة باستخدام قراءتين مختلفتين ، اللمعان والفلورة ، دون إضافة كواشف أو تنفيذ أي خطوات إضافية. هذا يقلل من الوقت والتباين بين المقايسات ، وهي ميزة رئيسية للفحوصات عالية الإنتاجية. تم التحقق من صحة البروتوكول الموصوف من خلال فحص مكتبة من 1280 مركبا. تم تأكيد النتائج التي تم الحصول عليها من خلال الأدبيات ، مع الكشف الفعال عن المركبات النشطة. وهكذا ، حقق هذا العمل هدف تزويد الحقل بأداة جديدة للمساعدة في مكافحة هذه البكتيريا شديدة المقاومة للأدوية.
Introduction
المتفطرة الخراجية (Mab) هي مسببات الأمراض الانتهازية المسؤولة عن الالتهابات الرئوية ، خاصة لدى الأشخاص المصابين بالتليف الكيسي واضطرابات الرئة الأخرى. يصعب علاج العدوى التي يسببها Mab بسبب مقاومة الأدوية الجوهرية الرائعة ، والتي يمكن مقارنتها بالسل المقاوم للأدويةالمتعددة 1. الأدوية المتاحة غير فعالة إلى حد كبير بسبب غلاف الخلية الفطرية غير المنفذة للغاية والجينوم الذي يشفر العديد من الإنزيمات التي تعطل المضادات الحيوية2. وبالتالي ، يشمل العلاج مزيجا من عدة أدوية تستغرق شهورا إلى سنوات. يؤدي هذا النظام الصعب متعدد الأدوية جنبا إلى جنب مع انخفاض امتثال المريض إلى متوسط معدل شفاء يتراوح من 30٪ إلى 50٪ 3. علاوة على ذلك ، زاد انتشار الالتهابات الرئوية التي تسببها البكتيريا الفطرية غير السلية على مدى العقود القليلة الماضية ، بما في ذلك تلك التي تسببها Mab1،4. وبالتالي ، يتسابق المجتمع العلمي لتطوير مركبات جديدة لعلاج عدوى ماب.
تتمثل إحدى الاستراتيجيات المتبعة لتحقيق هذا الهدف في إعادة استخدام الأدوية - وهي عملية تحديد الفرص العلاجية الجديدة للأدوية الموجودة. هذا يتحايل على التحدي الأكبر المصاحب لخط أنابيب اكتشاف وتطوير دواء جديد - الوقت5. يستفيد هذا المفهوم البسيط من ملفات تعريف الحرائك الدوائية والسلامة التي تم إنشاؤها بالفعل للعديد من الأدوية لتقليل تكاليف التطوير وتقصير الجدول الزمني الذي يستغرقه الحصول على الدواء من المقعد إلى السرير6. وهكذا ، تم تجميع المكتبات التي تجمع بين مئات إلى آلاف هذه المركبات ، مما يسمح للباحثين باختبار إمكانية إعادة استخدام الأدوية بسرعة ضد مسببات الأمراض التي تهمها.
تستند معظم الدراسات حول تطوير الأدوية ضد Mab إلى اختبار معياري ذهبي ولكنه تقليدي يقيم نشاط المركب في المختبر ضد البكتيريا الفطرية - وحدات تشكيل المستعمرة التي تعد7. على الرغم من دقته ، فإن هذا الإجراء يستغرق وقتا طويلا للغاية ، وسرعان ما يصبح غير ممكن عندما يهدف شخص ما إلى اختبار المكتبات التي تحتوي على آلاف المركبات. تحقيقا لهذه الغاية ، تم دمج الفحوصات عالية الإنتاجية (HTS) في تطوير الأدوية - فحوصات قوية تستفيد من الروبوتات وأجهزة معالجة السوائل ، مما يسمح بفحص آلاف المركبات بسرعةبالتوازي 8. يتم ذلك عادة عن طريق اختبار تركيز واحد في البداية ، باستخدام ألواح ميكروتيتر بتنسيقات 96 أو 384 أو 1536 أو 3456 جيدا ، والتي تعمل كنقطة انطلاق لتحديد الضربات وتحسينها بشكل أكبر في خط الأنابيب لاستخدامها سريريا.
توفر المقايسات المستندة إلى المراسل ميزة كبيرة لمتانة HTS نظرا لبساطتها وحساسيتها مقارنة بالصبغة الأخرى والمقايسات القائمة على الامتصاص7،9. ومع ذلك ، على حد علمنا ، لم تقم سوى عدد قليل من الدراسات بتحسين الفحص عالي الإنتاجية مقابل Mab9.
في الآونة الأخيرة ، طور مختبرنا سلالات مراسل مزدوجة قادرة على إصدار لمعان ومضان10 في وقت واحد. Mab operon_mScarlet هي واحدة من تلك السلالات. إنه مضيء تلقائيا بسبب التعبير عن أوبرون LuxABCDE ، والذي يتضمن لوسيفيراز بكتيري (عن طريق التعبير عن جينات luxAB ) وركيزة ألدهيد طويلة السلسلة (عن طريق التعبير عن جينات luxCDE ). من ناحية أخرى ، يتم الحصول على قراءة الفلورسنت من خلال التعبير عن بروتين فلوري أحمر تم تطويره مؤخرا ، mScarlet ، والذي يتفوق على بروتينات eGFP و mCherry الأكثر استخداما ، مما يوفر إشارة أكثر فعالية11. يتيح لنا استخدام هذه السلالة تقييم صلاحية البكتيريا في الثقافة السائلة عن طريق قياس إشارة الإنارة في قارئ الصفيحة الدقيقة دون إضافة كواشف أو تنفيذ خطوات إضافية. من حيث الكشف ، يسمح التألق الجوهري بالتصور المجهري في الخلايا الحية أو الثابتة دون استخدام الأصباغ أو الأجسام المضادة. يوفر وجود سلالة واحدة مع كلتا القراءات للباحثين ميزة كبيرة عند استخدامها في فحوصات HTS - التباين المنخفض بين المقايسات ذات القراءات المختلفة ، حيث لا توجد حاجة لتبادل السلالات بناء على طبيعة المقايس.
وهكذا ، طور هذا العمل اختبارا عالي الإنتاجية ضد Mab باستخدام سلالة مراسل مزدوجة هندسية داخلية (الشكل 1). سمح ذلك بإجراء تقييم سريع للنشاط المختبري 1280 دواء مخصص لإعادة الاستخدام باستخدام مكتبة تجارية (انظر جدول المواد). أولا ، تم تقييم الأنشطة في مقايسة زراعة المرق باستخدام اللمعان ، وثانيا ، باستخدام البلاعم المصابة ب Mab مستفيدة من إشارة الفلورسنت ، ومحاكاة عملية العدوى التي شوهدت في الجسم الحي12 بشكل أفضل.
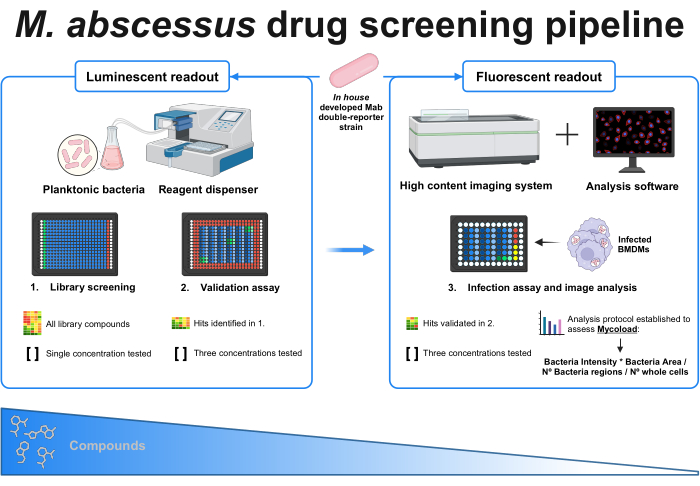
الشكل 1: الملخص الرسومي للبروتوكول المعمول به. اللاعب الرئيسي في هذا الفحص هو سلالة البكتيريا الفطرية المزدوجة المطورة داخليا ، والتي تستخدم في جميع التجارب. أولا ، باستخدام موزع الكاشف والبكتيريا العوالق ، يتم إجراء فحص أولي عن طريق اختبار المركبات بتركيز واحد. تنتقل الضربات المحددة إلى مقايسة التحقق ، حيث يتم اختبار ثلاثة تركيزات مختلفة. تتم كلتا التجربتين باستخدام قراءات المضيء. تنتقل الضربات التي تم التحقق من صحتها إلى مقايسة العدوى ، حيث يتم أيضا اختبار ثلاثة تركيزات مختلفة ، وتصاب البلاعم المشتقة من نخاع العظام في وزارة الداخلية 1. يكتسب نظام التصوير عالي المحتوى إشارة الفلورسنت البكتيرية ، ويتم استخدام برنامج التحليل لتقييم الحمل داخل الخلايا من خلال صيغة Mycoload. يقل عدد المركبات مع زيادة تعقيد الفحص. تم إنشاؤه باستخدام BioRender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل اللجنة المحلية لأخلاقيات في i3S ومرخصة من قبل المديرية العامة للأغذية والبيطرية التابعة للسلطة البرتغالية (DGAV) ، وفقا لتوجيه المجلس الأوروبي (2010/63 / EU) والقانون البرتغالي (DL 113/2013) لرعاية في التجارب.
1. تقييم عامل Z
ملاحظة: لتقييم أداء مقايسة HTS، يمكن تحديد العديد من المعلمات. المعلمة الأكثر استخداما هي العامل الأولي Z (عامل Z). يقيس هذا المقياس حجم التأثير الإحصائي لتجربة معينة ، مما يشير إلى مدى الفصل بين الضوابط الإيجابية والسلبية. إذا تراوح عامل Z بين 0.5 و 1 ، فإن الفصل بين كلا المجموعتين ممتاز ، ويمكن استخدام هذه الشروط في اختبار HTS. إذا كان Z' < 0.5 ، فإن الفصل هامشي فقط ، ولا ينصح بإجراء الفحص13. على هذا النحو ، تم تصميم تجربة باستخدام نصف صفيحة مع بكتيريا غير معالجة والنصف الآخر مع تحكم إيجابي لحساب عامل Z (الشكل التكميلي 1).
- قبل 2-3 أيام من الفحص ، قم بإعداد المزارع المسبقة ل Mab عن طريق تلقيح البكتيريا في وسط نمو سائل (حوالي 1 × 107 CFU / مل) في قارورة Erlenmeyer. اترك البكتيريا تنمو عند 37 درجة مئوية في حاضنة مع التحريض (90 دورة في الدقيقة).
تنبيه: مطلوب خزانة للسلامة الحيوية عند العمل مع مزارع Mab. - اتبع نمو ماب قبل الزراعة عن طريق قياس الكثافة الضوئية عند 600 نانومتر باستخدام مقياس الطيف الضوئي. عندما تصل الثقافة إلى مرحلة النمو الأسي ، انتقل إلى الخطوة 1.3.
- باستخدام الثقافة المسبقة الأسية ، قم بإعداد معلق بكتيري يبلغ حوالي 5 × 105 CFUs / مل (مرتبط بقيم الكثافة البصرية) 14 في وسط نمو السائل.
- تحضير محلول للتحكم الإيجابي في تثبيط نمو البكتيريا في وسط نمو سائل. بالنسبة لهذا الفحص ، كان التحكم الإيجابي هو كلاريثرومايسين (10 مجم / مل في DMSO) عند 4 ميكروغرام / مل. يجب تحضير كلاريثرومايسين 2x التركيز النهائي المطلوب.
- باستخدام موزع كاشف صفيحة دقيقة مزود بشريط صغير ، قم بتوزيع 15 ميكرولتر من وسط نمو السائل على الأعمدة الفارغة وغير المعالجة للوحة البولي بروبيلين السوداء المكونة من 384 بئر. بالنسبة للأعمدة الفارغة ، قم بتوزيع 15 ميكرولتر إضافي من وسط نمو السائل.
ملاحظة: تمنع الأعمدة الفارغة تبخر الآبار الداخلية عند 37 درجة مئوية. - مع موزع كاشف الصفيحة الدقيقة المجهز بشريط صغير ، قم بتوزيع 15 ميكرولتر من محلول التحكم الإيجابي المحضر في الخطوة 1.4 على أعمدة التحكم الإيجابية.
- باستخدام موزع كاشف صفيحة دقيقة مزود بشريط كبير ، قم بتوزيع 15 ميكرولتر من التعليق البكتيري المحضر في الخطوة 1.3 على جميع الأعمدة باستثناء الفراغات ، مما يؤدي إلى تخفيف كل شيء 1: 2. الحجم النهائي لجميع الآبار البالغ عددها 384 بئرا هو 30 ميكرولتر.
ملاحظة: يمكن تجهيز موزع كاشف الصفيحة الدقيقة بشريط كبير أو صغير ، يختلف في حجم الأنبوب (0.5 و 0.22 مم ، على التوالي). يفضل استخدام كاسيت أكبر لمنع تراكم البكتيريا في نظام الأنابيب ، على الرغم من أنه يؤدي إلى مزيد من هدر السوائل. ومع ذلك ، يمكن استخدام نفس الكاسيت في جميع أنحاء الفحص بأكمله. - أغلق كل لوحة باستخدام مادة مانعة للتسرب تسمح بالتبادل المستمر للغازات. احتضان عند 37 درجة مئوية في حاضنة دون تحريض داخل غرفة رطبة لمدة 48 ساعة.
- بعد 48 ساعة ، اقرأ اللمعان المنبعث من البكتيريا في كل لوحة باستخدام قارئ لوحة مع وقت تكامل 1 ثانية.
- لتحديد عامل Z ، استخدم القيم التي تم الحصول عليها في الخطوة 1.9 واحسب المتوسط والانحراف المعياري للعناصر الإيجابية (AVGP و SDP) والسالبة (AVGN و SDN). بعد ذلك ، قم بتطبيق الصيغة التالية:
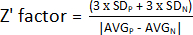
ملاحظة: 3 × SD هو عتبة شائعة الاستخدام. ومع ذلك ، يمكن تعديله ليناسب الفحص بشكل أفضل - إما عن طريق زيادة أو تقليل العامل الذي يمكن به ضرب الانحراف المعياري.
2. فحص المكتبة للزيارات
ملاحظة: تم إجراء الفحوصات الأولى ضد البكتيريا التي تنمو في المزرعة السائلة. تم تصميم الإعداد لألواح 384 بئرا بحجم نهائي 30 ميكرولتر. احتوت كل لوحة على آبار فارغة (وسط نمو سائل فقط) ، وضوابط سلبية (بكتيريا غير معالجة) ، وتحكم في المذيبات (البكتيريا بالإضافة إلى مذيب المركب - في هذه الحالة ، DMSO. الشكل التكميلي 2). تمت إضافة المركبات أو المذيبات إلى اللوحة بمعدل 2x التركيز النهائي المطلوب ، وأضيفت البكتيريا 1: 1 (تخفيف كل شيء إلى النصف).
- تحضير المعلق البكتيري كما هو موضح في الخطوات من 1.1 إلى 1.3.
تنبيه: مطلوب خزانة للسلامة الحيوية عند العمل مع مزارع Mab. - تحضير محلول المذيب في وسط نمو سائل. يجب أن تكون كمية المذيب 2x التركيز النهائي المطلوب.
- باستخدام موزع كاشف صفيحة دقيقة مزود بشريط صغير ، قم بتوزيع 15 ميكرولتر من وسط نمو السائل على كل عمود من ألواح البولي بروبيلين السوداء المكونة من 384 بئر ، باستثناء عمود التحكم في المذيبات. بالنسبة للأعمدة الفارغة ، قم بتوزيع 15 ميكرولتر إضافي من وسط نمو السائل.
- مع موزع كاشف الصفيحة الدقيقة المجهز بشريط صغير ، قم بتوزيع 15 ميكرولتر من محلول المذيبات المعد مسبقا على عمود التحكم في المذيبات.
- باستخدام معالج السوائل ، انقل 200 نانولتر من المركبات من ألواح المخزون المكونة من 96 بئرا (1 ملي مولار في DMSO) إلى الألواح المكونة من 384 بئرا ، باستثناء الفراغات والتحكم في المذيبات والأعمدة غير المعالجة. المركبات الآن بتركيز 13.3 ميكرومتر.
- باستخدام موزع كاشف صفيحة دقيقة مزود بشريط كبير ، قم بتوزيع 15 ميكرولتر من التعليق البكتيري المحضر في الخطوة 2.1 على جميع الأعمدة باستثناء الفراغات ، مما يؤدي إلى تخفيف كل شيء 1: 2. الحجم النهائي لجميع الآبار البالغ عددها 384 هو 30 ميكرولتر ، ويبلغ حجم كل مركب 6.66 ميكرومتر.
- أغلق كل لوحة باستخدام مادة مانعة للتسرب تسمح بالتبادل المستمر للغازات.
ملاحظة: يمكن إجراء الفحص بأغطية عادية ؛ ومع ذلك ، هناك احتمال أكبر لتأثيرات حافة أقوى. - احتضان عند 37 درجة مئوية في حاضنة دون تحريض داخل غرفة رطبة لمدة 48 ساعة.
- بعد 48 ساعة ، اقرأ اللمعان المنبعث من البكتيريا في كل لوحة باستخدام قارئ لوحة مع وقت تكامل 1 ثانية.
3. ضرب تحليل بيانات الفحص
ملاحظة: لتحديد الضربات باستخدام بيانات التلألؤ المكتسبة ، يجب تطبيع القيم إلى المذيب الذي تذوب فيه المركبات ، وفي حالة حدوثها ، إلى تأثير الحافة الذي تم التحقق منه على الألواح 384 ميكروتيتر.
- لتطبيع المذيبات للبيانات التي تم الحصول عليها في الخطوة 2.9 ، اقسم وحدات الضوء النسبية لكل بئر (RLU) على متوسط RLU لآبار التحكم في المذيبات (في اللوحة المقابلة). في هذا الفحص ، تم التحقق من تأثير حافة قوي في منتصف لوحات الفحص. وبالتالي ، تقرر تطبيع جميع البيانات الخاصة به. ولتحقيق ذلك، تمت العملية بطريقة من خطوتين، كما هو موضح أدناه.
- قم بإنشاء قناع تأثير الحافة بقسمة القيم التي تم الحصول عليها في الخطوة 3.1 للمواضع المقابلة، باستثناء النتائج، عبر جميع اللوحات (اللوحة 1 - P1، اللوحة 2 - P2، اللوحة 3 - P3، اللوحة 4 - P4). على سبيل المثال ، بالنسبة لوظائف A1 و A2 ، Mask_A1 = المتوسط (P1_A1 ؛ P2_A1. P3_A1. P4_A1); Mask_A2 = المتوسط (P1_A2; P2_A2. P4_A2) [تم استبعاد P3_A2 لأنه كان ناجحا].
- اقسم القيم التي تم الحصول عليها في الخطوة 3.1. من خلال قناع تأثير الحافة الذي تم الحصول عليه في الخطوة 3.1.1. على سبيل المثال،
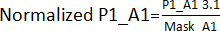 . بعد ذلك ، احسب AVG و SD لكل لوحة لإنشاء عتبة (AVG ± 3SD) لكل لوحة. يعتبر أي مركب خارج هذا الحد ضربة ويستنتقل إلى مقايسة التحقق من صحة الضربة.
. بعد ذلك ، احسب AVG و SD لكل لوحة لإنشاء عتبة (AVG ± 3SD) لكل لوحة. يعتبر أي مركب خارج هذا الحد ضربة ويستنتقل إلى مقايسة التحقق من صحة الضربة.
4. ضرب اختبار التحقق من الصحة
ملاحظة: بعد تحديد الضربات ، يجب التحقق من صحتها باستخدام تركيزات مختلفة. يستخدم مقايسة التحقق من الصحة إعدادا مشابها بنفس عناصر التحكم، ولكن ستخضع كل نتيجة لتخفيفات تسلسلية بنسبة 1:2. لهذا الاختبار ، تم استخدام ثلاثة تركيزات - 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر. ستحتوي أدوات التحكم في المذيبات على نفس النسبة المئوية للمذيبات مثل كل بئر مركب (الشكل التكميلي 3).
- تحضير المعلق البكتيري كما هو موضح في الخطوات من 1.1 إلى 1.3.
تنبيه: مطلوب خزانة للسلامة الحيوية عند العمل مع مزارع Mab. - باستخدام موزع كاشف صفيحة دقيقة مزود بشريط صغير ، قم بتوزيع 15 ميكرولتر من وسط نمو السائل على كل عمود من صفيحة البولي بروبيلين السوداء المكونة من 384 بئر. بالنسبة للآبار الفارغة ، قم بتوزيع 15 ميكرولتر إضافيا من وسط النمو السائل إلى العمود الأول والأخير.
- باستخدام موزع كاشف الصفيحة الدقيقة ، قم بتوزيع 15 ميكرولتر إضافيا من وسط نمو السائل على الأعمدة التي تحتوي على أعلى [ميكرومتر] من كل مركب.
- من الألواح المكونة من 96 بئرا ، قم بإدخال 0.8 ميكرولتر من كل ضربة يدويا (1 ملي مولار في DMSO) في الآبار الخاصة بها من الخطوة 4.3 ، في نسختين. المركبات الآن بتركيز 26.6 ميكرومتر.
- قم بإدخال 0.8 ميكرولتر من المذيبات يدويا في آبار التحكم في نسختين (نفس الخطوة 4.4).
- باستخدام ماصة دقيقة متعددة القنوات، قم بإجراء تخفيفين تسلسليين بنسبة 1:2 لكل مركب وتحكم في المذيبات. تخلص من التجاوز عن 15 ميكرولتر بعد التخفيف التسلسلي الأخير. تحتوي جميع الآبار الآن على 15 ميكرولتر ، وتركيزات المركبات 26.6 ميكرومتر و 13.3 ميكرومتر و 6.66 ميكرومتر.
- باستخدام موزع كاشف صفيحة دقيقة مع كاسيت كبير ، قم بتوزيع 15 ميكرولتر من المعلق البكتيري المحضر في 4.1 لجميع الأعمدة (باستثناء الآبار الفارغة) ، مع تخفيف المركبات 1: 2. يبلغ حجم جميع الآبار 30 ميكرولتر ، ويبلغ حجم كل مركب 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر.
- أغلق اللوحة بمادة مانعة للتسرب تسمح بالتبادل المستمر للغازات. احتضان عند 37 درجة مئوية في حاضنة دون تحريض داخل غرفة رطبة لمدة 48 ساعة.
- بعد 48 ساعة ، اقرأ التلألؤ المنبعث من البكتيريا في كل لوحة مع وقت تكامل يبلغ 1 ثانية باستخدام قارئ لوحة.
5. فحص العدوى
ملاحظة: Mab هو أحد مسببات الأمراض الاختيارية داخل الخلايا ، لذلك يجب تحديد النشاط المضاد للميكروبات للضربات وسمية المضيف في فحوصات العدوى. لذلك ، أصيبت البلاعم المشتقة من نخاع العظام (BMM) ب Mab وعولجت بالضربات التي تم التحقق من صحتها في الخطوة 4 بتركيزات مختلفة. تضمن كل اختبار فارغا (ماء فقط) ، وضوابط سلبية (ضامة مصابة غير معالجة) ، وضوابط إيجابية (ضامة مصابة معالجة بمضاد حيوي فعال) ، وضوابط المذيبات (في هذه الحالة ، DMSO) ، والمركبات التي سيتم اختبارها بثلاثة تركيزات - 13.3 ميكرومتر ، 6.66 ميكرومتر ، و 3.3 ميكرومتر (الشكل التكميلي 4).
- اشتقاق البلاعم من نخاع عظم الفئران من النوع البري (BALB / c أو C57BL / 6) ، كما هو موضحسابقا 15. ضع الخلايا على صفيحة مسطحة القاع ذات 96 بئرا ، سوداء ، واضحة بصريا عند 2 × 105 خلايا / مل ، 200 ميكرولتر لكل بئر. بعد 10 أيام من التمايز عند 37 درجة مئوية ، 7٪ ثاني أكسيد الكربون215 ، تكون الخلايا جاهزة للعدوى والمضي قدما في العلاج.
ملاحظة: بروتوكول الحصول على البلاعم المشتقة من نخاع العظام راسخ15. ومع ذلك ، يمكن تكييف بروتوكول الفحص هذا مع الخلايا الأخرى ، مثل RAW 264.7 و THP-1 والضامة المشتقة من PBMC. - قم بإعداد المعلق البكتيري كما هو موضح في الخطوات من 1.1 إلى 1.3 ، مع ضبط المعلق البكتيري في وسط زراعة الخلية لعدوى مع تعدد العدوى (MOI) من 1.
تنبيه: مطلوب خزانة للسلامة الحيوية عند العمل مع مزارع Mab. - قم بشفط وسط زراعة الخلايا المكمل للآبار بعناية باستخدام مضخة تفريغ متصلة بماصة زجاجية. يجب تنفيذ هذه الخطوة ببطء وسهولة لمنع انفصال الخلايا.
- قم بإدخال 75 ميكرولتر من المعلق البكتيري المحضر في الخطوة 5.2 يدويا إلى كل بئر. احتضان اللوحة عند 37 درجة مئوية مع 7٪ ثاني أكسيد الكربون2 لمدة 4 ساعات في حاضنة الخلية.
- تحضير المركبات لعلاج الخلايا. باستخدام موزع كاشف صفيحة دقيقة مزود بشريط صغير ، قم بالاستغناء عن مادة البولي بروبيلين ، والقاع المستدير ، وألواح 96 بئرا ، و 110 ميكرولتر من وسط زراعة الخلايا المكملة إلى الأعمدة حيث ستكون المركبات أو التحكم في المذيبات (الشكل التكميلي 4).
- باستخدام موزع كاشف الصفيحة الدقيقة ، قم بتوزيع 104 ميكرولتر إضافي من وسط زراعة الخلايا المكملة على الأعمدة حيث سيكون أعلى تركيز للمركب أو المذيب.
- قم بإدخال 5.9 ميكرولتر من المركبات يدويا (1 ملي مولار في DMSO) أو مذيب في الآبار المخصصة لها (الأعمدة في الخطوة 5.6). المركبات الآن بتركيز 26.6 ميكرومتر.
- باستخدام ماصة دقيقة متعددة القنوات، قم بإجراء تخفيفين تسلسليين بنسبة 1:2 لكل مركب ومذيب. تخلص من التجاوز عن 110 ميكرولتر بعد التخفيف التسلسلي الأخير. تحتوي جميع الآبار الآن على 110 ميكرولتر ، والمركبات بتركيز 26.6 ميكرومتر و 13.3 ميكرومتر و 6.66 ميكرومتر.
- باستخدام موزع كاشف الصفيحة الدقيقة ، قم بتوزيع 110 ميكرولتر من وسط زراعة الخلايا المكمل على جميع الأعمدة (باستثناء الآبار الفارغة). تحتوي جميع الآبار الآن على 220 ميكرولتر ، والمركبات بتركيز 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر.
- تحضير محلول كلاريثرومايسين (تحكم إيجابي) عند 2 ميكروغرام / مل في وسط زراعة الخلايا الكامل.
- بعد 4 ساعات من الخطوة 5.4 ، باستخدام غسالة الألواح ، اغسل 3 مرات بمحلول غسيل العدوى ب 200 ميكرولتر من اللوحة المصابة ذات 96 بئر. حافظ على الشفط وتوزيع السرعات على أبطأ ما يمكن لمنع أي انفصال للخلايا.
- بعد الشفط النهائي ، انقل 200 ميكرولتر من المركبات المحضرة في الخطوات 5.5-5.9 إلى الصفيحة المكونة من 96 بئرا التي تحتوي على البلاعم المصابة.
- نقل 200 ميكرولتر من وسط زراعة الخلايا المكملة إلى الآبار غير المعالجة. نقل 200 ميكرولتر من محلول كلاريثرومايسين المحضر في الخطوة 5.10 إلى الآبار الخاصة به.
- احتضان اللوحة في حاضنة خلية عند 37 درجة مئوية ، مع 7٪ ثاني أكسيد الكربون2 ، لمدة 48 ساعة.
- بعد 48 ساعة ، اغسل الصفيحة المصابة المكونة من 96 بئرا باستخدام غسالة الألواح بمحلول غسيل المركب (3x مع 200 ميكرولتر لكل بئر).
- باستخدام ماصة دقيقة متعددة القنوات ، قم بتوزيع 200 ميكرولتر من محلول التثبيت على جميع الآبار واتركها تعمل لمدة 10 دقائق.
- بعد التثبيت ، باستخدام غسالة الألواح ، اغسل الخلايا بمحلول غسيل المركبات (3x مع 200 ميكرولتر لكل بئر).
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. يمكن تخزين الخلايا في محلول غسيل المركبات عند 4 درجات مئوية لعدة أيام أو أسابيع إذا تم منع التلوث وجفاف الخلايا. يجب شفط محلول غسيل المركبات قبل الخطوة 5.18. - باستخدام ماصة دقيقة متعددة القنوات ، قم بتوزيع 200 ميكرولتر من محلول النفاذية لجميع الآبار واتركها تعمل لمدة 15 دقيقة. باستخدام غسالة الألواح ، قم بشفط محلول النفاذ.
- باستخدام ماصة دقيقة متعددة القنوات، قم بتوزيع 100 ميكرولتر يدويا من محلول التلوين واحتضان الألواح في درجة حرارة الغرفة لمدة 30 دقيقة.
- باستخدام غسالة الألواح ، اغسل الألواح بمحلول غسيل المركبات (3x مع 200 ميكرولتر لكل بئر). في النهاية ، اترك الخلايا الملطخة في محلول غسيل المركبات.
- قم بفحص اللوحات في نظام تصوير عالي المحتوى بالإعدادات التالية:
الهدف: 20x Air / 0.4NA (بئر واحد من صفيحة 96 ميكروتيتر ، 57 مجال رؤية (FOV)
الوضع: متحد البؤر
ليزر 405 نانومتر ل DAPI (النوى)
ليزر 561 نانومتر ل mScarlet (بكتيريا)
ليزر 640 نانومتر لقناع خلية HCS أحمر غامق (السيتوبلازم)
لا يوجد مكدس z
ملاحظة: يمكن تصوير الخلايا بنظام تصوير واسع المجال ، مما يقلل من التعريف. - قم بإعداد روبوت مناولة المعدات للحصول على الصور بين عشية وضحاها. يتبادل هذا الذراع الآلي الألواح في نظام التصوير عالي المحتوى دون تدخل بشري.
ملاحظة: هذا ليس إلزاميا. يمكن استبدال اللوحات يدويا.
6. تحليل الصور
ملاحظة: يتم إجراء تحليل الصور باستخدام برنامج التحليل ، وهو نفس نظام التصوير عالي المحتوى المستخدم للحصول على الصور. يجب إنشاء خط أنابيب التحليل باستخدام نماذج الصور (الشكل التكميلي 5). بعد ذلك ، سيتم تطبيقه على البئر بأكمله (57 مجال رؤية) ومجموعة البيانات (جميع الألواح). يتبع برنامج التحليل تسلسلا منطقيا من الخطوات ، بدءا من تجزئة مناطق الاهتمام المختلفة (النوى ، السيتوبلازم ، الخلايا ، والبكتيريا) ، وربطها (على سبيل المثال ، البكتيريا داخل الخلايا) ، ثم استخراج الخصائص المورفولوجية والشدة (على سبيل المثال ، المساحة ، الكثافة). الخطوات الأساسية لتحليل الصور موصوفة أدناه. يمكن العثور على البروتوكول الكامل المستخدم في الشكل التكميلي 5.
- قم بتقسيم النوى باستخدام إشارة DAPI ، والسيتوبلازم باستخدام إشارة DeepRed ، والبكتيريا باستخدام إشارة mScarlet.
- ربط النوى وتجزئة السيتوبلازم لإنشاء قناع للخلايا.
- قم بإزالة جميع الكائنات الحدودية. سيتم النظر فقط في الخلايا التي تظهر على أنها ممتلئة على مجال الرؤية (الخلايا الكاملة).
- تعريف مجموعة البكتيريا الناتجة في الخلايا الكاملة من خلال ربط الخلايا الكاملة والبكتيريا.
- تعريف الخلايا الكاملة المصابة على أنها تحتوي على أكثر من منطقة بكتيرية واحدة والخلايا الكاملة غير المصابة على أنها تحتوي على أقل من منطقة بكتيريا واحدة.
- بعد تقسيم جميع مناطق الاهتمام وإنشاء السكان ، احسب خصائصها واستخراجها. يتم استخراج الخصائص التالية لكل بئر.
- بالنسبة للخلايا الكاملة / الخلايا الكاملة المصابة / الخلايا الكاملة غير المصابة ، استخرج
عدد الخلايا (مجموع كل بئر)
المساحة [ميكرومتر2] (المتوسط + الانحراف المعياري لكل بئر)
نسبة الخلية من العرض إلى الطول (المتوسط + الانحراف المعياري لكل بئر) - للبكتيريا الموجودة في الخلايا الكاملة ، استخرج
عدد المناطق البكتيرية التي تم تحديدها (مجموع كل بئر)
الشدة (مجموع كل بئر من متوسط شدة كل منطقة)
مساحة المنطقة (مجموع البئر)
- بالنسبة للخلايا الكاملة / الخلايا الكاملة المصابة / الخلايا الكاملة غير المصابة ، استخرج
- بعد تصدير البيانات وتنظيمها في جدول بيانات ، حدد الحمل داخل الخلايا (Mycoload) وفقا للصيغة التالية:
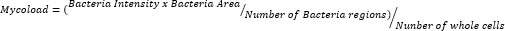
النتائج
تقييم عامل Z
يوضح الشكل 2 بيانات واحدة من كل تجربتين تم إجراؤهما لحساب عامل Z. كانت السيطرة الإيجابية هي كلاريثرومايسين عند 4 ميكروغرام / مل. أسفرت كلتا التجربتين عن عوامل Z 0.64 و 0.62 ، مما يعني أنه يمكن تطبيق الشروط والقراءات المستخدمة لهذا الاختبار على مقايسة الفحص التي تبعت (Z '> 0.5). ومع ذلك ، تم حساب عامل Z لجميع التجارب المتبقية (مقايسة العدوى) للتحكم في أداء كل تجربة.
كدليل على مفهوم اختبار HTS المصمم ، تم اختبار مكتبة من المركبات المخصصة لإعادة استخدام الأدوية. وهي تتألف من 1280 جزيئا متنوعا وصغيرا ، 95٪ منها أدوية معتمدة من إدارة الغذاء والدواء الأمريكية (FDA) و EMA. توفر هذه الجزيئات تنوعا كيميائيا ودوائيا عاليا.
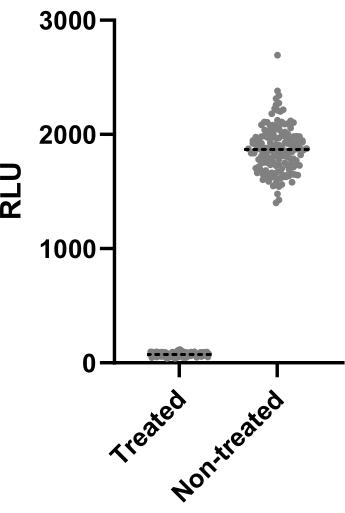
الشكل 2: نتائج تقييم عامل Z. تم احتضان Mab عند 2.5 × 105 CFUs / مل مع وبدون كلاريثرومايسين عند 4 ميكروغرام / مل لمدة 48 ساعة عند 37 درجة مئوية. بعد فترة الحضانة ، تم قياس اللمعان لتقييم صلاحية البكتيريا الفطرية. يوضح الرسم البياني قيم اللمعان الفردية للبكتيريا الفطرية القابلة للحياة المعالجة وغير المعالجة في تجربة مستقلة واحدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
عرض المكتبة للزيارات
تم اختبار جميع المركبات عند 6.66 ميكرومتر مقابل Mab. نظرا لحجم المكتبة ، تم تقسيم المركبات إلى أربع ألواح مختلفة من 384 بئرا (الشكل 3A-D). تم تطبيع النتائج لكل من المذيب وتأثير الحافة الذي تم التحقق منه.
في اختبار الفحص هذا ، تم تحديد ثلاث وثلاثين ضربة ، ثلاثون منها قلل بشكل كبير من انبعاث اللمعان ، مما قلل من قابلية البقاء الفطرية (الشكل 3). ومن المثير للاهتمام أن ثلاثة مركبات أدت إلى انبعاث تلألؤ أعلى ، ربما تكون مرتبطة بزيادة التمثيل الغذائي البكتيري أو تكاثره (الشكل 3). تم نقل جميع الضربات ال 33 إلى مقايسة التحقق ، بما في ذلك المركبات الثلاثة التي زادت من اللمعان ، لاختبار ما إذا كان سيتم الاحتفاظ بهذا الملف الشخصي.
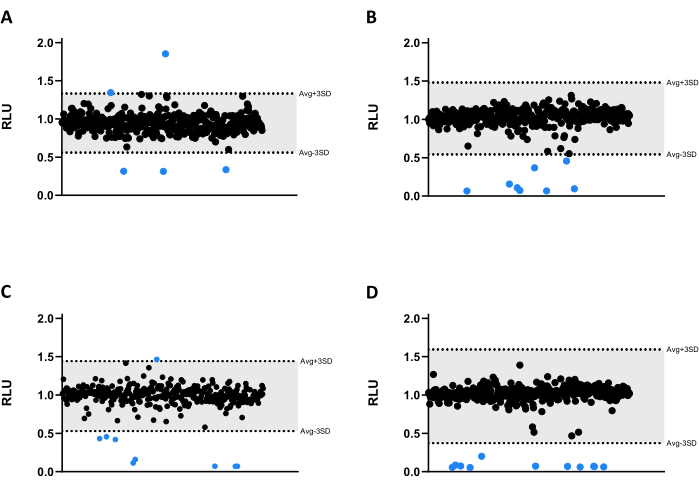
الشكل 3: نتائج فحص المكتبة. (A-D) Mab عند 2.5 × 10تم تحضين 5 CFUs / مل مع 1280 مركبا عند 6.66 ميكرومتر لمدة 48 ساعة عند 37 درجة مئوية. بعد الحضانة ، تم قياس اللمعان لتقييم صلاحية البكتيريا الفطرية. تظهر الرسوم البيانية RLU لتجربة مستقلة واحدة ، يتم تقديمها كوحدات تعسفية بعد تطبيع تأثير المذيبات والحافة. تم حساب AVG RLU و SD المقابل له لكل لوحة لتحديد عتبة (باللون الرمادي ؛ متوسط ± 3SD). تمثل الرموز المستديرة مركبا مختبتا. باللون الأزرق ، يعتبر أي مركب خارج هذا الحد ناجحا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
اختبار التحقق من صحة النتائج
كانت التركيزات المستخدمة في هذا الاختبار 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر. تم اختبار كل مركب في نسختين لزيادة المتانة.
الأهم من ذلك ، أن المركبات 30 و 31 و 32 ، التي كانت مرتبطة سابقا بارتفاع RLU (الشكل 3 أ ، ج) ، حافظت على هذا الملف الشخصي ، مع تحقيق أكثر من 200٪ من صلاحية البكتيريا الفطرية في الآبار المعالجة بالمركب 32 (الشكل 4).
تم اعتبار المركبين 20 و 33 غير نشطين ، حيث تقترب صلاحية البكتيريا الفطرية من 100٪ في جميع التركيزات التي تم اختبارها (الشكل 4).
أظهر المركبان 9 و 21 خفضا مماثلا عند أدنى تركيزين. ومع ذلك ، على عكس 20 ، فإنها تظل نشطة عند أعلى مستوى ، 13.3 ميكرومتر ، مع عرض المركب 21 فعالية أعلى (الشكل 4).
يعرض المركب 3 أيضا عدم نشاط عند أدنى تركيز وفقدان نشاط عند 6.66 ميكرومتر ، وإن كان أقل من المركب 21 (الشكل 4). فقط في أدنى تركيز ، أظهرت المركبات 2 و 7 و 8 و 10 و 16 و 18 و 24 و 28 إمكانات علاجية أقل. ومع ذلك ، لا تزال 2 و 10 و 28 تؤدي إلى <50٪ من صلاحية البكتيريا الفطرية.
على الصعيد العالمي ، كانت المركبات الأربعة عشر المتبقية نشطة في جميع التركيزات التي تم اختبارها.
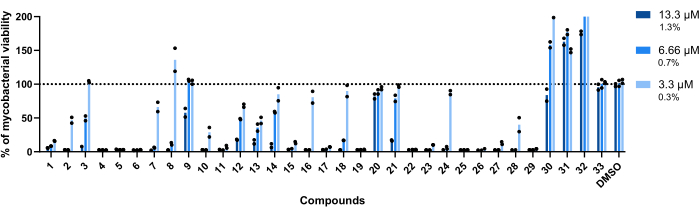
الشكل 4: نتائج مقايسة التحقق من الصحة. تم تحضين Mab عند 2.5 × 105 CFUs / مل مع كل إصابة تم تحديدها مسبقا عند 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر (1.3٪ و 0.7٪ و 0.3٪ من DMSO ، على التوالي) لمدة 48 ساعة عند 37 درجة مئوية. بعد فترة الحضانة ، تم قياس اللمعان لتقييم صلاحية البكتيريا الفطرية. يوضح الرسم البياني النسب المئوية للبكتيريا الفطرية القابلة للحياة المعالجة بالنسبة للبكتيريا الفطرية غير المعالجة لتجربة مستقلة واحدة ، مع اختبار كل مركب في نسختين. تمثل الرموز المستديرة التكرارات لكل مركب. تمثل الأشرطة متوسط تلك التكرارات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فحص العدوى
من بين ثلاثة وثلاثين مركبا تم اختباره ، تم اختيار ثمانية وعشرين مركبا لفحص العدوى (الشكل 4). لم يتم اختيار المركبات 7 و 8 و 9 و 20 و 33 لهذا الفحص. بينما تم استبعاد 9 و 20 و 33 بسبب عدم نشاطها عند التحقق من صحتها (الشكل 4) ، تم استبعاد الأولين لأسباب فنية. ومع ذلك ، تم تحديد هذه المركبات على أنها ريفامبيسين ولينزوليد ، وهي مضادات حيوية تستخدم بالفعل لعلاج عدوى Mab12. تم تحديد جميع المركبات التي تم اختبارها في مقايسة العدوى وهي مدرجة في الجدول 1. تم تقييم النشاط المضاد للميكروبات للمركبات ضد البلاعم المصابة ب Mab باستخدام التألق الجوهري للبكتيريا كقراءة.
| مركب | اسم | مركب | اسم |
| 1 | سلفاتيازول | 18 | سيفوروكسيم |
| 2 | سيبروفلوكساسين | 19 | ريفاكسيمين |
| 3 | سيفوتاكسيم | 21 | سيفدينير |
| 4 | Daunorubicin | 22 | كلاريثرومايسين |
| 5 | دوكسوروبيسين | 23 | بيسيفلوكساسين |
| 6 | ثيوستربتون | 24 | ليفوفلوكساسين |
| 10 | أميكاسين | 25 | ريفابوتين |
| 11 | موكسالاكتام | 26 | جاتيفلوكساسين |
| 12 | سلفاميثيزول | 27 | إبيروبيسين |
| 13 | سلفامونوميثوكسين | 28 | بيرفينيوم بموات |
| 14 | سيفوكسيتين | 29 | موكسيفلوكساسين |
| 15 | نوفوبيوسين | 30 | تروليندومايسين |
| 16 | سيفميتازول | 31 | لينكومايسين |
| 17 | روكسيثرومايسين | 32 | سبيراميسين |
الجدول 1: قائمة المركبات التي تم اختبارها في مقايسة العدوى. تم اختبار المركبات التي تم التحقق من صحتها في الخطوة 4 في مقايسة العدوى (الخطوة 5).
كانت سمية المركبات تجاه البلاعم المصابة ب Mab هي المعلمة الأولى التي تم تقييمها. كانت العتبة التي تم تحديدها لاعتبار المركب ساما أو غير سام 85٪ من البلاعم القابلة للحياة (الشكل 5). من بين المركبات الثمانية والعشرين التي تم اختبارها ، تم اعتبار 4 و 5 و 6 و 27 و 28 مركبا ساما. (الشكل 5). وبالتالي ، تم استبعاد هذه المركبات الخمسة من تقييم النشاط داخل الماكروبيا التالي.
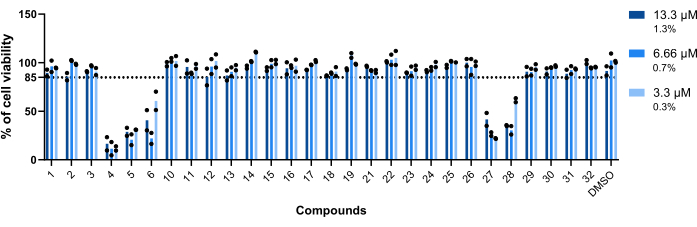
الشكل 5: سمية الضربات تجاه البلاعم المصابة ب Mab. أصيبت BALB / c فئران BMMs ب Mab (MOI = 1) وتم تحضنها مع كل إصابة تم تحديدها مسبقا عند 13.3 ميكرومتر و 6.66 ميكرومتر و 3.3 ميكرومتر (1.3٪ و 0.7٪ و 0.3٪ من DMSO ، على التوالي) لمدة 48 ساعة عند 37 درجة مئوية مع 7٪ ثاني أكسيدالكربون 2. تم تصوير الخلايا في مجهر فلوري عالي المحتوى ، باستخدام عدد النوى (الملطخة ب DAPI) لقياس بقاء الخلية. يوضح الرسم البياني النسب المئوية للبلاعم المصابة المعالجة القابلة للحياة بالنسبة إلى البلاعم المصابة غير المعالجة القابلة للحياة لتجربتين مستقلتين. تمثل الرموز المستديرة صلاحية الخلية لكل فحص. تمثل الأشرطة متوسط تجربتين مستقلتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لاستنتاج النشاط داخل البلاعم للمركبات الثلاثة والعشرين المتبقية ضد Mab داخل الخلايا (الشكل 6) ، تم استخدام صيغة Mycoload (الموضحة سابقا في الخطوة 6) للحصول على النسبة المئوية للبقاء الفطرية التي تم تطبيعها إلى البلاعم المصابة غير المعالجة. فقدت معظم المركبات إمكاناتها العلاجية ضد البكتيريا الفطرية الداخلية (الشكل 6) مقارنة بمقايسة التحقق من صحة النتيجة (الشكل 4) ، حيث انخفض عدد الزيارات من خمسة وعشرين إلى ستة بأعلى تركيز تم اختباره. اللافت للنظر أن جميع المركبات الثلاثة التي زادت من صلاحية عوالق Mab مقارنة بالبكتيريا غير المعالجة (30 و 31 و 32 ؛ الشكل 3 والشكل 4) أظهر نشاطا مضادا للبكتيريا الفطرية ضد Mab داخل الخلايا ، حيث تقدم المركبتان 30 و 32 اختلافا إحصائيا كبيرا عند مقارنتها ب DMSO ، حتى عند 3.3 ميكرومتر في حالة المركب 32 (الشكل 6). أظهرت البكتيريا الفطرية المعالجة بالمركبين 11 و 23 قابلية للحياة <50٪ عند 13.3 ميكرومتر. ومع ذلك ، لم يكن هذا مختلفا بشكل كبير عن عنصر تحكم DMSO (الشكل 6). كانت المركبات 21 و 26 و 29 قوية بما يكفي عند 13.3 ميكرومتر لتبرير اختلاف إحصائي كبير ، مع كون 29 هي الأكثر نشاطا (الشكل 6). أخيرا ، كانت المركبات 17 و 22 و 25 قوية للغاية في جميع التركيزات المختبرة ضد البكتيريا الفطرية الداخلية. تم تحديدها على أنها روكسيثرومايسين وكلاريثرومايسين وريفابوتين على التوالي (الجدول 1). من بين المركبات الثلاثة ، كان كلاريثرومايسين هو الأكثر نشاطا ضد Mab ، حيث لم تتجاوز صلاحية البكتيريا الفطرية 10٪ ، مما يمثل قيمة p <0.0001 في جميع التركيزات التي تم اختبارها مقارنة ب DMSO (الشكل 6).
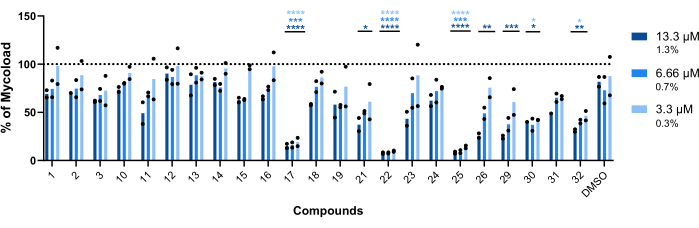
الشكل 6: يضرب النشاط داخل البلاعم ضد البلاعم المصابة ب Mab. أصيبت BALB / c BMMs ب Mab (MOI = 1) وتم تحضنها مع كل إصابة تم تحديدها مسبقا عند 13.3 و 6.66 و 3.3 ميكرومتر (1.3 و 0.7 و 0.3٪ من DMSO ، على التوالي) لمدة 48 ساعة عند 37 درجة مئوية مع 7٪ ثاني أكسيدالكربون 2. تم تصوير الخلايا في مجهر مضان عالي المحتوى ، واستخدمت إشارة الفلورسنت لحساب Mycoload (انظر الخطوة 6). يوضح الرسم البياني النسب المئوية للحمل الفطري الموجودة في البلاعم المصابة المعالجة مقارنة بالبلاعم المصابة غير المعالجة في تجربتين مستقلتين. تم إجراء الإحصائيات باستخدام ANOVA ثنائي الاتجاه مع اختبار المقارنة المتعددة في Dunnet. *، ص < 0.05؛ ** ، ص < 0.01 ؛ ، ص < 0.001 ؛ ، ص < 0.0001 مقارنة ب DMSO (التحكم في المذيبات). تتبع العلامات النجمية نفس رمز اللون لكل تركيز مثل وسيلة إيضاح الرسم البياني. تمثل الرموز المستديرة Mycoload لكل فحص. تمثل الأشرطة متوسط تجربتين مستقلتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: مثال على تخطيط لوحة 384 بئرا مستخدم في تقييم عامل Z. أبيض - آبار فارغة (وسط نمو سائل فقط) ؛ أصفر - تحكم إيجابي (البكتيريا المعالجة بالمضادات الحيوية) ؛ أحمر - تحكم سلبي (بكتيريا غير معالجة). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: مثال على تخطيط لوحة 384 بئرا مستخدم في فحص المكتبة. أبيض - آبار فارغة (وسط نمو سائل فقط) ؛ أخضر - التحكم في المذيبات ؛ أحمر - تحكم سلبي (بكتيريا غير معالجة) ؛ أزرق - مركبات ليتم فحصها. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: مثال على تخطيط لوحة 384 بئرا يستخدم للتحقق من صحة الضربات. أبيض - آبار فارغة (وسط نمو سائل فقط) ؛ أخضر - التحكم في المذيبات (في نسخ مكررة) ؛ أحمر - تحكم سلبي (بكتيريا غير معالجة) ؛ أزرق - المركبات المراد فحصها (في نسخ مكررة). تمثل الألوان الباهتة تخفيفات تسلسلية 1: 2. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: مثال على تخطيط لوحة 96 بئرا يستخدم لفحص العدوى. أبيض - آبار فارغة (ماء لمنع التبخر) ؛ أحمر - تحكم سلبي (البلاعم غير المعالجة) ؛ أصفر - تحكم إيجابي (البلاعم المعالجة بمضاد حيوي) ؛ أخضر - التحكم في المذيبات ؛ أزرق - مركبات ليتم اختبارها. تمثل الألوان الباهتة تخفيفات تسلسلية 1: 2. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: بروتوكول تحليل الصور. يتم استخدام بروتوكول مفصل لتحليل الصور في هذا العمل ، والذي يمكن تكييفه مع البرامج مفتوحة المصدر. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يصف هذا البروتوكول خط أنابيب فحص الأدوية ضد Mab باستخدام السلالات المطورة منزليا 10. باستخدام روبوتات معالجة السوائل ، والفحص المجهري الآلي والتحليل ، وسلالات المراسل المزدوج ، يتم تقييم صلاحية البكتيريا بسرعة باستخدام اللمعان أو التألق دون إضافة كواشف أو تنفيذ خطوات إضافية. يقلل هذا النهج من الوقت والتباين بين المقايسات ، وهي ميزة كبيرة عند النظر في الغرض من فحوصات HTS.
عند فحص آلاف المركبات ، يجب تحديد الدواء الفعال بسهولة. تحقيقا لهذه الغاية ، غالبا ما يستخدم عامل Z لقياس حجم التأثير الإحصائي ، واستنتاج أداء المقايس. إذا كان عامل Z > 0.5 ، فإن الظروف المختبرة هي الأمثل للتمييز بين السكان المعالجين وغير المعالجين13. أسفرت الظروف المختبرة عن عوامل Z > 0.6 (الشكل 2) ، مما يثبت إحصائيا أنه يمكن تطبيقها على حملة الفحص. هذه الخطوة حاسمة لضمان فعالية الفحص.
وهكذا ، تم تطوير بروتوكول HTS للكشف عن النشاط المضاد للميكروبات لآلاف المركبات ضد Mab الذي ينمو بشكل عوالق. نظرا لأن Mab هو عامل ممرض اختياري داخل الخلايا ، فإن البروتوكول المصمم يفحص أيضا النشاط المضاد للميكروبات داخل الخلايا ضد نفس السلالة البكتيرية - وهي ميزة حاسمة. علاوة على ذلك ، يمكن أيضا تقييم السمية تجاه الخلايا المضيفة. وبالتالي ، يتم وصف نهج متعدد الخطوات لفحص الأدوية ضد Mab ، باستخدام إعدادات تجريبية مختلفة لتقييم النشاط المضاد للميكروبات جنبا إلى جنب مع السمية الخلوية ، مما يزيد من فرص النجاح. كدليل على المفهوم ، تم فحص مكتبة كيميائية تضم 1280 مركبا.
تم تحديد ما مجموعه ثلاث وثلاثون إصابة (الشكل 3). من بين هؤلاء ، زادت ثلاثة بشكل كبير من قابلية البقامرة الفطرية في المزارع السائلة (المركبات 30 و 31 و 32 ؛ الشكل 3 والشكل 4). وتجدر الإشارة إلى أن هذه المركبات قد تتداخل مع انبعاث اللمعان دون التأثير على بقاء البكتيريا. عند اختبارها ضد البكتيريا الفطرية الداخلية ، أظهرت هذه المركبات نشاطا مضادا للميكروبات (الشكل 6) ، مما يدل على فعالية أعلى ضد Mab بعد استيعاب الخلية المضيفة. تم تحديد هذه المركبات على أنها troleandomycin (30) ، سبيرامايسين (32) ، ولينكومايسين (31 ؛ الجدول 1). الاثنان السابقان هما الماكروليدات ، وهي فئة من المضادات الحيوية المستخدمة لعلاج الالتهابات الفطرية16 ، والأخير هو لينكوزاميد ، وهو مضاد حيوي له آلية عمل مشابهة للماكروليدات17. تم الإبلاغ عن أن Mab مقاوم بشكل خاص لللينكوزاميد الآخر ، كليندامايسين ، في كل من الثقافات السائلة والصلبة18. ومع ذلك ، فقد ارتبطت الخصائص المناعية والمضادة للالتهابات بالماكروليدات19،20 واللينكوساميد21 ، والتي يمكن أن تفسر زيادة النشاط المضاد للميكروبات ضد البكتيريا الفطرية الداخلية (الشكل 6).
من بين الثلاثين ضربة المتبقية ، تقلل إحدى عشرة ضربة بنسبة >90٪ من صلاحية البكتيريا الفطرية في جميع التركيزات (الشكل 4). بالنظر إلى أن مقايسة HTS النموذجية لها معدل وصول متوقع يبلغ ~ 1٪ 22 ، فإن البروتوكول المطور يتفق مع ما يتم ملاحظته عادة. ومع ذلك ، كانت العديد من المركبات الأخرى لا تزال نشطة ، واستمر ثمانية وعشرون في فحص العدوى.
من بين المركبات المحددة ، اعتبرت خمسة مركبات سامة (الشكل 5) - daunorubicin (4) ، دوكسوروبيسين (5) ، epirubicin (27) ، thiostrepton (6) ، و pyrvinium pamoate (28 ؛ الجدول 1). الثلاثة الأولى هي عوامل مضادة للأورام23،24،25 ، لذلك ليس من المستغرب أنها سامة لخلايا الثدييات المستخدمة في هذا الفحص. تم استخدام بيرفينيوم بموات لسنوات عديدة كطارد فعال للديدان. ومع ذلك ، منذ عام 2004 ، تم ربطه أيضا بالأنشطة المضادة للأورام26. أخيرا ، الثيوستريبتون هو قليل الببتيد غالبا ما يستخدم في الطب البيطري ، ولم تتم الموافقة عليه أبدا للاستخدام في البشر27. تم الإبلاغ عن نشاط هذا الدواء ضد خلايا سرطان الثدي28. لم يتم تقييم نشاط الثيوستريبتون داخل البلاعم بسبب سميتها على الضامة المشتقة من نخاع العظام (الشكل 5). ومع ذلك ، فقد ثبت أن الثيوستريبتون فعال عند 5 ميكرومتر على خلايا THP-1 المصابة ب Mab29. تتشابه النتائج المبلغ عنها ضد بكتيريا العوالق29 مع تلك التي تم الحصول عليها في هذا الفحص ، حيث يكون الثيوستريبتون قويا للغاية (الشكل 4).
أظهرت معظم المركبات التي تم فحصها بحثا عن النشاط داخل البلاعم عدم وجود إمكانات علاجية (الشكل 6). يختلف النمو البكتيري داخل الخلايا اختلافا كبيرا عن ثقافات العوالق. في هذا الأخير ، يكون الاتصال المباشر بين البكتيريا والأدوية ممكنا دائما. في السابق ، بسبب استيعاب الخلايا المضيفة ، تعمل العديد من أغشية المضيف كحواجز مادية تحتاج الأدوية إلى نقلها للوصول إلى الهدف ، مما قد يساعد في تفسير انخفاض النشاط المضاد للميكروبات لمعظم الضربات. عند أعلى تركيز ، 13.3 ميكرومتر ، أظهرت ثلاثة مركبات فعالية كافية لتكون مختلفة إحصائيا عن تحكم DMSO (الشكل 6) - سيفدينير (21) ، جاتيفلوكساسين (26) وموكسيفلوكساسين (29 ؛ الجدول 1). بينما يستخدم الموكسي فلوكساسين بالفعل كدواء مضاد للسل16 ، يستخدم سيفدينير بشكل شائع لعلاج العديد من الالتهابات البكتيرية في الجهاز التنفسي ، مثل الالتهاب الرئوي30. ومع ذلك ، فقد تم الإبلاغ عن نشاطه ضد M. tuberculosis31 و Mab ، مما أظهر تأثيرا تآزريا قويا مع كاربابينيم ضد الأخير32. Gatifloxacin هو فلوروكينولون ، وقد تم الإبلاغ عن نشاطه ضد العديد من البكتيريا الفطرية فيالماضي 33،34. المركبات الثلاثة الأكثر نشاطا في هذا الاختبار (الشكل 6) هي روكسيثرومايسين (17) ، كلاريثرومايسين (22) ، وريفابوتين (25 ؛ الجدول 1) ، وهي قوية للغاية في جميع التركيزات. الأولان هما ماكروليدات ، في حين أن الريفابوتين هو ريفاميسين ، حيث تعمل كلتا الفئتين كأساس للعلاج ضد العديد من الالتهابات الفطرية16.
يعتمد هذا الفحص على معدات معالجة السوائل المحددة والمكلفة لتقليل التباين بين المقايسات. على الرغم من كونه قابلا للتكرار للغاية ، إلا أن معالج السائل لا يحتوي على نقل للمركبات بدون تلامس ، مثل المركبات الصوتية. وبالتالي ، يمكن أن تظل بعض المركبات الملتصقة ملتصقة بالدبابيس المعدنية بين عمليات النقل ، وتنتقل إلى الآبار التالية ، مما يؤدي إلى إيجابيات خاطئة أثناء مرحلة الفحص - وهذا ما حدث مع المركب 33. هذا هو السبب في أن التحقق من صحة الفحص أمر بالغ الأهمية لنجاحه ، مما يضمن عدم استمرار أي إيجابيات خاطئة إلى الخطوات التالية لخط أنابيب فحص الأدوية. يستخدم مقايسة العدوى نظام تصوير عالي المحتوى مع وضع متحد البؤر للحصول على أفضل تعريف ممكن للمناطق البكتيرية. ومع ذلك ، لا يزال من الممكن استخدامه بدون وضع متحد البؤر ، وإن كان ذلك في فقدان التعريف وربما يعيق تحديد المناطق البكتيرية. يستفيد هذا البروتوكول من برنامج التحليل البسيط وسهل الاستخدام المتكامل مع نظام التصوير. ومع ذلك ، يمكن استخدام البرامج مفتوحة المصدر باتباع البروتوكول (الشكل التكميلي 5). في النهاية ، على الرغم من عدم إعادة استخدام الأدوية لعلاج عدوى Mab ، فإن هذه النتائج مهمة للغاية لأنها تتحقق من صحة البروتوكول المعمول به ، والذي يمكن توسيعه ليشمل مكتبات أكبر. الأهم من ذلك ، نعتقد أنه يمكن تكييف هذا البروتوكول مع أي بكتيريا ، بشرط توفر قراءات الفلورسنت أو الإنارة وبالتالي ، يساهم هذا العمل بشكل كبير في مجال اكتشاف الأدوية ، حيث يوفر الأدوات اللازمة للمساعدة في محاربة واحدة من أكبر مشاكل الصحة العامة - البكتيريا المقاومة للمضادات الحيوية - وخاصة العامل الممرض المستعصي تقريبا - خراج المتفطرة.
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يتم تمويل هذا العمل من قبل الصناديق الوطنية البرتغالية من خلال FCT - Fundação para a Ciência e a Tecnologia, I.P, ضمن المشروع PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) وزمالات الدكتوراه 2021.07335.BD إلى GSO و UI/BD/150830/2021 إلى CMB; FWO - مؤسسة البحوث في فلاندرز ، منحة رقم 1S68720N ؛ مبادرة الطب المبتكر 2 دعوة 16 (IMI2-Call 16) اقتراح RespiriTB بموجب الاتفاقية رقم 853903. يقر المؤلفون بدعم المنصة العلمية i3S لفحص العلوم البيولوجية ، وهو عضو في البنى التحتية الوطنية PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) و PPBI - المنصة البرتغالية للتصوير الحيوي (PPBI-POCI-01-0145-FEDER-022122).
Materials
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
References
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997(2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179(2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221(2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239(2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I. The future of drug repositioning. Annual reports in medicinal chemistry. Macor, J. E. , Academic Press. 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562(2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204(2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224(2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866(2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90(2022).
- Bray, M. A., Carpenter, A. Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD). (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , 10th ed, Wayne, PA. (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18(2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421(2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202(2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302(2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527(2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165(2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249(2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661(2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511(2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293(2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved