Method Article
Разработка анализа для высокопроизводительного скрининга лекарственных препаратов против микобактерий
В этой статье
Резюме
В этом исследовании был разработан анализ для высокопроизводительного скрининга против Mycobacterium abscessus с недавно созданным двойным репортерным штаммом, используя флуоресценцию и люминесценцию для быстрой оценки жизнеспособности бактерий. Этот протокол будет актуален для исследователей, стремящихся проводить скрининг новых лекарств против этой лекарственно-устойчивой бактерии.
Аннотация
Инфекции Mycobacterium abscessus (Mab) трудно поддаются лечению из-за высокой внутренней лекарственной устойчивости, сравнимой с туберкулезом с множественной лекарственной устойчивостью. Методы лечения крайне неэффективны и основаны на схеме с несколькими препаратами, что приводит к низкой приверженности пациентов к лечению. В связи с этим научному сообществу настоятельно рекомендуется найти новые и эффективные препараты для лечения этих инфекций. Одной из стратегий, используемых для достижения этой цели, является перепрофилирование лекарств – процесс выявления новых терапевтических возможностей для существующих препаратов на рынке, обходя время, необходимое для установления фармакокинетических профилей и профилей безопасности новых лекарств. Поскольку большинство исследований по разработке лекарств против Mab основывались на традиционных и трудоемких методах, был разработан анализ для высокопроизводительного скрининга лекарств против микобактерий с использованием разработанного в нашей компании штамма Mab с двойным репортером. С помощью робототехники для работы с жидкостями, автоматизированной микроскопии и анализа, а также разработанных нами двойных репортерных штаммов, жизнеспособность бактерий может быть быстро измерена с использованием двух различных показаний: люминесценции и флуоресценции, без добавления реагентов или выполнения каких-либо дополнительных действий. Это сокращает время и вариативность между анализами, что является основным преимуществом для высокопроизводительного скрининга. Описанный протокол был валидирован путем скрининга библиотеки из 1280 соединений. Полученные результаты были подтверждены литературными данными, с эффективным детектированием активных соединений. Таким образом, эта работа выполнила задачу по поставке на поле нового средства, помогающего бороться с этой чрезвычайно устойчивой к лекарствам бактерией.
Введение
Mycobacterium abscessus (Mab) является условно-патогенным микроорганизмом, вызывающим легочные инфекции, особенно у людей с муковисцидозом и другими заболеваниями легких. Инфекции, вызванные Mab, печально известны своей сложностью в лечении из-за исключительной внутренней лекарственной устойчивости, сравнимой с туберкулезом с множественной лекарственной устойчивостью1. Имеющиеся препараты в значительной степени неэффективны из-за высоконепроницаемой оболочки микобактериальных клеток и генома, который кодирует несколько ферментов, деактивирующих антибиотики. Таким образом, лечение включает в себя комбинацию нескольких препаратов, занимающую от нескольких месяцев до нескольких лет. Эта сложная схема с несколькими препаратами в сочетании с низкой комплаентностью пациентов приводит к среднему показателю излечения от 30% до 50%3. Кроме того, за последние несколько десятилетий увеличилась распространенность легочных инфекций, вызванных нетуберкулезными микобактериями, в том числе вызванных Mab 1,4. Следовательно, научное сообщество стремится разработать новые соединения для лечения инфекций Mab.
Одной из стратегий, преследуемых с этой целью, является перепрофилирование лекарств – процесс выявления новых терапевтических возможностей для существующих лекарств. Таким образом, можно обойти самую большую проблему, связанную с открытием и разработкой нового лекарства - время5. Эта простая концепция использует преимущества уже установленных фармакокинетических профилей и профилей безопасности нескольких препаратов для снижения затрат на разработку и сокращения времени, необходимого для доставки препарата от стенда до постелибольного. Таким образом, были составлены библиотеки, объединяющие от сотен до тысяч таких соединений, что позволяет исследователям быстро проверить возможность повторного использования лекарств против их патогена.
Большинство исследований по разработке лекарств против Mab основаны на золотом стандарте, но традиционном анализе, который оценивает активность соединения in vitro против микобактерий - колониеобразующих единиц насчитывается7. Несмотря на свою точность, эта процедура занимает чрезвычайно много времени и быстро становится невыполнимой, когда кто-то стремится протестировать библиотеки, содержащие тысячи соединений. С этой целью в разработку лекарств были интегрированы высокопроизводительные скрининги (HTS) - надежные анализы, которые используют преимущества робототехники и устройств для работы с жидкостями, что позволяет быстро проводить параллельный скрининг тысяч соединений8. Обычно это делается путем первоначального тестирования одной концентрации с использованием микротитровальных планшетов форматов 96-, 384-, 1536- или 3456-лунок, выступающих в качестве отправной точки для идентификации попаданий и их дальнейшей оптимизации на конвейере для клинического использования.
Анализы, основанные на репортерах, обеспечивают значительное преимущество в отношении надежности HTS благодаря их простоте и чувствительности по сравнению с другими анализами, основанными на красителях и абсорбции 7,9. Однако, насколько нам известно, лишь в нескольких исследованиях был оптимизирован высокопроизводительный скрининг против Mab9.
Недавно в нашей лаборатории были разработаны двойные репортерные штаммы, способные одновременно излучать люминесценцию и флуоресценцию10. Mab operon_mScarlet является одним из таких сортов. Он является аутолюминесцентным благодаря экспрессии оперона LuxABCDE , который включает в себя бактериальную люциферазу (по экспрессии генов luxAB ) и длинноцепочечный альдегидный субстрат (по экспрессии генов luxCDE ). С другой стороны, флуоресцентное считывание получается за счет экспрессии недавно разработанного красного флуоресцентного белка mScarlet, который превосходит более типично используемые белки eGFP и mCherry, обеспечивая более мощный сигнал11. Использование этого штамма позволяет нам оценить жизнеспособность бактерий в жидкой культуре путем измерения люминесцентного сигнала в считывателе микропланшетов без добавления реагентов или выполнения дополнительных действий. С точки зрения детектирования, собственная флуоресценция позволяет визуализировать под микроскопом живые или фиксированные клетки без использования красителей или антител. Наличие одного штамма с обоими показаниями дает исследователям значительное преимущество при использовании его в анализах HTS - снижение вариабельности между анализами с разными показаниями, поскольку нет необходимости обменивать штаммы в зависимости от характера анализа.
Таким образом, в этой работе был разработан высокопроизводительный анализ против Mab с использованием разработанного нами штамма с двойным репортером (Рисунок 1). Это позволило быстро оценить активность in vitro 1280 препаратов, предназначенных для повторного использования, с использованием коммерческой библиотеки (см. Таблицу материалов). Во-первых, активность оценивали при анализе бульонной культуры с использованием люминесценции, а во-вторых, с использованием инфицированных Mab макрофагов с использованием флуоресцентного сигнала, что лучше имитирует процесс инфекции, наблюдаемый in vivo12.
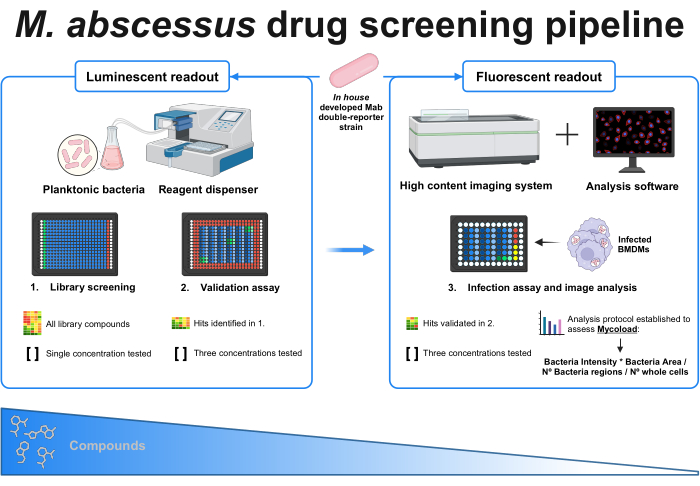
Рисунок 1: Графическая аннотация установленного протокола. Ключевым игроком в этом скрининге является штамм микобактерий собственной разработки с двойным репортером, который используется во всех экспериментах. Во-первых, с помощью дозатора реагентов и планктонных бактерий проводится первоначальный скрининг путем тестирования соединений в одной концентрации. Выявленные попадания поступают в валидационный анализ, где проверяются три различные концентрации. Оба эксперимента проводятся с использованием люминесцентного считывания. Проверенные попадания передаются в анализ на инфекцию, где также проверяются три различные концентрации, и макрофаги, полученные из костного мозга, инфицируются в MOI 1. Система визуализации с высоким содержанием регистрирует бактериальный флуоресцентный сигнал, а аналитическое программное обеспечение используется для оценки внутриклеточной нагрузки по формуле Mycoload. Количество соединений уменьшается по мере увеличения сложности анализа. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Все процедуры для животных были одобрены Местным комитетом по этике животных i3S и лицензированы Генеральным директоратом по пищевым продуктам и ветеринарии Португальского управления (DGAV) в соответствии с Директивой Европейского совета (2010/63/EU) и португальским законом (DL 113/2013) о защите животных от экспериментов.
1. Оценка Z' фактора
ПРИМЕЧАНИЕ: Для оценки эффективности анализа HTS можно определить несколько параметров. Наиболее часто используемым параметром является простой коэффициент Z (Z'-фактор). Этот показатель измеряет величину статистического эффекта данного эксперимента, указывая на то, насколько хорошо разделены положительный и отрицательный контроль. Если Z'-фактор находится в диапазоне от 0,5 до 1, то разделение между обеими популяциями является превосходным, и эти условия могут быть использованы в анализе HTS. Если Z' < 0,5, то отрыв является лишь краевым, и проводить скрининг13 не рекомендуется. Таким образом, был разработан эксперимент с использованием половины планшета с необработанными бактериями и другой половины с положительным контролем для расчета Z'-фактора (дополнительный рисунок 1).
- За 2-3 дня до анализа приготовьте предварительные культуры Mab путем инокуляции бактерий в жидкую питательную среду (примерно 1 x 107 КОЕ/мл) в колбе Эрленмейера. Оставьте бактерии расти при температуре 37 °C в инкубаторе с перемешиванием (90 об/мин).
ВНИМАНИЕ: При работе с культурами Mab требуется шкаф биобезопасности. - Следите за ростом прекультуры Маб путем измерения оптической плотности на длине волны 600 нм с помощью спектрофотометра. Когда культура достигнет фазы экспоненциального роста, переходите к шагу 1.3.
- Используя экспоненциальную предварительную культуру, приготовьте бактериальную суспензию в концентрации примерно 5 x 105 КОЕ/мл (в соответствии со значениями оптической плотности)14 в жидкой питательной среде.
- Приготовьте раствор положительного контроля подавления роста бактерий в жидкой питательной среде. Для этого анализа положительным контролем был кларитромицин (10 мг/мл в ДМСО) в концентрации 4 мкг/мл. Кларитромицин должен быть приготовлен в 2 раза выше желаемой конечной концентрации.
- С помощью микропланшетного дозатора реагентов, оснащенного небольшой кассетой, диспенсируйте 15 мкл жидкой питательной среды в заготовки и необработанные колонки черного полипропиленового 384-луночного планшета. Для пустых колонок выдайте дополнительно 15 μл жидкой питательной среды.
ПРИМЕЧАНИЕ: Глухие колонны предотвращают испарение внутренних лунок при температуре 37 °C. - С помощью микропланшетного дозатора реагентов, оснащенного небольшой кассетой, диспенсируйте 15 мкл положительного контрольного раствора, приготовленного на шаге 1.4, в положительные контрольные колонки.
- С помощью дозатора реагентов на микропланшетах, оснащенного большой кассетой, диспенсируйте 15 мкл бактериальной суспензии, приготовленной на шаге 1.3, во все колонки, кроме заготовок, разбавляя все в соотношении 1:2. Итоговый объем всех 384 скважин составляет 30 μл.
ПРИМЕЧАНИЕ: Микропланшетный дозатор реагентов может быть оснащен большой или маленькой кассетой, отличающейся размером трубки (0,5 и 0,22 мм соответственно). Предпочтительно использовать кассету большего размера, чтобы предотвратить скопление бактерий в системе трубок, даже если это приведет к большим потерям жидкости. Тем не менее, одна и та же кассета может быть использована на протяжении всего анализа. - Загерметизируйте каждую пластину герметиком, обеспечивающим непрерывный газообмен. Инкубировать при температуре 37 °C в инкубаторе без перемешивания во влажной камере в течение 48 ч.
- Через 48 ч считайте люминесценцию, испускаемую бактериями в каждой пластине, с помощью считывателя пластин с временем интегрирования 1 с.
- Чтобы определить Z'-фактор, используйте значения, полученные на шаге 1.9, и рассчитайте среднее и стандартное отклонение положительного (AVGP и SDP) и отрицательного (AVGN и SDN) элементов управления. После этого примените следующую формулу:
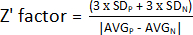
ПРИМЕЧАНИЕ: 3 x SD - это обычно используемый порог; Тем не менее, его можно отрегулировать так, чтобы он лучше подходил для скрининга - либо увеличивая, либо уменьшая коэффициент, на который умножается стандартное отклонение.
2. Проверка библиотеки на попадания
ПРИМЕЧАНИЕ: Первые скрининги были проведены против бактерий, растущих в жидкой культуре. Установка рассчитана на 384-луночные планшеты с конечным объемом 30 μл. Каждая пластина содержала глухие лунки (только жидкая питательная среда), отрицательный контроль (необработанные бактерии) и контроль растворителя (бактерии плюс растворитель соединения - в данном случае ДМСО; Дополнительный рисунок 2). Соединения или растворитель добавляли в пластину в 2 раза выше желаемой конечной концентрации, а бактерии добавляли в соотношении 1:1 (разбавляя все до половины).
- Приготовьте бактериальную суспензию, как описано в шагах с 1.1 по 1.3.
ВНИМАНИЕ: При работе с культурами Mab требуется шкаф биобезопасности. - Приготовьте раствор растворителя в жидкой питательной среде. Количество растворителя должно быть в 2 раза больше желаемой конечной концентрации.
- С помощью микропланшетного дозатора реагентов, оснащенного небольшой кассетой, диспенсируйте 15 мкл жидкой питательной среды в каждую колонну черных полипропиленовых 384-луночных планшетов, за исключением контрольной колонки растворителя. Для пустых колонок выдайте дополнительно 15 мкл жидкой питательной среды.
- С помощью микропланшетного дозатора реагентов, оснащенного небольшой кассетой, диспенсируйте 15 мкл предварительно приготовленного раствора растворителя в контрольную колонку растворителя.
- С помощью манипулятора с жидкостями перенесите 200 нл соединений из стандартных 96-луночных планшетов (1 мМ в ДМСО) на 384-луночные планшеты, за исключением заготовок, регуляторов растворителей и необработанных колонок. В настоящее время соединения находятся в концентрации 13,3 мкМ.
- С помощью микропланшетного дозатора реагентов, оснащенного большой кассетой, диспенсируйте 15 мкл бактериальной суспензии, приготовленной на шаге 2.1, во все колонки, кроме заготовок, разбавив все в соотношении 1:2. Конечный объем всех 384 лунок составляет 30 μл, а каждое соединение находится на уровне 6,66 μМ.
- Загерметизируйте каждую пластину герметиком, обеспечивающим непрерывный газообмен.
ПРИМЕЧАНИЕ: Анализ можно проводить с обычными крышками; Тем не менее, существует более высокая вероятность более сильных краевых эффектов. - Инкубировать при температуре 37 °C в инкубаторе без перемешивания во влажной камере в течение 48 ч.
- Через 48 ч считайте люминесценцию, испускаемую бактериями в каждой пластине, с помощью считывателя пластин с временем интегрирования 1 с.
3. Анализ данных скрининга хитов
ПРИМЕЧАНИЕ: Для идентификации попаданий с полученными данными люминесценции значения должны быть нормализованы по растворителю, в котором растворены соединения, и, если это происходит, по краевому эффекту, проверенному на 384-микротитровых планшетах.
- Для нормализации растворителей по данным, полученным на шаге 2.9, разделите относительные световые единицы (RLU) каждой лунки на среднее значение RLU контрольных лунок растворителя (в соответствующей пластине). В этом анализе был проверен сильный краевой эффект ближе к середине просеивающих пластин; Таким образом, было принято решение нормализовать все данные для него. Для достижения этой цели процесс был выполнен в два этапа, как описано ниже.
- Создайте маску эффекта краев, разделив значения, полученные на шаге 3.1 для соответствующих положений, исключая попадания, по всем пластинам (пластина 1 - P1, пластина 2 - P2, пластина 3 - P3, пластина 4 - P4). Например, для позиций A1 и A2 Mask_A1 = Average (P1_A1; P2_A1; P3_A1; P4_A1); Mask_A2 = Среднее (P1_A2; P2_A2; P4_A2) [P3_A2 был исключен, потому что это был хит].
- Разделите значения, полученные на шаге 3.1. По своему краю эффект маски получен на шаге 3.1.1. Например,
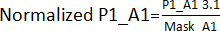 . После этого рассчитайте среднее значение и SD каждой пластины, чтобы установить пороговое значение (среднее значение ± 3SD) для каждой пластины. Любое соединение, превышающее этот порог, считается попаданием и передается в анализ на валидацию попадания.
. После этого рассчитайте среднее значение и SD каждой пластины, чтобы установить пороговое значение (среднее значение ± 3SD) для каждой пластины. Любое соединение, превышающее этот порог, считается попаданием и передается в анализ на валидацию попадания.
4. Проверочный анализ попадания
ПРИМЕЧАНИЕ: После выявления попаданий их необходимо проверить с использованием различных концентраций. В валидационном анализе используется аналогичная установка с теми же контрольными параметрами, но каждое попадание будет подвергаться серийному разведению в соотношении 1:2. Для этого анализа использовали три концентрации - 13,3 мкМ, 6,66 мкМ и 3,3 мкм. Контрольные растворители будут содержать тот же % растворителя, что и каждая лунка соединения (дополнительный рисунок 3).
- Приготовьте бактериальную суспензию, как описано в шагах с 1.1 по 1.3.
ВНИМАНИЕ: При работе с культурами Mab требуется шкаф биобезопасности. - С помощью дозатора реагентов на микропланшетах, оснащенного небольшой кассетой, диспенсируйте 15 мкл жидкой питательной среды в каждую колонку черного полипропиленового 384-луночного планшета. Для глухих лунок выдайте дополнительно 15 μL жидкой питательной среды в первую и последнюю колонку.
- С помощью дозатора реагентов на микропланшетах нанесите дополнительно 15 мкл жидкой питательной среды в колонки, содержащие наибольшее [μM] каждого соединения.
- Из стандартных 96-луночных планшетов вручную пипетируйте 0,8 мкл каждого попадания (1 мМ в ДМСО) в соответствующие лунки, начиная с шага 4.3, в двух экземплярах. В настоящее время соединения находятся в концентрации 26,6 мкМ.
- Вручную внесите 0,8 мкл растворителя в контрольные лунки в двух экземплярах (так же, как на шаге 4.4).
- С помощью многоканальной микропипетки выполните два последовательных разведения 1:2 для каждого соединения и контроля растворителя. Выбросьте более 15 мкл после последнего серийного разведения. Все скважины теперь имеют 15 μL, а концентрации соединений составляют 26,6 μM, 13,3 μM и 6,66 μM.
- С помощью микропланшетного дозатора реагентов с большой кассетой дозировать 15 мкл приготовленной в 4,1 степени бактериальной суспензии во все колонки (кроме глухих лунок), разбавляя соединения в соотношении 1:2. Все скважины имеют конечный объем 30 μL, а каждое соединение имеет 13,3 μM, 6,66 μМ и 3,3 μM.
- Загерметизируйте пластину герметиком, обеспечивающим непрерывный газообмен. Инкубировать при температуре 37 °C в инкубаторе без перемешивания во влажной камере в течение 48 ч.
- Через 48 ч считайте люминесценцию, испускаемую бактериями в каждой пластине, со временем интегрирования 1 с с помощью считывателя пластин.
5. Анализ на инфекцию
ПРИМЕЧАНИЕ: Маб является внутриклеточным факультативным патогеном, поэтому антимикробная активность хитов и токсичность для хозяина должны определяться при анализе инфекции. Для этого макрофаги (BMM), полученные из костного мозга, были инфицированы Mab и обработаны ударами, проверенными на этапе 4, в различных концентрациях. Каждый анализ включал холостой (только воду), отрицательный контроль (необработанные инфицированные макрофаги), положительный контроль (инфицированные макрофаги, обработанные эффективным антибиотиком), контроль растворителей (в данном случае ДМСО) и исследуемые соединения в трех концентрациях - 13,3 μМ, 6,66 μМ и 3,3 μМ (дополнительный рисунок 4).
- Получение макрофагов из костного мозга мышей дикого типа взрослых мышей (BALB/c или C57BL/6), как описано ранее15. Поместите элементы на 96-луночную, черную, оптически прозрачную пластину с плоским дном в соотношении 2 x 105 клеток/мл, 200 μл на лунку. После 10 дней дифференцировки при 37 °C, 7% CO215, клетки готовы к инфицированию и продолжают лечение.
ПРИМЕЧАНИЕ: Протокол получения макрофагов, полученных из костного мозга, хорошо известен15; однако этот протокол скрининга может быть адаптирован к другим клеткам, таким как RAW 264.7, THP-1 и макрофаги, полученные из PBMC. - Приготовьте бактериальную суспензию, как описано в шагах с 1.1 по 1.3, регулируя бактериальную суспензию в культуральной среде для инфекции с кратностью инфекции (MOI), равной 1.
ВНИМАНИЕ: При работе с культурами Mab требуется шкаф биобезопасности. - Тщательно отсасывайте дополненную среду для культивирования клеток из лунок с помощью вакуумного насоса, прикрепленного к стеклянной пипетке. Этот этап нужно выполнять медленно и с легкостью, чтобы предотвратить отслоение клеток.
- Вручную пипетируйте 75 мкл бактериальной суспензии, приготовленной на шаге 5.2, в каждую лунку. Инкубируйте планшет при 37 °C с 7%CO2 в течение 4 ч в клеточном инкубаторе.
- Подготовьте соединения для обработки клеток. С помощью дозатора реагентов на микропланшетах, оснащенного небольшой кассетой, диспенсируйте в полипропиленовые 96-луночные планшеты с круглым дном 110 мкл добавленной среды для культивирования клеток в колонки, где будут находиться соединения или контроль растворителя (дополнительный рисунок 4).
- С помощью дозатора реагентов на микропланшетах диспенсируйте дополнительно 104 мкл добавленной среды для клеточных культур в колонки, где будет наибольшая концентрация соединения или растворителя.
- Вручную пипетируйте 5,9 мкл соединений (1 мМ в ДМСО) или растворителя в предназначенные для них лунки (столбцы на шаге 5.6). В настоящее время соединения находятся в концентрации 26,6 мкМ.
- С помощью многоканальной микропипетки выполните два последовательных разведения 1:2 для каждого соединения и растворителя. Выбросьте более 110 мкл после последнего серийного разведения. Во всех скважинах теперь 110 μL, а концентрации соединений составляют 26,6 μM, 13,3 μM и 6,66 μM.
- С помощью микропланшетного дозатора реагентов диспенсируйте 110 мкл дополненной среды для культивирования клеток во все колонки (за исключением холостых лунок). В настоящее время во всех скважинах содержится 220 μL, а концентрации соединений составляют 13,3 μM, 6,66 μM и 3,3 μM.
- Готовят раствор кларитромицина (положительный контроль) в концентрации 2 мкг/мл в питательной среде для клеточных культур.
- Через 4 ч после шага 5.4 с помощью моечной машины для тарелок 3 раза промойте зараженный 96-луночный раствор 200 мкл раствора для промывки инфекции. Поддерживайте скорость аспирации и дозирования на максимально медленном уровне, чтобы предотвратить отслоение клеток.
- После окончательной аспирации 200 мкл соединений, приготовленных на этапах 5,5-5,9, переносят на 96-луночный планшет, содержащий инфицированные макрофаги.
- Перенесите 200 мкл добавленной среды для клеточных культур в необработанные лунки. Перенесите 200 мкл раствора кларитромицина, приготовленного на шаге 5.10, в соответствующие лунки.
- Инкубировать планшет в клеточном инкубаторе при температуре 37 °C, с 7%CO2, в течение 48 часов.
- Через 48 часов промойте зараженную 96-луночную пластину с помощью промывочной машины с моющим раствором компаунда (3 раза по 200 мкл на лунку).
- С помощью многоканальной микропипетки нанесите 200 мкл фиксирующего раствора во все лунки и дайте ему подействовать в течение 10 минут.
- После фиксации с помощью промывочной машины промыть клетки раствором для промывки соединений (3 раза по 200 мкл на лунку).
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь. Ячейки можно хранить в промывном растворе соединения при температуре 4 °C в течение нескольких дней или недель, если предотвратить загрязнение и сухость клеток. Моющий раствор компаундов необходимо отсасывать перед шагом 5.18. - С помощью многоканальной микропипетки нанесите 200 мкл проникающего раствора во все лунки и дайте ему подействовать в течение 15 минут. С помощью шайбы для тарелок отасуньте проникающий раствор.
- С помощью многоканальной микропипетки вручную дозируйте 100 мкл окрашивающего раствора и инкубируйте планшеты при комнатной температуре в течение 30 минут.
- С помощью моечной машины для тарелок промойте пластины промывочным раствором компаунда (3 раза по 200 мкл на лунку). В конце оставьте окрашенные клетки в растворе для стирки состава.
- Просеивайте пластины в системе визуализации с высоким содержанием изображения со следующими настройками:
Объектив: 20x Air/0,4NA (одна лунка 96-микротитрового планшета, 57 полей зрения (FOV))
Режим: Конфокальный
Лазер 405 нм для DAPI (ядер)
Лазер 561 нм для mScarlet (бактерии)
Лазер 640 нм для HCS Cell Mask Deep Red (цитоплазма)
Нет z-стека
ПРИМЕЧАНИЕ: Клетки могут быть визуализированы с помощью широкоугольной системы визуализации, что снижает четкость. - Настройте робота для работы с оборудованием для получения изображений в течение ночи. Эта роботизированная рука заменяет пластины в системе визуализации с высоким содержанием без вмешательства человека.
ПРИМЕЧАНИЕ: Это не является обязательным; Пластины можно заменять вручную.
6. Анализ изображений
ПРИМЕЧАНИЕ: Анализ изображений выполняется с помощью аналитического программного обеспечения, которое является тем же, что и система обработки изображений с высоким содержанием изображения, используемая для получения изображений. Конвейер анализа должен быть создан с использованием образцов изображений (дополнительный рисунок 5). После этого он будет применен ко всей скважине (57 FOV) и набору данных (всем пластинам). Аналитическое программное обеспечение следует логической последовательности шагов, начиная с сегментации различных областей интереса (ядер, цитоплазмы, клеток и бактерий), связывая их (например, бактерии внутри клеток), а затем извлекая морфологические свойства и свойства интенсивности (например, площадь, интенсивность). Основные этапы анализа изображений описаны ниже. Полный текст используемого протокола можно найти на дополнительном рисунке 5.
- Сегментируйте ядра с помощью сигнала DAPI, цитоплазму — с помощью сигнала DeepRed, а бактерии — с помощью сигнала mScarlet.
- Соотнесите ядра и сегментацию цитоплазмы, чтобы создать маску для клеток.
- Удалите все объекты границы. Будут учитываться только те ячейки, которые отображаются как заполненные на поле зрения (целые ячейки).
- Определите выходную популяцию бактерий в целых клетках, связав целые клетки и бактерии.
- Определите инфицированные целые клетки как имеющие более одной бактериальной области, а неинфицированные целые клетки как имеющие менее одной бактериальной области.
- После того как все интересующие регионы сегментированы и популяции созданы, вычислите и извлеките их свойства. Для каждой скважины извлекаются следующие свойства.
- Для цельных клеток/ Инфицированных цельных клеток/ Неинфицированных цельных клеток, экстракт
Количество ячеек (Sum per well)
Площадь [мкм2] (среднее + стандартное отклонение на скважину)
Отношение ширины к длине ячейки (среднее + стандартное отклонение на лунку) - Для бактерий в цельных клетках, экстракт
Количество идентифицированных бактериальных областей (сумма на лунку)
Интенсивность (Сумма средней интенсивности по каждой скважине в каждом регионе)
Площадь региона (Сумма на скважину)
- Для цельных клеток/ Инфицированных цельных клеток/ Неинфицированных цельных клеток, экстракт
- После экспорта данных и их обработки в электронной таблице количественно оцените внутриклеточную нагрузку (Mycoload) в соответствии со следующей формулой:
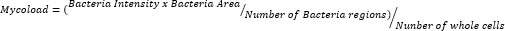
Результаты
Оценка Z' фактора
На рисунке 2 представлены данные одного из двух экспериментов, выполненных для расчета Z'-фактора. Положительным контролем был кларитромицин в концентрации 4 мкг/мл. Оба эксперимента дали Z'-факторы 0,64 и 0,62, что означает, что условия и показания, использованные для этого анализа, могут быть применены к последующему скрининговому анализу (Z' > 0,5). Тем не менее, Z'-фактор был рассчитан для всех остальных экспериментов (анализ на инфекцию) для контроля производительности каждого эксперимента.
В качестве доказательства концепции разработанного HTS-анализа была протестирована библиотека соединений, предназначенных для перепрофилирования лекарств. Он состоит из 1280 разнообразных и малых молекул, 95% из которых являются препаратами, одобренными FDA и EMA. Эти молекулы обладают высоким химическим и фармакологическим разнообразием.
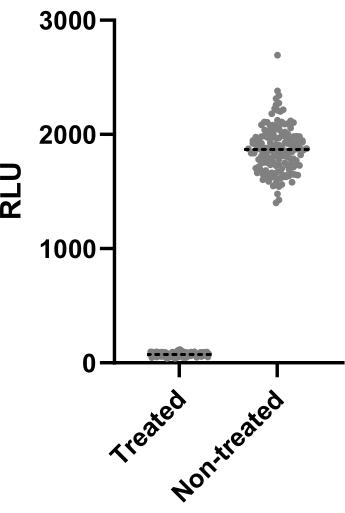
Рисунок 2: Результаты оценки Z'-фактора. Mab при концентрации 2,5 x 105 КОЕ /мл инкубировали с кларитромицином и без него при концентрации 4 мкг/мл в течение 48 ч при 37 °C. После инкубационного периода измеряли люминесценцию для оценки жизнеспособности микобактерий. На графике представлены индивидуальные значения люминесценции обработанных и необработанных жизнеспособных микобактерий в одном независимом эксперименте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Библиотечный скрининг на хиты
Все соединения были протестированы при 6,66 мкМ против Mab. Из-за размера библиотеки соединения были разделены на четыре различных 384-луночных микротитровых планшета (рис. 3A-D). Результаты были нормализованы как для растворителя, так и для верифицированного краевого эффекта.
В этом скрининговом анализе было идентифицировано тридцать три попадания, тридцать из которых значительно снизили излучение люминесценции, снижая жизнеспособность микобактерий (Рисунок 3). Интересно, что три соединения привели к более высокому излучению люминесценции, возможно, связанному с увеличением бактериального метаболизма или пролиферации (рис. 3). Все 33 попадания были перенесены на валидационный анализ, включая три соединения, которые увеличивают люминесценцию, чтобы проверить, будет ли сохраняться этот профиль.
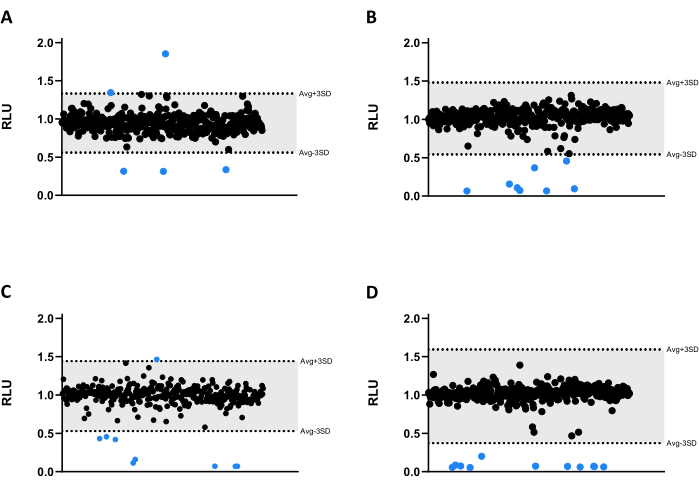
Рисунок 3: Результаты библиотечного скрининга. (A-D) Mab в концентрации 2,5 x 105 КОЕ/мл инкубировали с 1280 соединениями при 6,66 мкМ в течение 48 ч при 37 °C. После инкубации измеряли люминесценцию для оценки жизнеспособности микобактерий. На графиках представлены RLU одного независимого эксперимента, представленные в виде условных единиц после нормализации растворителя и краевого эффекта. AVG RLU и соответствующее ему SD были рассчитаны для каждой пластины для определения порога (серым цветом; AVG ± 3SD). Круглые символы представляют собой тестируемое соединение. Синим цветом обозначено любое соединение, выходящее за пределы этого порога, которое считается попаданием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Проверочный анализ попадания
Концентрации, использованные для этого анализа, составляли 13,3 μМ, 6,66 μМ и 3,3 μМ. Каждое соединение было протестировано в двух экземплярах для повышения надежности.
Важно отметить, что соединения 30, 31 и 32, ранее ассоциированные с более высоким RLU (рисунок 3A, C), сохранили этот профиль, при этом более 200% жизнеспособности микобактерий было достигнуто в лунках, обработанных соединением 32 (рисунок 4).
Соединения 20 и 33 были признаны неактивными, так как жизнеспособность микобактерий близка к 100% во всех протестированных концентрациях (рис. 4).
Соединения 9 и 21 демонстрировали сходное бездействие при двух самых низких концентрациях; однако, в отличие от 20, они остаются активными на самом высоком уровне, 13,3 мкМ, при этом соединение 21 демонстрирует более высокую активность (рис. 4).
Соединение 3 также демонстрирует бездействие при самой низкой концентрации и потерю активности при 6,66 мкМ, хотя и меньше, чем соединение 21 (рис. 4). Только в самых низких концентрациях соединения 2, 7, 8, 10, 16, 18, 24 и 28 проявляли меньший терапевтический потенциал. Тем не менее, 2, 10 и 28 по-прежнему приводят к <50% жизнеспособности микобактерий.
В глобальном масштабе остальные четырнадцать соединений были активны во всех протестированных концентрациях.
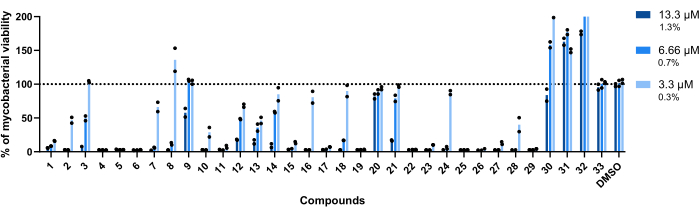
Рисунок 4: Результаты проверочного анализа попадания. Mab при концентрации 2,5 x 105 КОЕ/мл инкубировали с каждым ранее выявленным попаданием в концентрации 13,3 мкМ, 6,66 мкМ и 3,3 мкМ (1,3%, 0,7% и 0,3% ДМСО соответственно) в течение 48 ч при 37 °C. После инкубационного периода измеряли люминесценцию для оценки жизнеспособности микобактерий. На графике показано процентное соотношение обработанных жизнеспособных микобактерий по отношению к необработанным микобактериям в одном независимом эксперименте, при этом каждое соединение было протестировано в двух экземплярах. Круглые символы представляют собой дубликаты для каждого состава. Столбцы представляют среднее значение этих дубликатов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Анализ на инфекцию
Из тридцати трех протестированных соединений двадцать восемь были отобраны для анализа на инфекцию (Рисунок 4). Соединения 7, 8, 9, 20 и 33 не были выбраны для этого анализа. В то время как 9, 20 и 33 были исключены из-за их неактивности при валидации (рис. 4), первые два были исключены по техническим причинам. Тем не менее, эти соединения были идентифицированы как рифампицин и линезолид, антибиотики, уже используемые для лечения инфекций Mab. Все соединения, протестированные в анализе на инфекцию, были идентифицированы и перечислены в таблице 1. Антимикробную активность соединений в отношении инфицированных Mab-инфицированных макрофагов оценивали с помощью собственной флуоресценции бактерий в качестве считывания.
| Соединение | Имя | Соединение | Имя |
| 1 | Сульфатиазол | 18 | Цефуроксим |
| 2 | Ципрофлоксацин | 19 | Рифаксимин |
| 3 | Цефотаксим | 21 | Цефдинир |
| 4 | Даунорубицин | 22 | Кларитромицин |
| 5 | Доксорубицин | 23 | Безифлоксацин |
| 6 | Тиострептон | 24 | Левофлоксацин |
| 10 | Амикацин | 25 | Рифабутин |
| 11 | Моксалактам | 26 | Гатифлоксацин |
| 12 | Сульфаметизол | 27 | Эпирубицин |
| 13 | Сульфамонометоксин | 28 | Pyrvinium pamoate |
| 14 | Цефокситин | 29 | Моксифлоксацин |
| 15 | Новобиоцин | 30 | Тролеандомицин |
| 16 | Цефметазол | 31 | Линкомицин |
| 17 | Рокситромицин | 32 | Спирамицин |
Таблица 1: Список соединений, протестированных в анализе на инфекцию. Соединения, валидированные на этапе 4, были протестированы в анализе на инфекцию (этап 5).
Первым оцениваемым параметром была токсичность соединений по отношению к Mab-инфицированным макрофагам. Пороговое значение, установленное для признания соединения токсичным или нетоксичным, составляло 85% жизнеспособных макрофагов (рис. 5). Из двадцати восьми протестированных соединений 4, 5, 6, 27 и 28 были признаны токсичными. (Рисунок 5). Таким образом, эти пять соединений были исключены из последующей оценки внутримакрофагической активности.
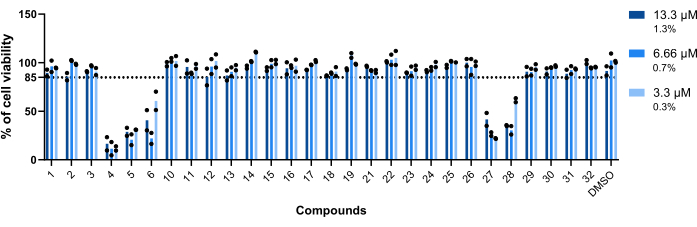
Рисунок 5: Токсичность ударов по отношению к макрофагам, инфицированным Mab. Мышей БММ BALB/c заражали Mab (MOI=1) и инкубировали с каждым ранее выявленным попаданием в дозах 13,3 мкМ, 6,66 мкМ и 3,3 мкМ (1,3%, 0,7% и 0,3% ДМСО соответственно) в течение 48 ч при 37 °C с 7%CO2. Клетки визуализировали в скрининговом флуоресцентном микроскопе с высоким содержанием зерна с использованием количества ядер (окрашенных DAPI) для измерения жизнеспособности клеток. На графике показано процентное соотношение жизнеспособных обработанных инфицированных макрофагов по отношению к жизнеспособным необработанным инфицированным макрофагам в двух независимых экспериментах. Круглые символы представляют жизнеспособность клетки для каждого анализа. Столбцы представляют собой среднее значение двух независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Чтобы сделать вывод об интрамакрофагической активности остальных двадцати трех соединений против внутриклеточного Mab (рис. 6), использовали формулу Mycoload (ранее описанную на шаге 6) для получения процента жизнеспособности микобактерий, нормализованного для необработанных инфицированных макрофагов. Большинство соединений утратили свой терапевтический потенциал против интернализованных микобактерий (рис. 6) по сравнению с валидационным анализом попадания (рис. 4), поскольку количество попаданий уменьшилось с двадцати пяти до шести при самой высокой испытанной концентрации. Поразительно, но все три соединения, которые увеличивают жизнеспособность планктонной маб по сравнению с необработанными бактериями (30, 31 и 32; Рисунки 3 и 4) продемонстрировали антимикобактериальную активность в отношении внутриклеточного Mab, при этом соединения 30 и 32 показали значительную статистическую разницу по сравнению с ДМСО, даже при концентрации 3,3 мкМ в случае соединения 32 (рис. 6). Микобактерии, обработанные соединениями 11 и 23, показали жизнеспособность <50% при 13,3 мкМ; однако это существенно не отличалось от контроля ДМСО (рис. 6). Соединения 21, 26 и 29 были достаточно активны при 13,3 мкМ, чтобы гарантировать значительную статистическую разницу, причем 29 были наиболее активными (рис. 6). Наконец, соединения 17, 22 и 25 были чрезвычайно активны во всех испытанных концентрациях против интернализованных микобактерий. Они были идентифицированы как рокситромицин, кларитромицин и рифабутин соответственно (Таблица 1). Из трех соединений кларитромицин был наиболее активен в отношении Mab, при этом жизнеспособность микобактерий никогда не превышала 10%, представляя p-значение <0,0001 во всех протестированных концентрациях по сравнению с ДМСО (рис. 6).
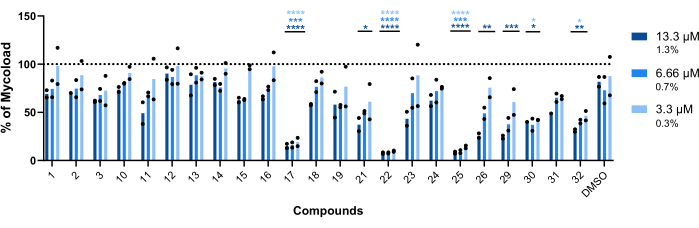
Рисунок 6: Внутримакрофагическая активность хитов в отношении макрофагов, инфицированных Mab. Мышей БММ BALB/c заражали Mab (MOI=1) и инкубировали с каждым ранее выявленным попаданием при дозах 13,3, 6,66 и 3,3 мкМ (1,3, 0,7 и 0,3% ДМСО соответственно) в течение 48 ч при 37 °C с 7%CO2. Клетки визуализировали в скрининговом флуоресцентном микроскопе с высоким содержанием жидкости, а флуоресцентный сигнал использовали для расчета Mycoload (см. шаг 6). На графике показано процентное соотношение Mycoload, обнаруженного в обработанных инфицированных макрофагах, по сравнению с необработанными инфицированными макрофагами в двух независимых экспериментах. Статистику проводили с использованием двусторонней ANOVA с тестом множественного сравнения Даннета; *, p < 0,05; **, p < 0,01; , p < 0,001; , p < 0,0001 по сравнению с ДМСО (контроль растворителя). Звездочки имеют тот же цветовой код для каждой концентрации, что и легенда графика. Круглые символы представляют Mycoload для каждого анализа. Столбцы представляют собой среднее значение двух независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Пример компоновки 384-луночных планшетов, используемой при оценке Z'-фактора. White - глухие лунки (только жидкая питательная среда); желтый – положительный контроль (бактерии лечатся антибиотиком); красный – отрицательный контроль (необработанные бактерии). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Пример компоновки 384-луночных планшетов, используемой при скрининге библиотеки. White - глухие лунки (только жидкая питательная среда); зеленый - контроль растворителя; красный – отрицательный контроль (необработанные бактерии); синий – соединения, которые необходимо просеять. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Пример компоновки 384-луночного планшета, используемого для валидации попадания. White - глухие лунки (только жидкая питательная среда); зеленый - контроль растворителя (в двух экземплярах); красный – отрицательный контроль (необработанные бактерии); синий - соединения, подлежащие экранированию (в дубликатах). Блеклые цвета представляют собой серийные разведения 1:2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Пример компоновки 96-луночного планшета, используемого для анализа инфекции. Белый – глухие колодцы (вода для предотвращения испарения); красный – отрицательный контроль (необработанные макрофаги); желтый – положительный контроль (макрофаги лечатся антибиотиком); зеленый - контроль растворителя; синий – соединения, подлежащие испытанию. Блеклые цвета представляют собой серийные разведения 1:2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 5: Протокол анализа изображений. В данной работе используется подробный протокол анализа изображений, который может быть адаптирован к программному обеспечению с открытым исходным кодом. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом протоколе описывается процесс скрининга лекарственных препаратов против Mab с использованием штаммов собственной разработки 10. С помощью робототехники для работы с жидкостями, автоматизированной микроскопии и анализа, а также двойных репортерных штаммов жизнеспособность бактерий быстро оценивается с помощью люминесценции или флуоресценции без добавления реагентов или выполнения дополнительных действий. Такой подход сокращает время и вариабельность между анализами, что является существенным преимуществом при рассмотрении цели ВТСП-анализов.
При скрининге тысяч соединений эффективный препарат должен быть легко идентифицирован. С этой целью Z'-фактор часто используется для измерения величины статистического эффекта, что позволяет сделать вывод о производительности анализа. Если Z'-фактор > 0,5, то тестируемые условия являются оптимальными для различения обработанных и необработанных популяций13. Тестируемые условия дали Z'-факторы > 0,6 (рис. 2), что статистически доказывает, что они могут быть применены к скрининговой кампании. Этот шаг имеет решающее значение для обеспечения эффективности скрининга.
Таким образом, был разработан протокол HTS для обнаружения антимикробной активности тысяч соединений против Mab, растущего планктоником. Поскольку Mab является внутриклеточным факультативным патогеном, разработанный протокол также проверяет внутриклеточную антимикробную активность против того же бактериального штамма, что является критическим преимуществом. Кроме того, можно также оценить токсичность по отношению к клеткам-хозяевам. Таким образом, описан многоступенчатый подход к скринингу лекарственных препаратов против Mab, использующий различные экспериментальные установки для оценки антимикробной активности наряду с цитотоксичностью, что увеличивает шансы на успех. В качестве доказательства концепции была проведена проверка химической библиотеки, содержащей 1280 соединений.
Всего было выявлено тридцать три попадания (рис. 3). Из них три значительно повысили жизнеспособность микобактерий в жидких культурах (соединения 30, 31 и 32; Рисунок 3 и Рисунок 4). Следует отметить, что эти соединения могут препятствовать излучению люминесценции, не влияя на жизнеспособность бактерий. При тестировании против интернализованных микобактерий эти соединения проявили антимикробную активность (рис. 6), продемонстрировав более высокую эффективность против Mab после интернализации клеток-хозяев. Эти соединения были идентифицированы как тролеандомицин (30), спирамицин (32) и линкомицин (31; Таблица 1). Первые два – это макролиды, класс антибиотиков, используемых для лечения микобактериальных инфекций16, а второй – линкозамид – антибиотик с механизмом действия, сходным с макролидами17. Сообщалось, что Mab особенно устойчив к другому линкозамиду, клиндамицину, как в жидких, так и в твердых культурах18. Тем не менее, иммуномодулирующие и противовоспалительные свойства были связаны с макролидами19,20 и линкозамидами21, что может объяснить повышенную антимикробную активность в отношении интернализованных микобактерий (рис. 6).
Из оставшихся тридцати попаданий одиннадцать снижают жизнеспособность микобактерий на >90% во всех концентрациях (Рисунок 4). Учитывая, что типичный анализ HTS имеет ожидаемую частоту попадания ~1%22, разработанный протокол согласуется с тем, что обычно наблюдается. Тем не менее, несколько других соединений все еще были активны, и двадцать восемь из них были включены в анализ на инфекцию.
Из выявленных соединений пять соединений были признаны токсичными (Рисунок 5) - даунорубицин (4), доксорубицин (5), эпирубицин (27), тиострептон (6) и пирвиниум памоат (28; Таблица 1). Первые три являются противоопухолевыми агентами 23,24,25, поэтому неудивительно, что они токсичны для клеток млекопитающих, используемых в этом анализе. Pyrvinium pamoate использовался в течение многих лет как эффективное глистогонное средство; Однако с 2004 г. она также связана с противоопухолевыми мероприятиями26. Наконец, тиострептон является олигопептидом, часто используемым в ветеринарии, но никогда не одобренным для использования у людей27. Об активности этого препарата в отношении клеток рака молочной железы сообщалось28. Внутримакрофагическая активность тиострептона не оценивалась из-за его токсичности на макрофагах, полученных из костного мозга (рис. 5). Тем не менее, было показано, что тиострептон эффективен при 5 мкМ на инфицированных Mab клетках THP-129. Представленные результаты в отношении планктонных бактерий29 аналогичны результатам, полученным в этом скрининге, при этом тиострептон обладает чрезвычайно высокой эффективностью (Рисунок 4).
Большинство соединений, прошедших скрининг на внутримакрофагическую активность, не показали терапевтического потенциала (рис. 6). Бактериальный внутриклеточный рост значительно отличается от планктонных культур. В последнем всегда возможен прямой контакт бактерий с лекарственными препаратами. В первом случае, из-за интернализации клетками-хозяевами, несколько мембран хозяина действуют как физические барьеры, которые лекарства должны транспонировать, чтобы достичь мишени, что может помочь объяснить снижение антимикробной активности большинства ударов. При самой высокой концентрации, 13,3 мкМ, три соединения проявляли достаточную активность, чтобы статистически отличаться от контроля ДМСО (рис. 6) - цефдинир (21), гатифлоксацин (26) и моксифлоксацин (29; Таблица 1). В то время как моксифлоксацин уже используется в качестве противотуберкулезного препарата второй линии16, цефдинир обычно используется для лечения нескольких бактериальных инфекций дыхательных путей, таких как пневмония30. Тем не менее, сообщалось о его активности в отношении M. tuberculosis31 и Mab, демонстрирующего мощный синергетический эффект с карбапенемом против последнего32. Гатифлоксацин является фторхинолоном, и его активность была зарегистрирована в отношении нескольких микобактерий в последние33,34 года. Тремя наиболее активными соединениями в этом анализе (рис. 6) были рокситромицин (17), кларитромицин (22) и рифабутин (25; Таблица 1), которые чрезвычайно эффективны во всех концентрациях. Первые два являются макролидами, в то время как рифабутин является рифамицином, причем оба класса служат основой для лечения многих микобактериальных инфекций16.
Этот скрининг основан на специальном и дорогостоящем оборудовании для работы с жидкостями, чтобы уменьшить вариативность между анализами. Несмотря на чрезвычайную воспроизводимость, манипулятор не имеет бесконтактной передачи соединений, такой как акустическая. Таким образом, некоторые адгезивные соединения могут оставаться прикрепленными к металлическим штифтам между переносами, переносясь в следующие скважины, что приводит к ложноположительным результатам на этапе скрининга - именно это произошло с соединением 33. Вот почему валидация скрининга так важна для его успеха, гарантируя, что никакие ложноположительные результаты не попадут на следующие этапы конвейера скрининга лекарств. В анализе инфекции используется система визуализации с высоким содержанием изображения с конфокальным режимом для получения наилучшего возможного определения бактериальных областей. Тем не менее, его все еще можно использовать без конфокального режима, хотя и с потерей четкости и, возможно, затрудняющим идентификацию бактериальных областей. Этот протокол использует преимущества простого и удобного для пользователя программного обеспечения для анализа, интегрированного с системой визуализации; тем не менее, программное обеспечение с открытым исходным кодом может использоваться в соответствии с протоколом (дополнительный рисунок 5). В конечном счете, несмотря на то, что препараты не перепрофилируются для лечения инфекций Mab, эти результаты чрезвычайно важны, потому что они подтверждают установленный протокол, который может быть расширен на более крупные библиотеки. Важно отметить, что мы считаем, что этот протокол может быть адаптирован к любым бактериям при условии наличия флуоресцентных или люминесцентных показаний. Таким образом, эта работа вносит значительный вклад в область разработки лекарств, предоставляя необходимые инструменты для борьбы с одной из самых больших проблем общественного здравоохранения - устойчивыми к антибиотикам бактериями - и, в частности, с почти неизлечимым патогеном - Mycobacterium abscessus.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа финансируется за счет национальных фондов Португалии через FCT - Fundação para a Ciência e a Tecnologia, I.P, в рамках проекта PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) и стипендий PhD 2021.07335.BD в GSO и UI/BD/150830/2021 в CMB; FWO - Исследовательский фонд Фландрии, грант No 1S68720N; Инициатива по инновационной медицине 2 Call 16 (IMI2-Call 16) предлагает RespiriTB в рамках соглашения No 853903. Авторы выражают признательность за поддержку научной платформе i3S BioSciences Screening, входящей в национальные инфраструктуры PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) и PPBI - Португальской платформе биовизуализации (PPBI-POCI-01-0145-FEDER-022122).
Материалы
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
Ссылки
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997 (2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179 (2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221 (2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239 (2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I., Macor, J. E. The future of drug repositioning. Annual reports in medicinal chemistry. , 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562 (2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204 (2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224 (2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866 (2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90 (2022).
- Bray, M. A., Carpenter, A., Markossian, S., et al. . Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. , (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18 (2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421 (2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202 (2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302 (2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527 (2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165 (2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249 (2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661 (2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511 (2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293 (2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены