Method Article
分枝杆菌高通量药物筛选的分析开发
摘要
本研究开发了一种针对 脓肿分枝杆菌 的高通量筛选方法,使用荧光和发光快速评估细菌活力。该协议将与旨在筛选针对这种耐药细菌的新药的研究人员相关。
摘要
脓肿分枝杆菌 (Mab) 感染由于具有高度的内在耐药性,与耐多药结核病相当,因此难以治疗。治疗非常无效,并且基于多药方案,导致患者依从性低。因此,敦促科学界确定新的有效药物来治疗这些感染。为此而采用的策略之一是药物再利用——为市场上的现有药物确定新的治疗机会的过程,规避建立新药药代动力学和安全性特征所需的时间。由于大多数针对 Mab 的药物开发研究都依赖于传统且耗时的方法,因此使用 内部 开发的 Mab 双报告菌株开发了一种针对分枝杆菌的高通量药物筛选测定方法。使用液体处理机器人、自动显微镜和分析,以及 内部 开发的双报告菌株,可以使用两种不同的读数(发光和荧光)快速测量细菌活力,而无需添加试剂或执行任何额外步骤。这减少了检测之间的时间和可变性,这是高通量筛选的主要优势。通过筛选 1280 种化合物的文库来验证所描述的方案。所获得的结果与文献相印证,可有效检测活性化合物。因此,这项工作实现了为该领域提供一种新工具来帮助对抗这种极度耐药细菌的目标。
引言
脓肿分枝杆菌 (Mab) 是一种导致肺部感染的机会性病原体,尤其是在囊性纤维化和其他肺部疾病患者中。由于 Mab 引起的感染具有极好的内在耐药性,因此难以治疗,可与耐多药结核病1 相媲美。由于高度不可渗透的分枝杆菌细胞包膜和编码几种使抗生素失活的酶的基因组,可用的药物在很大程度上是无效的 2。因此,治疗包括几种药物的组合,需要数月至数年的时间。这种具有挑战性的多药方案加上患者依从性低,导致平均治愈率为 30% 至 50%3。此外,在过去几十年中,由非结核分枝杆菌引起的肺部感染的患病率有所增加,包括由 Mab 1,4 引起的感染。因此,科学界正在竞相开发治疗 Mab 感染的新化合物。
为此目的而追求的策略之一是药物再利用——为现有药物确定新治疗机会的过程。这规避了新药发现和开发管道伴随的最大挑战 - 时间5。这个简单的概念利用了几种药物已经建立的药代动力学和安全性特征,以降低开发成本并缩短将药物从实验室到床旁所需的时间6。因此,已经编译了将数百到数千种此类化合物组合在一起的文库,使研究人员能够快速测试重新利用药物针对其目标病原体的可能性。
大多数针对 Mab 的药物开发研究都基于金标准但传统的分析方法,该分析方法评估化合物对分枝杆菌的 体外 活性 - 菌落形成单位计数为7。尽管它的准确性很高,但这个过程非常耗时,当有人打算测试包含数千种化合物的文库时,很快就会变得不可行。为此,高通量筛选 (HTS) 已集成到药物开发中 - 利用机器人和液体处理设备的稳健检测,允许快速并行筛选数千种化合物8。这通常是通过最初测试单一浓度来完成的,使用 96、384、1536 或 3456 孔规格的微量滴定板,作为识别苗头化合物的起点,并在管道中进一步优化它们以用于临床使用。
与其他基于染料和吸光度的检测相比,基于报告基因的检测具有简单性和灵敏度,因此为 HTS 的稳健性提供了显著优势7,9。然而,据我们所知,只有少数研究优化了针对 Mab9 的高通量筛选。
最近,我们实验室开发了能够同时发射发光和荧光的双报告菌株10。Mab operon_mScarlet 就是其中一种菌株。由于 LuxABCDE 操纵子的表达,它具有自发光性,包括细菌荧光素酶(通过表达 luxAB 基因)和长链醛底物(通过表达 luxCDE 基因)。另一方面,荧光读数是通过表达最近开发的红色荧光蛋白 mScarlet 获得的,该蛋白的性能优于更常用的 eGFP 和 mCherry 蛋白,可提供更有效的信号11。使用这种菌株使我们能够通过在酶标仪中测量发光信号来评估液体培养物中的细菌活力,而无需添加试剂或执行其他步骤。在检测方面,本征荧光允许在不使用染料或抗体的情况下对活细胞或固定细胞进行显微镜观察。在 HTS 分析中使用单个菌株时,具有两个读数的单个菌株为研究人员提供了一个显着的优势 - 减少了具有不同读数的分析之间的差异,因为无需根据分析的性质交换菌株。
因此,这项工作使用内部设计的双报告菌株开发了一种针对 Mab 的高通量测定法(图 1)。这允许使用商业库快速评估用于再利用的体外活性 1280 药物(参见材料表)。首先,使用发光在肉汤培养测定中评估活性,其次,利用荧光信号使用 mAb 感染的巨噬细胞,更好地模拟体内观察到的感染过程 12。
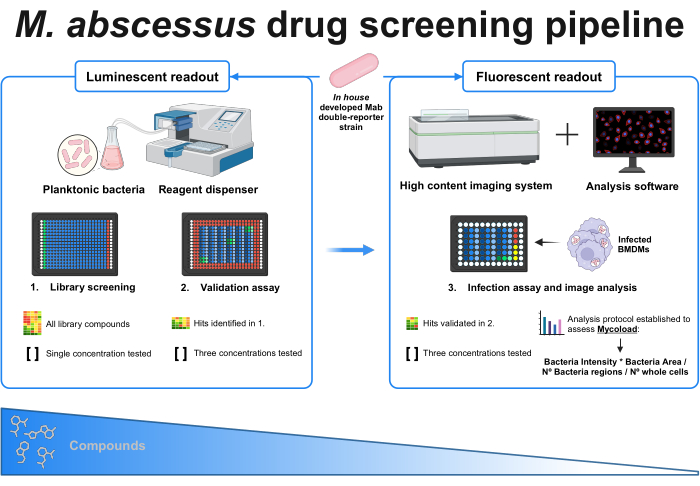
图 1:已建立协议的图形摘要。 该筛选的关键参与者是 内部 开发的双报告分枝杆菌菌株,该菌株贯穿所有实验。首先,使用试剂分配器和浮游细菌,通过测试单一浓度的化合物进行初步筛选。鉴定出的命中继续进行验证分析,在那里测试三种不同浓度的化合物。这两个实验都是使用发光读数完成的。经过验证的命中继续进行感染测定,其中还测试了三种不同浓度,并在 MOI 1 处感染骨髓来源的巨噬细胞。高内涵成像系统获取细菌荧光信号,并使用分析软件通过 Mycoload 公式评估细胞内载量。随着分析复杂性的增加,化合物的数量减少。使用 BioRender.com 创建。 请单击此处查看此图的较大版本。
研究方案
根据欧洲理事会指令 (2010/63/EU) 和葡萄牙法律 (DL 113/2013),所有动物程序均已获得 i3S 当地动物伦理委员会的批准,并获得了葡萄牙食品和兽医总局 (DGAV) 的许可实验动物福利。
1. Z' 因子评估
注:为了评估 HTS 分析的性能,可以确定几个参数。最常用的参数是 Z 质因数 (Z' 因数)。该指标度量给定实验的统计效应大小,指示阳性对照和阴性对照的分离程度。如果 Z' 因子范围在 0.5 和 1 之间,则两个群体之间的分离非常好,这些条件可用于 HTS 分析。如果 Z' < 0.5,则分离仅是边缘的,不建议进行筛选13。因此,设计了一个实验,使用半个带有未处理细菌的板和另一半带有阳性对照的板来计算 Z' 因子(补充图 1)。
- 在测定前 2-3 天,通过在锥形瓶中的液体生长培养基(约 1 x 107 CFU/mL)中接种细菌来制备 Mab 的预培养物。让细菌在 37 °C 下在搅拌 (90 rpm) 的培养箱中生长。
注意:处理 Mab 培养物时,需要生物安全柜。 - 使用分光光度计在 600 nm 处测量光密度,跟踪 Mab 预培养物的生长情况。当培养物达到指数增长阶段时,请继续执行步骤 1.3。
- 使用指数预培养,在液体生长培养基中制备约 5 x 105 CFU/mL(与光密度值相关)14 的细菌悬浮液。
- 在液体生长培养基中制备细菌生长抑制阳性对照溶液。对于该检测,阳性对照为 4 μg/mL 的克拉霉素(10 mg/mL 的 DMSO 溶液)。克拉霉素必须制备所需最终浓度的 2 倍。
- 使用配备小凝胶盒的微孔板试剂分配器,将 15 μL 液体生长培养基分配到黑色聚丙烯 384 孔板的空白柱和未处理柱中。对于空白柱,额外分配 15 μL 液体生长培养基。
注:空白色谱柱可防止内孔在 37 °C 下蒸发。 - 使用配备小盒的微孔板试剂分配器,将 15 μL 步骤 1.4 中制备的阳性对照溶液分配到阳性对照柱中。
- 使用配备大凝胶盒的微孔板试剂分配器,将 15 μL 步骤 1.3 中制备的细菌悬浮液分配到除空白柱之外的所有色谱柱中,以 1:2 稀释所有物质。所有 384 个孔的最终体积为 30 μL。
注:微孔板试剂分配器可配备大或小的透析盒,管路尺寸不同(分别为 0.5 和 0.22 mm)。最好使用更大的透析盒,以防止细菌在管道系统中聚集,即使会导致更多的液体浪费。尽管如此,在整个检测过程中可以使用相同的凝胶盒。 - 使用板密封器密封每个板,以允许连续气体交换。在 37 °C 的培养箱中,在潮湿的室内不搅拌地孵育 48 小时。
- 48 小时后,使用积分时间为 1 秒的读板器读取每个板中细菌发出的发光。
- 要确定 Z' 因子,请使用步骤 1.9 中获得的值并计算正(AVGP 和 SDP)和负(AVGN 和 SDN)对照的平均值和标准差。然后,应用以下公式:
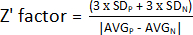
注意:3 x SD 是常用的阈值;但是,可以对其进行调整以更好地适应筛选 - 通过增加或减少标准差乘以的因子。
2. 命中的文库筛选
注意:对液体培养物中生长的细菌进行了第一次筛选。该设置设计用于最终体积为 30 μL 的 384 孔板。每个板都包含空白孔(仅限液体生长培养基)、阴性对照(未经处理的细菌)和溶剂对照(细菌加化合物的溶剂 - 在本例中为 DMSO; 补充图 2)。将化合物或溶剂以所需最终浓度的 2 倍添加到板中,并以 1:1 的比例添加细菌(将所有物质稀释至一半)。
- 如步骤 1.1 至 1.3 中所述制备细菌悬浮液。
注意:处理 Mab 培养物时,需要生物安全柜。 - 在液体生长培养基中制备溶剂溶液。溶剂量必须为所需最终浓度的 2 倍。
- 使用配备有小卡盒的微孔板试剂分配器,将 15 μL 液体生长培养基分配到黑色聚丙烯 384 孔板的每列中,溶剂对照柱除外。对于空白色谱柱,额外分配 15 μL 液体生长培养基。
- 使用配备小盒的微孔板试剂分液器,将 15 μL 先前制备的溶剂溶液分液到溶剂控制柱中。
- 使用液体处理器,将 200 nL 化合物从储备 96 孔板(1 mM 的 DMSO 中)转移到 384 孔板中,空白柱、溶剂对照柱和未处理柱除外。化合物现在的浓度为 13.3 μM。
- 使用配备有大盒的微孔板试剂分配器,将 15 μL 步骤 2.1 中制备的细菌悬浮液分配到除空白柱之外的所有色谱柱中,以 1:2 稀释所有物质。所有 384 个孔的最终体积为 30 μL,每种化合物为 6.66 μM。
- 使用板密封器密封每个板,以允许连续气体交换。
注意:可以使用普通盖子进行检测;但是,更强的边缘效果的可能性更高。 - 在 37 °C 的培养箱中,在潮湿的室内不搅拌地孵育 48 小时。
- 48 小时后,使用积分时间为 1 秒的读板器读取每个板中细菌发出的发光。
3. 苗头化合物筛选数据分析
注:为了识别采集的发光数据的命中,必须将值归一化为溶解化合物的溶剂,如果出现,则必须归一化为在 384 微量滴定板上验证的边缘效应。
- 对于步骤 2.9 中获得的数据的溶剂归一化,将每个孔的相对光单位 (RLU) 除以溶剂对照孔的平均 RLU(在相应的板中)。在该测定中,验证了筛选板中间的强边缘效应;因此,决定对它的所有数据进行归一化。为了实现这一点,该过程以两步方式完成,如下所述。
- 通过将步骤 3.1 中针对所有印版(印版 1 - P1、印版 2 - P2、印版 3 - P3、印版 4 - P4)的相应位置(不包括点击)获得的值来创建边缘效果蒙版。例如,对于 A1 和 A2 位置,Mask_A1 = 平均值 (P1_A1;P2_A1;P3_A1;P4_A1);Mask_A2 = 平均值 (P1_A2;P2_A2;P4_A2) [P3_A2 被排除在外,因为它很受欢迎]。
- 将步骤 3.1 中获得的值除以。通过步骤 3.1.1 中获得的边缘效果蒙版。例如,
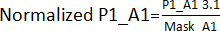 .之后,计算每个板的 AVG 和 SD 以为每个板建立阈值(AVG ± 3SD)。任何超出此阈值的化合物都被视为苗头化合物,并继续进行苗头化合物验证分析。
.之后,计算每个板的 AVG 和 SD 以为每个板建立阈值(AVG ± 3SD)。任何超出此阈值的化合物都被视为苗头化合物,并继续进行苗头化合物验证分析。
4. 苗头化合物验证分析
注:鉴定出苗头化合物后,需要使用不同的浓度进行验证。验证检测使用具有相同对照的类似设置,但每个命中将进行 1:2 的连续稀释。对于该分析,使用了三种浓度 - 13.3 μM、6.66 μM 和 3.3 μM。溶剂对照将包含与每个化合物孔相同的溶剂 %(补充图 3)。
- 如步骤 1.1 至 1.3 中所述制备细菌悬浮液。
注意:处理 Mab 培养物时,需要生物安全柜。 - 使用配备小凝胶盒的微孔板试剂分液器,将 15 μL 液体生长培养基分液分样到黑色聚丙烯 384 孔板的每根柱子中。对于空白孔,向第一根和最后一根色谱柱额外分配 15 μL 液体生长培养基。
- 使用微孔板试剂分液器,向每种化合物中含量最高 [μM] 的色谱柱中额外分配 15 μL 液体生长培养基。
- 从储备的 96 孔板中,从步骤 4.3 开始,手动将 0.8 μL 每次点击(1 mM 在 DMSO 中)移液到各自的孔中,一式两份。化合物现在的浓度为 26.6 μM。
- 手动将 0.8 μL 溶剂移液到对照孔中,一式两份(与步骤 4.4 相同)。
- 使用多通道微量移液器,对每种化合物和溶剂对照进行两次 1:2 连续稀释。在最后一次连续稀释后丢弃超过 15 μL。现在所有孔都有 15 μL,化合物的浓度为 26.6 μM、13.3 μM 和 6.66 μM。
- 使用带有大盒的微孔板试剂分配器,将 15 μL 在 4.1 中制备的细菌悬浮液分配到所有色谱柱(空白孔除外),以 1:2 稀释化合物。所有孔的最终体积为 30 μL,每种化合物的体积为 13.3 μM、6.66 μM 和 3.3 μM。
- 使用板密封机密封板,允许连续气体交换。在 37 °C 的培养箱中,在潮湿的室内不搅拌地孵育 48 小时。
- 48 小时后,使用读板器读取每个板中细菌发出的发光,积分时间为 1 秒。
5. 感染检测
注:Mab 是一种细胞内兼性病原体,因此必须在感染测定中确定苗头化合物的抗菌活性和宿主毒性。为此,用 Mab 感染骨髓来源的巨噬细胞 (BMM),并用步骤 4 中验证的不同浓度的命中处理。每个测定包括空白(仅水)、阴性对照(未经处理的感染巨噬细胞)、阳性对照(用有效抗生素处理的受感染的巨噬细胞)、溶剂对照(在本例中为 DMSO)和三种浓度的待测化合物 - 13.3 μM、6.66 μM 和 3.3 μM(补充图 4)。
- 如前所述,从野生型成年小鼠 (BALB/c 或 C57BL/6) 的小鼠骨髓中提取巨噬细胞15。将细胞以 2 x 105 个细胞/mL、每孔 200 μL 的浓度接种在 96 孔、黑色、光学透明平底板上。在 37 °C、7% CO2 15 下分化 10 天后,细胞即可感染并继续处理。
注:获得骨髓来源的巨噬细胞的方案是公认的15;然而,这种筛选方案可以适应其他细胞,例如 RAW 264.7、THP-1 和 PBMC 衍生的巨噬细胞。 - 如步骤 1.1 至 1.3 所述制备细菌悬浮液,调整细胞培养基中的细菌悬浮液以用于感染复数 (MOI) 为 1 的感染。
注意:处理 Mab 培养物时,需要生物安全柜。 - 使用连接到玻璃移液器的真空泵小心吸出孔中补充的细胞培养基。此步骤需要缓慢而轻松地进行,以防止细胞脱离。
- 手动移液 75 μL 在步骤 5.2 中制备的细菌悬浮液到每个孔中。将板在 37 °C 和 7% CO2 中在细胞培养箱中孵育 4 小时。
- 准备用于细胞处理的化合物。使用配备小凝胶盒的微孔板试剂分配器,将 110 μL 补充的细胞培养基分配到聚丙烯、圆底、96 孔板中,将补充的细胞培养基分配到化合物或溶剂对照的色谱柱中(补充图 4)。
- 使用微孔板试剂分液器,将补充的 104 μL 细胞培养基额外分配到化合物或溶剂浓度最高的色谱柱中。
- 手动将 5.9 μL 化合物(1 mM 在 DMSO 中)或溶剂移液到其指定的孔中(步骤 5.6 中的色谱柱)。化合物现在的浓度为 26.6 μM。
- 使用多通道微量移液器,对每种化合物和溶剂进行两次 1:2 的连续稀释。在最后一次连续稀释后丢弃超过 110 μL。现在所有孔都有 110 μL,化合物的浓度为 26.6 μM、13.3 μM 和 6.66 μM。
- 使用微孔板试剂分液器,将 110 μL 添加的细胞培养基分样到所有色谱柱(不包括空白孔)中。现在所有孔都有 220 μL,化合物的浓度为 13.3 μM、6.66 μM 和 3.3 μM。
- 在补充的细胞培养基中制备 2 μg/mL 的克拉霉素(阳性对照)溶液。
- 在步骤 5.4 后 4 小时,使用洗板机,用 200 μL 感染洗涤液洗涤感染的 96 孔板 3 次。将吸液和分液速度保持在尽可能慢的水平,以防止任何细胞脱落。
- 最后一次抽吸后,将 200 μL 在步骤 5.5-5.9 中制备的化合物转移到含有感染巨噬细胞的 96 孔板中。
- 将 200 μL 补充的细胞培养基转移至未处理的孔中。将 200 μL 步骤 5.10 中制备的克拉霉素溶液转移到各自的孔中。
- 将板在 37 °C 和 7% CO2 的细胞培养箱中孵育 48 小时。
- 48 小时后,使用洗板机和化合物的洗涤液(每孔 200 μL 3 次)洗涤感染的 96 孔板。
- 使用多通道微量移液器,将 200 μL 固定液分配到所有孔中,并静置 10 分钟。
- 固定后,使用洗板机,用化合物的洗涤液(每孔 200 μL 3 次)洗涤细胞。
注意:协议可以在此处暂停。如果防止污染和细胞干燥,细胞可以在 4 °C 的化合物洗涤液中储存数天或数周。必须在步骤 5.18 之前吸出化合物的洗涤液。 - 使用多通道微量移液器,将 200 μL 透化溶液分配到所有孔中,并让它作用 15 分钟。使用洗板机吸出透化溶液。
- 使用多通道微量移液器,手动分配 100 μL 染色溶液,并在室温下孵育板 30 分钟。
- 使用洗板机,用化合物的洗涤液(每孔 200 μL 3 次)洗涤板。最后,将染色的细胞留在化合物的洗涤液中。
- 使用以下设置在高内涵成像系统中筛选板:
物镜:20x 空气/0.4NA(一个 96 微孔板,57 个视野 (FOV)
模式:共聚焦
激光 405 nm,用于 DAPI(细胞核)
激光 561 nm,用于 mScarlet(细菌)
用于 HCS 细胞掩膜 Deep Red(细胞质)的激光 640 nm
无 z 堆栈
注意:细胞可以使用宽场成像系统成像,从而降低清晰度。 - 设置一个设备搬运机器人,用于过夜的图像采集。该机械臂无需人工干预即可更换高内涵成像系统中的板。
注意:这不是强制性的;可以手动更换板。
6. 图像分析
注:图像分析是使用分析软件进行的,该软件与用于获取图像的高内涵成像系统相同。必须使用样本图像创建分析管道(补充图 5)。之后,它将应用于整个孔 (57 FOV) 和数据集 (所有板)。分析软件遵循一个逻辑步骤序列,从分割不同的感兴趣区域(细胞核、细胞质、细胞和细菌)开始,将它们关联起来(例如,细胞内的细菌),然后提取形态和强度特性(例如,面积、强度)。图像分析的基本步骤如下所述。使用的完整协议可以在 补充图 5 中找到。
- 使用 DAPI 信号分割细胞核,使用 DeepRed 信号分割细胞质,使用 mScarlet 信号分割细菌。
- 将细胞核和细胞质分割联系起来,为细胞创建掩码。
- 删除所有 border 对象。仅考虑在 FOV 上显示为完整的单元格 (整个单元格)。
- 通过关联全细胞和细菌来定义输出群体 全细胞中的细菌。
- 将感染的全细胞定义为具有多个细菌区域,将未感染的全细胞定义为具有少于一个细菌区域。
- 分割所有感兴趣区域并创建种群后,计算并提取其属性。为每个孔提取以下属性。
- 对于全细胞/感染的全细胞/未感染的全细胞,提取
细胞数(每孔总和)
面积 [μm2](平均值 + 每孔的标准偏差)
宽长细胞比(平均值 + 每孔的标准偏差) - 对于全细胞中的细菌,提取
已识别的细菌区域数(每孔总和)
强度(每个区域的平均强度的每孔总和)
区域面积(每孔总和)
- 对于全细胞/感染的全细胞/未感染的全细胞,提取
- 导出数据并在电子表格中整理它们后,根据以下公式量化细胞内负荷 (Mycoload):
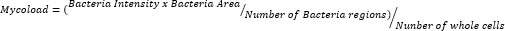
结果
Z 因子评估
图 2 描述了为计算 Z' 因子而进行的两次实验中的一项数据。阳性对照为 4 μg/mL 的克拉霉素。两个实验都产生了 0.64 和 0.62 的 Z' 因子,这意味着用于该测定的条件和读数可以应用于随后的筛选测定 (Z' > 0.5)。尽管如此,还是计算了所有剩余实验(感染测定)的 Z' 因子以控制每个实验的性能。
作为所设计的 HTS 分析的概念验证,测试了用于药物再利用的化合物库。它包括 1280 种不同的小分子,其中 95% 是 FDA 和 EMA 批准的药物。这些分子具有高度的化学和药理学多样性。
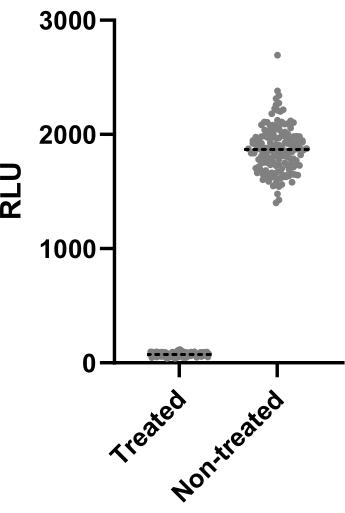
图 2:Z 因子评估结果。 在 37 °C 下,将 2.5 x 105 CFU/mL 的 mAb 与不含 4 μg/mL 的克拉霉素一起孵育 48 小时。 孵育期后,测量发光以评估分枝杆菌活力。该图显示了一项独立实验中处理和未处理的活分枝杆菌的单个发光值。 请单击此处查看此图的较大版本。
命中的文库筛选
所有化合物均以 6.66 μM 的浓度对 mAb 进行了检测。由于文库的大小,将化合物分成四种不同的微量滴定 384 孔板(图 3A-D)。对溶剂和经过验证的边缘效应的结果进行了归一化。
在该筛选测定中,确定了 33 个命中,其中 30 个显着降低了发光发射,降低了分枝杆菌活力(图 3)。有趣的是,三种化合物导致更高的发光发射,可能与细菌代谢或增殖增加有关(图 3)。所有 33 次命中均进行验证分析,包括三种增加发光的化合物,以测试是否会保留此图谱。
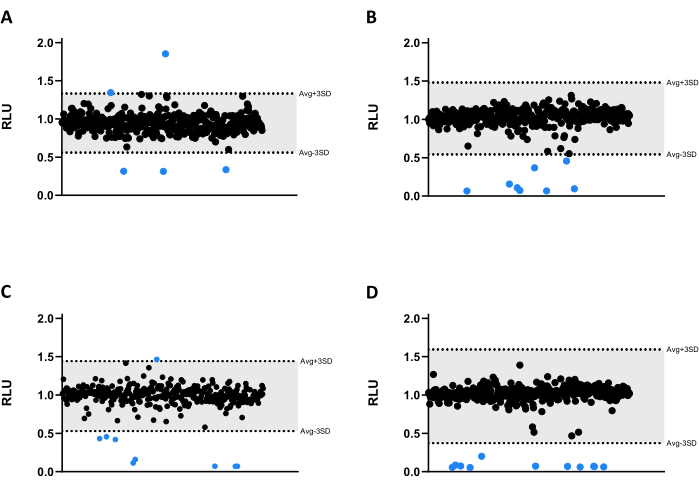
图 3:文库筛选结果。 (A-D) 将 2.5 x 105 CFU/mL 的 mAb 与 1280 种 6.66 μM 化合物在 37 °C 下孵育 48 小时。 孵育后,测量发光以评估分枝杆菌活力。这些图表显示了一个独立实验的 RLU,在溶剂和边缘效应归一化后以任意单位表示。计算每个板的 AVG RLU 及其相应的 SD 以确定阈值(灰色;AVG ± 3SD)。圆形符号表示测试化合物。蓝色表示超出该阈值的任何化合物都被视为命中。 请单击此处查看此图的较大版本。
苗头化合物验证检测
用于该测定的浓度为 13.3 μM、6.66 μM 和 3.3 μM。每种化合物都进行了一式两份测试,以提高稳定性。
重要的是,以前与较高 RLU 相关的化合物 30、31 和 32(图 3A、C)保持了这一特征,在用化合物 32 处理的孔中实现了超过 200% 的分枝杆菌活力(图 4)。
化合物 20 和 33 被认为是无活性的,因为在所有测试的浓度下,分枝杆菌的活力接近 100%(图 4)。
化合物 9 和 21 在两个最低浓度下表现出相似的无活性;然而,与 20 相反,它们在最高的 13.3 μM 处保持活性,化合物 21 显示出更高的效力(图 4)。
化合物 3 在最低浓度下也表现出无活性,在 6.66 μM 时活性丧失,尽管低于化合物 21(图 4)。仅在最低浓度下,化合物 2、7、8、10、16、18、24 和 28 显示出较低的治疗潜力。然而,2、10 和 28 仍然导致 <50% 的分枝杆菌活力。
在全球范围内,其余 14 种化合物在所有测试浓度下均具有活性。
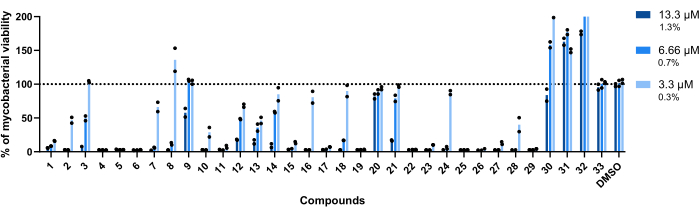
图 4:苗头化合物验证分析结果。 将 2.5 x 105 CFU/mL 的 mAb 与先前鉴定的 13.3 μM、6.66 μM 和 3.3 μM(分别为 DMSO 的 1.3%、0.7% 和 0.3%)的命中在 37 °C 下孵育 48 小时。 孵育期后,测量发光以评估分枝杆菌活力。该图显示了一项独立实验中处理的活分枝杆菌相对于未处理分枝杆菌的百分比,每种化合物一式两份测试。圆形符号表示每个复合的重复项。条形表示这些重复项的平均值。 请单击此处查看此图的较大版本。
感染检测
在 33 种测试化合物中,选择了 28 种用于感染测定(图 4)。化合物 7 、 8 、 9 、 20 和 33 未被选择用于该测定。虽然 9 、 20 和 33 在验证时由于不活跃而被遗漏(图 4),但前两个由于技术原因而被遗漏。尽管如此,这些化合物被鉴定为利福平和利奈唑胺,这些抗生素已经用于治疗 Mab 感染12。鉴定了感染测定中测试的所有化合物,并列于 表 1 中。通过使用细菌的内在荧光作为读数来评估化合物对 Mab 感染的巨噬细胞的抗菌活性。
| 复合 | 名字 | 复合 | 名字 |
| 1 | 磺胺噻唑 | 18 | 头孢呋辛 |
| 2 | 环丙沙星 | 19 | 利福昔明 |
| 3 | 头孢噻肟 | 21 | 头孢迪尼 |
| 4 | 柔红霉素 | 22 | 克拉霉素 |
| 5 | 阿 霉 素 | 23 | 贝西沙星 |
| 6 | 硫链球菌 | 24 | 左氧氟沙星 |
| 10 | 阿米卡星 | 25 | 利福布汀 |
| 11 | 莫沙内酰胺 | 26 | 加替沙星 |
| 12 | 磺胺噻唑 | 27 | 表柔比星 |
| 13 | 磺胺单甲氧嘧啶 | 28 | 双羟萘酸吡啶 |
| 14 | 头孢西丁 | 29 | 莫西沙星 |
| 15 | 新生霉素 | 30 | Troleandomycin (曲伦霉素) |
| 16 | 头孢美唑 | 31 | 林可霉素 |
| 17 | 罗红霉素 | 32 | 螺霉素 |
表 1:感染测定中测试的化合物列表。 在第 4 步中验证的化合物在感染测定(第 5 步)中进行了测试。
化合物对 Mab 感染的巨噬细胞的毒性是评估的第一个参数。将化合物视为有毒或无毒的阈值是 85% 的活巨噬细胞(图 5)。在测试的 28 种化合物中,有 4、5、6、27 和 28 被认为有毒。(图 5)。因此,这 5 种化合物被排除在以下巨噬体内活性评估之外。
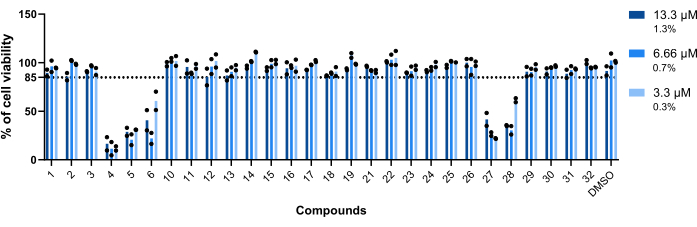
图 5:Hit 对 Mab 感染的巨噬细胞的毒性。 用 Mab (MOI=1) 感染 BALB/c 小鼠 BMM,并在 13.3 μM、6.66 μM 和 3.3 μM(分别为 DMSO 的 1.3%、0.7% 和 0.3%)下与 37 °C 和 7% CO2 孵育 48 小时。在高内涵筛选荧光显微镜中对细胞进行成像,使用细胞核数量(用 DAPI 染色)来测量细胞活力。该图显示了两个独立实验中活的经处理的感染巨噬细胞相对于活的未处理的受感染巨噬细胞的百分比。圆形符号代表细胞在每次检测中的活力。条形表示两个独立实验的平均值。 请单击此处查看此图的较大版本。
为了推断其余 23 种化合物对细胞内 mAb 的巨噬内活性(图 6),使用 Mycoload 公式(之前在步骤 6 中解释)获得归一化为未经处理的感染巨噬细胞的分枝杆菌活力百分比。与苗头化合物验证测定法(图 4)相比,大多数化合物对内化分枝杆菌(图 6)失去了治疗潜力,因为在最高测试浓度下,命中次数从 25 次减少到 6 次。引人注目的是,与未处理的细菌相比,所有三种提高浮游单克隆抗体活力的化合物(30、31 和 32;图 3 和图 4)显示出对细胞内 mAb 的抗分枝杆菌活性,与 DMSO 相比,化合物 30 和 32 呈现显着的统计学差异,即使在化合物 32 的情况下为 3.3 μM(图 6)。用化合物 11 和 23 处理的分枝杆菌在 13.3 μM 时显示活力 <50%;然而,这与 DMSO 对照没有显著差异(图 6)。化合物 21、26 和 29 在 13.3 μM 时足够有效,可以保证显着的统计差异,其中 29 是最活跃的(图 6)。最后,化合物 17、22 和 25 在所有测试浓度下对内化分枝杆菌都非常有效。这些分别被鉴定为罗红霉素、克拉霉素和利福布汀 (表 1)。在这三种化合物中,克拉霉素对 mAb 的活性最高,分枝杆菌活力从未超过 10%,与 DMSO 相比,在所有测试浓度下的 p 值为 <0.0001(图 6)。
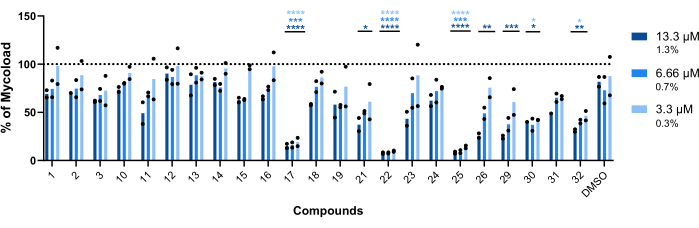
图 6:Hit 对 Mab 感染的巨噬细胞的巨噬细胞内活性。 用 Mab (MOI=1) 感染 BALB/c 小鼠 BMM,并在 13.3、6.66 和 3.3 μM(分别为 DMSO 的 1.3、0.7 和 0.3%)下与 13.3 、 6.66 和 3.3 μM (分别为 DMSO) 的每个先前鉴定的命中孵育 48 小时,浓度为 7% CO2。在高内涵筛选荧光显微镜中对细胞进行成像,并使用荧光信号计算 Mycoload(参见步骤 6)。该图显示了在两个独立实验中,相对于未处理的感染巨噬细胞,在处理过的感染巨噬细胞中发现的 Mycoload 百分比。使用双向方差分析和 Dunnet 多重比较检验进行统计;*,p < 0.05;**, p < 0.01;,p < 0.001;,与 DMSO(溶剂对照)相比,p < 0.0001。星号对于每个浓度遵循与图表图例相同的颜色代码。圆形符号代表每次分析的 Mycoload。条形表示两个独立实验的平均值。 请单击此处查看此图的较大版本。
补充图 1:Z' 因子评估中使用的 384 孔板布局示例。 白色 - 空白孔(仅限液体生长培养基);黄色 - 阳性对照(用抗生素处理的细菌);红色 - 阴性对照(未处理的细菌)。 请点击此处下载此文件。
补充图 2:文库筛选中使用的 384 孔板布局示例。 白色 - 空白孔(仅限液体生长培养基);绿色 - 溶剂控制;红色 - 阴性对照(未处理的细菌);蓝色 - 要筛选的化合物。 请点击此处下载此文件。
补充图 3:用于苗头化合物验证的 384 孔板布局示例。 白色 - 空白孔(仅限液体生长培养基);绿色 - 溶剂对照(一式两份);红色 - 阴性对照(未处理的细菌);blue - 要筛选的化合物(一式两份)。褪色的颜色表示 1:2 连续稀释。 请点击此处下载此文件。
补充图 4:用于感染测定的 96 孔板布局示例。 白色 - 空白井(防止蒸发的水);红色 - 阴性对照(未处理的巨噬细胞);黄色 - 阳性对照(用抗生素处理的巨噬细胞);绿色 - 溶剂控制;蓝色 - 待测化合物。褪色的颜色表示 1:2 连续稀释。 请点击此处下载此文件。
补充图 5:图像分析协议。 这项工作中使用了详细的图像分析协议,该协议可以适应开源软件。 请点击此处下载此文件。
讨论
该方案描述了使用 内部开发的菌株10 针对 Mab 的药物筛选管道。使用液体处理机器人、自动显微镜和分析以及双报告菌株,使用发光或荧光快速评估细菌活力,而无需添加试剂或执行额外步骤。这种方法减少了检测之间的时间和可变性,这在考虑 HTS 检测的目的时是一个显着的优势。
在筛选数千种化合物时,必须易于识别有效的药物。为此,Z' 因子通常用于测量统计效应大小,从而推断测定的性能。如果 Z' 因子> 0.5,则测试条件是区分治疗人群和未治疗人群的最佳条件13。测试条件得出 Z 因子> 0.6(图 2),从统计学上证明它们可以应用于筛选活动。此步骤对于确保筛查的有效性至关重要。
因此,开发了一种 HTS 方案来检测数千种化合物对浮游生物生长的 Mab 的抗菌活性。由于 Mab 是一种细胞内兼性病原体,因此设计的方案还可以筛选针对相同细菌菌株的细胞内抗菌活性 - 这是一个关键优势。此外,还可以评估对宿主细胞的毒性。因此,描述了一种针对 Mab 的药物筛选的多步骤方法,使用不同的实验设置来评估抗菌活性和细胞毒性,从而增加成功的机会。作为概念验证,筛选了一个包含 1280 种化合物的化学库。
共鉴定出 33 个命中(图 3)。其中,3 种显著增加了液体培养物中的分枝杆菌活力(化合物 30、31 和 32;图 3 和图 4)。应该注意的是,这些化合物可能会干扰发光发射,而不会影响细菌活力。当对内化分枝杆菌进行测试时,这些化合物显示出抗菌活性(图 6),在宿主细胞内化后对 mAb 表现出更高的疗效。这些化合物被鉴定为氨甲酰菌素 (30)、螺旋霉素 (32) 和林可霉素 (31;表 1)。前两种是大环内酯类,一类用于治疗分枝杆菌感染的抗生素16,后者是林可酰胺,一种作用机制类似于大环内酯类的抗生素17。据报道,Mab 在液体和固体培养物中对另一种林可酰胺克林霉素特别耐药18。尽管如此,免疫调节和抗炎特性与大环内酯类19,20 和林可酰胺21 有关,这可以解释对内化分枝杆菌的抗菌活性增加(图 6)。
在剩余的 30 次命中中,11 次将所有浓度的分枝杆菌活力降低了 >90%(图 4)。鉴于典型的 HTS 检测的预期命中率为 ~1%22,开发的方案与通常观察到的一致。尽管如此,其他几种化合物仍然具有活性,其中 28 种化合物进行了感染测定。
在鉴定的化合物中,有 5 种化合物被认为有毒(图 5)——柔红霉素 (4)、阿霉素 (5)、表柔比星 (27)、硫链球 (6) 和双羟萘酸吡咯铵 (28;表 1)。前三种是抗肿瘤剂 23,24,25,因此不出所料,它们对本测定中使用的哺乳动物细胞具有毒性。双羟萘酸吡啶多年来一直被用作有效的驱虫药;然而,自 2004 年以来,它也与抗肿瘤活性有关26。最后,硫链球菌是一种常用于兽医学的寡肽,从未被批准用于人类27。据报道,这种药物对乳腺癌细胞的活性28.由于硫链球对骨髓来源的巨噬细胞具有毒性,因此未评估其巨噬细胞内活性(图5)。然而,已经表明,硫链球菌在 5 μM 时对 Mab 感染的 THP-1 细胞有效29。针对浮游细菌29 的报告结果与本次筛选中获得的结果相似,其中硫链球菌非常有效(图 4)。
大多数筛选出巨噬体内活性的化合物显示没有治疗潜力(图 6)。细菌细胞内生长与浮游培养物有很大不同。在后者中,细菌和药物之间的直接接触总是可能的。在前者中,由于宿主细胞的内化,几个宿主膜充当药物需要转座才能到达靶标的物理屏障,这有助于解释大多数 HIT 的抗菌活性降低。在最高浓度 13.3 μM 下,三种化合物显示出与 DMSO 对照(图 6)相同的足够效力 - 头孢地尼 (21)、加替沙星 (26) 和莫西沙星 (29;表 1)。虽然莫西沙星已用作二线抗结核药物16,但头孢地尼通常用于治疗多种呼吸道细菌感染,例如肺炎30。然而,据报道,它对结核分枝杆菌 31 和 Mab 的活性,显示出与碳青霉烯类对后者32 的有效协同作用。加替沙星是一种氟喹诺酮类药物,在过去33,34 中已报道其对几种分枝杆菌的活性。该测定中三种最活跃的化合物(图 6)是罗红霉素 (17)、克拉霉素 (22) 和利福布汀 (25;表 1),它们在所有浓度下都非常有效。前两种是大环内酯类,而利福布汀是一种利福霉素,这两类都是治疗许多分枝杆菌感染的基础16。
这种筛选依赖于特定且昂贵的液体处理设备,以减少分析之间的差异。尽管具有极高的可重复性,但液体处理器没有化合物的非接触式转移,例如声波转移。因此,某些贴壁化合物可以在两次转移之间保持与金属针的结合,并转移到后续孔中,从而导致筛选阶段出现假阳性——这就是化合物 33 发生的情况。这就是为什么验证筛查对其成功如此重要的原因,确保没有假阳性继续进行药物筛查流程的下一步。感染测定使用具有共聚焦模式的高内涵成像系统来获得细菌区域的最佳清晰度。尽管如此,仍然可以在没有共聚焦模式的情况下使用它,尽管会丢失清晰度并可能妨碍细菌区域的识别。该协议利用了与成像系统集成的简单且用户友好的分析软件;但是,可以按照协议使用开源软件(补充图 5)。归根结底,尽管没有重新利用药物来治疗 Mab 感染,但这些结果非常重要,因为它们验证了既定方案,该方案可以扩展到更大的文库。重要的是,我们相信该协议可以适用于任何细菌,前提是荧光或发光读数可用。因此,这项工作为药物发现领域做出了重大贡献,为帮助解决最大的公共卫生问题之一——抗生素耐药细菌——尤其是几乎顽固的病原体——脓肿分枝杆菌提供了必要的工具。
披露声明
作者声明没有利益冲突。
致谢
这项工作由葡萄牙国家基金通过 FCT - Fundação para a Ciência e a Tecnologia, I.P,在 PTDC/BIA-MIC/3458/2020 项目 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) 和 GSO 博士奖学金和 UI/BD/150830/2021 博士奖学金 2021.07335.BD 和 CMB 的 UI/BD/150830/2021 中;FWO - 佛兰德斯研究基金会,资助号 1S68720N;创新医学倡议 2 Call 16 (IMI2-Call 16) 提案 RespiriTB 在协议编号 853903下。作者感谢 i3S 科学平台生物科学筛选的支持,该平台是国家基础设施 PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) 和 PPBI - 葡萄牙生物成像平台 (PPBI-POCI-01-0145-FEDER-022122) 的成员。
材料
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
参考文献
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997(2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179(2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221(2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239(2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I. The future of drug repositioning. Annual reports in medicinal chemistry. Macor, J. E. , Academic Press. 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562(2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204(2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224(2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866(2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90(2022).
- Bray, M. A., Carpenter, A. Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD). (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , 10th ed, Wayne, PA. (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18(2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421(2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202(2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302(2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527(2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165(2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249(2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661(2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511(2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293(2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。