Method Article
Mycobacteria에 대한 고처리량 약물 스크리닝을 위한 분석 개발
요약
이 연구는 박테리아 생존력을 신속하게 평가하기 위해 형광 및 발광을 사용하여 최근에 생성된 이중 리포터 균주를 사용하여 Mycobacterium abscessus 에 대한 고처리량 스크리닝을 위한 분석을 개발했습니다. 이 프로토콜은 이 약물 내성 박테리아에 대한 신약을 스크리닝하려는 연구자들과 관련이 있습니다.
초록
Mycobacterium abscessus (Mab) 감염은 다제내성 결핵에 필적하는 높은 내재적 약물 내성으로 인해 치료가 어렵습니다. 치료법은 매우 비효율적이며 다중 약물 요법을 기반으로 하므로 환자의 순응도가 낮습니다. 따라서 과학계는 이러한 감염을 치료할 수 있는 새롭고 효과적인 약물을 식별해야 합니다. 이를 위해 채택된 전략 중 하나는 약물 용도 변경(drug repurposing)으로, 이는 시장에 있는 기존 약물에 대한 새로운 치료 기회를 식별하여 신약의 약동학 및 안전성 프로필을 수립하는 데 필요한 시간을 우회하는 프로세스입니다. Mab에 대한 약물 개발에 대한 대부분의 연구가 전통적이고 시간이 많이 걸리는 방법에 의존함에 따라, 자체 개발한 Mab의 이중 리포터 균주를 사용하여 마이코박테리아에 대한 고처리량 약물 스크리닝을 위한 분석법이 개발되었습니다. 액체 처리 로봇, 자동 현미경 및 분석을 자체 개발한 이중 리포터 균주와 함께 사용하여 시약을 추가하거나 추가 단계를 수행하지 않고도 발광 및 형광의 두 가지 판독값을 사용하여 박테리아 생존율을 빠르게 측정할 수 있습니다. 이는 분석 간의 시간과 변동성을 줄여주며, 이는 고처리량 스크리닝의 주요 이점입니다. 설명된 프로토콜은 1280개의 화합물로 구성된 라이브러리를 스크리닝하여 검증되었습니다. 얻어진 결과는 활성 화합물의 효율적인 검출과 함께 문헌에 의해 확증되었습니다. 따라서 이 연구는 약물에 대한 내성이 매우 강한 이 박테리아와 싸우는 데 도움이 되는 새로운 도구를 현장에 공급하려는 목표를 달성했습니다.
서문
Mycobacterium abscessus(Mab)는 특히 낭포성 섬유증 및 기타 폐 질환이 있는 사람들에게 폐 감염을 일으키는 기회 감염 병원체입니다. Mab에 의한 감염은 다제내성 결핵에 필적하는 정교한 내재적 약물 내성으로 인해 치료가 어려운 것으로 악명이 높다1. 사용 가능한 약물은 불침투성이 높은 마이코박테리아 세포 외피와 항생제를 비활성화하는 여러 효소를 암호화하는 게놈으로 인해 대체로 효과가 없습니다2. 따라서 치료에는 몇 달에서 몇 년이 걸리는 여러 약물의 조합이 포함됩니다. 이처럼 까다로운 다중 약물 요법과 낮은 환자 순응도가 결합되어 평균 완치율이 30%에서 50%에 이릅니다3. 또한, 비결핵성 마이코박테리아에 의한 폐 감염의 유병률은 Mab 1,4에 의한 감염을 포함하여 지난 수십 년 동안 증가했습니다. 그 결과, 과학계는 Mab 감염을 치료하기 위한 새로운 화합물을 개발하기 위해 경쟁하고 있습니다.
이 목표를 위해 추구하는 전략 중 하나는 기존 약물에 대한 새로운 치료 기회를 식별하는 과정인 약물 용도 변경입니다. 이는 신약의 발견 및 개발 파이프라인에 수반되는 가장 큰 과제인 시간5를 우회합니다. 이 간단한 개념은 여러 약물의 이미 확립된 약동학 및 안전성 프로파일을 활용하여 개발 비용을 줄이고 약물을 벤치에서 병상까지 가져오는 데 걸리는 시간을 단축합니다6. 따라서 수백에서 수천 개의 이러한 화합물을 결합한 라이브러리가 컴파일되어 연구자들은 관심 병원체에 대한 약물 용도 변경 가능성을 신속하게 테스트할 수 있습니다.
Mab에 대한 약물 개발에 대한 대부분의 연구는 마이코박테리아(colony-forming units,7)에 대한 화합물의 시험관 내 활성을 평가하는 황금 표준이지만 전통적인 분석을 기반으로 합니다. 정확성에도 불구하고 이 절차는 시간이 매우 많이 소요되며, 수천 개의 화합물이 포함된 라이브러리를 테스트하려는 경우 빠르게 실현 불가능하게 됩니다. 이를 위해 고처리량 스크리닝(HTS)이 약물 개발에 통합되었으며, 로봇 공학 및 액체 처리 장치를 활용하는 강력한 분석법으로 수천 개의 화합물을 병렬로 신속하게 스크리닝할 수 있습니다8. 이는 일반적으로 96웰, 384웰, 1536웰 또는 3456웰 형식의 마이크로타이터 플레이트를 사용하여 초기에 단일 농도를 테스트하여 수행되며, 이는 히트를 식별하고 임상적으로 사용할 수 있도록 파이프라인을 따라 추가로 최적화하기 위한 시작점 역할을 합니다.
리포터 기반 분석은 다른 염료 및 흡광도 기반 분석에 비해 단순성과 감도로 인해 HTS의 견고성에 상당한 이점을 제공합니다 7,9. 그러나 우리가 아는 한, Mab9에 대한 고처리량 스크리닝을 최적화한 연구는 소수에 불과하다.
최근 우리 연구실에서는 발광과 형광10을 동시에 방출할 수 있는 이중 리포터 균주를 개발하였다. Mab operon_mScarlet는 그러한 균주 중 하나입니다. 박테리아 루시페라아제(luxAB 유전자 발현에 의해)와 장쇄 알데히드 기질(luxCDE 유전자 발현에 의해)을 포함하는 LuxABCDE 오페론의 발현으로 인해 자동 발광합니다. 반면에, 형광 판독은 최근에 개발된 적색 형광 단백질인 mScarlet의 발현을 통해 얻어지는데, 이 단백질은 일반적으로 사용되는 eGFP 및 mCherry 단백질을 능가하여 더 강력한 신호(11)를 제공한다. 이 균주를 사용하면 시약을 추가하거나 추가 단계를 수행하지 않고도 마이크로플레이트 리더에서 발광 신호를 측정하여 액체 배양에서 박테리아 생존력을 평가할 수 있습니다. 검출 측면에서, intrinsic fluorescence는 염료나 항체를 사용하지 않고 살아있는 세포 또는 고정된 세포에서 현미경을 시각화할 수 있습니다. 두 판독값을 모두 가진 단일 균주를 사용하면 HTS 분석에서 이를 사용할 때 상당한 이점이 있습니다 - 분석의 특성에 따라 균주를 교환할 필요가 없기 때문에 판독값이 다른 분석 간의 변동성이 줄어듭니다.
따라서 이 작업은 자체 엔지니어링된 이중 리포터 균주를 사용하여 Mab에 대한 고처리량 분석을 개발했습니다(그림 1). 이를 통해 상업용 라이브러리를 사용하여 용도 변경을 목적으로 하는 in vitro activity 1280 약물을 빠르게 평가할 수 있었습니다( 재료 표 참조). 첫째, 발광을 사용한 배양 분석에서 활성을 평가하고, 둘째, 형광 신호를 이용하는 Mab 감염 대식세포를 사용하여 생체 내12에서 볼 수 있는 감염 과정을 더 잘 모방함으로써 활성을 평가했습니다.
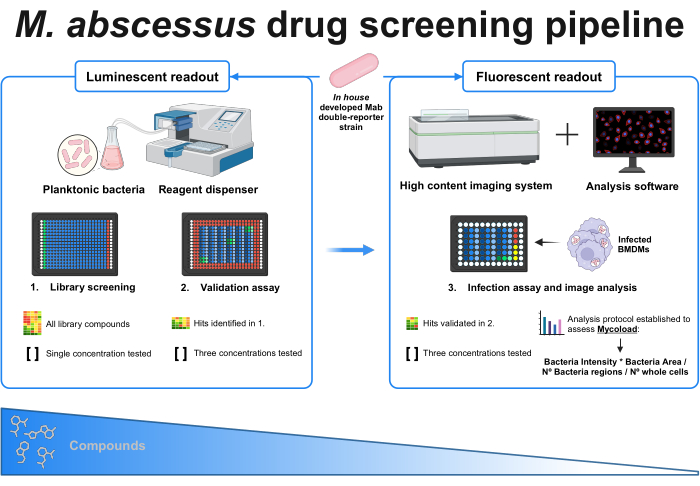
그림 1: 확립된 프로토콜의 그래픽 요약. 이 스크리닝의 핵심은 자체 개발한 이중 리포터 마이코박테리아 균주로, 모든 실험에서 사용됩니다. 먼저 시약 디스펜서와 플랑크톤 박테리아를 사용하여 단일 농도에서 화합물을 테스트하여 초기 스크리닝을 수행합니다. 식별된 히트는 세 가지 다른 농도를 테스트하는 검증 분석으로 이어집니다. 두 실험 모두 발광 판독값을 사용하여 수행됩니다. 검증된 히트는 감염 분석으로 이어지며, 여기서 세 가지 다른 농도도 테스트되고 골수 유래 대식세포는 MOI 1에서 감염됩니다. High-Content 이미징 시스템은 박테리아 형광 신호를 획득하고, 분석 소프트웨어는 Mycoload 포뮬러를 통해 세포 내 부하를 평가하는 데 사용됩니다. 분석의 복잡성이 증가함에 따라 화합물의 수가 줄어듭니다. BioRender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
모든 동물 시술은 실험에 대한 동물 복지에 대한 유럽 이사회 지침(2010/63/EU) 및 포르투갈 법률(DL 113/2013)에 따라 i3S의 지역 동물 윤리 위원회(Local Animal Ethics Committee)의 승인을 받았으며 포르투갈 당국 식품 및 수의학 총국(DGAV)의 허가를 받았습니다.
1. Z' 요인 평가
참고: HTS 분석의 성능을 평가하기 위해 몇 가지 매개변수를 결정할 수 있습니다. 가장 많이 사용되는 매개변수는 Z 소인수(Z' factor)입니다. 이 메트릭은 주어진 실험의 통계적 효과 크기를 측정하여 양성 대조군과 음성 대조군이 얼마나 잘 분리되어 있는지 나타냅니다. Z' 인자의 범위가 0.5와 1 사이인 경우 두 집단 간의 분리가 우수하며 이러한 조건을 HTS 분석에 사용할 수 있습니다. Z'가 0.5< 경우 분리는 미미한 정도에 불과하며, 스크리닝13을 수행하지 않는 것이 권장된다. 따라서 Z' factor를 계산하기 위해 처리되지 않은 박테리아가 있는 플레이트의 절반과 양성 대조군이 있는 다른 절반을 사용하는 실험이 설계되었습니다(보충 그림 1).
- 분석 2-3일 전에 삼각 플라스크의 액체 성장 배지(약 1 x 107 CFU/mL)에 박테리아를 접종하여 Mab의 사전 배양을 준비합니다. 박테리아를 37°C에서 교반(90rpm)과 함께 인큐베이터에서 자라도록 둡니다.
주의: Mab 배양물로 작업할 때는 생물안전 작업대가 필요합니다. - 분광광도계를 사용하여 600nm에서 광학 밀도를 측정하여 Mab 전배양의 성장을 추적합니다. 문화가 기하급수적 성장 단계에 도달하면 1.3단계를 수행합니다.
- Exponential pre-culture를 사용하여 액체 성장 배지에서 약 5 x 105 CFUs/mL(광학 밀도 값과 상관 관계)14 의 박테리아 현탁액을 준비합니다.
- 액체 성장 매체에서 박테리아 성장 억제의 긍정적 인 제어 용액을 준비하십시오. 이 분석에서 양성 대조군은 4μg/mL의 클래리스로마이신(DMSO에서 10mg/mL)이었습니다. 클라리스로마이신은 원하는 최종 농도의 2배를 준비해야 합니다.
- 소형 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 15μL의 액체 성장 배지를 검은색 폴리프로필렌 384웰 플레이트의 빈 컬럼 및 비처리 컬럼에 분주합니다. 빈 컬럼의 경우 추가로 15μL의 액체 성장 배지를 분주합니다.
참고: 빈 컬럼은 37°C에서 내부 웰의 증발을 방지합니다. - 작은 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 1.4단계에서 준비한 양성 대조군 용액 15μL를 양성 대조군 컬럼에 분주합니다.
- 대형 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 1.3단계에서 준비한 박테리아 현탁액 15μL를 블랭크를 제외한 모든 컬럼에 분주하고 모든 것을 1:2로 희석합니다. 모든 384웰의 최종 부피는 30μL입니다.
참고: 마이크로플레이트 시약 디스펜서에는 튜브 크기(각각 0.5mm 및 0.22mm)가 다른 크거나 작은 카세트를 장착할 수 있습니다. 더 많은 액체 낭비가 발생하더라도 튜빙 시스템에서 박테리아 응집을 방지하기 위해 더 큰 카세트를 사용하는 것이 좋습니다. 그럼에도 불구하고 전체 분석에서 동일한 카세트를 사용할 수 있습니다. - 지속적인 가스 교환을 허용하는 플레이트 실러로 각 플레이트를 밀봉합니다. 37°C에서 습한 챔버 내부에서 48시간 동안 교반 없이 인큐베이터에서 배양합니다.
- 48시간 후 적분 시간이 1초인 플레이트 리더를 사용하여 각 플레이트의 박테리아가 방출하는 발광을 읽습니다.
- Z' 계수를 결정하려면 1.9단계에서 얻은 값을 사용하여 양수(AVGP 및 SDP) 및 음수(AVGN 및 SDN) 컨트롤의 평균 및 표준 편차를 계산합니다. 그런 다음 다음 공식을 적용하십시오.
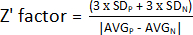
참고: 3 x SD는 일반적으로 사용되는 임계값입니다. 그러나 표준 편차를 곱하는 계수를 늘리거나 줄여 선별에 더 잘 맞도록 조정할 수 있습니다.
2. 히트작에 대한 라이브러리 심사
참고: 첫 번째 스크리닝은 액체 배양에서 자라는 박테리아에 대해 수행되었습니다. 이 설정은 최종 부피가 30μL인 384웰 플레이트를 위해 설계되었습니다. 각 플레이트에는 빈 웰(액체 성장 매체만 해당), 음성 대조군(처리되지 않은 박테리아) 및 용매 대조군(박테리아와 화합물의 용매 - 이 경우 DMSO; 보충 그림 2). 화합물 또는 용매를 원하는 최종 농도의 2배로 플레이트에 첨가하고 박테리아를 1:1(모든 것을 반으로 희석)로 첨가했습니다.
- 1.1 - 1.3 단계에 설명된 대로 박테리아 현탁액을 준비합니다.
주의: Mab 배양물로 작업할 때는 생물안전 작업대가 필요합니다. - 액체 성장 매체에 용매 용액을 준비합니다. 용매의 양은 원하는 최종 농도의 2배여야 합니다.
- 소형 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 용매 제어 컬럼을 제외한 검은색 폴리프로필렌 384웰 플레이트의 모든 컬럼에 15μL의 액체 성장 배지를 분주합니다. 빈 컬럼의 경우 추가로 15μL의 액체 성장 배지를 분주합니다.
- 작은 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 이전에 준비한 용매 용액 15μL를 용매 제어 컬럼에 분주합니다.
- 액체 핸들러를 사용하여 스톡 96웰 플레이트(DMSO의 경우 1mM)에서 블랭크, 용매 제어 및 처리되지 않은 컬럼을 제외한 200nL의 화합물을 384웰 플레이트로 옮깁니다. 화합물의 농도는 현재 13.3μM입니다.
- 대형 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 2.1단계에서 준비한 박테리아 현탁액 15μL를 블랭크를 제외한 모든 컬럼에 분주하여 모든 것을 1:2로 희석합니다. 모든 384웰의 최종 부피는 30μL이고 각 화합물은 6.66μM입니다.
- 지속적인 가스 교환을 허용하는 플레이트 실러로 각 플레이트를 밀봉합니다.
참고: 분석은 일반 뚜껑으로 수행할 수 있습니다. 그러나 더 강한 가장자리 효과가 발생할 가능성이 더 높습니다. - 37°C에서 습한 챔버 내부에서 48시간 동안 교반 없이 인큐베이터에서 배양합니다.
- 48시간 후 적분 시간이 1초인 플레이트 리더를 사용하여 각 플레이트의 박테리아가 방출하는 발광을 읽습니다.
3. 히트스크리닝 데이터 분석
참고: 획득한 발광 데이터로 히트를 식별하려면 화합물이 용해된 용매로 값을 정규화해야 하며, 문제가 발생하는 경우 384-마이크로타이터 플레이트에서 검증된 가장자리 효과로 정규화해야 합니다.
- 2.9단계에서 얻은 데이터의 용매 정규화를 위해 각 웰의 RLU(상대 광 단위)를 용매 제어 웰(해당 플레이트에 있음)의 평균 RLU로 나눕니다. 이 분석에서, 스크리닝 플레이트의 중앙을 향해 강한 가장자리 효과가 확인되었습니다. 따라서 모든 데이터를 정규화하기로 결정했습니다. 이를 달성하기 위해 프로세스는 아래에 설명된 대로 2단계 방식으로 수행되었습니다.
- 모든 플레이트(플레이트 1 - P1, 플레이트 2 - P2, 플레이트 3 - P3, 플레이트 4 - P4)에서 히트를 제외한 해당 위치에 대해 3.1단계에서 얻은 값을 나누어 가장자리 효과 마스크를 만듭니다. 예를 들어, A1 및 A2 위치의 경우 Mask_A1 = 평균 (P1_A1; P2_A1; P3_A1; P4_A1); Mask_A2 = 평균(P1_A2; P2_A2; P4_A2) [P3_A2는 히트작이었기 때문에 제외되었습니다].
- 3.1단계에서 얻은 값을 나눕니다. 3.1.1 단계에서 얻은 가장자리 효과 마스크에 의해. 예를 들어,
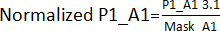 . 그런 다음 각 플레이트의 AVG 및 SD를 계산하여 각 플레이트에 대한 임계값(AVG ± 3SD)을 설정합니다. 이 임계값을 벗어난 모든 화합물은 hit로 간주되며 hit 검증 분석으로 진행됩니다.
. 그런 다음 각 플레이트의 AVG 및 SD를 계산하여 각 플레이트에 대한 임계값(AVG ± 3SD)을 설정합니다. 이 임계값을 벗어난 모든 화합물은 hit로 간주되며 hit 검증 분석으로 진행됩니다.
4. 히트 검증 분석
참고: 히트를 식별한 후에는 다양한 농도를 사용하여 유효성을 검사해야 합니다. 검증 분석은 동일한 대조군과 유사한 설정을 사용하지만 각 히트는 1:2 연속 희석을 거칩니다. 이 분석을 위해 13.3 μM, 6.66 μM 및 3.3 μM의 세 가지 농도가 사용되었습니다. 용매 대조군은 각 화합물 웰과 동일한 용매 %를 포함합니다(보충 그림 3).
- 1.1 - 1.3 단계에 설명된 대로 박테리아 현탁액을 준비합니다.
주의: Mab 배양물로 작업할 때는 생물안전 작업대가 필요합니다. - 작은 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 검은색 폴리프로필렌 384웰 플레이트의 모든 컬럼에 15μL의 액체 성장 배지를 분주합니다. 블랭크 웰의 경우 첫 번째 및 마지막 컬럼에 15μL의 액체 성장 배지를 추가로 분주합니다.
- 마이크로플레이트 시약 디스펜서를 사용하여 각 화합물의 가장 높은 [μM]를 포함하는 컬럼에 추가로 15μL의 액체 성장 배지를 분주합니다.
- 스톡 96웰 플레이트에서 각 히트 0.8μL(DMSO의 경우 1mM)를 4.3단계에서 중복하여 해당 웰에 수동으로 피펫팅합니다. 화합물의 농도는 현재 26.6μM입니다.
- 0.8 μL의 용매를 수동으로 피펫팅하여 대조군에 중복으로 넣습니다(4.4단계와 동일).
- 다중 채널 마이크로피펫을 사용하여 각 화합물 및 용매 제어에 대해 두 번의 1:2 연속 희석을 수행합니다. 마지막 연속 희석 후 초과하는 15μL는 폐기합니다. 이제 모든 웰에는 15μL가 있으며 화합물의 농도는 26.6μM, 13.3μM 및 6.66μM입니다.
- 대형 카세트가 있는 마이크로플레이트 시약 디스펜서를 사용하여 4.1에서 준비된 박테리아 현탁액 15μL를 모든 컬럼(블랭크 웰 제외)에 분주하여 화합물을 1:2로 희석합니다. 모든 웰의 최종 부피는 30μL이며 각 화합물은 13.3μM, 6.66μM 및 3.3μM입니다.
- 지속적인 가스 교환이 가능한 플레이트 실러로 플레이트를 밀봉합니다. 37°C에서 습한 챔버 내부에서 48시간 동안 교반 없이 인큐베이터에서 배양합니다.
- 48시간 후 플레이트 리더를 사용하여 1초의 통합 시간으로 각 플레이트에서 박테리아가 방출하는 발광을 판독합니다.
5. 감염 분석
참고: Mab는 세포 내 통성 병원체이므로 감염 분석에서 히트의 항균 활성과 숙주 독성을 결정해야 합니다. 이를 위해 골수 유래 대식세포(BMM)를 Mab에 감염시키고 4단계에서 검증된 히트를 다양한 농도에서 처리했습니다. 각 분석에는 블랭크(물만), 음성 대조군(처리되지 않은 감염된 대식세포), 양성 대조군(효과적인 항생제로 처리된 감염된 대식세포), 용매 대조군(이 경우 DMSO) 및 13.3μM, 6.66μM 및 3.3μM의 세 가지 농도로 테스트할 화합물이 포함되었습니다(보충 그림 4).
- 앞서 설명한 바와 같이 야생형 성체 마우스(BALB/c 또는 C57BL/6)의 쥐 골수에서 대식세포를 추출합니다15. 96웰, 검은색, 광학적으로 투명한 평평한 바닥 플레이트에 세포를 2 x 105 cells/mL, 웰당 200μL로 플레이트합니다. 37 °C, 7 % CO215에서 10 일 동안 분화 한 후 세포는 감염시키고 치료를 진행할 준비가되었습니다.
참고: 골수 유래 대식세포를 얻기 위한 프로토콜은 잘 확립되어 있습니다15; 그러나 이 스크리닝 프로토콜은 RAW 264.7, THP-1 및 PBMC 유래 대식세포와 같은 다른 세포에 적용할 수 있습니다. - 단계 1.1 내지 1.3에 기술된 바와 같이 세균 현탁액을 준비하고, 세포 배양 배지 내의 세균 현탁액을 감염에 대해 MOI(Multiplicity of Infection)가 1인 감염에 대해 조정합니다.
주의: Mab 배양물로 작업할 때는 생물안전 작업대가 필요합니다. - 유리 피펫에 부착된 진공 펌프를 사용하여 웰의 보충된 세포 배양 배지를 조심스럽게 흡입합니다. 이 단계는 세포 분리를 방지하기 위해 천천히 쉽게 수행해야 합니다.
- 5.2단계에서 준비한 박테리아 현탁액 75μL를 각 웰에 수동으로 피펫팅합니다. 세포 인큐베이터에서 7% CO2 로 37°C에서 4시간 동안 플레이트를 배양합니다.
- 세포 처리를 위해 화합물을 준비합니다. 소형 카세트가 장착된 마이크로플레이트 시약 디스펜서를 사용하여 폴리프로필렌, 둥근 바닥, 96웰 플레이트, 110μL의 보충된 세포 배양 배지에 화합물 또는 용매 제어가 있을 컬럼에 분주합니다(보충 그림 4).
- 마이크로플레이트 시약 디스펜서를 사용하여 보충된 세포 배양 배지 104μL를 화합물 또는 용매 농도가 가장 높은 컬럼에 추가로 분주합니다.
- 5.9μL의 화합물(DMSO에서 1mM)을 수동으로 피펫팅하거나 용매를 지정된 웰(5.6단계의 컬럼)에 넣습니다. 화합물의 농도는 현재 26.6μM입니다.
- 다중 채널 마이크로피펫을 사용하여 각 화합물과 용매에 대해 1:2로 두 번의 연속 희석을 수행합니다. 마지막 연속 희석 후 초과 110μL는 폐기합니다. 이제 모든 웰은 110μL를 가지며 화합물의 농도는 26.6μM, 13.3μM 및 6.66μM입니다.
- 마이크로플레이트 시약 디스펜서를 사용하여 110μL의 보충된 세포 배양 배지를 모든 컬럼(블랭크 웰 제외)에 분주합니다. 이제 모든 웰에는 220μL가 있으며 화합물의 농도는 13.3μM, 6.66μM 및 3.3μM입니다.
- 보충된 세포 배양 배지에 2μg/mL의 clarithromycin(positive control) 용액을 준비합니다.
- 5.4단계 후 4시간에 플레이트 세척기를 사용하여 감염된 96웰 플레이트를 200μL의 감염 세척 용액으로 3번 세척합니다. 세포 분리를 방지하기 위해 흡입 및 투약 속도를 가능한 가장 느리게 유지하십시오.
- 최종 흡인 후 5.5-5.9단계에서 준비한 화합물 200μL를 감염된 대식세포가 포함된 96웰 플레이트로 옮깁니다.
- 200μL의 보충된 세포 배양 배지를 처리되지 않은 웰로 옮깁니다. 5.10단계에서 준비한 클래리스로마이신 용액 200μL를 각각의 웰로 옮깁니다.
- 37 ° C의 세포 인큐베이터에서 7 % CO2 로 48 시간 동안 플레이트를 배양합니다.
- 48시간 후 화합물의 세척 용액이 있는 플레이트 와셔를 사용하여 감염된 96웰 플레이트를 세척합니다(웰당 200μL로 3회).
- 다중 채널 마이크로피펫을 사용하여 200μL의 고정 용액을 모든 웰에 분주하고 10분 동안 작용시킵니다.
- 고정 후 플레이트 세척기를 사용하여 화합물의 세척 용액(웰당 3μL로 200x)으로 세포를 세척합니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 세포는 오염 및 세포 건조가 방지되는 경우 4°C의 화합물 세척 용액에 며칠 또는 몇 주 동안 보관할 수 있습니다. 화합물의 세척 용액은 5.18단계 전에 흡인해야 합니다. - 다중 채널 마이크로피펫을 사용하여 투과성 용액 200μL를 모든 웰에 분주하고 15분 동안 작용시킵니다. 플레이트 와셔를 사용하여 투과성 용액을 흡입합니다.
- 다중 채널 마이크로피펫을 사용하여 100μL의 염색 용액을 수동으로 분주하고 플레이트를 실온에서 30분 동안 배양합니다.
- 플레이트 와셔를 사용하여 화합물의 세척 용액(웰당 3μL로 200회)으로 플레이트를 세척합니다. 결국, 염색된 세포를 화합물의 세척 용액에 그대로 두십시오.
- 다음 설정으로 high-content imaging 시스템에서 플레이트를 스크리닝합니다.
대물렌즈: 20x Air/0.4NA(96마이크로타이터 플레이트의 웰 1개, 57개의 시야(FOV))
모드: 공초점
DAPI(핵)용 레이저 405nm
mScarlet(박테리아)용 레이저 561nm
HCS 세포 마스크용 레이저 640nm Deep Red(세포질)
z-stack 없음
참고: 세포는 광시야 이미징 시스템으로 이미징할 수 있으며, 이로 인해 선명도가 낮아질 수 있습니다. - 하룻밤 사이에 이미지 획득을 위해 장비 핸들링 로봇을 설정합니다. 이 로봇 팔은 사람의 개입 없이 High-Content Imaging 시스템의 플레이트를 교환합니다.
참고: 이것은 필수가 아닙니다. 플레이트는 수동으로 교체할 수 있습니다.
6. 이미지 분석
참고: 이미지 분석은 이미지를 획득하는 데 사용되는 High-Content Imaging 시스템과 동일한 분석 소프트웨어를 사용하여 수행됩니다. 샘플 이미지를 사용하여 분석 파이프라인을 생성해야 합니다(보충 그림 5). 그 후 전체 웰(57 FOV) 및 데이터 세트(모든 플레이트)에 적용됩니다. 분석 소프트웨어는 서로 다른 관심 영역(핵, 세포질, 세포 및 박테리아)의 세분화부터 시작하여 이들(예: 세포 내 박테리아)을 관련시킨 다음 형태학적 및 강도 특성(예: 면적, 강도)을 추출하는 논리적 단계를 따릅니다. 이미지 분석의 필수 단계는 아래에 설명되어 있습니다. 사용된 전체 프로토콜은 보충 그림 5에서 확인할 수 있습니다.
- DAPI 신호를 사용하여 핵을 분할하고, DeepRed 신호를 사용하여 세포질을 분할하고, mScarlet 신호를 사용하여 박테리아를 분할합니다.
- 핵과 세포질 분절을 연관시켜 세포를 위한 마스크를 만듭니다.
- 모든 테두리 객체를 제거합니다. FOV에서 꽉 찬 것으로 나타나는 셀만 고려됩니다(전체 셀).
- output population Bacteria in whole cells를 전체 세포와 박테리아를 연관시켜 정의합니다.
- 감염된 전체 세포는 둘 이상의 박테리아 영역을 갖는 것으로 정의하고, 감염되지 않은 전체 세포는 하나 미만의 박테리아 영역을 갖는 것으로 정의합니다.
- 모든 관심 영역을 세분화하고 모집단을 만든 후 해당 속성을 계산하고 추출합니다. 각 웰에 대해 다음 속성이 추출됩니다.
- 전세포/ 감염된 전세포/ 비감염 전세포, 추출물
셀 수(웰당 합계)
면적 [μm2] (평균 + 웰당 표준 편차)
Width-to-length cell ratio(평균 + 웰당 표준 편차) - 전체 세포의 박테리아에 대해 추출물
식별된 박테리아 영역의 수(웰당 합계)
Intensity (각 영역의 평균 강도의 웰당 합계)
지역의 면적(우물당 합계)
- 전세포/ 감염된 전세포/ 비감염 전세포, 추출물
- 데이터를 내보내고 스프레드시트로 선별한 후 다음 공식에 따라 세포 내 부하(Mycoload)를 정량화합니다.
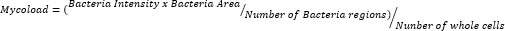
결과
Z' 요인 평가
그림 2는 Z' 인자를 계산하기 위해 수행된 두 가지 실험 중 한 가지 실험의 데이터를 보여줍니다. 양성 대조군은 4μg/mL의 클라리스로마이신이었습니다. 두 실험 모두 0.64 및 0.62의 Z' 계수를 산출했으며, 이는 이 분석에 사용된 조건 및 판독값을 후속 스크리닝 분석(Z' > 0.5)에 적용할 수 있음을 의미합니다. 그럼에도 불구하고, 각 실험의 성능을 제어하기 위해 나머지 모든 실험(감염 분석)에 대해 Z' 인자를 계산했습니다.
설계된 HTS 분석의 개념 증명으로 약물 용도 변경을 위한 화합물 라이브러리를 테스트했습니다. 1280개의 다양하고 작은 분자로 구성되어 있으며, 그 중 95%는 FDA 및 EMA 승인 약물입니다. 이 분자는 높은 화학적 및 약리학적 다양성을 제공합니다.
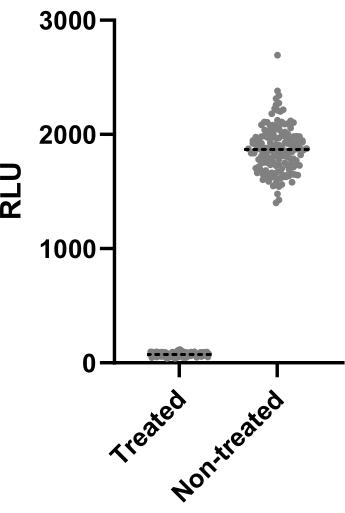
그림 2: Z' 요인 평가 결과. 2.5 x 105 CFUs/mL의 Mab를 37°C에서 48시간 동안 4μg/mL의 클래리스로마이신과 함께 또는 배제하고 배양했습니다. 배양 기간 후, 마이코박테리아 생존력을 평가하기 위해 발광을 측정했습니다. 이 그래프는 하나의 독립적인 실험에서 처리된 생존 가능한 마이코박테리아와 처리되지 않은 마이코박테리아의 개별 발광 값을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
히트작에 대한 라이브러리 심사
모든 화합물은 Mab에 대해 6.66μM에서 테스트되었습니다. 라이브러리의 크기 때문에 화합물은 4개의 서로 다른 마이크로타이터 384웰 플레이트로 나뉘었습니다(그림 3A-D). 결과는 용매와 검증된 가장자리 효과 모두에 대해 정규화되었습니다.
이 스크리닝 분석에서 33개의 히트가 확인되었으며, 그 중 30개는 발광 방출을 크게 감소시켜 마이코박테리아 생존력을 감소시켰습니다(그림 3). 흥미롭게도, 세 가지 화합물이 더 높은 발광 방출을 유도했으며, 이는 박테리아 대사 증가 또는 증식과 관련이 있을 수 있습니다(그림 3). 이 프로파일이 유지되는지 테스트하기 위해 발광을 증가시키는 3개의 화합물을 포함하여 33개의 모든 히트가 검증 분석으로 수행되었습니다.
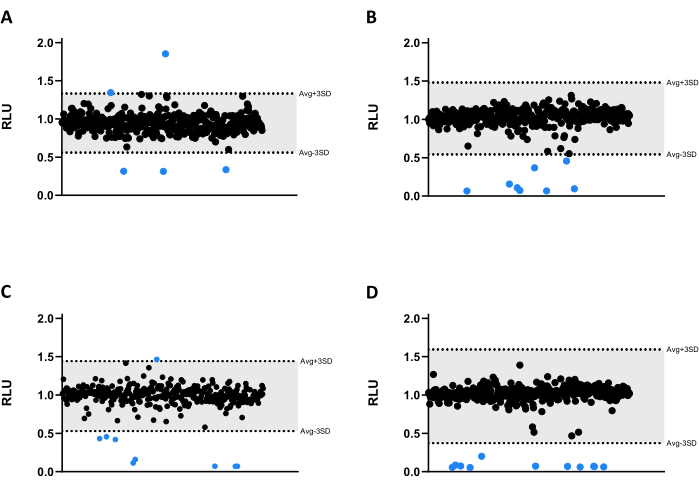
그림 3: 라이브러리 스크리닝 결과. (A-D) 2.5 x 105 CFUs/mL에서 Mab를 37°C에서 48시간 동안 6.66μM에서 1280개의 화합물과 함께 배양했습니다. 배양 후, 마이코박테리아 생존력을 평가하기 위해 발광을 측정하였다. 그래프는 하나의 독립적인 실험의 RLU를 보여주며, 용매 및 에지 효과 정규화 후 임의의 단위로 표시됩니다. 임계값을 결정하기 위해 각 플레이트에 대해 AVG RLU 및 해당 SD를 계산했습니다(회색; AVG ± 3SD)를 참조하십시오. 원형 기호는 테스트된 화합물을 나타냅니다. 파란색의 경우, 해당 임계값을 벗어난 모든 화합물은 적중으로 간주됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
히트 검증 분석
이 분석에 사용된 농도는 13.3μM, 6.66μM 및 3.3μM였습니다. 각 화합물은 견고성을 높이기 위해 중복으로 테스트되었습니다.
중요한 것은 이전에 더 높은 RLU(그림 3A,C)와 관련이 있었던 화합물 30, 31 및 32가 화합물 32로 처리된 웰에서 200% 이상의 마이코박테리아 생존력을 달성하면서 이 프로필을 유지했다는 것입니다(그림 4).
화합물 20 및 33은 테스트된 모든 농도에서 마이코박테리아 생존율이 100%에 가깝기 때문에 비활성인 것으로 간주되었습니다(그림 4).
화합물 9 및 21은 두 개의 가장 낮은 농도에서 유사한 비활성을 나타냈다; 그러나 20과 달리 가장 높은 13.3μM에서 활성 상태를 유지하며 화합물 21이 더 높은 효능을 나타냅니다(그림 4).
또한 화합물 3은 화합물 21보다 작지만 가장 낮은 농도에서 비활성과 6.66μM에서 활성 손실을 나타냅니다(그림 4). 가장 낮은 농도에서만 화합물 2, 7, 8, 10, 16, 18, 24 및 28이 더 낮은 치료 잠재력을 나타냈습니다. 그러나 2, 10, 28은 여전히 마이코박테리아 생존력의 <50%를 차지합니다.
전 세계적으로 나머지 14개 화합물은 테스트된 모든 농도에서 활성을 보였습니다.
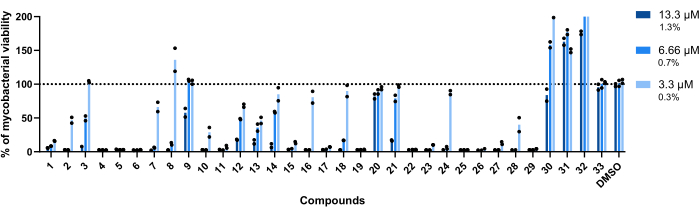
그림 4: 적중 검증 분석 결과. 2.5 x 105 CFUs/mL의 Mab를 37°C에서 48시간 동안 13.3μM, 6.66μM 및 3.3μM(각각 DMSO의 1.3%, 0.7% 및 0.3%)에서 이전에 확인된 각 히트와 함께 배양했습니다. 배양 기간 후, 마이코박테리아 생존력을 평가하기 위해 발광을 측정했습니다. 이 그래프는 하나의 독립적인 실험에서 처리되지 않은 마이코박테리아에 비해 처리된 생존 가능한 마이코박테리아의 비율을 보여주며, 각 화합물은 중복으로 테스트되었습니다. 라운드 기호는 각 화합물에 대한 중복을 나타냅니다. 막대는 이러한 중복의 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
감염 분석
테스트된 33개의 화합물 중 28개가 감염 분석을 위해 선택되었습니다(그림 4). 화합물 7, 8, 9, 20 및 33은 이 분석을 위해 선택되지 않았습니다. 9, 20 및 33은 검증 시 비활성으로 인해 제외되었지만(그림 4) 처음 두 개는 기술적인 이유로 제외되었습니다. 그럼에도 불구하고, 이러한 화합물은 리팜피신(rifampicin)과 리네졸리드(linezolid)로 확인되었는데, 이들은 이미 Mab 감염을 치료하는 데 사용된 항생제이다12. 감염 분석에서 테스트한 모든 화합물이 확인되었으며 표 1에 나열되어 있습니다. Mab-감염된 대식세포에 대한 화합물의 항균 활성은 박테리아의 고유 형광을 판독값으로 사용하여 평가하였다.
| 화합물 | 이름 | 화합물 | 이름 |
| 1 | 설파티아졸 | 18 | 세푸록시메 |
| 2 | 시프로플록사신(Ciprofloxacin) | 19 | 리팍시민 |
| 3 | 세포탁심 | 21 | 세프디니르 |
| 4 | 다우노루비신 | 22 | 클라리스로마이신 |
| 5 | 독소루비신 | 23 | 베시플록사신 |
| 6 | 티오스트렙톤 | 24 | 레보플록사신 |
| 10 | 아미카신 | 25 | 리파부틴 |
| 11 | 뜸살락탐 | 26 | 가티플록사신(Gatifloxacin) |
| 12 | 설파메티졸 | 27 | 에피루비신 |
| 13 | 설파모노메톡신 | 28 | 피르비늄 파모에이트 |
| 14 | 세폭시틴 | 29 | 목시플록사신 |
| 15 | 노보비오신 | 30 | 트로레안도마이신 |
| 16 | 세프메타졸 | 31 | 링코마이신 |
| 17 | 록시트로마이신 | 32 | 스피라마이신 |
표 1: 감염 분석에서 테스트한 화합물 목록. 4단계에서 검증된 화합물은 감염 분석(5단계)에서 테스트되었습니다.
Mab에 감염된 대식세포에 대한 화합물의 독성이 평가된 첫 번째 매개변수였습니다. 화합물을 독성 또는 무독성으로 간주하기 위해 설정된 임계값은 생존 가능한 대식세포의 85%였습니다(그림 5). 테스트된 28개의 화합물 중 4, 5, 6, 27 및 28이 독성이 있는 것으로 간주되었습니다. (그림 5). 따라서, 이들 5가지 화합물은 다음의 대식내 활성 평가에서 제외되었다.
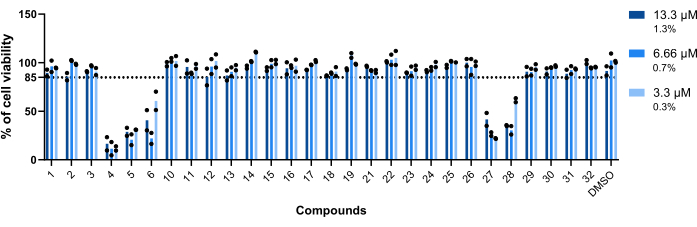
그림 5: Mab에 감염된 대식세포에 대한 히트의 독성. BALB/c 마우스 BMM을 Mab(MOI=1)에 감염시키고 이전에 확인된 각 히트를 13.3μM, 6.66μM 및 3.3μM(각각 DMSO의 1.3%, 0.7% 및 0.3%)에서 7%CO2로 37°C에서 48시간 동안 배양했습니다. 세포 생존율을 측정하기 위해 핵의 수(DAPI로 염색)를 사용하여 고함량 스크리닝 형광 현미경으로 세포를 이미지화했습니다. 이 그래프는 두 개의 독립적인 실험에서 생존 가능한 비치료 감염 대식세포에 대한 생존 가능한 치료된 감염된 대식세포의 비율을 보여줍니다. 둥근 기호는 각 분석에 대한 세포의 생존력을 나타냅니다. 막대는 두 개의 독립적인 실험의 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
세포 내 Mab에 대한 나머지 23개 화합물의 대식내 활성을 추론하기 위해(그림 6), Mycoload 공식(이전에 6단계에서 설명)을 사용하여 치료되지 않은 감염된 대식세포에 대해 정규화된 마이코박테리아 생존력의 백분율을 얻었습니다. 대부분의 화합물은 적중 검증 분석(그림 4)에 비해 내부화된 마이코박테리아에 대한 치료 잠재력을 잃었는데, 이는 테스트된 최고 농도에서 적중 횟수가 25회에서 6회로 감소했기 때문입니다. 놀랍게도, 처리되지 않은 박테리아에 비해 플랑크톤 Mab의 생존력을 증가시킨 세 가지 화합물 모두(30, 31 및 32; 그림 3 및 그림 4)는 화합물 30 및 32가 화합물 32의 경우 3.3μM에서도 DMSO와 비교할 때 상당한 통계적 차이를 나타내면서 세포 내 Mab에 대한 항마이코박테리아 활성을 나타냈습니다(그림 6). 화합물 11 및 23으로 처리된 마이코박테리아는 13.3μM에서 생존율<50%)을 나타냈습니다. 그러나 이는 DMSO 대조군과 크게 다르지 않았습니다(그림 6). 화합물 21, 26 및 29는 13.3μM에서 상당한 통계적 차이를 보증할 만큼 충분히 강력했으며 29가 가장 활성이었습니다(그림 6). 마지막으로, 화합물 17, 22 및 25는 내부화된 마이코박테리아에 대해 테스트된 모든 농도에서 매우 강력했습니다. 이들은 각각 록시트로마이신(roxithromycin), 클래리스로마이신(clarithromycin) 및 리파부틴(rifabutin)으로 확인되었다(표 1). 세 가지 화합물 중 클래리스로마이신은 Mab에 대해 가장 활성이 높았으며, 마이코박테리아 생존력이 10%를 넘지 않았으며, DMSO와 비교하여 테스트한 모든 농도에서 p-값 <0.0001을 나타냈습니다(그림 6).
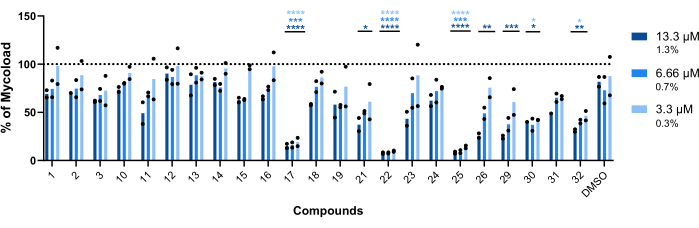
그림 6: Mab에 감염된 대식세포에 대한 Hits의 대식내 활성. BALB/c 마우스 BMM을 Mab(MOI=1)에 감염시키고 이전에 확인된 각 히트를 13.3, 6.66 및 3.3μM(각각 DMSO의 1.3, 0.7 및 0.3%)에서 7%CO2로 37°C에서 48시간 동안 배양했습니다. 세포를 high-content screening 형광 현미경으로 이미지화하고, 형광 신호를 사용하여 Mycoload를 계산하였다(단계 6 참조). 이 그래프는 두 개의 독립적인 실험에서 치료되지 않은 감염된 대식세포와 비교하여 치료된 감염된 대식세포에서 발견된 Mycoload의 백분율을 보여줍니다. 통계는 Dunnet의 다중 비교 테스트와 함께 양방향 분산 분석을 사용하여 수행되었습니다. *, p < 0.05; **, p < 0.01; , p < 0.001; , p < DMSO(용매 제어)와 비교하여 0.0001입니다. 별표는 그래프의 범례와 각 농도에 대해 동일한 색상 코드를 따릅니다. 둥근 기호는 각 분석에 대한 Mycoload를 나타냅니다. 막대는 두 개의 독립적인 실험의 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: Z' 계수 평가에 사용된 384웰 플레이트 레이아웃의 예. 흰색 - 빈 웰 (액체 성장 매체 만 해당); 노란색 - 양성 대조군 (항생제로 처리 된 박테리아); 빨간색 - 음성 대조군(처리되지 않은 박테리아). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 라이브러리 스크리닝에 사용된 384웰 플레이트 레이아웃의 예. 흰색 - 빈 웰 (액체 성장 매체 만 해당); 녹색 - 용매 제어; 빨간색 - 음성 대조군 (처리되지 않은 박테리아); 파란색 - 스크리닝할 화합물. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 히트 검증에 사용되는 384웰 플레이트 레이아웃의 예. 흰색 - 빈 웰 (액체 성장 매체 만 해당); 녹색 - 용매 제어(중복); 빨간색 - 음성 대조군 (처리되지 않은 박테리아); 파란색 - 스크리닝할 화합물(중복). 희미한 색상은 1:2 연속 희석을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: 감염 분석에 사용된 96웰 플레이트 레이아웃의 예. 흰색 - 빈 우물 (증발을 방지하기위한 물); 빨간색 - 음성 대조군(처리되지 않은 대식세포); 노란색 - 양성 대조군 (항생제로 처리 된 대식 세포); 녹색 - 용매 제어; 파란색 - 테스트할 화합물입니다. 희미한 색상은 1:2 연속 희석을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5: 이미지 분석 프로토콜. 이 작업에는 상세한 이미지 분석 프로토콜이 사용되며, 이는 오픈 소스 소프트웨어에 적용할 수 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 자체 개발한 균주10을 사용하여 Mab에 대한 약물 스크리닝 파이프라인을 설명합니다. 액체 처리 로봇, 자동 현미경 및 분석, 이중 리포터 균주를 사용하여 시약을 추가하거나 추가 단계를 수행하지 않고도 발광 또는 형광을 사용하여 박테리아 생존력을 신속하게 평가할 수 있습니다. 이 접근법은 분석 간의 시간과 변동성을 줄이며, 이는 HTS 분석의 목적을 고려할 때 상당한 이점입니다.
수천 개의 화합물을 스크리닝할 때 효과적인 약물을 쉽게 식별할 수 있어야 합니다. 이를 위해 Z' factor는 종종 통계적 효과 크기를 측정하는 데 사용되어 분석의 성능을 추론합니다. Z' 계수가 0.5> 경우, 테스트된 조건이 처리된 모집단과 치료되지 않은 모집단을 구별하는 데 최적입니다13. 테스트된 조건에서 Z' 인자는 0.6> 산출되었으며(그림 2), 스크리닝 캠페인에 적용할 수 있음을 통계적으로 입증했습니다. 이 단계는 스크리닝의 효과를 보장하는 데 매우 중요합니다.
따라서 플랑크톤으로 성장하는 Mab에 대한 수천 가지 화합물의 항균 활성을 감지하기 위해 HTS 프로토콜이 개발되었습니다. Mab는 세포 내 통성 병원체이기 때문에 설계된 프로토콜은 동일한 박테리아 균주에 대한 세포 내 항균 활성도 스크리닝하며, 이는 중요한 이점입니다. 또한 숙주 세포에 대한 독성도 평가할 수 있습니다. 따라서 Mab에 대한 약물 스크리닝에 대한 다단계 접근 방식을 설명하며, 세포 독성과 함께 항균 활성을 평가하기 위해 다양한 실험 설정을 사용하여 성공 가능성을 높입니다. 개념 증명으로 1280개의 화합물로 구성된 화학 라이브러리를 스크리닝했습니다.
총 33개의 히트가 확인되었습니다(그림 3). 그 중 3개는 액체 배양에서 마이코박테리아 생존력을 유의하게 증가시켰습니다(화합물 30, 31 및 32; 그림 3 및 그림 4). 이러한 화합물은 박테리아 생존력에 영향을 주지 않고 발광 방출을 방해할 수 있다는 점에 유의해야 합니다. 내재화된 마이코박테리아에 대해 테스트했을 때 이러한 화합물은 항균 활성을 보였으며(그림 6), 숙주 세포 내재화 후 Mab에 대해 더 높은 효능을 보여주었습니다. 이들 화합물은 트로레안도마이신(troleandomycin, 30), 스피라마이신(spiramycin, 32) 및 린코마이신(lincomycin)(31; 표 1). 앞의 두 가지는 마이코박테리아 감염을 치료하는 데 사용되는 항생제의 일종인 마크로라이드(macrolides)이고, 후자는 마크로라이드(macrolides)17와 유사한 작용 기전을 가진 항생제인 린코사마이드(lincosamide)이다. Mab는 액체 및 고체 배양균 모두에서 또 다른 린코사마이드인 클린다마이신(clindamycin)에 특히 내성이 있는 것으로 보고되었다18. 그럼에도 불구하고 면역 조절 및 항염증 특성은 마크로라이드19,20 및 린코사마이드21과 관련이 있으며, 이는 내부화된 마이코박테리아에 대한 항균 활성이 증가한 것을 설명할 수 있습니다(그림 6).
나머지 30개 중 11개는 모든 농도에서 마이코박테리아 생존력을 >90% 감소시킵니다(그림 4). 일반적인 HTS 분석의 예상 적중률이 ~1%22인 점을 감안할 때 개발된 프로토콜은 일반적으로 관찰되는 것과 일치합니다. 그럼에도 불구하고 몇 가지 다른 화합물은 여전히 활성 상태였으며 28 명이 감염 분석을 계속했습니다.
확인된 화합물 중 다우노루비신(daunorubicin)(4), 독소루비신(doxorubicin)(5), 에피루비신(epirubicin)(27), 티오스트렙톤(thiostrepton)(6) 및 피르비늄 파모에이트(pyrvinium pamoate)(28; 표 1). 처음 세 개는 항종양제(anti-neoplastic agents) 23,24,25이므로 당연히 이 분석에 사용된 포유류 세포에 독성이 있습니다. Pyrvinium pamoate는 효과적인 구충제로 수년 동안 사용되었습니다. 그러나 2004년 이후로는 반종양 활동과도 관련이 있다26. 마지막으로, 티오스트렙톤은 수의학에서 자주 사용되는 올리고펩타이드로, 인간에게 사용하도록 승인된 적이 없습니다27. 유방암 세포에 대한 이 약의 활성은28로 보고되었습니다. 티오스트렙톤의 대식세포내 활성은 골수 유래 대식세포에 대한 독성으로 인해 평가되지 않았습니다(그림 5). 그러나, 티오스트렙톤은 Mab-감염된 THP-1 세포에 대해 5μM에서 효과가 있는 것으로 나타났다(29). 플랑크톤 박테리아29에 대해 보고된 결과는 이 스크리닝에서 얻은 것과 유사하며, 티오스트렙톤은 매우 강력합니다(그림 4).
대식내 활성을 위해 스크리닝된 대부분의 화합물은 치료 가능성이 없는 것으로 나타났습니다(그림 6). 박테리아의 세포 내 성장은 플랑크톤 배양과 상당히 다릅니다. 후자의 경우 박테리아와 약물 간의 직접적인 접촉이 항상 가능합니다. 전자의 경우, 숙주 세포에 의한 내재화로 인해 여러 숙주막이 약물이 표적에 도달하기 위해 전치해야 하는 물리적 장벽으로 작용하며, 이는 대부분의 적중에서 감소된 항균 활성을 설명하는 데 도움이 될 수 있습니다. 가장 높은 농도인 13.3μM에서 세 가지 화합물인 세프디니르(cefdinir)(21), 가티플록사신(gatifloxacin)(26) 및 목시플록사신(moxifloxacin)(29; 표 1). 목시플록사신(moxifloxacin)은 이미 2차 항결핵제로 사용되고 있지만(16), 세프디니르(cefdinir)는 폐렴(pneumonia)과 같은 여러 호흡기 세균 감염을 치료하는 데 일반적으로 사용된다30. 그러나, M. tuberculosis31 및 Mab에 대한 활성이 보고되었으며, 후자32에 대한 carbapenem과 강력한 시너지 효과를 나타냅니다. Gatifloxacin은 플루오로 퀴놀론이며, 그 활성은 지난33,34 년에 여러 마이코 박테리아에 대해보고되었습니다. 이 분석에서 가장 활성이 높은 세 가지 화합물(그림 6)은 록시트로마이신(17), 클래리스로마이신(22) 및 리파부틴(25; 표 1), 모든 농도에서 매우 강력합니다. 처음 두 종류는 마크로라이드(macrolides)인 반면, 리파부틴(rifabutin)은 리파마이신(rifamycin)으로, 두 종류 모두 많은 마이코박테리아 감염에 대한 치료의 기초 역할을 한다16.
이 스크리닝은 분석 간의 변동성을 줄이기 위해 특정하고 값비싼 액체 처리 장비에 의존합니다. 재현성이 매우 높음에도 불구하고 액체 핸들러는 음향 핸들러와 같은 화합물의 비접촉식 전달이 없습니다. 따라서, 특정 접착성 화합물은 이송 사이에 금속 핀에 부착된 상태로 유지되어 후속 웰로 전달되어 스크리닝 단계에서 위양성(false positive)을 초래할 수 있으며, 이것이 화합물 33에서 발생한 일입니다. 그렇기 때문에 스크리닝을 검증하는 것이 성공에 매우 중요한 이유이며, 약물 스크리닝 파이프라인의 다음 단계로 위양성이 발생하지 않도록 합니다. 감염 분석은 공초점 모드의 high-content imaging 시스템을 사용하여 박테리아 영역에 대한 최상의 선명도를 얻습니다. 그럼에도 불구하고 공초점 모드 없이 여전히 사용할 수 있지만 정의 손실이 있고 박테리아 영역의 식별을 방해할 수 있습니다. 이 프로토콜은 이미징 시스템과 통합된 간단하고 사용자 친화적인 분석 소프트웨어를 활용합니다. 그러나 오픈 소스 소프트웨어는 프로토콜에 따라 사용할 수 있습니다(추가 그림 5). 궁극적으로, Mab 감염을 치료하기 위해 약물을 용도 변경하지는 않지만, 이러한 결과는 확립된 프로토콜을 검증하기 때문에 매우 중요하며, 이는 더 큰 라이브러리로 확장될 수 있습니다. 중요한 것은 이 프로토콜이 형광 또는 발광 판독값을 사용할 수 있는 경우 모든 박테리아에 적용할 수 있다고 믿는다는 것입니다. 따라서 이 연구는 약물 발견 분야에 크게 기여하며, 가장 큰 공중 보건 문제 중 하나인 항생제 내성 박테리아, 특히 거의 다루기 어려운 병원균인 Mycobacterium abscessus와 싸우는 데 필요한 도구를 제공합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 프로젝트 PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) 및 GSO 및 UI/BD/150830/2021 CMB에 2021.07335.BD 박사 펠로우십 FCT - Fundação para a Ciência e a Tecnologia, I.P를 통해 포르투갈 국가 기금으로 자금을 조달합니다. FWO - 연구 재단 플랑드르, 보조금 n° 1S68720N; 계약 번호 853903에 따른 IMI2-Call 16(IMI2-Call 16) 제안 RespiriTB. 저자들은 국가 인프라 PT-OPENSCREEN(NORTE-01-0145-FEDER-085468) 및 PPBI - 포르투갈 바이오이미징 플랫폼(PPBI-POCI-01-0145-FEDER-022122)의 회원인 i3S Scientific Platform BioSciences Screening의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
참고문헌
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997(2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179(2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221(2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239(2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I. The future of drug repositioning. Annual reports in medicinal chemistry. Macor, J. E. , Academic Press. 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562(2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204(2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224(2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866(2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90(2022).
- Bray, M. A., Carpenter, A. Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD). (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , 10th ed, Wayne, PA. (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18(2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421(2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202(2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302(2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527(2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165(2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249(2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661(2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511(2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293(2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유