Method Article
Assay-Entwicklung für das Hochdurchsatz-Wirkstoffscreening gegen Mykobakterien
In diesem Artikel
Zusammenfassung
In dieser Studie wurde ein Assay für das Hochdurchsatz-Screening gegen Mycobacterium abscessus mit einem kürzlich entwickelten Doppelreporterstamm entwickelt, der Fluoreszenz und Lumineszenz verwendet, um die Lebensfähigkeit von Bakterien schnell zu beurteilen. Dieses Protokoll wird für Forscher relevant sein, die neue Medikamente gegen diese arzneimittelresistenten Bakterien untersuchen wollen.
Zusammenfassung
Mycobacterium abscessus (Mab)-Infektionen sind aufgrund der hohen intrinsischen Arzneimittelresistenz, vergleichbar mit der multiresistenten Tuberkulose, schwierig zu behandeln. Die Behandlungen sind äußerst unwirksam und basieren auf einem Multi-Drug-Regime, was zu einer geringen Compliance der Patienten führt. Daher ist die wissenschaftliche Gemeinschaft aufgefordert, neue und wirksame Medikamente zur Behandlung dieser Infektionen zu identifizieren. Eine der Strategien, die zu diesem Zweck eingesetzt werden, ist das Drug Repurposing - der Prozess der Identifizierung neuer therapeutischer Möglichkeiten für bestehende Medikamente auf dem Markt, um die Zeit zu umgehen, die für die Erstellung von pharmakokinetischen und Sicherheitsprofilen neuer Medikamente erforderlich ist. Da die meisten Studien zur Arzneimittelentwicklung gegen Mab auf traditionellen und zeitaufwändigen Methoden beruhen, wurde ein Assay für das Hochdurchsatz-Wirkstoffscreening gegen Mykobakterien unter Verwendung eines selbst entwickelten Doppelreporterstamms von Mab entwickelt. Mithilfe von Liquid-Handling-Robotik, automatisierter Mikroskopie und Analyse sowie intern entwickelten Doppelreporterstämmen kann die Lebensfähigkeit von Bakterien mit zwei verschiedenen Messwerten, Lumineszenz und Fluoreszenz, schnell gemessen werden, ohne dass Reagenzien hinzugefügt oder zusätzliche Schritte durchgeführt werden müssen. Dies reduziert den Zeitaufwand und die Variabilität zwischen den Assays, ein großer Vorteil für Hochdurchsatz-Screenings. Das beschriebene Protokoll wurde durch das Screening einer Bibliothek von 1280 Verbindungen validiert. Die erzielten Ergebnisse wurden durch die Literatur bestätigt, wobei die Wirkstoffe effizient nachgewiesen werden konnten. Damit wurde mit dieser Arbeit das Ziel erfüllt, dem Feld ein neues Werkzeug zur Verfügung zu stellen, das bei der Bekämpfung dieser extrem arzneimittelresistenten Bakterien hilft.
Einleitung
Mycobacterium abscessus (Mab) ist ein opportunistischer Erreger, der für Lungeninfektionen verantwortlich ist, insbesondere bei Menschen mit Mukoviszidose und anderen Lungenerkrankungen. Infektionen, die durch Mab verursacht werden, sind aufgrund ihrer exquisiten intrinsischen Arzneimittelresistenz, vergleichbar mit der multiresistenten Tuberkulose, berüchtigt schwierig zu behandeln1. Die verfügbaren Medikamente sind aufgrund der hochundurchlässigen mykobakteriellen Zellhülle und eines Genoms, das für mehrere Enzyme kodiert, die Antibiotika deaktivieren, weitgehend wirkungslos2. So umfasst die Behandlung die Kombination mehrerer Medikamente, die Monate bis Jahre dauert. Dieses anspruchsvolle Multi-Drug-Schema in Kombination mit der geringen Compliance der Patienten führt zu einer durchschnittlichen Heilungsrate von 30 % bis 50 %3. Darüber hinaus hat die Prävalenz von Lungeninfektionen, die durch nicht-tuberkulöse Mykobakterien verursacht werden, in den letzten Jahrzehnten zugenommen, einschließlich derjenigen, die durch Mabverursacht werden 1,4. Daher arbeitet die wissenschaftliche Gemeinschaft an einem Wettlauf um die Entwicklung neuer Wirkstoffe zur Behandlung von Mab-Infektionen.
Eine der Strategien, die zu diesem Zweck verfolgt werden, ist das Drug Repurposing - der Prozess der Identifizierung neuer therapeutischer Möglichkeiten für bestehende Medikamente. Dadurch wird die größte Herausforderung umgangen, die mit der Entdeckungs- und Entwicklungspipeline eines neuen Medikaments einhergeht - Zeit5. Dieses einfache Konzept nutzt die bereits etablierten pharmakokinetischen und Sicherheitsprofile mehrerer Medikamente, um die Entwicklungskosten zu senken und die Zeitspanne zu verkürzen, die benötigt wird, um ein Medikament vom Labortisch bis zum Krankenbett zu bringen6. So wurden Bibliotheken zusammengestellt, die Hunderte bis Tausende solcher Verbindungen kombinieren, die es den Forschern ermöglichen, schnell die Möglichkeit der Wiederverwendung von Medikamenten gegen ihren Erreger von Interesse zu testen.
Die meisten Studien zur Arzneimittelentwicklung gegen Mab basieren auf einem Goldstandard, der die In-vitro-Aktivität eines Wirkstoffs gegen Mykobakterien bewertet - koloniebildende Einheiten, die7 zählen. Trotz seiner Genauigkeit ist dieses Verfahren extrem zeitaufwändig und wird schnell undurchführbar, wenn jemand Bibliotheken mit Tausenden von Verbindungen testen möchte. Zu diesem Zweck wurden Hochdurchsatz-Screenings (HTS) in die Arzneimittelentwicklung integriert - robuste Assays, die die Vorteile von Robotik und Liquid-Handling-Geräten nutzen und es ermöglichen, Tausende von Verbindungen schnell parallel zu screenen8. Dies geschieht in der Regel durch das Testen einer einzelnen Konzentration zunächst unter Verwendung von Mikrotiterplatten in den Formaten 96, 384, 1536 oder 3456 Wells, die als Ausgangspunkt für die Identifizierung von Treffern und deren weitere Optimierung in der Pipeline für den klinischen Einsatz dienen.
Reporterbasierte Assays bieten aufgrund ihrer Einfachheit und Sensitivität im Vergleich zu anderen farbstoff- und absorptionsbasierten Assays einen signifikanten Vorteil für die Robustheit von HTS 7,9. Unseres Wissens nach haben jedoch nur wenige Studien ein Hochdurchsatz-Screening gegen Mab9 optimiert.
Vor kurzem hat unser Labor Doppelreporterstämme entwickelt, die in der Lage sind, gleichzeitig Lumineszenz und Fluoreszenz10 zu emittieren. Mab operon_mScarlet ist eine dieser Sorten. Es ist autolumineszierend aufgrund der Expression des LuxABCDE-Operons , das eine bakterielle Luciferase (durch Expression der luxAB-Gene ) und ein langkettiges Aldehydsubstrat (durch Expression der luxCDE-Gene ) umfasst. Auf der anderen Seite wird die Fluoreszenzauslesung durch die Expression eines kürzlich entwickelten rot fluoreszierenden Proteins, mScarlet, erreicht, das die typischerweise verwendeten eGFP- und mCherry-Proteine übertrifft und ein stärkeres Signal liefert11. Die Verwendung dieses Stammes ermöglicht es uns, die Lebensfähigkeit von Bakterien in Flüssigkulturen zu beurteilen, indem wir das Lumineszenzsignal in einem Mikroplatten-Reader messen, ohne Reagenzien hinzuzufügen oder zusätzliche Schritte durchzuführen. Was die Detektion betrifft, so ermöglicht die intrinsische Fluoreszenz die mikroskopische Visualisierung in lebenden oder fixierten Zellen ohne den Einsatz von Farbstoffen oder Antikörpern. Die Tatsache, dass ein einziger Stamm mit beiden Messwerten vorhanden ist, bietet Forschern einen erheblichen Vorteil bei der Verwendung in HTS-Assays - die geringere Variabilität zwischen Assays mit unterschiedlichen Messwerten, da es nicht erforderlich ist, Stämme basierend auf der Art des Assays auszutauschen.
Daher wurde in dieser Arbeit ein Hochdurchsatz-Assay gegen Mab unter Verwendung eines selbst entwickelten Doppelreporterstamms entwickelt (Abbildung 1). Dies ermöglichte eine schnelle Bewertung der In-vitro-Aktivität 1280 Arzneimittel, die für die Wiederverwendung bestimmt waren, mit Hilfe einer kommerziellen Bibliothek (siehe Materialtabelle). Zum einen wurden die Aktivitäten in einem Bouillonkultur-Assay mittels Lumineszenz bewertet, zum anderen durch die Verwendung von Mab-infizierten Makrophagen, die sich das Fluoreszenzsignal zunutze machten, um den in vivo beobachteten Infektionsprozess besser zu emulieren 12.
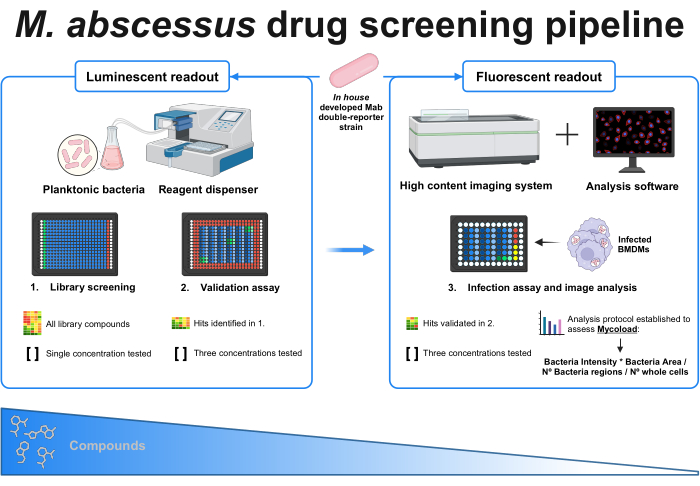
Abbildung 1: Grafische Zusammenfassung des etablierten Protokolls. Der Hauptakteur in diesem Screening ist ein selbst entwickelter Doppelreporter-Mykobakterienstamm, der in allen Experimenten verwendet wird. Zunächst wird mit einem Reagenzienspender und planktonischen Bakterien ein erstes Screening durchgeführt, indem die Verbindungen in einer einzigen Konzentration getestet werden. Die identifizierten Treffer werden in den Validierungsassay übernommen, bei dem drei verschiedene Konzentrationen getestet werden. Beide Experimente werden mit Hilfe der Lumineszenzanzeige durchgeführt. Die validierten Treffer werden in den Infektionstest übertragen, wo ebenfalls drei verschiedene Konzentrationen getestet werden und aus dem Knochenmark stammende Makrophagen bei MOI 1 infiziert werden. Ein High-Content-Bildgebungssystem erfasst das bakterielle Fluoreszenzsignal, und eine Analysesoftware wird verwendet, um die intrazelluläre Last anhand der Mycoload-Formel zu beurteilen. Die Anzahl der Verbindungen nimmt mit zunehmender Komplexität des Assays ab. Erstellt mit BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Alle Tierversuche wurden von der lokalen Tierethikkommission von i3S genehmigt und von der portugiesischen Generaldirektion für Lebensmittel und Veterinärwesen (DGAV) gemäß der Richtlinie des Europäischen Rates (2010/63/EU) und dem portugiesischen Gesetz (DL 113/2013) zum Tierschutz bei Versuchen lizenziert.
1. Bewertung des Faktors Z'
HINWEIS: Um die Leistung eines HTS-Assays zu beurteilen, können mehrere Parameter bestimmt werden. Der am häufigsten verwendete Parameter ist der Z-Primfaktor (Z'-Faktor). Diese Metrik misst die statistische Effektstärke eines bestimmten Experiments und gibt an, wie gut Positiv- und Negativkontrollen voneinander getrennt sind. Wenn ein Z'-Faktor zwischen 0,5 und 1 liegt, ist die Trennung zwischen beiden Populationen hervorragend, und diese Bedingungen können im HTS-Assay verwendet werden. Wenn Z' 0,5 <, ist der Abstand nur marginal, und es wird nicht empfohlen, das Screeningdurchzuführen 13. Daher wurde ein Experiment konzipiert, bei dem die Hälfte einer Platte mit unbehandelten Bakterien und die andere Hälfte mit einer Positivkontrolle zur Berechnung des Z'-Faktors verwendet wurde (Ergänzende Abbildung 1).
- 2-3 Tage vor dem Assay sind Vorkulturen von Mab vorzubereiten, indem die Bakterien in einem flüssigen Wachstumsmedium (ca. 1 x 107 KBE/ml) in einem Erlenmeyerkolben inokuliert werden. Lassen Sie die Bakterien bei 37 °C in einem Inkubator mit Rührwerk (90 U/min) wachsen.
ACHTUNG: Bei der Arbeit mit Mab-Kulturen ist eine Biosicherheitswerkbank erforderlich. - Verfolgen Sie das Wachstum der Mab-Vorkultur durch optische Dichtemessung bei 600 nm mit einem Spektralphotometer. Wenn die Kultur die exponentielle Wachstumsphase erreicht, fahren Sie mit Schritt 1.3 fort.
- Unter Verwendung der exponentiellen Vorkultur wird eine Bakteriensuspension von ca. 5 x 105 KBE/ml (korreliert mit optischen Dichtewerten)14 in flüssigem Wachstumsmedium hergestellt.
- Bereiten Sie eine Lösung zur positiven Kontrolle der bakteriellen Wachstumshemmung in einem flüssigen Wachstumsmedium vor. Für diesen Assay war die Positivkontrolle Clarithromycin (10 mg/ml in DMSO) in einer Menge von 4 μg/ml. Clarithromycin muss das 2-fache der gewünschten Endkonzentration hergestellt werden.
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, 15 μl flüssiges Wachstumsmedium auf die leeren und unbehandelten Säulen einer schwarzen 384-Well-Platte aus Polypropylen. Geben Sie für die Blankosäulen zusätzlich 15 μl flüssiges Wachstumsmedium ab.
HINWEIS: Die leeren Säulen verhindern die Verdunstung der inneren Vertiefungen bei 37 °C. - Geben Sie mit dem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, 15 μl der in Schritt 1.4 hergestellten Positivkontrolllösung in die Positivkontrollsäulen.
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer großen Kassette ausgestattet ist, 15 μl der in Schritt 1.3 hergestellten Bakteriensuspension in alle Spalten außer Leerproben und verdünnen Sie alles 1:2. Das Endvolumen aller 384 Vertiefungen beträgt 30 μl.
HINWEIS: Der Mikrotiterplatten-Reagenzienspender kann mit einer großen oder kleinen Kassette ausgestattet werden, die sich in der Schlauchgröße (0,5 bzw. 0,22 mm) unterscheidet. Es ist vorzuziehen, eine größere Kassette zu verwenden, um eine bakterielle Ansammlung im Schlauchsystem zu verhindern, auch wenn dies zu mehr Flüssigkeitsverschwendung führt. Nichtsdestotrotz kann die gleiche Kassette während des gesamten Assays verwendet werden. - Versiegeln Sie jede Platte mit einem Plattenversiegeler, der einen kontinuierlichen Gasaustausch ermöglicht. Inkubieren Sie bei 37 °C in einem Inkubator ohne Rühren in einer Feuchtkammer für 48 h.
- Nach 48 h wird die von den Bakterien in jeder Platte emittierte Lumineszenz mit einem Plattenleser mit einer Integrationszeit von 1 s abgelesen.
- Um den Z'-Faktor zu bestimmen, verwenden Sie die in Schritt 1.9 erhaltenen Werte und berechnen Sie den Durchschnitt und die Standardabweichung der positiven (AVGP und SDP) und negativen (AVGN und SDN) Kontrollen. Wenden Sie anschließend die folgende Formel an:
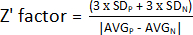
HINWEIS: 3 x SD ist ein häufig verwendeter Schwellenwert; Sie kann jedoch angepasst werden, um sie besser an das Screening anzupassen - entweder durch Erhöhung oder Verringerung des Faktors, um den die Standardabweichung multipliziert werden soll.
2. Bibliotheks-Screening auf Treffer
HINWEIS: Die ersten Screenings wurden gegen Bakterien durchgeführt, die in Flüssigkulturen wachsen. Der Aufbau wurde für 384-Well-Platten mit einem Endvolumen von 30 μl ausgelegt. Jede Platte enthielt Blindvertiefungen (nur flüssiges Wachstumsmedium), Negativkontrollen (unbehandelte Bakterien) und Lösungsmittelkontrollen (Bakterien plus Lösungsmittel der Verbindung - in diesem Fall DMSO; Ergänzende Abbildung 2). Die Verbindungen oder das Lösungsmittel wurden in der 2-fachen der gewünschten Endkonzentration auf die Platte gegeben, und die Bakterien wurden 1:1 hinzugefügt (alles auf die Hälfte verdünnt).
- Bereiten Sie die Bakteriensuspension wie in den Schritten 1.1 bis 1.3 beschrieben vor.
ACHTUNG: Bei der Arbeit mit Mab-Kulturen ist eine Biosicherheitswerkbank erforderlich. - Bereiten Sie eine Lösungsmittellösung in einem flüssigen Wachstumsmedium vor. Die Menge des Lösungsmittels muss das 2-fache der gewünschten Endkonzentration betragen.
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, 15 μl flüssiges Wachstumsmedium in jede Säule der schwarzen 384-Well-Platten aus Polypropylen, mit Ausnahme der Lösungsmittel-Kontrollsäule. Für leere Säulen geben Sie zusätzlich 15 μl flüssiges Wachstumsmedium ab.
- Geben Sie mit dem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, 15 μl der zuvor vorbereiteten Lösungsmittellösung in die Lösungsmittelkontrollsäule ab.
- Übertragen Sie mit einem Liquid Handler 200 nL der Verbindungen von den 96-Well-Standardplatten (1 mM in DMSO) auf die 384-Well-Platten, mit Ausnahme der Rohlinge, der Lösungsmittelkontrolle und der unbehandelten Säulen. Die Verbindungen liegen nun in einer Konzentration von 13,3 μM vor.
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer großen Kassette ausgestattet ist, 15 μl der in Schritt 2.1 hergestellten Bakteriensuspension in alle Säulen außer Leerproben und verdünnen Sie alles 1:2. Das Endvolumen aller 384 Vertiefungen beträgt 30 μl, und jede Verbindung liegt bei 6,66 μM.
- Versiegeln Sie jede Platte mit einem Plattenversiegeler, der einen kontinuierlichen Gasaustausch ermöglicht.
HINWEIS: Der Assay kann mit normalen Lidern durchgeführt werden; Es besteht jedoch eine höhere Wahrscheinlichkeit für stärkere Kanteneffekte. - Inkubieren Sie bei 37 °C in einem Inkubator ohne Rühren in einer Feuchtkammer für 48 h.
- Nach 48 h wird die von den Bakterien in jeder Platte emittierte Lumineszenz mit einem Plattenleser mit einer Integrationszeit von 1 s abgelesen.
3. Analyse von Hit-Screening-Daten
HINWEIS: Um Treffer mit den erfassten Lumineszenzdaten zu identifizieren, müssen die Werte auf das Lösungsmittel normiert werden, in dem die Verbindungen gelöst sind, und, falls vorhanden, auf den Kanteneffekt, der auf den 384-Mikrotiterplatten überprüft wurde.
- Für die Lösungsmittelnormalisierung der in Schritt 2.9 erhaltenen Daten dividieren Sie die relativen Lichteinheiten (RLU) jeder Vertiefung durch die durchschnittliche RLU der Lösungsmittelkontrollvertiefungen (in der entsprechenden Platte). In diesem Assay wurde ein starker Kanteneffekt in der Mitte der Screening-Platten nachgewiesen; Daher wurde beschlossen, alle Daten dafür zu normalisieren. Um dies zu erreichen, wurde der Prozess in zwei Schritten durchgeführt, wie im Folgenden beschrieben.
- Erstellen Sie eine Kanteneffektmaske, indem Sie die in Schritt 3.1 erhaltenen Werte für die entsprechenden Positionen ohne Treffer auf alle Platten (Platte 1 - P1, Platte 2 - P2, Platte 3 - P3, Platte 4 - P4) aufteilen. Für die Positionen A1 und A2 gilt beispielsweise Mask_A1 = Durchschnitt (P1_A1; P2_A1; P3_A1; P4_A1); Mask_A2 = Durchschnitt (P1_A2; P2_A2; P4_A2) [P3_A2 wurde ausgeschlossen, weil es ein Treffer war].
- Teilen Sie die in Schritt 3.1 erhaltenen Werte. durch ihre in Schritt 3.1.1 erhaltene Kanteneffektmaske. Beispiel:
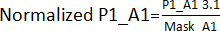 . Berechnen Sie anschließend die AVG und SD jeder Platte, um einen Schwellenwert (AVG ± 3SD) für jede Platte festzulegen. Jede Verbindung, die außerhalb dieses Schwellenwerts liegt, gilt als Treffer und wird in den Treffervalidierungsassay aufgenommen.
. Berechnen Sie anschließend die AVG und SD jeder Platte, um einen Schwellenwert (AVG ± 3SD) für jede Platte festzulegen. Jede Verbindung, die außerhalb dieses Schwellenwerts liegt, gilt als Treffer und wird in den Treffervalidierungsassay aufgenommen.
4. Hit-Validierungs-Assay
HINWEIS: Nach der Identifizierung von Treffern müssen diese mit unterschiedlichen Konzentrationen validiert werden. Der Validierungsassay verwendet einen ähnlichen Aufbau mit den gleichen Kontrollen, aber jeder Treffer wird einer seriellen Verdünnung von 1:2 unterzogen. Für diesen Assay wurden drei Konzentrationen verwendet - 13,3 μM, 6,66 μM und 3,3 μM. Lösungsmittelkontrollen enthalten den gleichen Lösungsmittelanteil wie jede Vertiefung der Verbindung (ergänzende Abbildung 3).
- Bereiten Sie die Bakteriensuspension wie in den Schritten 1.1 bis 1.3 beschrieben vor.
ACHTUNG: Bei der Arbeit mit Mab-Kulturen ist eine Biosicherheitswerkbank erforderlich. - Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, 15 μl flüssiges Wachstumsmedium auf jede Säule einer schwarzen 384-Well-Platte aus Polypropylen. Für Blank-Wells geben Sie zusätzlich 15 μl flüssiges Wachstumsmedium in die erste und letzte Säule.
- Geben Sie mit dem Mikrotiterplatten-Reagenziendispenser weitere 15 μl flüssiges Wachstumsmedium in die Säulen mit den höchsten [μM] jeder Verbindung.
- Pipettieren Sie von den 96-Well-Standardplatten manuell 0,8 μl jedes Treffers (1 mM in DMSO) in die entsprechenden Wells aus Schritt 4.3 in doppelter Ausführung. Die Verbindungen liegen nun in einer Konzentration von 26,6 μM vor.
- Pipettieren Sie manuell 0,8 μl Lösungsmittel in doppelter Ausführung in die Kontrollvertiefungen (wie in Schritt 4.4).
- Führen Sie mit einer Mehrkanal-Mikropipette zwei 1:2-Reihenverdünnungen für jede Verbindung und Lösungsmittelkontrolle durch. Die mehr als 15 μl sind nach der letzten seriellen Verdünnung zu verwerfen. Alle Wells haben jetzt 15 μL, und die Konzentrationen der Verbindungen betragen 26,6 μM, 13,3 μM und 6,66 μM.
- Mit einem Mikrotiterplatten-Reagenzienspender mit einer großen Kassette werden 15 μl der in 4.1 hergestellten Bakteriensuspension in alle Säulen (außer Blank Wells) gegeben, wobei die Verbindungen im Verhältnis 1:2 verdünnt werden. Alle Wells haben ein Endvolumen von 30 μl, und jede Verbindung liegt bei 13,3 μM, 6,66 μM und 3,3 μM.
- Versiegeln Sie die Platte mit einem Plattenversiegeler, der einen kontinuierlichen Gasaustausch ermöglicht. Inkubieren Sie bei 37 °C in einem Inkubator ohne Rühren in einer Feuchtkammer für 48 h.
- Nach 48 h wird die von den Bakterien in jeder Platte emittierte Lumineszenz mit einer Integrationszeit von 1 s mit einem Plattenlesegerät abgelesen.
5. Infektionstest
HINWEIS: Bei Mab handelt es sich um einen intrazellulären fakultativen Erreger, daher müssen die antimikrobielle Aktivität und die Wirtstoxizität der Treffer in Infektionstests bestimmt werden. Zu diesem Zweck wurden aus dem Knochenmark stammende Makrophagen (BMM) mit Mab infiziert und mit den in Schritt 4 validierten Treffern in unterschiedlichen Konzentrationen behandelt. Jeder Assay umfasste Blind- (nur Wasser), Negativkontrollen (unbehandelte infizierte Makrophagen), Positivkontrollen (infizierte Makrophagen, die mit einem wirksamen Antibiotikum behandelt wurden), Lösungsmittelkontrollen (in diesem Fall DMSO) und die zu testenden Verbindungen in drei Konzentrationen - 13,3 μM, 6,66 μM und 3,3 μM (Ergänzende Abbildung 4).
- Makrophagen aus dem murinen Knochenmark von adulten Wildtyp-Mäusen (BALB/c oder C57BL/6) ableiten, wie zuvor beschrieben15. Plattieren Sie die Zellen auf einer schwarzen, optisch klaren 96-Well-Platte mit flachem Boden mit 2 x 105 Zellen/ml, 200 μl pro Well. Nach 10 Tagen Differenzierung bei 37 °C, 7 % CO215 sind die Zellen bereit, sich zu infizieren und mit der Behandlung fortzufahren.
HINWEIS: Das Protokoll zur Gewinnung von Makrophagen aus dem Knochenmark ist gut etabliert15; Dieses Screening-Protokoll kann jedoch an andere Zellen angepasst werden, wie z. B. RAW 264.7, THP-1 und PBMC-abgeleitete Makrophagen. - Bereiten Sie die Bakteriensuspension wie in den Schritten 1.1 bis 1.3 beschrieben vor und passen Sie die Bakteriensuspension im Zellkulturmedium für eine Infektion mit einer Multiplizitätsinfektion (MOI) von 1 an.
ACHTUNG: Bei der Arbeit mit Mab-Kulturen ist eine Biosicherheitswerkbank erforderlich. - Aspirieren Sie das supplementierte Zellkulturmedium aus den Wells vorsichtig mit einer Vakuumpumpe, die an einer Glaspipette befestigt ist. Dieser Schritt muss langsam und einfach durchgeführt werden, um eine Zellablösung zu verhindern.
- 75 μl der in Schritt 5.2 hergestellten Bakteriensuspension werden manuell in jede Vertiefung pipettiert. Inkubieren Sie die Platte bei 37 °C mit 7 % CO2 für 4 h in einem Zellinkubator.
- Bereiten Sie die Verbindungen für die Zellbehandlung vor. Geben Sie mit einem Mikrotiterplatten-Reagenzienspender, der mit einer kleinen Kassette ausgestattet ist, auf 96-Well-Platten aus Polypropylen mit rundem Boden und 110 μl supplementiertes Zellkulturmedium in Säulen, in denen die Verbindungen oder die Lösungsmittelkontrolle durchgeführt werden (ergänzende Abbildung 4).
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender weitere 104 μl supplementiertes Zellkulturmedium in die Säulen, in denen die höchste Konzentration der Verbindung oder des Lösungsmittels auftritt.
- 5,9 μl der Verbindungen (1 mM in DMSO) oder Lösungsmittel werden manuell in die dafür vorgesehenen Vertiefungen pipettiert (Spalten in Schritt 5.6). Die Verbindungen liegen nun in einer Konzentration von 26,6 μM vor.
- Führen Sie mit einer Mehrkanal-Mikropipette zwei serielle Verdünnungen 1:2 für jede Verbindung und jedes Lösungsmittel durch. Die überschüssigen 110 μl sind nach der letzten seriellen Verdünnung zu verwerfen. Alle Wells haben jetzt 110 μL, und die Verbindungen haben eine Konzentration von 26,6 μM, 13,3 μM und 6,66 μM.
- Geben Sie mit einem Mikrotiterplatten-Reagenzienspender 110 μl supplementiertes Zellkulturmedium in alle Säulen (mit Ausnahme von Blank-Wells). Alle Vertiefungen haben jetzt 220 μl, und die Verbindungen liegen in einer Konzentration von 13,3 μM, 6,66 μM und 3,3 μM vor.
- Bereiten Sie eine Lösung von Clarithromycin (Positivkontrolle) in einer Dosis von 2 μg/ml in einem supplementierten Zellkulturmedium vor.
- 4 h nach Schritt 5.4 wird die infizierte 96-Well-Platte mit einer Plattenwaschmaschine 3x mit 200 μl Infektionswaschlösung gewaschen. Halten Sie die Aspirations- und Dosiergeschwindigkeiten so langsam wie möglich, um eine Zellablösung zu verhindern.
- Nach der abschließenden Aspiration werden 200 μl der in den Schritten 5.5 bis 5.9 hergestellten Verbindungen auf die 96-Well-Platte mit den infizierten Makrophagen übertragen.
- Übertragen Sie 200 μl supplementiertes Zellkulturmedium in die unbehandelten Wells. 200 μl der in Schritt 5.10 hergestellten Clarithromycin-Lösung werden in die entsprechenden Vertiefungen überführt.
- Die Platte in einem Zellinkubator bei 37 °C mit 7 % CO2 48 h inkubieren.
- Nach 48 h waschen Sie die infizierte 96-Well-Platte mit einem Plattenwascher mit der Waschlösung des Compounds (3x mit 200 μL pro Well).
- Geben Sie mit einer Mehrkanal-Mikropipette 200 μl der Fixierlösung in alle Vertiefungen und lassen Sie sie 10 Minuten lang einwirken.
- Waschen Sie die Zellen nach der Fixierung mit einem Plattenwascher mit der Waschlösung der Verbindungen (3x mit 200 μL pro Well).
HINWEIS: Das Protokoll kann hier pausiert werden. Die Zellen können mehrere Tage oder Wochen in der Waschlösung der Compounds bei 4 °C gelagert werden, wenn eine Kontamination und Zelltrockenheit verhindert werden. Die Waschlösung der Mischungen muss vor Schritt 5.18 abgesaugt werden. - Geben Sie mit einer Mehrkanal-Mikropipette 200 μl der permeabilisierenden Lösung in alle Vertiefungen und lassen Sie sie 15 Minuten einwirken. Saugen Sie die permeabilisierende Lösung mit einem Plattenwascher an.
- Mit einer Mehrkanal-Mikropipette 100 μl der Färbelösung manuell dosieren und die Platten 30 Minuten lang bei Raumtemperatur inkubieren.
- Waschen Sie die Platten mit einer Plattenwaschmaschine mit der Waschlösung der Compounds (3x mit 200 μL pro Well). Lassen Sie die gefärbten Zellen am Ende in der Waschlösung der Verbindungen.
- Sieben Sie die Platten in einem High-Content-Imaging-System mit den folgenden Einstellungen:
Objektiv: 20x Air/0,4NA (eine Vertiefung einer 96-Mikrotiterplatte, 57 Sichtfelder (FOV)
Modus: Konfokal
Laser 405 nm für DAPI (Zellkerne)
Laser 561 nm für mScarlet (Bakterien)
Laser 640 nm für HCS Zellmaske Deep Red (Zytoplasma)
Kein Z-Stapel
HINWEIS: Die Zellen können mit einem Weitfeld-Bildgebungssystem abgebildet werden, wodurch die Schärfe verringert wird. - Richten Sie über Nacht einen Gerätehandhabungsroboter für die Bildaufnahme ein. Dieser Roboterarm tauscht die Platten im High-Content-Bildgebungssystem ohne menschliches Eingreifen aus.
HINWEIS: Dies ist nicht obligatorisch. Die Platten können manuell ausgetauscht werden.
6. Bildanalyse
HINWEIS: Die Bildanalyse wird mit der Analysesoftware durchgeführt, die mit dem High-Content-Bildgebungssystem identisch ist, das zur Erfassung der Bilder verwendet wird. Eine Analysepipeline muss anhand von Beispielbildern erstellt werden (Ergänzende Abbildung 5). Anschließend wird es auf das gesamte Well (57 FOV) und den Datensatz (alle Platten) angewendet. Die Analysesoftware folgt einer logischen Abfolge von Schritten, beginnend mit der Segmentierung der verschiedenen interessierenden Regionen (Zellkerne, Zytoplasma, Zellen und Bakterien), ihrer Beziehung (z. B. Bakterien innerhalb von Zellen) und der anschließenden Extraktion morphologischer und Intensitätseigenschaften (z. B. Fläche, Intensität). Im Folgenden werden die wesentlichen Schritte der Bildanalyse beschrieben. Das vollständige verwendete Protokoll finden Sie in der ergänzenden Abbildung 5.
- Segmentieren Sie die Zellkerne mit dem DAPI-Signal, das Zytoplasma mit dem DeepRed-Signal und die Bakterien mit dem mScarlet-Signal.
- Setzen Sie die Zellkern- und Zytoplasmasegmentierung in Beziehung, um eine Maske für Zellen zu erstellen.
- Entfernen Sie alle Rahmenobjekte. Es werden nur Zellen berücksichtigt, die auf dem FOV als voll erscheinen (ganze Zellen).
- Definieren Sie die Ausgangspopulation von Bakterien in ganzen Zellen, indem Sie ganze Zellen und Bakterien in Beziehung setzen.
- Definieren Sie infizierte ganze Zellen mit mehr als einer Bakterienregion und nicht infizierte ganze Zellen mit weniger als einer Bakterienregion.
- Nachdem alle relevanten Regionen segmentiert und die Grundgesamtheiten erstellt wurden, berechnen und extrahieren Sie deren Eigenschaften. Die folgenden Eigenschaften werden für jede Vertiefung extrahiert.
- Für ganze Zellen / Infizierte ganze Zellen / Nicht infizierte ganze Zellen, Extrakt
Anzahl der Zellen (Summe pro Well)
Fläche [μm2] (Mittelwert + Standardabweichung pro Well)
Verhältnis von Dicke zu Länge der Zelle (Mittelwert + Standardabweichung pro Well) - Für Bakterien in ganzen Zellen Extrakt
Anzahl der identifizierten Bakterienregionen (Summe pro Well)
Intensität (Summe der mittleren Intensität jeder Region pro Well)
Fläche der Region (Summe pro Brunnen)
- Für ganze Zellen / Infizierte ganze Zellen / Nicht infizierte ganze Zellen, Extrakt
- Nachdem Sie die Daten exportiert und in einer Tabelle kuratiert haben, quantifizieren Sie die intrazelluläre Belastung (Mycoload) nach der folgenden Formel:
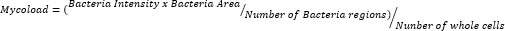
Ergebnisse
Bewertung des Faktors Z'
Abbildung 2 zeigt die Daten von einem von zwei Experimenten, die zur Berechnung des Z'-Faktors durchgeführt wurden. Die Positivkontrolle war Clarithromycin mit 4 μg/ml. Beide Experimente ergaben Z'-Faktoren von 0,64 und 0,62, was bedeutet, dass die Bedingungen und Messwerte, die für diesen Assay verwendet wurden, auf den folgenden Screening-Assay angewendet werden können (Z' > 0,5). Nichtsdestotrotz wurde der Z'-Faktor für alle verbleibenden Experimente berechnet (Infektionsassay), um die Leistung jedes Experiments zu kontrollieren.
Als Proof of Concept des entwickelten HTS-Assays wurde eine Bibliothek von Verbindungen getestet, die für die Wiederverwendung von Medikamenten bestimmt sind. Es besteht aus 1280 verschiedenen und kleinen Molekülen, von denen 95 % sowohl von der FDA als auch von der EMA zugelassene Medikamente sind. Diese Moleküle bieten eine hohe chemische und pharmakologische Diversität.
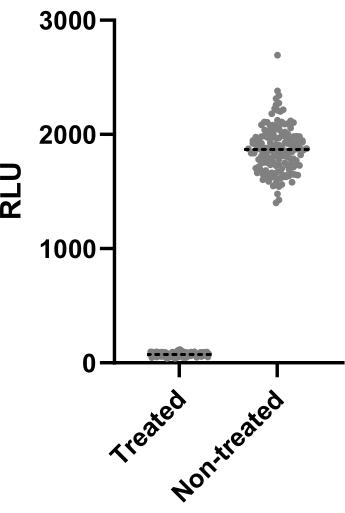
Abbildung 2: Ergebnisse der Z'-Faktorenbewertung. Mab bei 2,5 x 105 KBE/ml wurde mit und ohne Clarithromycin bei 4 μg/ml für 48 h bei 37 °C inkubiert. Nach der Inkubationszeit wurde die Lumineszenz gemessen, um die Lebensfähigkeit der Mykobakterien zu bewerten. Die Grafik zeigt die individuellen Lumineszenzwerte von behandelten und unbehandelten lebensfähigen Mykobakterien in einem unabhängigen Experiment. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bibliotheks-Screening auf Treffer
Alle Verbindungen wurden bei 6,66 μM gegen Mab getestet. Aufgrund der Größe der Bibliothek wurden die Verbindungen in vier verschiedene Mikrotiterplatten mit 384 Vertiefungen aufgeteilt (Abbildung 3A-D). Die Ergebnisse wurden sowohl für das Lösungsmittel als auch für den verifizierten Kanteneffekt normalisiert.
In diesem Screening-Assay wurden dreiunddreißig Treffer identifiziert, von denen dreißig die Lumineszenzemission signifikant verringerten, was die Lebensfähigkeit der Mykobakterien verringerte (Abbildung 3). Interessanterweise führten drei Verbindungen zu einer höheren Lumineszenzemission, die möglicherweise mit einem erhöhten bakteriellen Stoffwechsel oder einer erhöhten bakteriellen Proliferation zusammenhängt (Abbildung 3). Alle 33 Treffer wurden in den Validierungsassay übertragen, einschließlich der drei Verbindungen, die die Lumineszenz erhöhten, um zu testen, ob dieses Profil beibehalten werden würde.
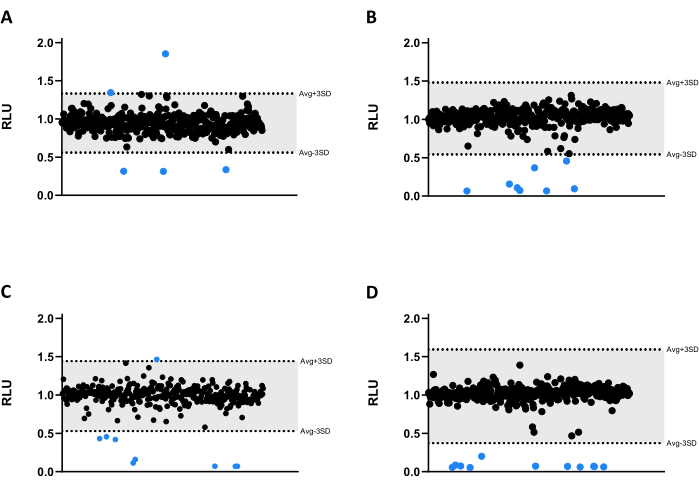
Abbildung 3: Ergebnisse des Bibliotheksscreenings. (A-D) Mab bei 2,5 x 105 KBE/ml wurde mit 1280 Verbindungen bei 6,66 μM für 48 Stunden bei 37 °C inkubiert. Nach der Inkubation wurde die Lumineszenz gemessen, um die Lebensfähigkeit der Mykobakterien zu bewerten. Die Diagramme zeigen die RLU eines unabhängigen Experiments, dargestellt als beliebige Einheiten nach der Normalisierung des Lösungsmittels und des Kanteneffekts. Die AVG RLU und die entsprechende SD wurden für jede Platte berechnet, um einen Schwellenwert (in grau; AVG ± 3SD). Runde Symbole stellen eine getestete Verbindung dar. In Blau wird jede Verbindung außerhalb dieses Schwellenwerts als Treffer gewertet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Hit-Validierungs-Assay
Die für diesen Assay verwendeten Konzentrationen betrugen 13,3 μM, 6,66 μM und 3,3 μM. Jede Verbindung wurde doppelt getestet, um die Robustheit zu erhöhen.
Wichtig ist, dass die Verbindungen 30, 31 und 32, die zuvor mit einer höheren RLU assoziiert waren (Abbildung 3A, C), dieses Profil beibehielten, wobei mehr als 200 % der mykobakteriellen Lebensfähigkeit in Vertiefungen erreicht wurden, die mit Verbindung 32 behandelt wurden (Abbildung 4).
Die Verbindungen 20 und 33 wurden als inaktiv eingestuft, da die Lebensfähigkeit der Mykobakterien in allen getesteten Konzentrationen bei nahezu 100 % liegt (Abbildung 4).
Die Verbindungen 9 und 21 zeigten bei den beiden niedrigsten Konzentrationen eine ähnliche Inaktivität; Im Gegensatz zu 20 bleiben sie jedoch bei der höchsten Konzentration von 13,3 μM aktiv, wobei die Verbindung 21 eine höhere Wirksamkeit aufweist (Abbildung 4).
Verbindung 3 zeigt ebenfalls Inaktivität bei der niedrigsten Konzentration und einen Aktivitätsverlust bei 6,66 μM, wenn auch weniger als Verbindung 21 (Abbildung 4). Nur in der niedrigsten Konzentration zeigten die Verbindungen 2, 7, 8, 10, 16, 18, 24 und 28 ein geringeres therapeutisches Potenzial. 2, 10 und 28 führen jedoch immer noch zu <50 % der Lebensfähigkeit der Mykobakterien.
Weltweit waren die restlichen vierzehn Verbindungen in allen getesteten Konzentrationen aktiv.
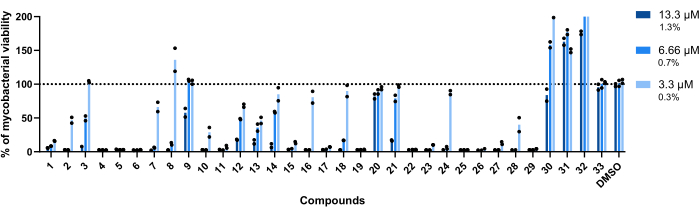
Abbildung 4: Ergebnisse des Hit-Validierungsassays. Mab bei 2,5 x 105 KBE/ml wurde inkubiert, wobei jeder zuvor identifizierte Treffer bei 13,3 μM, 6,66 μM und 3,3 μM (1,3 %, 0,7 % bzw. 0,3 % des DMSO) für 48 Stunden bei 37 °C erfolgte. Nach der Inkubationszeit wurde die Lumineszenz gemessen, um die Lebensfähigkeit der Mykobakterien zu bewerten. Das Diagramm zeigt den prozentualen Anteil der behandelten lebensfähigen Mykobakterien im Vergleich zu den unbehandelten Mykobakterien eines unabhängigen Experiments, wobei jede Verbindung in doppelter Ausführung getestet wurde. Runde Symbole stellen die Duplikate für jede Verbindung dar. Balken stellen den Durchschnitt dieser Duplikate dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Infektions-Assay
Von dreiunddreißig getesteten Verbindungen wurden achtundzwanzig für den Infektionstest ausgewählt (Abbildung 4). Die Verbindungen 7, 8, 9, 20 und 33 wurden für diesen Assay nicht ausgewählt. Während 9, 20 und 33 bei der Validierung aufgrund ihrer Inaktivität nicht berücksichtigt wurden (Abbildung 4), wurden die ersten beiden aus technischen Gründen nicht berücksichtigt. Nichtsdestotrotz wurden diese Verbindungen als Rifampicin und Linezolid identifiziert, Antibiotika, die bereits zur Behandlung von Mab-Infektionen eingesetzt werden12. Alle im Infektionstest getesteten Verbindungen wurden identifiziert und sind in Tabelle 1 aufgeführt. Die antimikrobielle Aktivität der Verbindungen gegen Mab-infizierte Makrophagen wurde anhand der intrinsischen Fluoreszenz der Bakterien bewertet.
| Verbindung | Name | Verbindung | Name |
| 1 | Sulfathiazol | 18 | Cefuroxim |
| 2 | Ciprofloxacin | 19 | Rifaximin |
| 3 | Cefotaxim | 21 | Cefdinir |
| 4 | Daunorubicin | 22 | Clarithromycin |
| 5 | Doxorubicin | 23 | Besifloxacin |
| 6 | Thiostrepton | 24 | Levofloxacin |
| 10 | Amikacin | 25 | Rifabutin |
| 11 | Moxalactam | 26 | Gatifloxacin |
| 12 | Sulfamethizol | 27 | Epirubicin |
| 13 | Sulfamonomethoxin | 28 | Pyrvinium-Pamoat |
| 14 | Cefoxitin | 29 | Moxifloxacin |
| 15 | Novobiocin | 30 | Troleandomycin |
| 16 | Cefmetazol | 31 | Lincomycin |
| 17 | Roxithromycin | 32 | Spiramycin |
Tabelle 1: Liste der im Infektionstest getesteten Verbindungen. Die in Schritt 4 validierten Verbindungen wurden im Infektionsassay (Schritt 5) getestet.
Die Toxizität der Verbindungen gegenüber Mab-infizierten Makrophagen war der erste Parameter, der bewertet wurde. Der Schwellenwert, um eine Verbindung als toxisch oder nicht toxisch einzustufen, lag bei 85 % der lebensfähigen Makrophagen (Abbildung 5). Von den achtundzwanzig getesteten Verbindungen wurden 4, 5, 6, 27 und 28 als giftig eingestuft. (Abbildung 5). Daher wurden diese fünf Verbindungen von der folgenden Bewertung der intramakrophagischen Aktivität ausgeschlossen.
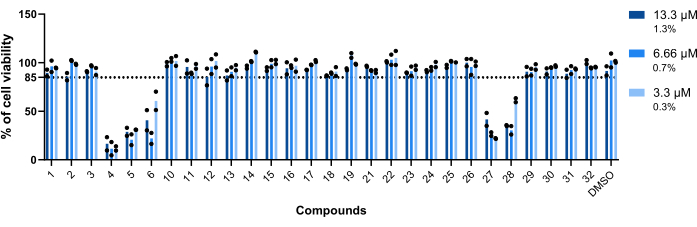
Abbildung 5: Toxizität der Treffer gegenüber Mab-infizierten Makrophagen. BALB/c-Mäuse BMMs wurden mit Mab (MOI=1) infiziert und mit jedem zuvor identifizierten Treffer bei 13,3 μM, 6,66 μM und 3,3 μM (1,3 %, 0,7 % bzw. 0,3 % DMSO) für 48 Stunden bei 37 °C mit 7 % CO2 inkubiert. Die Zellen wurden in einem High-Content-Screening-Fluoreszenzmikroskop abgebildet, wobei die Anzahl der Kerne (mit DAPI gefärbt) verwendet wurde, um die Lebensfähigkeit der Zellen zu messen. Die Grafik zeigt den prozentualen Anteil lebensfähiger behandelter infizierter Makrophagen im Verhältnis zu den lebensfähigen, unbehandelten infizierten Makrophagen von zwei unabhängigen Experimenten. Runde Symbole stellen die Lebensfähigkeit der Zelle für jeden Assay dar. Die Balken stellen den Durchschnitt von zwei unabhängigen Experimenten dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um die intramakrophagische Aktivität der verbleibenden dreiundzwanzig Verbindungen gegen intrazellulären Mab (Abbildung 6) abzuleiten, wurde die Mycoload-Formel (zuvor in Schritt 6 erläutert) verwendet, um den Prozentsatz der mykobakteriellen Lebensfähigkeit zu erhalten, der auf unbehandelte infizierte Makrophagen normalisiert wurde. Die meisten Verbindungen verloren ihr therapeutisches Potenzial gegen internalisierte Mykobakterien (Abbildung 6) im Vergleich zum Hit-Validierungsassay (Abbildung 4), da die Anzahl der Treffer bei der höchsten getesteten Konzentration von fünfundzwanzig auf sechs reduziert wurde. Auffallend ist, dass alle drei Verbindungen, die die Lebensfähigkeit von planktonischem Mab im Vergleich zu unbehandelten Bakterien erhöhten (30, 31 und 32; Abbildung 3 und Abbildung 4) zeigten eine antimykobakterielle Aktivität gegen intrazelluläres Mab, wobei die Verbindungen 30 und 32 einen signifikanten statistischen Unterschied im Vergleich zu DMSO darstellten, selbst bei 3,3 μM im Fall von Verbindung 32 (Abbildung 6). Mykobakterien, die mit den Verbindungen 11 und 23 behandelt wurden, zeigten bei 13,3 μM eine Lebensfähigkeit von <50 %; dies unterschied sich jedoch nicht signifikant von der DMSO-Kontrolle (Abbildung 6). Die Verbindungen 21, 26 und 29 waren bei 13,3 μM stark genug, um einen signifikanten statistischen Unterschied zu rechtfertigen, wobei 29 am aktivsten war (Abbildung 6). Schließlich waren die Verbindungen 17, 22 und 25 in allen getesteten Konzentrationen extrem wirksam gegen internalisierte Mykobakterien. Diese wurden als Roxithromycin, Clarithromycin bzw. Rifabutin identifiziert (Tabelle 1). Von den drei Verbindungen war Clarithromycin am aktivsten gegen Mab, wobei die Lebensfähigkeit der Mykobakterien nie über 10 % stieg und in allen getesteten Konzentrationen einen p-Wert von <0,0001 im Vergleich zu DMSO darstellte (Abbildung 6).
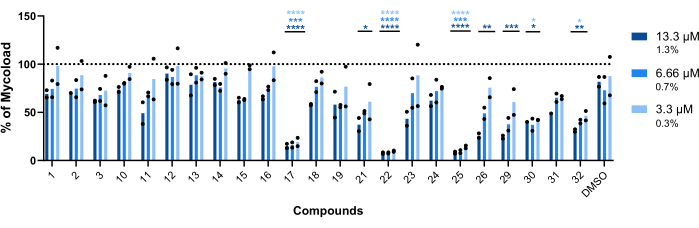
Abbildung 6: Intramakrophagische Aktivität der Treffer gegen Mab-infizierte Makrophagen. BALB/c-Mäuse BMMs wurden mit Mab (MOI=1) infiziert und mit jedem zuvor identifizierten Treffer bei 13,3, 6,66 bzw. 3,3 μM (1,3, 0,7 bzw. 0,3 % DMSO) für 48 Stunden bei 37 °C mit 7 % CO2 inkubiert. Die Zellen wurden in einem High-Content-Screening-Fluoreszenzmikroskop abgebildet und das Fluoreszenzsignal zur Berechnung des Mycoload verwendet (siehe Schritt 6). Die Grafik zeigt den prozentualen Anteil der Mycoload, die in behandelten infizierten Makrophagen gefunden wurde, im Vergleich zu unbehandelten infizierten Makrophagen in zwei unabhängigen Experimenten. Die Statistik wurde unter Verwendung einer bidirektionalen ANOVA mit dem Mehrfachvergleichstest von Dunnet durchgeführt. *, S. < 0,05; **, S. < 0,01; , S. < 0,001; , p < 0,0001 im Vergleich zu DMSO (Solvent Control). Sternchen folgen für jede Konzentration dem gleichen Farbcode wie die Legende des Diagramms. Runde Symbole stellen das Mycoload für jeden Assay dar. Die Balken stellen den Durchschnitt von zwei unabhängigen Experimenten dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Beispiel für ein 384-Well-Plattenlayout, das bei der Z'-Faktor-Bewertung verwendet wird. Weiß - Blank Wells (nur flüssiges Wachstumsmedium); gelb - Positivkontrolle (Bakterien, die mit einem Antibiotikum behandelt wurden); Rot - Negativkontrolle (unbehandelte Bakterien). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Beispiel für ein 384-Well-Plattenlayout, das im Bibliotheksscreening verwendet wird. Weiß - Blank Wells (nur flüssiges Wachstumsmedium); grün - Lösungsmittelkontrolle; rot - Negativkontrolle (unbehandelte Bakterien); blau - Verbindungen, die gesiebt werden sollen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Beispiel für ein 384-Well-Plattenlayout, das für die Treffervalidierung verwendet wird. Weiß - Blank Wells (nur flüssiges Wachstumsmedium); grün - Lösungsmittelkontrolle (in Duplikaten); rot - Negativkontrolle (unbehandelte Bakterien); blau - Verbindungen, die gesiebt werden sollen (in Duplikaten). Verblasste Farben stellen serielle Verdünnungen im Verhältnis 1:2 dar. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: Beispiel für ein 96-Well-Plattenlayout, das für einen Infektionsassay verwendet wird. Weiß - leere Vertiefungen (Wasser, um Verdunstung zu verhindern); rot - Negativkontrolle (unbehandelte Makrophagen); gelb - Positivkontrolle (Makrophagen, die mit einem Antibiotikum behandelt wurden); grün - Lösungsmittelkontrolle; blau - zu prüfende Verbindungen. Verblasste Farben stellen serielle Verdünnungen im Verhältnis 1:2 dar. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5: Bildanalyseprotokoll. In dieser Arbeit wird ein detailliertes Protokoll der Bildanalyse verwendet, das an Open-Source-Software angepasst werden kann. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieses Protokoll beschreibt eine Wirkstoff-Screening-Pipeline gegen Mab , die in selbst entwickelten Stämmenverwendet wird 10. Mit Hilfe von Liquid-Handling-Robotik, automatisierter Mikroskopie und Analyse sowie Doppelreporterstämmen wird die Lebensfähigkeit von Bakterien schnell anhand von Lumineszenz oder Fluoreszenz bewertet, ohne dass Reagenzien hinzugefügt oder zusätzliche Schritte durchgeführt werden müssen. Dieser Ansatz reduziert den Zeitaufwand und die Variabilität zwischen den Assays, was ein erheblicher Vorteil ist, wenn man den Zweck von HTS-Assays berücksichtigt.
Beim Screening von Tausenden von Verbindungen muss ein wirksames Medikament leicht identifiziert werden können. Zu diesem Zweck wird häufig der Z'-Faktor verwendet, um die statistische Effektgröße zu messen und auf die Leistung des Assays zu schließen. Wenn der Z'-Faktor 0,5 >, sind die getesteten Bedingungen optimal, um zwischen behandelten und unbehandelten Populationen zu unterscheiden13. Die getesteten Bedingungen ergaben Z'-Faktoren > 0,6 (Abbildung 2), was statistisch beweist, dass sie auf eine Screening-Kampagne angewendet werden können. Dieser Schritt ist entscheidend, um die Wirksamkeit des Screenings zu gewährleisten.
Aus diesem Grund wurde ein HTS-Protokoll entwickelt, um die antimikrobielle Aktivität von Tausenden von Verbindungen gegen planktonwachsendes Mab nachzuweisen. Da es sich bei Mab um einen intrazellulären fakultativen Erreger handelt, schirmt das entwickelte Protokoll auch die intrazelluläre antimikrobielle Aktivität gegen denselben Bakterienstamm ab - ein entscheidender Vorteil. Darüber hinaus kann auch die Toxizität gegenüber den Wirtszellen beurteilt werden. Daher wird ein mehrstufiger Ansatz für das Wirkstoffscreening gegen Mab beschrieben, bei dem verschiedene Versuchsaufbauten verwendet werden, um die antimikrobielle Aktivität zusammen mit der Zytotoxizität zu bewerten, was die Erfolgschancen erhöht. Als Proof of Concept wurde eine chemische Bibliothek mit 1280 Verbindungen gescreent.
Insgesamt wurden dreiunddreißig Treffer identifiziert (Abbildung 3). Von diesen erhöhten drei signifikant die Lebensfähigkeit von Mykobakterien in Flüssigkulturen (Verbindungen 30, 31 und 32; Abbildung 3 und Abbildung 4). Es ist zu beachten, dass diese Verbindungen die Lumineszenzemission beeinträchtigen können, ohne die Lebensfähigkeit der Bakterien zu beeinträchtigen. Bei Tests gegen internalisierte Mykobakterien zeigten diese Verbindungen eine antimikrobielle Aktivität (Abbildung 6), was eine höhere Wirksamkeit gegen Mab nach der Internalisierung der Wirtszelle zeigte. Diese Verbindungen wurden als Troleandomycin (30), Spiramycin (32) und Lincomycin (31; Tabelle 1). Bei den ersten beiden handelt es sich um Makrolide, eine Klasse von Antibiotika, die zur Behandlung von mykobakteriellen Infektionen eingesetzt werden16, und bei letzterem handelt es sich um ein Lincosamid, ein Antibiotikum mit einem ähnlichen Wirkmechanismus wie Makrolide17. Es wurde berichtet, dass Mab sowohl in flüssigen als auch in festen Kulturen besonders resistent gegen ein anderes Lincosamid, Clindamycin, ist18. Nichtsdestotrotz wurden mit den Makroliden19,20 und Lincosamiden21 immunmodulatorische und entzündungshemmende Eigenschaften in Verbindung gebracht, was die erhöhte antimikrobielle Aktivität gegen internalisierte Mykobakterien erklären könnte (Abbildung 6).
Von den verbleibenden dreißig Treffern reduzieren elf die Lebensfähigkeit der Mykobakterien in allen Konzentrationen um >90 % (Abbildung 4). Angesichts der Tatsache, dass ein typischer HTS-Assay eine erwartete Trefferquote von ~1%22 aufweist, stimmt das entwickelte Protokoll mit dem überein, was normalerweise beobachtet wird. Nichtsdestotrotz waren mehrere andere Verbindungen noch aktiv, und achtundzwanzig wurden in den Infektionstest aufgenommen.
Von den identifizierten Verbindungen wurden fünf Verbindungen als toxisch eingestuft (Abbildung 5) - Daunorubicin (4), Doxorubicin (5), Epirubicin (27), Thiostrepton (6) und Pyrviniumpamoat (28; Tabelle 1). Bei den ersten drei handelt es sich um antineoplastische Wirkstoffe 23,24,25, so dass es nicht überrascht, dass sie für die in diesem Assay verwendeten Säugetierzellen toxisch sind. Pyrviniumpamoat wurde viele Jahre lang als wirksames Anthelminthikum verwendet; Seit 2004 wird sie jedoch auch mit antineoplastischen Aktivitäten in Verbindung gebracht26. Schließlich ist Thiostrepton ein Oligopeptid, das häufig in der Veterinärmedizin verwendet wird und nie für die Anwendung beim Menschen zugelassen wurde27. Über die Wirksamkeit dieses Arzneimittels gegen Brustkrebszellen wurde berichtet28. Die intramakrophagische Aktivität von Thiostrepton wurde aufgrund seiner Toxizität für aus dem Knochenmark gewonnene Makrophagen nicht untersucht (Abbildung 5). Es wurde jedoch gezeigt, dass Thiostrepton bei 5 μM auf Mab-infizierten THP-1-Zellen wirksam ist29. Die berichteten Ergebnisse gegen planktonische Bakterien29 ähneln denen, die in diesem Screening erzielt wurden, wobei Thiostrepton extrem wirksam ist (Abbildung 4).
Die meisten Verbindungen, die auf intramakrophagische Aktivität untersucht wurden, zeigten kein therapeutisches Potenzial (Abbildung 6). Das intrazelluläre Wachstum von Bakterien unterscheidet sich erheblich von Planktonkulturen. Bei letzterem ist immer ein direkter Kontakt zwischen Bakterien und Medikamenten möglich. Bei ersterem fungieren aufgrund der Internalisierung durch Wirtszellen mehrere Wirtsmembranen als physikalische Barrieren, die Medikamente transponieren müssen, um das Ziel zu erreichen, was die verminderte antimikrobielle Aktivität der meisten Treffer erklären kann. Bei der höchsten Konzentration von 13,3 μM zeigten drei Verbindungen eine ausreichende Wirksamkeit, um sich statistisch von der DMSO-Kontrolle zu unterscheiden (Abbildung 6) - Cefdinir (21), Gatifloxacin (26) und Moxifloxacin (29; Tabelle 1). Während Moxifloxacin bereits als Zweitlinienmedikament gegen Tuberkulose eingesetzt wird16, wird Cefdinir häufig zur Behandlung verschiedener bakterieller Infektionen der Atemwege, wie z. B. Lungenentzündung30, eingesetzt. Es wurde jedoch über seine Aktivität gegen M. tuberculosis31 und Mab berichtet, die eine starke synergistische Wirkung mit einem Carbapenem gegen letzteres zeigte32. Gatifloxacin ist ein Fluorchinolon, und seine Aktivität wurde in der Vergangenheit gegen mehrere Mykobakterien berichtet33,34. Die drei aktivsten Verbindungen in diesem Assay (Abbildung 6) waren Roxithromycin (17), Clarithromycin (22) und Rifabutin (25; Tabelle 1), die in allen Konzentrationen extrem wirksam sind. Die ersten beiden sind Makrolide, während Rifabutin ein Rifamycin ist, wobei beide Klassen als Grundlage für die Behandlung vieler mykobakterieller Infektionen dienen16.
Dieses Screening stützt sich auf spezielle und teure Liquid-Handling-Geräte, um die Variabilität zwischen den Assays zu reduzieren. Obwohl der Liquid Handler extrem reproduzierbar ist, verfügt er nicht über eine berührungslose Übertragung von Verbindungen, wie z. B. eine akustische. So können bestimmte adhärente Verbindungen zwischen den Transfers an den Metallstiften haften bleiben und in nachfolgende Vertiefungen übertragen werden, was während der Screening-Phase zu falsch positiven Ergebnissen führt - genau das war bei Verbindung 33 der Fall. Aus diesem Grund ist die Validierung des Screenings so entscheidend für seinen Erfolg, um sicherzustellen, dass keine falsch positiven Ergebnisse in die nächsten Schritte der Wirkstoffscreening-Pipeline übergehen. Der Infektionsassay verwendet ein High-Content-Bildgebungssystem mit einem konfokalen Modus, um die bestmögliche Definition der Bakterienregionen zu erhalten. Nichtsdestotrotz ist es immer noch möglich, es ohne konfokalen Modus zu verwenden, wenn auch mit einem Definitionsverlust und möglicherweise mit Schwierigkeiten bei der Identifizierung von Bakterienregionen. Dieses Protokoll nutzt die Vorteile der einfachen und benutzerfreundlichen Analysesoftware, die in das Bildgebungssystem integriert ist. Open-Source-Software kann jedoch nach dem Protokoll verwendet werden (Ergänzende Abbildung 5). Obwohl keine Medikamente zur Behandlung von Mab-Infektionen umfunktioniert werden, sind diese Ergebnisse letztendlich äußerst wichtig, da sie das etablierte Protokoll validieren, das auf größere Bibliotheken ausgeweitet werden kann. Wichtig ist, dass wir glauben, dass dieses Protokoll an alle Bakterien angepasst werden kann, vorausgesetzt, dass Fluoreszenz- oder Lumineszenzanzeigen verfügbar sind. Somit leistet diese Arbeit einen wichtigen Beitrag zur Wirkstoffforschung und liefert die notwendigen Werkzeuge, um eines der größten Probleme der öffentlichen Gesundheit zu bekämpfen - antibiotikaresistente Bakterien - und insbesondere einen fast hartnäckigen Krankheitserreger - Mycobacterium abscessus.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Arbeit wird aus portugiesischen nationalen Mitteln über FCT - Fundação para a Ciência e a Tecnologia, I.P, im Rahmen des Projekts PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) und PhD-Stipendien 2021.07335.BD an GSO und UI/BD/150830/2021 an CMB finanziert; FWO - Forschungsstiftung Flandern, Zuschuss Nr. 1S68720N; Innovative Medicine Initiative 2 Call 16 (IMI2-Call 16) Vorschlag RespiriTB unter der Vertragsnummer 853903. Die Autoren danken für die Unterstützung der i3S Scientific Platform BioSciences Screening, Mitglied der nationalen Infrastrukturen PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) und PPBI - Portuguese Platform of Bioimaging (PPBI-POCI-01-0145-FEDER-022122).
Materialien
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
Referenzen
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997 (2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179 (2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221 (2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239 (2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I., Macor, J. E. The future of drug repositioning. Annual reports in medicinal chemistry. , 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562 (2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204 (2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224 (2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866 (2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90 (2022).
- Bray, M. A., Carpenter, A., Markossian, S., et al. . Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. , (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18 (2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421 (2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202 (2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302 (2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527 (2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165 (2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249 (2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661 (2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511 (2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293 (2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten