Method Article
פיתוח Assay לבדיקת תרופות בתפוקה גבוהה נגד מיקובקטריה
In This Article
Summary
מחקר זה פיתח בדיקה לסינון בתפוקה גבוהה נגד Mycobacterium abscessus עם זן כפול של כתב שנוצר לאחרונה, תוך שימוש בפלואורסצנטיות ולומינסנציה כדי להעריך את כדאיות החיידקים במהירות. פרוטוקול זה יהיה רלוונטי לחוקרים השואפים לסנן תרופות חדשות נגד חיידק עמיד לתרופות.
Abstract
זיהומים מסוג Mycobacterium abscessus (Mab) מאתגרים לטיפול בשל עמידות גבוהה לתרופות פנימיות, בדומה לשחפת עמידה לתרופות רבות. הטיפולים מאוד לא יעילים ומבוססים על משטר תרופות רב-תרופתי, וכתוצאה מכך היענות נמוכה למטופלים. כתוצאה מכך, הקהילה המדעית נקראת לזהות תרופות חדשות ויעילות לטיפול בזיהומים אלה. אחת האסטרטגיות הננקטות למטרה זו היא ייעוד מחדש של תרופות - תהליך של זיהוי הזדמנויות טיפוליות חדשות לתרופות קיימות בשוק, תוך עקיפת הזמן הנדרש לביסוס פרופילים פרמקוקינטיים ובטיחותיים של תרופות חדשות. מכיוון שרוב המחקרים על פיתוח תרופות נגד Mab מסתמכים על שיטות מסורתיות וגוזלות זמן, פותחה בדיקה לסינון תרופות בתפוקה גבוהה נגד מיקובקטריה באמצעות זן כפול של Mab שפותח בבית. באמצעות רובוטיקה לטיפול בנוזלים, מיקרוסקופיה אוטומטית ואנליזה, לצד זני כתב כפול שפותחו בבית, ניתן למדוד במהירות את כדאיות החיידקים באמצעות שתי קריאות שונות, זוהר ופלואורסצנציה, מבלי להוסיף ריאגנטים או לבצע צעדים נוספים. זה מפחית את הזמן והשונות בין הבדיקות, יתרון משמעותי עבור הקרנות בתפוקה גבוהה. הפרוטוקול המתואר אומת על ידי סינון ספרייה של 1280 תרכובות. התוצאות שהתקבלו אומתו על ידי הספרות, עם זיהוי יעיל של חומרים פעילים. כך, עבודה זו הגשימה את המטרה לספק לתחום כלי חדש שיעזור להילחם בחיידק עמיד מאוד לתרופות.
Introduction
Mycobacterium abscessus (Mab) הוא פתוגן אופורטוניסטי האחראי לזיהומים ריאתיים, במיוחד אצל אנשים עם סיסטיק פיברוזיס והפרעות ריאה אחרות. זיהומים הנגרמים על ידי Mab הם מאתגרים לשמצה לטיפול בשל עמידות מעולה לתרופות פנימיות, בדומה לשחפת עמידה לתרופותמרובות 1. התרופות הזמינות אינן יעילות במידה רבה בשל מעטפת התא המיקובקטריאלי הבלתי חדיר ביותר וגנום המקודד מספר אנזימים המנטרלים אנטיביוטיקה2. לפיכך, הטיפול כולל שילוב של מספר תרופות האורכות חודשים עד שנים. משטר מאתגר זה של תרופות מרובות בשילוב עם היענות נמוכה למטופלים מביא לשיעור ריפוי ממוצע של 30% עד 50%3. יתר על כן, השכיחות של זיהומים ריאתיים הנגרמים על ידי מיקובקטריה שאינם שחפת עלתה במהלך העשורים האחרונים, כולל אלה הנגרמים על ידי Mab 1,4. כתוצאה מכך, הקהילה המדעית נמצאת במרוץ לפיתוח תרכובות חדשות לטיפול בזיהומי Mab.
אחת האסטרטגיות הננקטות במטרה זו היא ייעוד מחדש של תרופות - תהליך של זיהוי הזדמנויות טיפוליות חדשות לתרופות קיימות. זה עוקף את האתגר הגדול ביותר המלווה את צנרת הגילוי והפיתוח של תרופה חדשה - זמן5. רעיון פשוט זה מנצל את פרופילי הפרמקוקינטיקה והבטיחות שכבר נקבעו של מספר תרופות כדי להפחית את עלויות הפיתוח ולקצר את ציר הזמן שלוקח לקבל תרופה מספסל למיטה6. לפיכך, נאספו ספריות המשלבות מאות עד אלפי תרכובות כאלה, ומאפשרות לחוקרים לבחון במהירות את האפשרות של ייעוד מחדש של תרופות כנגד הפתוגן המעניין אותן.
רוב המחקרים על פיתוח תרופות נגד Mab מבוססים על בדיקה סטנדרטית אך מסורתית המעריכה את פעילות התרכובת במבחנה כנגד מיקובקטריה - יחידות יוצרות מושבה הסופרות7. למרות הדיוק שלו, הליך זה גוזל זמן רב, והופך במהירות ללא ישים כאשר מישהו שואף לבדוק ספריות המכילות אלפי תרכובות. לשם כך, בדיקות סקר בתפוקה גבוהה (HTS) שולבו בפיתוח תרופות - בדיקות חזקות המנצלות את הרובוטיקה והתקני הטיפול בנוזלים, ומאפשרות סינון מהיר של אלפי תרכובות במקביל8. זה נעשה בדרך כלל על ידי בדיקת ריכוז יחיד בתחילה, באמצעות לוחות microtiter של 96, 384-, 1536-, או 3456-- פורמטים באר, המשמש כנקודת מוצא לזהות פגיעות ולייעל אותם עוד יותר במורד הצינור לשימוש קליני.
מבדקים מבוססי כתב מספקים יתרון משמעותי לחוסן של HTS בשל פשטותם ורגישותם בהשוואה למבחני צבע וספיגה אחרים 7,9. עם זאת, למיטב ידיעתנו, רק מחקרים מעטים הצליחו לבצע אופטימיזציה של סינון בתפוקה גבוהה כנגד Mab9.
לאחרונה, המעבדה שלנו פיתחה זנים כפולים המסוגלים לפלוט במקביל זוהר ופלואורסצנטיות10. Mab operon_mScarlet הוא אחד הזנים האלה. הוא זוהר אוטומטית בשל ביטוי אופרון LuxABCDE , הכולל לוציפראז חיידקי (על ידי ביטוי של גנים luxAB ) ומצע אלדהיד ארוך שרשרת (על ידי ביטוי של גנים luxCADE ). מצד שני, הקריאה הפלואורסצנטית מתקבלת באמצעות ביטוי של חלבון פלואורסצנטי אדום שפותח לאחרונה, mScarlet, אשר עולה בביצועיו על חלבוני eGFP ו- mCherry המשמשים בדרך כלל, ומספק אותחזק יותר 11. שימוש בזן זה מאפשר לנו להעריך את כדאיות החיידקים בתרבית נוזלית על ידי מדידת האות הזוהר בקורא מיקרו-צלחות מבלי להוסיף ריאגנטים או לבצע צעדים נוספים. מבחינת זיהוי, פלואורסצנטיות פנימית מאפשרת הדמיה של מיקרוסקופ בתאים חיים או קבועים ללא שימוש בצבעים או נוגדנים. קיומו של זן אחד בודד עם שתי הקריאות מספק לחוקרים יתרון משמעותי בעת השימוש בו במבחני HTS - השונות המופחתת בין בדיקות עם קריאות שונות, שכן אין צורך להחליף זנים בהתבסס על אופי הבדיקה.
לפיכך, עבודה זו פיתחה מבחן תפוקה גבוהה כנגד Mab באמצעות זן מהונדס כפול פנימי (איור 1). זה איפשר הערכה מהירה של פעילות חוץ גופית 1280 תרופות המיועדות לייעוד מחדש באמצעות ספרייה מסחרית (ראה טבלת חומרים). ראשית, הפעילויות הוערכו בבדיקת תרבית מרק באמצעות זוהר, ושנית, על ידי שימוש במקרופאגים נגועים ב-Mab תוך ניצול האות הפלואורסצנטי, חיקוי טוב יותר של תהליך ההדבקה שנראה in vivo12.
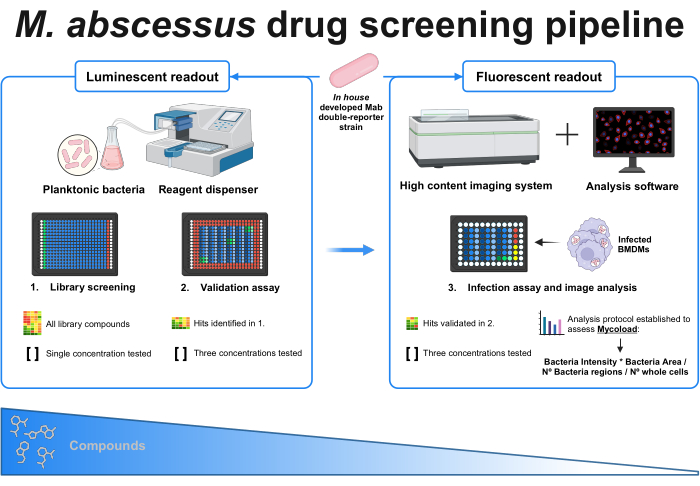
איור 1: תקציר גרפי של הפרוטוקול שנקבע. שחקן המפתח בסינון זה הוא זן מיקובקטריאלי כפול שפותח בבית , המשמש לאורך כל הניסויים. ראשית, באמצעות מתקן מגיב וחיידקים פלנקטוניים, סינון ראשוני מבוצע על ידי בדיקת התרכובות בריכוז יחיד. הפגיעות שזוהו ממשיכות לבדיקת התיקוף, שם נבדקים שלושה ריכוזים שונים. שני הניסויים נעשים באמצעות קריאה זוהרת. הפגיעות המאומתות ממשיכות לבדיקת הזיהום, שם נבדקים גם שלושה ריכוזים שונים, ומקרופאגים שמקורם במח עצם נדבקים ב-MOI 1. מערכת הדמיה בעלת תוכן גבוה רוכשת את האות הפלואורסצנטי של החיידקים, ותוכנת ניתוח משמשת להערכת העומס התוך תאי באמצעות נוסחת Mycoload. מספר התרכובות פוחת ככל שמורכבות הבדיקה גדלה. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
כל נהלי בעלי החיים אושרו על ידי הוועדה המקומית לאתיקה של בעלי חיים של i3S ואושרו על ידי המנהל הכללי של הרשות הפורטוגזית למזון ווטרינרי (DGAV), בעקבות דירקטיבת המועצה האירופית (2010/63/EU) והחוק הפורטוגלי (DL 113/2013) לרווחת בעלי חיים בניסויים.
1. הערכת גורם Z'
הערה: כדי להעריך את הביצועים של בדיקת HTS, ניתן לקבוע מספר פרמטרים. הפרמטר הנפוץ ביותר הוא גורם Z ראשוני (גורם Z). מדד זה מודד את גודל ההשפעה הסטטיסטית של ניסוי נתון, ומציין עד כמה הבקרות החיוביות והשליליות מופרדות. אם פקטור Z נע בין 0.5 ל-1, ההפרדה בין שתי האוכלוסיות מצוינת, וניתן להשתמש בתנאים אלה בבדיקת HTS. אם Z' < 0.5, ההפרדה היא שולית בלבד, ולא מומלץ לבצע את הבדיקה13. כך, תוכנן ניסוי שהשתמש בחצי צלחת עם חיידקים שלא טופלו ובחצי השני עם בקרה חיובית כדי לחשב את גורם Z (איור משלים 1).
- ב 2-3 ימים לפני הבדיקה, להכין תרביות מראש של Mab על ידי חיסון חיידקים במדיום גידול נוזלי (בערך 1 x 107 CFU/mL) בצלוחית Erlenmeyer. השאירו את החיידקים לגדול ב 37 מעלות צלזיוס באינקובטור עם תסיסה (90 סל"ד).
זהירות: ארון בטיחות ביולוגית נדרש בעת עבודה עם תרביות Mab. - עקבו אחר הצמיחה של התרבות הקדם-תרבותית של Mab על ידי מדידת צפיפות אופטית ב-600 ננומטר באמצעות ספקטרופוטומטר. כאשר התרבות מגיעה לשלב הצמיחה המעריכית, המשך לשלב 1.3.
- באמצעות תרבית קדם-תרבית מעריכית, הכינו תרחיף חיידקי של כ-5 x 105 יחידות יוצרות מושבה/מ"ל (בקורלציה עם ערכי צפיפות אופטית)14 במדיום גידול נוזלי.
- הכינו תמיסה של בקרה חיובית של עיכוב צמיחת חיידקים במדיום גידול נוזלי. עבור בדיקה זו, הבקרה החיובית הייתה clarithromycin (10 מ"ג / מ"ל ב DMSO) ב 4 מיקרוגרם / מ"ל. Clarithromycin חייב להיות מוכן 2x את הריכוז הסופי הרצוי.
- באמצעות מתקן מגיב microplate מצויד קלטת קטנה, לחלק 15 μL של מדיום גידול נוזלי עמודות ריקות ולא מטופלות של צלחת פוליפרופילן שחור 384-באר. עבור העמודות הריקות, יש להוציא 15 מיקרוליטר נוספים של מדיום גידול נוזלי.
הערה: העמודים הריקים מונעים אידוי של הבארות הפנימיות ב 37 ° C. - עם מתקן מגיב microplate מצויד קלטת קטנה, לחלק 15 μL של פתרון הבקרה החיובית מוכן בשלב 1.4 עמודות הבקרה החיובית.
- עם מתקן מגיב microplate מצויד קסטה גדולה, לחלק 15 μL של מתלה חיידקי מוכן בשלב 1.3 לכל העמודות למעט ריק, מדלל הכל 1: 2. הנפח הסופי של כל 384 הבארות הוא 30 μL.
הערה: מתקן מגיב microplate יכול להיות מצויד קלטת גדולה או קטנה, שונה בגודל צינורות (0.5 ו 0.22 מ"מ, בהתאמה). עדיף להשתמש בקלטת גדולה יותר כדי למנוע הצטברות חיידקים במערכת הצינורות, למרות שהתוצאה היא בזבוז נוזלים רב יותר. עם זאת, ניתן להשתמש באותה קלטת לאורך כל הבדיקה. - אטמו כל צלחת עם אטם פלטות המאפשר החלפת גזים רציפה. לדגור ב 37 מעלות צלזיוס באינקובטור ללא תסיסה בתוך תא לח במשך 48 שעות.
- לאחר 48 שעות, קרא את עוצמת האור הנפלטת על ידי החיידקים בכל צלחת באמצעות קורא לוחות עם זמן אינטגרציה של 1 שניות.
- כדי לקבוע את גורם Z', השתמש בערכים המתקבלים בשלב 1.9 וחשב את הממוצע וסטיית התקן של הפקדים החיוביים (AVG P ו- SDP) והשליליים (AVGN ו- SDN). לאחר מכן, החל את הנוסחה הבאה:
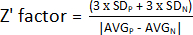
הערה: 3 x SD הוא סף נפוץ; עם זאת, ניתן להתאים אותו כך שיתאים טוב יותר לבדיקה - על ידי הגדלה או הקטנה של הגורם שבאמצעותו ניתן להכפיל את סטיית התקן.
2. סינון ספריה ללהיטים
הערה: הבדיקות הראשונות בוצעו נגד חיידקים הגדלים בתרבית נוזלית. ההתקנה תוכננה עבור לוחות 384 בארות עם 30 μL של נפח סופי. כל צלחת הכילה בארות ריקות (מדיום גידול נוזלי בלבד), בקרות שליליות (חיידקים שאינם מטופלים) ובקרת ממסים (חיידקים בתוספת ממס של תרכובת - במקרה זה, DMSO; תרשים משלים 2). התרכובות או הממסים נוספו לצלחת בריכוז הסופי פי 2 מהריכוז הסופי הרצוי, וחיידקים נוספו ביחס של 1:1 (דילול הכל לחצי).
- הכינו תרחיף חיידקי כמתואר בשלבים 1.1 עד 1.3.
זהירות: ארון בטיחות ביולוגית נדרש בעת עבודה עם תרביות Mab. - הכינו תמיסה של ממס במדיום גידול נוזלי. כמות הממס חייבת להיות פי 2 מהריכוז הסופי הרצוי.
- באמצעות מתקן מגיב microplate מצויד קסטה קטנה, לחלק 15 μL של מדיום גידול נוזלי לכל עמודה של לוחות פוליפרופילן שחור 384-באר, למעט עמוד הבקרה ממס. עבור עמודות ריקות, יש להוציא 15 μL נוספים של מדיום גידול נוזלי.
- עם מתקן מגיב microplate מצויד קלטת קטנה, לחלק 15 μL של פתרון ממס מוכן בעבר עמוד הבקרה ממס.
- באמצעות מטפל נוזלי, העבר 200 nL של תרכובות מן מלאי 96 בארות לוחות (1 mM ב DMSO) אל לוחות 384 בארות, למעט החסר, בקרת ממס, עמודות לא מטופלות. התרכובות נמצאות כעת בריכוז של 13.3 מיקרומטר.
- עם מתקן מגיב microplate מצויד קסטה גדולה, לוותר 15 μL של מתלה חיידקי מוכן בשלב 2.1 לכל העמודות למעט ריק, מדלל הכל 1: 2. הנפח הסופי של כל 384 הבארות הוא 30 μL, וכל תרכובת היא 6.66 μM.
- אטמו כל צלחת עם אטם פלטות המאפשר החלפת גזים רציפה.
הערה: הבדיקה יכולה להיעשות עם מכסים רגילים; עם זאת, קיימת אפשרות גבוהה יותר להשפעות קצה חזקות יותר. - לדגור ב 37 מעלות צלזיוס באינקובטור ללא תסיסה בתוך תא לח במשך 48 שעות.
- לאחר 48 שעות, קרא את עוצמת האור הנפלטת על ידי החיידקים בכל צלחת באמצעות קורא לוחות עם זמן אינטגרציה של 1 שניות.
3. ניתוח נתוני סינון להיטים
הערה: כדי לזהות פגיעות עם נתוני ההארה שנרכשו, יש לנרמל את הערכים לממס שבו מומסות התרכובות, ואם הוא מתרחש, לאפקט הקצה המאומת על לוחות 384 מיקרוטיטר.
- עבור נורמליזציה ממס של הנתונים המתקבלים בשלב 2.9, לחלק את יחידות האור היחסי של כל באר (RLU) על ידי RLU הממוצע של בארות בקרת ממס (בלוח המתאים). בבדיקה זו אומת אפקט קצה חזק לקראת אמצע לוחות ההקרנה; לפיכך, הוחלט לנרמל את כל הנתונים עבור זה. לשם כך, התהליך נעשה באופן דו-שלבי, כמתואר להלן.
- צרו מסיכת אפקט קצוות באמצעות חלוקת הערכים המתקבלים בשלב 3.1 למיקומים המתאימים, למעט כניסות, בכל הלוחות (לוח 1 - P1, לוח 2 - P2, לוח 3 - P3, לוח 4 - P4). לדוגמה, עבור מיקומי A1 ו- A2, Mask_A1 = ממוצע (P1_A1; P2_A1; P3_A1; P4_A1); Mask_A2 = ממוצע (P1_A2; P2_A2; P4_A2) [P3_A2 הוחרג כי זה היה להיט].
- חלק את הערכים המתקבלים בשלב 3.1. על ידי מסיכת אפקט הקצה שלה המתקבלת בשלב 3.1.1. לדוגמה,
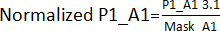 . לאחר מכן, חשב את AVG ו- SD של כל צלחת כדי לקבוע סף (AVG ± 3SD) עבור כל לוחית. כל מתחם שנמצא מחוץ לסף זה נחשב להיט וממשיך למבחן אימות הפגיעה.
. לאחר מכן, חשב את AVG ו- SD של כל צלחת כדי לקבוע סף (AVG ± 3SD) עבור כל לוחית. כל מתחם שנמצא מחוץ לסף זה נחשב להיט וממשיך למבחן אימות הפגיעה.
4. בדיקת אימות מכה
הערה: לאחר זיהוי פגיעות, יש לאמת אותן באמצעות ריכוזים שונים. בדיקת האימות משתמשת בהגדרה דומה עם אותם פקדים, אך כל מכה תהיה נתונה לדילול סדרתי של 1:2. בבדיקה זו נעשה שימוש בשלושה ריכוזים - 13.3 מיקרומטר, 6.66 מיקרומטר ו-3.3 מיקרומטר. בקרות הממס יכילו את אותו אחוז ממס כמו כל באר תרכובת (איור משלים 3).
- הכינו תרחיף חיידקי כמתואר בשלבים 1.1 עד 1.3.
זהירות: ארון בטיחות ביולוגית נדרש בעת עבודה עם תרביות Mab. - באמצעות מתקן מגיב microplate מצויד קלטת קטנה, לחלק 15 μL של מדיום גידול נוזלי לכל עמוד של צלחת פוליפרופילן שחור 384-באר. עבור בארות ריקות, יש לפזר 15 מיקרוליטר נוספים של מדיום גידול נוזלי לעמודה הראשונה והאחרונה.
- עם מתקן מגיב microplate, לפזר 15 μL נוספים של מדיום גידול נוזלי לעמודות המכילות את [μM] הגבוה ביותר של כל תרכובת.
- מתוך מלאי 96 בארות צלחות, פיפטה ידנית 0.8 μL של כל מכה (1 mM ב DMSO) לתוך הבארות שלהם בהתאמה משלב 4.3, כפול. התרכובות נמצאות כעת בריכוז של 26.6 מיקרומטר.
- פיפטה ידנית 0.8 μL של ממס לתוך בארות הבקרה כפול (זהה לשלב 4.4).
- באמצעות מיקרופיפטה רב ערוצית, בצע שני דילולים טוריים ביחס של 1:2 לכל תרכובת ובקרת ממס. יש להשליך את הכמות העולה על 15 μL לאחר הדילול הטורי האחרון. בכל הבארות יש כיום 15 μL, וריכוזי התרכובות הם 26.6 μM, 13.3 μM ו-6.66 μM.
- באמצעות מתקן מגיב microplate עם קסטה גדולה, לחלק 15 μL של תרחיף חיידקי מוכן 4.1 לכל העמודות (למעט בארות ריקות), מדלל את תרכובות 1: 2. לכל הבארות יש נפח סופי של 30 μL, וכל תרכובת היא ב 13.3 μM, 6.66 μM, ו 3.3 μM.
- אטמו את הצלחת עם אוטם פלטות המאפשר החלפת גזים רציפה. לדגור ב 37 מעלות צלזיוס באינקובטור ללא תסיסה בתוך תא לח במשך 48 שעות.
- לאחר 48 שעות, קראו את עוצמת האור הנפלטת על ידי החיידקים בכל צלחת עם זמן אינטגרציה של 1 שניות באמצעות קורא לוחות.
5. בדיקת זיהום
הערה: Mab הוא פתוגן פקולטטיבי תוך תאי, ולכן הפעילות האנטי-מיקרוביאלית של הפגיעות ורעילות המאכסן חייבות להיקבע בבדיקות זיהום. לשם כך, מקרופאגים שמקורם במח עצם (BMM) היו נגועים ב-Mab וטופלו בפגיעות שאומתו בשלב 4 בריכוזים שונים. כל בדיקה כללה בקרות ריקות (מים בלבד), בקרות שליליות (מקרופאגים נגועים שלא טופלו), בקרות חיוביות (מקרופאגים נגועים שטופלו באנטיביוטיקה יעילה), בקרות ממס (במקרה זה, DMSO), והתרכובות שנבדקו בשלושה ריכוזים - 13.3 מיקרומטר, 6.66 מיקרומטר ו-3.3 מיקרומטר (איור משלים 4).
- להפיק מקרופאגים ממח עצם מורין של עכברים בוגרים מסוג בר (BALB/c או C57BL/6), כפי שתואר קודם15. לוחים את התאים על צלחת שטוחה 96 באר, שחורה ושקופה אופטית ב 2 x 105 תאים / מ"ל, 200 μL לכל באר. לאחר 10 ימים של התמיינות ב 37 ° C, 7% CO215, התאים מוכנים להדביק ולהמשיך בטיפול.
הערה: הפרוטוקול לקבלת מקרופאגים שמקורם במח עצם מבוסס היטב15; עם זאת, פרוטוקול סינון זה יכול להיות מותאם לתאים אחרים, כגון RAW 264.7, THP-1 ומקרופאגים שמקורם ב-PBMC. - הכינו תרחיף חיידקי כמתואר בשלבים 1.1 עד 1.3, התאמת התרחיף החיידקי בתווך תרבית התאים לזיהום עם ריבוי זיהום (MOI) של 1.
זהירות: ארון בטיחות ביולוגית נדרש בעת עבודה עם תרביות Mab. - בזהירות לשאוף את המדיום תרבית תאים בתוספת של הבארות באמצעות משאבת ואקום מחובר פיפטה זכוכית. שלב זה צריך להתבצע לאט ובקלות כדי למנוע ניתוק תאים.
- פיפטה ידנית 75 μL של תרחיף חיידקי מוכן בשלב 5.2 לכל באר. לדגור על הצלחת ב 37 ° C עם 7% CO2 במשך 4 שעות באינקובטור התא.
- הכינו את התרכובות לטיפול בתאים. באמצעות מתקן מגיב מיקרו-צלחות המצויד בקלטת קטנה, יש לחלק לפוליפרופילן, תחתית עגולה, לוחות 96 בארות, 110 מיקרוליטר של תרבית תאים משלימה בינונית לעמודות שבהן יהיו תרכובות או בקרת ממס (איור משלים 4).
- באמצעות מתקן מגיב microplate, לפזר תוספת של 104 μL של מדיום תרבית תאים בתוספת לעמודות שבהן יהיה הריכוז הגבוה ביותר של תרכובת או ממס.
- פיפטה ידנית 5.9 μL של תרכובות (1 mM ב DMSO) או ממס לתוך בארות ייעודי שלהם (עמודות בשלב 5.6). התרכובות נמצאות כעת בריכוז של 26.6 מיקרומטר.
- באמצעות מיקרופיפטה רב ערוצית, בצע שני דילולים טוריים 1:2 עבור כל תרכובת וממס. יש להשליך את הכמות העולה על 110 מיקרוליטר לאחר הדילול הטורי האחרון. בכל הבארות יש כיום 110 μL, והתרכובות נמצאות בריכוז של 26.6 μM, 13.3 μM ו-6.66 μM.
- באמצעות מתקן מגיב microplate, לחלק 110 μL של תוספת תרבית תאים מדיום לכל העמודות (למעט בארות ריקות). בכל הבארות יש כיום 220 μL, והתרכובות נמצאות בריכוז של 13.3 μM, 6.66 μM ו-3.3 μM.
- הכינו תמיסה של clarithromycin (בקרה חיובית) ב 2 מיקרוגרם / מ"ל בתווך תרבית תאים מוסף.
- ב 4 שעות לאחר שלב 5.4, באמצעות מכונת כביסה צלחות, לשטוף 3x עם 200 μL של תמיסת שטיפת זיהום צלחת 96 באר נגוע. שמור על השאיפה וחלק את המהירויות לאיטיות ביותר האפשרית כדי למנוע ניתוק תאים.
- לאחר השאיפה הסופית, להעביר 200 μL של תרכובות מוכן בשלבים 5.5-5.9 לצלחת 96 באר המכילה את המקרופאגים נגועים.
- להעביר 200 μL של מדיום תרבית תאים בתוספת לבארות שאינן מטופלות. העבר 200 μL של תמיסת clarithromycin מוכן בשלב 5.10 לבארות בהתאמה.
- לדגור על הצלחת באינקובטור תאים ב 37 ° C, עם 7% CO2, במשך 48 שעות.
- לאחר 48 שעות, שטפו את הצלחת הנגועה עם 96 בארות באמצעות מכונת כביסה עם תמיסת הכביסה של התרכובת (3x עם 200 μL לבאר).
- באמצעות micropipette רב ערוצי, לחלק 200 μL של פתרון קיבוע לכל הבארות ולתת לו לפעול במשך 10 דקות.
- לאחר הקיבוע, באמצעות מכונת כביסה, לשטוף את התאים עם תמיסת הכביסה של תרכובות (3x עם 200 μL לכל באר).
הערה: ניתן להשהות את הפרוטוקול כאן. ניתן לאחסן את התאים בתמיסת השטיפה של התרכובות בטמפרטורה של 4°C למשך מספר ימים או שבועות אם נמנעים זיהום ויובש בתאים. יש לשאוף את תמיסת השטיפה של התרכובת לפני שלב 5.18. - באמצעות micropipette רב ערוצי, לחלק 200 μL של פתרון permebilizing לכל הבארות ולתת לו לפעול במשך 15 דקות. באמצעות מכונת כביסה לצלחות, שואפים את הפתרון מחלחל.
- באמצעות מיקרופיפטה רב ערוצית, מוציאים ידנית 100 μL מתמיסת הצביעה ודגרים על הצלחות בטמפרטורת החדר למשך 30 דקות.
- בעזרת מכונת כביסה, שטפו את הצלחות בתמיסת הכביסה של התרכובת (פי 3 עם 200 מיקרוליטר לבאר). בסופו של דבר, השאירו את התאים המוכתמים בתמיסת השטיפה של התרכובות.
- מסך את הלוחות במערכת הדמיה בעלת תוכן גבוה עם ההגדרות הבאות:
מטרה: 20x Air/0.4NA (באר אחת של צלחת 96 מיקרוטיטר, 57 שדות ראייה (FOV)
מצב: Confocal
לייזר 405 ננומטר עבור DAPI (גרעינים)
לייזר 561 ננומטר עבור mScarlet (חיידקים)
לייזר 640 ננומטר עבור מסכת תאי HCS אדום עמוק (ציטופלסמה)
ללא מחסנית z
הערה: ניתן לצלם את התאים באמצעות מערכת הדמיה בשדה רחב, מה שמקטין את ההגדרה. - הגדירו רובוט לטיפול בציוד לרכישת תמונות בן לילה. זרוע רובוטית זו מחליפה את הלוחות במערכת ההדמיה בעלת התוכן הגבוה ללא התערבות אנושית.
הערה: זה לא חובה; ניתן להחליף צלחות באופן ידני.
6. ניתוח תמונות
הערה: ניתוח התמונה מתבצע באמצעות תוכנת הניתוח, הזהה למערכת ההדמיה בעלת התוכן הגבוה המשמשת להשגת התמונות. יש ליצור צינור ניתוח באמצעות תמונות לדוגמה (איור משלים 5). לאחר מכן, הוא יוחל על כל הבאר (57 FOV) ועל מערך הנתונים (כל הלוחות). תוכנת הניתוח עוקבת אחר רצף לוגי של שלבים, החל מפילוח אזורי העניין השונים (גרעינים, ציטופלסמה, תאים וחיידקים), קישור ביניהם (למשל, חיידקים בתוך תאים), ולאחר מכן חילוץ תכונות מורפולוגיות ועוצמה (למשל, שטח, עוצמה). השלבים החיוניים של ניתוח התמונה מתוארים להלן. ניתן למצוא את הפרוטוקול המלא שנעשה בו שימוש באיור משלים 5.
- פלחו את הגרעינים באמצעות אות DAPI, את הציטופלסמה באמצעות האות DeepRed ואת החיידקים באמצעות האות mScarlet.
- קשרו את פילוח הגרעינים והציטופלזמה ליצירת מסיכה לתאים.
- הסר את כל אובייקטי הגבול. רק תאים המופיעים כמלאים ב- FOV ייחשבו (תאים שלמים).
- הגדרת אוכלוסיית פלט חיידקים בתאים שלמים על ידי קישור תאים שלמים וחיידקים.
- הגדירו תאים שלמים נגועים כבעלי יותר מאזור חיידקים אחד ותאים שלמים שאינם נגועים כבעלי פחות מאזור חיידקים אחד.
- לאחר שכל אזורי העניין מפולחים והאוכלוסיות נוצרות, מחשבים ומחלצים את תכונותיהם. המאפיינים הבאים מופקים עבור כל באר.
- עבור תאים שלמים/ תאים שלמים נגועים/ תאים שלמים שאינם נגועים, חלצו
מספר התאים (סכום לבאר)
שטח [μm2] (ממוצע + סטיית תקן לכל באר)
יחס רוחב-אורך תא (ממוצע + סטיית תקן לכל באר) - עבור חיידקים בתאים שלמים, לחלץ
מספר אזורי החיידקים שזוהו (סכום לבאר)
עוצמה (סכום לבאר מהעוצמה הממוצעת של כל אזור)
אזור האזור (סכום לבאר)
- עבור תאים שלמים/ תאים שלמים נגועים/ תאים שלמים שאינם נגועים, חלצו
- לאחר ייצוא הנתונים ואגירתם בגיליון אלקטרוני, כמת עומס תוך תאי (Mycoload) לפי הנוסחה הבאה:
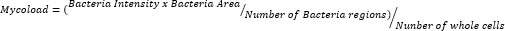
תוצאות
הערכת גורם Z'
איור 2 מתאר את הנתונים של אחד מכל שני ניסויים שבוצעו כדי לחשב את גורם Z. הבקרה החיובית הייתה clarithromycin ב 4 מיקרוגרם / מ"ל. שני הניסויים הניבו גורמי Z של 0.64 ו-0.62, כלומר ניתן להחיל את התנאים והקריאה ששימשו לבדיקה זו על בדיקת הסינון שבאה לאחר מכן (Z' >-0.5). עם זאת, גורם Z' חושב עבור כל הניסויים הנותרים (בדיקת זיהום) כדי לשלוט בביצועים של כל ניסוי.
כהוכחת היתכנות של בדיקת HTS המתוכננת, נבדקה ספרייה של תרכובות המיועדות לייעוד מחדש של תרופות. הוא כולל 1280 מולקולות מגוונות וקטנות, 95% מהן הן תרופות מאושרות FDA ו- EMA. מולקולות אלה מציעות מגוון כימי ופרמקולוגי גבוה.
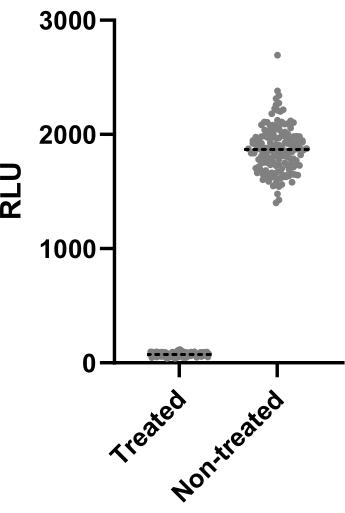
איור 2: תוצאות הערכת גורם Z. Mab ב 2.5 x 105 CFUs / מ"ל הודגר עם וללא clarithromycin ב 4 מיקרוגרם / מ"ל במשך 48 שעות ב 37 ° C. לאחר תקופת הדגירה, נמדדה ההארה כדי להעריך את הכדאיות המיקובקטריאלית. הגרף מציג את ערכי ההארה הבודדים של מיקובקטריה בת קיימא שטופלה ולא טופלה בניסוי עצמאי אחד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הקרנת להיטים בספרייה
כל התרכובות נבדקו ב-6.66 מיקרומטר כנגד Mab. בשל גודלה של הספרייה, התרכובות חולקו לארבעה לוחות מיקרוטיטר שונים בעלי 384 בארות (איור 3A-D). התוצאות נורמלו הן עבור הממס והן עבור אפקט הקצה המאומת.
בבדיקת הסקר הזו זוהו שלושים ושלוש פגיעות, שלושים מהן הפחיתו באופן משמעותי את פליטת ההארה, מה שהפחית את הכדאיות המיקובקטריאלית (איור 3). באופן מעניין, שלוש תרכובות הובילו לפליטת אור גבוהה יותר, שייתכן שהיא קשורה למטבוליזם מוגבר של חיידקים או להתפשטות (איור 3). כל 33 הפגיעות הועברו לבדיקת התיקוף, כולל שלוש התרכובות שהגבירו את עוצמת ההארה, כדי לבדוק אם פרופיל זה יישמר.
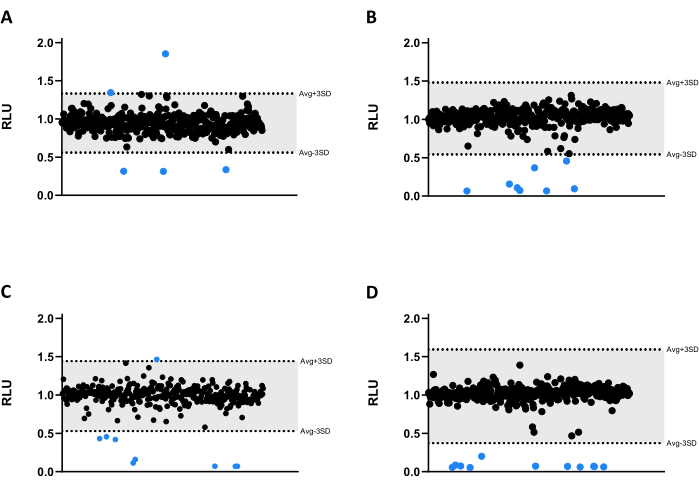
איור 3: תוצאות סינון הספרייה. (A-D) Mab ב 2.5 x 105 CFUs / מ"ל הודגר עם 1280 תרכובות ב 6.66 מיקרומטר במשך 48 שעות ב 37 ° C. לאחר הדגירה, נמדדה ההארה כדי להעריך את הכדאיות המיקובקטריאלית. הגרפים מראים את ה-RLU של ניסוי עצמאי אחד, המוצג כיחידות שרירותיות לאחר נורמליזציה של ממס ואפקט קצה. ה-AVG RLU וה-SD המתאים לו חושבו עבור כל לוח כדי לקבוע סף (באפור; AVG ± 3SD). סמלים עגולים מייצגים תרכובת שנבדקה. בכחול, כל מתחם מחוץ לסף זה נחשב להיט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בדיקת אימות מכה
הריכוזים ששימשו לבדיקה זו היו 13.3 מיקרומטר, 6.66 מיקרומטר ו-3.3 מיקרומטר. כל תרכובת נבדקה בשכפול כדי להגביר את החוסן.
חשוב לציין שתרכובות 30, 31 ו-32, שהיו קשורות בעבר ל-RLU גבוה יותר (איור 3A,C), שמרו על הפרופיל הזה, כאשר יותר מ-200% מהכדאיות המיקובקטריאלית הושגה בבארות שטופלו בתרכובת 32 (איור 4).
תרכובות 20 ו-33 נחשבו לא פעילות, מאחר שהכדאיות המיקובקטריאלית קרובה ל-100% בכל הריכוזים שנבדקו (איור 4).
תרכובות 9 ו-21 הציגו חוסר פעילות דומה בשני הריכוזים הנמוכים ביותר; אולם בניגוד ל-20, הם נשארים פעילים ברמות הגבוהות ביותר, 13.3 מיקרומטר, כאשר תרכובת 21 מפגינה עוצמה גבוהה יותר (איור 4).
תרכובת 3 מציגה גם חוסר פעילות בריכוז הנמוך ביותר ואובדן פעילות ב-6.66 מיקרומטר, אם כי פחות מתרכובת 21 (איור 4). רק בריכוז הנמוך ביותר, תרכובות 2, 7, 8, 10, 16, 18, 24 ו-28 הציגו פוטנציאל טיפולי נמוך יותר. עם זאת, 2, 10 ו-28 עדיין מובילים ל-<50% מהכדאיות המיקובקטריאלית.
ברחבי העולם, ארבעה-עשר התרכובות הנותרות היו פעילות בכל הריכוזים שנבדקו.
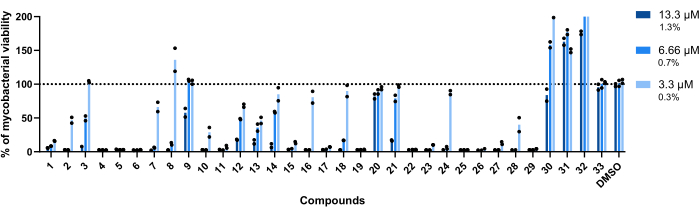
איור 4: פגע בתוצאות בדיקת התיקוף. Mab ב 2.5 x 105 CFUs/mL הודגר עם כל פגיעה שזוהתה בעבר ב 13.3 μM, 6.66 μM, ו 3.3 μM (1.3%, 0.7%, ו 0.3% של DMSO, בהתאמה) במשך 48 שעות ב 37 ° C. לאחר תקופת הדגירה, נמדדה ההארה כדי להעריך את הכדאיות המיקובקטריאלית. הגרף מציג את אחוזי המיקובקטריה הקיימים שטופלו ביחס למיקובקטריה הלא מטופלת בניסוי עצמאי אחד, כאשר כל תרכובת נבדקה בכפולות. סמלים עגולים מייצגים את הכפילויות של כל תרכובת. עמודות מייצגות את הממוצע של כפילויות אלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בדיקת זיהום
מתוך שלושים ושלוש תרכובות שנבדקו, עשרים ושמונה נבחרו לבדיקת הזיהום (איור 4). מתחמים 7, 8, 9, 20 ו-33 לא נבחרו לבדיקה זו. בעוד 9, 20 ו-33 נותרו בחוץ בשל חוסר הפעילות שלהם כאשר אומתו (איור 4), שני הראשונים נותרו בחוץ מסיבות טכניות. עם זאת, תרכובות אלה זוהו כרימפיצין ולינזוליד, אנטיביוטיקה שכבר שימשה לטיפול בזיהומי Mab12. כל התרכובות שנבדקו בבדיקת הזיהום זוהו ומפורטות בטבלה 1. הפעילות האנטי-מיקרוביאלית של התרכובות נגד מקרופאגים נגועים ב-Mab הוערכה על-ידי שימוש בפלואורסצנטיות הפנימית של החיידקים כקריאה.
| תרכובת | שם | תרכובת | שם |
| 1 | סולפטיאזול | 18 | צפורוקסימה |
| 2 | ציפרופלוקסצין | 19 | ריפקסימין |
| 3 | Cefotaxime | 21 | צפדיניר |
| 4 | דאונורוביצין | 22 | קלריתרומיצין |
| 5 | דוקסורוביצין | 23 | בסיפלוקסצין |
| 6 | תיאוסטרפטון | 24 | לבופלוקסצין |
| 10 | אמיקצין | 25 | ריפאבוטין |
| 11 | מוקסלקטם | 26 | גטיפלוקסצין |
| 12 | Sulfamethizole | 27 | אפירוביצין |
| 13 | סולפמונומתוקסין | 28 | פירוויניום פמואט |
| 14 | צפוקסטין | 29 | מוקסיפלוקסצין |
| 15 | נובוביוצין | 30 | טרולאנדומיצין |
| 16 | Cefmetazole | 31 | לינקומיצין |
| 17 | רוקסיתרומיצין | 32 | ספירמיצין |
טבלה 1: רשימת התרכובות שנבדקו בבדיקת הזיהום. התרכובות שאומתו בשלב 4 נבדקו בבדיקת הזיהום (שלב 5).
רעילות התרכובות כלפי מקרופאגים נגועים ב-Mab הייתה הפרמטר הראשון שהוערך. הסף שנקבע כדי להגדיר תרכובת כרעילה או לא רעילה היה 85% מהמקרופאגים בני קיימא (איור 5). מתוך עשרים ושמונה התרכובות שנבדקו, 4, 5, 6, 27 ו-28 הוגדרו רעילות. (איור 5). לפיכך, חמש תרכובות אלה לא נכללו בהערכת הפעילות התוך-מקרופגית הבאה.
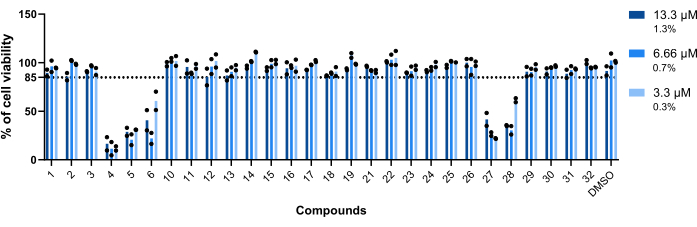
איור 5: רעילות פגיעות כלפי מקרופאגים נגועים ב-Mab. עכברי BALB/c BMM היו נגועים ב-Mab (MOI=1) והודגרו עם כל פגיעה שזוהתה קודם לכן ב-13.3 מיקרומטר, 6.66 מיקרומטר ו-3.3 מיקרומטר (1.3%, 0.7% ו-0.3% מ-DMSO, בהתאמה) במשך 48 שעות ב-37°C עם 7% CO2. התאים צולמו במיקרוסקופ פלואורסצנטי בעל תוכן גבוה, תוך שימוש במספר הגרעינים (המוכתמים ב-DAPI) כדי למדוד את כדאיות התא. הגרף מציג את אחוזי המקרופאגים הנגועים המטופלים באופן בר-קיימא ביחס למקרופאגים הנגועים הלא-מטופלים הקיימים של שני ניסויים עצמאיים. סמלים עגולים מייצגים את יכולת הקיום של התא עבור כל בדיקה. עמודות מייצגות את הממוצע של שני ניסויים עצמאיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי להסיק את הפעילות התוך-מקרופגית של עשרים ושלוש התרכובות הנותרות כנגד Mab תוך-תאי (איור 6), נוסחת Mycoload (שהוסברה קודם לכן בשלב 6) שימשה להשגת אחוז הכדאיות המיקובקטריאלית המנורמל למקרופאגים נגועים שאינם מטופלים. רוב התרכובות איבדו את הפוטנציאל הטיפולי שלהן נגד מיקובקטריה מופנמת (איור 6) בהשוואה לבדיקת אימות הפגיעות (איור 4), כאשר מספר הפגיעות ירד מעשרים וחמש לשש בריכוז הגבוה ביותר שנבדק. באופן מדהים, כל שלוש התרכובות שהגדילו את הכדאיות של Mab פלנקטוני בהשוואה לחיידקים לא מטופלים (30, 31 ו-32; איור 3 ואיור 4) הציגו פעילות אנטי-מיקובקטריאלית נגד Mab תוך-תאי, כאשר תרכובות 30 ו-32 הציגו הבדל סטטיסטי משמעותי בהשוואה ל-DMSO, אפילו ב-3.3 מיקרומטר במקרה של תרכובת 32 (איור 6). מיקובקטריה שטופלה בתרכובות 11 ו-23 הראתה חיוניות <50% ב-13.3 מיקרומטר; עם זאת, זה לא היה שונה באופן משמעותי מבקרת DMSO (איור 6). תרכובות 21, 26 ו-29 היו חזקות מספיק ב-13.3 מיקרומטר כדי להצדיק הבדל סטטיסטי משמעותי, כאשר 29 היו הפעילות ביותר (איור 6). לבסוף, תרכובות 17, 22 ו-25 היו חזקות מאוד בכל הריכוזים שנבדקו נגד מיקובקטריה שהופנמה. אלה זוהו כרוקיתרומיצין, קלריתרומיצין וריפאבוטין, בהתאמה (טבלה 1). מבין שלוש התרכובות, קלריתרומיצין היה הפעיל ביותר נגד Mab, כאשר הכדאיות המיקובקטריאלית מעולם לא עלתה על 10%, והציגה ערך p <0.0001 בכל הריכוזים שנבדקו בהשוואה ל-DMSO (איור 6).
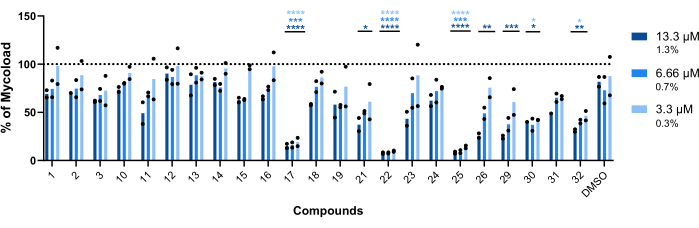
איור 6: הפעילות התוך-מקרופגית של פגיעות נגד מקרופאגים נגועים ב-Mab. עכברי BALB/c BMM היו נגועים ב-Mab (MOI=1) והודגרו עם כל פגיעה שזוהתה קודם לכן ב-13.3, 6.66 ו-3.3 מיקרומטר (1.3, 0.7 ו-0.3% מה-DMSO, בהתאמה) במשך 48 שעות ב-37 מעלות צלזיוס עם 7% CO2. התאים צולמו במיקרוסקופ פלואורסצנטי בעל תוכן גבוה, והאות הפלואורסצנטי שימש לחישוב המיקו (ראה שלב 6). הגרף מציג את אחוזי המיקופרדס שנמצאו במקרופאגים נגועים שטופלו ביחס למקרופאגים נגועים שלא טופלו בשני ניסויים בלתי תלויים. הסטטיסטיקה בוצעה באמצעות ANOVA דו-כיווני עם מבחן ההשוואה המרובה של Dunnet; *, עמ' < 0.05; **, עמ' < 0.01; עמ' <0.001;, p < 0.0001 בהשוואה ל- DMSO (בקרת ממס)., כוכביות עוקבות אחר אותו קוד צבע לכל ריכוז כמו מקרא התרשים. סמלים עגולים מייצגים את Mycoload עבור כל בדיקה. עמודות מייצגות את הממוצע של שני ניסויים עצמאיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: דוגמה לפריסת לוחות של 384 בארות ששימשה בהערכת גורם Z. לבן - בארות ריקות (מדיום צמיחה נוזלי בלבד); צהוב - שליטה חיובית (חיידקים המטופלים באנטיביוטיקה); אדום - שליטה שלילית (חיידקים שאינם מטופלים). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: דוגמה לפריסת לוחות של 384 בארות ששימשה בהקרנת הספרייה. לבן - בארות ריקות (מדיום צמיחה נוזלי בלבד); ירוק - בקרת ממס; אדום - שליטה שלילית (חיידקים שאינם מטופלים); כחול - תרכובות לבדיקה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: דוגמה לפריסת לוחות של 384 בארות המשמשת לאימות פגיעות. לבן - בארות ריקות (מדיום צמיחה נוזלי בלבד); ירוק - בקרת ממס (בכפילויות); אדום - שליטה שלילית (חיידקים שאינם מטופלים); כחול - תרכובות להקרנה (בכפילויות). צבעים דהויים מייצגים דילול סדרתי ביחס של 1:2. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 4: דוגמה לפריסת צלחת של 96 בארות המשמשת לבדיקת זיהום. לבן - בארות ריקות (מים למניעת אידוי); אדום - שליטה שלילית (מקרופאגים לא מטופלים); צהוב - שליטה חיובית (מקרופאגים המטופלים באנטיביוטיקה); ירוק - בקרת ממס; כחול - תרכובות לבדיקה. צבעים דהויים מייצגים דילול סדרתי ביחס של 1:2. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 5: פרוטוקול ניתוח תמונות. פרוטוקול מפורט של ניתוח תמונה משמש בעבודה זו, אשר ניתן להתאים לתוכנת קוד פתוח. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטוקול זה מתאר צינור סינון תרופות נגד Mab באמצעות זנים10 שפותחו בבית. באמצעות רובוטיקה לטיפול בנוזלים, מיקרוסקופיה וניתוח אוטומטיים, וזני כתב כפול, כדאיות חיידקים מוערכת במהירות באמצעות לומינסנציה או פלואורסצנטיות מבלי להוסיף ריאגנטים או לבצע צעדים נוספים. גישה זו מפחיתה זמן ושונות בין מבדקים, דבר המהווה יתרון משמעותי כאשר בוחנים את מטרת מבחני HTS.
בעת סינון אלפי תרכובות, תרופה יעילה חייבת להיות מזוהה בקלות. לשם כך, גורם Z משמש לעתים קרובות למדידת גודל האפקט הסטטיסטי, ומסיק את ביצועי הבדיקה. אם מקדם Z' > 0.5, התנאים שנבדקו הם אופטימליים כדי להבחין בין אוכלוסיות מטופלות ללא מטופלות13. התנאים שנבדקו הניבו גורמי Z > 0.6 (איור 2), מה שמוכיח סטטיסטית שניתן ליישם אותם במסע סינון. שלב זה חיוני כדי להבטיח את יעילות הבדיקה.
לפיכך, פרוטוקול HTS פותח כדי לזהות את הפעילות האנטי-מיקרוביאלית של אלפי תרכובות נגד גידול פלנקטוני של Mab. מכיוון ש-Mab הוא פתוגן פקולטטיבי תוך-תאי, הפרוטוקול המתוכנן מסנן גם את הפעילות האנטי-מיקרוביאלית התוך-תאית כנגד אותו זן חיידקי - יתרון קריטי. יתר על כן, רעילות כלפי התאים המארחים ניתן גם להעריך. לפיכך, מתוארת גישה רב-שלבית לבדיקת תרופות נגד Mab, תוך שימוש במערכי ניסוי שונים כדי להעריך פעילות מיקרוביאלית יחד עם ציטוטוקסיות, מה שמגדיל את סיכויי ההצלחה. כהוכחת היתכנות הוקרנה ספרייה כימית הכוללת 1280 תרכובות.
סה"כ אותרו 33 נפילות (איור 3). מתוכם, שלושה הגדילו משמעותית את הכדאיות המיקובקטריאלית בתרביות נוזליות (תרכובות 30, 31 ו-32; איור 3 ואיור 4). יש לציין כי תרכובות אלה עלולות להפריע לפליטת האור מבלי להשפיע על יכולת הקיום של החיידקים. כאשר נבדקו מול מיקובקטריה שהופנמה, תרכובות אלה הראו פעילות אנטי-מיקרוביאלית (איור 6), מה שמדגים יעילות גבוהה יותר נגד Mab לאחר הפנמת התא המארח. תרכובות אלה זוהו כטרולאנדומיצין (30), ספירמיצין (32) ולינקומיצין (31; טבלה 1). שני הראשונים הם מקרולידים, סוג של אנטיביוטיקה המשמשת לטיפול בזיהומים מיקובקטריאליים16, והאחרון הוא lincosamide, אנטיביוטיקה עם מנגנון פעולה דומה macrolides17. דווח כי Mab עמיד במיוחד ללינקוסמיד אחר, קלינדמיצין, הן בתרביות נוזליות והן בתרביות מוצקות18. אף על פי כן, תכונות אימונומודולטוריות ונוגדות דלקת נקשרו למקרולידים19,20 וללינקוסמידים21, מה שיכול להסביר את הפעילות האנטי-מיקרוביאלית המוגברת נגד מיקובקטריה מופנמת (איור 6).
מתוך שלושים הפגיעות הנותרות, אחת עשרה מפחיתות ב->90% את הכדאיות המיקובקטריאלית בכל הריכוזים (איור 4). בהתחשב בכך, לבדיקת HTS טיפוסית יש שיעור פגיעה צפוי של ~ 1% 22, הפרוטוקול המפותח תואם את מה שנצפה בדרך כלל. עם זאת, כמה תרכובות אחרות עדיין היו פעילות, ועשרים ושמונה המשיכו לבדיקת הזיהום.
מתוך התרכובות שזוהו, חמש תרכובות נחשבו רעילות (איור 5) - דאונורוביצין (4), דוקסורוביצין (5), אפירוביצין (27), תיאוסטרפטון (6) ופירוויניום פמוט (28; טבלה 1). שלושת הראשונים הם חומרים אנטי-ניאופלסטיים 23,24,25, כך שבאופן לא מפתיע, הם רעילים לתאי היונקים המשמשים בניסוי זה. Pyrvinium pamoate שימש במשך שנים רבות כמו anthelminthic יעיל; עם זאת, מאז 2004, זה כבר קשור גם עם פעילויות אנטי neoplastic26. לבסוף, thiostrepton הוא oligopeptide המשמש לעתים קרובות ברפואה וטרינרית, מעולם לא אושר לשימוש בבני אדם27. הפעילות של תרופה זו נגד תאי סרטן השד דווחה28. הפעילות התוך-מקרופגית של תיאוסטרפטון לא הוערכה בשל רעילותו על מקרופאגים שמקורם במח עצם (איור 5). עם זאת, הוכח כי thiostrepton יעיל ב 5 μM על תאי THP-1 נגועים Mab29. התוצאות המדווחות נגד חיידקים פלנקטוניים29 דומות לאלה שהתקבלו בסריקה זו, כאשר תיאוסטרפטון הוא חזק מאוד (איור 4).
רוב התרכובות שנבדקו לפעילות תוך-מקרופגית לא הראו פוטנציאל טיפולי (איור 6). גידול חיידקים תוך תאי שונה במידה ניכרת מתרביות פלנקטוניות. באחרון, מגע ישיר בין חיידקים לתרופות תמיד אפשרי. בראשון, עקב הפנמה על ידי תאים מארחים, כמה קרומי מארח פועלים כמחסומים פיזיים שתרופות צריכות לעבור כדי להגיע למטרה, מה שיכול לעזור להסביר את הפעילות האנטי-מיקרוביאלית המופחתת של רוב הפגיעות. בריכוז הגבוה ביותר, 13.3 מיקרומטר, שלוש תרכובות הציגו עוצמה מספקת כדי להיות שונות סטטיסטית מבקרת DMSO (איור 6) - צפדיניר (21), גטיפלוקסצין (26) ומוקסיפלוקסצין (29; טבלה 1). בעוד moxifloxacin כבר משמש כתרופה קו שני נגד שחפת16, cefdinir משמש בדרך כלל לטיפול במספר זיהומים חיידקיים בדרכי הנשימה, כגון דלקת ריאות30. עם זאת, דווח על פעילותו נגד M. tuberculosis31 ו- Mab, המציגה השפעה סינרגטית חזקה עם קרבפנם כנגד32 האחרונים. Gatifloxacin הוא fluoroquinolone, ופעילותו דווחה נגד מספר mycobacteria בעבר33,34. שלושת החומרים הפעילים ביותר בבדיקה זו (איור 6) היו רוקסיתרומיצין (17), קלריתרומיצין (22) וריפאבוטין (25; טבלה 1), שהם חזקים ביותר בכל הריכוזים. שני הראשונים הם מקרולידים, ואילו ריפאבוטין הוא ריפמיצין, כאשר שני הסוגים משמשים בסיס לטיפול נגד זיהומים מיקובקטריאליים רבים16.
סינון זה מסתמך על ציוד ספציפי ויקר לטיפול בנוזלים כדי להפחית את השונות בין הבדיקות. למרות היותו ניתן לשחזור רב, למטפל בנוזלים אין העברה ללא מגע של תרכובות, כגון אחת אקוסטית. כך, תרכובות דבק מסוימות יכולות להישאר מחוברות לפינים המתכתיים בין ההעברות, לעבור לבארות הבאות, וכתוצאה מכך לקבל תוצאות חיוביות שגויות בשלב הסינון - זה מה שקרה עם מתחם 33. זו הסיבה שאימות הבדיקה הוא כה קריטי להצלחתה, ומבטיח שאף תוצאה חיובית כוזבת לא תמשיך לשלבים הבאים בצנרת סינון התרופות. בדיקת הזיהום משתמשת במערכת הדמיה בעלת תוכן גבוה עם מצב קונפוקלי כדי לקבל את ההגדרה הטובה ביותר האפשרית של אזורי החיידקים. עם זאת, עדיין ניתן להשתמש בו ללא מצב קונפוקלי, אם כי באובדן הגדרה ואולי בפגיעה בזיהוי אזורים חיידקיים. פרוטוקול זה מנצל את תוכנת הניתוח הפשוטה והידידותית למשתמש המשולבת במערכת ההדמיה; עם זאת, ניתן להשתמש בתוכנת קוד פתוח בהתאם לפרוטוקול (איור משלים 5). בסופו של דבר, למרות שלא ייעדו מחדש תרופות לטיפול בזיהומי Mab, תוצאות אלה חשובות ביותר מכיוון שהן מאמתות את הפרוטוקול שנקבע, שניתן להרחיבו לספריות גדולות יותר. חשוב לציין, אנו מאמינים שניתן להתאים פרוטוקול זה לכל חיידק, בתנאי שקריאות פלואורסצנטיות או זוהרות זמינות. לפיכך, עבודה זו תורמת באופן משמעותי לתחום גילוי התרופות, ומספקת את הכלים הדרושים כדי לסייע במאבק באחת הבעיות הגדולות ביותר של בריאות הציבור - חיידקים עמידים לאנטיביוטיקה - ובמיוחד פתוגן כמעט בלתי פתיר - Mycobacterium abscessus.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
עבודה זו ממומנת על ידי קרנות לאומיות פורטוגליות באמצעות FCT - Fundação para a Ciência e a Tecnologia, I.P, במסגרת הפרויקט PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) ומלגות דוקטורט 2021.07335.BD ל- GSO ו- UI/BD/150830/2021 ל- CMB; FWO - קרן המחקר פלנדריה, מענק n° 1S68720N; יוזמת רפואה חדשנית 2 Call 16 (IMI2-Call 16) הצעה RespiriTB תחת הסכם מספר 853903. המחברים מודים על תמיכת i3S Scientific Platform BioSciences Screening, חברה בתשתיות הלאומיות PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) ו-PPBI - Portuguese Platform of Bioimaging (PPBI-POCI-01-0145-FEDER-022122).
Materials
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
References
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997(2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179(2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221(2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239(2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I. The future of drug repositioning. Annual reports in medicinal chemistry. Macor, J. E. , Academic Press. 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562(2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204(2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224(2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866(2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90(2022).
- Bray, M. A., Carpenter, A. Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD). (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , 10th ed, Wayne, PA. (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18(2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421(2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202(2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302(2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527(2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165(2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249(2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661(2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511(2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293(2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved