Method Article
Mikobakterilere Karşı Yüksek Verimli İlaç Taraması için Test Geliştirme
Bu Makalede
Özet
Bu çalışma, bakteri canlılığını hızlı bir şekilde değerlendirmek için floresan ve lüminesans kullanarak, yakın zamanda oluşturulmuş bir çift raportör suşu ile Mycobacterium abscessus'a karşı yüksek verimli tarama için bir test geliştirdi. Bu protokol, bu ilaca dirençli bakterilere karşı yeni ilaçları taramayı amaçlayan araştırmacılar için geçerli olacaktır.
Özet
Mycobacterium abscessus (MAB) enfeksiyonları, çoklu ilaca dirençli tüberküloz ile karşılaştırılabilir yüksek intrinsik ilaç direnci nedeniyle tedavisi zordur. Tedaviler son derece etkisizdir ve çoklu ilaç rejimine dayanır, bu da hasta uyumunun düşük olmasına neden olur. Sonuç olarak, bilim camiasından bu enfeksiyonları tedavi etmek için yeni ve etkili ilaçlar belirlemesi istenmektedir. Bu amaçla kullanılan stratejilerden biri, yeni ilaçların farmakokinetik ve güvenlik profillerini oluşturmak için gereken süreyi atlatarak, piyasadaki mevcut ilaçlar için yeni terapötik fırsatları belirleme süreci olan ilacın yeniden kullanımıdır. Mab'a karşı ilaç geliştirme ile ilgili çoğu çalışma geleneksel ve zaman alıcı yöntemlere dayanırken, Mab'ın kurum içinde geliştirilen çift raportör bir suşu kullanılarak mikobakterilere karşı yüksek verimli ilaç taraması için bir test geliştirilmiştir. Sıvı işleme robotları, otomatik mikroskopi ve analizin yanı sıra evde geliştirilen çift raportör suşlar kullanılarak, bakteri canlılığı, reaktif eklemeden veya herhangi bir ekstra adım gerçekleştirmeden lüminesans ve floresan olmak üzere iki farklı okuma kullanılarak hızlı bir şekilde ölçülebilir. Bu, tahliller arasındaki süreyi ve değişkenliği azaltır, bu da yüksek verimli taramalar için büyük bir avantajdır. Açıklanan protokol, 1280 bileşikten oluşan bir kütüphane taranarak doğrulandı. Elde edilen sonuçlar, aktif bileşiklerin etkin bir şekilde tespit edilmesiyle literatür tarafından desteklenmiştir. Böylece, bu çalışma, bu son derece ilaca dirençli bakteriyle savaşmaya yardımcı olmak için alana yeni bir araç sağlama amacını yerine getirdi.
Giriş
Mycobacterium abscessus (Mab), özellikle kistik fibroz ve diğer akciğer rahatsızlıkları olan kişilerde akciğer enfeksiyonlarından sorumlu fırsatçı bir patojendir. Mab'ın neden olduğu enfeksiyonların, çoklu ilaca dirençli tüberküloz1 ile karşılaştırılabilir mükemmel içsel ilaç direnci nedeniyle tedavi edilmesi rezil bir şekilde zordur. Mevcut ilaçlar, yüksek derecede geçirimsiz mikobakteriyel hücre zarfı ve antibiyotikleri etkisiz hale getiren birkaç enzimi kodlayan bir genom nedeniyle büyük ölçüde etkisizdir2. Bu nedenle, tedavi aylar ila yıllar süren çeşitli ilaçların kombinasyonunu içerir. Bu zorlu çoklu ilaç rejimi, düşük hasta uyumu ile birleştiğinde ortalama %30 ila %50 arasında bir iyileşme oranı ile sonuçlanır3. Ayrıca, tüberküloz dışı mikobakterilerin neden olduğu akciğer enfeksiyonlarının prevalansı, Mab 1,4'ün neden olduğu enfeksiyonlar da dahil olmak üzere son birkaç on yılda artmıştır. Sonuç olarak, bilim topluluğu Mab enfeksiyonlarını tedavi etmek için yeni bileşikler geliştirmek için yarışıyor.
Bu amaçla izlenen stratejilerden biri, mevcut ilaçlar için yeni terapötik fırsatların belirlenmesi süreci olan ilacın yeniden kullanımıdır. Bu, yeni bir ilacın keşif ve geliştirme hattına eşlik eden en büyük zorluğun üstesinden geliyor - zaman5. Bu basit konsept, gelişimsel maliyetleri azaltmak ve bir ilacın tezgahtan yatak başına geçmesi için gereken zaman ölçeğini kısaltmak için çeşitli ilaçların halihazırda belirlenmiş farmakokinetik ve güvenlik profillerinden yararlanır6. Bu nedenle, yüzlerce ila binlerce bileşiği birleştiren kütüphaneler derlendi ve araştırmacıların, ilgilendikleri patojene karşı ilaçları yeniden kullanma olasılığını hızlı bir şekilde test etmelerine olanak sağladı.
MAB'a karşı ilaç geliştirme üzerine yapılan çalışmaların çoğu, bir bileşiğin mikobakterilere karşı in vitro aktivitesini değerlendiren altın standart, ancak geleneksel bir teste dayanmaktadır - koloni oluşturan birimler7. Doğruluğuna rağmen, bu prosedür son derece zaman alıcıdır ve birisi binlerce bileşik içeren kütüphaneleri test etmeyi hedeflediğinde hızla uygulanamaz hale gelir. Bu amaçla, yüksek verimli taramalar (HTS) ilaç geliştirmeye entegre edilmiştir - robotik ve sıvı işleme cihazlarından yararlanan ve binlerce bileşiğinparalel olarak hızlı bir şekilde taranmasına olanak tanıyan sağlam tahliller8. Bu tipik olarak, başlangıçta tek bir konsantrasyonun test edilmesiyle, 96, 384, 1536 veya 3456 kuyucuklu formatlarda mikrotitre plakaları kullanılarak, isabetleri tanımlamak ve klinik olarak kullanılmak üzere boru hattında daha da optimize etmek için bir başlangıç noktası görevi görür.
Raportör bazlı tahliller, diğer boya ve absorbans bazlı tahlillere kıyasla basitlikleri ve hassasiyetleri nedeniyle HTS'nin sağlamlığı için önemli bir avantaj sağlamaktadır 7,9. Bununla birlikte, bildiğimiz kadarıyla, yalnızca birkaç çalışma Mab9'a karşı yüksek verimli bir taramayı optimize etmiştir.
Son zamanlarda, laboratuvarımız aynı anda lüminesans ve floresan10 yayabilen çift raportör suşları geliştirmiştir. Mab operon_mScarlet bu türlerden biridir. Bir bakteriyel lusiferaz (luxAB genlerinin ekspresyonu ile) ve uzun zincirli bir aldehit substratı (luxCDE genlerinin ekspresyonu ile) içeren LuxABCDE operonunun ekspresyonu nedeniyle otomatik ışıldayandır. Öte yandan, floresan okuması, daha tipik olarak kullanılan eGFP ve mCherry proteinlerinden daha iyi performans gösteren ve daha güçlü bir sinyal11 sağlayan, yakın zamanda geliştirilen bir kırmızı floresan proteini olan mScarlet'in ekspresyonu yoluyla elde edilir. Bu suşun kullanılması, reaktifler eklemeden veya ek adımlar gerçekleştirmeden bir mikroplaka okuyucusunda ışıldayan sinyali ölçerek sıvı kültürdeki bakteri canlılığını değerlendirmemizi sağlar. Tespit açısından, içsel floresan, boya veya antikor kullanmadan canlı veya sabit hücrelerde mikroskop görselleştirmesine izin verir. Her iki okumada da tek bir suşa sahip olmak, araştırmacılara HTS tahlillerinde kullanırken önemli bir avantaj sağlar - tahlilin doğasına bağlı olarak suşları değiştirmeye gerek olmadığından, farklı okumalara sahip tahliller arasındaki azaltılmış değişkenlik.
Bu nedenle, bu çalışma, kurum içi tasarlanmış bir çift raportör suşu kullanarak Mab'a karşı yüksek verimli bir test geliştirdi (Şekil 1). Bu, ticari bir kütüphane kullanılarak yeniden kullanılması amaçlanan in vitro aktivite 1280 ilacının hızlı bir şekilde değerlendirilmesine izin verdi (bkz. İlk olarak, aktiviteler lüminesans kullanılarak et suyu kültürü testinde değerlendirildi ve ikinci olarak, floresan sinyalinden yararlanan Mab ile enfekte makrofajlar kullanılarak, in vivo12'de görülen enfeksiyon sürecini daha iyi taklit ederek değerlendirildi.
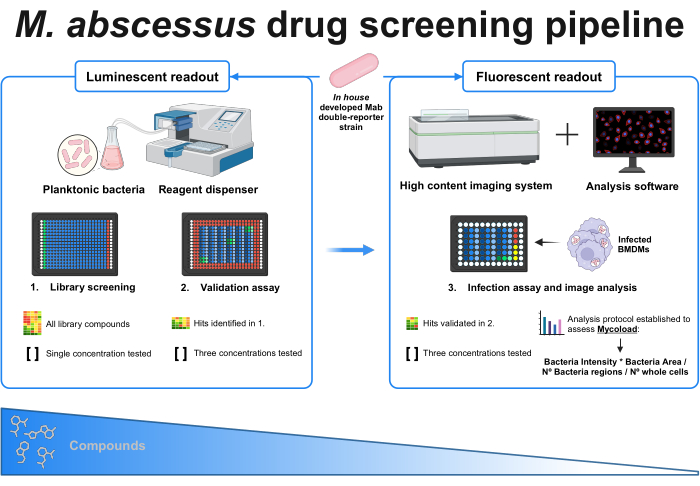
Şekil 1: Oluşturulan protokolün grafiksel özeti. Bu taramadaki kilit oyuncu, tüm deneyler boyunca kullanılan, evde geliştirilen çift raportör mikobakteriyel suştur. İlk olarak, bir reaktif dağıtıcı ve planktonik bakteriler kullanılarak, bileşiklerin tek bir konsantrasyonda test edilmesiyle bir ilk tarama gerçekleştirilir. Tanımlanan isabetler, üç farklı konsantrasyonun test edildiği doğrulama testine devam eder. Her iki deney de ışıldayan okuma kullanılarak yapılır. Doğrulanmış isabetler, üç farklı konsantrasyonun da test edildiği enfeksiyon testine devam eder ve kemik iliği türevli makrofajlar MOI 1'de enfekte olur. Yüksek içerikli bir görüntüleme sistemi, bakteriyel floresan sinyalini alır ve Mycoload formülü aracılığıyla hücre içi yükü değerlendirmek için analiz yazılımı kullanılır. Tahlil karmaşıklığı arttıkça bileşiklerin sayısı azalır. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm hayvan prosedürleri, i3S'nin Yerel Hayvan Etik Komitesi tarafından onaylanmış ve Avrupa Konseyi Direktifi (2010/63/EU) ve deneyle ilgili hayvan refahı için Portekiz yasası (DL 113/2013) uyarınca Portekiz Gıda ve Veterinerlik Genel Müdürlüğü (DGAV) tarafından lisanslanmıştır.
1. Z' faktörü değerlendirmesi
NOT: Bir HTS testinin performansını değerlendirmek için birkaç parametre belirlenebilir. En çok kullanılan parametre Z asal faktörüdür (Z' faktörü). Bu metrik, belirli bir deneyin istatistiksel etki boyutunu ölçerek, pozitif ve negatif kontrollerin ne kadar iyi ayrıldığını gösterir. Bir Z' faktörü 0.5 ile 1 arasında değişiyorsa, her iki popülasyon arasındaki ayrım mükemmeldir ve bu koşullar HTS testinde kullanılabilir. Z' 0.5 < ise, ayırma sadece marjinaldir ve taramanınyapılması önerilmez 13. Bu nedenle, Z' faktörünü hesaplamak için tedavi edilmemiş bakterilerle yarısı ve diğer yarısı pozitif kontrollü bir plaka kullanan bir deney tasarlanmıştır (Ek Şekil 1).
- Testten 2-3 gün önce, bakterileri bir Erlenmeyer şişesinde sıvı bir büyüme ortamında (yaklaşık 1 x 107 CFU / mL) aşılayarak Mab'ın ön kültürlerini hazırlayın. Bakterileri 37 °C'de çalkalama (90 rpm) ile bir inkübatörde büyümeye bırakın.
DİKKAT: Mab kültürleri ile çalışırken bir biyogüvenlik kabini gereklidir. - Bir spektrofotometre kullanarak 600 nm'de optik yoğunluk ölçümü ile Mab prekültürünün büyümesini takip edin. Kültür üstel büyüme aşamasına ulaştığında, adım 1.3'e geçin.
- Üstel ön kültürü kullanarak, sıvı büyüme ortamında yaklaşık 5 x 105 CFU/mL'lik (optik yoğunluk değerleri ile ilişkili)14 bir bakteri süspansiyonu hazırlayın.
- Sıvı bir büyüme ortamında bakteri üremesinin inhibisyonunun pozitif kontrolü için bir çözelti hazırlayın. Bu test için pozitif kontrol 4 μg/mL'de klaritromisin (DMSO'da 10 mg/mL) idi. Klaritromisin, istenen nihai konsantrasyonun 2 katı hazırlanmalıdır.
- Küçük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı kullanarak, siyah polipropilen 384 oyuklu bir plakanın boş ve işlenmemiş sütunlarına 15 μL sıvı büyüme ortamı dağıtın. Boş sütunlar için ek 15 μL sıvı büyüme ortamı dağıtın.
NOT: Boş kolonlar, iç kuyucukların 37 °C'de buharlaşmasını önler. - Küçük bir kaset ile donatılmış mikroplaka reaktif dağıtıcısı ile, adım 1.4'te hazırlanan pozitif kontrol solüsyonunun 15 μL'sini pozitif kontrol kolonlarına dağıtın.
- Büyük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı ile, adım 1.3'te hazırlanan 15 μL bakteri süspansiyonunu boşluklar hariç tüm sütunlara dağıtın ve her şeyi 1:2 oranında seyreltin. 384 kuyunun tamamının nihai hacmi 30 μL'dir.
NOT: Mikroplaka reaktif dağıtıcısı, boru boyutunda farklılık gösteren (sırasıyla 0.5 ve 0.22 mm) büyük veya küçük bir kaset ile donatılabilir. Daha fazla sıvı israfına neden olsa bile, boru sisteminde bakteri toplanmasını önlemek için daha büyük bir kaset kullanılması tercih edilir. Bununla birlikte, aynı kaset tüm tahlil boyunca kullanılabilir. - Her plakayı, sürekli gaz değişimine izin veren bir plaka kapatıcı ile kapatın. 37 ° C'de bir inkübatörde 48 saat boyunca nemli bir oda içinde çalkalama olmadan inkübe edin.
- 48 saat sonra, entegrasyon süresi 1 s olan bir plaka okuyucu kullanarak her bir plakadaki bakterilerin yaydığı lüminesansı okuyun.
- Z' faktörünü belirlemek için, adım 1.9'da elde edilen değerleri kullanın ve pozitif (AVGP ve SDP) ve negatif (AVGN ve SDN) kontrollerin ortalama ve standart sapmasını hesaplayın. Daha sonra aşağıdaki formülü uygulayın:
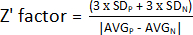
NOT: 3 x SD, yaygın olarak kullanılan bir eşiktir; Bununla birlikte, standart sapmayı çarpmak için faktörü artırarak veya azaltarak taramaya daha iyi uyacak şekilde ayarlanabilir.
2. İsabetler için kütüphane taraması
NOT: İlk taramalar sıvı kültürde üreyen bakterilere karşı yapılmıştır. Kurulum, 30 μL nihai hacme sahip 384 oyuklu plakalar için tasarlanmıştır. Her plaka boş kuyucuklar (yalnızca sıvı büyüme ortamı), negatif kontroller (tedavi edilmemiş bakteriler) ve çözücü kontrolü (bakteri artı bileşiğin çözücüsü - bu durumda, DMSO; Ek Şekil 2). Bileşikler veya çözücü, istenen nihai konsantrasyonun 2 katı oranında plakaya ilave edildi ve bakteriler 1: 1 oranında eklendi (her şey yarıya kadar seyreltildi).
- Bakteriyel süspansiyonu adım 1.1 ila 1.3'te açıklandığı gibi hazırlayın.
DİKKAT: Mab kültürleri ile çalışırken bir biyogüvenlik kabini gereklidir. - Sıvı bir büyüme ortamında bir çözücü çözeltisi hazırlayın. Çözücü miktarı, istenen nihai konsantrasyonun 2 katı olmalıdır.
- Küçük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı kullanarak, solvent kontrol kolonu hariç, siyah polipropilen 384 oyuklu plakaların her sütununa 15 μL sıvı büyüme ortamı dağıtın. Boş sütunlar için, ek bir 15 μL sıvı büyüme ortamı dağıtın.
- Küçük bir kaset ile donatılmış mikroplaka reaktif dağıtıcısı ile, daha önce hazırlanmış olan 15 μL çözücü çözeltisini çözücü kontrol kolonuna dağıtın.
- Sıvı bir işleyici kullanarak, 200 nL bileşiği stok 96 oyuklu plakalardan (DMSO'da 1 mM) boşluklar, çözücü kontrolü ve işlenmemiş kolonlar hariç 384 oyuklu plakalara aktarın. Bileşikler şimdi 13.3 μM'lik bir konsantrasyondadır.
- Büyük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı ile, adım 2.1'de hazırlanan 15 μL bakteri süspansiyonunu boşluklar hariç tüm sütunlara dağıtın ve her şeyi 1:2 oranında seyreltin. 384 kuyunun tamamının nihai hacmi 30 μL'dir ve her bileşik 6.66 μM'dir.
- Her plakayı, sürekli gaz değişimine izin veren bir plaka kapatıcı ile kapatın.
NOT: Test normal kapaklarla yapılabilir; Bununla birlikte, daha güçlü kenar etkileri olasılığı daha yüksektir. - 37 ° C'de bir inkübatörde 48 saat boyunca nemli bir oda içinde çalkalama olmadan inkübe edin.
- 48 saat sonra, entegrasyon süresi 1 s olan bir plaka okuyucu kullanarak her bir plakadaki bakterilerin yaydığı lüminesansı okuyun.
3. İsabet tarama veri analizi
NOT: Elde edilen lüminesans verileriyle isabetleri tanımlamak için, değerlerin bileşiklerin çözündüğü çözücüye ve meydana gelirse, 384 mikrotitre plakalarda doğrulanan kenar etkisine normalleştirilmesi gerekir.
- Adım 2.9'da elde edilen verilerin çözücü normalizasyonu için, her bir kuyucuğun bağıl ışık birimlerini (RLU) çözücü kontrol kuyularının (ilgili plakada) ortalama RLU'suna bölün. Bu tahlilde, tarama plakalarının ortasına doğru güçlü bir kenar etkisi doğrulandı; Böylece, bunun için tüm verilerin normalleştirilmesine karar verildi. Bunu başarmak için, süreç aşağıda açıklandığı gibi iki aşamalı bir şekilde yapıldı.
- Adım 3.1'de elde edilen değerleri, isabetler hariç karşılık gelen konumlar için tüm plakalara bölerek bir kenar efekti maskesi oluşturun (plaka 1 - P1, plaka 2 - P2, plaka 3 - P3, plaka 4 - P4). Örneğin, A1 ve A2 konumları için Mask_A1 = Ortalama (P1_A1; P2_A1; P3_A1; P4_A1); Mask_A2 = Ortalama (P1_A2; P2_A2; P4_A2) [P3_A2 bir hit olduğu için hariç tutuldu].
- Adım 3.1'de elde edilen değerleri bölün. Adım 3.1.1'de elde edilen kenar efektli maskesi ile. Örneğin,
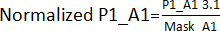 . Ardından, her plaka için bir eşik (AVG ± 3SD) oluşturmak için her plakanın AVG ve SD'sini hesaplayın. Bu eşiğin dışındaki herhangi bir bileşik isabet olarak kabul edilir ve isabet doğrulama testine devam eder.
. Ardından, her plaka için bir eşik (AVG ± 3SD) oluşturmak için her plakanın AVG ve SD'sini hesaplayın. Bu eşiğin dışındaki herhangi bir bileşik isabet olarak kabul edilir ve isabet doğrulama testine devam eder.
4. İsabet doğrulama testi
NOT: İsabetleri belirledikten sonra, bunların farklı konsantrasyonlar kullanılarak doğrulanması gerekir. Doğrulama testi, aynı kontrollerle benzer bir kurulum kullanır, ancak her isabet 1:2 seri seyreltmeye tabi tutulacaktır. Bu test için üç konsantrasyon kullanıldı - 13.3 μM, 6.66 μM ve 3.3 μM. Solvent kontrolleri, her bir bileşik kuyusu ile aynı solvent yüzdesini içerecektir (Ek Şekil 3).
- Bakteriyel süspansiyonu adım 1.1 ila 1.3'te açıklandığı gibi hazırlayın.
DİKKAT: Mab kültürleri ile çalışırken bir biyogüvenlik kabini gereklidir. - Küçük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı kullanarak, siyah polipropilen 384 oyuklu bir plakanın her sütununa 15 μL sıvı büyüme ortamı dağıtın. Boş kuyular için, ilk ve son sütuna 15 μL ilave sıvı büyüme ortamı dağıtın.
- Mikroplaka reaktif dağıtıcısı ile, her bir bileşiğin en yüksek [μM] değerini içeren sütunlara 15 μL ek bir sıvı büyüme ortamı dağıtın.
- Stok 96 oyuklu plakalardan, her vuruştan 0.8 μL'yi (DMSO'da 1 mM) 4.3. adımdan itibaren ilgili kuyucuklarına iki kez manuel olarak pipetleyin. Bileşikler şimdi 26.6 μM'lik bir konsantrasyondadır.
- 0,8 μL çözücüyü kontrol kuyucuklarına iki parça halinde manuel olarak pipetleyin (adım 4.4 ile aynı).
- Çok kanallı bir mikropipet kullanarak, her bileşik ve çözücü kontrolü için iki adet 1:2 seri seyreltme gerçekleştirin. Son seri seyreltmeden sonra aşan 15 μL'yi atın. Tüm kuyucuklar artık 15 μL'ye sahiptir ve bileşiklerin konsantrasyonları 26.6 μM, 13.3 μM ve 6.66 μM'dir.
- Büyük bir kasete sahip bir mikroplaka reaktif dağıtıcısı kullanarak, 4.1'de hazırlanan 15 μL bakteri süspansiyonunu tüm sütunlara (boş kuyucuklar hariç) dağıtın ve bileşikleri 1: 2 oranında seyreltin. Tüm kuyucukların nihai hacmi 30 μL'dir ve her bileşik 13.3 μM, 6.66 μM ve 3.3 μM'dir.
- Plakayı, sürekli gaz değişimine izin veren bir plaka kapatıcı ile kapatın. 37 ° C'de bir inkübatörde 48 saat boyunca nemli bir oda içinde çalkalama olmadan inkübe edin.
- 48 saat sonra, bir plaka okuyucu kullanarak 1 sn entegrasyon süresi ile her bir plakadaki bakteriler tarafından yayılan lüminesansı okuyun.
5. Enfeksiyon testi
NOT: Mab, hücre içi fakültatif bir patojendir, bu nedenle enfeksiyon deneylerinde isabetlerin antimikrobiyal aktivitesi ve konakçı toksisitesi belirlenmelidir. Bunun için, kemik iliği kaynaklı makrofajlar (BMM) MAB ile enfekte edildi ve farklı konsantrasyonlarda adım 4'te doğrulanan isabetlerle tedavi edildi. Her tahlil, boş (sadece su), negatif kontroller (tedavi edilmemiş enfekte makrofajlar), pozitif kontroller (etkili bir antibiyotikle tedavi edilmiş enfekte makrofajlar), çözücü kontrolleri (bu durumda, DMSO) ve üç konsantrasyonda test edilecek bileşikleri içeriyordu - 13.3 μM, 6.66 μM ve 3.3 μM (Ek Şekil 4).
- Daha önce tarif edildiği gibi, vahşi tip yetişkin farelerin (BALB / c veya C57BL / 6) murin kemik iliğinden makrofajlar türetin15. Hücreleri, oyuk başına 2 μL, 2 x 10 5 hücre / mL'de 96 oyuklu,siyah , optik olarak şeffaf düz tabanlı bir plaka üzerine yerleştirin. 37 ° C'de,% 7 CO215'te 10 günlük farklılaşmadan sonra, hücreler enfekte olmaya ve tedaviye devam etmeye hazırdır.
NOT: Kemik iliği kaynaklı makrofajların elde edilmesi için protokol iyi bilinmektedir15; bununla birlikte, bu tarama protokolü RAW 264.7, THP-1 ve PBMC'den türetilmiş makrofajlar gibi diğer hücrelere uyarlanabilir. - Bakteriyel süspansiyonu 1.1 ila 1.3 adımlarında açıklandığı gibi hazırlayın, hücre kültürü ortamındaki bakteriyel süspansiyonu 1 enfeksiyon çokluğu (MOI) olan bir enfeksiyon için ayarlayın.
DİKKAT: Mab kültürleri ile çalışırken bir biyogüvenlik kabini gereklidir. - Bir cam pipete bağlı bir vakum pompası kullanarak kuyucukların takviye edilmiş hücre kültürü ortamını dikkatlice aspire edin. Hücre ayrılmasını önlemek için bu adımın yavaş ve kolay bir şekilde gerçekleştirilmesi gerekir.
- Adım 5.2'de hazırlanan bakteri süspansiyonunun 75 μL'sini her bir oyuğa manuel olarak pipetleyin. Plakayı bir hücre inkübatöründe 4 saat boyunca% 7 CO2 ile 37 ° C'de inkübe edin.
- Hücre tedavisi için bileşikleri hazırlayın. Küçük bir kaset ile donatılmış bir mikroplaka reaktif dağıtıcısı kullanarak, polipropilen, yuvarlak tabanlı, 96 oyuklu plakalara, 110 μL takviyeli hücre kültürü ortamına, bileşiklerin veya çözücü kontrolünün olacağı sütunlara dağıtın (Ek Şekil 4).
- Bir mikroplaka reaktif dağıtıcısı kullanarak, en yüksek bileşik veya çözücü konsantrasyonunun olacağı sütunlara ek 104 μL ek hücre kültürü ortamı dağıtın.
- 5.9 μL bileşiğin (DMSO'da 1 mM) veya çözücüyü belirlenen kuyucuklarına (adım 5.6'daki sütunlar) manuel olarak pipetleyin. Bileşikler şimdi 26.6 μM'lik bir konsantrasyondadır.
- Çok kanallı bir mikropipet kullanarak, her bileşik ve çözücü için 1:2 oranında iki seri seyreltme gerçekleştirin. Son seri seyreltmeden sonra aşan 110 μL'yi atın. Tüm kuyucuklar artık 110 μL'ye sahiptir ve bileşikler 26.6 μM, 13.3 μM ve 6.66 μM konsantrasyondadır.
- Bir mikroplaka reaktif dağıtıcısı kullanarak, tüm sütunlara (boş kuyucuklar hariç) 110 μL takviye hücre kültürü ortamı dağıtın. Tüm kuyucuklar artık 220 μL'ye sahiptir ve bileşikler 13.3 μM, 6.66 μM ve 3.3 μM konsantrasyondadır.
- Takviye edilmiş bir hücre kültürü ortamında 2 μg / mL'de bir klaritromisin (pozitif kontrol) çözeltisi hazırlayın.
- Adım 5.4'ten 4 saat sonra, bir plaka yıkayıcı kullanarak, enfekte olmuş 96 oyuklu plakayı 200 μL enfeksiyon yıkama solüsyonu ile 3x yıkayın. Herhangi bir hücre ayrılmasını önlemek için aspirasyonu ve dağıtım hızlarını mümkün olan en yavaş seviyede tutun.
- Son aspirasyondan sonra, 5.5-5.9 adımlarında hazırlanan bileşiklerin 200 μL'sini, enfekte makrofajları içeren 96 oyuklu plakaya aktarın.
- 200 μL takviye edilmiş hücre kültürü ortamını tedavi edilmemiş kuyucuklara aktarın. Adım 5.10'da hazırlanan klaritromisin çözeltisinin 200 μL'sini ilgili kuyucuklarına aktarın.
- Plakayı 37 ° C'de,% 7 CO2 ile 48 saat boyunca bir hücre inkübatöründe inkübe edin.
- 48 saat sonra, enfekte olmuş 96 oyuklu plakayı, bileşiğin yıkama solüsyonu ile bir plaka yıkayıcı kullanarak yıkayın (oyuk başına 200 μL ile 3x).
- Çok kanallı bir mikropipet kullanarak, 200 μL sabitleme solüsyonunu tüm kuyucuklara dağıtın ve 10 dakika boyunca etki etmesine izin verin.
- Fiksasyondan sonra, bir plaka yıkayıcı kullanarak, hücreleri bileşiklerin yıkama solüsyonu ile yıkayın (kuyu başına 200 μL ile 3x).
NOT: Protokol buradan duraklatılabilir. Hücreler, kontaminasyon ve hücre kuruluğu önlenirse, bileşiklerin yıkama solüsyonunda birkaç gün veya hafta boyunca 4 °C'de saklanabilir. Bileşiklerin yıkama çözeltisi adım 5.18'den önce aspire edilmelidir. - Çok kanallı bir mikropipet kullanarak, tüm kuyucuklara 200 μL geçirgenlik solüsyonu dağıtın ve 15 dakika boyunca etki etmesine izin verin. Bir plaka yıkayıcı kullanarak, geçirgenleştirici çözeltiyi aspire edin.
- Çok kanallı bir mikropipet kullanarak, 100 μL boyama solüsyonunu manuel olarak dağıtın ve plakaları oda sıcaklığında 30 dakika inkübe edin.
- Bir plaka yıkayıcı kullanarak, plakaları bileşiklerin yıkama solüsyonuyla yıkayın (kuyu başına 200 μL ile 3x). Sonunda, lekeli hücreleri bileşiklerin yıkama solüsyonunda bırakın.
- Plakaları yüksek içerikli bir görüntüleme sisteminde aşağıdaki ayarlarla tarayın:
Amaç: 20x Hava/0.4NA (96 mikrotitreli plakanın bir kuyusu, 57 görüş alanı (FOV)
Mod: Konfokal
DAPI (çekirdekler) için lazer 405 nm
mScarlet (bakteri) için lazer 561 nm
HCS Hücre Maskesi Koyu Kırmızı (sitoplazma) için lazer 640 nm
Z-yığını yok
NOT: Hücreler, geniş alan görüntüleme sistemi ile görüntülenebilir ve bu da çözünürlüğü azaltır. - Gece boyunca görüntü almak için bir ekipman taşıma robotu kurun. Bu robotik kol, insan müdahalesi olmadan yüksek içerikli görüntüleme sistemindeki plakaları değiştirir.
NOT: Bu zorunlu değildir; Plakalar manuel olarak değiştirilebilir.
6. Görüntü analizi
NOT: Görüntü analizi, görüntüleri elde etmek için kullanılan yüksek içerikli görüntüleme sistemi ile aynı olan analiz yazılımı ile gerçekleştirilir. Örnek görüntüler kullanılarak bir analiz işlem hattı oluşturulmalıdır (Ek Şekil 5). Daha sonra, tüm kuyuya (57 FOV) ve veri setine (tüm plakalar) uygulanacaktır. Analiz yazılımı, farklı ilgi alanlarının (çekirdekler, sitoplazma, hücreler ve bakteriler) segmentasyonuyla başlayan, bunları ilişkilendiren (örneğin, hücreler içindeki bakteriler) ve ardından morfolojik ve yoğunluk özelliklerini (örneğin, alan, yoğunluk) çıkaran mantıksal bir dizi adımı takip eder. Görüntü analizinin temel adımları aşağıda açıklanmıştır. Kullanılan protokolün tamamı Ek Şekil 5'te bulunabilir.
- DAPI sinyalini kullanarak çekirdekleri, DeepRed sinyalini kullanarak sitoplazmayı ve mScarlet sinyalini kullanarak bakterileri segmentlere ayırın.
- Hücreler için bir maske oluşturmak için çekirdek ve sitoplazma segmentasyonunu ilişkilendirin.
- Tüm kenarlık nesnelerini kaldırın. Yalnızca FOV'da dolu olarak görünen hücreler dikkate alınır (tam hücreler).
- Tüm hücreleri ve bakterileri ilişkilendirerek tüm hücrelerdeki çıktı popülasyonu Bakterileri tanımlayın.
- Enfekte olmuş bütün hücreleri birden fazla bakteri bölgesine sahip olarak ve enfekte olmamış bütün hücreleri birden az bakteri bölgesine sahip olarak tanımlayın.
- Tüm ilgi alanları bölümlere ayrıldıktan ve popülasyonlar oluşturulduktan sonra, özelliklerini hesaplayın ve çıkarın. Her kuyu için aşağıdaki özellikler çıkarılır.
- Tüm hücreler için / Enfekte olmuş bütün hücreler / Enfekte olmayan bütün hücreler, ekstrakt
Hücre sayısı (Kuyu başına toplam)
Alan [μm2] (Ortalama + Kuyu başına standart sapma)
Genişlik-uzunluk hücre oranı (Ortalama + Kuyu başına standart sapma) - Tüm hücrelerdeki bakteriler için, özü
Tanımlanan bakteri bölgelerinin sayısı (Kuyucuk başına toplam)
Yoğunluk (Her bölgenin ortalama yoğunluğunun kuyu başına toplamı)
Bölgenin alanı (Kuyu başına toplam)
- Tüm hücreler için / Enfekte olmuş bütün hücreler / Enfekte olmayan bütün hücreler, ekstrakt
- Verileri dışa aktardıktan ve bir elektronik tabloda düzenledikten sonra, hücre içi yükü (Mycoload) aşağıdaki formüle göre ölçün:
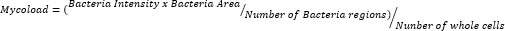
Sonuçlar
Z' faktörü değerlendirmesi
Şekil 2, Z' faktörünü hesaplamak için gerçekleştirilen iki deneyden birinin verilerini göstermektedir. Pozitif kontrol 4 μg/mL'de klaritromisin idi. Her iki deney de 0.64 ve 0.62'lik Z' faktörlerini verdi, bu da bu test için kullanılan koşulların ve okumanın takip eden tarama testine uygulanabileceği anlamına gelir (Z' > 0.5). Bununla birlikte, her deneyin performansını kontrol etmek için kalan tüm deneyler (enfeksiyon testi) için Z' faktörü hesaplandı.
Tasarlanan HTS testinin kavram kanıtı olarak, ilacın yeniden kullanılması amaçlanan bir bileşik kütüphanesi test edildi. %95'i hem FDA hem de EMA onaylı ilaçlar olan 1280 çeşitli ve küçük molekülden oluşur. Bu moleküller yüksek kimyasal ve farmakolojik çeşitlilik sunar.
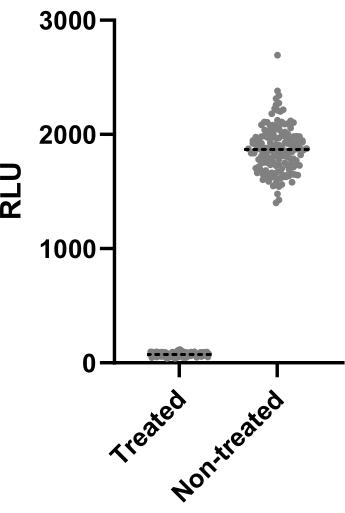
Şekil 2: Z' faktörü değerlendirme sonuçları. 2.5 x 105 CFU / mL'de Mab, 37 ° C'de 48 saat boyunca 4 μg / mL'de klaritromisin ile ve klaritromisin olmadan inkübe edildi. İnkübasyon döneminden sonra, mikobakteriyel canlılığı değerlendirmek için lüminesans ölçüldü. Grafik, tek bir bağımsız deneyde tedavi edilmiş ve tedavi edilmemiş canlı mikobakterilerin bireysel lüminesans değerlerini göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hitler için kütüphane taraması
Tüm bileşikler Mab'a karşı 6.66 μM'de test edildi. Kütüphanenin büyüklüğü nedeniyle, bileşikler dört farklı mikrotitre 384 oyuklu plakaya bölünmüştür (Şekil 3A-D). Sonuçlar hem çözücü hem de doğrulanmış kenar etkisi için normalleştirildi.
Bu tarama testinde, otuzu lüminesans emisyonunu önemli ölçüde azaltan ve mikobakteriyel canlılığı azaltan otuz üç isabet tespit edildi (Şekil 3). İlginç bir şekilde, üç bileşik, muhtemelen artan bakteri metabolizması veya proliferasyonu ile ilgili olarak daha yüksek lüminesans emisyonuna yol açtı (Şekil 3). 33 isabetin tümü, bu profilin korunup korunmayacağını test etmek için lüminesansı artıran üç bileşik de dahil olmak üzere doğrulama testine tabi tutuldu.
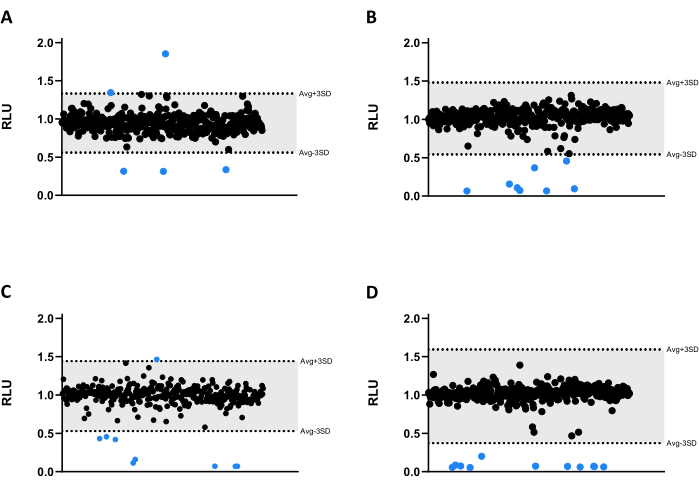
Şekil 3: Kütüphane tarama sonuçları. (AD) 2.5 x 105 CFU / mL'de Mab, 37 ° C'de 48 saat boyunca 6.66 μM'de 1280 bileşik ile inkübe edildi. İnkübasyondan sonra, mikobakteriyel canlılığı değerlendirmek için lüminesans ölçüldü. Grafikler, çözücü ve kenar etkisi normalizasyonundan sonra keyfi birimler olarak sunulan bağımsız bir deneyin RLU'sunu göstermektedir. AVG RLU ve karşılık gelen SD, bir eşik belirlemek için her plaka için hesaplandı (gri renkte; ORT ± 3SD). Yuvarlak semboller test edilmiş bir bileşiği temsil eder. Mavi renkte, bu eşiğin dışındaki herhangi bir bileşik isabet olarak kabul edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
İsabet doğrulama testi
Bu test için kullanılan konsantrasyonlar 13.3 μM, 6.66 μM ve 3.3 μM idi. Sağlamlığı artırmak için her bileşik iki kez test edildi.
Daha da önemlisi, daha önce daha yüksek RLU ile ilişkilendirilen 30, 31 ve 32 bileşikleri (Şekil 3A,C), bileşik 32 ile muamele edilen kuyucuklarda elde edilen mikobakteriyel canlılığın %200'ünden fazlası ile bu profili korumuştur (Şekil 4).
Test edilen tüm konsantrasyonlarda mikobakteriyel canlılık %100'e yakın olduğu için 20 ve 33 numaralı bileşikler inaktif olarak kabul edildi (Şekil 4).
Bileşik 9 ve 21, en düşük iki konsantrasyonda benzer hareketsizlik gösterdi; bununla birlikte, 20'nin aksine, en yüksek 13.3 μM'de aktif kalırlar ve bileşik 21 daha yüksek etki gösterir (Şekil 4).
Bileşik 3 ayrıca, bileşik 21'den daha az olmasına rağmen, en düşük konsantrasyonda hareketsizlik ve 6.66 μM'de bir aktivite kaybı gösterir (Şekil 4). Sadece en düşük konsantrasyonda, 2, 7, 8, 10, 16, 18, 24 ve 28 bileşikleri daha düşük terapötik potansiyel göstermiştir. Bununla birlikte, 2, 10 ve 28 hala mikobakteriyel canlılığın% <50'sine yol açar.
Küresel olarak, kalan on dört bileşik, test edilen tüm konsantrasyonlarda aktifti.
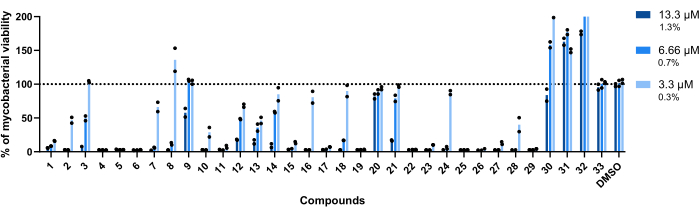
Şekil 4: İsabet doğrulama tahlili sonuçları. 2.5 x 105 CFU / mL'de Mab, daha önce tanımlanan her bir isabet ile 13.3 μM, 6.66 μM ve 3.3 μM'de (sırasıyla% 1.3,% 0.7 ve% 0.3 DMSO) 37 ° C'de 48 saat boyunca inkübe edildi. İnkübasyon döneminden sonra, mikobakteriyel canlılığı değerlendirmek için lüminesans ölçüldü. Grafik, her bir bileşiğin iki kez test edildiği bağımsız bir deneyin tedavi edilmemiş mikobakterilerine göre tedavi edilmiş canlı mikobakterilerin yüzdelerini gösterir. Yuvarlak semboller, her bileşik için kopyaları temsil eder. Çubuklar, bu kopyaların ortalamasını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Enfeksiyon tahlili
Test edilen otuz üç bileşikten yirmi sekizi enfeksiyon testi için seçildi (Şekil 4). Bu test için 7, 8, 9, 20 ve 33 bileşikleri seçilmemiştir. 9, 20 ve 33, doğrulandıklarında aktif olmamaları nedeniyle dışarıda bırakılırken (Şekil 4), ilk ikisi teknik nedenlerden dolayı dışarıda bırakıldı. Bununla birlikte, bu bileşikler, Mab enfeksiyonlarını tedavi etmek için halihazırda kullanılan antibiyotikler olan rifampisin ve linezolid olarak tanımlandı12. Enfeksiyon tahlilinde test edilen tüm bileşikler tanımlanmış ve Tablo 1'de listelenmiştir. Bileşiklerin Mab ile enfekte makrofajlara karşı antimikrobiyal aktivitesi, bakterilerin içsel floresansı bir okuma olarak kullanılarak değerlendirildi.
| Bileşik | Ad | Bileşik | Ad |
| 1 | Sülfatiyazol | 18 | Sefuroksim |
| 2 | Siprofloksasin | 19 | Rifaximin Belediyesi |
| 3 | Sefotaksim | 21 | Cefdinir |
| 4 | Daunorubisin | 22 | Klaritromisin |
| 5 | Doksorubisin | 23 | Besifloksasin |
| 6 | Thiostrepton | 24 | Levofloksasin |
| 10 | Amikasin | 25 | Rifabutin |
| 11 | Moksalaktam | 26 | Gatifloksasin |
| 12 | Sülfametizol | 27 | Epirubisin |
| 13 | Sülfamonometoksin | 28 | Pyrvinium pamoat |
| 14 | Sefoksitin | 29 | Moksifloksasin |
| 15 | Novobiyosin | 30 | Troleandomisin |
| 16 | Sefmetazol | 31 | Lincomycin (Lincomycin) |
| 17 | Roksitromisin | 32 | Spiramisin |
Tablo 1: Enfeksiyon tahlilinde test edilen bileşiklerin listesi. Adım 4'te doğrulanan bileşikler enfeksiyon testinde test edildi (adım 5).
Bileşiklerin Mab ile enfekte makrofajlara karşı toksisitesi, değerlendirilen ilk parametreydi. Bir bileşiğin toksik veya toksik olmadığını kabul etmek için belirlenen eşik, canlı makrofajların %85'i idi (Şekil 5). Test edilen yirmi sekiz bileşikten 4, 5, 6, 27 ve 28'i toksik olarak kabul edildi. (Şekil 5). Bu nedenle, bu beş bileşik aşağıdaki intramakrofajik aktivite değerlendirmesinden çıkarıldı.
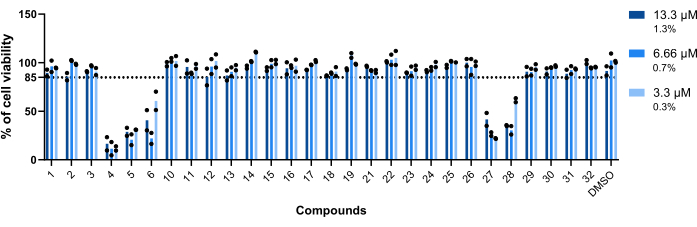
Şekil 5: Hitlerin Mab ile enfekte makrofajlara karşı toksisitesi. BALB / c fareleri BMM'leri Mab (MOI = 1) ile enfekte edildi ve daha önce tanımlanan her bir isabet ile 13.3 μM, 6.66 μM ve 3.3 μM'de (sırasıyla% 1.3,% 0.7 ve% 0.3 DMSO) 37 ° C'de% 7 CO2 ile% 48 saat boyunca inkübe edildi. Hücreler, hücre canlılığını ölçmek için çekirdek sayısı (DAPI ile boyanmış) kullanılarak yüksek içerikli bir tarama floresan mikroskobunda görüntülendi. Grafik, iki bağımsız deneyin canlı tedavi edilmemiş enfekte makrofajlarına göre canlı tedavi edilmiş enfekte makrofajların yüzdelerini göstermektedir. Yuvarlak semboller, her tahlil için hücrenin canlılığını temsil eder. Çubuklar, iki bağımsız deneyin ortalamasını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kalan yirmi üç bileşiğin hücre içi Mab'a karşı intramakrofajik aktivitesini çıkarmak için (Şekil 6), tedavi edilmemiş enfekte makrofajlara normalize edilmiş mikobakteriyel canlılık yüzdesini elde etmek için Mycoload formülü (daha önce adım 6'da açıklanmıştır) kullanılmıştır. Çoğu bileşik, içselleştirilmiş mikobakterilere karşı terapötik potansiyellerini kaybetti (Şekil 6) isabet doğrulama testine (Şekil 4) kıyasla, test edilen en yüksek konsantrasyonda isabet sayısı yirmi beşten altıya düştü. Çarpıcı bir şekilde, tedavi edilmeyen bakterilere kıyasla planktonik Mab'ın canlılığını artıran üç bileşik de (30, 31 ve 32; Şekil 3 ve Şekil 4), hücre içi Mab'a karşı antimikobakteriyel aktivite göstermiştir, 30 ve 32 bileşikleri, bileşik 32 durumunda 3.3 μM'de bile, DMSO ile karşılaştırıldığında önemli bir istatistiksel fark göstermiştir (Şekil 6). 11 ve 23 bileşikleri ile muamele edilen mikobakteriler, 13.3 μM'de% <50 canlılık gösterdi; ancak bu, DMSO kontrolünden önemli ölçüde farklı değildi (Şekil 6). 21, 26 ve 29 numaralı bileşikler, 13.3 μM'de önemli bir istatistiksel farkı garanti edecek kadar güçlüydü ve 29 en aktif olanıydı (Şekil 6). Son olarak, 17, 22 ve 25 bileşikleri, içselleştirilmiş mikobakterilere karşı test edilen tüm konsantrasyonlarda son derece güçlüydü. Bunlar sırasıyla roksitromisin, klaritromisin ve rifabutin olarak tanımlandı (Tablo 1). Üç bileşikten klaritromisin, Mab'a karşı en aktif olanıydı, mikobakteriyel canlılık hiçbir zaman% 10'u geçmedi ve DMSO'ya kıyasla test edilen tüm konsantrasyonlarda <0.0001'lik bir p değeri sundu (Şekil 6).
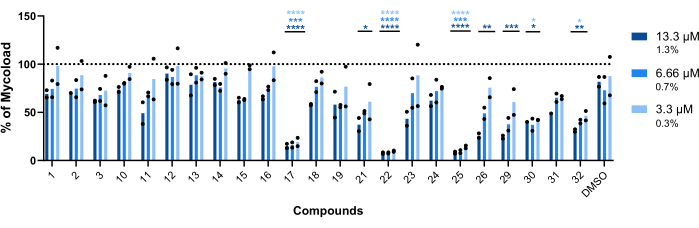
Şekil 6: Mab ile enfekte makrofajlara karşı isabetlerin intramakrofajik aktivitesi. BALB / c fareleri BMM'leri MAB (MOI = 1) ile enfekte edildi ve daha önce tanımlanan her bir isabetle 13.3, 6.66 ve 3.3 μM'de (sırasıyla DMSO'nun% 1.3, 0.7 ve 0.3'ü) 48 saat boyunca% 7 CO2 ile 37 ° C'de inkübe edildi. Hücreler, yüksek içerikli bir tarama floresan mikroskobunda görüntülendi ve Mycoload'u hesaplamak için floresan sinyali kullanıldı (bkz. adım 6). Grafik, iki bağımsız deneyde tedavi edilmeyen enfekte makrofajlara göre tedavi edilen enfekte makrofajlarda bulunan Mycoload yüzdelerini göstermektedir. İstatistikler Dunnet'in çoklu karşılaştırma testi ile iki yönlü varyans analizi (ANOVA) kullanılarak gerçekleştirilmiş; *, p < 0.05; **, p < 0.01; , p < 0.001; , p < 0.0001 DMSO (solvent kontrolü) ile karşılaştırıldığında. Yıldız işaretleri, her konsantrasyon için grafiğin göstergesiyle aynı renk kodunu takip eder. Yuvarlak semboller, her tahlil için Mycoload'u temsil eder. Çubuklar, iki bağımsız deneyin ortalamasını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Z' faktörü değerlendirmesinde kullanılan 384 kuyulu bir plaka düzeni örneği. Beyaz - boş kuyular (yalnızca sıvı büyüme ortamı); sarı - pozitif kontrol (bir antibiyotikle tedavi edilen bakteriler); kırmızı - negatif kontrol (tedavi edilmemiş bakteriler). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Kütüphane taramasında kullanılan 384 kuyulu plaka düzeni örneği. Beyaz - boş kuyular (yalnızca sıvı büyüme ortamı); yeşil - çözücü kontrolü; kırmızı - negatif kontrol (tedavi edilmemiş bakteriler); mavi - taranacak bileşikler. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: İsabet doğrulaması için kullanılan 384 kuyulu bir plaka düzeni örneği. Beyaz - boş kuyular (yalnızca sıvı büyüme ortamı); yeşil - çözücü kontrolü (kopyalar halinde); kırmızı - negatif kontrol (tedavi edilmemiş bakteriler); mavi - taranacak bileşikler (kopyalar halinde). Soluk renkler 1:2 seri seyreltmeleri temsil eder. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 4: Bir enfeksiyon testi için kullanılan 96 oyuklu bir plaka düzeni örneği. Beyaz - boş kuyular (buharlaşmayı önlemek için su); kırmızı - negatif kontrol (tedavi edilmemiş makrofajlar); sarı - pozitif kontrol (bir antibiyotikle tedavi edilen makrofajlar); yeşil - çözücü kontrolü; mavi - test edilecek bileşikler. Soluk renkler 1:2 seri seyreltmeleri temsil eder. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 5: Görüntü analizi protokolü. Bu çalışmada, açık kaynaklı yazılıma uyarlanabilen ayrıntılı bir görüntü analizi protokolü kullanılmaktadır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, evde geliştirilen suşlarda kullanılarak Mab'a karşı bir ilaç tarama boru hattını tanımlar10. Sıvı işleme robotları, otomatik mikroskopi ve analiz ve çift raportör suşları kullanılarak, bakteri canlılığı, reaktif eklemeden veya ekstra adımlar gerçekleştirmeden lüminesans veya floresan kullanılarak hızlı bir şekilde değerlendirilir. Bu yaklaşım, HTS testlerinin amacı göz önüne alındığında önemli bir avantaj olan testler arasındaki süreyi ve değişkenliği azaltır.
Binlerce bileşiği tararken, etkili bir ilacın kolayca tanımlanması gerekir. Bu amaçla, Z' faktörü genellikle istatistiksel etki boyutunu ölçmek için kullanılır ve testin performansını çıkarır. Z faktörü 0.5 >, test edilen koşullar tedavi edilen ve edilmeyen popülasyonları ayırt etmek için optimaldir13. Test edilen koşullar, Z' faktörlerini > 0.6 (Şekil 2) verdi ve istatistiksel olarak bir tarama kampanyasına uygulanabileceklerini kanıtladı. Bu adım, taramanın etkinliğini sağlamak için çok önemlidir.
Bu nedenle, planktonik olarak büyüyen Mab'a karşı binlerce bileşiğin antimikrobiyal aktivitesini tespit etmek için bir HTS protokolü geliştirilmiştir. Mab hücre içi fakültatif bir patojen olduğundan, tasarlanan protokol aynı bakteri suşuna karşı hücre içi antimikrobiyal aktiviteyi de tarar - kritik bir avantaj. Ayrıca, konakçı hücrelere yönelik toksisite de değerlendirilebilir. Bu nedenle, sitotoksisite ile birlikte antimikrobiyal aktiviteyi değerlendirmek için farklı deney düzenekleri kullanılarak MAB'a karşı ilaç taramasına yönelik çok aşamalı bir yaklaşım tanımlanmıştır ve başarı şansını artırmaktadır. Kavram kanıtı olarak, 1280 bileşikten oluşan bir kimyasal kütüphane tarandı.
Toplam otuz üç isabet tespit edildi (Şekil 3). Bunlardan üçü, sıvı kültürlerde mikobakteriyel canlılığı önemli ölçüde arttırdı (bileşikler 30, 31 ve 32; Şekil 3 ve Şekil 4). Bu bileşiklerin, bakteri canlılığını etkilemeden lüminesans emisyonuna müdahale edebileceğine dikkat edilmelidir. İçselleştirilmiş mikobakterilere karşı test edildiğinde, bu bileşikler antimikrobiyal aktivite gösterdi (Şekil 6), bu da konakçı hücre içselleştirmesinden sonra Mab'a karşı daha yüksek bir etkinlik gösterdi. Bu bileşikler troleandomisin (30), spiramisin (32) ve lincomycin (31; Tablo 1). İlk ikisi, mikobakteriyel enfeksiyonları16 tedavi etmek için kullanılan bir antibiyotik sınıfı olan makrolidlerdir ve ikincisi, makrolidlere17 benzer bir etki mekanizmasına sahip bir antibiyotik olan bir lincosamiddir. MAB'ın hem sıvı hem de katı kültürlerde başka bir lincosamide olan klindamisin'e özellikle dirençli olduğu bildirilmiştir18. Bununla birlikte, immünomodülatör ve antienflamatuar özellikler, içselleştirilmiş mikobakterilere karşı artan antimikrobiyal aktiviteyi açıklayabilen makrolidler19,20 ve lincosamidler21 ile ilişkilendirilmiştir (Şekil 6).
Kalan otuz isabetten on biri, tüm konsantrasyonlarda mikobakteriyel canlılığı% >90 oranında azaltır (Şekil 4). Tipik bir HTS testinin beklenen isabet oranının ~%1 olduğu göz önüne alındığında22, geliştirilen protokol genellikle gözlemlenenlerle uyumludur. Bununla birlikte, birkaç başka bileşik hala aktifti ve yirmi sekizi enfeksiyon testine devam etti.
Tanımlanan bileşiklerden beş bileşik toksik olarak kabul edildi (Şekil 5) - daunorubisin (4), doksorubisin (5), epirubisin (27), tiostrepton (6) ve pirvinyum pamoat (28; Tablo 1). İlk üçü anti-neoplastik ajanlardır 23,24,25, bu yüzden şaşırtıcı olmayan bir şekilde, bu tahlilde kullanılan memeli hücreleri için toksiktirler. Pyrvinium pamoate uzun yıllar etkili bir antelmintik olarak kullanıldı; Bununla birlikte, 2004 yılından bu yana, anti-neoplastik faaliyetlerle de bağlantılıdır26. Son olarak, tiostrepton, veterinerlik tıbbında sıklıkla kullanılan ve insanlarda kullanım için hiçbir zaman onaylanmamış bir oligopeptittir27. Bu ilacın meme kanseri hücrelerine karşı aktivitesi bildirilmiştir28. Thiostrepton'un intramakrofajik aktivitesi, kemik iliği kaynaklı makrofajlar üzerindeki toksisitesi nedeniyle değerlendirilmemiştir (Şekil 5). Bununla birlikte, tiostreptonun Mab ile enfekte THP-1 hücreleri29 üzerinde 5 μM'de etkili olduğu gösterilmiştir. Planktonik bakterilere29 karşı bildirilen sonuçlar, bu taramada elde edilenlere benzerdir ve tiostrepton son derece güçlüdür (Şekil 4).
İntramakrofajik aktivite açısından taranan bileşiklerin çoğu terapötik potansiyel göstermemiştir (Şekil 6). Bakteri hücre içi büyüme, planktonik kültürlerden önemli ölçüde farklıdır. İkincisinde, bakteri ve ilaçlar arasında doğrudan temas her zaman mümkündür. İlkinde, konakçı hücreler tarafından içselleştirme nedeniyle, birkaç konak zarı, ilaçların hedefe ulaşmak için transpoze etmesi gereken fiziksel engeller olarak işlev görür ve bu da çoğu isabetin azalmış antimikrobiyal aktivitesini açıklamaya yardımcı olabilir. En yüksek konsantrasyonda, 13.3 μM'de, üç bileşik, DMSO kontrolünden istatistiksel olarak farklı olmak için yeterli gücü gösterdi (Şekil 6) - sefdinir (21), gatifloksasin (26) ve moksifloksasin (29; Tablo 1). Moksifloksasin halihazırda ikinci basamak bir anti-tüberküloz ilacı16 olarak kullanılırken, sefdinir, pnömoni30 gibi çeşitli solunum yolu bakteriyel enfeksiyonlarını tedavi etmek için yaygın olarak kullanılmaktadır. Bununla birlikte, M. tuberculosis31 ve Mab'a karşı aktivitesi bildirilmiştir ve son32'ye karşı bir karbapenem ile güçlü bir sinerjik etki göstermiştir. Gatifloksasin bir florokinolondur ve son33,34 içinde birkaç mikobakteriye karşı aktivitesi bildirilmiştir. Bu testteki en aktif üç bileşik (Şekil 6) roksitromisin (17), klaritromisin (22) ve rifabutin (25; Tablo 1), tüm konsantrasyonlarda son derece güçlüdür. İlk ikisi makroliddir, rifabutin ise bir rifamisindir ve her iki sınıf da birçok mikobakteriyel enfeksiyona karşı tedavinin temelini oluşturur16.
Bu tarama, tahliller arasındaki değişkenliği azaltmak için özel ve pahalı sıvı işleme ekipmanına dayanır. Son derece tekrarlanabilir olmasına rağmen, sıvı işleyici, akustik gibi temassız bir bileşik transferine sahip değildir. Bu nedenle, bazı yapışkan bileşikler, transferler arasında metal pimlere bağlı kalabilir, takip eden kuyucuklara devam edebilir ve tarama aşaması sırasında yanlış pozitiflere neden olabilir - bu, bileşik 33'te olan şeydi. Bu nedenle, taramanın doğrulanması, başarısı için çok önemlidir ve hiçbir yanlış pozitifin ilaç tarama boru hattının sonraki adımlarına geçmemesini sağlar. Enfeksiyon testi, bakteri bölgelerinin mümkün olan en iyi tanımını elde etmek için konfokal modlu yüksek içerikli bir görüntüleme sistemi kullanır. Bununla birlikte, bir tanım kaybında da olsa ve muhtemelen bakteri bölgelerinin tanımlanmasını engellese de, konfokal bir mod olmadan kullanmak hala mümkündür. Bu protokol, görüntüleme sistemi ile entegre edilmiş basit ve kullanıcı dostu analiz yazılımından yararlanır; ancak, protokole uygun olarak açık kaynaklı yazılım kullanılabilir (Ek Şekil 5). Sonuç olarak, Mab enfeksiyonlarını tedavi etmek için ilaçları yeniden kullanmamasına rağmen, bu sonuçlar son derece önemlidir çünkü daha büyük kütüphanelere genişletilebilen yerleşik protokolü doğrularlar. Daha da önemlisi, bu protokolün floresan veya ışıldayan okumaların mevcut olması koşuluyla herhangi bir bakteriye uyarlanabileceğine inanıyoruz. Bu nedenle, bu çalışma, en büyük halk sağlığı sorunlarından biri olan antibiyotiğe dirençli bakteriler ve özellikle de neredeyse inatçı bir patojen olan Mycobacterium abscessus ile savaşmaya yardımcı olmak için gerekli araçları sağlayarak ilaç keşif alanına önemli ölçüde katkıda bulunur.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, PTDC/BIA-MIC/3458/2020 (DOI: 10.54499/PTDC/BIA-MIC/3458/2020) projesi kapsamında FCT - Fundação para a Ciência e a Tecnologia, I.P aracılığıyla Portekiz ulusal fonları tarafından finanse edilmektedir ve GSO'ya 2021.07335.BD doktora bursları ve SPK'ya UI/BD/150830/2021; FWO - Flanders Araştırma Vakfı, hibe n° 1S68720N; Yenilikçi Tıp Girişimi 2 Çağrı 16 (IMI2-Çağrı 16) önerisi RespiriTB 853903 numaralı anlaşma kapsamında. Yazarlar, ulusal altyapılar PT-OPENSCREEN (NORTE-01-0145-FEDER-085468) ve PPBI - Portekiz Biyogörüntüleme Platformu (PPBI-POCI-01-0145-FEDER-022122) üyesi olan i3S Bilimsel Platform BioSciences Screening'in desteğini kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% Neutral buffered formalin | Bio Optica | 05-01005Q | fixation solution |
| 384-well black round bottom polypropylene not treated microplate | Corning | 3658 | White microplates can be used; polystyrene can be used |
| 50 TS Washer | BioTek | ||
| Breathe-Easy sealing membrane | Sigma-Aldrich | Z380059-1PAK | |
| cell::explorer | Revvity | equipment handling robot | |
| Clarithromycin | Sigma-Aldrich | A3487-100MG | Dissolved in DMSO to the desired concentration |
| DMSO | Fisher Scientific | D/4121/PB15 | Dilute in liquid growth medium to the desired concentration |
| Harmony 5.1 | Revvity | analysis software | |
| Heracell VIOS 160i CO2 Incubator, 165 L | Thermo Scientific | cell incubator | |
| JANUS with 4 Tip Arm and MDT Arm | Revvity | liquid handler | |
| KB 8182 | Termaks | incubator with agitation | |
| Libra S4+ | Biochrom | ||
| Multidrop Combi Reagent Dispenser | Thermo Scientific | ||
| Opera Phenix Plus | Revvity | imaging system | |
| PhenoPlate | Revvity | 6055302 | Necessary for high-content microscopes |
| Phosphate Buffer Saline (PBS) 1x | NA | NA | washing solution |
| Prestwick Chemical libraries | Commercial chemical library intended for drug repurposing | ||
| Shaking incubator 3031 | GFL | ||
| VICTOR Nivo | Revvity | ||
| Cell culture medium: | When needed, add 10% of supplement | ||
| DMEM | Gibco | 10938-025 | |
| Fetal Bovine Serum (FBS) | Biowest | S1810 | |
| HEPES Buffer Solution (1 M) | Gibco | 15630-056 | |
| LCCM | NA | NA | Conditioned media from L929 cell line that releases Macrophage colony stimulating factor (M-CSF); cell culture medium supplement |
| L-glutamin (200 mM) | Thermo Scientific | 25030024 | |
| Sodium Pyruvate 100 mM (100X) | Gibco | 11360-039 | |
| Infection washing solution | |||
| Apirogenic water | Multiple suppliers available | ||
| Hank's Balanced Salt Solution 10x | Gibco | 14060-040 | Dilute to 1x with apirogenic water |
| Permeabilising Solution | PBS with 0.1% Triton X100 | ||
| PBS 1x | NA | NA | |
| Triton X100 | Sigma-Aldrich | T8787 | Other suppliers available |
| Staining solution | PBS with DAPI (500 ng/mL) and HCS Far Red (10 ng/mL) | ||
| DAPI | Sigma-Aldrich | D9564 | |
| HCS Far Red | Invitrogen | H32721 | |
| PBS 1x | NA | NA | Multiple suppliers available |
| Liquid growth medium | When needed, add 10% supplement | ||
| Middlebrook 7H9 Broth | BD Difco | 271310 | |
| Tween80 | Sigma-Aldrich | P4780 | 0.05% final concentration. Other suppliers available |
| Liquid growth medium supplement: | |||
| Bovine Serum Albumin | Fisher Scientific | BP9702-100 | |
| D-Glucose anhydrous | Fisher Scientific | G/0450/60 |
Referanslar
- Victoria, L., Gupta, A., Gomez, J. L., Robledo, J. Mycobacterium abscessus complex: A review of recent developments in an emerging pathogen. Front Cell Infect Microbiol. 11, 659997(2021).
- Luthra, S., Rominski, A., Sander, P. The role of antibiotic-target-modifying and antibiotic-modifying enzymes in Mycobacterium abscessus drug resistance. Front Microbiol. 9, 2179(2018).
- Nathavitharana, R. R., Strnad, L., Lederer, P. A., Shah, M., Hurtado, R. M. Top questions in the diagnosis and treatment of pulmonary M. abscessus disease. Open Forum Infect Dis. 6 (7), ofz221(2019).
- Cristancho-Rojas, C., et al. Epidemiology of Mycobacterium abscessus. Clin Microbiol Infect. 30 (6), 712-717 (2024).
- Hua, Y., et al. Drug repositioning: Progress and challenges in drug discovery for various diseases. Eur J Med Chem. 234, 114239(2022).
- Doan, T. L., Pollastri, M., Walters, M. A., Georg, G. I. The future of drug repositioning. Annual reports in medicinal chemistry. Macor, J. E. , Academic Press. 385-401 (2011).
- Bento, C. M., Gomes, M. S., Silva, T. Evolution of antibacterial drug screening methods: Current prospects for mycobacteria. Microorganisms. 9 (12), 2562(2021).
- Attene-Ramos, M. S., Austin, C. P., Xia, M. High throughput screening. Encycl Toxicol. 3, 916-917 (2014).
- Gupta, R., Netherton, M., Byrd, T. F., Rohde, K. H. Reporter-based assays for high-throughput drug screening against Mycobacterium abscessus. Front Microbiol. 8, 2204(2017).
- Bento Clara, M., et al. Characterization of novel double-reporter strains of Mycobacterium abscessus for drug discovery: A study in mScarlet. Microbiol Spectr. , e0036224(2024).
- Kolbe, K., et al. Development and optimization of chromosomally-integrated fluorescent Mycobacterium tuberculosis reporter constructs. Front Microbiol. 11, 591866(2020).
- Lopez-Roa, P., Esteban, J., Munoz-Egea, M. C. Updated review on the mechanisms of pathogenicity in Mycobacterium abscessus, a rapidly growing emerging pathogen. Microorganisms. 11 (1), 90(2022).
- Bray, M. A., Carpenter, A. Advanced assay development guidelines for image-based high content screening and analysis in Assay guidance manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD). (2004).
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. CLSI document M07-A10. , 10th ed, Wayne, PA. (2015).
- Silva, T., et al. Lactoferricin peptides increase macrophages' capacity to kill Mycobacterium avium. mSphere. 2 (4), e00301-e00317 (2017).
- Bento, C. M., Gomes, M. S., Silva, T. Looking beyond typical treatments for atypical mycobacteria. Antibiotics (Basel). 9 (1), 18(2020).
- Spizek, J., Rezanka, T. Lincosamides: Chemical structure, biosynthesis, mechanism of action, resistance, and applications. Biochem Pharmacol. 133, 20-28 (2017).
- Hurst-Hess, K. R., Rudra, P., Ghosh, P. Ribosome protection as a mechanism of lincosamide resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 65 (11), e0118421(2021).
- Kang, J. K., Kang, H. K., Hyun, C. G. Anti-inflammatory effects of spiramycin in lps-activated raw 264.7 macrophages. Molecules. 27 (10), 3202(2022).
- Zimmermann, P., Ziesenitz, V. C., Curtis, N., Ritz, N. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms. Front Immunol. 9, 302(2018).
- Pradhan, S., Madke, B., Kabra, P., Singh, A. L. Anti-inflammatory and immunomodulatory effects of antibiotics and their use in dermatology. Indian J Dermatol. 61 (5), 469-481 (2016).
- Volochnyuk, D. M., et al. Evolution of commercially available compounds for hts. Drug Discov Today. 24 (2), 390-402 (2019).
- Sritharan, S., Sivalingam, N. A comprehensive review on time-tested anticancer drug doxorubicin. Life Sci. 278, 119527(2021).
- Arwanih, E. Y., Louisa, M., Rinaldi, I., Wanandi, S. I. Resistance mechanism of acute myeloid leukemia cells against daunorubicin and cytarabine: A literature review. Cureus. 14 (12), e33165(2022).
- Khasraw, M., Bell, R., Dang, C. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. Breast. 21 (2), 142-149 (2012).
- Schultz, C. W., Nevler, A. Pyrvinium pamoate: Past, present, and future as an anti-cancer drug. Biomedicines. 10 (12), 3249(2022).
- Bailly, C. The bacterial thiopeptide thiostrepton. An update of its mode of action, pharmacological properties and applications. Eur J Pharmacol. 914, 174661(2022).
- Kwok, J. M., et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box m1 expression. Mol Cancer Ther. 7 (7), 2022-2032 (2008).
- Kim, T. H., et al. Thiostrepton: A novel therapeutic drug candidate for Mycobacterium abscessus infection. Molecules. 24 (24), 4511(2019).
- Perry, C. M., Scott, L. J. Cefdinir: A review of its use in the management of mild-to-moderate bacterial infections. Drugs. 64 (13), 1433-1464 (2004).
- Ramon-Garcia, S., et al. Repurposing clinically approved cephalosporins for tuberculosis therapy. Sci Rep. 6, 34293(2016).
- Kumar, P., et al. Mycobacterium abscessus l,d-transpeptidases are susceptible to inactivation by carbapenems and cephalosporins but not penicillins. Antimicrob Agents Chemother. 61 (10), e00866-e00917 (2017).
- Alvirez-Freites, E. J., Carter, J. L., Cynamon, M. H. In vitro and in vivo activities of gatifloxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother. 46 (4), 1022-1025 (2002).
- Braback, M., Riesbeck, K., Forsgren, A. Susceptibilities of Mycobacterium marinum to gatifloxacin, gemifloxacin, levofloxacin, linezolid, moxifloxacin, telithromycin, and quinupristin-dalfopristin (synercid) compared to its susceptibilities to reference macrolides and quinolones. Antimicrob Agents Chemother. 46 (4), 1114-1116 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır