Method Article
إجراءات الزراعة في المختبر لللولبية الشاحبة ، الزهري
In This Article
Summary
يصف هذا البروتوكول الزراعة في المختبر لمسببات الأمراض الزهرية اللولبية الشاحبة subsp. الشاحبة في الزراعة المشتركة مع خلايا الثدييات. الطريقة قابلة للتطوير. يمكن استخدامه لإنتاج كميات كبيرة من T. الشاحبة ولتوليد الثقافات النسيلية.
Abstract
لأكثر من قرن من الزمان ، اللولبية الشاحبة subsp. الشاحب، البكتيريا الحلزونية الشكل التي تسبب مرض الزهري ، لا يمكن نشرها إلا عن طريق تلقيح وحصاد الكائنات الحية من خصيتي الأرانب. في عام 2018 ، وصفنا طريقة لزراعة T. pallidumin vitro باستمرار. يستخدم هذا النظام الزراعة المشتركة مع الخلايا الظهارية للأرانب (خلايا Sf1Ep) في وسط زراعة الأنسجة المحتوية على المصل يسمى TpCM-2. يشبه وقت مضاعفة T. pallidum في الثقافة ذلك المقدر أنه يحدث أثناء العدوى الطبيعية (حوالي 33-45 ساعة). يمكن استزراع الكائن الحي بشكل مستمر مع وقت مرور قياسي قدره أسبوع واحد في بيئة منخفضة الأكسجين (1.5٪) عند 34 درجة مئوية. تحتوي هذه المقالة على بروتوكولات استزراع الشريطية الشاحبة ، وطرق نمو خلايا زراعة الأنسجة المطلوبة والحفاظ عليها ، وتقنية توليد سلالات متساوية الوراثة عن طريق الحد من التخفيف. توفر القدرة على زراعة T. pallidum في المختبر طرقا تجريبية جديدة لدراسة وفهم هذا الكائن الحي الغامض.
Introduction
اللولبية الشاحبة هي نوع من البكتيريا الحلزونية الشكل (تسمى اللولبيات) التي تسبب مرض الزهري والالتهابات ذات الصلة لدى البشر والرئيسيات الأخرى. مرض الزهري مرض خطير له آثار طويلة المدى على الأفراد المصابين ، ويقدر أن أكثر من 8 ملايين حالة جديدة من مرض الزهري تحدث في جميع أنحاء العالم كلعام 1. T. الشاحبة تم تقسيمها إلى ثلاثة أنواع فرعية بناء على الأمراض التي تسببها في البشر بالإضافة إلى الاختلافات الجينية الطفيفة: الأنواع الفرعية الشاحبة (التي تسبب مرض الزهري المنقول جنسيا) ، والأنواع الفرعية pertenue (الداء العليقي) ، والأنواع الفرعية المتوطنة (المسببة للزهري المتوطن) 2،3. T. pallidum subsp. pertenue يسبب أيضا التهابات في البابون والشمبانزي والرئيسيات الأخرى. كائن حي وثيق الصلة يسمى اللولبية (وتسمى أيضا اللولبية paraluisleporidarum) يسبب عدوى في الأرانب والأرانبالبرية 4،5. ترتبط كل هذه البكتيريا ارتباطا وثيقا ، مع هوية تسلسل الحمض النووي بنسبة تزيد عن 98٪ على مستوى الجينوم6،7،8. لكل منها كروموسوم دائري واحد صغير يبلغ حجمه حوالي 1.14 مليون زوج أساسي. أعضاء هذه المجموعة T. pallidum تم العثور عليها فقط بالاشتراك مع مضيفيها من الثدييات. على هذا النحو ، فهي مسببات الأمراض الملزمة التي تعتمد على الأنواع المضيفة للبقاء والنمو9،10.
بدأت محاولات استزراع T. pallidum في المختبر بعد فترة وجيزة من تحديده من قبل Schaudinn و Hoffman في عام 190511،12. ومع ذلك ، فشلت هذه الجهود في أن تؤدي إلى نمو ثابت وقابل للتكرار للكائن الحي. نتيجة لذلك ، T . شاحبة تتطلب الدراسات البحثية تكاثر الكائن الحي من خلال العدوى التجريبية لحيوانات المختبر ، والأكثر شيوعا الأرنب13،14. في عام 1981 ، قدم Fieldsteel et al.15 نظاما لزراعة الأنسجة عزز تكاثر سلالات T. pallidum لمدة تصل إلى أسبوعين. تضمن هذا النظام الزراعة المشتركة ل T. pallidum مع الخلايا الظهارية للأرانب ذات الذيل القطني Sf1Ep في وسط زراعة الأنسجة المعدلة (T. pallidum Culture Medium 1 ، TpCM-1) بناء على الحد الأدنى من الوسط الأساسي للنسر (MEM) و 20٪ مصل بقري جنين (FBS). كانت ظروف الاستزراع الأخرى المطلوبة هي الحضانة عند 34 درجة مئوية في جو يحتوي على 1.5٪ O2 و 5٪ CO29،16. في هذا النظام ، ترتبط T. pallidum بخلايا Sf1Ep وتتكاثر عندما تكون مرتبطة ارتباطا وثيقا بسطح خلية الثدييات. على الرغم من العديد من محاولات الزراعة الفرعية والتعديلات الأخرى ، فشل نظام Fieldsteel et al. في تعزيز النمو المستمر في المختبر .
في عام 2018 ، أفاد مختبرنا أن استخدام وسيط معدل يسمى TpCM-2 (حيث تم استبدال Mem الخاص ب Eagle's MEM بوسط زراعة أنسجة أكثر تعقيدا ، CMRL 1066) يوفر ل T. pallidum العناصر الغذائية المطلوبة للسماح بثقافة متسقة على المدىالطويل 17. حتى الآن ، أدى هذا التعديل إلى ثقافة متسقة ومستمرة لما لا يقل عن 5 سلالات من T. pallidum subsp. الشاحبة (Nichols و SS14 و Mexico A و UW231B و UW249B) وسلالة واحدة من T. pallidum subsp. endemicum (البوسنة أ) 18،19. على سبيل المثال ، تم الآن زراعة سلالة Nichols بشكل مستمر في المختبر لأكثر من 6 سنوات. حتى الآن ، لم تنجح محاولات استزراع عزلات الداء العليقي (T. pallidum subsp. pertenue) أو T. paraluiscuniculiin vitro 18. لا يزال نظام TpCM-2 يتطلب وجود خلايا Sf1Ep ، وتركيزات منخفضة من الأكسجين ، وحضانة عند 34 درجة مئوية ، مما يجعل النظام أكثر تعقيدا من معظم تقنيات الاستزراع البكتيري. ومع ذلك ، فإن هذا النظام المعدل لزراعة الشريطية الشاحبة كان مفيدا في تحديد متطلبات نمو البكتيريا18 ، وتحديد الحد الأدنى من التركيزات المثبطة (MICs) للمركبات والببتيدات المضادةللميكروبات 20،21،22،23،24،25 ، ونشر سلالات جديدة من أنسجة المريض التي تستنشق26 ، مما أدى إلى عزل التجمعات النسيلة ل الكائنالحي 27 ، الذي يميز نظام التباين المستضد tprK 27،28 ، فحص التعبير الجيني29 ، وإجراء تحليل الطفري30،31،32.
هنا ، نصف الطرق الحالية لزراعة T. pallidum في المختبر. نأمل أن تساعد هذه المعلومات في تسهيل التطبيق على نطاق أوسع لتقنية الثقافة في المختبر لتحسين تشخيص مرض الزهري والالتهابات اللولبية ذات الصلة وعلاجه والوقاية منه.
Protocol
ملاحظة: تتطلب جميع الخطوات استخدام تقنية معقمة ومواد وكواشف معقمة. يوصى باستخدام غطاء التدفق الصفحي لزراعة الأنسجة لتقليل أ) تعرض الأفراد للمواد المعدية و ب) إمكانية التلوث الميكروبي للثقافات.
1. إنشاء مخزونات خلايا Sf1Ep
ملاحظة: يمكن شراء الخلايا الظهارية للأرانب ذات الذيل القطني Sf1Ep كمخزونات مجمدة من مجموعة ثقافة النوع الأمريكي (انظر جدول المواد). يبدو أن الطبيعة البطيئة النمو ومعدل الأيض المنخفض لخلايا Sf1Ep هي المفتاح لقدرتها على دعم بقاء ونمو T. pallidum33 على المدى الطويل. لذلك ، لا ينصح بالاستبدال بمزارع خلايا الثدييات الأخرى. خلايا Sf1Ep ليست خط خلوي خالد ويمكن الحفاظ عليها لمدة 25-30 مقطعا فقط في الثقافة. لذلك ، من المهم الحفاظ على مخزون مجمد من خلايا Sf1Ep منخفضة المرور للاستخدام في المستقبل. تنشأ خطوط Sf1Ep الخالدة أحيانا أثناء الثقافة طويلة المدى لخلايا Sf1Ep. (ملاحظات غير منشورة). غالبا ما تنمو هذه الخطوط بشكل أسرع ويسهل التعامل معها. ومع ذلك ، في بعض الأحيان ، يفقدون القدرة على دعم نمو الشريطية الشاحبة . يمكن استخدام خطوط Sf1Ep الخالدة ثم استبدالها عندما تبدأ اللولبيات في النمو ببطء.
- قم بإعداد وسط خلية Sf1Ep وقم بتسخينه مسبقا في حاضنة 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 .
ملاحظة: يتكون وسط الخلية Sf1Ep من MEM من Eagle مكمل بنسبة 10٪ FBS ، و 1x MEM من الأحماض الأمينية غير الأساسية ، و 2 ملي مولار L-glutamine ، و 1 ملي مولار بيروفات الصوديوم. (انظر جدول المواد). يجب تعقيم الوسط بالترشيح ويمكن تخزينه عند 4 درجات مئوية لمدة تصل إلى شهرين. لا ينبغي استخدام المضادات الحيوية (مثل البنسلين والستربتومايسين) في وسط خلية Sf1Ep لأن ترحيل كميات ضئيلة من المضادات الحيوية سيتداخل مع نمو الشريطية الشاحبة. - قم بإذابة مخزون Sf1Ep المجمد بسرعة عند 37 درجة مئوية. امسح الجزء الخارجي من القارورة بنسبة 70٪ من الإيثانول.
- أضف 1 مل من وسط خلية Sf1Ep إلى التبريد واخلطه برفق. أضف خليط مخزون الخلية المتوسط / الخلوي إلى أنبوب طرد مركزي مخروطي معقم سعة 15 مل يحتوي على 5 مل من وسط الخلية Sf1Ep واخلطه برفق.
- حبيبات الخلايا عن طريق الطرد المركزي عند 100 × جم لمدة 7 دقائق. قم بإزالة المادة الطافية والتخلص منها ، مع الحرص على عدم إزعاج حبيبات الخلية.
- أعد تعليق خلايا Sf1Ep المذابة برفق في 15 مل من وسط خلية Sf1Ep الطازجة وانقلها إلى قارورة زراعة الأنسجة T75.
ملاحظة: تم تحسين استعادة خلايا Sf1Ep المذابة حديثا عن طريق الطرد المركزي لإزالة DMSO المستخدم لتجميد الخلايا. ومع ذلك ، يمكن حذف الخطوات 1.4-1.7 ويمكن زرع الخلايا المذابة من الخطوة 3 مباشرة في قارورة ثقافة الأنسجة T75 التي تحتوي على 14 مل من وسط خلية Sf1Ep. بعد الحضانة بين عشية وضحاها ، استبدل نصف الوسط بوسط Sf1Ep جديد لتخفيف DMSO المتبقي. - احتضان مزارع Sf1Ep في حاضنة زراعة الأنسجة المرطبة القياسية عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2. قم بفك أغطية قوارير زراعة الأنسجة غير ذات الفتحات للحفاظ على درجة حموضة متوسطة مناسبة.
2. مرور خلايا Sf1Ep
ملاحظة: تتم مراقبة نمو مزرعة الخلايا Sf1Ep باستخدام مجهر مقلوب باستخدام بصريات تباين الطور. عادة ما تستغرق الخلايا حوالي أسبوع للوصول إلى التقاء قريب. عندما تصل الخلايا إلى ~ 90٪ من التقاء ، يمكن تمريرها أو استخدامها لزراعة T. pallidum أو تحضير المخزونات المجمدة. يمكن تمديد عمر الثقافة إلى أسبوعين عن طريق استبدال نصف وسط الثقافة بعد أسبوع واحد من الثقافة.
- استنشق وتخلص من وسط نمو Sf1Ep من القارورة. اشطف طبقة الخلية ب 5 مل من PBS المعقم في درجة حرارة الغرفة (RT) ، وشفط وتخلص من شطف PBS.
- أضف 2.5 مل من التربسين EDTA إلى القارورة وأغلق الغطاء. هز القارورة ذهابا وإيابا لتغطية طبقة الخلية باستخدام التربسين-EDTA واحتضان القارورة عند 37 درجة مئوية لمدة 5 دقائق.
- اضغط على القارورة برفق لإخراج الخلايا. راقب تحت المجهر المقلوب لتأكيد تشتت خلايا Sf1Ep.
- أضف 5 مل من وسط نمو Sf1Ep وهز القارورة لتختلط مع التربسين-EDTA وتوقف عن عمل التربسين. قم بإزالة خلايا Sf1Ep العالقة إلى أنبوب مخروطي معقم.
- قم بقياس الخلايا باستخدام مقياس كثافة الدم أو عداد الخلايا الآلي.
- للحفاظ على مخزون الخلايا العاملة ، قم بنقل كمية (0.5-1.0 مل أو ~ 8 × 105 خلايا) من خليط الوسط / التربسين-EDTA / الخلية إلى قارورة ثقافة الأنسجة T75 الجديدة التي تحتوي على 15 مل من وسط Sf1Ep الطازج.
- بالنسبة لثقافة الشريطية الشاحبة ، قم بتخفيف الخلايا في وسط Sf1Ep إلى 0.25-0.5 × 105 خلايا / مل والبذور في أوعية زراعة مناسبة (الجدول 1).
- لتجميد خلايا Sf1Ep ، قم بالدوران في جهاز طرد مركزي منضدي بمعدل 100 × جم لمدة 7 دقائق. قم بإزالة المادة الطافية بعناية دون إزعاج حبيبات الخلية. أعد تعليق حبيبات الخلية في وسط Sf1Ep مكملا بنسبة 10٪ DMSO بدرجة زراعة الأنسجة.
- قم بتوزيع 1 مل من تعليق الخلية على كل تبريد وقم بتجميدها طوال الليل عند -70 درجة مئوية إلى -80 درجة مئوية في حاوية معزولة (مثل حامل أنبوب اختبار الستايروفوم) لتعزيز الاحتفاظ بالجدوى قبل نقل القوارير إلى وعاء مبرد من النيتروجين السائل.
3. زراعة T. الشاحبة
تنبيه: جميع T. pallidum الأنواع الفرعية والسلالات المسببة للأمراض للإنسان وتصنف على أنها مسببات الأمراض من مستوى السلامة الحيوية 2 (BSL-2)34. ومن الضروري اتخاذ التدابير المناسبة لحماية الموظفين؛ وتشمل هذه استخدام القفازات ومعدات الحماية الشخصية الأخرى (PPE) بالإضافة إلى تطهير الأسطح والمواد والسوائل التي يحتمل أن تتعرض للمثقبية الشاحبة. يتم تعطيل المثقبية الشاحبة بسهولة عن طريق التعرض ل 70٪ من الإيثانول أو المطهرات المتاحة تجاريا. يوصى باستخدام أغطية التدفق الصفحي بشكل متسق للتعامل مع العينات التي تحتوي على T. pallidum .
ملاحظة: T. pallidum هو كائن حي دقيق يمكن قتله ببضع ساعات من التعرض لمستويات الأكسجين في الغلاف الجوي9،16،35. لذلك ، يوصى بأن يقتصر التعامل مع الشريطية الشاحبة في الهواء على أقل من ساعة إن أمكن. أيضا ، يجب أن يكون وسط TpCM-2 متوازنا مسبقا في 1.5٪ O2 ، و 5٪ CO2 ، والتوازن N2 ، ويجب أن يكون التقليب القوي (على سبيل المثال ، استخدام الدوامة) محدودا. نظرا لأن زراعة الشريطية الشاحبة تجرى عادة في حالة عدم وجود مضادات حيوية ، فهناك حاجة إلى مزيد من العناية لتجنب التلوث بالبكتيريا أو الفطريات. الإجراء Sf1Ep-TpCM-2 لزراعة T. الشاحبة ملخص في الشكل 1 ويتضمن خطوات متعددة ، بما في ذلك بذر أوعية الاستزراع بخلايا Sf1Ep ، وتحضير وسط TpCM-2 ، وتلقيح الثقافات بالمثقبية الشاحبة. مصل الأبقار الجنينية المعطلة بالحرارة (FBS) هو مكون متوسط مهم ، وتختلف فعاليته بين مختلف الموردين والمجموعات19. من الضروري الفحص المسبق لمجموعات FBS للتأكد من فعاليتها.
- حدد حجم الثقافة المناسب.
ملاحظة: ثقافة T. pallidum قابلة للتطوير من التنسيقات الكبيرة (مثل قوارير75 سم 2 تنتج ~ 1 × 109 T. الشاحبة لكل ثقافة) إلى ألواح 96 بئرا (مناسبة لتجارب الاستنساخ) 17،18،19،27.- عند ضبط حجم المزرعة ، ضع في اعتبارك عدد خلايا Sf1Ep و T. pallidum الملقحة لكل مزرعة ، بالإضافة إلى كمية الوسط المطلوب ، كما هو موضح في الجدول 1. استخدم قوارير ذات أغطية تهوية لأنها تسمح بالدوران الحر للغازات مع انخفاض فقدان الحجم بسبب التبخر.
- استخدم تنسيق الألواح المكونة من 6 آبار للثقافات الأولية لأنه من الملائم تضمين النسخ المتماثلة الثلاثية والآبار الإضافية في حالة حدوث تلوث ميكروبي.
- بذور خلايا Sf1Ep قبل 1-2 أيام من التجربة.
- قم بإعداد تعليق خلايا Sf1Ep عن طريق التربسين لمزارع المخزون ، كما هو موضح في الخطوة 2.7.
- حدد تركيز خلايا Sf1Ep في المعلق باستخدام مقياس الدم أو عداد الخلايا الآلي.
- أضف العدد المناسب من خلايا Sf1Ep ووسيط Sf1Ep (الجدول 1) إلى كل ثقافة. احتضان المزارع عند 37 درجة مئوية في حاضنة زراعة الأنسجة القياسية مع 5٪ ثاني أكسيد الكربون2 حتى الاستخدام.
- تحضير TpCM-2 قبل يوم واحد من التجربة.
ملاحظة: يمكن تحضير TpCM-2 وتخزينه عند -20 درجة مئوية لعدة أشهر. يجب إذابة الوسط وتوازنه في حاضنة الأكسجين المنخفض في اليوم السابق للتجربة.- احصل على محاليل معقمة لمكونات TpCM-2 (الجدول 2) تجاريا أو قم بإعدادها من الكواشف الجافة وتعقيمها بالترشيح. قم بتخزين المحاليل في درجة حرارة 4 درجات مئوية لمدة تصل إلى شهرين. اضبط درجة الحموضة في المخزن المؤقت MOPS إلى 7.5 قبل تعقيم المرشح ؛ خلاف ذلك ، لا يلزم ضبط المكونات أو TpCM-2 النهائي بدرجة الحموضة.
ملاحظة: يوصى باستخدام الماء المقطر المعقم من الدرجة المزروعة للأنسجة لتحضير المكونات المتوسطة. - امزج الكواشف المدرجة في الجدول 2 في وعاء معقم ، مع إضافة ثنائي ثيوثريتول (DTT) كمسحوق جاف أخيرا (لتقليل أكسدة). قم بزيادة (أو خفض) كميات كل مكون لتحضير الكمية المطلوبة من TpCM-2. قم بخلط الوسط بلطف وتعقيمه باستخدام وحدة تصفية 0.22 ميكرومتر.
- قم بفك غطاء القارورة التي تحتوي على TpCM-2. قم بموازنة الوسط مسبقا عن طريق وضعه في وعاء لاهوائي (Brewer) ، وإخلاء وإعادة تعبئته بخليط غاز 95٪ N2 ، 5٪ CO2 ثلاث مرات ، ثم ملأه ب 1.5٪ O2 ، 5٪ CO2 ، وازن خليط الغاز N2 بعد الإخلاء النهائي. تم تصوير مثال على نظام لتنفيذ عملية تبادل الغاز هذه في الشكل 2.
- انقل الوسط بسرعة إلى حاضنة ثلاثية الغازات تم إعدادها لتوفير 1.5٪ O2 و 5٪ CO2 وتوازن N2 في الغلاف الجوي عند 34 درجة مئوية. بدلا من ذلك ، يمكن إغلاق الجرة اللاهوائية التي تحتوي على الوسط بعد تبادل الغازات الموصوف في 3.3.3 ونقلها إلى حاضنة قياسية.
- احصل على محاليل معقمة لمكونات TpCM-2 (الجدول 2) تجاريا أو قم بإعدادها من الكواشف الجافة وتعقيمها بالترشيح. قم بتخزين المحاليل في درجة حرارة 4 درجات مئوية لمدة تصل إلى شهرين. اضبط درجة الحموضة في المخزن المؤقت MOPS إلى 7.5 قبل تعقيم المرشح ؛ خلاف ذلك ، لا يلزم ضبط المكونات أو TpCM-2 النهائي بدرجة الحموضة.
- في صباح يوم التجربة ، تحقق من ثقافات Sf1Ep باستخدام مجهر مقلوب. تأكد من أن الخلايا متصلة ومتلاقة بنسبة 5٪ -10٪. قم بإزالة الوسط بشكل معقم.
- اشطف الآبار لفترة وجيزة باستخدام حجم صغير (0.2 مل إلى 2 مل ، حسب حجم الوعاء) من TpCM-2 المتوازن مسبقا ، وقم بإزالة الشطف ، وأضف الكمية المناسبة من TpCM-2 (الجدول 1). قم بموازنة الصفائح في 1.5٪ O2 ، 5٪ CO2 ، وتوازن N2 في الغلاف الجوي عند 34 درجة مئوية لمدة 3-4 ساعات كما هو موضح سابقا.
- انقل الألواح إلى غطاء التدفق الصفحي وقم بالتلقيح بالرقم المناسب (الجدول 1) من T. pallidum من المخزونات المجمدة أو مستحضرات التربسين من المزارع التي تم حصادها حديثا (كما هو موضح أدناه). يمكن أيضا استخدام المخزون الطازج أو المجمد الذي تم جمعه بشكل معقم من الأرانبالمصابة 13. أعد موازنة الصفائح كما هو موضح في 3.3.3 واحتضان الثقافات في 1.5٪ O2 ، 5٪ CO2 ، وتوازن N2 في الغلاف الجوي عند 34 درجة مئوية.
4. حصاد ومرور مزارع T. pallidum
ملاحظة: نظرا لأن غالبية T. الشاحبة في الثقافة مرتبطة بسطح خلايا Sf1Ep ، فمن الضروري فصل اللولبيات عن خلايا الثدييات من أجل استعادتها والحصول على تعداد دقيق للكائنات الحية. عادة ما يتم هذا "الحصاد" والمرور إلى الثقافات الطازجة في اليوم السابع من الثقافة. الإجراء الموصوف هنا هو لألواح 6 آبار. يتم ضبط كمية محلول التربسين-EDTA المستخدم لأعلى أو لأسفل اعتمادا على حجم تنسيق الثقافة17،19،27.
- في وقت الحصاد ، قم بإزالة الثقافات من الحاضنة. افحص طبقة الخلية Sf1Ep في كل بئر باستخدام مجهر تباين الطور المقلوب وسجل كثافة الخلية (على سبيل المثال ، 80٪ ملتقية) والمظهر. لاحظ أيضا لون TpCM-2 ؛ غالبا ما يتحول مؤشر Resazurin من اللون الوردي إلى الأصفر نتيجة لانخفاض درجة الحموضة.
- ماصة الوسط من كل بئر إلى أنبوب مخروطي معقم سعة 15 مل ، باستخدام ماصات منفصلة لكل بئر لمنع التلوث المتبادل. اشطف كل بئر ب 0.35 مل من محلول Trypsin-EDTA المسخن مسبقا ، وأضف الشطف إلى الوسط.
- أضف 0.35 مل أخرى من محلول Trypsin-EDTA إلى كل بئر ، واحتضن اللوحة لمدة 5 دقائق في حاضنة قياسية 37 درجة مئوية ؛ الغلاف الجوي المنخفضO 2 غير مطلوب لهذه الفترة الزمنية القصيرة.
- تحقق من تقريب وانفصال خلايا Sf1Ep ، والذي يرتبط أيضا بتفكك T. pallidum عن خلايا الثدييات. راقب هذه العملية باستخدام المجهر المقلوب ، ووفر وقتا إضافيا أو حل Trypsin-EDTA حسب الحاجة. يتم تسهيل عملية التفكك عن طريق الراب برفق على جانب اللوحة المجمدة باستخدام رف أنبوب اختبار بلاستيكي أو كائن مشابه.
- ماصة الوسط المحجوز واشطفها في البئر لاستعادة المثقبية الشاحبة المنفصلة والخلايا. سجل الحجم الإجمالي الذي تم استرداده لحساب العائد لكل ثقافة.
- في معظم التجارب ، انقل حجما محددا من T. pallidum المحصود إلى ألواح استزراع بخلايا Sf1Ep جديدة و TpCM-2. في مثل هذه الحالات ، قم بنقل حوالي 1/20من حجم الاستزراع (مثل 200 ميكرولتر لزراعة 4 مل ، 6 آبار) ؛ اضبط هذا الحجم لأعلى أو لأسفل اعتمادا على ما إذا كانت سلالة T. pallidum سريعة أو بطيئة النمو. قم بإزالة خلايا Sf1Ep في اللقاح عن طريق الطرد المركزي عند 100 × جم لمدة 5 دقائق ، لكن هذه الخطوة ليست ضرورية لعمليات النقل الروتينية.
- مباشرة بعد تلقيح الألواح للتجربة ، قم بتبادل الغلاف الجوي في الألواح باستخدام عملية الإخلاء وإعادة التعبئة (الخطوة 3.3.3). احتضان الألواح عند 34 درجة مئوية داخل جرة البيرة أو انقلها إلى حاضنة ثلاثية الغازات.
- تعداد T. pallidum عن طريق المجهر المظلم باستخدام غرفة عد Helber أو جهاز مشابه ، باتباع تعليمات الشركة المصنعة.
ملاحظة: غرفة Helber عبارة عن شريحة زجاجية معايرة وانزلاق غطاء يحسن بشكل كبير من دقة وقابلية تكرار الأعداد البكتيرية ؛ يتم تطهير الغرفة وتنظيفها وتجفيفها بسهولة باستخدام 70٪ من الإيثانول والمناديل الورقية ويمكن إعادة استخدامها إلى أجل غير مسمى. من الناحية المثالية ، يجب أن يكون لمجهر المجال المظلم هدف 40x و 15x عدسة. قم بإجراء عمليات عد مكررة لكل ثقافة ، وسجل عدد المشعرية المتحركة وغير المتحركة وأي تغييرات مورفولوجية يتم تسجيلها. يمكن أيضا استخدام تفاعل البوليميراز المتسلسل الكمي (qPCR) في الحالات التي لا يلزم فيها تحديد الكمية الدقيقة وتحديد الحركة17،24. - في التجارب التي قد لا يكون فيها العلاج بالتربسين مرغوبا فيه (مثل تلك التي تفحص محتوى بروتين الشريطية الشاحبة ) ، استخدم وسيط تفكك EDTA لفصل المثقبدة الشاحبة وطبقة الخلية أحاديةالطبقة 17،19.
ملاحظة: يتكون وسط التفكك من FBS الذي تم تحليله بالكلى ضد محلول ملحي مخزن بالفوسفات (PBS) أو محلول الملح الأساسي لإيرل (EBSS) بدون كلوريد الكالسيوم وكلوريد المغنيسيوم لإزالة الكاتيونات ثنائية التكافؤ في وسط زراعة المبسط T. pallidum (الجدول 2). قد يستغرق هذا الإجراء فترة زمنية أطول (تصل إلى 30 دقيقة) أو العلاج المتكرر للتفكك الكامل.
5. تجميد وتخزين ثقافات T. pallidum
ملاحظة: يمكن تخزين T. pallidum إلى أجل غير مسمى عند درجة حرارة -70 درجة مئوية أو أقل ، مع قابلية البقاء عند الذوبان عادة ما تكون 50٪ -90٪.
- قم بتجميد T. pallidum مزارع عند الحصاد مع إضافة 10٪ (v / v) جلسرين. قم بتفريق الجلسرين طوال فترة التحضير من خلال سحب العينة أو الانقلاب اللطيف. بعد ذلك ، قم بتوزيع المستحضر في 1-2 مل في قوارير مجمدة مغطاة بالمسمار وضع القوارير على الفور في فريزر -80 درجة مئوية أو فريزر N2 سائل.
- لبدء ثقافة الشريطية الشاحبة من المخزون المجمد ، أولا ، قم بإعداد وعاء (وعاء) استزراع مناسب يحتوي على خلايا Sf1Ep و TpCM-2 كما هو موضح في القسم 3. قم بإذابة القارورة التي تحتوي على T. pallidum المخزون المجمد بسرعة ؛ يعد الاستخدام الدقيق للحمام المائي أو كتلة التدفئة 37 درجة مئوية مفيدا في هذا الصدد.
- ثم انقل المستحضر المذاب إلى وعاء (أوعية الاستزراع). تأكد من أن نسبة حجم المخزون المجمد إلى وسط Tp-CM2 هي 1: 5 أو أكثر لضمان التخفيف الكافي للجلسرين لتعزيز بقاء ونمو T. الشاحب.
- احتضان المستزرعة في ظروف الهوائية الدقيقة لمدة 7 أيام ونقلها إلى مزارع جديدة كما هو موضح في القسم 4.
6. توليد استنساخ متساوي الجين من T. الشاحبة
ملاحظة: تم وصف هذا الإجراء بالتفصيل في دراسة سابقة27.
- في تجربة نموذجية ، قم بإعداد وتوازن مسبق لوحتين بسعة 96 بئرا مع 1000 خلية Sf1Ep و 200 ميكرولتر من TpCM-2 لكل بئر ، كما هو موضح في القسم 3.
ملاحظة: تعمل الماصة متعددة القنوات سعة 200 ميكرولتر وخزانات الكاشف المعقمة المتوافقة التي تستخدم لمرة واحدة على تبسيط خطوات تلقيح الخلايا Sf1Ep والتبادل المتوسط والتلقيح إلى حد كبير. - قم بقياس تركيز المثقبية الشاحبة في مستحضر تم حصاده حديثا باستخدام مجهر المجال المظلم وغرفة هيلبر (الخطوة 4.8). تخفيف معلق المثقبية الشاحبة في TpCM-2 لإنتاج مستحضرين بتركيزات 10 لولبيات/مل و40 لولبيات/مل؛ 10 مل من كل مستحضر أكثر من كافية لتلقيح صفيحة واحدة مكونة من 96 بئرا مع كل تخفيف. كعنصر تحكم ، قم بإعداد 1 مل من تخفيف آخر يحتوي على 2 × 103 T. pallidum / مل.
- باستخدام ماصة قياسية أحادية القناة أو ماصة متعددة القنوات، قم بتلقيح 50 ميكرولتر لكل بئر من مستحضر 10 T. pallidum/مل في أحد ألواح الآبار ال 96 المحضرة، مع حذف بئرين للتحكم. كرر هذه العملية مع 40 T. شاحبة / مل المستحضر واللوحة الأخرى. في بئري التحكم في كل لوحة ، قم بتلقيح 2 × 103 T. الشاحبة / مل التخفيف. ستنتج هذه العملية صفائح تحتوي (في المتوسط) على 0.5 أو 2 T. pallidum لكل بئر ، جنبا إلى جنب مع آبار التحكم الإيجابية التي تحتوي على 100 T. الشاحب.
ملاحظة: كفاءة طلاء T. pallidum منخفضة في ظل هذه الظروف ، لذلك حتى الآبار المصنفة بالكائنات الحية ~ 2 من المرجح أن تنتج مجموعات نسيلية. - قم بموازنة الألواح بخليط الغاز O2 المنخفض (الخطوة 3.3.3) واحتضانها في وعاء Brewer أو حاضنة ثلاثية الغاز عند 34 درجة مئوية.
- في 7 أيام ، قم بإزالة 100 ميكرولتر من الوسط من كل بئر مزرعة واستبدله ب 100 ميكرولتر من TpCM-2 الطازج والموازن. تحقق من جدوى ونمو T. pallidum في آبار التحكم عن طريق المجهر والتعداد في الحقول المظلمة للتأكد من أن ظروف الثقافة تدعم تكاثر T. pallidum .
ملاحظة: تأكد من استخدام طرف ماصة جديد لكل بئر لمنع التلوث المتبادل للمزارع النسيلية. - في 14 يوما ، قم بنقل 50 ميكرولتر من المادة الطافية للزراعة من كل بئر إلى أطباق طازجة محضرة كما في الخطوة 6.1.
- كرر التغذية بالتناوب والمرور حسب الحاجة في اليومين 21 و 28.
- راقب وجود الشريطية الشاحبة في كل بئر باستخدام الفحص المجهري للحقل المظلم أو qPCR26.
ملاحظة: مع معدل النمو البطيء ل T. pallidum والفقدان الضروري للكائنات الحية أثناء التغذية والنقل ، فإن الآبار المصنفة ب 0.5 أو 2 T. pallidum عادة ما تكون غير موجبة بأي من الطريقتين حتى اليوم 28 أو بعد ذلك. - بمجرد تحديد الآبار الإيجابية ، قم بالتربسين ونقل هذه الآبار إلى ألواح مكونة من 24 بئرا لمزيد من التوسع. تحديد الاستنساخ من خلال غلبة تسلسل tprK واحد ووجود تسلسلات مفردة في المواقع غير المتجانسة في السلالة الأم27.
النتائج
باستخدام الشروط الموصوفة ، يحتفظ T. pallidum عادة بحركة >90٪ ويتكاثر لوغاريتميا مع وقت مضاعفة من 33 ساعة إلى 45 ساعة لمدة 7 أيام تقريبا قبل دخول المرحلة الثابتة (الشكل 3). على مدار أسبوع واحد ، تخضع اللولبيات لما يقرب من 4-5 مضاعفات (الشكل 4). ). بالإضافة إلى ذلك ، قد تنمو سلالات مختلفة من T. الشاحبة بمعدلات مختلفة. سلالات مجموعة SS14 من T. الشاحبة تميل إلى أن يكون لها أوقات مضاعفة أبطأ من تلك الموجودة في مجموعة نيكولز17.
قد تؤدي تغذية الثقافات إلى إطالة وقت الزراعة لعدة أيام ولكن غالبا ما تفشل طبقة خلية Sf1Ep بعد أسبوع من الزراعة. علاوة على ذلك ، تصل اللولبيات إلى الحد الأعلى للكائنات الحية حوالي 5 × 107 / مل. عادة ما تستمر الثقافات المنقولة على فترات 7 أيام في الضرب اللوغاريتمي مع مرحلة تأخر قليلة أو معدومة. غالبا ما يصعب تمرير الكائنات الحية في المرحلة الثابتة.
ترتبط معظم الشريطية الشاحبة بخلايا Sf1Ep. ومع ذلك ، يبقى ما يكفي من T. pallidum في المادة الطافية بحيث يمكن إزالة العينات المتوسطة بشكل دوري للتحقق من الجدوى والتكاثر. إذا كانت هناك حاجة إلى تقدير دقيق ، فيجب قياس حجم الوسط الذي تمت إزالته ، وعدد T. pallidum كميا ، وإضافة العدد الإجمالي للكائنات الحية التي تمت إزالتها إلى التعداد النهائي عند الحصاد.
في الدراسات السابقة ، كانت كفاءة الاستنساخ (عدد المزارع الإيجابية لكل كائن حي ملقح) 12.5٪ ل 2 T. pallidum الملقح لكل بئر و 6.7٪ ل 0.5 T. الشاحبة الملقحة لكل بئر27. وبالتالي ، فمن المحتمل أن يمثل أي بئر إيجابي نتاج كائن حي واحد في أي من هذه العينات. ومع ذلك ، يجب التحقق من استنساخ المجموعات السكانية الناتجة من خلال فحص الثقافة للتأكد من تجانسها في المواقع غير المتجانسة في الثقافة الأم. الطريقة الأكثر تحديدا لإثبات أن الثقافة متساوية المنشأ هي من خلال تسلسل الجينوم الكامل27.
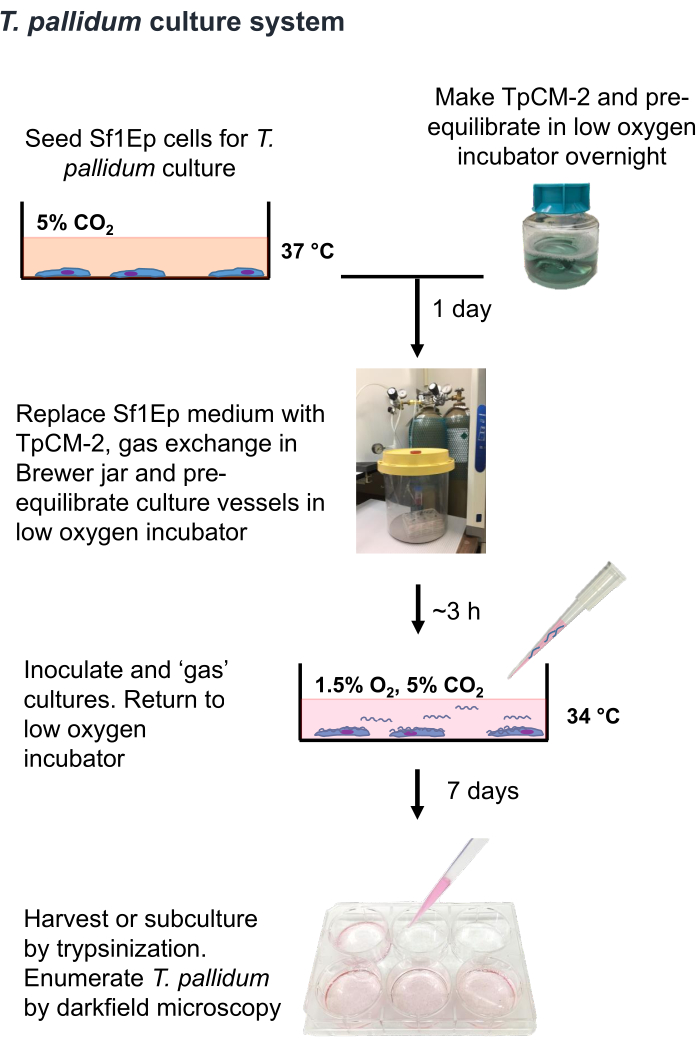
الشكل 1: مخطط انسيابي لإجراء الزراعة في المختبر T. pallidumin . أعيد طبع هذا الرقم بإذن من إدموندسون ونوريس (2021) 19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
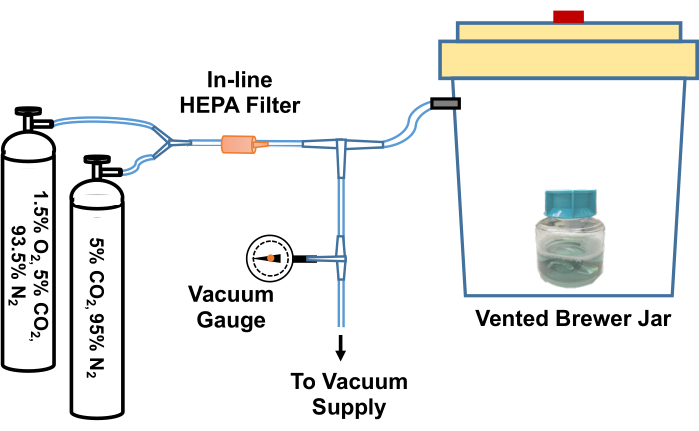
الشكل 2: رسم تخطيطي للنظام لموازنة T. كاشف زراعة الشاحبة في بيئة منخفضة الأكسجين. يتم توصيل فتحة تهوية جرة البيرة عبر مفصل T بمصدر فراغ (مثل فراغ المنزل) وأسطوانات الغاز التي تحتوي على مخاليط غاز مخصصة (5٪ CO2 ، توازن النيتروجين و 1.5٪ O2 ، 5٪ CO2 ، توازن النيتروجين). يقيس مقياس التفريغ المضمن الفراغ المسحوب في البرطمان. يتم سحب الفراغ في الجرة إلى حوالي -58 كيلو باسكال. ثم يتم إعادة ملء البرطمان المفرغ ببطء بمخاليط الغاز. يتم إعادة تعبئة جرة Brewer ثلاث مرات بنسبة 5٪ CO2 ، وتوازن النيتروجين قبل الإخلاء النهائي ، وإعادة تعبئتها بنسبة 95٪ N2 ، و 5٪ CO2 ، و 1.5٪ O2. ثم تتم إزالة الثقافات أو الوسائط من البرطمان ونقلها بسرعة إلى الحاضنة منخفضة الأكسجين. بالتناوب ، يمكن تثبيت الأنبوب بين جرة Brewer والمفصل T الأول بإحكام ، وفصل الأنبوب عن المفصل T ، ويمكن نقل جرة Brewer بأكملها إلى حاضنة 34 درجة مئوية. أعيد طبع هذا الرقم بإذن من إدموندسون ونوريس (2021) 19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
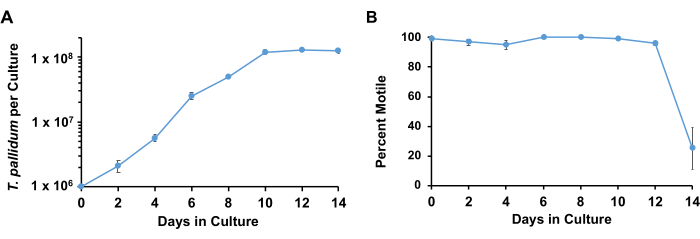
الشكل 3: منحنيات نمو T. pallidum المزروعة بخلايا Sf1Ep مع وسط TpCM-2. تم زرع الثقافات الثلاثية المتوازية مع T. pallidum. تم حصاد النسخ المتماثلة في كل نقطة زمنية. تمثل النتائج المتوسط + SEM لهذه الثقافات. (أ) تظهر التغييرات في المشعرية الشاحبة لكل مزرعة و (ب) النسبة المئوية للحركة. تم تكييف هذا الرقم بإذن من Edmondson et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
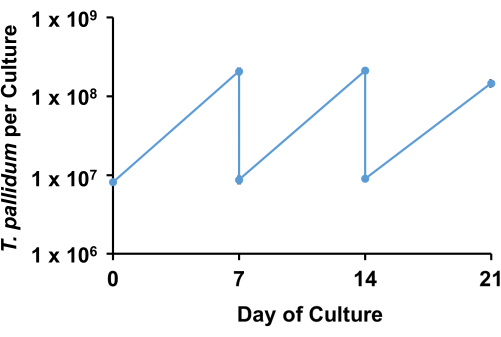
الشكل 4: مثال على مرور الثقافة المختبرية ل T. الشاحب، سلالة نيكولز. تم زرع الثقافات الثلاثية المتوازية مع T. الشاحبة وتم تمريرها أسبوعيا باستخدام تخفيف 1:20. تظهر مخطط سن المنشار أعداد T. pallidum لكل ثقافة والعدد المنقول إلى ثقافات جديدة في كل نقطة زمنية. تمثل النتائج متوسط ± SEM لثلاثة مكررات بيولوجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
جدول 1: الحجم المتوسط ونسب البذر لأوعية الاستزراع. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: وسائط زراعة T. pallidum . يجب تعقيم جميع الوسائط بعد التحضير. يمكن تخزين وسط Sf1Ep عند 4 درجات مئوية لمدة تصل إلى شهرين. عادة ما يتم تصنيع TpCM-2 قبل يوم واحد من الاستخدام. يجب أن يكون وسط التفكك مقتبسا ومجمدا. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
نظام Sf1Ep-TpCM-2 هو أول إجراء متاح يعزز الاستزراع المستمر في المختبر للمثقبية الشاحبة. النظام معقد بسبب متطلبات النمو القصوى لهذا الكائن الحي: 1) الاحتياجات الغذائية المعقدة بسبب قدرات التخليق الحيوي المحدودة. 2) متطلبات غير مفهومة جيدا لكميات صغيرة من الأكسجين ، على الرغم من الحساسية العالية لأنواع الأكسجينالتفاعلية 9،10،16،36 ؛ و 3) الحاجة الحالية لوجود خلايا Sf1Ep. في حين أنه من المغري "قطع الزوايا" في الإجراء ، فمن المستحسن اتباع الخطوات بعناية حتى يتم تحقيق ثقافة ناجحة على المدى الطويل قبل تجربة التعديلات. مع تراكم معلومات إضافية حول متطلبات التمثيل الغذائي ل T. pallidum ، قد يكون من الممكن تطوير ظروف محورية لا تتطلب وجود خلايا Sf1Ep. ومع ذلك ، من المرجح أن يظل معدل النمو في المختبر بطيئا (مع حد أدنى لمضاعفة الوقت من 33 ساعة إلى 46 ساعة ، اعتمادا على السلالة)17،18 ، بالنظر إلى أن T. الشاحبة تتكاثر في وقت مضاعفة يقدر من 30 ساعة إلى 33 ساعة حتى أثناء عدوى الثدييات37،38. كما هو الحال مع أي ثقافة بكتيرية ، يوصى بالحفاظ على مخزونات مرور منخفضة وإجراء تجارب على ثقافات T. pallidum التي تقل عن 10 ممرات من هذه المخزونات لتجنب "الانجراف الجيني" والتغيرات المظهرية المرتبطة بها بسبب الطفرات.
يبدو أن خلايا Sf1Ep توفر العناصر الغذائية الأساسية أو الأنشطة الأنزيمية لللولبيات. ومع ذلك ، فإنها تستهلك أيضا العناصر الغذائية (مثل الجلوكوز والأكسجين) وقد تنتج ظروفا سامة مثل انخفاض درجة الحموضة9،16،39. لذلك ، هناك عمل موازنة بين وجود خلايا Sf1Ep كافية لدعم تكاثر الشريطية الشاحبة ومنع فرط نمو خلايا الثدييات وسميتها. تميل أعداد المرور العالية لخلايا Sf1Ep إلى النمو بشكل أسرع وفي بعض الأحيان تفقد القدرة على دعم تكاثر T. pallidum . على هذا النحو ، يجب مراقبة رقم مرور Sf1Ep ، ويجب استبدال مخزونات الخلايا بمستحضرات مجمدة منخفضة الممر بشكل دوري. يؤدي وجود خلايا Sf1Ep أيضا إلى تعقيد دراسة T . pallidum خصائص مثل الحمض النووي والحمض النووي الريبي ومحتوى البروتين وأنشطة الإنزيم. يمكن إزالة خلايا الأرانب إلى حد ما باستخدام الطرد المركزي المتكرر منخفض السرعة (100 × جم لمدة 5 دقائق) أو بشكل أكثر فعالية باستخدام تدرجات Percoll أو Hypaque40،41. ومع ذلك ، فإن طرق الطرد المركزي المتدرج فعالة بشكل عام فقط مع أعداد كبيرة من T. الشاحب. تقتصر الطرق البديلة لتكاثر الشريطية الشاحبة على عدوى المختبر مثل الأرانب13،14. هذا النهج له اعتبارات أخلاقية وأصبح مكلفا بشكل متزايد. ومع ذلك ، فإن نموذج الأرانب مفيد جدا لدراسة التسبب في الشريطية الشاحبة والاستجابات المناعية للمضيف. بالإضافة إلى ذلك ، من المحتمل أن تكون هناك بعض الاختلافات في التعبير الجيني أو النمو أو سلوك T. pallidum أثناء زراعة المختبر وعدوى الأرانب27.
في وقت إعداد هذا التقرير ، تم إنشاء نظام Sf1Ep-TpCM-2 في 6 مجموعات بحثية على الأقل في الولايات المتحدة وأوروبا وأسفر عن 16 منشورا بموضوعات تتراوح من T. pallidum علم الأحياء الأساسي وعلم الوراثة إلى الحساسية لمضادات الميكروبات. من المرجح أن تزداد قيمة الثقافة في المختبر في دراسة هذا العامل الممرض الغامض مع الاستخدام الموسع والتحسينات المستقبلية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل بمنحة R01 AI141958 من المعاهد الوطنية للصحة بالولايات المتحدة / NIAID. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار النشر أو إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
References
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved