Method Article
梅毒螺旋体(梅毒螺旋体)的体外培养程序
摘要
该方案描述了梅毒病原体梅毒螺旋体梅毒螺旋体亚种的体外培养与哺乳动物细胞共培养。 该方法具有可扩展性;它可用于产生大量的梅毒螺旋体和产生克隆培养物。
摘要
一个多世纪以来,梅毒螺旋体亚种梅毒螺旋体( Treponema pallidum subsp. pallidum)是导致梅毒的螺旋形细菌,只能通过接种和收获兔子睾丸中的微生物来繁殖。2018 年,我们描述了一种在体外连续培养 梅毒螺旋体的方法。该系统利用在称为 TpCM-2 的含血清组织培养基中与兔上皮细胞(Sf1Ep 细胞)共培养。培养物中的 梅毒螺旋 体倍增时间与估计在自然感染期间发生的时间相似(约 33-45 小时)。该微生物可以在 34 °C 的低氧 (1.5%) 环境中连续培养,标准传代时间为 1 周。 本文包含培养 梅毒螺旋体的方案、生长和维持所需组织培养细胞的方法以及通过限制稀释产生同基因菌株的技术。 在体外生长梅毒螺旋 体的能力为研究和理解这种神秘的生物体提供了新的实验途径。
引言
梅毒螺旋体是一种螺旋形细菌(称为螺旋体),可引起人类和其他灵长类动物的梅毒和相关感染。梅毒是一种对感染者有长期影响的严重疾病,据估计,全球每年有超过 800 万例梅毒新发病例1。梅毒螺旋体根据它们在人类中引起的疾病以及微小的遗传差异被细分为三个亚种:梅毒螺旋亚种(导致性传播疾病梅毒)、pertenue 亚种(雅司病)和地方性亚种(导致贝杰尔或地方性梅毒)2,3。T. pallidum pertenue 亚种也会导致狒狒、黑猩猩和其他灵长类动物感染。一种称为 Treponema paraluiscuniculi(也称为 Treponema paraluisleporidarum)的密切相关生物会引起兔子和野兔的感染 4,5。所有这些细菌都非常密切相关,在基因组水平上具有超过 98% 的 DNA 序列同一性 6,7,8。它们每个都有一条大小约为 114 万个碱基对 (Mb) 的小圆形染色体。这个梅毒螺旋体组的成员仅与它们的哺乳动物宿主有关;因此,它们是依赖宿主物种生存和生长的专性病原体 9,10。
在 Schaudinn 和 Hoffman 于 1905 年鉴定梅毒螺旋体后不久,开始尝试在体外培养梅毒螺旋体11,12。然而,这些努力未能导致生物体的一致、可重复的生长。因此,梅毒螺旋体的研究需要通过实验动物(最常见的是兔子)的实验感染来繁殖生物体13,14。1981 年,Fieldsteel 等人15 引入了一种组织培养系统,该系统促进了梅毒螺旋体菌株的繁殖长达 2 周。该系统涉及在基于 Eagle 最低必需培养基 (MEM) 和 20% 胎牛血清 (FBS) 的改性组织培养基(梅毒螺旋体培养基 1,TpCM-1)中共培养梅毒螺旋体与 Sf1Ep 棉尾兔上皮细胞。所需的其他培养条件是在 34 °C 下在含有 1.5% O2 和 5% CO2 的气氛中孵育 9,16。在这个系统中,梅毒螺旋体附着在 Sf1Ep 细胞上,并在与哺乳动物细胞表面紧密结合时繁殖。尽管进行了许多传代培养尝试和其他修改,但 Fieldsteel 等人的系统未能促进持续的体外生长。
2018 年,我们的实验室报告说,使用一种名为 TpCM-2 的改良培养基(其中 Eagle 的 MEM 被更复杂的组织培养基 CMRL 1066 取代)为梅毒螺旋体提供了所需的营养物质,以实现一致的长期培养17。迄今为止,这种修改已经导致至少 5 种梅毒螺旋亚种菌株(Nichols、SS14、墨西哥 A、UW231B 和 UW249B)和一种梅毒螺旋亚种地方性菌株(波斯尼亚 A)18,19 的一致、连续培养。例如,Nichols 菌株现在已经在体外连续培养了 6 年以上。到目前为止,体外培养雅司病分离株 (T. pallidum subsp. pertenue) 或 T. paraluiscuniculi 的尝试均未成功18。TpCM-2 系统仍然需要 Sf1Ep 细胞的存在、低氧浓度和 34 °C 的孵育,这使得该系统比大多数细菌培养技术更复杂。然而,这种改良的梅毒螺旋体培养系统可用于进一步确定细菌的生长需求18,确定抗菌化合物和肽的最低抑菌浓度 (MIC) 20,21,22,23,24,25,从患者组织抽吸物中繁殖新菌株26,分离克隆种群生物体27,表征 tprK 抗原变异系统27,28,检查基因表达29,并进行突变分析 30,31,32。
在这里,我们描述了目前在 体外培养梅毒螺旋体的方法。我们希望这些信息将有助于促进这种 体外 培养技术的更广泛应用,以改善梅毒和相关密螺旋体感染的诊断、治疗和预防。
研究方案
注:所有步骤都需要使用无菌技术以及无菌材料和试剂。建议使用组织培养层流罩,以减少 a) 人员接触传染性物质和 b) 培养物受到微生物污染的可能性。
1. 建立 Sf1Ep 细胞储备
注:Sf1Ep 棉尾兔上皮细胞可以从美国典型培养物保藏中心作为冷冻原液购买(参见材料表)。Sf1Ep 细胞的缓慢生长性质和低代谢率似乎是它们能够支持梅毒螺旋体 33 长期存活和生长的关键;因此,不建议用其他哺乳动物细胞培养物替代。Sf1Ep 细胞不是永生化细胞系,在培养物中仅可维持 25-30 次传代。因此,保持低传代 Sf1Ep 细胞的冷冻储备以备将来使用非常重要。在 Sf1Ep 细胞的长期培养过程中,偶尔会出现永生化的 Sf1Ep 细胞系。(未发表的观察结果)。这些线路通常增长得更快,更容易处理;然而,有时它们会失去支持梅毒螺旋体生长的能力。可以使用永生化的 Sf1Ep 细胞系,然后在螺旋体开始缓慢生长时更换。
- 制备 Sf1Ep 细胞培养基,并在 37 °C、5% CO2 培养箱中预热。
注:Sf1Ep 细胞培养基由补充有 10% FBS、1x MEM 非必需氨基酸、2 mM L-谷氨酰胺和 1 mM 丙酮酸钠的 Eagle MEM 组成。(请参阅 材料表)。培养基应进行过滤灭菌,可在 4 °C 下储存长达 2 个月。抗生素(如青霉素和链霉素)不应在 Sf1Ep 细胞培养基中使用,因为即使是微量抗生素的残留也会干扰 梅毒螺旋体的生长。 - 在 37 °C 下快速解冻冷冻的 Sf1Ep 原液。 用 70% 乙醇擦拭样品瓶的外部。
- 向冻存管中加入 1 mL Sf1Ep 细胞培养基并轻轻混合。将培养基/细胞原液混合物添加到含有 5 mL Sf1Ep 细胞培养基的无菌 15 mL 锥形离心管中,并轻轻混合。
- 通过以 100 x g 离心 7 分钟来沉淀细胞。取出并丢弃上清液,注意不要干扰细胞沉淀。
- 将解冻的 Sf1Ep 细胞轻轻重悬于 15 mL 新鲜的 Sf1Ep 细胞培养基中,并将它们转移到 T75 组织培养瓶中。
注:通过离心去除用于冷冻细胞的 DMSO,可以提高新解冻的 Sf1Ep 细胞的回收率。然而,可以省略步骤 1.4-1.7,步骤 3 中解冻的细胞可以直接接种到含有 14 mL Sf1Ep 细胞培养基的 T75 组织培养瓶中。孵育过夜后,用新鲜的 Sf1Ep 培养基替换一半的培养基,以稀释残留的 DMSO。 - 将 Sf1Ep 培养物在 37 °C、5% CO2 的标准加湿组织培养箱中孵育。松开非通气组织培养瓶的盖子,以保持适当的培养基 pH 值。
2. 传代 Sf1Ep 细胞
注:使用相差光学器件的倒置显微镜监测 Sf1Ep 细胞培养物的生长。通常,细胞需要大约一周的时间才能达到接近汇合。当细胞达到 ~90% 汇合时,它们可以通过,用于 梅毒螺旋 体培养或制备冷冻原液。培养一周后更换一半的培养基,可将培养寿命延长至两周。
- 从培养瓶中吸出并丢弃 Sf1Ep 生长培养基。在室温 (RT) 下用 5 mL 无菌 PBS 冲洗细胞层,吸出并丢弃 PBS 冲洗液。
- 向培养瓶中加入 2.5 mL 胰蛋白酶-EDTA 并密封瓶盖。来回摇动培养瓶,用胰蛋白酶-EDTA覆盖细胞层,并将培养瓶在37°C下孵育5分钟。
- 轻轻敲击培养瓶以去除细胞。在倒置显微镜下观察以确认 Sf1Ep 细胞的分散。
- 加入 5 mL Sf1Ep 生长培养基,摇动培养瓶,与胰蛋白酶-EDTA 混合,停止胰蛋白酶的作用。将悬浮的 Sf1Ep 细胞取出到无菌锥形管中。
- 使用血细胞计数器或自动细胞计数仪定量细胞。
- 为了维持工作细胞储备液,将培养基/胰蛋白酶-EDTA/细胞混合物的等分试样(0.5-1.0 mL 或 ~8 x 105 个细胞)转移到含有 15 mL 新鲜 Sf1Ep 培养基的新 T75 组织培养瓶中。
- 对于 梅毒螺旋体 培养,将 Sf1Ep 培养基中的细胞稀释至 0.25-0.5 x 105 个细胞/mL,并接种到适当的培养容器中(表 1)。
- 要冷冻 Sf1Ep 细胞,请在台式离心机中以 100 x g 的速度旋转 7 分钟。小心去除上清液,不要干扰细胞沉淀。在补充有 10% 组织培养级 DMSO 的 Sf1Ep 培养基中重悬细胞沉淀。
- 将 1 mL 细胞悬液分配到每个冻存管中,并在 -70 °C 至 -80 °C 的绝缘容器(如聚苯乙烯泡沫塑料试管架)中冷冻过夜,以增强活力保留,然后再将冻存管转移到液氮低温容器中。
3. 培养梅毒螺旋体
注意:所有 梅毒螺旋 体亚种和菌株都对人类致病,并被归类为生物安全 2 级 (BSL-2) 病原体34。必须采取适当措施来保护人员;这些措施包括使用手套和其他个人防护设备 (PPE),以及对可能暴露于 梅毒螺旋体的表面、材料和液体进行消毒。 梅毒螺旋 体很容易通过暴露于 70% 乙醇或市售消毒剂来灭活。建议始终使用层流罩处理含有 梅毒螺旋体 的标本。
注意:梅毒螺旋体是一种微需氧生物,暴露于大气中的氧气水平数小时即可杀死 9,16,35。因此,建议尽可能将梅毒螺旋体在空气中的处理限制在一小时以内。此外,应在 1.5% O2、5% CO2 中预平衡 TpCM-2 培养基,平衡 N2,并应限制剧烈搅拌(例如,使用涡旋)。由于梅毒螺旋体培养通常在没有抗生素的情况下进行,因此需要格外小心以避免细菌或真菌污染。图 1 总结了培养梅毒螺旋体的 Sf1Ep-TpCM-2 程序,涉及多个步骤,包括用 Sf1Ep 细胞接种培养容器、制备 TpCM-2 培养基以及用梅毒螺旋体接种培养物。热灭活胎牛血清 (FBS) 是一种关键的培养基成分,其功效因供应商和批次而异19.有必要对 FBS 批次进行疗效预筛选。
- 选择合适的培养物大小。
注:梅毒螺旋菌培养可从大规格(例如 75 cm2 培养瓶,每次培养产生 ~1 x 109个梅毒螺旋菌)扩展到 96 孔板(适用于克隆实验)17,18,19,27。- 调整培养物大小时,要考虑每次培养物接种的 Sf1Ep 细胞和 梅毒螺旋 体的数量,以及所需的培养基量,如 表 1 所示。使用带通气盖的培养瓶,因为它们允许气体自由循环,同时减少因蒸发而造成的体积损失。
- 使用 6 孔板形式进行初始培养,因为在发生微生物污染的情况下,可以方便地包括一式三份重复和额外的孔。
- 在实验前 1-2 天接种 Sf1Ep 细胞。
- 如步骤 2.7 所述,通过储备培养物的胰蛋白酶消化制备 Sf1Ep 细胞的悬浮液。
- 使用血细胞计数器或自动细胞计数仪测定悬浮液中 Sf1Ep 细胞的浓度。
- 向每种培养物中加入适当数量的 Sf1Ep 细胞和 Sf1Ep 培养基(表 1)。将培养物在 37 °C 下在 5% CO2 的标准组织培养箱中孵育直至使用。
- 在实验前 1 天准备 TpCM-2。
注意:TpCM-2 可以制备并在 -20 °C 下储存数月。实验前一天应在低氧培养箱中解冻和平衡培养基。- 从商业上获得 TpCM-2 组分的无菌溶液(表 2),或从干燥试剂制备它们并对其进行过滤灭菌。将溶液在 4 °C 下储存长达 2 个月。过滤器灭菌前,将 MOPS 缓冲液的 pH 值调节至 7.5;否则,组分或最终的 TpCM-2 不需要进行 pH 值调节。
注:建议使用无菌的组织培养级蒸馏水制备培养基组分。 - 将 表 2 中列出的试剂混合在无菌容器中,加入二硫苏糖醇 (DTT) 作为干粉最后(以尽量减少其氧化)。按比例增加(或减少)每种组分的数量以制备所需量的 TpCM-2。使用 0.22 μm 过滤装置轻轻混合和过滤消毒培养基。
- 松开装有 TpCM-2 的烧瓶的盖子。将培养基放入厌氧 (Brewer) 罐中,抽真空并重新填充 95% N2、5% CO2 气体混合物 3 次,然后填充 1.5% O2、5% CO2,在最终抽真空后平衡 N2 气体混合物。 图 2 描述了执行此气体交换过程的系统示例。
- 将培养基快速转移到三气培养箱中,该培养箱设置为提供 1.5% O2、5% CO2,并在 34 °C 下平衡 N2 气氛。 或者,可以在 3.3.3 中描述的气体交换后密封含有培养基的厌氧罐,并转移到标准培养箱中。
- 从商业上获得 TpCM-2 组分的无菌溶液(表 2),或从干燥试剂制备它们并对其进行过滤灭菌。将溶液在 4 °C 下储存长达 2 个月。过滤器灭菌前,将 MOPS 缓冲液的 pH 值调节至 7.5;否则,组分或最终的 TpCM-2 不需要进行 pH 值调节。
- 在实验的早晨,使用倒置显微镜检查 Sf1Ep 培养物。确保细胞附着且 5%-10% 汇合。无菌去除培养基。
- 使用小体积(0.2 mL 至 2 mL,取决于容器大小)的预平衡 TpCM-2 短暂冲洗孔,去除冲洗液,并加入适量的 TpCM-2(表 1)。如前所述,在 1.5% O2、5% CO2 中平衡板,并在 34 °C 下平衡 N2 气氛 3-4 小时。
- 将板转移到层流罩中,并接种来自冷冻原液或新鲜收获培养物的胰蛋白酶化制剂中适当数量(表 1)的 梅毒螺旋 体(如下所述)。也可以使用从受感染的兔子13 无菌收集的新鲜制备或冷冻原液。如3.3.3所述重新平衡板,并在1.5%O2,5%CO2中孵育培养物,并在34°C下平衡N2 气氛。
4. 收获和传代梅毒螺旋体培养物
注意:由于培养物中的大部分梅毒螺旋体附着在 Sf1Ep 细胞的表面,因此有必要将密螺旋体与哺乳动物细胞分离,以便检索它们并获得生物体的准确计数。这种“收获”和传代到新鲜培养物通常在培养的第 7 天进行。此处描述的程序适用于 6 孔板;胰蛋白酶-EDTA 溶液的用量根据培养形式的大小上下调整 17,19,27。
- 收获时,从培养箱中取出培养物。使用倒置相差显微镜检查每个孔中的 Sf1Ep 细胞层,并记录细胞密度(例如,80% 汇合)和外观。另外,请注意 TpCM-2 的颜色;由于 pH 值较低,刃天青指示剂通常会从粉红色变成黄色。
- 将培养基从每个孔中移液到无菌的 15 mL 锥形管中,每个孔使用单独的移液管以防止交叉污染。用 0.35 mL 预热的胰蛋白酶-EDTA 溶液冲洗每个孔,然后将冲洗液添加到培养基中。
- 向每个孔中再加入 0.35 mL 胰蛋白酶-EDTA 溶液,并在标准 37 °C 培养箱中孵育板 5 分钟;在这个短暂的时间段内,不需要低 O2 大气。
- 检查 Sf1Ep 细胞的四舍五入和分离,这也与 梅毒螺旋 体与哺乳动物细胞的解离有关。使用倒置显微镜监测这一过程,并根据需要提供额外的时间或胰蛋白酶-EDTA 溶液。用塑料试管架或类似物体轻轻敲击固定板的侧面,可促进解离过程。
- 移液管保留的培养基并冲洗到孔中以取回解离的 梅毒螺旋 体和细胞。记录检索到的总体积,以计算每种培养物的产量。
- 在大多数实验中,将一定体积的收获的 梅毒螺旋 体转移到装有新鲜 Sf1Ep 细胞和 TpCM-2 的培养板中。在这种情况下,转移约 1/20的 培养体积(例如 4 mL、6 孔板培养物为 200 μl);根据 梅毒螺旋 体菌株是快速生长还是缓慢生长来向上或向下调整此体积。通过以 100 x g 离心 5 分钟去除接种物中的 Sf1Ep 细胞,但此步骤对于常规转移不是必需的。
- 接种实验板后,立即使用抽真空和重新填充过程(步骤 3.3.3)交换板中的气氛。将板在 34 °C 下在 Brewer 罐内孵育或将它们转移到三气培养箱中。
- 按照制造商的说明,使用 Helber 计数室或类似设备通过暗视野显微镜计数 梅毒螺旋 体。
注意:Helber 腔室是经过校准的载玻片和盖玻片,可大大提高细菌计数的准确性和可重复性;该腔室易于使用 70% 乙醇和纸巾进行消毒、清洁和干燥,并且可以无限期重复使用。理想情况下,暗场显微镜应具有 40 倍物镜和 15 倍目镜。对每种培养物进行重复计数,并记录可移动和非可移动的梅毒螺旋体的数量以及任何形态学变化。定量 PCR (qPCR) 也可用于不需要精确定量和确定运动性的情况17,24。 - 在可能不需要胰蛋白酶处理的实验中(例如检查梅毒螺旋体蛋白质含量的实验),使用 EDTA 解离培养基解离梅毒螺旋体和细胞单层17,19。
注:解离培养基由经磷酸盐缓冲盐水 (PBS) 或不含氯化钙和氯化镁的 Earle 碱性盐溶液 (EBSS) 透析的 FBS 组成,以去除简化的 梅毒螺旋 体培养培养基中的二价阳离子(表 2)。此过程可能需要更长的时间(最多 30 分钟)或重复处理以完全解离。
5. 冷冻和储存梅毒螺旋体培养物
注: 梅毒螺旋 体可以在 -70 °C 或以下无限期储存,解冻后的存活率通常为 50%-90%。
- 在收获时冷冻 梅毒螺旋 体培养物,添加 10% (v/v) 甘油。通过轻柔的移液或倒置将甘油分散到整个制备过程中。然后,将制备物以 1-2 mL 等分试样分配到带螺口的冻存瓶中,并立即将冻存管放入 -80 °C 冰箱或液体 N2 冻存箱中。
- 要从冷冻原液开始梅 毒螺旋 体培养,首先,如第 3 节所述,准备含有 Sf1Ep 细胞和 TpCM-2 的适当培养容器。快速解冻含有 梅毒螺旋 体冷冻原液的小瓶;在这方面,谨慎使用 37 °C 水浴或加热块是有帮助的。
- 然后,将解冻的制剂转移到培养容器中。确保冷冻原液体积与 Tp-CM2 培养基的比例为 1:5 或更大,以确保甘油的充分稀释以促进 梅毒螺旋体的存活和生长。
- 在微需氧条件下孵育培养物 7 天,然后按照第 4 节所述转移到新鲜培养物中。
6. 生成梅毒螺旋体的同基因克隆
注意:该程序在先前的研究27 中进行了详细描述。
- 在典型实验中,如第 3 节所述,准备并预平衡两个 96 孔板,每孔含有 1000 个 Sf1Ep 细胞和 200 μL TpCM-2。
注:多通道 200 μL 移液器和兼容的无菌一次性试剂储液槽大大简化了 Sf1Ep 细胞接种、培养基更换和接种步骤。 - 使用暗场显微镜和 Helber 室定量新鲜收获的制剂中梅 毒螺旋体 的浓度(步骤 4.8)。在 TpCM-2 中稀释 梅毒螺旋 体悬浮液,以产生浓度分别为 10 梅毒螺旋体/mL 和 40 梅毒螺旋体/mL 的两种制剂;每种制剂 10 mL 足以用每种稀释液接种一个 96 孔板。作为对照,制备 1 mL 另一种稀释液,其中包含 2 x 103 梅毒螺旋体/mL。
- 使用标准单通道移液器或多通道移液器,将每孔 50 μL 的 10 梅毒螺旋体/mL 制剂接种到制备的 96 孔板之一中,省略两个对照孔。对 40 梅毒螺旋体/mL 制备物和另一个板重复此过程。在每个板的两个对照孔中,接种 2 x 103 梅毒螺旋体/mL 稀释液。该过程将产生每孔含有 0.5 或 2 个 梅毒螺旋体 的板,以及含有 100 个 梅毒螺旋体的阳性对照孔。
注意:在这些条件下, 梅毒螺旋 体的接种效率较低,因此即使接种了 ~2 个生物体的孔也可能产生克隆种群。 - 用低O2 气体混合物平衡板(步骤3.3.3),并在34°C的Brewer罐或三气培养箱中孵育。
- 7 天时,从每个培养孔中取出 100 μL 培养基,并用 100 μL 新鲜、平衡的 TpCM-2 代替。通过暗视野显微镜和计数检查对照孔中 梅毒螺旋 体的活力和生长情况,以确保培养条件支持 梅毒螺旋 体增殖。
注:确保每个孔都使用新的移液器吸头,以防止克隆培养物的交叉污染。 - 在 14 天时,将 50 μL 培养上清液从每个孔转移到按照步骤 6.1 制备的新鲜板中。
- 在第 21 天和第 28 天根据需要重复交替喂养和传代。
- 使用暗视野显微镜或 qPCR26 监测每个孔中梅毒螺旋体的存在。
注意:由于 梅毒螺旋 体的缓慢生长速度和在喂养和转移过程中生物体的必要损失,接种 0.5 或 2 梅毒螺旋体 的孔通常直到第 28 天或之后才通过任何一种方法呈阳性。 - 一旦鉴定出阳性孔,就用胰蛋白酶消化并将这些孔转移到 24 孔板中以进一步扩增。通过单个 tprK 序列的优势和亲本菌株中异质性位点存在单个序列来确定克隆性27。
结果
使用所描述的条件, 梅毒螺旋 体通常保持 >90% 的运动性,并在进入固定相之前以 33 小时至 45 小时的倍增时间进行对数倍增,持续约 7 天(图 3)。在 1 周的过程中,螺旋体经历大约 4-5 次倍增(图 4)。).此外,不同的 梅毒螺旋 体菌株可能以不同的速度生长。SS14 组 梅毒螺旋 体菌株的倍增时间往往比 Nichols 组17 的菌株慢。
培养物的补料可能会将培养时间延长数天,但 Sf1Ep 细胞层通常在培养一周后失效。此外,密螺旋体达到约 5 x 107/mL 的生物上限。以 7 天为间隔转移的培养物通常继续对数增殖,几乎没有或没有滞后期。处于固定相中的生物体通常变得难以通过。
大多数 梅毒螺旋 体附着在 Sf1Ep 细胞上。然而,上清液中仍残留足够的 梅毒螺旋 体,因此可以定期去除培养基样品以检查活力和增殖。如果需要仔细定量,应测量去除的培养基的体积,定量梅 毒螺旋 体的数量,并将去除的生物总数添加到收获时的最终计数中。
在以前的研究中,每孔接种 2 个 梅毒螺旋 体的克隆效率(每个生物体的阳性培养物数量)为 12.5%,每孔接种 0.5 个 梅毒螺旋 体的克隆效率为 6.7%27。因此,任何阳性孔都可能代表单个生物体在这些接种物中的任何一个处的生长。然而,必须通过检查亲本培养物中异质性位点的培养物的同质性来验证所得群体的克隆性。证明培养物是同基因的最明确方法是通过全基因组测序27。
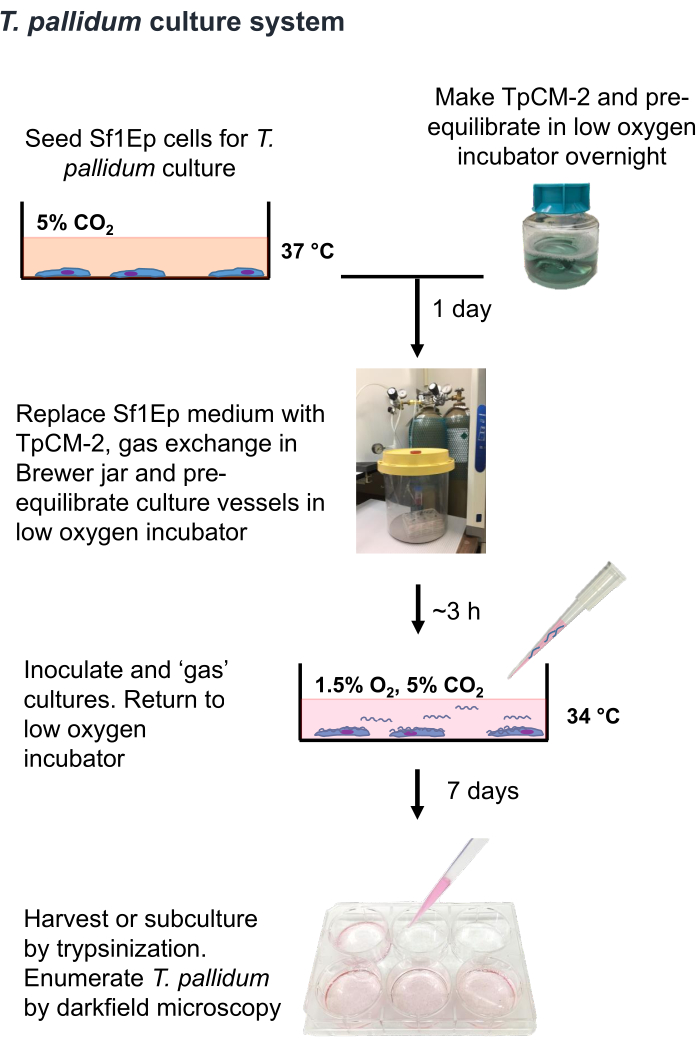
图 1: 梅毒螺旋体体外 培养程序的流程图。 此图经 Edmondson 和 Norris (2021)19 许可转载。 请单击此处查看此图的较大版本。
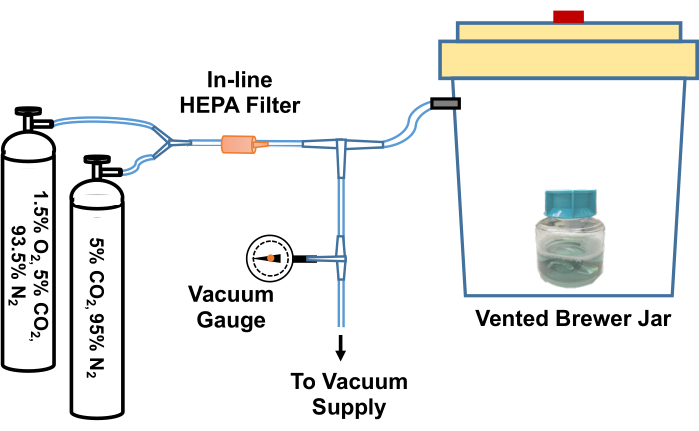
图 2:将 梅毒螺旋 体培养试剂平衡到低氧环境的系统示意图。 Brewer 罐通风口通过 T 型接头连接到真空源(例如室内真空)和包含定制气体混合物(5% CO2,平衡氮和 1.5% O2,5% CO2,平衡氮)的气瓶。在线真空计测量罐中抽取的真空。真空在罐子中被吸入至约 -58 kPa。然后慢慢地将抽空的罐子重新装满气体混合物。Brewer 罐用 5% CO2 重新填充 3 次,在最终抽真空前平衡氮气,然后重新填充 95% N2、5% CO2、1.5% O2。然后从罐中取出培养物或培养基,并迅速转移到低氧培养箱中。或者,可以将 Brewer 罐和第一个 T 形接头之间的管道拧紧,将管道与 T 形接头断开,并将整个 Brewer 罐转移到 34 °C 培养箱中。此图经 Edmondson 和 Norris (2021)19 许可转载。 请单击此处查看此图的较大版本。
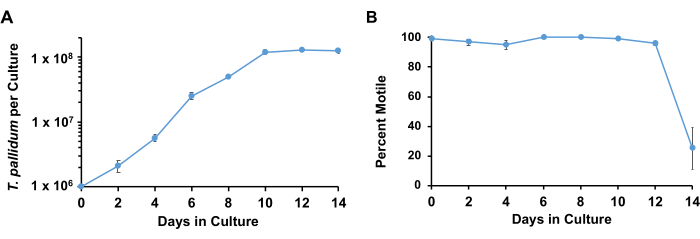
图 3:用 Sf1Ep 细胞和 TpCM-2 培养基培养的 梅毒螺旋 体的生长曲线。 平行一式三份培养物接种梅 毒螺旋体。在每个时间点收获重复;结果表示这些培养物的平均值 + SEM。(A) 显示了每次培养的 梅毒螺旋体 的变化和 (B) 运动百分比。此图经 Edmondson 等人18 许可改编。 请单击此处查看此图的较大版本。
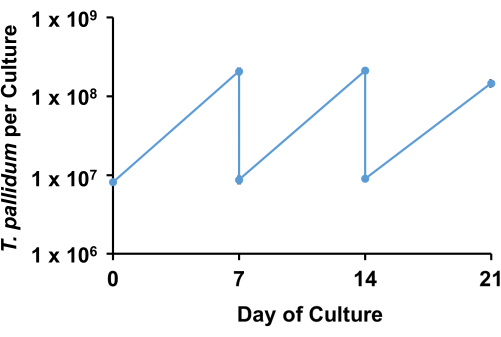
图 4:梅毒螺旋体 Nichols 菌株的体外培养传代示例。用梅毒螺旋菌接种平行一式三份的培养物,并使用 1:20 稀释度每周传递一次。锯齿图显示每次培养的梅毒螺旋体数量以及在每个时间点转移到新培养物的数量。结果表示 3 次生物学重复的 SEM ±平均值。请单击此处查看此图的较大版本。
表 1:培养容器的中等体积和接种比例。请点击此处下载此表格。
表 2: 梅毒螺旋 体培养培养基。 所有培养基在制备后都应进行过滤灭菌。Sf1Ep 培养基可在 4 °C 下储存长达两个月。TpCM-2 通常在使用前一天制备。解离培养基应分装并冷冻。 请点击此处下载此表格。
讨论
Sf1Ep-TpCM-2 系统是第一个促进梅毒螺旋体连续体外培养的可用程序。由于这种生物体的极端生长要求,该系统很复杂:1) 由于生物合成能力有限,营养需求复杂;2) 尽管对活性氧高度敏感 9,10,16,36,但对少量氧气的需求知之甚少;3) 目前需要 Sf1Ep 细胞的存在。虽然在程序上“偷工减料”很诱人,但建议仔细遵循这些步骤,直到在尝试修改之前实现成功的长期培养。随着有关梅毒螺旋体代谢需求的其他信息的积累,有可能发展出不需要 Sf1Ep 细胞存在的轴系条件。然而,体外生长速率可能会保持缓慢(最小倍增时间为 33 小时至 46 小时,具体取决于菌株)17,18,因为即使在哺乳动物感染期间,梅毒螺旋体的估计倍增时间也为 30 小时至 33 小时37,38。与任何细菌培养物一样,建议保持低传代率的原液,并使用距离这些原液少于 10 次的梅毒螺旋体培养物进行实验,以避免“遗传漂变”和由于突变引起的相关表型变化。
Sf1Ep 细胞显然为密螺旋体提供必需的营养物质或酶活性。然而,它们也会消耗营养物质(如葡萄糖和氧气),并可能产生低 pH值 9,16,39 等有毒情况。因此,在拥有足够的 Sf1Ep 细胞来支持梅毒螺旋体增殖和防止哺乳动物细胞过度生长和毒性之间存在平衡作用。高传代数的 Sf1Ep 细胞往往生长得更快,有时会失去支持梅毒螺旋体增殖的能力。因此,应监测 Sf1Ep 传代数,并应定期用低传代冷冻制剂更换细胞储备液。Sf1Ep 细胞的存在也使梅毒螺旋体特性(如 DNA、RNA 和蛋白质含量以及酶活性)的研究复杂化。在一定程度上,使用重复低速离心(100 x g ,5 分钟)或更有效地使用 Percoll 或 Hypaque 梯度40,41 可以去除兔细胞。然而,梯度离心方法通常仅对大量梅毒螺旋体有效。传播梅毒螺旋体的替代方法仅限于实验室动物(如兔子)的感染13,14。这种方法有道德考虑,并且成本越来越高;然而,兔模型对于研究梅毒螺旋体的发病机制和宿主免疫反应非常有用。此外,在体外培养和兔感染期间,梅毒螺旋体的基因表达、生长或行为可能存在一些差异27。
在本报告发布时,Sf1Ep-TpCM-2 系统已在美国和欧洲的至少 6 个研究小组中建立,并已发表 16 篇出版物,主题从 梅毒螺旋 体基础生物学和遗传学到抗菌药物敏感性。 体外 培养在研究这种神秘病原体方面的价值可能会随着使用范围的扩大和未来的改进而增加。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了美国国立卫生研究院/NIAID 的 R01 AI141958 赠款的支持。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
参考文献
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。