Method Article
נהלים לטיפוח חוץ גופי של Treponema pallidum, עגבת Spirochete
In This Article
Summary
פרוטוקול זה מתאר גידול חוץ גופי של פתוגן עגבת Treponema pallidum subsp. pallidum בתרבית משותפת עם תאי יונקים. השיטה ניתנת להרחבה; ניתן להשתמש בו לייצור כמויות גדולות של T. pallidum וליצירת תרביות שבטיות.
Abstract
במשך יותר ממאה שנה, Treponema pallidum subsp. pallidum, החיידק בצורת ספירלה הגורם עגבת, יכול היה להיות מופץ רק על ידי חיסון וקציר של אורגניזמים מאכי ארנבת. בשנת 2018 תיארנו שיטה לטיפוח מתמשך של T. pallidumin vitro. מערכת זו משתמשת בתרבית משותפת עם תאי אפיתל ארנבים (תאי Sf1Ep) בתווך תרבית רקמה המכיל סרום בשם TpCM-2. זמן ההכפלה של T. pallidum בתרבית דומה לזה המוערך במהלך זיהום טבעי (כ 33-45 שעות). האורגניזם יכול להיות בתרבית ברציפות עם זמן מעבר סטנדרטי של שבוע אחד בסביבה חמצן נמוכה (1.5%) ב 34 °C (75 °F). מאמר זה מכיל את הפרוטוקולים לגידול T. pallidum, שיטות לגידול ותחזוקה של תאי תרבית רקמה נדרשים, ואת הטכניקה ליצירת זנים איזוגניים על ידי הגבלת דילול. היכולת לגדל T. pallidum in vitro מספקת דרכים ניסיוניות חדשות לחקור ולהבין את האורגניזם החידתי הזה.
Introduction
Treponema pallidum הוא מין של חיידק בצורת ספירלה (הנקרא spirochetes) הגורם עגבת וזיהומים הקשורים בבני אדם ופרימטים אחרים. עגבת היא מחלה קשה עם השפעות ארוכות טווח על אנשים נגועים, וההערכה היא כי מעל 8 מיליון מקרים חדשים של עגבת להתרחש ברחבי העולםמדי שנה 1. T. pallidum חולק לשלושה תת-מינים בהתבסס על המחלות שהם גורמים בבני אדם, כמו גם הבדלים גנטיים קלים: תת-מינים pallidum (הגורם למחלת המין עגבת), תת-מינים pertenue (פיהוקים) ותת-מינים endemicum (הגורם לעגבת או עגבת אנדמית)2,3. T. pallidum subsp. pertenue גורם גם לזיהומים בבבונים, שימפנזים ופרימטים אחרים. אורגניזם קרוב בשם Treponema paraluiscuniculi (נקרא גם Treponema paraluisleporidarum) גורם לזיהום ארנבות ארנבות 4,5. כל החיידקים האלה קשורים מאוד זה לזה, עם יותר מ-98% זהות רצף DNA ברמת הגנום 6,7,8. לכל אחד מהם כרומוזום עגול יחיד וקטן בגודל של כ-1.14 מיליון זוגות בסיסים (Mb). חברי קבוצת T. pallidum זו נמצאים רק בשיתוף עם פונדקאי היונקים שלהם; ככאלה, הם פתוגנים מחייבים התלויים במין המארח שלהם להישרדות וצמיחה 9,10.
ניסיונות לתרבית T. pallidum in vitro החלו זמן קצר לאחר זיהויו על ידי שאודין והופמן בשנת 190511,12. עם זאת, מאמצים אלה לא הצליחו להוביל לצמיחה עקבית וניתנת לשחזור של האורגניזם. כתוצאה מכך, מחקרי T. pallidum דרשו התפשטות של האורגניזם באמצעות זיהום ניסיוני של חיות מעבדה, לרוב ארנב13,14. בשנת 1981, Fieldsteel et al.15 הציגו מערכת תרבית רקמות שקידמה את הכפל של זני T. pallidum לתקופה של עד שבועיים. מערכת זו כללה תרבית משותפת של T. pallidum עם תאי אפיתל ארנב זנב כותנה Sf1Ep בתווך תרבית רקמה שונה (T. pallidum Culture Medium 1, TpCM-1) המבוסס על Eagle's Minimum Essential Medium (MEM) ו-20% נסיוב בקר עוברי (FBS). תנאי תרבית אחרים שנדרשו היו דגירה בטמפרטורה של 34 מעלות צלזיוס באטמוספירה המכילה 1.5% O2 ו-5% CO2 9,16. במערכת זו, T. pallidum נצמד לתאי Sf1Ep ומתרבה כאשר הוא נמצא בקשר הדוק עם פני התא של יונקים. למרות ניסיונות תת-תרבות רבים ושינויים אחרים, מערכת Fieldsteel et al. לא הצליחה לקדם צמיחה מתמשכת במבחנה.
בשנת 2018, המעבדה שלנו דיווחה כי השימוש בתווך שונה בשם TpCM-2 (שבו MEM של נשר הוחלף בתווך תרבית רקמה מורכב יותר, CMRL 1066) סיפק T. pallidum את החומרים המזינים הדרושים כדי לאפשר תרבית עקבית לטווח ארוך17. עד כה, שינוי זה הוביל לתרבית עקבית ורציפה של לפחות 5 זנים של T. pallidum subsp. pallidum (Nichols, SS14, Mexico A, UW231B ו-UW249B) וזן אחד של T. pallidum subsp. endemicum (בוסניה A)18,19. לדוגמה, זן ניקולס מתורבת כעת ברציפות במבחנה במשך למעלה מ-6 שנים. עד כה, ניסיונות לתרבית פיהוקים מבודדים (T. pallidum subsp. pertenue) או T. paraluiscuniculiin vitro לא צלחו18. מערכת TpCM-2 עדיין דורשת נוכחות של תאי Sf1Ep, ריכוזי חמצן נמוכים ודגירת 34°C, מה שהופך את המערכת למורכבת יותר מרוב טכניקות תרבית החיידקים. עם זאת, מערכת תרבית T. pallidum שונה זו הייתה שימושית להגדרה נוספת של דרישות הגדילה של החיידק18, קביעת ריכוזים מעכבים מינימליים (MICs) של תרכובות מיקרוביאליות ופפטידים 20,21,22,23,24,25, הפצת זנים חדשים מרקמת המטופל26, בידוד אוכלוסיות משובטים של אורגניזם27, המאפיין את מערכת השונות האנטיגנית tprK 27,28, בוחן ביטוי גנים29, ומבצע ניתוח מוטציות 30,31,32.
במאמר זה נתאר את השיטות הנוכחיות לטיפוח T. pallidum in vitro. אנו מקווים שמידע זה יסייע להקל על היישום הנרחב יותר של טכניקת תרבית חוץ גופית זו לשיפור האבחון, הטיפול והמניעה של עגבת וזיהומים טרפונמליים קשורים.
Protocol
הערה: כל השלבים דורשים שימוש בטכניקה אספטית ובחומרים סטריליים וריאגנטים. מומלץ להשתמש בקולט זרימה למינרי של תרבית רקמה כדי להפחית הן א) את חשיפת כוח האדם לחומר זיהומי והן את האפשרות לזיהום מיקרוביאלי של תרביות.
1. הקמת מלאי תאי Sf1Ep
הערה: ניתן לרכוש תאי אפיתל ארנב זנב כותנה Sf1Ep כמלאי קפוא מאוסף תרביות הסוגים האמריקאי (ראה טבלת חומרים). נראה כי אופי הגידול האיטי וקצב חילוף החומרים הנמוך של תאי Sf1Ep הם המפתח ליכולתם לתמוך בהישרדות ובצמיחה ארוכות טווח של T. pallidum33; לכן, החלפה עם תרביות תאים אחרות של יונקים אינה מומלצת. תאי Sf1Ep אינם קו תאים אימורטלי וניתן לשמור עליהם רק 25-30 מעברים בתרבית. לכן, חשוב לשמור מלאי קפוא של תאי Sf1Ep בעלי מעבר נמוך לשימוש עתידי. קווי Sf1Ep אימורטליים מופיעים מדי פעם במהלך התרבית ארוכת הטווח של תאי Sf1Ep. (תצפיות שלא פורסמו). קווים אלה לעתים קרובות גדלים מהר יותר וקל יותר לטפל בהם; עם זאת, לפעמים, הם מאבדים את היכולת לתמוך בצמיחת T. pallidum . ניתן להשתמש בקווי Sf1Ep מונצחים ולאחר מכן להחליף אותם כאשר הספירוצ'טות מתחילות לגדול לאט.
- הכינו תא Sf1Ep בינוני וחממו אותו מראש באינקובטור של 37°C, 5% CO2 .
הערה: מדיום תאי Sf1Ep מורכב מ-MEM של Eagle's בתוספת 10% FBS, 1x MEM חומצות אמינו לא חיוניות, 2 mM L-גלוטמין ו-1 mM נתרן פירובט. (ראה טבלת חומרים). המדיום צריך להיות מעוקר מסנן והוא יכול להיות מאוחסן ב 4 ° C במשך עד 2 חודשים. אין להשתמש באנטיביוטיקה (כגון פניצילין וסטרפטומיצין) בתווך התא Sf1Ep מכיוון שנשיאה של כמויות זעירות של אנטיביוטיקה תפריע לצמיחה של T. pallidum. - הפשיר את מלאי Sf1Ep הקפוא במהירות ב 37 ° C. נגבו את החלק החיצוני של הבקבוקון עם 70% אתנול.
- הוסף 1 מ"ל של תווך תא Sf1Ep לקריוביאל וערבב בעדינות. הוסף את תערובת ציר בינוני / תאים לצינור צנטריפוגה חרוטי סטרילי 15 מ"ל המכיל 5 מ"ל של תווך תא Sf1Ep וערבבו בעדינות.
- משחררים את התאים על ידי צנטריפוגה ב 100 x גרם במשך 7 דקות. הסר והשליך את supernatant, נזהר לא להפריע את גלולת התא.
- השהה מחדש בעדינות את תאי Sf1Ep המופשרים ב- 15 מ"ל של תווך תאי Sf1Ep טריים והעבר אותם לצלוחית תרבית רקמה T75.
הערה: השחזור של תאי Sf1Ep שהופשרו לאחרונה משופר על ידי צנטריפוגה כדי להסיר את ה- DMSO המשמש להקפאת התאים. עם זאת, ניתן להשמיט את שלבים 1.4-1.7 ולזרוע את התאים המופשרים משלב 3 ישירות לתוך בקבוק תרבית רקמה T75 המכיל 14 מ"ל של תווך תא Sf1Ep. לאחר הדגירה למשך הלילה, החליפו מחצית מהמדיום בתווך Sf1Ep טרי כדי לדלל את שאריות ה-DMSO. - לדגור על תרביות Sf1Ep באינקובטור סטנדרטי של תרביות רקמה לחות ב 37 ° C, 5% CO2. שחררו את הכובעים של צלוחיות תרבית רקמה לא מאווררות כדי לשמור על pH בינוני תקין.
2. העברת תאי Sf1Ep
הערה: צמיחת תרבית תאים Sf1Ep מנוטרת באמצעות מיקרוסקופ הפוך באמצעות אופטיקת ניגודיות פאזה. בדרך כלל, לוקח לתאים כשבוע להגיע למפגש קרוב. כאשר התאים מגיעים למפגש ~90%, ניתן להעביר אותם, להשתמש בהם לגידול T. pallidum , או להכנת מלאי קפוא. ניתן להאריך את חיי התרבות לשבועיים על ידי החלפת מחצית ממדיום התרבות לאחר שבוע אחד של תרבות.
- שאפו והשליכו את מדיום הגידול Sf1Ep מהצלוחית. יש לשטוף את שכבת התא עם 5 מ"ל של PBS סטרילי בטמפרטורת החדר (RT), ולשאוף ולהשליך את שטיפת PBS.
- הוסף 2.5 מ"ל של טריפסין-EDTA לבקבוק ואטם את המכסה. נענעו את הבקבוק קדימה ואחורה כדי לכסות את שכבת התא בטריפסין-EDTA ולדגור על הבקבוק בטמפרטורה של 37°C למשך 5 דקות.
- הקש על הבקבוק בעדינות כדי לעקור את התאים. התבונן תחת מיקרוסקופ הפוך כדי לאשר את פיזור תאי Sf1Ep.
- הוסף 5 מ"ל של מדיום גידול Sf1Ep ונדנד את הבקבוק כדי לערבב עם טריפסין-EDTA ולעצור את הפעולה של טריפסין. הסר את תאי Sf1Ep המרחפים לצינור חרוטי סטרילי.
- כמת את התאים באמצעות hemocytometer או מונה תאים אוטומטי.
- כדי לשמור על מלאי תאי עבודה, העבר aliquot (0.5-1.0 מ"ל או ~ 8 x 105 תאים) של תערובת המדיום/טריפסין-EDTA/תאים לבקבוק תרבית רקמה T75 חדש המכיל 15 מ"ל של מדיום Sf1Ep טרי.
- עבור תרבית T. pallidum , יש לדלל את התאים בתווך Sf1Ep ל-0.25-0.5 x 105 תאים/מ"ל ולזרוע אותם לכלי תרבית מתאימים (טבלה 1).
- כדי להקפיא תאי Sf1Ep, סובבו בצנטריפוגה שולחנית במהירות של 100 x גרם למשך 7 דקות. הסר בזהירות את הסופרנאטנט מבלי להפריע לכדורית התא. יש להשהות מחדש את גלולת התא בתווך Sf1Ep בתוספת DMSO בדרגת תרבית רקמה של 10%.
- יש לפזר 1 מ"ל של תרחיף התא לכל קריוביאל ולהקפיא למשך הלילה בטמפרטורה של -70°C עד -80°C במיכל מבודד (כגון מחזיק מבחנה מקלקר) כדי לשפר את שימור הכדאיות לפני העברת הבקבוקונים לכלי קריוגני של חנקן נוזלי.
3. טיפוח T. pallidum
זהירות: כל תת-המינים והזנים של T. pallidum הם פתוגניים לבני אדם ומסווגים כפתוגנים ברמת בטיחות ביולוגית 2 (BSL-2)34. אמצעים מתאימים נחוצים כדי להגן על כוח אדם; אלה כוללים שימוש בכפפות ובציוד מגן אישי אחר (PPE) וכן חיטוי של משטחים, חומרים ונוזלים שעלולים להיות חשופים ל-T. pallidum. T. pallidum מנוטרל בקלות על ידי חשיפה ל-70% אתנול או חומרי חיטוי זמינים מסחרית. מומלץ להשתמש באופן עקבי במנדפים של זרימה למינרית לטיפול בדגימות המכילות T. pallidum .
הערה: T. pallidum הוא אורגניזם מיקרואירופילי שניתן להרוג על ידי כמה שעות של חשיפה לרמות אטמוספריות של חמצן 9,16,35. לכן, מומלץ להגביל את הטיפול ב-T. pallidum באוויר לפחות משעה במידת האפשר. כמו כן, מדיום TpCM-2 צריך להיות מאוזן מראש ב 1.5% O2, 5% CO2, איזון N2, ערבוב נמרץ (למשל, שימוש במערבולת) צריך להיות מוגבל. מכיוון שתרבית T. pallidum מתבצעת בדרך כלל בהיעדר אנטיביוטיקה, יש צורך בזהירות נוספת כדי למנוע זיהום בחיידקים או פטריות. הליך Sf1Ep-TpCM-2 לגידול T. pallidum מסוכם באיור 1 וכולל מספר שלבים, כולל זריעת כלי תרבית עם תאי Sf1Ep, הכנת תווך TpCM-2 וחיסון התרביות עם T. pallidum. סרום בקר עוברי מומת בחום (FBS) הוא מרכיב בינוני קריטי, ויעילותו משתנה בין ספקים שונים ומגרשיםשונים 19. סינון מוקדם של מגרשי FBS ליעילות הוא הכרחי.
- בחר את גודל התרבות המתאים.
הערה: תרבית T. pallidum ניתנת להרחבה מפורמטים גדולים (כגון 75 ס"מ2 צלוחיות המניבות ~ 1 x 109T. pallidum לכל תרבית) לצלחות 96 בארות (מתאימות לניסויי שיבוט)17,18,19,27.- בעת התאמת גודל התרבית, יש לקחת בחשבון את מספר תאי Sf1Ep ו- T. pallidum שחוסנו בכל תרבית, כמו גם את כמות המדיום הדרושה, כפי שמוצג בטבלה 1. השתמש צלוחיות עם כובעים מאווררים כפי שהם מאפשרים זרימה חופשית של גזים עם ירידה באובדן נפח עקב אידוי.
- השתמש בפורמט צלחת 6 בארות עבור תרביות ראשוניות מכיוון שנוח לכלול משכפלים משולשים ובארות נוספות במקרה של זיהום מיקרוביאלי.
- זרע תאי Sf1Ep 1-2 ימים לפני הניסוי.
- הכן השעיה של תאי Sf1Ep על ידי טריפסיניזציה של תרביות מלאי, כמתואר בשלב 2.7.
- קבע את ריכוז תאי Sf1Ep בתרחיף באמצעות hemacytometer או מונה תאים אוטומטי.
- הוסף את המספר המתאים של תאי Sf1Ep ומדיום Sf1Ep (טבלה 1) לכל תרבית. יש לדגור על התרביות בטמפרטורה של 37 מעלות צלזיוס באינקובטור תרביות רקמה סטנדרטי עם 5%CO2 עד לשימוש.
- הכינו את TpCM-2 יום אחד לפני הניסוי.
הערה: ניתן להכין ולאחסן את TpCM-2 בטמפרטורה של -20°C למשך מספר חודשים. יש להפשיר את התווך ולאזן אותו באינקובטור דל החמצן יום לפני הניסוי.- להשיג פתרונות סטריליים עבור רכיבי TpCM-2 (טבלה 2) באופן מסחרי או להכין אותם מגיבים יבשים ולסנן לעקר אותם. אחסנו את התמיסות בטמפרטורה של 4°C למשך עד חודשיים. התאם את ה- pH של מאגר MOPS ל- 7.5 לפני עיקור המסנן; אחרת, אין צורך להתאים את הרכיבים או את ה- TpCM-2 הסופי ל- pH.
הערה: מומלץ להשתמש במים מזוקקים סטריליים באיכות תרבית רקמה להכנת המרכיבים הבינוניים. - שלב את הריאגנטים המפורטים בטבלה 2 במיכל סטרילי, והוסף dithiothreitol (DTT) כאבקה יבשה אחרונה (כדי למזער את החמצון שלה). הרחב (או צמצם) את הכמויות של כל רכיב כדי להכין את הכמות הדרושה של TpCM-2. ערבבו ועיקרו בעדינות את המדיום באמצעות יחידת מסנן של 0.22 מיקרומטר.
- שחררו את מכסה הבקבוק המכיל את TpCM-2. יש לאזן מראש את המדיום על ידי הכנסתו לצנצנת אנאירובית (Brewer), פינוי ומילוי מחדש בתערובת גז 95% N2, 5% CO2 שלוש פעמים, ולאחר מכן מילוי בתערובת גז 1.5% O2, 5% CO2, איזון תערובת גז N2 לאחר הפינוי הסופי. דוגמה למערכת לביצוע תהליך חילופי הגזים הזה מתוארת באיור 2.
- העבר במהירות את התווך לחממה תלת-גזית שהוקמה כדי לספק 1.5% O2, 5% CO2, ולאזן אטמוספירה N2 ב 34 ° C. לחילופין, ניתן לאטום את הצנצנת האנאירובית המכילה את התווך בעקבות חילופי הגזים המתוארים ב-3.3.3 ולהעבירו לאינקובטור תקני.
- להשיג פתרונות סטריליים עבור רכיבי TpCM-2 (טבלה 2) באופן מסחרי או להכין אותם מגיבים יבשים ולסנן לעקר אותם. אחסנו את התמיסות בטמפרטורה של 4°C למשך עד חודשיים. התאם את ה- pH של מאגר MOPS ל- 7.5 לפני עיקור המסנן; אחרת, אין צורך להתאים את הרכיבים או את ה- TpCM-2 הסופי ל- pH.
- בבוקר הניסוי, בדקו את תרביות Sf1Ep באמצעות מיקרוסקופ הפוך. ודא שהתאים מחוברים ו- 5%-10% מתמזגים. הסר את המדיום.
- שטפו את הבארות לזמן קצר באמצעות נפח קטן (0.2 מ"ל עד 2 מ"ל, תלוי בגודל כלי הדם) של ה-TpCM-2 המשויל מראש, הסירו את השטיפה והוסיפו את הכמות המתאימה של TpCM-2 (טבלה 1). אזנו את הלוחות ב-1.5% O2, 5% CO2, ואזן את אטמוספירת N2 ב-34°C למשך 3-4 שעות כפי שתואר קודם לכן.
- מעבירים את הצלחות למכסה זרימה למינרי ומחסנים במספר המתאים (טבלה 1) של T. pallidum ממלאי קפוא או תכשירים טריפסיניים מתרביות טריות שנקטפו (כמתואר להלן). ניתן להשתמש גם במלאי טרי או קפוא שנאסף מארנבים נגועים13. יש לאזן מחדש את הלוחות כמתואר ב-3.3.3 ולדגור על התרביות ב-1.5% O2, 5% CO2, ולאזן את האטמוספירה N2 ב-34°C.
4. קציר והעברה של תרביות T. pallidum
הערה: מכיוון שרוב T. pallidum בתרבית מחובר לפני השטח של תאי Sf1Ep, יש צורך לנתק את הטרפונמים מתאי היונקים כדי לאחזר אותם ולקבל ספירה מדויקת של האורגניזמים. 'קטיף' כזה ומעבר לתרבויות טריות נעשה בדרך כלל ביום השביעי של התרבות. ההליך המתואר כאן הוא עבור צלחות 6 בארות; כמות תמיסת טריפסין-EDTA בשימוש מותאמת למעלה או למטה בהתאם לגודל תבנית התרבית 17,19,27.
- בזמן הקציר מוציאים את התרביות מהאינקובטור. בחן את שכבת התא Sf1Ep בכל באר באמצעות מיקרוסקופ ניגודיות פאזה הפוכה ורשום את צפיפות התא (למשל, 80% במפגש) ואת המראה. כמו כן, שים לב לצבע של TpCM-2; מחוון resazurin יהפוך לעתים קרובות מוורוד לצהוב כתוצאה של pH נמוך יותר.
- פיפטה את המדיום מכל באר לתוך צינור חרוטי סטרילי 15 מ"ל, באמצעות pipets נפרדים עבור כל באר כדי למנוע זיהום צולב. יש לשטוף כל באר בתמיסת טריפסין-EDTA שחוממה מראש ב-0.35 מ"ל, ולהוסיף את השטיפה למדיום.
- הוסף עוד 0.35 מ"ל של תמיסת טריפסין-EDTA לכל באר, ודגר על הצלחת במשך 5 דקות באינקובטור סטנדרטי של 37 מעלות צלזיוס; אטמוספירה נמוכה O2 אינה נדרשת לפרק זמן קצר זה.
- בדוק את העיגול והניתוק של תאי Sf1Ep, אשר נמצא בקורלציה גם עם הדיסוציאציה של T. pallidum מתאי היונקים. עקוב אחר תהליך זה באמצעות המיקרוסקופ ההפוך, וספק זמן נוסף או תמיסת טריפסין-EDTA לפי הצורך. תהליך הדיסוציאציה מקל על ידי ראפ עדין בצד הצלחת המשותקת עם מתלה מבחנה מפלסטיק או חפץ דומה.
- פיפטה המדיום השמור ולשטוף לתוך הבאר כדי לאחזר את T. pallidum מנותק תאים. רשום את הנפח הכולל שאוחזר לצורך חישוב התשואה לתרבית.
- ברוב הניסויים, העבירו נפח קבוע של T. pallidum שנקטף לצלחות תרבית עם תאי Sf1Ep טריים ו-TpCM-2. במקרים כאלה, להעביר כ 1/20מנפח התרבית (כגון 200 μl עבור תרבית צלחת 4 מ"ל, 6 בארות); כוונן עוצמת קול זו למעלה או למטה, תלוי אם זן T. pallidum גדל מהר או לאט. הסר את תאי Sf1Ep בחיסון על ידי צנטריפוגה ב 100 x גרם במשך 5 דקות, אבל שלב זה אינו הכרחי עבור העברות שגרתיות.
- מיד לאחר חיסון הצלחות לניסוי, החליפו את האווירה בצלחות בתהליך הפינוי והמילוי מחדש (שלב 3.3.3). לדגור על הצלחות בטמפרטורה של 34 מעלות צלזיוס בתוך צנצנת הבירה או להעביר אותן לאינקובטור תלת גז.
- ספירת T. pallidum במיקרוסקופ שדה כהה באמצעות תא ספירה Helber או מכשיר דומה, בהתאם להוראות היצרן.
הערה: תא הלבר הוא מגלשת זכוכית מכויילת והחלקת כיסוי המשפרת מאוד את הדיוק ויכולת השחזור של ספירת החיידקים; התא עובר חיטוי, ניקוי וייבוש בקלות באמצעות 70% אתנול ורקמות נייר וניתן לעשות בו שימוש חוזר ללא הגבלת זמן. באופן אידיאלי, מיקרוסקופ השדה האפל צריך להיות בעל עיניות אובייקטיביות של 40x ו- 15x. בצע ספירות כפולות עבור כל תרבית, ורשום את מספר T. pallidum התנועתי והלא תנועתי וכל שינוי מורפולוגי שיירשם. PCR כמותי (qPCR) עשוי לשמש גם במקרים בהם אין צורך בכימות מדויקת וקביעת תנועתיות17,24. - בניסויים שבהם טיפול בטריפסין עשוי שלא להיות רצוי (כגון אלה הבוחנים את תכולת חלבון T. pallidum), השתמש במדיום דיסוציאציה EDTA כדי לנתק את T. pallidum ואת מונושכבההתא 17,19.
הערה: Dissociation Medium מורכב מ-FBS שעבר חיוג כנגד מלח חוצץ פוספט (PBS) או תמיסת מלח בסיסית של ארל (EBSS) ללא סידן כלורי ומגנזיום כלורי כדי להסיר קטיונים דו-ערכיים במדיום גידול T. pallidum מפושט (טבלה 2). הליך זה עשוי להימשך פרק זמן ארוך יותר (עד 30 דקות) או טיפול חוזר לדיסוציאציה מלאה.
5. הקפאה ואחסון של תרביות T. pallidum
הערה: ניתן לאחסן T . pallidum ללא הגבלת זמן בטמפרטורה של -70°C או פחות, כאשר הכדאיות בעת ההפשרה היא בדרך כלל 50%-90%.
- יש להקפיא תרביות T. pallidum בעת הקציר בתוספת של 10% (v/v) גליצרול. פזרו את הגליצרול לאורך כל ההכנה באמצעות פיפטינג עדין או היפוך. לאחר מכן, להפיץ את ההכנה 1-2 מ"ל aliquots לתוך בקבוקוני מקפיא בורג ומיד לשים את הבקבוקונים במקפיא -80 מעלות צלזיוס או מקפיא N2 נוזלי.
- כדי להתחיל תרבית T. pallidum ממלאי קפוא, ראשית, הכינו כלי תרבית מתאימים המכילים תאי Sf1Ep ו- TpCM-2 כמתואר בסעיף 3. הפשירו את הבקבוקון המכיל את המלאי הקפוא T. pallidum במהירות; שימוש זהיר באמבט מים בטמפרטורה של 37 מעלות צלזיוס או בלוק חימום מועיל בהקשר זה.
- לאחר מכן, העבירו את התכשיר המופשר לכלי התרבית. ודא שהיחס בין נפח מלאי קפוא למדיום Tp-CM2 הוא 1:5 ומעלה כדי להבטיח דילול מספיק של גליצרול כדי לקדם את הישרדותו וצמיחתו של T. pallidum.
- לדגור על התרבית בתנאים מיקרו-אירוביים למשך 7 ימים ולעבור לתרביות טריות כמתואר בסעיף 4.
6. יצירת שיבוטים איזוגניים של T. pallidum
הערה: הליך זה מתואר בפירוט במחקר קודם27.
- בניסוי טיפוסי, הכינו ושיווי משקל מראש של שני לוחות 96 בארות עם 1000 תאי Sf1Ep ו-200 מיקרוליטר של TpCM-2 לכל באר, כמתואר בסעיף 3.
הערה: פיפטור רב-ערוצי של 200 μL ומאגרים מגיבים חד-פעמיים סטריליים תואמים מפשטים מאוד את שלבי החיסון של תאי Sf1Ep, החלפה בינונית וחיסון. - כמת את ריכוז T. pallidum בתכשיר שזה עתה נקטף באמצעות מיקרוסקופ שדה כהה ותא הלבר (שלב 4.8). לדלל את תרחיף T. pallidum ב- TpCM-2 כדי לייצר שני תכשירים בריכוזים של 10 טרפונמים/מ"ל ו-40 טרפונמים/מ"ל; 10 מ"ל של כל תכשיר הוא יותר ממספיק כדי לחסן צלחת אחת 96 באר עם כל דילול. כבקרה, להכין 1 מ"ל של דילול נוסף המכיל 2 x 103 T. pallidum/mL.
- באמצעות פיפטה חד-ערוצית סטנדרטית או פיפטה רב-ערוצית, יש לחסן 50 μL לכל באר של תכשיר 10 T. pallidum/mL באחת מ-96 לוחות הקידוח המוכנים, תוך השמטת שתי בארות בקרה. חזור על תהליך זה עם הכנת 40 T. pallidum/mL והצלחת השנייה. בשתי בארות הבקרה בכל צלחת, לחסן את 2 x 103 T. pallidum/mL דילול. תהליך זה יפיק לוחות עם (בממוצע) 0.5 או 2 T. pallidum לכל באר, יחד עם בארות בקרה חיובית המכילות 100 T. pallidum.
הערה: יעילות הציפוי של T. pallidum נמוכה בתנאים אלה, כך שאפילו בארות שנזרעו עם ~2 אורגניזמים עשויות להניב אוכלוסיות שבטיות. - אזנו את הצלחות עם תערובת הגז O2 הנמוכה (שלב 3.3.3) ודגרו עליהן בצנצנת בירה או באינקובטור תלת גזים בטמפרטורה של 34°C.
- לאחר 7 ימים, הסר 100 μL של מדיום מכל באר תרבית והחלף אותו עם 100 μL של TpCM-2 טרי ומאוזן. בדוק את הכדאיות והצמיחה של T. pallidum בבארות הבקרה על ידי מיקרוסקופ שדה כהה וספירה כדי להבטיח שתנאי התרבית תומכים בכפל T. pallidum .
הערה: הקפד להשתמש בקצה פיפט חדש עבור כל באר כדי למנוע זיהום צולב של תרביות שבטים. - לאחר 14 יום, להעביר 50 μL של supernatant התרבות מכל באר לצלחות טריות מוכן כמו בשלב 6.1.
- יש לחזור על האכלה ומעבר לסירוגין לפי הצורך בימים 21 ו-28.
- עקוב אחר נוכחותו של T. pallidum בכל באר באמצעות מיקרוסקופ שדה כהה או qPCR26.
הערה: עם קצב הצמיחה האיטי של T. pallidum ואובדן הכרחי של אורגניזמים במהלך הזנה והעברה, הבארות שנזרעו עם 0.5 או 2 T. pallidum בדרך כלל אינן חיוביות באף אחת מהשיטות עד היום ה-28 או לאחר מכן. - לאחר זיהוי בארות חיוביות, טריפסינזציה ולהעביר בארות אלה ללוחות 24 בארות להרחבה נוספת. לקבוע שיבוט על ידי דומיננטיות של רצף tprK יחיד ונוכחות של רצפים בודדים באתרים הטרוגניים בזן האב27.
תוצאות
באמצעות התנאים המתוארים, T. pallidum בדרך כלל שומר על תנועתיות של >90% ומתרבה לוגריתמית עם זמן הכפלה של 33 שעות עד 45 שעות במשך כ-7 ימים לפני הכניסה לשלב הנייח (איור 3). במהלך שבוע אחד הספירוכטות עוברות כ-4-5 הכפלות (איור 4). ). בנוסף, זנים שונים של T. pallidum עשויים לגדול בקצב שונה. זנים של קבוצת SS14 של T. pallidum נוטים להיות בעלי זמני הכפלה איטיים יותר מאלה של קבוצת ניקולס17.
האכלת תרביות עשויה להאריך את זמן התרבית במספר ימים, אך שכבת תאי Sf1Ep נכשלת לעתים קרובות לאחר שבוע של תרבית. יתר על כן, הטרפונמות מגיעות לגבול עליון של אורגניזמים של כ 5 x 107 / מ"ל. תרביות המועברות במרווחים של 7 ימים ממשיכות בדרך כלל את הכפל הלוגריתמי עם שלב פיגור קטן או ללא שלב השהיה. אורגניזמים בשלב הנייח לעתים קרובות הופכים קשים למעבר.
רוב T. pallidum מחוברים לתאי Sf1Ep. עם זאת, מספיק T. pallidum נשאר supernatant כי דגימות בינוניות ניתן להסיר מעת לעת כדי לבדוק את הכדאיות ואת הכפל. אם נדרשת כימות זהיר, יש למדוד את נפח התווך שהוסר, לכמת את מספר T. pallidum ולהוסיף לספירה הסופית בספירה הסופית בעת הקציר.
במחקרים קודמים, יעילות השיבוט (מספר התרביות החיוביות לכל אורגניזם שחוסן) הייתה 12.5% עבור 2 T. pallidum מחוסן לכל באר ו-6.7% עבור 0.5 T. pallidum מחוסן לכל באר27. לכן, סביר להניח שכל באר חיובית מייצגת את הצמיחה של אורגניזם יחיד באחד מהחיסונים האלה. עם זאת, יש לאמת את השיבוט של האוכלוסיות המתקבלות על ידי בחינת התרבות להומוגניות באתרים הטרוגניים בתרבות האם. הדרך הוודאית ביותר להוכיח שהתרבית היא איזוגנית היא באמצעות ריצוף גנום שלם27.
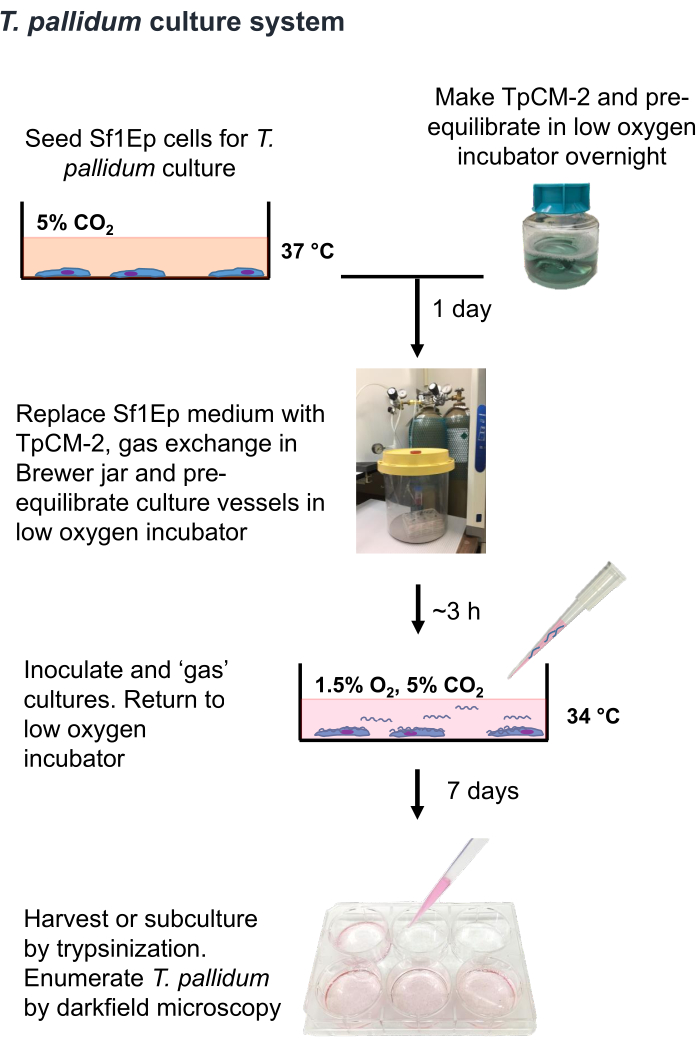
איור 1: תרשים זרימה של הליך גידול T. pallidumin vitro . נתון זה הודפס מחדש באישור Edmondson and Norris (2021)19. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
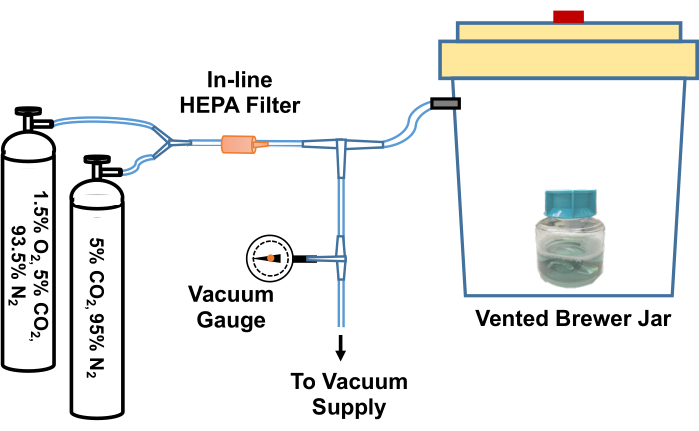
איור 2: דיאגרמה של המערכת לשיווי משקל ריאגנטים של תרביות T. pallidum לסביבה דלת חמצן. פתח אוורור של צנצנת בירה מחובר באמצעות מפרק T למקור ואקום (כגון ואקום ביתי) ולבלוני גז המכילים תערובות גז מותאמות אישית (5% CO2, חנקן איזון ו-1.5% O2, 5% CO2, חנקן מאוזן). מד ואקום מובנה מודד את הוואקום הנמשך בצנצנת. הוואקום נמשך בצנצנת לכ-58- kPa. הצנצנת המפונה מתמלאת מחדש בהדרגה בתערובות הגז. צנצנת הבירה ממולאת מחדש שלוש פעמים ב-5% CO2, מאזנת חנקן לפני פינוי סופי, וממלאת מחדש ב-95% N2, 5% CO2, 1.5% O2. לאחר מכן מוציאים תרביות או מדיה מהצנצנת ומעבירים במהירות לאינקובטור דל חמצן. לחילופין, ניתן להדק היטב את הצינור בין צנצנת Brewer לבין מפרק ה-T הראשון, לנתק את הצינור ממפרק ה-T, ולהעביר את כל צנצנת Brewer לאינקובטור בטמפרטורה של 34°C. נתון זה הודפס מחדש באישור Edmondson and Norris (2021)19. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 3: עקומות גדילה של T. pallidum בתרבית עם תאי Sf1Ep עם תווך TpCM-2. תרביות משולשות מקבילות נזרעו עם T. pallidum. העתקים נקטפו בכל נקודת זמן; התוצאות מייצגות את הממוצע + SEM עבור תרבויות אלה. (A) השינויים ב-T. pallidum לכל תרבית ו-(B) אחוזי תנועתיות מוצגים. נתון זה הותאם באישור אדמונדסון ואחרים 18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 4: דוגמה למעבר של תרבית חוץ גופית של T. pallidum, זן ניקולס. תרביות משולשות מקבילות נזרעו עם T. pallidum והועברו מדי שבוע באמצעות דילול של 1:20. תרשים שיני המסור מראה את המספרים של T. pallidum לכל תרבית ואת המספר שהועבר לתרבויות חדשות בכל נקודת זמן. התוצאות מייצגות את הממוצע ± SEM עבור שלושה שכפולים ביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: נפח בינוני ויחסי זריעה לכלי תרבית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: מדיה לגידול T. pallidum . יש לעקר את כל המדיה לאחר ההכנה. ניתן לאחסן מדיום Sf1Ep בטמפרטורה של 4°C למשך עד חודשיים. TpCM-2 מיוצר בדרך כלל יום אחד לפני השימוש. מדיום הדיסוציאציה צריך להיות מוקפא ולהקפיא. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
מערכת Sf1Ep-TpCM-2 היא ההליך הזמין הראשון המקדם את התרבות המתמשכת במבחנה של T. pallidum. המערכת מורכבת בשל דרישות הגידול הקיצוניות של אורגניזם זה: 1) צרכים תזונתיים מורכבים בגלל יכולות ביוסינתטיות מוגבלות; 2) דרישה לא מובנת לכמויות קטנות של חמצן, למרות רגישות גבוהה למיני חמצן תגובתי 9,10,16,36; ו-3) הצורך הנוכחי בנוכחות תאי Sf1Ep. למרות שזה מפתה "לעגל פינות" על ההליך, מומלץ לעקוב אחר הצעדים בזהירות עד שתושג תרבות מוצלחת לטווח ארוך לפני שמנסים שינויים. ככל שמצטבר מידע נוסף על הדרישות המטבוליות של T. pallidum, ייתכן שניתן יהיה לפתח תנאים אקסניים שאינם דורשים נוכחות של תאי Sf1Ep. עם זאת, קצב הגדילה במבחנה יישאר ככל הנראה איטי (עם זמן הכפלה מינימלי של 33 שעות עד 46 שעות, תלוי בזן)17,18, בהתחשב בכך ש- T. pallidum מתרבה בזמן הכפלה משוער של 30 שעות עד 33 שעות גם במהלך זיהום יונקים37,38. כמו בכל תרבית חיידקים, מומלץ לשמור על מלאי מעבר נמוך ולבצע ניסויים בתרביות T. pallidum שנמצאות במרחק של פחות מ-10 מעברים ממאגרים אלה כדי למנוע "סחף גנטי" ושינויים פנוטיפיים הקשורים עקב מוטציות.
תאי Sf1Ep מספקים ככל הנראה חומרים מזינים חיוניים או פעילויות אנזימטיות לטרפונמים. עם זאת, הם גם צורכים חומרים מזינים (כגון גלוקוז וחמצן) ועלולים לייצר תנאים רעילים כגון pH נמוך 9,16,39. לכן, קיים איזון בין כמות מספקת של תאי Sf1Ep לתמיכה בכפל T. pallidum לבין מניעת צמיחת יתר ורעילות של תאי יונקים. מספרי מעבר גבוהים של תאי Sf1Ep נוטים לגדול מהר יותר ולעיתים מאבדים את היכולת לתמוך בכפל T. pallidum. לפיכך, יש לעקוב אחר מספר המעבר של Sf1Ep, ולהחליף את מלאי התאים בתכשירים קפואים בעלי מעבר נמוך מעת לעת. נוכחותם של תאי Sf1Ep גם מסבכת את המחקר של תכונות T. pallidum כגון DNA, RNA ותכולת חלבונים, ופעילויות אנזימים. הסרת תאי הארנב אפשרית במידה מסוימת באמצעות צנטריפוגה חוזרת במהירות נמוכה (100 x גרם למשך 5 דקות) או בצורה יעילה יותר באמצעות שיפועי פרקול או Hypaque40,41. עם זאת, שיטות הצנטריפוגה ההדרגתית יעילות בדרך כלל רק עם מספרים גבוהים של T. pallidum. שיטות חלופיות להפצת T. pallidum מוגבלות לזיהום של חיות מעבדה כגון ארנבות13,14. לגישה זו יש שיקולים אתיים והיא הפכה יקרה יותר ויותר; עם זאת, מודל הארנב שימושי מאוד לחקר פתוגנזה של T. pallidum ותגובות חיסוניות של המארח. בנוסף, סביר להניח שיש כמה הבדלים בביטוי גנים, גדילה או התנהגות של T. pallidum במהלך תרבית חוץ גופית וזיהום ארנבת27.
בזמן כתיבת דו"ח זה, מערכת Sf1Ep-TpCM-2 הוקמה בלפחות 6 קבוצות מחקר בארצות הברית ובאירופה והביאה ל -16 פרסומים עם נושאים החל מביולוגיה בסיסית וגנטיקה של T. pallidum ועד רגישות מיקרוביאלית. הערך של תרבית חוץ גופית בחקר הפתוגן החידתי הזה צפוי לעלות עם הרחבת השימוש ושיפורים עתידיים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק R01 AI141958 מהמכונים הלאומיים לבריאות של ארצות הברית / NIAID. למממנים לא היה כל תפקיד בעיצוב המחקר, באיסוף הנתונים ובניתוחם, בהחלטה על פרסומם או בהכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
References
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved