Method Article
Процедуры культивирования in vitro Treponema pallidum, спирохеты сифилиса
В этой статье
Резюме
Этот протокол описывает культивирование in vitro возбудителя сифилиса Treponema pallidum subsp. pallidum в кокультуре с клетками млекопитающих. Метод является масштабируемым; его можно использовать для получения больших количеств T. pallidum и для получения клональных культур.
Аннотация
На протяжении более ста лет Treponema pallidum subsp. pallidum, спиралевидная бактерия, вызывающая сифилис, могла размножаться только путем инокуляции и сбора микроорганизмов из яичек кроликов. В 2018 году мы описали метод непрерывного культивирования T. pallidumin vitro. В этой системе используется кокультура с эпителиальными клетками кролика (клетками Sf1Ep) в содержащей сыворотку питательной среде для культуры тканей под названием TpCM-2. Время удвоения T. pallidum в культуре аналогично тому, которое, по оценкам, происходит при естественной инфекции (около 33-45 ч). Организм может культивироваться непрерывно со стандартным временем прохождения 1 неделя в среде с низким содержанием кислорода (1,5%) при температуре 34 °C. Статья содержит протоколы культивирования T. pallidum, методы выращивания и поддержания необходимых клеток тканевой культуры, а также методику получения изогенных штаммов путем ограничения разведения. Возможность выращивать T. pallidum in vitro открывает новые экспериментальные возможности для изучения и понимания этого загадочного организма.
Введение
Treponema pallidum — это вид спиралевидных бактерий (называемых спирохетами), которые вызывают сифилис и связанные с ним инфекции у людей и других приматов. Сифилис является серьезным заболеванием с долгосрочными последствиями для инфицированных людей, и, по оценкам, ежегодно во всем мире происходит более 8 миллионов новых случаевсифилиса1. T. pallidum подразделяется на три подвида в зависимости от заболеваний, которые они вызывают у человека, а также незначительных генетических различий: подвид pallidum (вызывающий сифилис, передающийся половым путем), подвид pertenue (фрамбезия) и подвид endemicum (вызывающий беджель или эндемический сифилис)2,3. T. pallidum subsp. pertenue также вызывает инфекции у бабуинов, шимпанзе и других приматов. Близкородственный организм под названием Treponema paraluiscuniculi (также называемый Treponema paraluisleporidarum) вызывает инфекцию у кроликов и зайцев 4,5. Все эти бактерии очень тесно связаны, с более чем 98% идентичности последовательности ДНК на уровне генома 6,7,8. Каждый из них имеет одну маленькую кольцевую хромосому размером около 1,14 миллиона пар оснований (Mb). Члены этой группы T. pallidum встречаются только в связи со своими хозяевами-млекопитающими; Таким образом, они являются облигатными патогенами, выживание и рост которых зависят от вида хозяина 9,10.
Попытки культивирования T. pallidum in vitro начались вскоре после его идентификации Шаудином и Хоффманом в 1905 году. Однако эти усилия не привели к последовательному, воспроизводимому росту организма. В результате, научные исследования T. pallidum потребовали размножения организма через экспериментальное заражение лабораторных животных, чаще всего кроликов13,14. В 1981 году Fieldsteel et al.15 представили систему культивирования тканей, которая способствовала размножению штаммов T. pallidum в течение периода до 2 недель. Эта система включала совместное культивирование T. pallidum с эпителиальными клетками кролика Sf1Ep в модифицированной питательной среде для тканей (T. pallidum Culture Medium 1, TpCM-1) на основе Eagle's Minimum Essential Medium (MEM) и 20% фетальной бычьей сыворотки (FBS). Другими требуемыми условиями культивирования были инкубация при 34 °С в атмосфере, содержащей 1,5%О2 и 5%СО2 9,16. В этой системе T. pallidum прикрепляется к клеткам Sf1Ep и размножается при тесной связи с поверхностью клеток млекопитающих. Несмотря на многочисленные попытки субкультуры и другие модификации, система Fieldsteel et al. не смогла обеспечить непрерывный рост in vitro.
В 2018 году наша лаборатория сообщила, что использование модифицированной среды под названием TpCM-2 (в которой MEM Eagle был заменен на более сложную среду для культуры тканей, CMRL 1066) обеспечило T. pallidum необходимыми питательными веществами для обеспечения стабильного долгосрочного культивирования17. На сегодняшний день эта модификация привела к последовательной, непрерывной культуре, по крайней мере, 5 штаммов T. pallidum subsp. pallidum (Nichols, SS14, Mexico A, UW231B и UW249B) и одного штамма T. pallidum subsp. endemicum (Босния А)18,19. Например, штамм Николса в настоящее время непрерывно культивируется in vitro в течение более 6 лет. До сих пор попытки культивирования изолятов фрамбезии (T. pallidum subsp. pertenue) или T. paraluiscuniculiin vitro не увенчались успехом18. Система TpCM-2 по-прежнему требует наличия клеток Sf1Ep, низких концентраций кислорода и инкубации при 34 °C, что делает систему более сложной, чем большинство методов культивирования бактерий. Тем не менее, данная модифицированная система культивирования T. pallidum оказалась полезной для дальнейшего определения потребностей бактерии в росте18, определения минимальных ингибирующих концентраций (МИК) антимикробных соединений и пептидов 20,21,22,23,24,25, размножения новых штаммов из аспиратов тканей пациента26, выделения клональных популяций бактерий организм27, характеризующий систему антигенной вариации tprK 27,28, изучающий экспрессию генов29 и выполняющий мутационный анализ 30,31,32.
В этой статье мы опишем современные методы культивирования T. pallidum in vitro. Мы надеемся, что эта информация поможет способствовать более широкому применению этого метода культивирования in vitro для улучшения диагностики, лечения и профилактики сифилиса и связанных с ним трепонемных инфекций.
протокол
ПРИМЕЧАНИЕ: Все этапы требуют использования асептической техники и стерильных материалов и реагентов. Использование ламинарного проточного колпака для тканевых культур рекомендуется для снижения как а) контакта персонала с инфекционным материалом, так и б) возможности микробного загрязнения культур.
1. Создание фондов элементов Sf1Ep
ПРИМЕЧАНИЕ: Эпителиальные клетки кролика Sf1Ep могут быть приобретены в виде замороженных запасов из Американской коллекции типовых культур (см. Таблицу материалов). Медленный рост и низкая скорость метаболизма клеток Sf1Ep, по-видимому, являются ключом к их способности поддерживать долгосрочное выживание и рост T. pallidum33; Поэтому замена другими культурами клеток млекопитающих не рекомендуется. Клетки Sf1Ep не являются иммортализованной клеточной линией и могут поддерживаться только в течение 25-30 пассажей в культуре. Поэтому важно поддерживать замороженный запас низкопроходящих элементов Sf1Ep для использования в будущем. Иммортализированные линии Sf1Ep иногда возникают во время длительного культивирования клеток Sf1Ep. (неопубликованные наблюдения). Эти линии часто растут быстрее и с ними легче справиться; однако иногда они теряют способность поддерживать рост T. pallidum . Увековеченные линии Sf1Ep могут быть использованы, а затем заменены, когда спирохеты начнут медленно расти.
- Приготовьте клеточную среду Sf1Ep и прогрейте ее в инкубаторе с температурой 37 °C и 5%CO2 .
ПРИМЕЧАНИЕ: Клеточная среда Sf1Ep состоит из MEM Eagle с добавлением 10% FBS, 1x заменимых аминокислот MEM, 2 mM L-глутамина и 1 mM пирувата натрия. (см. Таблицу материалов). Среда должна быть стерилизована фильтром и может храниться при температуре 4 °C до 2 месяцев. Антибиотики (такие как пенициллин и стрептомицин) не следует использовать в клеточной среде Sf1Ep, поскольку перенос даже следовых количеств антибиотиков будет препятствовать росту T. pallidum. - Быстро разморозьте замороженный бульон Sf1Ep при температуре 37 °C. Протрите флакон снаружи 70% этанолом.
- Добавьте 1 мл клеточной среды Sf1Ep в криовиальную среду и аккуратно перемешайте. Добавьте смесь среды/клеточного материала в стерильную коническую центрифужную пробирку объемом 15 мл, содержащую 5 мл клеточной среды Sf1Ep, и аккуратно перемешайте.
- Гранулируйте клетки центрифугированием при 100 x g в течение 7 минут. Удалите и выбросьте надосадочную жидкость, стараясь не потревожить клеточную гранулу.
- Аккуратно ресуспендируйте размороженные клетки Sf1Ep в 15 мл свежей клеточной среды Sf1Ep и перенесите их в колбу для культуры тканей T75.
ПРИМЕЧАНИЕ: Восстановление только что размороженных ячеек Sf1Ep улучшается путем центрифугирования для удаления ДМСО, используемого для замораживания клеток. Однако этапы 1.4-1.7 могут быть опущены, и размороженные клетки из стадии 3 могут быть непосредственно засеяны в колбу для культуры тканей T75, содержащую 14 мл клеточной среды Sf1Ep. После ночной инкубации замените половину среды свежей средой Sf1Ep, чтобы разбавить остаточный ДМСО. - Инкубируйте культуры Sf1Ep в стандартном инкубаторе для культур увлажненных тканей при 37 °C, 5%CO2. Ослабьте крышки невентилируемых колб для культуры тканей, чтобы поддерживать надлежащий средний pH.
2. Пропускание ячеек Sf1Ep
ПРИМЕЧАНИЕ: Рост клеточной культуры Sf1Ep контролируется с помощью инвертированного микроскопа с использованием фазово-контрастной оптики. Как правило, клеткам требуется около одной недели, чтобы достичь почти полного слияния. Когда клетки достигают ~90% конфлюенции, их можно пропускать, использовать для культивирования T. pallidum или приготовления замороженных запасов. Срок жизни культуры может быть продлен до двух недель путем замены половины питательной среды после одной недели культивирования.
- Отсадите и выбросьте питательную среду Sf1Ep из колбы. Промойте клеточный слой 5 мл стерильного PBS при комнатной температуре (RT), а затем отсадите и выбросьте промывку PBS.
- Добавьте в колбу 2,5 мл трипсина-ЭДТА и закройте крышку. Покачивайте колбу вперед и назад, чтобы покрыть слой клеток трипсином-ЭДТА, и инкубируйте колбу при температуре 37 °C в течение 5 минут.
- Осторожно постучите по колбе, чтобы выбить ячейки. Наблюдайте под перевернутым микроскопом, чтобы подтвердить дисперсию клеток Sf1Ep.
- Добавьте 5 мл питательной среды Sf1Ep и раскачайте колбу, чтобы смешать с трипсином-ЭДТА и остановить действие трипсина. Извлеките взвешенные клетки Sf1Ep в стерильную коническую трубку.
- Количественное определение клеток с помощью гемоцитометра или автоматического счетчика клеток.
- Для поддержания рабочего клеточного запаса необходимо перенести аликвоту (0,5-1,0 мл или ~8 x 105 клеток) смеси среда/трипсин-ЭДТА/клетки в новую колбу для культуры тканей T75, содержащую 15 мл свежей среды Sf1Ep.
- Для культуры T. pallidum клетки разводят в среде Sf1Ep до 0,25-0,5 x 105 клеток/мл и затравливают в соответствующие культуральные сосуды (табл. 1).
- Чтобы заморозить клетки Sf1Ep, вращайте в настольной центрифуге при 100 x g в течение 7 минут. Осторожно удалите надосадочную жидкость, не потревожив клеточную гранулу. Ресуспендируйте клеточную таблетку в среде Sf1Ep с добавлением 10% тканевой культуры ДМСО.
- Распределите по 1 мл клеточной суспензии на каждый криовиал и заморозьте на ночь при температуре от -70 °C до -80 °C в изолированном контейнере (например, держателе для пробирок из пенополистирола) для улучшения сохранения жизнеспособности перед переносом флаконов в криогенный сосуд с жидким азотом.
3. Выращивание T. pallidum
ВНИМАНИЕ: Все подвиды и штаммы T. pallidum являются патогенными для человека и классифицируются как патогены уровня биобезопасности 2 (BSL-2)34. Необходимы соответствующие меры для защиты персонала; к ним относятся использование перчаток и других средств индивидуальной защиты (СИЗ), а также дезинфекция поверхностей, материалов и жидкостей, потенциально подверженных воздействию T. pallidum. T. pallidum легко инактивируется при воздействии 70% этанола или коммерчески доступных дезинфицирующих средств. Рекомендуется последовательное использование ламинарных колпаков для работы с образцами, содержащими T. pallidum .
Примечание: T. pallidum является микроаэрофильным организмом, который может быть убит при воздействии атмосферного уровня кислорода 9,16,35. Поэтому рекомендуется по возможности ограничивать время работы с T. pallidum на воздухе менее чем за час. Кроме того, среда TpCM-2 должна быть предварительно уравновешена в 1,5%O2, 5%CO2, балансN2, а энергичное перемешивание (например, использование вихря) должно быть ограничено. Поскольку культура T. pallidum обычно проводится в отсутствие антибиотиков, необходима дополнительная осторожность, чтобы избежать заражения бактериями или грибами. Процедура культивирования T. pallidum с помощью Sf1Ep-TpCM-2 кратко изложена на рисунке 1 и включает в себя несколько этапов, включая засеивание культуральных сосудов клетками Sf1Ep, приготовление среды TpCM-2 и инокуляцию культур T. pallidum. Инактивированная при нагревании фетальная бычья сыворотка (FBS) является критически важным компонентом среды, и ее эффективность варьируется у разных поставщиков и партий19. Необходим предварительный скрининг партий FBS на эффективность.
- Выберите подходящий размер культуры.
ПРИМЕЧАНИЕ: Культуру T. pallidum можно масштабировать от больших форматов (таких как 75-сантиметровые2 колбы, дающие ~1 x 109T. pallidum на культуру) до 96-луночных планшетов (пригодных для экспериментов по клонированию)17,18,19,27.- При корректировке размера культуры учитывайте количество инокулированных клеток Sf1Ep и T. pallidum на одну культуру, а также количество необходимой среды, как показано в таблице 1. Используйте колбы с вентилируемыми крышками, так как они обеспечивают свободную циркуляцию газов с меньшими потерями объема из-за испарения.
- Используйте формат 6-луночных планшетов для исходных культур, потому что удобно включать тройные репликации и дополнительные лунки на случай микробного загрязнения.
- Высевайте клетки Sf1Ep за 1-2 дня до эксперимента.
- Приготовьте суспензию клеток Sf1Ep путем трипсинизации исходных культур, как описано в шаге 2.7.
- Определяют концентрацию клеток Sf1Ep в суспензии с помощью гемацитометра или автоматизированного счетчика клеток.
- Добавьте соответствующее количество клеток Sf1Ep и среду Sf1Ep (Таблица 1) к каждой культуре. Инкубируйте культуры при 37 °C в стандартном инкубаторе для культур тканей с 5%CO2 до использования.
- Приготовьте TpCM-2 за 1 день до эксперимента.
ПРИМЕЧАНИЕ: TpCM-2 можно готовить и хранить при температуре -20 °C в течение нескольких месяцев. Среду следует разморозить и сбалансировать в инкубаторе с низким содержанием кислорода за день до эксперимента.- Получать стерильные растворы компонентов TpCM-2 (табл. 2) в промышленных масштабах или готовить их из сухих реагентов и фильтровать-стерилизовать. Хранить растворы при температуре 4 °C до 2 месяцев. Отрегулируйте pH буфера MOPS до 7,5 перед стерилизацией фильтра; в противном случае компоненты или конечный TpCM-2 не нуждаются в регулировке pH.
ПРИМЕЧАНИЕ: Для приготовления компонентов среды рекомендуется использовать стерильную дистиллированную воду для тканевых культур. - Соедините реагенты, перечисленные в таблице 2 , в стерильную емкость, добавив дитиотреитол (ДТТ) в качестве сухого порошка в последнюю очередь (чтобы свести к минимуму его окисление). Увеличьте (или уменьшите) количество каждого компонента, чтобы получить необходимое количество TpCM-2. Аккуратно перемешайте и отфильтруйте и стерилизуйте среду с помощью фильтрующего устройства 0,22 мкм.
- Ослабьте крышку колбы, содержащей TpCM-2. Предварительно уравновесьте среду, поместив ее в анаэробную (пивоваренную) банку, вакуумировав и повторно наполнив газовой смесью 95% N2, 5% CO2 три раза, а затем наполнив 1,5% O2, 5% CO2, уравновесив газовую смесь N2 после окончательной откачки. Пример системы для осуществления этого процесса газообмена изображен на рисунке 2.
- Быстро переведите среду в трехгазовый инкубатор, настроенный на обеспечение 1,5%O2, 5%CO2 и балансировку атмосферы N2 при 34 °C. В качестве альтернативы анаэробная банка, содержащая среду, может быть запечатана после газообмена, описанного в 3.3.3, и перенесена в стандартный инкубатор.
- Получать стерильные растворы компонентов TpCM-2 (табл. 2) в промышленных масштабах или готовить их из сухих реагентов и фильтровать-стерилизовать. Хранить растворы при температуре 4 °C до 2 месяцев. Отрегулируйте pH буфера MOPS до 7,5 перед стерилизацией фильтра; в противном случае компоненты или конечный TpCM-2 не нуждаются в регулировке pH.
- Утром в день эксперимента проверьте культуры Sf1Ep с помощью инвертированного микроскопа. Убедитесь, что клетки прикреплены и сливаются на 5%-10%. Асептически удалите среду.
- Кратковременно промойте лунки небольшим объемом (от 0,2 мл до 2 мл, в зависимости от размера сосуда) предварительно уравновешенного TpCM-2, удалите промывку и добавьте соответствующее количество TpCM-2 (Таблица 1). Уравновесьте пластины в 1,5%O2, 5%CO2 и сбалансируйте атмосферуN2 при 34 °C в течение 3-4 часов, как описано ранее.
- Переложите планшеты в ламинарный проточный колпак и инокулируйте соответствующим количеством (табл. 1) T. pallidum из замороженных запасов или трипсинизированными препаратами из свежесобранных культур (как описано ниже). Также может быть использован свежеприготовленный или замороженный поголовье, собранный асептическим способом от инфицированных кроликов13. Восстановите равновесие в планшетах, как описано в 3.3.3, и инкубируйте культуры при 1,5%O2, 5%CO2 и сбалансируйте атмосферуN2 при 34°C.
4. Уборка и перевалка культур T. pallidum
Примечание: Поскольку большая часть T. pallidum в культуре прикреплена к поверхности клеток Sf1Ep, необходимо отделить трепонемы от клеток млекопитающих, чтобы извлечь их и получить точный подсчет организмов. Такой «сбор урожая» и переход к свежим культурам обычно осуществляется на 7-й день культуры. Описанная здесь процедура предназначена для 6-луночных планшетов; количество используемого раствора трипсин-ЭДТА корректируют в большую или меньшую сторону в зависимости от размера формата культуры 17,19,27.
- В момент сбора урожая извлеките культуры из инкубатора. Исследуйте клеточный слой Sf1Ep в каждой лунке с помощью инвертированного фазово-контрастного микроскопа и запишите плотность клеток (например, 80% сливаемости) и внешний вид. Также обратите внимание на цвет TpCM-2; индикатор резазурина часто меняется с розового на желтый в результате более низкого pH.
- Пипетируйте среду из каждой лунки в стерильную коническую пробирку объемом 15 мл, используя отдельные пипетки для каждой лунки для предотвращения перекрестного загрязнения. Промойте каждую лунку 0,35 мл предварительно подогретого раствора Trypsin-EDTA, и добавьте ополаскиватель в среду.
- Добавьте еще 0,35 мл раствора Трипсин-ЭДТА в каждую лунку, и инкубируйте планшет в течение 5 мин в стандартном инкубаторе при температуре 37 °С; атмосфера с низким содержаниемО2 не требуется для этого короткого периода времени.
- Проверьте округление и отслоение клеток Sf1Ep, что также коррелирует с диссоциацией T. pallidum из клеток млекопитающих. Контролируйте этот процесс с помощью инвертированного микроскопа и при необходимости предоставьте дополнительное время или раствор Trypsin-EDTA. Процессу диссоциации способствует легкое постукивание по боковой стороне иммобилизованной пластины пластиковым штатиком для пробирок или аналогичным предметом.
- Пипеткой нанесите зарезервированную среду и промойте ее в лунке для извлечения диссоциированного T. pallidum и клеток. Запишите общий полученный объем для расчета урожайности на культуру.
- В большинстве экспериментов заданный объем собранного T. pallidum переносят в культуральные планшеты со свежими клетками Sf1Ep и TpCM-2. В таких случаях переносят около 1/20 части объема культуры (например, 200 мкл для культуры в 6-луночном планшете объемом 4 мл); Отрегулируйте этот объем в большую или меньшую сторону в зависимости от того, является ли штамм T. pallidum быстрорастущим или медленно растущим. Удалите клетки Sf1Ep из инокулюма центрифугированием при 100 x g в течение 5 минут, но этот шаг не является необходимым для рутинных переносов.
- Сразу после того, как планшеты для эксперимента будут инокулированы, замените атмосферу в пластинах с помощью процесса вакуумирования и дозаправки (шаг 3.3.3). Инкубируйте пластины при температуре 34 °C в банке для пивоварения или перенесите их в трехгазовый инкубатор.
- Подсчитайте T. pallidum с помощью темнопольной микроскопии с помощью счетной камеры Хелбера или аналогичного устройства, следуя инструкциям производителя.
ПРИМЕЧАНИЕ: Камера Хелбера представляет собой калиброванное стеклянное стекло и защитное стекло, которое значительно повышает точность и воспроизводимость подсчета бактерий; Камера легко дезинфицируется, очищается и высушивается с использованием 70% этанола и бумажных салфеток и может использоваться повторно в течение неограниченного времени. В идеале темнопольный микроскоп должен иметь 40-кратный объектив и 15-кратный окуляр. Проведите повторный подсчет для каждой культуры и запишите количество подвижных и неподвижных T. pallidum, а также любые морфологические изменения, которые должны быть зарегистрированы. Количественная ПЦР (кПЦР) также может быть использована в тех случаях, когда точное количественное определение и определение подвижности не требуется17,24. - В экспериментах, в которых лечение трипсином может быть нежелательным (например, при изучении содержания белка T. pallidum), используют среду диссоциации ЭДТА для диссоциации T. pallidum и монослоя клетки17,19.
ПРИМЕЧАНИЕ: Диссоциационная среда состоит из FBS, который был диализован против фосфатно-солевого буфера (PBS) или основного солевого раствора Эрла (EBSS) без хлорида кальция и хлорида магния для удаления двухвалентных катионов в упрощенной среде для культивирования T. pallidum (Таблица 2). Эта процедура может занять более длительный период времени (до 30 минут) или повторное лечение для полной диссоциации.
5. Замораживание и хранение культур T. pallidum
Примечание: T. pallidum можно хранить неограниченное время при температуре -70 °C или ниже, при этом жизнеспособность после размораживания обычно составляет 50%-90%.
- Замораживают культуры T. pallidum при сборе урожая с добавлением 10% (v/v) глицерина. Диспергируйте глицерин по всему препарату с помощью осторожного пипетирования или инверсии. Затем распределите препарат по 1-2 мл аликвот по флаконам с завинчивающимися крышками морозильной камеры и сразу же поместите флаконы в морозильную камеру с температурой -80 °C или жидкую морозильную камеру N2 .
- Чтобы начать выращивание культуры T. pallidum из замороженного сырья, сначала подготовьте соответствующий культуральный сосуд (сосуды), содержащий клетки Sf1Ep и TpCM-2, как описано в разделе 3. Быстро разморозьте флакон, содержащий замороженный бульон T. pallidum ; в этом отношении полезно осторожное использование водяной бани с температурой 37 °C или нагревательного блока.
- Затем переложите размороженный препарат в сосуд (сосуды) для культивирования. Убедитесь, что соотношение объема замороженного сырья к среде Tp-CM2 составляет 1:5 или выше, чтобы обеспечить достаточное разбавление глицерина для обеспечения выживания и роста T. pallidum.
- Инкубируйте культуру в микроаэробных условиях в течение 7 дней и переведите на свежие культуры, как описано в разделе 4.
6. Получение изогенных клонов T. pallidum
Примечание: Эта процедура подробно описана в предыдущем исследовании27.
- В типичном эксперименте подготавливают и предварительно уравновешивают два 96-луночных планшета с 1000 ячейками Sf1Ep и 200 мкл TpCM-2 на лунку, как описано в разделе 3.
ПРИМЕЧАНИЕ: Многоканальная пипетка объемом 200 мкл и совместимые стерильные одноразовые резервуары для реагентов значительно упрощают этапы инокуляции клеток Sf1Ep, обмена сред и инокуляции. - Количественно оцените концентрацию T. pallidum в свежесобранном препарате с помощью темнопольного микроскопа и камеры Хелбера (шаг 4.8). Разбавляют суспензию T. pallidum в TpCM-2 с получением двух препаратов с концентрациями 10 трепонем/мл и 40 трепонем/мл; 10 мл каждого препарата более чем достаточно для инокуляции одного 96-луночного планшета при каждом разведении. В качестве контроля приготовьте 1 мл другого разведения, содержащего 2 x 103 T. pallidum/мл.
- Используя либо стандартную одноканальную пипетку, либо многоканальную пипетку, инокулируйте 50 мкл на лунку препарата 10 Т. паллидум/мл в одну из подготовленных 96-луночных планшетов, исключая две контрольные лунки. Повторите этот процесс с препаратом 40 т. паллидума/мл и другой пластиной. В две контрольные лунки в каждой чашке введите 2 x 103 T. pallidum/мл раствора. В результате этого процесса будут получены планшеты с (в среднем) 0,5 или 2 T. pallidum на лунку, а также положительные контрольные лунки, содержащие 100 T. pallidum.
ПРИМЕЧАНИЕ: Эффективность осаждения T. pallidum в этих условиях низкая, поэтому даже лунки, засеянные ~2 организмами, могут дать клональные популяции. - Уравновесьте планшеты газовой смесью с низким содержаниемO2 (шаг 3.3.3) и инкубируйте их в пивоваренной банке или тригазовом инкубаторе при температуре 34 °C.
- Через 7 дней удалите по 100 мкл среды из каждой культурной лунки и замените ее 100 мкл свежего, уравновешенного TpCM-2. Проверьте жизнеспособность и рост T. pallidum в контрольных лунках с помощью темнопольной микроскопии и подсчета, чтобы убедиться, что условия культивирования способствуют размножению T. pallidum .
ПРИМЕЧАНИЕ: Обязательно используйте новый наконечник для дозатора для каждой лунки, чтобы предотвратить перекрестное загрязнение клональных культур. - Через 14 дней перенесите по 50 мкл надосадочной жидкости культуры из каждой лунки в свежие тарелки, приготовленные на шаге 6.1.
- Повторяйте чередование кормления и пассажа по мере необходимости на 21 и 28 день.
- Контролируйте присутствие T. pallidum в каждой лунке с помощью темнопольной микроскопии или количественной ПЦР26.
Примечание: В связи с медленным темпом роста T. pallidum и необходимой потерей организмов во время кормления и переноса, лунки, засеянные 0,5 или 2 T. pallidum , обычно не дают положительного результата ни одним из методов до 28-го дня или позже. - После того, как положительные скважины определены, трипсинизацию и перенос этих скважин на 24-луночные планшеты для дальнейшего расширения. Определение клональности по преобладанию одной последовательности tprK и наличию одиночных последовательностей в сайтах, которые являются неоднородными в родительском штамме27.
Результаты
Используя описанные условия, T. pallidum обычно сохраняет подвижность >90% и размножается логарифмически со временем удвоения от 33 до 45 часов в течение примерно 7 дней до перехода в неподвижную фазу (рис. 3). В течение 1 недели спирохеты претерпевают примерно 4-5 удвоений (рисунок 4). ). Кроме того, разные штаммы T. pallidum могут расти с разной скоростью. Штаммы T. pallidum группы SS14, как правило, имеют более медленное время удвоения, чем штаммы группы Николса17.
Кормление культур может продлить время культивирования на несколько дней, но клеточный слой Sf1Ep часто выходит из строя после недели культивирования. Кроме того, трепонемы достигают верхнего предела организмов примерно 5 x 107/мл. Культуры, перенесенные с интервалом в 7 дней, обычно продолжают логарифмическое размножение с небольшой фазой задержки или без нее. Организмы в стационарной фазе часто становятся труднопроходимыми.
Большинство T. pallidum прикреплены к клеткам Sf1Ep. Тем не менее, в надосадочной жидкости остается достаточное количество T. pallidum , что позволяет периодически удалять образцы среды для проверки жизнеспособности и размножения. Если требуется тщательное количественное определение, следует измерить объем удаленной среды, количественно определить количество T. pallidum и добавить общее количество удаленных организмов к окончательным подсчетам при сборе урожая.
В предыдущих исследованиях эффективность клонирования (количество положительных культур на один инокулированный организм) составляла 12,5% для 2 T. pallidum, инокулированных на лунку, и 6,7% для 0,5 T. pallidum, инокулированных на лунку27. Таким образом, вполне вероятно, что любая положительная скважина представляет собой рост одного организма в любой из этих инокуляций. Тем не менее, клональность полученных популяций должна быть проверена путем исследования культуры на предмет гомогенности на участках, которые неоднородны в родительской культуре. Наиболее точным способом демонстрации того, что культура является изогенной, является полногеномное секвенирование27.
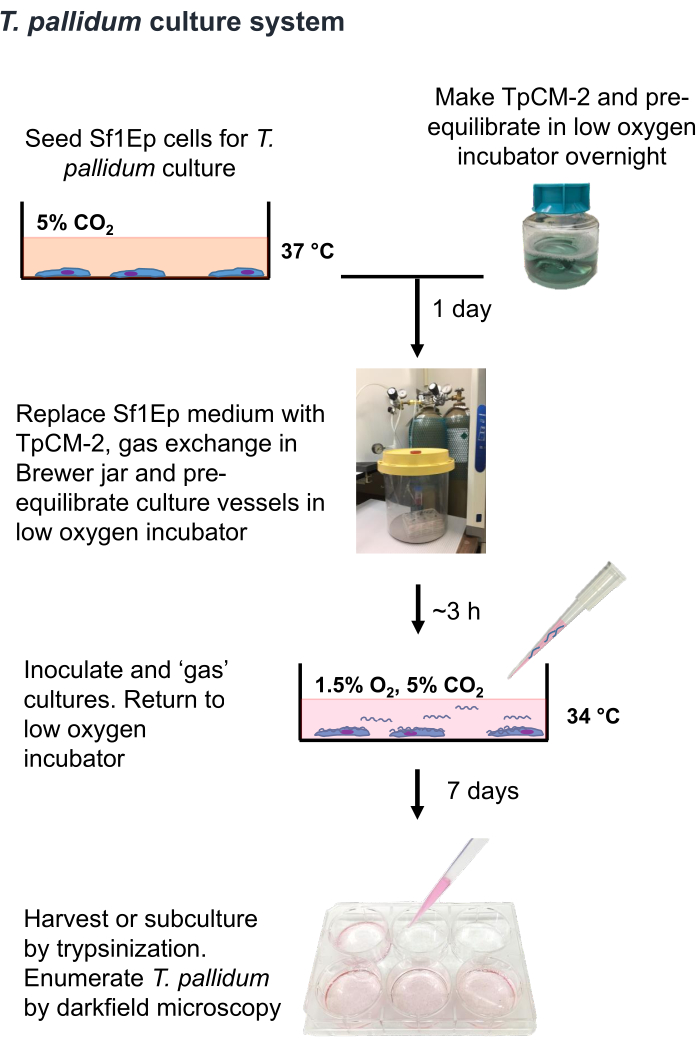
Рисунок 1: Технологическая схема процедуры культивирования T. pallidumin vitro . Этот рисунок был перепечатан с разрешения Эдмондсона и Норриса (2021)19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
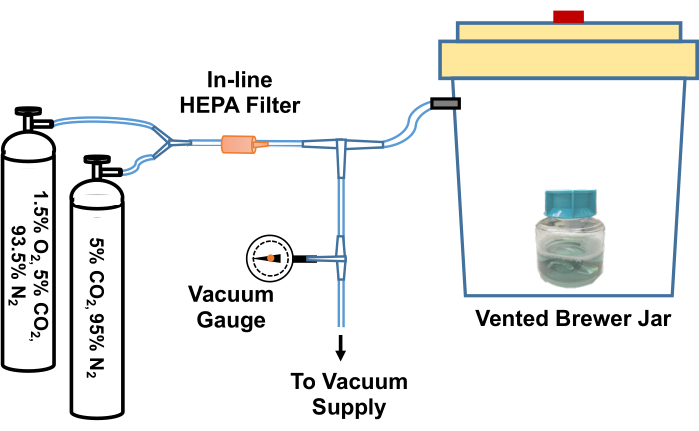
Рисунок 2: Схема системы для уравновешивания культуральных реагентов T. pallidum в среде с низким содержанием кислорода. Вентиляционное отверстие в банке Brewer подключается через Т-образное соединение к источнику вакуума (например, домашнему пылесосу) и к газовым баллонам, содержащим специальные газовые смеси (5% CO2, балансовый азот и 1,5%O2, 5% CO2, балансовый азот). Встроенный вакуумметр измеряет вакуум, набранный в банке. Вакуум втягивается в банку примерно до -58 кПа. Затем откачанный кувшин медленно заполняется газовыми смесями. Кувшин для пивоварения трижды наполняется 5%CO2, балансирует азот перед окончательной эвакуацией и снова наполняется 95% N2, 5% CO2, 1,5% O2. Затем культуры или среды извлекаются из банки и быстро переносятся в инкубатор с низким содержанием кислорода. В качестве альтернативы трубка между кувшином Brewer и первым Т-образным соединением может быть плотно зажата, трубка отсоединена от Т-образного соединения, и вся банка Brewer может быть перенесена в инкубатор с температурой 34 °C. Этот рисунок был перепечатан с разрешения Эдмондсона и Норриса (2021)19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 3: Кривые роста T. pallidum , культивируемого клетками Sf1Ep со средой TpCM-2. Параллельные тройные культуры были засеяны T. pallidum. Реплики собирались в каждый момент времени; результаты представляют собой среднее значение + SEM для этих культур. (А) Показаны изменения T . pallidum в каждой культуре и (В) процент подвижности. Этот рисунок был адаптирован с разрешения Edmondson et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 4: Пример пассажа культуры in vitro T . pallidum, штамма Николса. Параллельные тройные культуры засеивали T. pallidum и еженедельно пропускали в разведении 1:20. Пилообразный график показывает количество T. pallidum в каждой культуре и количество перенесенных в новые культуры в каждый момент времени. Результаты представляют собой среднее значение ± SEM для трех биологических репликатов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Средний объем и соотношения высева для культуральных сосудов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Среда для выращивания T. pallidum . После подготовки все среды должны быть стерилизованы фильтром. Среда Sf1Ep может храниться при температуре 4 °C до двух месяцев. TpCM-2 обычно изготавливается за день до использования. Среда диссоциации должна быть аликвотирована и заморожена. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Система Sf1Ep-TpCM-2 является первой доступной процедурой, которая способствует непрерывному культивированию T. pallidum in vitro. Система сложна из-за экстремальных потребностей этого организма в росте: 1) сложных потребностей в питании из-за ограниченных биосинтетических возможностей; 2) плохо изученная потребность в малых количествах кислорода, несмотря на высокую чувствительность к активным формам кислорода 9,10,16,36; и 3) текущей потребности в наличии клеток Sf1Ep. Несмотря на то, что существует соблазн «срезать углы» на этой процедуре, рекомендуется тщательно следовать шагам до тех пор, пока не будет достигнута успешная долгосрочная культура, прежде чем пытаться внести изменения. По мере накопления дополнительной информации о метаболических потребностях T. pallidum может стать возможным развитие аксенических состояний, не требующих присутствия клеток Sf1Ep. Тем не менее, темпы роста in vitro, вероятно, останутся медленными (с минимальным временем удвоения от 33 до 46 часов, в зависимости от штамма)17,18, учитывая, что T. pallidum размножается с расчетным временем удвоения от 30 до 33 часов даже во время инфекции млекопитающих37,38. Как и в случае с любой бактериальной культурой, рекомендуется поддерживать низкий уровень пассажа и проводить эксперименты с культурами T. pallidum, которые находятся менее чем в 10 пассажах от этих культур, чтобы избежать «генетического дрейфа» и связанных с ним фенотипических изменений из-за мутаций.
Клетки Sf1Ep, по-видимому, обеспечивают трепонему необходимыми питательными веществами или ферментативной активностью. Тем не менее, они также потребляют питательные вещества (такие как глюкоза и кислород) и могут вызывать токсичные условия, такие как низкий pH 9,16,39. Таким образом, существует баланс между наличием достаточного количества клеток Sf1Ep для поддержания размножения T. pallidum и предотвращением чрезмерного роста и токсичности клеток млекопитающих. Большое число пассажей клеток Sf1Ep, как правило, растет быстрее и иногда теряет способность поддерживать размножение T. pallidum. Таким образом, следует контролировать проходимость Sf1Ep, а запасы клеток следует периодически заменять замороженными препаратами с низким проходимостью. Присутствие клеток Sf1Ep также усложняет изучение свойств T. pallidum, таких как содержание ДНК, РНК и белка, а также активность ферментов. Удаление кроличьих клеток возможно в некоторой степени с помощью многократного низкоскоростного центрифугирования (100 x g в течение 5 мин) или более эффективно с помощью градиентов Percoll или Hypaque40,41. Тем не менее, методы градиентного центрифугирования, как правило, эффективны только при большом количестве T. pallidum. Альтернативные методы размножения T. pallidum ограничены инфекцией лабораторных животных, таких как кролики 13,14. Этот подход имеет этические соображения и становится все более дорогостоящим; тем не менее, модель кролика очень полезна для изучения патогенеза T. pallidum и иммунных реакций хозяина. Кроме того, вероятно, существуют некоторые различия в экспрессии генов, росте или поведении T. pallidum во время культивирования in vitro и заражения кроликов.
На момент написания настоящего доклада система Sf1Ep-TpCM-2 была создана по меньшей мере в 6 исследовательских группах в Соединенных Штатах и Европе, что привело к 16 публикациям по различным темам, начиная от фундаментальной биологии и генетики T. pallidum и заканчивая чувствительностью к противомикробным препаратам. Ценность культуры in vitro в изучении этого загадочного патогена, вероятно, возрастет с расширением использования и будущими улучшениями.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана грантом R01 AI141958 от Национальных институтов здравоохранения США/NIAID. Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
Ссылки
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены