Method Article
Treponema pallidum, Syphilis Spirochete의 시험관 내 배양 절차
요약
이 프로토콜은 포유류 세포와 공동 배양하는 매독 병원균 Treponema pallidum subsp. pallidum의 시험관 내 배양을 설명합니다. 이 방법은 확장 가능합니다. T. pallidum을 대량으로 생산하고 클론 배양을 생성하는 데 사용할 수 있습니다.
초록
100년이 넘는 기간 동안, 매독을 일으키는 나선형 모양의 박테리아인 Treponema pallidum subsp. pallidum은 토끼 고환에서 유기체를 접종하고 채취해야만 번식할 수 있었습니다. 2018년에는 T. pallidumin vitro를 지속적으로 배양하는 방법을 설명했습니다. 이 시스템은 TpCM-2라는 혈청 함유 조직 배양 배지에서 토끼 상피 세포(Sf1Ep 세포)와 공동 배양을 활용합니다. 배양 시 T. pallidum 배증 시간은 자연 감염 중(약 33-45시간) 발생하는 것으로 추정되는 시간과 유사합니다. 유기체는 34°C의 저산소(1.5%) 환경에서 1주일의 표준 통과 시간으로 지속적으로 배양할 수 있습니다. 이 논문에는 T. pallidum을 배양하기 위한 프로토콜, 필요한 조직 배양 세포를 성장시키고 유지하는 방법, 희석을 제한하여 동종 균주를 생성하는 기술이 포함되어 있습니다. T. pallidum을 체외에서 성장시킬 수 있는 능력은 이 수수께끼 같은 유기체를 연구하고 이해할 수 있는 새로운 실험 방법을 제공합니다.
서문
Treponema pallidum은 인간과 다른 영장류에서 매독 및 관련 감염을 일으키는 나선형 박테리아(spirochetes라고 함)의 일종입니다. 매독은 감염된 개인에게 장기적인 영향을 미치는 심각한 질병이며, 매년 전 세계적으로 800만 명 이상의 새로운 매독 사례가 발생하는 것으로 추정됩니다1. T. pallidum은 인간에게 유발하는 질병과 사소한 유전적 차이에 따라 세 가지 아종으로 세분되었습니다: 아종 pallidum(성병 매독을 유발), 아종 pertenue(yaws) 및 아종 endemicum(베젤 또는 풍토성 매독을 유발)2,3. T. pallidum subsp. pertenue는 또한 개코원숭이, 침팬지 및 기타 영장류에서 감염을 일으킵니다. Treponema paraluiscuniculi (Treponema paraluisleporidarum이라고도 함)라는 밀접하게 관련된 유기체는 토끼와 토끼에서 감염을 일으킵니다 4,5. 이 모든 박테리아는 매우 밀접하게 관련되어 있으며 게놈 수준 6,7,8에서 98% 이상의 DNA 서열 식별성을 가지고 있습니다. 그들은 각각 약 114만 염기쌍(Mb) 크기의 작은 단일 원형 염색체를 가지고 있습니다. 이 T. pallidum 그룹의 구성원들은 그들의 포유류 숙주와만 연관되어 발견된다; 따라서 그들은 생존과 성장을 위해 숙주 종에 의존하는 의무 병원체입니다 9,10.
T. pallidum을 시험관에서 배양하려는 시도는 1905년 Schaudinn과 Hoffman에 의해 확인된 직후시작되었다 11,12. 그러나 이러한 노력은 유기체의 일관되고 재현 가능한 성장으로 이어지지 못했습니다. 결과적으로, T. pallidum 연구 연구는 실험실 동물, 가장 일반적으로 토끼13,14의 실험적 감염을 통한 유기체의 번식을 필요로했습니다. 1981년, Fieldsteel 등[15]은 최대 2주 동안 T. pallidum 균주의 증식을 촉진하는 조직 배양 시스템을 도입했습니다. 이 시스템은 Eagle's Minimum Essential Medium(MEM) 및 20% 소 태아 혈청(FBS)을 기반으로 하는 변형 조직 배양 배지(T. pallidum Culture Medium 1, TpCM-1)에서 T. pallidum과 Sf1Ep 솜꼬리 토끼 상피 세포의 공동 배양을 포함했습니다. 필요한 다른 배양 조건은 1.5 % O2 및 5 % CO2 를 함유하는 분위기에서 34 ° C에서 배양하는 것이었다 9,16. 이 시스템에서 T. pallidum은 Sf1Ep 세포에 부착하고 포유류 세포 표면과 밀접하게 결합할 때 증식합니다. 많은 하위 배양 시도 및 기타 수정에도 불구하고 Fieldsteel et al. 시스템은 지속적인 체외 성장을 촉진하지 못했습니다.
2018년에 우리 실험실은 TpCM-2(Eagle의 MEM이 더 복잡한 조직 배양 배지인 CMRL 1066으로 대체됨)라는 변형된 배지를 사용하여 T. pallidum에 일관된 장기 배양을 허용하는 데 필요한 영양소를 제공한다고 보고했습니다17. 현재까지 이러한 변형은 T. pallidum subsp. pallidum (Nichols, SS14, Mexico A, UW231B 및 UW249B)의 최소 5 개 균주와 T. pallidum subsp. endemicum (Bosnia A) 18,19 균주의 일관되고 지속적인 배양으로 이어졌습니다. 예를 들어, 니콜스 균주는 현재 6년 이상 시험관내에서 지속적으로 배양되고 있습니다. 지금까지 분리된 요(yaws isolates, T. pallidum subsp. pertenue) 또는 T. paraluiscuniculiin vitro를 배양하려는 시도는 성공하지 못했다18. TpCM-2 시스템은 여전히 Sf1Ep 세포의 존재, 낮은 산소 농도 및 34°C에서의 배양을 필요로 하므로 대부분의 박테리아 배양 기술보다 시스템을 더 복잡하게 만듭니다. 그러나, 이 수정된 T. pallidum 배양 시스템은 박테리아의 성장 요구 사항(18)을 추가로 정의하고, 항균 화합물 및 펩티드 20,21,22,23,24,25의 최소 억제 농도(MIC)를 결정하고, 환자 조직 흡인(26)으로부터 새로운 균주를 증식하고, 클론 개체군을 분리하는 데 유용했다. 유기체27, tprK 항원 변이 시스템27,28의 특성화, 유전자 발현검사 29 및 돌연변이 분석수행 30,31,32.
여기에서는 T. pallidum을 시험관에서 배양하는 현재 방법을 설명합니다. 우리는 이 정보가 매독 및 관련 트레포네말 감염의 개선된 진단, 치료 및 예방에 이 체외 배양 기술의 보다 광범위한 적용을 촉진하는 데 도움이 되기를 바랍니다.
프로토콜
알림: 모든 단계에는 무균 기술과 멸균 재료 및 시약을 사용해야 합니다. 조직 배양 층류 후드의 활용은 a) 감염 물질에 대한 직원의 노출과 b) 배양의 미생물 오염 가능성을 줄이기 위해 권장됩니다.
1. Sf1Ep 세포 원료 설정
참고: Sf1Ep 솜꼬리 토끼 상피 세포는 American Type Culture Collection에서 냉동 재고로 구입할 수 있습니다( 재료 표 참조). Sf1Ep 세포의 느린 성장 특성과 낮은 대사율은 T. pallidum33의 장기 생존 및 성장을 지원하는 능력의 핵심인 것으로 보입니다. 따라서 다른 포유류 세포 배양으로 대체하는 것은 권장되지 않습니다. Sf1Ep 세포는 불멸화된 세포주가 아니며 배양 과정에서 25-30 passage 동안만 유지될 수 있습니다. 따라서 향후 사용을 위해 저통로 Sf1Ep 셀의 냉동 재고를 유지하는 것이 중요합니다. 불멸화된 Sf1Ep 라인은 Sf1Ep 세포의 장기 배양 중에 때때로 발생합니다. (발표되지 않은 관찰). 이러한 선은 종종 더 빨리 커지고 다루기 쉽습니다. 그러나 때로는 T. pallidum 성장을 지원하는 능력을 잃습니다. 불멸의 Sf1Ep 라인은 사용한 다음 spirochetes가 천천히 자라기 시작할 때 교체 할 수 있습니다.
- Sf1Ep 세포 배지를 준비하고 37°C, 5%CO2 인큐베이터에서 예열합니다.
참고: Sf1Ep 세포 배지는 10% FBS, 1x MEM 비필수 아미노산, 2mM L-글루타민 및 1mM 피루브산 나트륨이 보충된 Eagle's MEM으로 구성됩니다. ( 재료 표 참조). 매체는 필터 멸균해야 하며 4°C에서 최대 2개월 동안 보관할 수 있습니다. 항생제(예: 페니실린 및 스트렙토마이신)는 미량의 항생제 이월이 T. pallidum의 성장을 방해하기 때문에 Sf1Ep 세포 배지에 사용해서는 안 됩니다. - 얼린 Sf1Ep 스톡을 37°C에서 빠르게 해동합니다. 70% 에탄올로 바이알 외부를 닦습니다.
- Sf1Ep 세포 배지 1mL를 cryovial에 넣고 부드럽게 혼합합니다. 배지/세포 스톡 혼합물을 5mL의 Sf1Ep 세포 배지가 들어 있는 멸균 15mL 코니컬 원심분리 튜브에 넣고 부드럽게 혼합합니다.
- 100 x g 에서 7분 동안 원심분리하여 세포를 펠렛화합니다. 세포 펠릿을 방해하지 않도록 주의하면서 상층액을 제거하고 버리십시오.
- 해동된 Sf1Ep 세포를 15mL의 신선한 Sf1Ep 세포 배지에 부드럽게 재현탁시키고 T75 조직 배양 플라스크에 옮깁니다.
참고: 새로 해동된 Sf1Ep 세포의 회수는 세포를 동결하는 데 사용되는 DMSO를 제거하기 위한 원심분리를 통해 개선됩니다. 그러나 1.4-1.7단계를 생략할 수 있으며 3단계에서 해동된 세포를 14mL의 Sf1Ep 세포 배지를 포함하는 T75 조직 배양 플라스크에 직접 파종할 수 있습니다. 하룻밤 배양 후 배지의 1/2을 새로운 Sf1Ep 배지로 교체하여 잔류 DMSO를 희석합니다. - Sf1Ep 배양액을 37°C, 5%CO2의 표준 가습 조직 배양 인큐베이터에서 배양합니다. 적절한 배지 pH를 유지하기 위해 통풍되지 않는 조직 배양 플라스크의 캡을 풉니다.
2. Sf1Ep 세포 통과
참고: Sf1Ep 세포 배양 성장은 위상차 광학을 사용하여 도립 현미경으로 모니터링합니다. 일반적으로 세포가 거의 밀도에 도달하는 데 약 1주일이 걸립니다. 세포가 ~ 90 % 밀도에 도달하면 T. pallidum 배양 또는 냉동 스톡 준비에 사용되어 통과 될 수 있습니다. 배양 수명은 1주일 배양 후 배양 배지의 1/2을 교체하여 2주까지 연장할 수 있습니다.
- 플라스크에서 Sf1Ep 성장 배지를 흡입하고 버립니다. 실온(RT)에서 5mL의 멸균 PBS로 세포층을 헹구고 PBS 헹굼을 흡인하여 폐기합니다.
- 플라스크에 2.5mL의 트립신-EDTA를 넣고 캡을 밀봉합니다. 플라스크를 앞뒤로 흔들어 세포층을 트립신-EDTA로 덮고 플라스크를 37°C에서 5분 동안 배양합니다.
- 플라스크를 가볍게 두드려 세포를 제거합니다. Sf1Ep 세포의 분산을 확인하기 위해 도립 현미경으로 관찰합니다.
- 5mL의 Sf1Ep 성장 배지를 추가하고 플라스크를 흔들어 트립신-EDTA와 혼합하고 트립신의 작용을 멈춥니다. 부유 중인 Sf1Ep 세포를 멸균 원추형 튜브로 제거합니다.
- 혈구계 또는 자동 세포 카운터를 사용하여 세포를 정량화합니다.
- 작동하는 세포 스톡을 유지하려면 배지/트립신-EDTA/세포 혼합물의 부분 표본(0.5-1.0mL 또는 ~8 x 105 개 세포)을 15mL의 신선한 Sf1Ep 배지가 들어 있는 새로운 T75 조직 배양 플라스크에 옮깁니다.
- T. pallidum 배양의 경우 Sf1Ep 배지의 세포를 0.25-0.5 x 105 cells/mL로 희석하고 적절한 배양 용기에 파종합니다(표 1).
- Sf1Ep 세포를 동결하려면 탁상용 원심분리기에서 100 x g 으로 7분 동안 회전시킵니다. 세포 펠릿을 방해하지 않고 상층액을 조심스럽게 제거하십시오. 10% 조직 배양 등급 DMSO가 보충된 Sf1Ep 배지에 세포 펠릿을 재현탁시킵니다.
- 세포 현탁액 1mL를 각 극저온 용기에 분배하고 -70°C에서 -80°C의 절연 용기(예: 스티로폼 시험관 홀더)에서 밤새 얼려 생존력 유지력을 높인 후 바이알을 액체 질소 극저온 용기로 옮깁니다.
3. T. pallidum 재배
주의: 모든 T. pallidum 아종 및 균주는 인간에게 병원성이며 생물안전 레벨 2(BSL-2) 병원체34로 분류됩니다. 직원을 보호하기 위해 적절한 조치가 필요합니다. 여기에는 장갑 및 기타 개인 보호 장비(PPE)의 사용과 T. pallidum에 잠재적으로 노출될 수 있는 표면, 재료 및 액체의 소독이 포함됩니다. T. pallidum 은 70% 에탄올 또는 시판되는 소독제에 노출되면 쉽게 비활성화됩니다. T. pallidum 을 함유한 시편을 취급하기 위해 층류 후드를 일관되게 사용하는 것이 좋습니다.
알림: T. pallidum은 대기 수준의 산소 9,16,35에 몇 시간 동안 노출되면 죽을 수 있는 미세 호기성 유기체입니다. 따라서 T. pallidum의 공기 중 취급은 가능하면 한 시간 미만으로 제한하는 것이 좋습니다. 또한, TpCM-2 매체는 1.5%O2, 5%CO2, 밸런스N2로 사전 평형을 이루어야 하며, 격렬한 교반(예를 들어, 와류의 사용)은 제한되어야 한다. T. pallidum 배양은 일반적으로 항생제 없이 수행되기 때문에 박테리아나 곰팡이에 오염되지 않도록 각별한 주의가 필요합니다. T. pallidum을 배양하기 위한 Sf1Ep-TpCM-2 절차는 그림 1에 요약되어 있으며 Sf1Ep 세포가 있는 배양 용기의 파종, TpCM-2 배지의 준비 및 T. pallidum으로 배양물 접종을 포함한 여러 단계를 포함합니다. 열 비활성화 소 태아 혈청(FBS)은 중요한 배지 성분이며, 그 효능은 공급업체와 로트에 따라 다르다19. 효능을 위해 FBS 로트의 사전 스크리닝이 필요합니다.
- 적절한 문화권 크기를 선택합니다.
참고: T. pallidum 배양은 대형 형식(예: 배양물당 ~1 x 109T. pallidum을 산출하는 75cm2 플라스크)에서 96웰 플레이트(복제 실험에 적합)17,18,19,27까지 확장할 수 있습니다.- 배양 크기를 조정할 때는 표 1과 같이 배양당 접종된 Sf1Ep 세포 및 T. pallidum의 수와 필요한 배지의 양을 고려하십시오. 통풍 캡이 있는 플라스크를 사용하면 증발로 인한 부피 손실이 줄어들면서 가스가 자유롭게 순환할 수 있습니다.
- 미생물 오염이 발생할 경우 삼중 복제와 추가 웰을 포함하는 것이 편리하기 때문에 초기 배양에 6-웰 플레이트 형식을 사용합니다.
- 실험 1-2일 전에 Sf1Ep 세포를 파종합니다.
- 2.7단계에서 설명한 대로 스톡 배양의 트립신화에 의한 Sf1Ep 세포의 현탁액을 준비합니다.
- 혈량계 또는 자동 세포 카운터를 사용하여 현탁액의 Sf1Ep 세포 농도를 측정합니다.
- 각 배양액에 적절한 수의 Sf1Ep 세포와 Sf1Ep 배지(표 1)를 추가합니다. 사용할 때까지 5% CO2 가 있는 표준 조직 배양 인큐베이터에서 37°C에서 배양액을 배양합니다.
- 실험 1일 전에 TpCM-2를 준비합니다.
참고: TpCM-2는 -20°C에서 수개월 동안 준비하고 보관할 수 있습니다. 배지는 실험 전날 저산소 인큐베이터에서 해동하고 평형을 이루어야 합니다.- TpCM-2(표 2)의 구성 요소에 대한 멸균 용액을 상업적으로 얻거나 건조 시약에서 준비하고 필터 멸균합니다. 용액을 4°C에서 최대 2개월 동안 보관합니다. 필터 멸균 전에 MOPS 완충액의 pH를 7.5로 조정하십시오. 그렇지 않으면 성분 또는 최종 TpCM-2를 pH 조정할 필요가 없습니다.
참고: 매체 구성 요소의 준비를 위해 멸균 조직 배양 등급 증류수를 사용하는 것이 좋습니다. - 표 2에 나열된 시약을 멸균 용기에 넣고 디티오트레이톨(DTT)을 건조 분말 마지막(산화를 최소화하기 위해)으로 첨가합니다. 필요한 양의 TpCM-2를 준비하기 위해 각 구성 요소의 수량을 확장(또는 축소)합니다. 0.22μm 필터 장치를 사용하여 매체를 부드럽게 혼합하고 필터 멸균합니다.
- TpCM-2가 들어있는 플라스크의 뚜껑을 풉니다. 매체를 혐기성(브루어) 항아리에 넣고 95%N2, 5%CO2 가스 혼합물을 세 번 비우고 다시 채운 다음 1.5%O2, 5%CO2로 채우고 최종 배출 후N2 가스 혼합물의 균형을 맞춥니다. 이 가스 교환 공정을 수행하기 위한 시스템의 예가 그림 2에 나와 있습니다.
- 매체를 1.5 % O2, 5 % CO2 를 제공하고 34 ° C에서 N2 분위기의 균형을 이루도록 설정된 tri-gas incubator로 신속하게 옮깁니다. 대안적으로, 매체를 포함하는 혐기성 용기는 3.3.3에 설명된 가스 교환 후 밀봉하고 표준 인큐베이터로 옮길 수 있습니다.
- TpCM-2(표 2)의 구성 요소에 대한 멸균 용액을 상업적으로 얻거나 건조 시약에서 준비하고 필터 멸균합니다. 용액을 4°C에서 최대 2개월 동안 보관합니다. 필터 멸균 전에 MOPS 완충액의 pH를 7.5로 조정하십시오. 그렇지 않으면 성분 또는 최종 TpCM-2를 pH 조정할 필요가 없습니다.
- 실험 당일 아침에 도립 현미경을 사용하여 Sf1Ep 배양을 확인합니다. 셀이 연결되어 있고 5%-10%가 합류하는지 확인합니다. 매체를 무균으로 제거하십시오.
- 사전 평형화된 TpCM-2의 소량(용기 크기에 따라 0.2mL - 2mL)을 사용하여 웰을 간단히 헹구고 헹굼을 제거하고 적절한 양의 TpCM-2를 추가합니다(표 1). 플레이트를 1.5%O2, 5%CO2 에서 평형화하고 앞서 설명한 대로 3-4시간 동안 34°C에서N2 분위기의 균형을 유지합니다.
- 플레이트를 층류 후드로 옮기고 냉동 스톡에서 적절한 수(표 1)의 T. pallidum 을 접종하거나 갓 수확한 배양물에서 트립신화된 제제(아래 설명 참조)를 접종합니다. 감염된 토끼13로부터 무균 상태로 채취한 신선하게 준비되거나 냉동된 가축도 사용할 수 있다. 3.3.3에 설명된 대로 플레이트를 다시 평형화하고 1.5%O2, 5%CO2에서 배양액을 배양하고 34°C에서N2 분위기의 균형을 맞춥니다.
4. T. pallidum 배양균 수확 및 패싱(passaging)
참고: 배양 중인 T. pallidum의 대부분은 Sf1Ep 세포의 표면에 부착되어 있기 때문에 트레포넴을 회수하고 유기체의 정확한 수를 얻기 위해 포유류 세포에서 트레포네임을 해리해야 합니다. 이러한 '수확'과 새로운 문화로의 이동은 일반적으로 문화의 7일째에 이루어집니다. 여기에 설명된 절차는 6웰 플레이트에 대한 것입니다. 사용되는 trypsin-EDTA 용액의 양은 배양 형식 17,19,27의 크기에 따라 위 또는 아래로 조정됩니다.
- 수확 시 인큐베이터에서 배양액을 제거합니다. 역위상차 현미경을 사용하여 각 웰의 Sf1Ep 세포층을 검사하고 세포 밀도(예: 80% 합류) 및 모양을 기록합니다. 또한 TpCM-2의 색상에 유의하십시오. Resazurin 지시자는 낮은 pH의 결과로 종종 분홍색에서 노란색으로 바뀝니다.
- 교차 오염을 방지하기 위해 각 웰에 대해 별도의 피펫을 사용하여 각 웰의 배지를 멸균 15mL 코니컬 튜브에 피펫팅합니다. 0.35mL의 미리 예열된 Trypsin-EDTA 용액으로 각 우물을 헹구고 헹굼제를 배지에 추가합니다.
- 각 웰에 0.35mL의 Trypsin-EDTA 용액을 더 추가하고 표준 37°C 인큐베이터에서 5분 동안 플레이트를 배양합니다. 이 짧은 시간 동안 낮은 O2 대기가 필요하지 않습니다.
- Sf1Ep 세포의 반올림 및 분리를 확인하며, 이는 포유류 세포에서 T. pallidum 의 해리와도 관련이 있습니다. 도립 현미경을 사용하여 이 과정을 모니터링하고 필요에 따라 추가 시간 또는 Trypsin-EDTA 용액을 제공합니다. 해리 과정은 고정된 플레이트의 측면을 플라스틱 시험관 랙 또는 이와 유사한 물체로 부드럽게 두드리는 방식으로 촉진됩니다.
- 예약된 배지를 피펫팅하고 웰로 헹구어 해리된 T. pallidum 및 세포를 회수합니다. 배양당 수율 계산을 위해 검색된 총 부피를 기록합니다.
- 대부분의 실험에서 수확된 T. pallidum 의 일정 부피를 신선한 Sf1Ep 세포 및 TpCM-2가 있는 배양 플레이트로 옮깁니다. 이러한 경우 배양 부피의 약 1/20( 예: 4mL, 6웰 플레이트 배양의 경우 200μl)을 이송합니다. T. pallidum 균주가 빠르게 성장하는지 느리게 성장하는지에 따라 이 볼륨을 높이거나 낮춥니다. 100 x g 에서 5분 동안 원심분리하여 접종액의 Sf1Ep 세포를 제거하지만, 이 단계는 일상적인 이식에는 필요하지 않습니다.
- 실험용 플레이트를 접종한 직후 배출 및 재충전 프로세스(단계 3.3.3)를 사용하여 플레이트의 분위기를 교환합니다. Brewer jar 내에서 34 °C의 플레이트를 배양하거나 tri-gas incubator로 옮깁니다.
- 제조업체의 지침에 따라 Helber 계수 챔버 또는 유사한 장치를 사용하여 암시야 현미경으로 T. pallidum 을 열거합니다.
알림: Helber 챔버는 박테리아 수의 정확성과 재현성을 크게 향상시키는 보정된 유리 슬라이드 및 커버 슬립입니다. 챔버는 70% 에탄올과 종이 티슈를 사용하여 쉽게 소독, 청소 및 건조할 수 있으며 무기한으로 재사용할 수 있습니다. 이상적으로 암시야 현미경에는 40x 대물렌즈와 15x 접안렌즈가 있어야 합니다. 각 배양권에 대해 중복 계수를 수행하고, 운동성 및 비운동성 T. pallidum의 수와 형태학적 변화를 기록합니다. 정량적 PCR(qPCR)은 정밀한 정량 분석 및 운동성 측정이 필요하지 않은 경우에도 사용할 수 있습니다17,24. - 트립신을 사용한 처리가 바람직하지 않을 수 있는 실험(예: T. pallidum 단백질 함량을 검사하는 실험)에서는 EDTA 해리 배지를 사용하여 T. pallidum 및 세포 단층17,19을 해리합니다.
참고: 해리 배지는 단순화된 T. pallidum 배양 배지에서 2가 양이온을 제거하기 위해 염화칼슘 및 염화마그네슘이 없는 인산염 완충 식염수(PBS) 또는 Earle's Basic Salt Solution(EBSS)에 대해 투석된 FBS로 구성됩니다(표 2). 이 절차는 더 오랜 시간(최대 30분)이 걸리거나 완전한 해리를 위해 반복적으로 치료할 수 있습니다.
5. T. pallidum 배양균 냉동 및 보관
참고: T. pallidum 은 -70 °C 이하에서 무기한 보관할 수 있으며 해동 시 생존율은 일반적으로 50%-90%입니다.
- 수확 시 T. pallidum 배양액을 10%(v/v) 글리세롤을 첨가하여 동결합니다. 부드러운 피펫팅 또는 반전을 통해 전처리 전반에 걸쳐 글리세롤을 분산시킵니다. 그런 다음 1-2mL 분취액의 제제를 스크류 캡이 있는 냉동고 바이알에 분배하고 즉시 바이알을 -80°C 냉동고 또는 액체 N2 냉동고에 넣습니다.
- 냉동 스톡에서 T. pallidum 배양을 시작하려면 먼저 섹션 3에 설명된 대로 Sf1Ep 세포 및 TpCM-2를 포함하는 적절한 배양 용기를 준비합니다. T. pallidum 냉동 스톡이 들어있는 바이알을 빠르게 해동하십시오. 이와 관련하여 37°C 수조 또는 가열 블록을 주의해서 사용하는 것이 도움이 됩니다.
- 그런 다음 해동된 제제를 배양 용기로 옮깁니다. T. pallidum의 생존과 성장을 촉진하기 위해 글리세롤을 충분히 희석할 수 있도록 Tp-CM2 배지에 대한 냉동 재고 부피의 비율이 1:5 이상인지 확인하십시오.
- 미세 호기성 조건에서 7일 동안 배양액을 배양하고 섹션 4에 설명된 대로 신선한 배양액으로 옮깁니다.
6. T. pallidum의 동인성 클론 생성
참고: 이 절차는 선행 연구27에 자세히 설명되어 있습니다.
- 일반적인 실험에서는 섹션 3에 설명된 대로 1000 Sf1Ep 셀과 웰당 200 μL의 TpCM-2가 있는 두 개의 96웰 플레이트를 준비하고 사전 평형을 만듭니다.
참고: 다중 채널 200 μL 피펫터와 호환 가능한 멸균 일회용 시약 저장소는 Sf1Ep 세포 접종, 배지 교환 및 접종 단계를 크게 단순화합니다. - 암시야 현미경과 Helber 챔버를 사용하여 갓 수확한 제제에서 T. pallidum 의 농도를 정량화합니다(단계 4.8). T. pallidum 현탁액을 TpCM-2에 희석하여 10 treponemes/mL 및 40 treponemes/mL의 농도로 두 가지 제제를 생성합니다. 각 제제의 10mL는 각 희석액과 함께 96웰 플레이트 1개를 접종하기에 충분합니다. 대조군으로 2 x 103 T. pallidum/mL를 포함하는 다른 희석액 1mL를 준비합니다.
- 표준 단일 채널 피펫 또는 다중 채널 피펫을 사용하여 10 T. pallidum/mL 전처리의 웰당 50 μL를 준비된 96웰 플레이트 중 하나에 접종하고 두 개의 대조 웰을 생략합니다. 40 T. pallidum/mL 전처리 및 다른 플레이트에 대해 이 과정을 반복합니다. 각 플레이트에 있는 두 개의 대조 웰에서 2 x 103T. pallidum/mL 희석액을 접종합니다. 이 공정은 100 T. pallidum을 함유한 포지티브 컨트롤 웰과 함께 웰당 (평균적으로) 0.5 또는 2 T. pallidum이 있는 플레이트를 생산합니다.
참고 : T. pallidum 의 도금 효율은 이러한 조건에서 낮기 때문에 ~ 2 개의 유기체로 파종 된 우물조차도 클론 개체군을 생성 할 가능성이 높습니다. - 플레이트를 낮은O2 가스 혼합물로 평형화하고(단계 3.3.3) 34°C의 Brewer jar 또는 tri-gas incubator에서 배양합니다.
- 7일이 되면 각 배양 웰에서 100μL의 배지를 제거하고 100μL의 신선하고 평형화된 TpCM-2로 교체합니다. 암시야 현미경 및 계수를 통해 대조군에서 T. pallidum 의 생존력과 성장을 확인하여 배양 조건이 T. pallidum 증식을 지원하는지 확인합니다.
알림: 클론 배양의 교차 오염을 방지하기 위해 각 웰에 대해 새 피펫 팁을 사용해야 합니다. - 14일째에 각 웰에서 배양 상층액 50μL를 단계 6.1과 같이 준비된 새 플레이트로 옮깁니다.
- 21일째와 28일째에 필요에 따라 번갈아 가며 수유와 통과를 반복하십시오.
- 암시야 현미경 또는 qPCR26을 사용하여 각 웰에서 T. pallidum의 존재를 모니터링합니다.
참고 : T. pallidum 의 느린 성장 속도와 먹이 및 전달 중 유기체의 필연적 손실로 인해 0.5 또는 2 T. pallidum 으로 파종 된 우물은 일반적으로 28 일 또는 그 이후까지 두 가지 방법 중 하나로 양성이 아닙니다. - 포지티브 웰이 식별되면 트립시화하여 이 웰을 24웰 플레이트로 옮겨 추가 팽창을 거둡니다. 단일 tprK 염기서열의 우세와 부모 균주에서 이질적인 부위에서의 단일 염기서열의 존재에 의해 클론성을 결정한다27.
결과
설명된 조건을 사용하여 T. pallidum 은 일반적으로 >90%의 운동성을 유지하고 고정상에 진입하기 전에 약 7일 동안 33시간에서 45시간의 배가로 대수적으로 곱합니다(그림 3). 1주일 동안 스피로헤테스는 약 4-5배의 배가(doublering)를 겪습니다(그림 4). ). 또한, T. pallidum 의 다른 균주는 다른 속도로 성장할 수 있습니다. T. pallidum 의 SS14 그룹의 균주는 Nichols그룹 17의 균주보다 배가시간이 느린 경향이 있습니다.
배양액을 공급하면 배양 시간이 며칠 연장될 수 있지만 Sf1Ep 세포층은 배양 일주일 후에 실패하는 경우가 많습니다. 또한, 트레포네메는 약 5 x 107/mL의 유기체의 상한에 도달합니다. 7일 간격으로 전송된 배양권은 일반적으로 지연 단계가 거의 또는 전혀 없이 로그 곱셈을 계속합니다. 정지 상태에 있는 유기체는 종종 통과하기 어려워집니다.
대부분의 T. pallidum 은 Sf1Ep 세포에 부착되어 있습니다. 그러나 충분한 T. pallidum 이 상층액에 남아 있어 생존력과 증식을 확인하기 위해 배지 샘플을 주기적으로 제거할 수 있습니다. 신중한 정량 분석이 필요한 경우, 제거된 배지의 부피를 측정하고, 정량화된 T. pallidum 의 수를 측정하고, 제거된 총 유기체 수를 수확 시 최종 계수에 추가해야 합니다.
이전 연구에서, 클로닝 효율(접종된 유기체당 양성 배양물의 수)은 웰당 접종된 2 T. pallidum 에 대해 12.5%, 웰당 접종된 0.5 T. pallidum 에 대해 6.7%였다27. 따라서, 어떠한 양성 우물도 이들 접종물 중 어느 하나에서 단일 유기체의 성장을 나타낼 가능성이 높다. 그러나 결과 모집단의 클론성은 부모 배양에서 이질적인 사이트에서 균질성을 위해 배양을 검사하여 확인해야 합니다. 배양이 동원성임을 입증하는 가장 확실한 방법은 전체 게놈 시퀀싱27을 사용하는 것입니다.
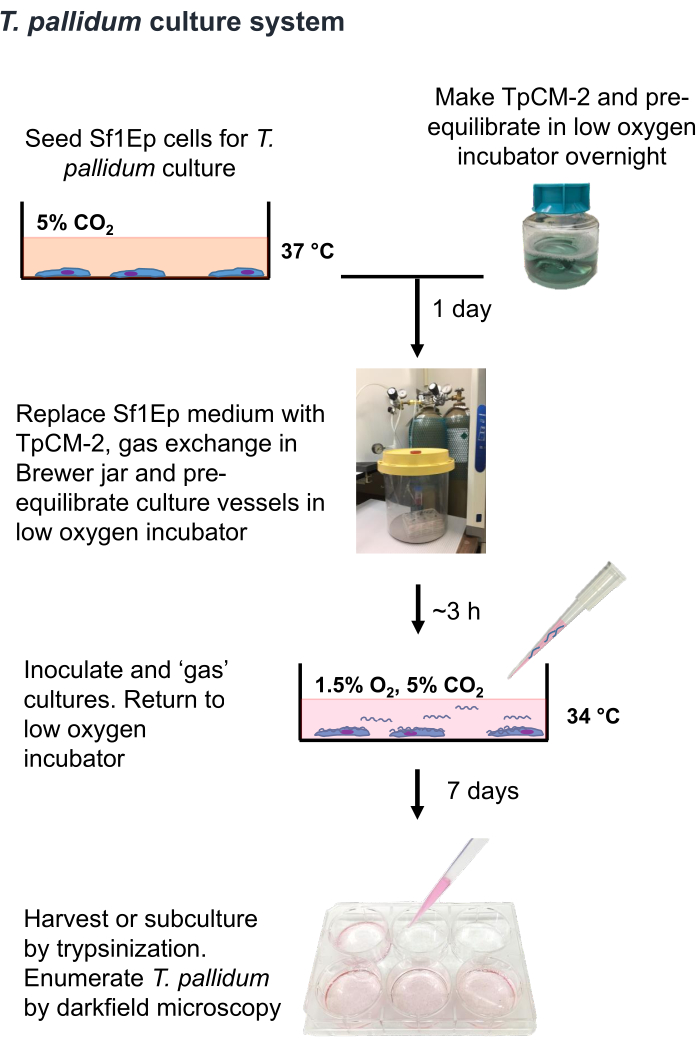
그림 1: T. pallidumin vitro 배양 절차의 흐름도. 이 그림은 Edmondson and Norris (2021)19의 허가를 받아 재인쇄되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
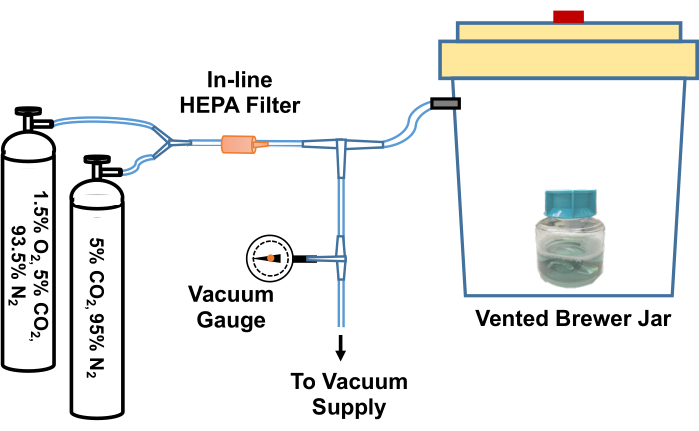
그림 2: T. pallidum 배양 시약을 저산소 환경과 평형화하기 위한 시스템 다이어그램. Brewer jar vent는 T- 조인트를 통해 진공 소스 (예 : 집 진공)와 맞춤형 가스 혼합물 (5 % CO2 , 균형 질소 및 1.5 % O2 , 5 % CO2 , 균형 질소)이 들어있는 가스 실린더에 연결됩니다. 인라인 진공 게이지는 용기에서 흡입된 진공을 측정합니다. 진공은 용기에서 약 -58kPa까지 흡입됩니다. 그런 다음 비워진 항아리는 가스 혼합물로 천천히 다시 채워집니다. 브루어 항아리는 5 % CO2 로 세 번 리필되고 최종 배출 전에 질소의 균형을 맞추고 95 % N2 , 5 % CO2 , 1.5 % O2 로 다시 채워집니다. 그런 다음 배양액 또는 배지를 용기에서 제거하고 저산소 인큐베이터로 신속하게 옮깁니다. 또는 Brewer jar와 첫 번째 T 조인트 사이의 튜브를 단단히 고정하고 튜브를 T- 조인트에서 분리 한 다음 전체 Brewer jar를 34 ° C 인큐베이터로 옮길 수 있습니다. 이 그림은 Edmondson and Norris (2021)19의 허가를 받아 재인쇄되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3: TpCM-2 배지를 사용하여 Sf1Ep 세포로 배양한 T. pallidum 의 성장 곡선. 평행한 삼중 배양은 T. pallidum으로 파종되었다. 반복실험은 각 시점에서 수집되었습니다. 결과는 이러한 문화권에 대한 평균 + SEM을 나타냅니다. (A) 배양에 따른 T. pallidum 의 변화와 (B) 운동성 퍼센트가 표시됩니다. 이 그림은 Edmondson et al.18의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 4: T. pallidum, Nichols 균주의 시험관 내 배양 통과 예. 병렬 삼중 배양에 T. pallidum을 파종하고 1:20 희석을 사용하여 매주 통과시켰습니다. 톱니 그림은 배양당 T. pallidum의 수와 각 시점에서 새로운 배양으로 이동된 수를 보여줍니다. 결과는 3개의 생물학적 복제에 대한 SEM± 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 배양 용기의 중간 부피 및 시딩 비율. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: T. pallidum 배양용 배지. 모든 매체는 준비 후 필터 멸균해야 합니다. Sf1Ep 배지는 4°C에서 최대 2개월 동안 보관할 수 있습니다. TpCM-2는 일반적으로 사용 하루 전에 만들어집니다. 해리 매체는 분주되고 동결되어야 합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
Sf1Ep-TpCM-2 시스템은 T. pallidum의 지속적인 시험관 내 배양을 촉진하는 최초의 사용 가능한 절차입니다. 이 시스템은 이 유기체의 극단적인 성장 요구 사항으로 인해 복잡합니다: 1) 제한된 생합성 능력으로 인해 복잡한 영양 요구; 2) 활성 산소 종 9,10,16,36에 대한 높은 민감도에도 불구하고 소량의 산소에 대한 요구 사항이 잘 이해되지 않음; 3) Sf1Ep 셀의 존재에 대한 현재 필요성. 절차를 '대충 넘어가기' 싶은 유혹이 들지만, 수정을 시도하기 전에 성공적인 장기 문화가 달성될 때까지 단계를 주의 깊게 따르는 것이 좋습니다. T. pallidum의 대사 요구 사항에 대한 추가 정보가 축적됨에 따라 Sf1Ep 세포의 존재를 필요로 하지 않는 축삭 상태가 발생할 수 있습니다. 그러나, T. pallidum이 포유류 감염중에도 30 시간에서 33 시간의 추정 배증 시간에 증식한다는 점을 감안할 때, 시험관 내 성장 속도는 느린 상태로 유지될 가능성이 높습니다(균주에 따라 최소 33시간에서 46시간까지)17,18. 다른 박테리아 배양과 마찬가지로, '유전적 부동' 및 돌연변이로 인한 관련 표현형 변화를 피하기 위해 낮은 통로 스톡을 유지하고 이러한 스톡에서 10개 미만의 통로 미만인 T. pallidum 배양으로 실험을 수행하는 것이 권장됩니다.
Sf1Ep 세포는 트레포네메에 필수 영양소 또는 효소 활성을 제공하는 것으로 보입니다. 그러나 그들은 또한 영양소(예: 포도당 및 산소)를 소비하고 낮은 pH 9,16,39와 같은 독성 조건을 생성할 수 있습니다. 따라서 T. pallidum 증식을 지원하기에 충분한 Sf1Ep 세포를 보유하는 것과 포유류 세포의 과잉 증식 및 독성을 예방하는 것 사이에는 균형 작용이 있습니다. Sf1Ep 세포의 높은 통로 수는 더 빠르게 성장하는 경향이 있으며 때때로 T. pallidum 증식을 지원하는 능력을 잃게 됩니다. 따라서 Sf1Ep 통로 수를 모니터링해야 하며 셀 스톡을 주기적으로 통로가 낮은 냉동 제제로 교체해야 합니다. Sf1Ep 세포의 존재는 또한 DNA, RNA 및 단백질 함량 및 효소 활성과 같은 T. pallidum 특성에 대한 연구를 복잡하게 만듭니다. 토끼 세포의 제거는 반복적인 저속 원심분리(5분 동안 100 x g)를 사용하여 어느 정도 가능하거나 Percoll 또는 Hypaque 그래디언트(40,41)를 보다 효과적으로 사용할 수 있습니다. 그러나 그래디언트 원심분리 방법은 일반적으로 T. pallidum의 수가 많을 때만 효과적입니다. T. pallidum을 번식시키는 대체 방법은 토끼와 같은 실험실 동물의 감염으로 제한된다13,14. 이 접근 방식에는 윤리적 고려 사항이 있으며 점점 더 비용이 많이 듭니다. 그러나 토끼 모델은 T. pallidum 발병 기전 및 숙주 면역 반응을 연구하는 데 매우 유용합니다. 또한, 체외 배양 및 토끼 감염 중 T. pallidum의 유전자 발현, 성장 또는 행동에 약간의 차이가 있을 수 있다27.
이 보고서 작성 시점을 기준으로 Sf1Ep-TpCM-2 시스템은 미국과 유럽의 최소 6개 연구 그룹에 확립되어 있으며, T. pallidum 기초 생물학 및 유전학에서 항생제 감수성에 이르기까지 다양한 주제로 16개의 출판물을 발표했습니다. 이 수수께끼 같은 병원체를 연구하는 데 있어 체외 배양의 가치는 사용 확대와 향후 개선에 따라 증가할 것입니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health)/NIAID의 보조금 R01 AI141958의 지원을 받았습니다. 연구비 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할도 하지 않았다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
참고문헌
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유