Method Article
Procedimentos para o cultivo in vitro de Treponema pallidum, a espiroqueta da sífilis
Neste Artigo
Resumo
Este protocolo descreve o cultivo in vitro do patógeno da sífilis Treponema pallidum subsp. pallidum em co-cultura com células de mamíferos. O método é escalável; pode ser usado para produzir grandes quantidades de T. pallidum e gerar culturas clonais.
Resumo
Por mais de um século, Treponema pallidum subsp. pallidum, a bactéria em forma de espiral que causa a sífilis, só podia ser propagada por inoculação e colheita dos organismos de testículos de coelhos. Em 2018, descrevemos um método para cultivar continuamente T. pallidumin vitro. Este sistema utiliza co-cultura com células epiteliais de coelho (células Sf1Ep) em um meio de cultura de tecidos contendo soro chamado TpCM-2. O tempo de duplicação de T. pallidum em cultura é semelhante ao estimado para ocorrer durante a infecção natural (cerca de 33-45 h). O organismo pode ser cultivado continuamente com um tempo de passagem padrão de 1 semana em um ambiente de baixo oxigênio (1,5%) a 34 ° C. Este artigo contém os protocolos para cultura de T. pallidum, métodos para cultivar e manter as células de cultura de tecidos necessárias e a técnica para gerar cepas isogênicas limitando a diluição. A capacidade de cultivar T. pallidum in vitro fornece novos caminhos experimentais para estudar e entender esse organismo enigmático.
Introdução
Treponema pallidum é uma espécie de bactéria em forma de espiral (chamada espiroquetas) que causa sífilis e infecções relacionadas em humanos e outros primatas. A sífilis é uma doença grave com efeitos de longo prazo em indivíduos infectados, e estima-se que mais de 8 milhões de novos casos de sífilis ocorram em todo o mundo a cada ano1. T. pallidum foi subdividido em três subespécies com base nas doenças que causam em humanos, bem como pequenas diferenças genéticas: subespécie pallidum (que causa a doença sexualmente transmissível sífilis), subespécie pertenue (bouba) e subespécie endemicum (causando bejel ou sífilis endêmica)2,3. T. pallidum subsp. pertenue também causa infecções em babuínos, chimpanzés e outros primatas. Um organismo intimamente relacionado chamado Treponema paraluiscuniculi (também chamado de Treponema paraluisleporidarum) causa uma infecção em coelhos e lebres 4,5. Todas essas bactérias estão intimamente relacionadas, com mais de 98% de identidade de sequência de DNA no nível do genoma 6,7,8. Cada um deles tem um único cromossomo circular pequeno com cerca de 1,14 milhão de pares de bases (Mb) de tamanho. Os membros deste grupo de T. pallidum são encontrados apenas em associação com seus hospedeiros mamíferos; como tal, são patógenos obrigatórios que dependem de suas espécies hospedeiras para sobrevivência e crescimento 9,10.
As tentativas de cultivo de T. pallidum in vitro começaram logo após sua identificação por Schaudinn e Hoffman em 190511,12. No entanto, esses esforços não conseguiram levar a um crescimento consistente e reprodutível do organismo. Como resultado, os estudos de pesquisa sobre T. pallidum exigiram a propagação do organismo por meio da infecção experimental de animais de laboratório, mais comumente o coelho13,14. Em 1981, Fieldsteel et al.15 introduziram um sistema de cultura de tecidos que promoveu a multiplicação de cepas de T. pallidum por um período de até 2 semanas. Este sistema envolveu co-cultura de T. pallidum com células epiteliais de coelho Sf1Ep em meio de cultura de tecidos modificado (T. pallidum Culture Medium 1, TpCM-1) baseado no Meio Essencial Mínimo de Eagle (MEM) e 20% de soro fetal bovino (FBS). Outras condições de cultivo necessárias foram incubação a 34 °C em atmosfera contendo 1,5% deO2 e 5% de CO2 9,16. Nesse sistema, T. pallidum se liga às células Sf1Ep e se multiplica quando em estreita associação com a superfície celular dos mamíferos. Apesar de muitas tentativas de subcultivo e outras modificações, o sistema Fieldsteel et al. não conseguiu promover o crescimento contínuo in vitro.
Em 2018, nosso laboratório relatou que o uso de um meio modificado chamado TpCM-2 (no qual o MEM de Eagle foi substituído por um meio de cultura de tecidos mais complexo, CMRL 1066) forneceu a T. pallidum os nutrientes necessários para permitir uma cultura consistente a longo prazo17. Até o momento, essa modificação levou a uma cultura consistente e contínua de pelo menos 5 cepas de T. pallidum subsp. pallidum (Nichols, SS14, México A, UW231B e UW249B) e uma cepa de T. pallidum subsp. endemicum (Bósnia A) 18 , 19 . Por exemplo, a cepa Nichols já foi cultivada continuamente in vitro por mais de 6 anos. Até agora, as tentativas de cultivar isolados de bouba (T. pallidum subsp. pertenue) ou T. paraluiscuniculiin vitro não tiveram sucesso18. O sistema TpCM-2 ainda requer a presença de células Sf1Ep, baixas concentrações de oxigênio e incubação a 34 °C, tornando o sistema mais complexo do que a maioria das técnicas de cultura bacteriana. No entanto, este sistema de cultura modificado de T. pallidum tem sido útil para definir melhor os requisitos de crescimento da bactéria18, determinando concentrações inibitórias mínimas (MICs) de compostos antimicrobianos e peptídeos 20,21,22,23,24,25, propagando novas cepas de aspirados de tecido de pacientes26, isolando populações clonais do organismo27, caracterizando o sistema de variação antigênica tprK 27,28, examinando a expressão gênica29 e realizando análise mutacional 30,31,32.
Aqui, descrevemos os métodos atuais para o cultivo de T. pallidum in vitro. Esperamos que essas informações ajudem a facilitar a aplicação mais difundida dessa técnica de cultura in vitro para melhorar o diagnóstico, o tratamento e a prevenção da sífilis e infecções treponêmicas relacionadas.
Protocolo
NOTA: Todas as etapas requerem o uso de uma técnica asséptica e materiais e reagentes estéreis. A utilização de uma capela de fluxo laminar de cultura de tecidos é recomendada para reduzir a) a exposição do pessoal a material infeccioso e b) a possibilidade de contaminação microbiana das culturas.
1. Estabelecimento de estoques de células Sf1Ep
NOTA: As células epiteliais de coelho Sf1Ep podem ser adquiridas como estoques congelados na American Type Culture Collection (consulte a Tabela de Materiais). A natureza de crescimento lento e a baixa taxa metabólica das células Sf1Ep parecem ser a chave para sua capacidade de apoiar a sobrevivência e o crescimento a longo prazo de T. pallidum33; portanto, a substituição por outras culturas de células de mamíferos não é recomendada. As células Sf1Ep não são uma linhagem celular imortalizada e podem ser mantidas por apenas 25-30 passagens em cultura. Portanto, é importante manter um estoque congelado de células Sf1Ep de baixa passagem para uso futuro. Linhagens de Sf1Ep imortalizadas ocasionalmente surgem durante a cultura de longo prazo de células Sf1Ep. (observações não publicadas). Essas linhas geralmente crescem mais rápido e são mais fáceis de manusear; no entanto, às vezes, eles perdem a capacidade de suportar o crescimento de T. pallidum . As linhas Sf1Ep imortalizadas podem ser usadas e substituídas quando as espiroquetas começarem a crescer lentamente.
- Prepare um meio celular Sf1Ep e pré-aqueça-o em uma incubadora de CO2 a 37 °C, 5%.
NOTA: O meio celular Sf1Ep consiste em MEM de Eagle suplementado com 10% de FBS, 1x aminoácidos não essenciais MEM, 2 mM de L-glutamina e 1 mM de piruvato de sódio. (ver Tabela de Materiais). O meio deve ser esterilizado por filtro e pode ser armazenado a 4 °C por até 2 meses. Antibióticos (como penicilina e estreptomicina) não devem ser usados no meio celular Sf1Ep, pois a transferência de vestígios dos antibióticos interferirá no crescimento de T. pallidum. - Descongele o estoque de Sf1Ep congelado rapidamente a 37 °C. Limpe a parte externa do frasco com etanol a 70%.
- Adicione 1 mL de meio celular Sf1Ep ao criogênico e misture delicadamente. Adicione a mistura de estoque de meio/célula a um tubo de centrífuga cônico estéril de 15 mL contendo 5 mL de meio celular Sf1Ep e misture suavemente.
- Pulverizar as células por centrifugação a 100 x g durante 7 min. Remova e descarte o sobrenadante, tomando cuidado para não perturbar o pellet celular.
- Ressuspenda suavemente as células Sf1Ep descongeladas em 15 ml de meio de células Sf1Ep fresco e transfira-as para um balão de cultura de tecidos T75.
NOTA: A recuperação das células Sf1Ep recém-descongeladas é melhorada pela centrifugação para remover o DMSO usado para congelar as células. No entanto, as etapas 1.4-1.7 podem ser omitidas e as células descongeladas da etapa 3 podem ser semeadas diretamente em um frasco de cultura de tecidos T75 contendo 14 mL de meio celular Sf1Ep. Após incubação durante a noite, substitua metade do meio por meio Sf1Ep fresco para diluir o DMSO residual. - Incubar as culturas de Sf1Ep em uma incubadora de cultura de tecidos umidificada padrão a 37 °C, 5% de CO2. Afrouxe as tampas dos frascos de cultura de tecidos não ventilados para manter o pH médio adequado.
2. Células Sf1Ep de passagem
NOTA: O crescimento da cultura de células Sf1Ep é monitorado com um microscópio invertido usando óptica de contraste de fase. Normalmente, as células levam cerca de uma semana para chegar perto da confluência. Quando as células atingem ~90% de confluência, elas podem ser passadas, usadas para cultivo de T. pallidum ou preparação de estoques congelados. A vida útil da cultura pode ser estendida para duas semanas pela substituição de metade do meio de cultura após uma semana de cultura.
- Aspirar e rejeitar o meio de cultura Sf1Ep do balão. Enxágue a camada celular com 5 mL de PBS estéril à temperatura ambiente (RT) e aspire e descarte o enxágue com PBS.
- Adicione 2,5 ml de tripsina-EDTA ao balão e feche a tampa. Agite o balão para a frente e para trás para cobrir a camada celular com tripsina-EDTA e incube o balão a 37 °C durante 5 min.
- Bata suavemente no frasco para desalojar as células. Observe sob um microscópio invertido para confirmar a dispersão das células Sf1Ep.
- Adicione 5 mL de meio de crescimento Sf1Ep e balance o frasco para misturar com a tripsina-EDTA e interromper a ação da tripsina. Remova as células Sf1Ep suspensas para um tubo cônico estéril.
- Quantifique as células usando um hemocitômetro ou contador de células automatizado.
- Para manter os estoques de células em funcionamento, transfira uma alíquota (0,5-1,0 mL ou ~ 8 x 105 células) da mistura de meio / tripsina-EDTA / célula para um novo frasco de cultura de tecidos T75 contendo 15 mL de meio Sf1Ep fresco.
- Para a cultura de T. pallidum , diluir as células em meio Sf1Ep para 0,25-0,5 x 105 células/mL e semear em recipientes de cultura apropriados (Tabela 1).
- Para congelar as células Sf1Ep, gire em uma centrífuga de mesa a 100 x g por 7 min. Remova cuidadosamente o sobrenadante sem perturbar o pellet celular. Ressuspenda o pellet celular em meio Sf1Ep suplementado com 10% de DMSO de grau de cultura de tecidos.
- Distribua 1 mL da suspensão celular para cada criogenia e congele durante a noite a -70 ° C a -80 ° C em um recipiente isolado (como um suporte de tubo de ensaio de isopor) para aumentar a retenção da viabilidade antes de transferir os frascos para um recipiente criogênico de nitrogênio líquido.
3. Cultivo de T. pallidum
CUIDADO: Todas as subespécies e cepas de T. pallidum são patogênicas para humanos e são classificadas como patógenos de nível de biossegurança 2 (BSL-2)34. São necessárias medidas adequadas para proteger o pessoal; isso inclui o uso de luvas e outros equipamentos de proteção individual (EPI), bem como a desinfecção de superfícies, materiais e líquidos potencialmente expostos a T. pallidum. T. pallidum é prontamente inativado pela exposição a 70% de etanol ou desinfetantes disponíveis comercialmente. Recomenda-se o uso consistente de capelas de fluxo laminar para o manuseio de amostras contendo T. pallidum .
NOTA: T. pallidum é um organismo microaerofílico que pode ser morto por algumas horas de exposição aos níveis atmosféricos de oxigênio 9,16,35. Portanto, recomenda-se que o manuseio de T. pallidum no ar seja limitado a menos de uma hora, se possível. Além disso, o meio TpCM-2 deve ser pré-equilibrado em 1,5% O2, 5% CO2, equilíbrio N2 e agitação vigorosa (por exemplo, uso de um vórtice) deve ser limitado. Como a cultura de T. pallidum é normalmente realizada na ausência de antibióticos, é necessário cuidado extra para evitar a contaminação por bactérias ou fungos. O procedimento Sf1Ep-TpCM-2 para cultura de T. pallidum está resumido na Figura 1 e envolve várias etapas, incluindo a semeadura de vasos de cultura com células Sf1Ep, preparação do meio TpCM-2 e inoculação das culturas com T. pallidum. O soro fetal bovino inativado pelo calor (FBS) é um componente crítico do meio, e sua eficácia varia entre diferentes fornecedores e lotes19. É necessária uma pré-triagem dos lotes de FBS quanto à eficácia.
- Selecione o tamanho de cultura apropriado.
NOTA: A cultura de T. pallidum é escalável de grandes formatos (como frascos de75 cm 2 rendendo ~ 1 x 109T. pallidum por cultura) para placas de 96 poços (adequadas para experimentos de clonagem) 17 , 18 , 19 , 27 .- Ao ajustar o tamanho da cultura, leve em consideração o número de células Sf1Ep e T. pallidum inoculadas por cultura, bem como a quantidade de meio necessária, conforme mostrado na Tabela 1. Use frascos com tampas ventiladas, pois permitem a livre circulação de gases com diminuição da perda de volume devido à evaporação.
- Use o formato de placa de 6 poços para culturas iniciais, pois é conveniente incluir réplicas triplicadas e poços extras caso ocorra contaminação microbiana.
- Semeie células Sf1Ep 1-2 dias antes do experimento.
- Preparar uma suspensão de células Sf1Ep por tripsinização de culturas de reservas, conforme descrito no passo 2.7.
- Determine a concentração de células Sf1Ep na suspensão usando um hemacitómetro ou contador de células automatizado.
- Adicione o número apropriado de células Sf1Ep e meio Sf1Ep (Tabela 1) a cada cultura. Incubar as culturas a 37 °C numa incubadora de cultura de tecidos padrão com 5% de CO2 até à utilização.
- Prepare o TpCM-2 1 dia antes do experimento.
NOTA: O TpCM-2 pode ser preparado e armazenado a -20 °C por vários meses. O meio deve ser descongelado e equilibrado na incubadora de baixo teor de oxigênio no dia anterior ao experimento.- Obtenha soluções estéreis para os componentes do TpCM-2 (Tabela 2) comercialmente ou prepare-as a partir de reagentes secos e filtre-as. Conservar as soluções a 4 °C durante um período máximo de 2 meses. Ajuste o pH do tampão MOPS para 7,5 antes da esterilização do filtro; caso contrário, os componentes ou o TpCM-2 final não precisam ser ajustados em pH.
NOTA: Recomenda-se o uso de água destilada estéril de grau de cultura de tecidos para a preparação dos componentes do meio. - Combine os reagentes listados na Tabela 2 em um recipiente estéril, adicionando ditiotreitol (DTT) como forma de pó seco (para minimizar sua oxidação). Aumente (ou diminua) as quantidades de cada componente para preparar a quantidade necessária de TpCM-2. Misture suavemente e esterilize o meio usando uma unidade de filtro de 0,22 μm.
- Afrouxe a tampa do frasco contendo o TpCM-2. Pré-equilibre o meio colocando-o em um frasco anaeróbico (Brewer), evacuando e reabastecendo com uma mistura de gases 95% N2, 5% CO2 três vezes e, em seguida, enchendo com 1.5% O2, 5% CO2, equilibre a mistura de gases N2 após a evacuação final. Um exemplo de um sistema para realizar esse processo de troca gasosa é representado na Figura 2.
- Transfira rapidamente o meio para uma incubadora tri-gás configurada para fornecer uma atmosfera de 1,5% de O2, 5% de CO2 e equilibrar a atmosfera de N2 a 34 °C. Em alternativa, o frasco anaeróbio que contém o meio pode ser selado na sequência da troca gasosa descrita no ponto 3.3.3 e transferido para uma incubadora normalizada.
- Obtenha soluções estéreis para os componentes do TpCM-2 (Tabela 2) comercialmente ou prepare-as a partir de reagentes secos e filtre-as. Conservar as soluções a 4 °C durante um período máximo de 2 meses. Ajuste o pH do tampão MOPS para 7,5 antes da esterilização do filtro; caso contrário, os componentes ou o TpCM-2 final não precisam ser ajustados em pH.
- Na manhã do experimento, verifique as culturas de Sf1Ep usando um microscópio invertido. Certifique-se de que as células estejam conectadas e 5% a 10% confluentes. Remova assepticamente o meio.
- Enxágue os poços brevemente usando um pequeno volume (0,2 mL a 2 mL, dependendo do tamanho do recipiente) do TpCM-2 pré-equilibrado, remova o enxágue e adicione a quantidade apropriada de TpCM-2 (Tabela 1). Equilibre as placas em uma atmosfera de 1,5% O2, 5% CO2 e equilibre a atmosfera de N2 a 34 ° C por 3-4 h, conforme descrito anteriormente.
- Transferir as placas para uma capela de fluxo laminar e inocular com o número adequado (Quadro 1) de T. pallidum de matérias-primas congeladas ou preparações tripsinizadas de culturas recém-colhidas (conforme descrito abaixo). Pode também ser utilizado material acabado de preparar ou congelado recolhido assepticamente de coelhos infectados13. Reequilibrar as placas como descrito no ponto 3.3.3 e incubar as culturas numa atmosfera de 1,5% de O2, 5% de CO2 e equilibrar N2 a 34 °C.
4. Colheita e passagem de culturas de T. pallidum
NOTA: Como a maioria do T. pallidum em cultura está ligada à superfície das células Sf1Ep, é necessário dissociar os treponemas das células de mamíferos para recuperá-los e obter uma contagem precisa dos organismos. Essa 'colheita' e passagem para novas culturas é normalmente feita no dia 7 da cultura. O procedimento descrito aqui é para placas de 6 poços; a quantidade de solução de tripsina-EDTA usada é ajustada para cima ou para baixo, dependendo do tamanho do formato da cultura 17,19,27.
- No momento da colheita, retire as culturas da incubadora. Examine a camada de células Sf1Ep em cada poço usando um microscópio de contraste de fase invertida e registre a densidade celular (por exemplo, 80% confluente) e a aparência. Além disso, observe a cor do TpCM-2; o indicador de resazurina geralmente muda de rosa para amarelo como resultado de um pH mais baixo.
- Pipetar o meio de cada alvéolo para um tubo cónico estéril de 15 ml, utilizando pipetas separadas para cada alvéolo para evitar a contaminação cruzada. Enxágue cada poço com 0,35 mL de solução pré-aquecida de tripsina-EDTA e adicione o enxágue ao meio.
- Adicione mais 0,35 mL de solução de tripsina-EDTA a cada poço e incube a placa por 5 min em uma incubadora padrão de 37 ° C; uma atmosfera de baixo O2 não é necessária para este breve período de tempo.
- Verifique o arredondamento e o descolamento das células Sf1Ep, que também se correlacionam com a dissociação de T. pallidum das células de mamíferos. Monitore este processo usando o microscópio invertido e forneça tempo adicional ou solução de tripsina-EDTA conforme necessário. O processo de dissociação é facilitado batendo suavemente na lateral da placa imobilizada com um suporte de tubo de ensaio de plástico ou objeto semelhante.
- Pipetar o meio reservado e enxaguar para o poço para retirar o T. pallidum dissociado e as células. Registar o volume total recuperado para o cálculo do rendimento por cultura.
- Na maioria dos experimentos, transfira um volume definido do T. pallidum colhido para placas de cultura com células Sf1Ep frescas e TpCM-2. Nesses casos, transfira cerca de 1/20do volume da cultura (como 200 μl para uma cultura de placa de 4 mL e 6 poços); ajuste esse volume para cima ou para baixo, dependendo se a cepa de T. pallidum é de crescimento rápido ou lento. Remova as células Sf1Ep do inóculo por centrifugação a 100 x g por 5 min, mas esta etapa não é necessária para transferências de rotina.
- Imediatamente após a inoculação das placas para um experimento, trocar a atmosfera nas placas usando o processo de evacuação e reabastecimento (etapa 3.3.3). Incube as placas a 34 °C dentro do frasco Brewer ou transfira-as para uma incubadora tri-gas.
- Enumerar T. pallidum por microscopia de campo escuro utilizando uma câmara de contagem de Helber ou dispositivo semelhante, seguindo as instruções do fabricante.
NOTA: A câmara Helber é uma lâmina de vidro calibrada e lamínula que melhora muito a precisão e a reprodutibilidade das contagens bacterianas; A câmara é facilmente desinfetada, limpa e seca com etanol 70% e lenços de papel e pode ser reutilizada indefinidamente. Idealmente, o microscópio de campo escuro deve ter uma objetiva de 40x e oculares de 15x. Realize contagens duplicadas para cada cultura e registre o número de T. pallidum móvel e imóvel e quaisquer alterações morfológicas sejam registradas. A PCR quantitativa (qPCR) também pode ser usada nos casos em que a quantificação precisa e a determinação da motilidade não são necessárias17,24. - Em experimentos em que o tratamento com tripsina pode não ser desejável (como aqueles que examinam o conteúdo de proteína de T. pallidum), use um meio de dissociação EDTA para dissociar o T. pallidum e a monocamada celular17,19.
NOTA: O meio de dissociação consiste em FBS que foi dialisado contra solução salina tamponada com fosfato (PBS) ou solução salina básica de Earle (EBSS) sem cloreto de cálcio e cloreto de magnésio para remover cátions divalentes em um meio de cultivo simplificado de T. pallidum (Tabela 2). Este procedimento pode levar um período de tempo mais longo (até 30 min) ou tratamento repetido para dissociação total.
5. Congelamento e armazenamento de culturas de T. pallidum
NOTA: T. pallidum pode ser armazenado indefinidamente a -70 °C ou menos, com viabilidade após o descongelamento normalmente sendo de 50% a 90%.
- Congelar as culturas de T. pallidum na colheita com a adição de 10% (v/v) de glicerol. Disperse o glicerol por toda a preparação por meio de pipetagem ou inversão suave. Em seguida, distribua a preparação em alíquotas de 1-2 mL em frascos para freezer com tampa de rosca e coloque imediatamente os frascos em um freezer a -80 ° C ou em um freezer líquido N2 .
- Para iniciar uma cultura de T. pallidum a partir de material congelado, em primeiro lugar, preparar o(s) recipiente(s) de cultura adequado(s) contendo células Sf1Ep e TpCM-2, conforme descrito na secção 3. Descongele rapidamente o frasco contendo o caldo congelado de T. pallidum ; o uso cuidadoso de um banho-maria ou bloco de aquecimento a 37 °C é útil nesse sentido.
- Em seguida, transfira a preparação descongelada para o(s) recipiente(s) de cultura. Certifique-se de que a proporção entre o volume de estoque congelado e o meio Tp-CM2 seja de 1:5 ou superior para garantir uma diluição suficiente de glicerol para promover a sobrevivência e o crescimento de T. pallidum.
- Incubar a cultura em condições microaeróbias durante 7 dias e transferir para culturas frescas, conforme descrito na secção 4.
6. Geração de clones isogênicos de T. pallidum
NOTA: Este procedimento é descrito em detalhes em um estudo anterior27.
- Em um experimento típico, prepare e pré-equilibre duas placas de 96 poços com 1000 células Sf1Ep e 200 μL de TpCM-2 por poço, conforme descrito na seção 3.
NOTA: Um pipetador multicanal de 200 μL e reservatórios de reagentes descartáveis estéreis compatíveis simplificam muito as etapas de inoculação, troca de meio e inoculação de células Sf1Ep. - Quantificar a concentração de T. pallidum numa preparação recentemente colhida utilizando um microscópio de campo escuro e uma câmara de Helber (passo 4.8). Diluir a suspensão de T. pallidum em TpCM-2 para produzir duas preparações com concentrações de 10 treponemas/ml e 40 treponemes/ml; 10 mL de cada preparação são mais do que suficientes para inocular uma placa de 96 poços com cada diluição. Como controle, prepare 1 mL de outra diluição contendo 2 x 103 T . pallidum/mL.
- Usando uma pipeta monocanal padrão ou uma pipeta multicanal, inocular 50 μL por alvéolo da preparação de 10 T. pallidum/mL em uma das placas de 96 poços preparadas, omitindo dois alvéolos de controle. Repita este processo com a preparação de 40 T. pallidum/mL e a outra placa. Nos dois alvéolos de controlo em cada placa, inocular a diluição 2 x 103 T. pallidum/ml. Este processo produzirá placas com (em média) 0,5 ou 2 T. pallidum por poço, juntamente com poços de controle positivo contendo 100 T. pallidum.
NOTA: A eficiência de plaqueamento de T. pallidum é baixa nessas condições, portanto, mesmo poços semeados com ~ 2 organismos provavelmente produzirão populações clonais. - Equilibre as placas com a mistura de gases com baixo teor de O2 (passo 3.3.3) e incube-as num frasco de cerveja ou incubadora de três gases a 34 °C.
- Aos 7 dias, remover 100 μL de meio de cada poço de cultura e substituí-lo por 100 μL de TpCM-2 fresco e equilibrado. Verificar a viabilidade e o crescimento de T. pallidum nos poços de controlo por microscopia de campo escuro e enumeração para garantir que as condições de cultura suportam a multiplicação de T. pallidum .
NOTA: Certifique-se de usar uma nova ponta de pipeta para cada poço para evitar a contaminação cruzada de culturas clonais. - Aos 14 dias, transferir 50 μl do sobrenadante da cultura de cada alvéolo para placas frescas preparadas como no passo 6.1.
- Repita a alimentação e a passagem alternadas conforme necessário nos dias 21 e 28.
- Monitore a presença de T. pallidum em cada poço usando microscopia de campo escuro ou qPCR26.
NOTA: Com a lenta taxa de crescimento de T. pallidum e a perda necessária de organismos durante a alimentação e transferência, os poços semeados com 0,5 ou 2 T. pallidum normalmente não são positivos por nenhum dos métodos até o dia 28 ou depois. - Uma vez identificados os poços positivos, tripsinize e transfira esses poços para placas de 24 poços para expansão adicional. Determinar a clonalidade pela predominância de uma única sequência de tprK e pela presença de sequências únicas em locais heterogêneos na cepa original27.
Resultados
Usando as condições descritas, T. pallidum normalmente retém>90% de motilidade e se multiplica logaritmicamente com um tempo de duplicação de 33 h a 45 h por aproximadamente 7 dias antes de entrar na fase estacionária (Figura 3). Ao longo de 1 semana, as espiroquetas sofrem aproximadamente 4-5 duplicações (Figura 4). ). Além disso, diferentes cepas de T. pallidum podem crescer em taxas diferentes. As cepas do grupo SS14 de T. pallidum tendem a ter tempos de duplicação mais lentos do que as do grupo Nichols17.
A alimentação das culturas pode estender o tempo de cultura por vários dias, mas a camada de células Sf1Ep geralmente falha após uma semana de cultura. Além disso, os treponemas atingem um limite superior de organismos de cerca de 5 x 107/mL. As culturas transferidas em intervalos de 7 dias geralmente continuam a multiplicação logarítmica com pouca ou nenhuma fase de defasagem. Organismos na fase estacionária muitas vezes se tornam difíceis de passar.
A maioria dos T. pallidum está ligada às células Sf1Ep. No entanto, T . pallidum permanece suficiente no sobrenadante para que amostras de meio possam ser removidas periodicamente para verificar a viabilidade e multiplicação. Se for necessária uma quantificação cuidadosa, o volume do meio removido deve ser medido, o número de T. pallidum quantificado e o número total de organismos removidos adicionado às contagens finais na colheita.
Em estudos anteriores, a eficiência de clonagem (número de culturas positivas por organismo inoculado) foi de 12,5% para 2 T. pallidum inoculado por poço e 6,7% para 0,5 T. pallidum inoculado por poço27. Assim, é provável que qualquer poço positivo represente o crescimento de um único organismo em qualquer um desses inóculos. No entanto, a clonalidade das populações resultantes deve ser verificada examinando a homogeneidade da cultura em locais heterogêneos na cultura original. A maneira mais definitiva de demonstrar que a cultura é isogênica é por meio do sequenciamento do genoma completo27.
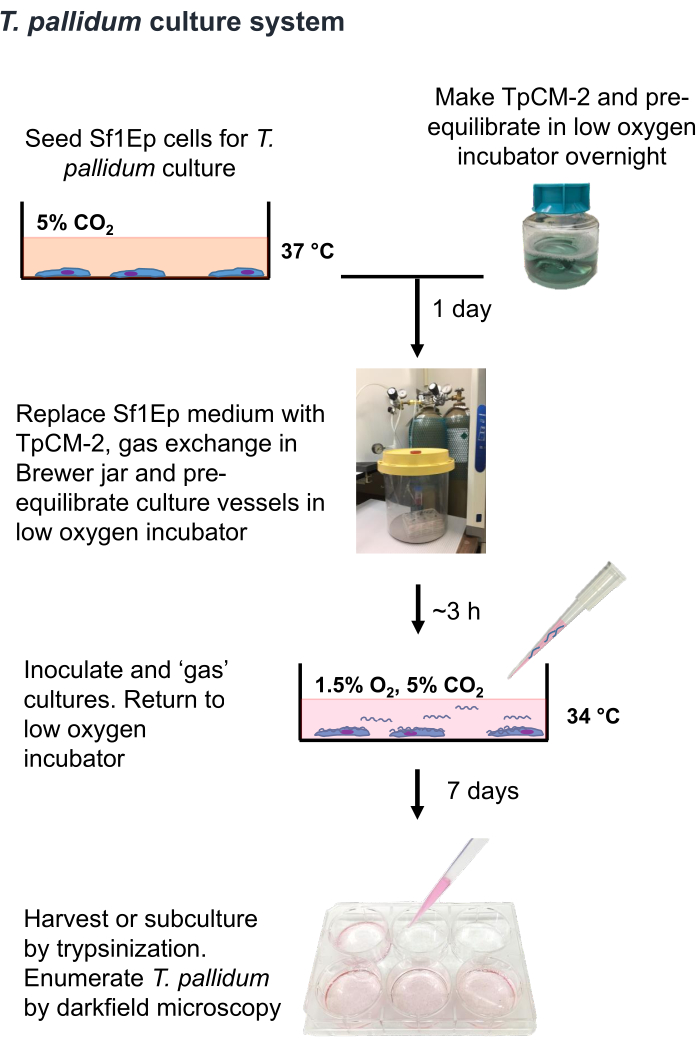
Figura 1: Fluxograma do procedimento de cultivo de T. pallidumin vitro . Esta figura foi reimpressa com permissão de Edmondson e Norris (2021)19. Clique aqui para ver uma versão maior desta figura.
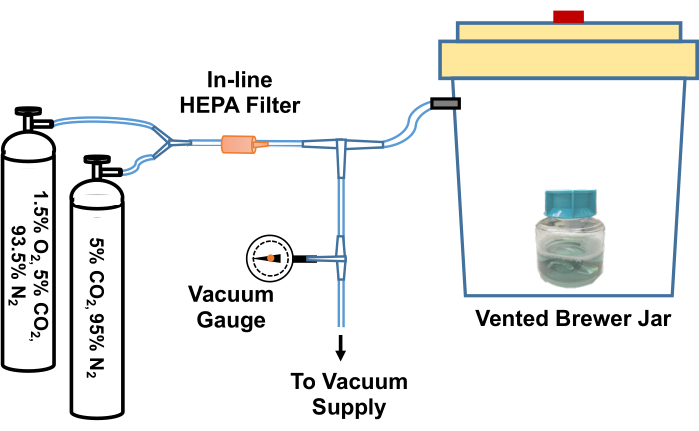
Figura 2: Diagrama do sistema para equilibrar os reagentes de cultura de T. pallidum em um ambiente com baixo teor de oxigênio. Uma ventilação do frasco de cervejeiro é conectada por meio de uma junta em T a uma fonte de vácuo (como um aspirador doméstico) e a cilindros de gás contendo misturas de gases personalizadas (5% CO2, nitrogênio de equilíbrio e 1,5% O2, 5% CO2, nitrogênio de equilíbrio). Um medidor de vácuo em linha mede o vácuo aspirado no frasco. O vácuo é aspirado no frasco a aproximadamente -58 kPa. O frasco evacuado é então lentamente reabastecido com as misturas de gases. O frasco Brewer é reabastecido três vezes com 5% de CO2, equilibra o nitrogênio antes de uma evacuação final e reabastece com 95% de N2, 5% de CO2, 1,5% de O2. As culturas ou meios são então removidos do frasco e rapidamente transferidos para a incubadora de baixo oxigênio. Alternativamente, a tubulação entre o frasco Brewer e a primeira junta em T pode ser clamped firmemente, o tubo desconectado da junta em T e todo o frasco Brewer pode ser transferido para uma incubadora a 34 °C. Esta figura foi reimpressa com permissão de Edmondson e Norris (2021)19. Clique aqui para ver uma versão maior desta figura.
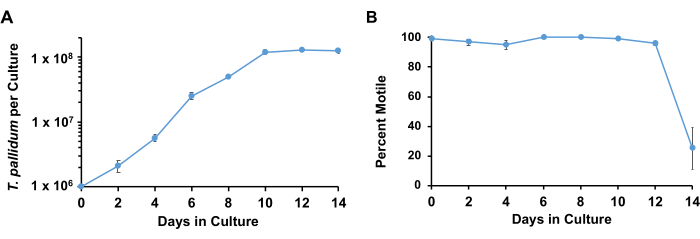
Figura 3: Curvas de crescimento de T. pallidum cultivado com células Sf1Ep com meio TpCM-2. Culturas triplicadas paralelas foram semeadas com T. pallidum. As repetições foram colhidas em cada ponto de tempo; os resultados representam a média + EPM para essas culturas. (A) As mudanças em T. pallidum por cultura e (B) motilidade percentual são mostradas. Essa figura foi adaptada com permissão de Edmondson et al.18. Clique aqui para ver uma versão maior desta figura.
Figura 4: Exemplo de passagem de cultura in vitro de T. pallidum, cepa Nichols. Culturas triplicadas paralelas foram semeadas com T. pallidum e passadas semanalmente usando uma diluição de 1:20. O gráfico dente de serra mostra o número de T. pallidum por cultura e o número transferido para novas culturas em cada ponto de tempo. Os resultados representam a média ± SEM para três repetições biológicas. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Volume médio e taxas de semeadura para vasos de cultura. Clique aqui para baixar esta tabela.
Tabela 2: Meios para cultivo de T. pallidum . Todos os meios devem ser esterilizados por filtro após a preparação. O meio Sf1Ep pode ser armazenado a 4 °C por até dois meses. O TpCM-2 é normalmente feito um dia antes do uso. O meio de dissociação deve ser aliquotado e congelado. Clique aqui para baixar esta tabela.
Discussão
O sistema Sf1Ep-TpCM-2 é o primeiro procedimento disponível que promove o cultivo contínuo in vitro de T. pallidum. O sistema é complexo devido aos requisitos extremos de crescimento deste organismo: 1) necessidades nutricionais complexas devido às capacidades biossintéticas limitadas; 2) uma necessidade pouco compreendida de pequenas quantidades de oxigênio, apesar da alta sensibilidade a espécies reativas de oxigênio 9,10,16,36; e 3) a necessidade atual da presença de células Sf1Ep. Embora seja tentador 'cortar custos' no procedimento, recomenda-se que as etapas sejam seguidas cuidadosamente até que uma cultura bem-sucedida de longo prazo seja alcançada antes de tentar modificações. À medida que informações adicionais sobre os requisitos metabólicos de T. pallidum se acumulam, pode ser possível desenvolver condições axênicas que não requerem a presença de células Sf1Ep. No entanto, a taxa de crescimento in vitro provavelmente permanecerá lenta (com um tempo mínimo de duplicação de 33 h a 46 h, dependendo da cepa)17,18, uma vez que T. pallidum se multiplica em um tempo de duplicação estimado de 30 h a 33 h, mesmo durante a infecção de mamíferos 37,38. Como acontece com qualquer cultura bacteriana, recomenda-se que estoques de passagem baixa sejam mantidos e que experimentos sejam realizados com culturas de T. pallidum que estejam a menos de 10 passagens desses estoques para evitar 'deriva genética' e alterações fenotípicas associadas devido a mutações.
As células Sf1Ep aparentemente fornecem nutrientes essenciais ou atividades enzimáticas aos treponemas. No entanto, eles também consomem nutrientes (como glicose e oxigênio) e podem produzir condições tóxicas, como baixo pH 9,16,39. Portanto, há um ato de equilíbrio entre ter células Sf1Ep suficientes para apoiar a multiplicação de T. pallidum e prevenir o crescimento excessivo e a toxicidade de células de mamíferos. Altos números de passagem de células Sf1Ep tendem a crescer mais rapidamente e, às vezes, perdem a capacidade de suportar a multiplicação de T. pallidum. Como tal, o número de passagem de Sf1Ep deve ser monitorado e os estoques de células devem ser substituídos por preparações congeladas de baixa passagem periodicamente. A presença de células Sf1Ep também complica o estudo das propriedades de T. pallidum, como DNA, RNA e conteúdo de proteínas e atividades enzimáticas. A remoção das células de coelho é possível, até certo ponto, usando centrifugação repetida de baixa velocidade (100 x g por 5 min) ou, mais efetivamente, usando gradientes de Percoll ou Hypaque40,41. No entanto, os métodos de centrifugação por gradiente geralmente são eficazes apenas com um grande número de T. pallidum. Métodos alternativos para propagação de T. pallidum são limitados à infecção de animais de laboratório, como coelhos13,14. Essa abordagem tem considerações éticas e tornou-se cada vez mais cara; no entanto, o modelo de coelho é muito útil para estudar a patogênese de T. pallidum e as respostas imunes do hospedeiro. Além disso, provavelmente existem algumas diferenças na expressão gênica, crescimento ou comportamento de T. pallidum durante a cultura in vitro e infecção de coelhos27.
No momento deste relatório, o sistema Sf1Ep-TpCM-2 foi estabelecido em pelo menos 6 grupos de pesquisa nos Estados Unidos e na Europa e resultou em 16 publicações com tópicos que vão desde a biologia básica e genética do T. pallidum até a suscetibilidade antimicrobiana. O valor da cultura in vitro no estudo desse patógeno enigmático provavelmente aumentará com o uso expandido e melhorias futuras.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pela bolsa R01 AI141958 dos Institutos Nacionais de Saúde dos Estados Unidos / NIAID. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
Referências
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados