Method Article
Verfahren zur In-vitro-Kultivierung von Treponema pallidum, der Syphilis-Spirochäte
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die in vitro Kultivierung des Syphilis-Erregers Treponema pallidum subsp. pallidum in Co-Kultur mit Säugetierzellen. Die Methode ist skalierbar; Es kann zur Herstellung großer Mengen von T. pallidum und zur Erzeugung klonaler Kulturen verwendet werden.
Zusammenfassung
Über ein Jahrhundert lang konnte Treponema pallidum subsp. pallidum, das spiralförmige Bakterium, das Syphilis verursacht, nur durch Inokulation und Ernte der Organismen aus Kaninchenhoden vermehrt werden. Im Jahr 2018 haben wir eine Methode zur kontinuierlichen Kultivierung von T. pallidumin vitro beschrieben. Dieses System verwendet eine Co-Kultur mit Kaninchen-Epithelzellen (Sf1Ep-Zellen) in einem serumhaltigen Gewebekulturmedium namens TpCM-2. Die Verdopplungszeit von T. pallidum in Kultur ist ähnlich wie bei einer natürlichen Infektion (ca. 33-45 h). Der Organismus kann kontinuierlich mit einer Standard-Passagezeit von 1 Woche in einer sauerstoffarmen Umgebung (1,5 %) bei 34 °C kultiviert werden. Dieser Artikel enthält die Protokolle für die Kultivierung von T. pallidum, Methoden für die Züchtung und Erhaltung der erforderlichen Gewebekulturzellen und die Technik zur Erzeugung isogener Stämme durch Begrenzung der Verdünnung. Die Möglichkeit, T. pallidum in vitro zu züchten, bietet neue experimentelle Möglichkeiten, diesen rätselhaften Organismus zu untersuchen und zu verstehen.
Einleitung
Treponema pallidum ist eine spiralförmige Bakterienart (Spirochäten genannt), die bei Menschen und anderen Primaten Syphilis und verwandte Infektionen verursacht. Syphilis ist eine schwere Krankheit mit langfristigen Auswirkungen auf infizierte Personen, und es wird geschätzt, dass jedes Jahr weltweit über 8 Millionen neue Fälle von Syphilis auftreten1. T. pallidum wurde in drei Unterarten unterteilt, basierend auf den Krankheiten, die sie beim Menschen verursachen, sowie geringfügigen genetischen Unterschieden: Unterart pallidum (Erreger der sexuell übertragbaren Krankheit Syphilis), Unterart pertenue (Frambösie) und Unterart endemicum (Verursacher von Bejel oder endemischer Syphilis)2,3. T. pallidum subsp. pertenue verursacht auch Infektionen bei Pavianen, Schimpansen und anderen Primaten. Ein eng verwandter Organismus namens Treponema paraluiscuniculi (auch Treponema paraluisleporidarum genannt) verursacht bei Kaninchen und Hasen eine Infektion 4,5. Alle diese Bakterien sind sehr eng miteinander verwandt, mit einer DNA-Sequenzidentität von mehr als 98 % auf Genomebene 6,7,8. Sie haben jeweils ein einzelnes, kleines zirkuläres Chromosom mit einer Größe von etwa 1,14 Millionen Basenpaaren (Mb). Die Mitglieder dieser T. pallidum-Gruppe kommen nur in Verbindung mit ihren Säugetierwirten vor; Als solche sind sie obligate Krankheitserreger, die für ihr Überleben und Wachstum von ihrer Wirtsspezies abhängig sind 9,10.
Versuche, T. pallidum in vitro zu kultivieren, begannen kurz nach seiner Identifizierung durch Schaudinn und Hoffman im Jahr 190511,12. Diese Bemühungen führten jedoch nicht zu einem konsistenten, reproduzierbaren Wachstum des Organismus. Infolgedessen erforderten Forschungsstudien zu T. pallidum die Vermehrung des Organismus durch die experimentelle Infektion von Labortieren, am häufigsten des Kaninchens13,14. Im Jahr 1981 führten Fieldsteel et al.15 ein Gewebekultursystem ein, das die Vermehrung von T. pallidum-Stämmen über einen Zeitraum von bis zu 2 Wochen förderte. Dieses System umfasste die Co-Kultur von T. pallidum mit Sf1Ep-Epithelzellen aus Baumwollschwanzkaninchen in einem modifizierten Gewebekulturmedium (T. pallidum Kulturmedium 1, TpCM-1) auf der Grundlage von Eagle's Minimum Essential Medium (MEM) und 20 % fötalem Rinderserum (FBS). Weitere erforderliche Kulturbedingungen waren die Inkubation bei 34 °C in einer Atmosphäre, die 1,5 %O2 und 5 % CO2 9,16 enthielt. In diesem System bindet sich T. pallidum an die Sf1Ep-Zellen und vermehrt sich, wenn es in enger Verbindung mit der Zelloberfläche von Säugetieren steht. Trotz vieler Subkulturversuche und anderer Modifikationen gelang es dem System von Fieldsteel et al. nicht, ein kontinuierliches In-vitro-Wachstum zu fördern.
Im Jahr 2018 berichtete unser Labor, dass die Verwendung eines modifizierten Mediums namens TpCM-2 (bei dem Eagles MEM durch ein komplexeres Gewebekulturmedium, CMRL 1066, ersetzt wurde) T. pallidum die erforderlichen Nährstoffe lieferte, um eine konsistente Langzeitkultur zu ermöglichen17. Bisher hat diese Modifikation zu einer konsistenten, kontinuierlichen Kultur von mindestens 5 Stämmen von T. pallidum subsp. pallidum (Nichols, SS14, Mexico A, UW231B und UW249B) und einem Stamm von T. pallidum subsp. endemicum (Bosnien A)18,19 geführt. Als Beispiel wird der Nichols-Stamm nun seit über 6 Jahren kontinuierlich in vitro kultiviert. Bisher waren Versuche, Frambösie-Isolate (T. pallidum subsp. pertenue) oder T. paraluiscuniculiin vitro zu kultivieren, erfolglos18. Das TpCM-2-System erfordert immer noch das Vorhandensein von Sf1Ep-Zellen, niedrige Sauerstoffkonzentrationen und eine Inkubation bei 34 °C, was das System komplexer macht als die meisten Bakterienkulturtechniken. Dieses modifizierte T. pallidum-Kultursystem war jedoch nützlich für die weitere Definition der Wachstumsanforderungen des Bakteriums18, die Bestimmung minimaler inhibitorischer Konzentrationen (MICs) von antimikrobiellen Verbindungen und Peptiden20,21,22,23,24,25, die Vermehrung neuer Stämme aus Patientengewebeaspiraten26 und die Isolierung klonaler Populationen der Organismus27, Charakterisierung des antigenen Variationssystems tprK 27,28, Untersuchung der Genexpression29 und Durchführung von Mutationsanalysen 30,31,32.
Hier beschreiben wir die aktuellen Methoden zur Kultivierung von T. pallidum in vitro. Wir hoffen, dass diese Informationen dazu beitragen werden, die breitere Anwendung dieser In-vitro-Kulturtechnik zur Verbesserung der Diagnose, Behandlung und Prävention von Syphilis und verwandten Treponemalinfektionen zu erleichtern.
Protokoll
HINWEIS: Alle Schritte erfordern die Verwendung einer aseptischen Technik sowie steriler Materialien und Reagenzien. Die Verwendung einer Laminar-Flow-Haube für Gewebekulturen wird empfohlen, um sowohl a) die Exposition des Personals gegenüber infektiösem Material als auch b) die Möglichkeit einer mikrobiellen Kontamination der Kulturen zu reduzieren.
1. Aufbau von Sf1Ep-Zellbeständen
HINWEIS: Sf1Ep Baumwollschwanz-Kaninchen-Epithelzellen können als gefrorene Bestände aus der American Type Culture Collection erworben werden (siehe Materialtabelle). Das langsame Wachstum und die niedrige Stoffwechselrate von Sf1Ep-Zellen scheinen der Schlüssel zu ihrer Fähigkeit zu sein, das langfristige Überleben und Wachstum von T. pallidumzu unterstützen 33; Daher wird eine Substitution mit anderen Säugetierzellkulturen nicht empfohlen. Sf1Ep-Zellen sind keine immortalisierte Zelllinie und können nur 25-30 Passagen in Kultur aufbewahrt werden. Daher ist es wichtig, einen gefrorenen Bestand an Sf1Ep-Zellen mit niedrigem Durchgang für die zukünftige Verwendung vorzuhalten. Immortalisierte Sf1Ep-Linien entstehen gelegentlich während der Langzeitkultur von Sf1Ep-Zellen. (unveröffentlichte Beobachtungen). Diese Linien wachsen oft schneller und sind einfacher zu handhaben; Manchmal verlieren sie jedoch die Fähigkeit, das Wachstum von T. pallidum zu unterstützen. Immortalisierte Sf1Ep-Leinen können verwendet und dann ersetzt werden, wenn die Spirochäten langsam zu wachsen beginnen.
- Bereiten Sie ein Sf1Ep-Zellmedium vor und wärmen Sie es in einem 37 °C und 5 % CO2 -Inkubator vor.
HINWEIS: Das Sf1Ep-Zellmedium besteht aus Eagle's MEM, ergänzt mit 10% FBS, 1x MEM nicht-essentiellen Aminosäuren, 2 mM L-Glutamin und 1 mM Natriumpyruvat. (siehe Materialtabelle). Das Medium sollte filtersterilisiert werden und kann bis zu 2 Monate bei 4 °C gelagert werden. Antibiotika (wie Penicillin und Streptomycin) sollten nicht im Sf1Ep-Zellmedium verwendet werden, da die Verschleppung selbst von Spuren der Antibiotika das Wachstum von T. pallidum beeinträchtigt. - Tauen Sie das gefrorene Sf1Ep-Material schnell bei 37 °C auf. Wischen Sie die Außenseite des Fläschchens mit 70 % Ethanol ab.
- Geben Sie 1 ml Sf1Ep-Zellmedium in das Kryoröhrchen und mischen Sie es vorsichtig. Geben Sie das Medium/Zell-Stammgemisch in ein steriles konisches 15-ml-Zentrifugenröhrchen mit 5 ml Sf1Ep-Zellmedium und mischen Sie es vorsichtig.
- Pelletieren Sie die Zellen durch Zentrifugation bei 100 x g für 7 min. Entfernen und entsorgen Sie den Überstand, wobei darauf zu achten ist, dass das Zellpellet nicht beschädigt wird.
- Die aufgetauten Sf1Ep-Zellen werden vorsichtig in 15 ml frischem Sf1Ep-Zellmedium resuspendiert und in einen T75-Gewebekulturkolben überführt.
HINWEIS: Die Rückgewinnung der neu aufgetauten Sf1Ep-Zellen wird durch Zentrifugation verbessert, um das DMSO zu entfernen, das zum Einfrieren der Zellen verwendet wurde. Die Schritte 1.4-1.7 können jedoch weggelassen werden und die aufgetauten Zellen aus Schritt 3 können direkt in einen T75-Gewebekulturkolben mit 14 ml Sf1Ep-Zellmedium ausgesät werden. Nach der Inkubation über Nacht wird die Hälfte des Mediums durch frisches Sf1Ep-Medium ersetzt, um das restliche DMSO zu verdünnen. - Inkubieren Sie die Sf1Ep-Kulturen in einem befeuchteten Standard-Gewebekultur-Inkubator bei 37 °C, 5 % CO2. Lockern Sie die Kappen von nicht belüfteten Gewebekulturkolben, um den richtigen mittleren pH-Wert aufrechtzuerhalten.
2. Passieren von Sf1Ep-Zellen
HINWEIS: Das Wachstum der Sf1Ep-Zellkultur wird mit einem inversen Mikroskop unter Verwendung einer Phasenkontrastoptik überwacht. Normalerweise dauert es etwa eine Woche, bis die Zellen nahezu konfluenzfähig sind. Wenn die Zellen eine Konfluenz von ~90% erreichen, können sie passieren, für die Kultivierung von T. pallidum oder die Zubereitung von gefrorenen Brühen verwendet werden. Die Lebensdauer der Kultur kann auf zwei Wochen verlängert werden, indem die Hälfte des Nährmediums nach einer Woche Kultur ausgetauscht wird.
- Das Wachstumsmedium Sf1Ep wird aspiriert und aus dem Kolben verworfen. Spülen Sie die Zellschicht mit 5 mL sterilem PBS bei Raumtemperatur (RT) und aspirieren und verwerfen Sie die PBS-Spülung.
- Geben Sie 2,5 ml Trypsin-EDTA in den Kolben und verschließen Sie die Kappe. Den Kolben hin und her bewegen, um die Zellschicht mit Trypsin-EDTA zu bedecken, und den Kolben bei 37 °C 5 min inkubieren.
- Klopfen Sie vorsichtig auf den Kolben, um die Zellen zu lösen. Beobachten Sie unter einem inversen Mikroskop, um die Ausbreitung der Sf1Ep-Zellen zu bestätigen.
- Fügen Sie 5 ml Sf1Ep-Wachstumsmedium hinzu und schütteln Sie den Kolben, um sich mit dem Trypsin-EDTA zu vermischen und die Wirkung des Trypsins zu stoppen. Entfernen Sie die suspendierten Sf1Ep-Zellen in ein steriles konisches Röhrchen.
- Quantifizieren Sie die Zellen mit einem Hämozytometer oder einem automatisierten Zellzähler.
- Um funktionierende Zellbestände zu erhalten, überführen Sie ein Aliquot (0,5-1,0 ml oder ~8 x 105 Zellen) des Mediums/Trypsin-EDTA/Zell-Gemischs in einen neuen T75-Gewebekulturkolben mit 15 ml frischem Sf1Ep-Medium.
- Für die T . pallidum-Kultur verdünnen Sie die Zellen in Sf1Ep-Medium auf 0,25-0,5 x 105 Zellen/ml und säen Sie sie in geeignete Kulturgefäße aus (Tabelle 1).
- Um Sf1Ep-Zellen einzufrieren, in einer Tischzentrifuge bei 100 x g für 7 min drehen. Entfernen Sie vorsichtig den Überstand, ohne das Küvettenpellet zu stören. Resuspendieren Sie das Zellpellet in Sf1Ep-Medium, das mit 10 % DMSO in Gewebekulturqualität ergänzt wird.
- Verteilen Sie 1 ml der Zellsuspension auf jedes Kryofläschchen und frieren Sie es über Nacht bei -70 °C bis -80 °C in einem isolierten Behälter (z. B. einem Styropor-Reagenzglashalter) ein, um die Lebensfähigkeit zu verbessern, bevor Sie die Fläschchen in ein kryogenes Gefäß mit flüssigem Stickstoff überführen.
3. Anbau von T. pallidum
VORSICHT: Alle Unterarten und Stämme von T. pallidum sind für den Menschen pathogen und als Krankheitserreger der Biosicherheitsstufe 2 (BSL-2)34 eingestuft. Zum Schutz des Personals sind geeignete Maßnahmen erforderlich; Dazu gehören die Verwendung von Handschuhen und anderer persönlicher Schutzausrüstung (PSA) sowie die Desinfektion von Oberflächen, Materialien und Flüssigkeiten, die möglicherweise T. pallidum ausgesetzt sind. T. pallidum lässt sich leicht inaktivieren, wenn man 70%igem Ethanol oder handelsüblichen Desinfektionsmitteln ausgesetzt wird. Die konsequente Verwendung von Laminar-Flow-Hauben für den Umgang mit Proben, die T. pallidum enthalten, wird empfohlen.
HINWEIS: T. pallidum ist ein mikroaerophiler Organismus, der durch einige Stunden Exposition gegenüber atmosphärischen Sauerstoffkonzentrationen 9,16,35 abgetötet werden kann. Daher wird empfohlen, den Umgang mit T. pallidum an der Luft nach Möglichkeit auf weniger als eine Stunde zu beschränken. Außerdem sollte das TpCM-2-Medium in 1,5 % O2, 5 % CO2 und dem Rest N2 voräquilibriert werden, und kräftiges Rühren (z. B. Verwendung eines Wirbels) sollte begrenzt werden. Da die T. pallidum-Kultur in der Regel ohne Antibiotika durchgeführt wird, ist besondere Vorsicht geboten, um eine Kontamination mit Bakterien oder Pilzen zu vermeiden. Das Sf1Ep-TpCM-2-Verfahren zur Kultivierung von T. pallidum ist in Abbildung 1 zusammengefasst und umfasst mehrere Schritte, einschließlich der Aussaat von Kulturgefäßen mit Sf1Ep-Zellen, der Vorbereitung des TpCM-2-Mediums und der Inokulation der Kulturen mit T. pallidum. Hitzeinaktiviertes fötales Rinderserum (FBS) ist eine kritische Komponente des Mediums, und seine Wirksamkeit variiert je nach Anbieter und Charge19. Ein Vorab-Screening von FBS-Chargen auf Wirksamkeit ist erforderlich.
- Wählen Sie die entsprechende Kulturgröße aus.
HINWEIS: Die T. pallidum-Kultur ist skalierbar von großen Formaten (z. B. 75-cm-2-Kolben mit ~1 x 109T. pallidum pro Kultur) bis hin zu 96-Well-Platten (geeignet für Klonierungsexperimente)17,18,19,27.- Bei der Anpassung der Kulturgröße ist die Anzahl der pro Kultur beimpften Sf1Ep-Zellen und T. pallidum sowie die benötigte Menge an Medium zu berücksichtigen, wie in Tabelle 1 dargestellt. Verwenden Sie Kolben mit belüfteten Verschlüssen, da sie eine freie Zirkulation der Gase mit geringerem Volumenverlust durch Verdampfung ermöglichen.
- Verwenden Sie das 6-Well-Plattenformat für Erstkulturen, da es zweckmäßig ist, dreifache Replikate und zusätzliche Wells einzuschließen, falls eine mikrobielle Kontamination auftritt.
- Säen Sie Sf1Ep-Zellen 1-2 Tage vor dem Experiment.
- Bereiten Sie eine Suspension von Sf1Ep-Zellen durch Trypsinisierung von Stammkulturen vor, wie in Schritt 2.7 beschrieben.
- Bestimmen Sie die Konzentration von Sf1Ep-Zellen in der Suspension mit einem Hämazytometer oder einem automatisierten Zellzähler.
- Geben Sie die entsprechende Anzahl von Sf1Ep-Zellen und Sf1Ep-Medium (Tabelle 1) in jede Kultur. Inkubieren Sie die Kulturen bei 37 °C in einem Standard-Gewebekultur-Inkubator mit 5 % CO2 bis zur Verwendung.
- Bereiten Sie TpCM-2 1 Tag vor dem Versuch vor.
HINWEIS: TpCM-2 kann mehrere Monate bei -20 °C hergestellt und gelagert werden. Das Medium sollte am Tag vor dem Versuch aufgetaut und im sauerstoffarmen Inkubator äquilibriert werden.- Sterile Lösungen für die Bestandteile von TpCM-2 (Tabelle 2) kommerziell beschaffen oder aus trockenen Reagenzien herstellen und filtrieren. Lagern Sie die Lösungen bis zu 2 Monate bei 4 °C. Stellen Sie den pH-Wert des MOPS-Puffers vor der Filtersterilisation auf 7,5 ein. Andernfalls müssen die Komponenten oder das endgültige TpCM-2 nicht pH-angepasst werden.
HINWEIS: Die Verwendung von sterilem destilliertem Wasser in Gewebekulturqualität für die Herstellung der Mediumkomponenten wird empfohlen. - Kombinieren Sie die in Tabelle 2 aufgeführten Reagenzien in einem sterilen Behälter und fügen Sie Dithiothreitol (DTT) als trockenes Pulver hinzu (um die Oxidation zu minimieren). Skalieren Sie die Mengen jeder Komponente nach oben (oder unten), um die benötigte Menge an TpCM-2 herzustellen. Mischen und sterilisieren Sie das Medium vorsichtig mit einer 0,22-μm-Filtereinheit.
- Der Deckel des Kolbens, der das TpCM-2 enthält, wird gelöst. Das Medium wird voräquilibriert, indem es in ein anaerobes (Brauer-)Gefäß gegeben wird, dreimal evakuiert und mit einem 95%igen N2, 5 % CO2 -Gasgemisch nachgefüllt wird und dann nach der endgültigen Evakuierung mit 1,5 % O2, 5 % CO2 gefüllt wird. Ein Beispiel für ein System zur Durchführung dieses Gasaustauschprozesses ist in Abbildung 2 dargestellt.
- Übertragen Sie das Medium schnell in einen Tri-Gas-Inkubator, der so eingerichtet ist, dass er 1,5 % O2 und 5 % CO2 liefert und die N2-Atmosphäre bei 34 °C ausgleicht. Alternativ kann das anaerobe Gefäß, das das Medium enthält, nach dem in 3.3.3 beschriebenen Gasaustausch verschlossen und in einen Standard-Inkubator überführt werden.
- Sterile Lösungen für die Bestandteile von TpCM-2 (Tabelle 2) kommerziell beschaffen oder aus trockenen Reagenzien herstellen und filtrieren. Lagern Sie die Lösungen bis zu 2 Monate bei 4 °C. Stellen Sie den pH-Wert des MOPS-Puffers vor der Filtersterilisation auf 7,5 ein. Andernfalls müssen die Komponenten oder das endgültige TpCM-2 nicht pH-angepasst werden.
- Am Morgen des Experiments werden die Sf1Ep-Kulturen mit einem inversen Mikroskop überprüft. Stellen Sie sicher, dass die Zellen angeheftet und zu 5 % bis 10 % konfluent sind. Entfernen Sie das Medium aseptisch.
- Spülen Sie die Vertiefungen kurz mit einem kleinen Volumen (0,2 mL bis 2 mL, je nach Gefäßgröße) des voräquilibrierten TpCM-2, nehmen Sie die Spülung heraus und fügen Sie die entsprechende Menge TpCM-2 hinzu (Tabelle 1). Die Platten werden in einer Atmosphäre von 1,5 % O2 und 5 % CO2 äquilibriert und die N2-Atmosphäre bei 34 °C für 3-4 h wie zuvor beschrieben ausgeglichen.
- Die Platten werden in eine Laminar-Flow-Haube überführt und mit der entsprechenden Anzahl (Tabelle 1) T . pallidum aus gefrorenen Brühen oder trypsinisierten Zubereitungen aus frisch geernteten Kulturen (wie unten beschrieben) beimpft. Frisch zubereitete oder gefrorene Brühe, die aseptisch von infizierten Kaninchen13 gesammelt wurde, kann ebenfalls verwendet werden. Die Platten werden wie in 3.3.3 beschrieben wieder ins Gleichgewicht gebracht und die Kulturen in einer Atmosphäre von 1,5 % O2 und 5 % CO2 inkubiert und die N2-Atmosphäre bei 34 °C ausgeglichen.
4. Ernte und Passage von T. pallidum-Kulturen
HINWEIS: Da der Großteil von T. pallidum in Kultur an der Oberfläche der Sf1Ep-Zellen gebunden ist, ist es notwendig, die Treponeme von den Säugetierzellen zu trennen, um sie zu gewinnen und eine genaue Zählung der Organismen zu erhalten. Eine solche "Ernte" und der Übergang zu frischen Kulturen erfolgt in der Regel am 7. Tag der Kultur. Das hier beschriebene Verfahren gilt für 6-Well-Platten; Die Menge der verwendeten Trypsin-EDTA-Lösung wird je nach Größe des Kulturformats nach oben oder unten angepasst 17,19,27.
- Nehmen Sie die Kulturen zum Zeitpunkt der Ernte aus dem Brutschrank. Untersuchen Sie die Sf1Ep-Zellschicht in jeder Vertiefung mit einem inversen Phasenkontrastmikroskop und zeichnen Sie die Zelldichte (z. B. 80 % konfluent) und das Aussehen auf. Beachten Sie auch die Farbe des TpCM-2; Der Resazurin-Indikator wechselt aufgrund des niedrigeren pH-Werts oft von rosa zu gelb.
- Pipettieren Sie das Medium aus jeder Vertiefung in ein steriles konisches 15-ml-Röhrchen, wobei Sie für jede Vertiefung separate Pipetten verwenden, um eine Kreuzkontamination zu vermeiden. Spülen Sie jede Probe gut mit 0,35 ml vorgewärmter Trypsin-EDTA-Lösung aus und geben Sie die Spülung in das Medium.
- Geben Sie weitere 0,35 ml Trypsin-EDTA-Lösung in jede Vertiefung und inkubieren Sie die Platte 5 Minuten lang in einem Standard-Inkubator bei 37 °C. eine niedrige O2 -Atmosphäre ist für diesen kurzen Zeitraum nicht erforderlich.
- Überprüfen Sie, ob die Sf1Ep-Zellen aufgerundet und abgelöst werden, was auch mit der Dissoziation von T. pallidum von den Säugetierzellen korreliert. Überwachen Sie diesen Prozess mit dem inversen Mikroskop und stellen Sie bei Bedarf zusätzliche Zeit oder Trypsin-EDTA-Lösung zur Verfügung. Der Dissoziationsprozess wird erleichtert, indem die Seite der immobilisierten Platte vorsichtig mit einem Kunststoff-Reagenzglasgestell oder einem ähnlichen Gegenstand abgeklopft wird.
- Pipettieren Sie das reservierte Medium und spülen Sie es in die Vertiefung, um das dissoziierte T. pallidum und die Zellen zu entnehmen. Notieren Sie das entnommene Gesamtvolumen, um die Ausbeute pro Kultur zu berechnen.
- In den meisten Experimenten wird ein festgelegtes Volumen des geernteten T. pallidum auf Kulturplatten mit frischen Sf1Ep-Zellen und TpCM-2 übertragen. In solchen Fällen ist etwa 1/20des Kulturvolumens zu übertragen (z. B. 200 μl für eine 4-ml-Plattenkultur mit 6 Vertiefungen); Stellen Sie diese Lautstärke nach oben oder unten ein, je nachdem, ob der T. pallidum-Stamm schnell oder langsam wächst. Entfernen Sie die Sf1Ep-Zellen im Inokulum durch Zentrifugation bei 100 x g für 5 min, aber dieser Schritt ist für Routinetransfers nicht erforderlich.
- Unmittelbar nach dem Beimpfen der Platten für ein Experiment wird die Atmosphäre in den Platten durch den Evakuierungs- und Nachfüllprozess ausgetauscht (Schritt 3.3.3). Inkubieren Sie die Platten bei 34 °C im Brewerglas oder überführen Sie sie in einen Tri-Gas-Inkubator.
- Zählen Sie T. pallidum durch Dunkelfeldmikroskopie mit einer Helber-Zählkammer oder einem ähnlichen Gerät gemäß den Anweisungen des Herstellers.
HINWEIS: Die Helber-Kammer ist ein kalibrierter Glasobjektträger und Deckglas, der die Genauigkeit und Reproduzierbarkeit der Keimzählungen erheblich verbessert. Die Kammer lässt sich leicht desinfizieren, reinigen und mit 70 % Ethanol und Papiertüchern trocknen und kann unbegrenzt wiederverwendet werden. Idealerweise sollte das Dunkelfeldmikroskop über ein 40x Objektiv und 15x Okulare verfügen. Führen Sie Duplikatzählungen für jede Kultur durch und erfassen Sie die Anzahl der beweglichen und unbeweglichen T. pallidum sowie alle aufzuzeichnenden morphologischen Veränderungen. Die quantitative PCR (qPCR) kann auch in Fällen verwendet werden, in denen eine genaue Quantifizierung und Bestimmung der Motilität nicht erforderlich ist17,24. - In Experimenten, in denen eine Behandlung mit Trypsin möglicherweise nicht wünschenswert ist (z. B. bei der Untersuchung des Proteingehalts von T. pallidum), ist ein EDTA-Dissoziationsmedium zu verwenden, um das T. pallidum und die Zellmonoschicht zu dissoziieren17,19.
HINWEIS: Das Dissoziationsmedium besteht aus FBS, das gegen phosphatgepufferte Kochsalzlösung (PBS) dialysiert wurde, oder Earle's Basic Salt Solution (EBSS) ohne Calciumchlorid und Magnesiumchlorid, um zweiwertige Kationen in einem vereinfachten T. pallidum-Kulturmedium zu entfernen (Tabelle 2). Dieses Verfahren kann einen längeren Zeitraum (bis zu 30 Minuten) oder eine wiederholte Behandlung zur vollständigen Dissoziation in Anspruch nehmen.
5. Einfrieren und Lagern von T. pallidum-Kulturen
HINWEIS: T. pallidum kann unbegrenzt bei oder unter -70 °C gelagert werden, wobei die Lebensfähigkeit nach dem Auftauen typischerweise 50 % bis 90 % beträgt.
- Frieren Sie T. pallidum-Kulturen bei der Ernte unter Zugabe von 10 % (v/v) Glycerin ein. Dispergieren Sie das Glycerin durch sanftes Pipettieren oder Inversion in der Zubereitung. Verteilen Sie dann die Zubereitung in 1-2 mL Aliquots in Gefrierfläschchen mit Schraubverschluss und stellen Sie die Fläschchen sofort in einen -80 °C Gefrierschrank oder einen flüssigen N2 Gefrierschrank.
- Um eine T. pallidum-Kultur aus gefrorenem Bestand zu starten, bereiten Sie zunächst geeignete Kulturgefäße vor, die Sf1Ep-Zellen und TpCM-2 enthalten, wie in Abschnitt 3 beschrieben. Tauen Sie das Fläschchen mit der gefrorenen Brühe von T. pallidum schnell auf; Hilfreich ist dabei die vorsichtige Verwendung eines 37 °C warmen Wasserbades oder Heizblocks.
- Füllen Sie dann das aufgetaute Präparat in das/die Kulturgefäß(e) um. Stellen Sie sicher, dass das Verhältnis des gefrorenen Stoffvolumens zum Tp-CM2-Medium 1:5 oder größer beträgt, um eine ausreichende Verdünnung von Glycerin zu gewährleisten und das Überleben und Wachstum von T. pallidum zu fördern.
- Die Kultur wird 7 Tage lang unter mikroaeroben Bedingungen inkubiert und wie in Abschnitt 4 beschrieben in frische Kulturen überführt.
6. Erzeugung isogener Klone von T. pallidum
HINWEIS: Dieses Verfahren ist in einer früheren Studieausführlich beschrieben 27.
- In einem typischen Experiment werden zwei 96-Well-Platten mit 1000 Sf1Ep-Zellen und 200 μl TpCM-2 pro Well vorbereitet und voräquilibriert, wie in Abschnitt 3 beschrieben.
HINWEIS: Ein Mehrkanal-Pipettierer mit 200 μl und kompatible sterile Einweg-Reagenzreservoire vereinfachen die Inokulation von Sf1Ep-Zellen, den Austausch von Medien und die Inokulationsschritte erheblich. - Die Konzentration von T. pallidum in einem frisch geernteten Präparat wird mit einem Dunkelfeldmikroskop und einer Helber-Kammer quantifiziert (Schritt 4.8). Die T. pallidum-Suspension in TpCM-2 wird verdünnt, um zwei Präparate mit Konzentrationen von 10 Treponemen/ml und 40 Treponemen/ml herzustellen; 10 ml jedes Präparats sind mehr als ausreichend, um eine 96-Well-Platte mit jeder Verdünnung zu beimpfen. Bereiten Sie als Kontrolle 1 ml einer anderen Verdünnung vor, die 2 x 103 T. pallidum/ml enthält.
- Mit einer Standard-Einkanalpipette oder einer Mehrkanalpipette werden 50 μl pro Vertiefung des 10 T. pallidum/ml-Präparats in eine der vorbereiteten 96-Well-Platten inokuliert, wobei zwei Kontrollvertiefungen weggelassen werden. Wiederholen Sie diesen Vorgang mit dem 40 T. pallidum/ml-Präparat und der anderen Platte. In den beiden Kontrollvertiefungen in jeder Platte wird die Verdünnung von 2 x 103 T. pallidum/ml inokuliert. Bei diesem Verfahren werden Platten mit (durchschnittlich) 0,5 oder 2 T. pallidum pro Vertiefung sowie Positivkontrollvertiefungen mit 100 T. pallidum hergestellt.
HINWEIS: Die Plattierungseffizienz von T. pallidum ist unter diesen Bedingungen gering, so dass selbst Vertiefungen, die mit ~2 Organismen besät sind, wahrscheinlich klonale Populationen ergeben. - Die Platten werden mit dem niedrigenO2-Gasgemisch äquilibriert (Schritt 3.3.3) und in einem Brewerglas oder Tri-Gas-Inkubator bei 34 °C inkubiert.
- Entfernen Sie nach 7 Tagen 100 μl Medium aus jeder Kulturvertiefung und ersetzen Sie es durch 100 μl frisches, äquilibriertes TpCM-2. Überprüfen Sie die Lebensfähigkeit und das Wachstum von T. pallidum in den Kontrollvertiefungen durch Dunkelfeldmikroskopie und Enumeration, um sicherzustellen, dass die Kulturbedingungen die Vermehrung von T. pallidum unterstützen.
HINWEIS: Achten Sie darauf, für jede Vertiefung eine neue Pipettenspitze zu verwenden, um eine Kreuzkontamination von klonalen Kulturen zu vermeiden. - Nach 14 Tagen werden 50 μl des Kulturüberstands aus jeder Vertiefung auf frische Platten überführt, die wie in Schritt 6.1 vorbereitet wurden.
- Wiederholen Sie die abwechselnde Fütterung und Passage nach Bedarf an den Tagen 21 und 28.
- Überwachen Sie das Vorhandensein von T. pallidum in jeder Vertiefung mit Dunkelfeldmikroskopie oder qPCR26.
HINWEIS: Aufgrund der langsamen Wachstumsrate von T. pallidum und des notwendigen Verlusts von Organismen während der Fütterung und des Transfers sind die mit 0,5 oder 2 T. pallidum besäten Vertiefungen in der Regel bis zum 28. Tag oder danach bei keiner der beiden Methoden positiv. - Sobald positive Wells identifiziert sind, trypsinisieren Sie diese Wells und übertragen sie zur weiteren Expansion auf 24-Well-Platten. Bestimmung der Klonalität anhand des Überwiegens einer einzelnen tprK-Sequenz und des Vorhandenseins einzelner Sequenzen an heterogenen Stellen im Elternstamm27.
Ergebnisse
Unter den beschriebenen Bedingungen behält T. pallidum typischerweise eine Motilität von >90 % bei und vermehrt sich logarithmisch mit einer Verdopplungszeit von 33 h bis 45 h für etwa 7 Tage, bevor es in die stationäre Phase eintritt (Abbildung 3). Im Laufe von 1 Woche durchlaufen die Spirochäten etwa 4-5 Verdopplungen (Abbildung 4). ). Darüber hinaus können verschiedene Stämme von T. pallidum unterschiedlich schnell wachsen. Stämme der SS14-Gruppe von T. pallidum neigen dazu, langsamere Verdopplungszeiten zu haben als die der Nichols-Gruppe17.
Die Fütterung von Kulturen kann die Kulturzeit um mehrere Tage verlängern, aber die Sf1Ep-Zellschicht versagt oft nach einer Woche Kultur. Darüber hinaus erreichen die Treponeme eine Obergrenze für Organismen von etwa 5 x 107/ml. Kulturen, die in Abständen von 7 Tagen übertragen werden, setzen in der Regel die logarithmische Multiplikation mit geringer oder keiner Verzögerungsphase fort. Organismen in der stationären Phase sind oft schwer zu passieren.
Die meisten T. pallidum sind an die Sf1Ep-Zellen gebunden. Es verbleibt jedoch so viel T. pallidum im Überstand, dass die Proben des Mediums regelmäßig entnommen werden können, um die Lebensfähigkeit und Vermehrung zu überprüfen. Wenn eine sorgfältige Quantifizierung erforderlich ist, sollte das Volumen des entnommenen Mediums gemessen, die Anzahl von T. pallidum quantifiziert und die Gesamtzahl der entfernten Organismen zu den endgültigen Zählungen bei der Ernte addiert werden.
In früheren Studien betrug die Klonierungseffizienz (Anzahl der positiven Kulturen pro geimpftem Organismus) 12,5 % für 2 T. pallidum , die pro Vertiefung geimpft wurden, und 6,7 % für 0,5 T. pallidum , die pro Vertiefung geimpft wurden27. Daher ist es wahrscheinlich, dass jede positive Vertiefung das Auswachsen eines einzelnen Organismus an einer dieser Inokula darstellt. Die Klonalität der resultierenden Populationen muss jedoch verifiziert werden, indem die Kultur an Stellen, die in der Elternkultur heterogen sind, auf Homogenität untersucht wird. Der eindeutigste Weg, um nachzuweisen, dass die Kultur isogen ist, ist die Sequenzierung des gesamten Genoms27.
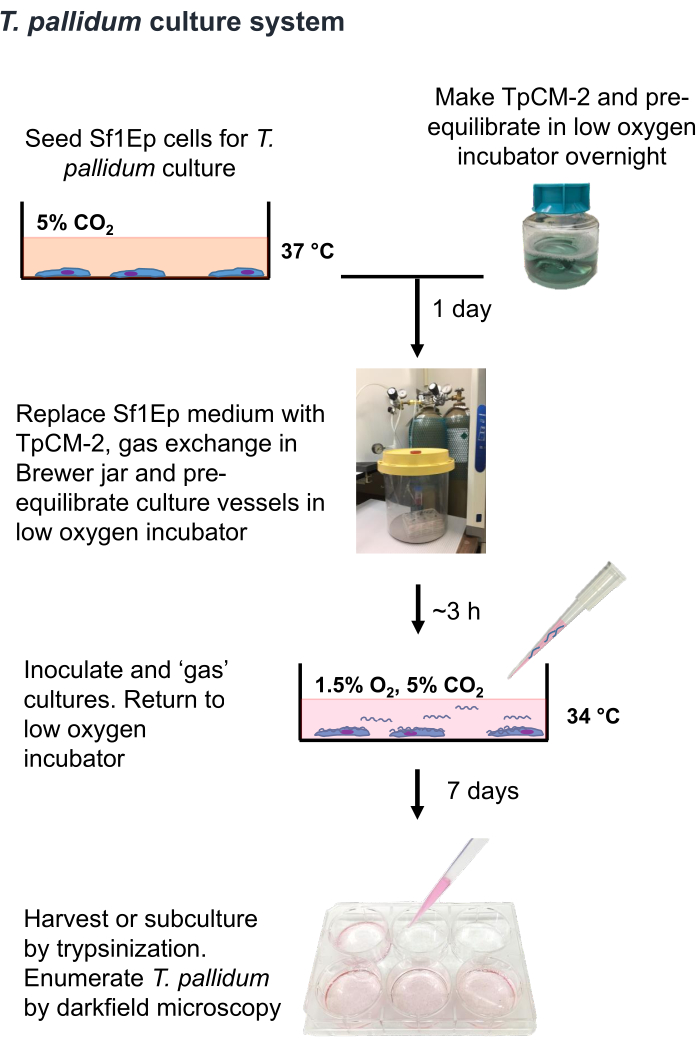
Abbildung 1: Flussdiagramm des In-vitro-Kultivierungsverfahrens von T. pallidum . Diese Abbildung wurde mit Genehmigung von Edmondson und Norris (2021)19 nachgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
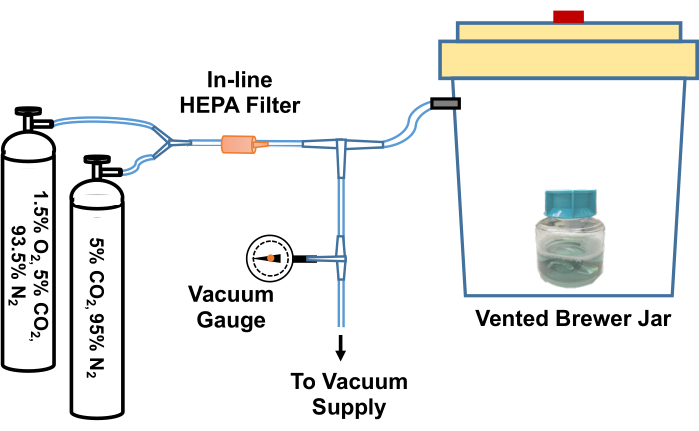
Abbildung 2: Diagramm des Systems zur Äquilibrierung von Reagenzien der T . pallidum-Kultur in einer sauerstoffarmen Umgebung. Eine Entlüftung eines Brauerglases wird über ein T-Gelenk mit einer Vakuumquelle (z. B. einem Hausvakuum) und mit Gasflaschen verbunden, die kundenspezifische Gasgemische enthalten (5 % CO2, Balance Stickstoff und 1,5 % O2, 5 % CO2, Balance Stickstoff). Ein Inline-Vakuummeter misst das im Gefäß gezogene Vakuum. Das Vakuum wird im Gefäß auf ca. -58 kPa gezogen. Das evakuierte Gefäß wird dann langsam wieder mit den Gasgemischen befüllt. Das Brauglas wird dreimal mit 5 % CO2 nachgefüllt, vor einer abschließenden Evakuierung mit Stickstoff ausgeglichen und mit 95 % N2, 5 % CO2 und 1,5 % O2 aufgefüllt. Kulturen oder Medien werden dann aus dem Glas entnommen und schnell in den sauerstoffarmen Inkubator überführt. Alternativ kann der Schlauch zwischen dem Brewerglas und dem ersten T-Gelenk fest geklemmt, der Schlauch vom T-Gelenk getrennt und das gesamte Brewerglas in einen 34 °C heißen Inkubator überführt werden. Diese Abbildung wurde mit Genehmigung von Edmondson und Norris (2021)19 nachgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 3: Wachstumskurven von T. pallidum , kultiviert mit Sf1Ep-Zellen mit TpCM-2-Medium. Parallele dreifache Kulturen wurden mit T. pallidum besiedelt. Zu jedem Zeitpunkt wurden Replikate geerntet; Die Ergebnisse stellen den Mittelwert + SEM für diese Kulturen dar. (A) Die Veränderungen von T. pallidum pro Kultur und (B) prozentuale Motilität sind dargestellt. Diese Abbildung wurde mit Genehmigung von Edmondson et al.18 angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4: Beispiel für die Passage einer In-vitro-Kultur von T. pallidum, Nichols-Stamm. Parallele dreifache Kulturen wurden mit T. pallidum besät und wöchentlich in einer Verdünnung von 1:20 verabreicht. Das Sägezahndiagramm zeigt die Anzahl von T. pallidum pro Kultur und die Anzahl, die zu jedem Zeitpunkt in neue Kulturen übertragen wurde. Die Ergebnisse stellen den Mittelwert ± SEM für drei biologische Replikate dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Mittleres Volumen und Aussaatverhältnis für Kulturgefäße. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Medien für den Anbau von T. pallidum . Alle Medien sollten nach der Aufbereitung filtersterilisiert werden. Das Sf1Ep-Medium kann bis zu zwei Monate bei 4 °C gelagert werden. TpCM-2 wird in der Regel einen Tag vor der Anwendung hergestellt. Das Dissoziationsmedium sollte aliquotiert und eingefroren werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das Sf1Ep-TpCM-2-System ist das erste verfügbare Verfahren, das die kontinuierliche In-vitro-Kultur von T. pallidum fördert. Das System ist aufgrund der extremen Wachstumsanforderungen dieses Organismus komplex: 1) komplexe Ernährungsbedürfnisse aufgrund begrenzter Biosynthesefähigkeiten; 2) ein wenig verstandener Bedarf an kleinen Sauerstoffmengen trotz hoher Empfindlichkeit gegenüber reaktiven Sauerstoffspezies 9,10,16,36; und 3) der derzeitige Bedarf an Sf1Ep-Zellen. Obwohl es verlockend ist, bei dem Verfahren Abstriche zu machen, wird empfohlen, die Schritte sorgfältig zu befolgen, bis eine erfolgreiche Langzeitkultur erreicht ist, bevor Änderungen ausprobiert werden. Wenn sich zusätzliche Informationen über den metabolischen Bedarf von T. pallidum ansammeln, kann es möglich sein, axenische Zustände zu entwickeln, die keine Sf1Ep-Zellen erfordern. Die In-vitro-Wachstumsrate wird jedoch wahrscheinlich langsam bleiben (mit einer minimalen Verdopplungszeit von 33 h bis 46 h, je nach Stamm)17,18, da sich T. pallidum auch während einer Säugetierinfektion mit einer geschätzten Verdopplungszeit von 30 h bis 33 h vermehrt37,38. Wie bei jeder Bakterienkultur wird empfohlen, niedrige Passagenbestände beizubehalten und Experimente mit T. pallidum-Kulturen durchzuführen, die weniger als 10 Passagen von diesen Stämmen entfernt sind, um eine "genetische Drift" und damit verbundene phänotypische Veränderungen aufgrund von Mutationen zu vermeiden.
Sf1Ep-Zellen versorgen die Treponeme offenbar mit essentiellen Nährstoffen oder enzymatischen Aktivitäten. Sie verbrauchen jedoch auch Nährstoffe (wie Glukose und Sauerstoff) und können toxische Bedingungen wie einen niedrigen pH-Wertvon 9,16,39 hervorrufen. Daher besteht ein Balanceakt zwischen genügend Sf1Ep-Zellen zur Unterstützung der Vermehrung von T. pallidum und der Verhinderung des Überwachsens und der Toxizität von Säugetierzellen. Hohe Passagezahlen von Sf1Ep-Zellen neigen dazu, schneller zu wachsen und verlieren manchmal die Fähigkeit, die Vermehrung von T. pallidum zu unterstützen. Daher sollte die Passagenummer von Sf1Ep überwacht werden, und die Zellbestände sollten regelmäßig durch gefrorene Präparate mit niedriger Passage ersetzt werden. Das Vorhandensein von Sf1Ep-Zellen erschwert auch die Untersuchung von T. pallidum-Eigenschaften wie DNA-, RNA- und Proteingehalt sowie Enzymaktivitäten. Die Entnahme der Kaninchenzellen ist bis zu einem gewissen Grad durch wiederholte Zentrifugation mit niedriger Geschwindigkeit (100 x g für 5 min) oder effektiver unter Verwendung von Percoll- oder Hypaque-Gradientenmöglich 40,41. Die Methoden der Gradientenzentrifugation sind jedoch in der Regel nur bei hohen Anzahlen von T. pallidum wirksam. Alternative Methoden zur Vermehrung von T. pallidum sind auf die Infektion von Versuchstieren wie Kaninchen beschränkt13,14. Dieser Ansatz ist ethisch begründet und ist immer teurer geworden; Das Kaninchenmodell ist jedoch sehr nützlich für die Untersuchung der Pathogenese von T. pallidum und der Immunantworten des Wirts. Darüber hinaus gibt es wahrscheinlich einige Unterschiede in der Genexpression, dem Wachstum oder dem Verhalten von T. pallidum während der In-vitro-Kultur und der Kanincheninfektion27.
Zum Zeitpunkt der Erstellung dieses Berichts war das Sf1Ep-TpCM-2-System in mindestens 6 Forschungsgruppen in den Vereinigten Staaten und Europa etabliert und hat zu 16 Veröffentlichungen mit Themen geführt, die von der grundlegenden Biologie und Genetik von T. pallidum bis hin zur antimikrobiellen Empfindlichkeit reichen. Der Wert der In-vitro-Kultur bei der Erforschung dieses rätselhaften Erregers wird wahrscheinlich mit zunehmender Nutzung und zukünftigen Verbesserungen zunehmen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch das Stipendium R01 AI141958 der United States National Institutes of Health/NIAID unterstützt. Die Geldgeber spielten keine Rolle beim Studiendesign, der Datenerhebung und -analyse, der Entscheidung über die Veröffentlichung oder der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
Referenzen
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten