Method Article
梅毒スピロヘータである 梅毒トレポネーマ・パリダムの体外培養手順
要約
このプロトコルは、哺乳類細胞との共培養における梅毒病原体Treponema pallidum subsp. pallidumのin vitro培養について説明しています。この方法はスケーラブルです。T. pallidumの大量産生やクローン培養物の生成に用いることができます。
要約
1世紀以上にわたり、梅毒を引き起こすらせん状の細菌である Treponema pallidum subsp. pallidumは、ウサギの精巣からの生物の接種と収穫によってのみ増殖することができました。2018年には、 T. pallidumin vitroで連続培養する方法について説明しました。このシステムは、TpCM-2と呼ばれる血清含有組織培養培地でウサギ上皮細胞(Sf1Ep細胞)と共培養します。培養中の T. pallidum の倍加時間は、自然感染中(約33-45時間)で発生すると推定される時間と同様です。この生物は、34°Cの低酸素(1.5%)環境下で1週間の標準通過時間で連続培養できます。 この記事では、 T. pallidumを培養するためのプロトコル、必要な組織培養細胞を成長および維持する方法、および希釈を制限することによって同質遺伝子株を生成する技術について説明します。 T. pallidumをin vitro で増殖させる能力は、この謎めいた生物を研究し理解するための新たな実験的手段を提供します。
概要
梅毒トレポネーマは、梅毒や他の霊長類に梅毒や関連する感染症を引き起こすらせん状の細菌(スピロヘータと呼ばれる)の一種です。梅毒は感染者に長期的な影響を与える重篤な疾患であり、世界中で毎年800万人以上の梅毒の新規症例が発生していると推定されています1。T. pallidumは、ヒトに引き起こす病気とわずかな遺伝的違いに基づいて、亜種pallidum(性感染症の梅毒を引き起こす)、亜種pertenue(ヨー)、および亜種endemicum(bejelまたは風土病の梅毒を引き起こす)2,3の3つの亜種に細分されています。T. pallidum subsp. pertenueは、ヒヒ、チンパンジー、その他の霊長類にも感染を引き起こします。Treponema paraluiscuniculi(Treponema paraluisleporidarumとも呼ばれる)と呼ばれる密接に関連する生物は、ウサギとノウサギに感染を引き起こします4,5。これらの細菌はすべて非常に密接に関連しており、ゲノムレベルで98%以上のDNA配列同一性を持っています6,7,8。それらはそれぞれ、サイズが約114万塩基対(Mb)の単一の小さな環状染色体を持っています。このT. pallidumグループのメンバーは、哺乳類の宿主と関連してのみ見られます。このように、それらは生存と成長のために宿主種に依存する絶対的な病原体である9,10。
T. pallidumをin vitroで培養する試みは、1905年にSchaudinnとHoffmanによって同定された直後から始まった11,12。しかし、これらの努力は、生物の一貫した再現性のある成長につながらなかった。その結果、T. pallidumの研究研究では、実験動物、最も一般的にはウサギ13,14の実験的感染による生物の繁殖が必要でした。1981年、Fieldsteelら15は、T. pallidum株の増殖を最大2週間促進する組織培養システムを導入しました。このシステムでは、Eagle's Minimum Essential Medium(MEM)と20%ウシ胎児血清(FBS)をベースにした改変組織培養培地(T. pallidum Culture Medium 1, TpCM-1)で、T. pallidumとSf1Epワタオウサギ上皮細胞を共培養しました。必要な他の培養条件は、1.5%のO2および5%のCO2 9,16を含む雰囲気中で34°Cでインキュベートすることであった。このシステムでは、T. pallidumはSf1Ep細胞に付着し、哺乳類細胞表面と密接に関連しているときに増殖します。多くの継代培養の試みやその他の変更にもかかわらず、Fieldsteelらのシステムは継続的なin vitro成長を促進することができませんでした。
2018年、当研究室では、TpCM-2と呼ばれる改変培地(EagleのMEMをより複雑な組織培養培地であるCMRL 1066に置き換えたもの)の使用により、T. pallidumが一貫した長期培養を可能にするために必要な栄養素を提供したと報告しました17。今日までに、この修飾により、少なくとも5株のT. pallidum subsp. pallidum(Nichols、SS14、Mexico A、UW231B、およびUW249B)とT. pallidum subsp. endemicum(ボスニアA)の1株の一貫した連続培養が行われました18,19。一例として、ニコルズ株は現在、6年以上にわたってin vitroで連続的に培養されています。これまでのところ、ヨー分離株(T. pallidum subsp. pertenue)またはT. paraluiscuniculiin vitroで培養する試みは成功していない18。TpCM-2システムは、Sf1Ep細胞の存在、低酸素濃度、および34°Cでのインキュベーションを必要とするため、システムはほとんどの細菌培養技術よりも複雑になります。しかし、この改変されたT. pallidum培養システムは、細菌の増殖要件18をさらに定義し、抗菌化合物およびペプチド20,21,22,23,24,25の最小阻害濃度(MIC)を決定し、患者組織吸引物26から新しい株を増殖させ、T. pallidumのクローン集団を単離するために有用であった生物27、tprK抗原変異システム27、28を特徴付け、遺伝子発現を調べる29、および突然変異分析30、31、32を行う。
ここでは、 現在のT. pallidumのin vitroでの培養方法について述べます。この情報が、この in vitro 培養技術が梅毒および関連するトレポネーマ感染症の診断、治療、予防の改善に広く適用されるのに役立つことを願っています。
プロトコル
注:すべてのステップでは、無菌技術と滅菌材料および試薬を使用する必要があります。組織培養層流フードの使用は、a)人員の感染性物質への曝露とb)培養物の微生物汚染の可能性の両方を減らすために推奨されます。
1. Sf1Ep細胞ストックの確立
注:Sf1Epワタオウサギ上皮細胞は、American Type Culture Collection(材料表参照)から凍結ストックとして購入できます。Sf1Ep細胞の増殖が遅く、代謝率が低いことが、T. pallidumの長期生存と成長を支える能力の鍵となるようです33。したがって、他の哺乳類細胞培養物による置換は推奨されません。Sf1Ep細胞は不死化細胞株ではなく、培養で25〜30継代しか維持できません。したがって、将来の使用のために、低継代のSf1Ep細胞の凍結ストックを維持することが重要です。不死化Sf1Ep系統は、Sf1Ep細胞の長期培養中に時折発生します。(未発表の観察)。これらのラインは、多くの場合、より速く成長し、扱いやすくなります。ただし、場合によっては、T.pallidumの成長をサポートする能力を失うことがあります。不死化されたSf1Epラインは、スピロヘータがゆっくりと成長し始めたときに使用し、交換することができます。
- Sf1Ep細胞培地を調製し、37°C、5%CO2 インキュベーターで予温します。
注:Sf1Ep細胞培地は、10%FBS、1x MEM非必須アミノ酸、2 mM L-グルタミン、および1 mMピルビン酸ナトリウムを添加したEagle's MEMで構成されています。( 資料の表を参照)。培地はフィルター滅菌し、4°Cで最大2か月間保存できます。抗生物質(ペニシリンやストレプトマイシンなど)は、微量の抗生物質のキャリーオーバーでさえT . pallidumの成長を妨げるため、Sf1Ep細胞培地では使用しないでください。 - 凍結したSf1Epストックを37°Cで素早く解凍します。 バイアルの外側を70%エタノールで拭きます。
- 1 mLのSf1Ep細胞培地をクライオバイアルに加え、穏やかに混合します。培地/細胞ストック混合物を、5 mLのSf1Ep細胞培地を含む滅菌済みの15 mL円錐形遠心チューブに加え、穏やかに混合します。
- 細胞を100 x g で7分間遠心分離してペレット化します。上清は、細胞ペレットを乱さないように注意しながら取り除いて捨ててください。
- 解凍したSf1Ep細胞を15 mLの新鮮なSf1Ep細胞培地に穏やかに再懸濁し、T75組織培養フラスコに移します。
注:新たに解凍したSf1Ep細胞の回収率は、細胞の凍結に使用されたDMSOを除去するための遠心分離によって改善されます。ただし、ステップ1.4〜1.7を省略し、ステップ3で解凍した細胞を、14mLのSf1Ep細胞培地を含むT75組織培養フラスコに直接播種することができます。一晩インキュベートした後、培地の半分を新鮮なSf1Ep培地と交換して、残留DMSOを希釈します。 - Sf1Ep培養物を標準的な加湿組織培養インキュベーターで37°C、5%CO2でインキュベートします。通気孔のない組織培養フラスコのキャップを緩めて、適切な培地のpHを維持します。
2. Sf1Ep細胞の継代
注:Sf1Ep細胞培養の増殖は、位相コントラスト光学系を用いて倒立顕微鏡でモニターします。通常、細胞がほぼコンフルエントに達するまでに約1週間かかります。細胞が~90%のコンフルエント度に達すると、細胞を通過させたり、 T. pallidum の培養や凍結ストックの調製に使用したりできます。培養後1週間後に培地の半分を交換することにより、培養寿命を2週間に延長することができます。
- フラスコからSf1Ep成長培地を吸引して廃棄します。細胞層を5mLの滅菌PBSで室温(RT)ですすぎ、PBSリンスを吸引して廃棄します。
- フラスコに2.5mLのトリプシン-EDTAを加え、キャップを密封します。フラスコを前後に揺さぶって細胞層をトリプシン-EDTAで覆い、フラスコを37°Cで5分間インキュベートします。
- フラスコを軽くたたいて細胞を取り除きます。倒立顕微鏡で観察し、Sf1Ep細胞の分散を確認します。
- 5mLのSf1Ep増殖培地を加え、フラスコを揺らしてトリプシン-EDTAと混合し、トリプシンの作用を停止します。懸濁したSf1Ep細胞を滅菌コニカルチューブに移します。
- 血球計算盤または自動セルカウンターを使用して細胞を定量します。
- ワーキングセルストックを維持するには、培地/トリプシン-EDTA/細胞混合物のアリコート(0.5-1.0 mLまたは~8 x 105 細胞)を、15 mLの新鮮なSf1Ep培地を含む新しいT75組織培養フラスコに移します。
- T. pallidumの培養では、Sf1Ep培地で細胞を0.25-0.5 x 105細胞/mLに希釈し、適切な培養容器に播種します(表1)。
- Sf1Ep細胞を凍結するには、卓上遠心分離機で100 x g で7分間遠心します。細胞ペレットを乱さないように上清を慎重に取り除きます。細胞ペレットを10%組織培養グレードのDMSOを添加したSf1Ep培地に再懸濁します。
- 1 mLの細胞懸濁液を各クライオバイアルに分配し、バイアルを液体窒素極低温容器に移す前に、バイアルを液体窒素極低温容器に移す前に、断熱容器(発泡スチロール試験管ホルダーなど)で-70°C〜-80°Cで一晩凍結します。
3. T. pallidumの栽培
注意:すべての T. pallidum 亜種および株はヒトに対して病原性であり、バイオセーフティレベル2(BSL-2)病原体34に分類されます。人員を保護するために適切な措置が必要です。これには、手袋やその他の個人用保護具(PPE)の使用、 およびT. pallidumにさらされる可能性のある表面、材料、および液体の消毒が含まれます。 T. pallidum は、70%エタノールまたは市販の消毒剤に曝露すると容易に不活化されます。 T. pallidum を含む試料を取り扱うために、層流フードを一貫して使用することをお勧めします。
注:T. pallidumは、大気中の酸素レベル9,16,35に数時間さらされることで死滅する可能性がある微好気性生物です。したがって、可能であれば、空気中でのT.pallidumの取り扱いを1時間未満に制限することをお勧めします。また、TpCM-2培地は、1.5%O2、5%CO2、バランスN2で事前に平衡化する必要があり、激しい攪拌(ボルテックスの使用など)を制限する必要があります。T. pallidumの培養は通常、抗生物質を使わずに行われるため、細菌や真菌による汚染を避けるために特別な注意が必要です。T. pallidumを培養するためのSf1Ep-TpCM-2の手順は図1にまとめられており、Sf1Ep細胞の培養容器への播種、TpCM-2培地の調製、およびT. pallidumの培養物への接種を含む複数のステップが含まれます。熱不活化ウシ胎児血清(FBS)は重要な培地成分であり、その有効性は供給者やロットによって異なります19。FBSロットの有効性について事前スクリーニングが必要です。
- 適切なカルチャ サイズを選択します。
注:T. pallidumの培養は、大判(例えば、75cmの2フラスコで1培養あたり~1×109T. pallidumを収穫するなど)から96ウェルプレート(クローニング実験に適する)までスケーラブルである17,18,19,27。- 培養サイズを調整する際には、表1に示すように、培養ごとに接種されるSf1Ep細胞とT.pallidumの数、および必要な培地の量を考慮してください。ベントキャップ付きのフラスコを使用すると、ガスの自由な循環が可能になり、蒸発による体積の損失が減少します。
- 初期培養には6ウェルプレートフォーマットを使用してください。これは、微生物汚染が発生した場合に備えて、トリプリケートレプリケートと追加のウェルを含めるのに便利だからです。
- 実験の1〜2日前にSf1Ep細胞を播種します。
- ステップ2.7で説明したように、ストック培養物のトリプシン化により、Sf1Ep細胞の懸濁液を調製します。
- 血球計算盤または自動セルカウンターを使用して、懸濁液中のSf1Ep細胞の濃度を測定します。
- 各培養物に適切な数のSf1Ep細胞とSf1Ep培地(表1)を添加します。標準的な組織培養インキュベーターで、5% CO2 を含む37°Cで培養物を使用までインキュベートします。
- 実験の1日前にTpCM-2を準備します。
注:TpCM-2は、-20°Cで数ヶ月間調製および保存することができます。培地は、実験の前日に低酸素インキュベーターで解凍し、平衡化する必要があります。- TpCM-2の成分(表2)の滅菌溶液を市販で入手するか、乾燥試薬から調製してろ過滅菌します。溶液を4°Cで最大2ヶ月間保存します。フィルター滅菌の前に、MOPSバッファーのpHを7.5に調整してください。そうでなければ、コンポーネントまたは最終的なTpCM-2をpH調整する必要はありません。
注:培地成分の調製には、滅菌済みの組織培養グレードの蒸留水の使用が推奨されます。 - 表2にリストされている試薬を滅菌容器に混ぜ合わせ、最後に乾燥粉末としてジチオスレイトール(DTT)を加えます(酸化を最小限に抑えるため)。各成分の量をスケールアップ(またはスケールダウン)して、必要な量のTpCM-2を調製します。0.22 μmのフィルターユニットを使用して培地を穏やかに混合し、フィルター滅菌します。
- TpCM-2が入ったフラスコの蓋を緩めます。培地を嫌気性(Brewer)ジャーに入れ、95%N2、5%CO2 ガス混合物を3回排気して補充し、最終排気後に1.5%O2、5%CO2、バランスN2 ガス混合物を充填して、培地を事前に平衡化します。このガス交換プロセスを実行するシステムの一例を 図2に示します。
- 1.5% O2、5% CO2 を提供し、34 °C で N2 雰囲気のバランスをとるようにセットアップされたトライガスインキュベーターに培地を迅速に移します。 あるいは、培地を含む嫌気性ジャーを、3.3.3に記載されているガス交換に従って密封し、標準的なインキュベーターに移すこともできます。
- TpCM-2の成分(表2)の滅菌溶液を市販で入手するか、乾燥試薬から調製してろ過滅菌します。溶液を4°Cで最大2ヶ月間保存します。フィルター滅菌の前に、MOPSバッファーのpHを7.5に調整してください。そうでなければ、コンポーネントまたは最終的なTpCM-2をpH調整する必要はありません。
- 実験当日の朝、倒立顕微鏡でSf1Epの培養物を確認します。セルが結合し、5%〜10%がコンフルエントであることを確認します。培地を無菌的に取り除きます。
- 予め平衡化したTpCM-2の少量(容器サイズに応じて0.2 mL〜2 mL)を使用してウェルを短時間すすぎ、リンス液を取り除き、適切な量のTpCM-2を添加します(表1)。プレートを1.5%O2、5%CO2で平衡化し、前述のようにN2 雰囲気を34°Cで3〜4時間バランスさせます。
- プレートを層流フードに移し、凍結ストックまたは新たに収穫した培養物からのトリプシン処理製剤(以下に記載)から適切な数(表1)の T.pallidum を接種します。感染したウサギ13から無菌的に採取した新たに調製されたまたは凍結したストックも使用してもよい。3.3.3に記載されているようにプレートを再平衡化し、培養物を1.5%O2、5%CO2でインキュベートし、34°CでN2 雰囲気のバランスを取ります。
4. T. pallidum の培養物の採取と継代
注:培養中のT. pallidumの大部分はSf1Ep細胞の表面に付着しているため、トレポネムを回収して生物の正確な数を得るためには、哺乳類細胞からトレポネムを解離させる必要があります。このような「収穫」と新鮮な培養への移行は、通常、培養の7日目に行われます。ここで説明する手順は、6ウェルプレート用です。使用されるトリプシン-EDTA溶液の量は、培養フォーマット17,19,27のサイズに応じて上下に調整されます。
- 収穫時には、インキュベーターから培養物を取り出します。逆位相コントラスト顕微鏡を使用して各ウェルのSf1Ep細胞層を検査し、細胞密度(例:80%コンフルエント)と外観を記録します。また、TpCM-2の色にも注意してください。レサズリンインジケーターは、pHの低下の結果としてピンクから黄色に変わることがよくあります。
- 各ウェルから培地を滅菌済みの15 mLコニカルチューブにピペットで移し、クロスコンタミネーションを防ぐためにウェルごとに別々のピペットを使用します。各ウェルを0.35 mLの予熱済みトリプシン-EDTA溶液ですすぎ、すすぎ液を培地に加えます。
- 各ウェルにさらに0.35 mLのトリプシン-EDTA溶液を加え、標準的な37°Cインキュベーターでプレートを5分間インキュベートします。この短い期間には、低O2 雰囲気は必要ありません。
- Sf1Ep細胞の切り上げと剥離を確認しますが、これは哺乳類細胞からの T.pallidum の解離とも相関しています。倒立顕微鏡を使用してこのプロセスをモニターし、必要に応じて追加の時間またはトリプシン-EDTA溶液を提供します。解離プロセスは、固定されたプレートの側面をプラスチック製の試験管ラックまたは同様の物体で優しく叩くことによって促進されます。
- 予約した培地をピペットでピペットで洗い流し、ウェルにすすぎ、解離した T. pallidum と細胞を回収します。培養あたりの収量を計算するために取得した総量を記録します。
- ほとんどの実験では、採取したT . pallidum を一定量、新鮮なSf1Ep細胞とTpCM-2を入れた培養プレートに移します。このような場合は、培養量の約1/20( 4 mLの6ウェルプレート培養の場合は200 μlなど)を移します。 T. pallidum 株が速いか遅いかに応じて、このボリュームを上下に調整します。接種材料中のSf1Ep細胞を100 x g で5分間遠心分離して除去しますが、このステップは日常的な移載には必要ありません。
- 実験用プレートに接種した直後に、排気・補充プロセスを用いてプレート内の雰囲気を交換します(ステップ3.3.3)。プレートをBrewerジャー内で34°Cでインキュベートするか、トライガスインキュベーターに移します。
- T . pallidum は、製造元の指示に従って、Helber計数チャンバーまたは同様のデバイスを使用して暗視野顕微鏡で列挙します。
注:ヘルバーチャンバーは、目盛り付きのスライドガラスとカバースリップで、細菌数の精度と再現性を大幅に向上させます。チャンバーは、70%エタノールとペーパーティッシュを使用して簡単に消毒、洗浄、乾燥でき、無期限に再利用できます。理想的には、暗視野顕微鏡には40倍の対物レンズと15倍の接眼レンズが必要です。各培養物について重複カウントを行い、運動性および非運動性T. pallidumの数と記録する形態学的変化を記録します。定量的PCR(qPCR)は、正確な定量と運動性の決定が必要ない場合にも使用できる17,24。 - トリプシンによる治療が望ましくない可能性のある実験(T. pallidumタンパク質含有量を調べる実験など)では、EDTA解離培地を使用してT. pallidumと細胞単層17,19を解離します。
注:解離培地は、リン酸緩衝生理食塩水(PBS)または塩化カルシウムおよび塩化マグネシウムを含まないアール塩基性塩溶液(EBSS)に対して透析されたFBSで構成されており、単純化された T. pallidum 培養培地中の二価カチオンを除去します(表2)。この手順は、完全な解離のためにより長い期間(最大30分)または繰り返し治療を必要とする場合があります。
5. T. pallidum 培養物の凍結と保存
注: T. pallidum は-70°C以下で無期限に保存でき、解凍後の生存率は通常50%〜90%です。
- 収穫時に T. pallidum の培養物を10%(v / v)グリセロールを添加して凍結します。グリセロールを穏やかなピペッティングまたは反転により、調製全体に分散させます。次に、1〜2 mLのアリコートに入った調製物をスクリューキャップ付きフリーザーバイアルに分配し、すぐにバイアルを-80°Cのフリーザーまたは液体N2 フリーザーに入れます。
- 凍結ストックから T. pallidum の培養を開始するには、まず、セクション3で説明したように、Sf1Ep細胞とTpCM-2を含む適切な培養容器を準備します。 T. pallidum 凍結ストックを含むバイアルを急速に解凍します。この点では、37°Cのウォーターバスまたはヒーティングブロックを慎重に使用することが役立ちます。
- 次に、解凍した調製物を培養容器に移します。T . pallidumの生存と成長を促進するためにグリセロールの十分な希釈を確保するために、凍結ストック量とTp-CM2培地の比率が1:5以上であることを確認してください。
- マイクロ好気性条件下で培養物を7日間インキュベートし、セクション4に記載されているように新鮮な培養物に移します。
6. T. pallidumの同質遺伝子クローンの生成
注:この手順は、先行研究27で詳細に説明されています。
- 一般的な実験では、セクション3で説明したように、1000個のSf1Ep細胞とウェルあたり200μLのTpCM-2を含む2つの96ウェルプレートを調製し、事前に平衡化します。
注:マルチチャンネル200μLピペッターと互換性のある滅菌ディスポーザブル試薬リザーバーにより、Sf1Ep細胞の接種、培地交換、および接種のステップが大幅に簡素化されます。 - 暗視野顕微鏡とヘルバーチャンバーを使用して、収穫したばかりの調製物中の 淡蒼菌 の濃度を定量します(ステップ4.8)。 T. pallidum 懸濁液をTpCM-2で希釈して、10トレポネーム/mLおよび40トレポネーム/mLの濃度の2つの製剤を作製します。各調製物10 mLは、希釈ごとに1つの96ウェルプレートを接種するのに十分すぎるほどです。対照として、2 x 103 T. pallidum/mL を含む別の希釈液 1 mL を調製します。
- 標準的なシングルチャンネルピペットまたはマルチチャンネルピペットを使用して、10 T. pallidum/mL調製物のウェルあたり50 μLを、調製した96ウェルプレートの1つに接種します。これは、2つのコントロールウェルを省略します。このプロセスを40 T. pallidum/mL調製物と他のプレートで繰り返します。各プレートの2つのコントロールウェルで、2 x 103 T. pallidum/mL希釈液を接種します。このプロセスでは、ウェルあたり(平均して)0.5または2 T. pallidum のプレートと、100 T. pallidumのポジティブコントロールウェルが生成されます。
注:これらの条件下では 、T. pallidum のめっき効率は低いため、~2つの生物を播種した井戸でさえ、クローン性個体群を生成する可能性があります。 - プレートを低O2 ガス混合物で平衡化し(ステップ3.3.3)、Brewerジャーまたはトライガスインキュベーターで34°Cでインキュベートします。
- 7 日後に、各培養ウェルから 100 μL の培地を取り出し、100 μL の新鮮な平衡化 TpCM-2 と交換します。暗視野顕微鏡と計数により、コントロールウェル内の T. pallidum の生存率と増殖を確認し、培養条件が T. pallidum の増殖をサポートしていることを確認します。
注:クローン培養物の交差汚染を防ぐために、ウェルごとに新しいピペットチップを使用してください。 - 14日後、各ウェルから50 μLの培養上清をステップ6.1で調製したフレッシュプレートに移します。
- 21日目と28日目に、必要に応じて交互に給餌と通過を繰り返します。
- 暗視野顕微鏡法またはqPCR26を使用して、各ウェル内のT. pallidumの存在をモニターします。
注: T. pallidum の成長速度が遅く、摂食および移動中に生物が必然的に失われるため、0.5または2 T. pallidum を播種した井戸は、通常、28日目以降までどちらの方法でも陽性ではありません。 - 陽性のウェルが特定されたら、これらのウェルをトリプシン化して24ウェルプレートに移し、さらに増殖させます。単一の tprK 配列の優位性および親株27において不均一な部位における単一配列の存在によってクローン性を決定する。
結果
記載された条件を使用すると、 T. pallidum は通常>90%の運動性を保持し、固定相に入る前に約7日間、33時間から45時間の倍加時間で対数的に乗算します(図3)。1週間の間に、スピロヘータは約4〜5倍になります(図4)。).さらに、 T. pallidum の異なる株は、異なる速度で成長する可能性があります。 T. pallidum のSS14グループの株は、Nicholsグループ17の株よりも倍加時間が遅い傾向があります。
培養物の供給は培養時間を数日延長する可能性がありますが、Sf1Ep細胞層は培養の1週間後に失敗することがよくあります。さらに、トレポネームは生物の上限である約5 x 107 / mLに達します。7日間隔で移された培養物は、通常、ラグフェーズがほとんどまたはまったくなく、対数乗算を続けます。静止期の生物は、しばしば通過が困難になります。
ほとんどのT. pallidumはSf1Ep細胞に付着しています。しかし、上清には十分な量の淡蒼菌が残っているため、培地のサンプルを定期的に取り出して生存率と増殖を確認できます。慎重な定量が必要な場合は、除去した培地の量を測定し、T. pallidumの数を定量し、除去した生物の総数を収穫時の最終カウントに追加する必要があります。
以前の研究では、クローニング効率(接種した生物当たりの陽性培養数)は、ウェル当たり2個の T. pallidum を接種した場合で12.5%、1ウェルあたり0.5 個のT. pallidum を接種した場合で6.7%であった27。したがって、任意の正の井戸は、これらの接種のいずれかにおける単一の生物の増殖を表している可能性があります。ただし、結果として得られる集団のクローン性は、親培養で不均一な場所での培養の均一性を調べることによって検証する必要があります。培養物が同質遺伝子であることを実証する最も決定的な方法は、全ゲノムシーケンシング27を行うことである。
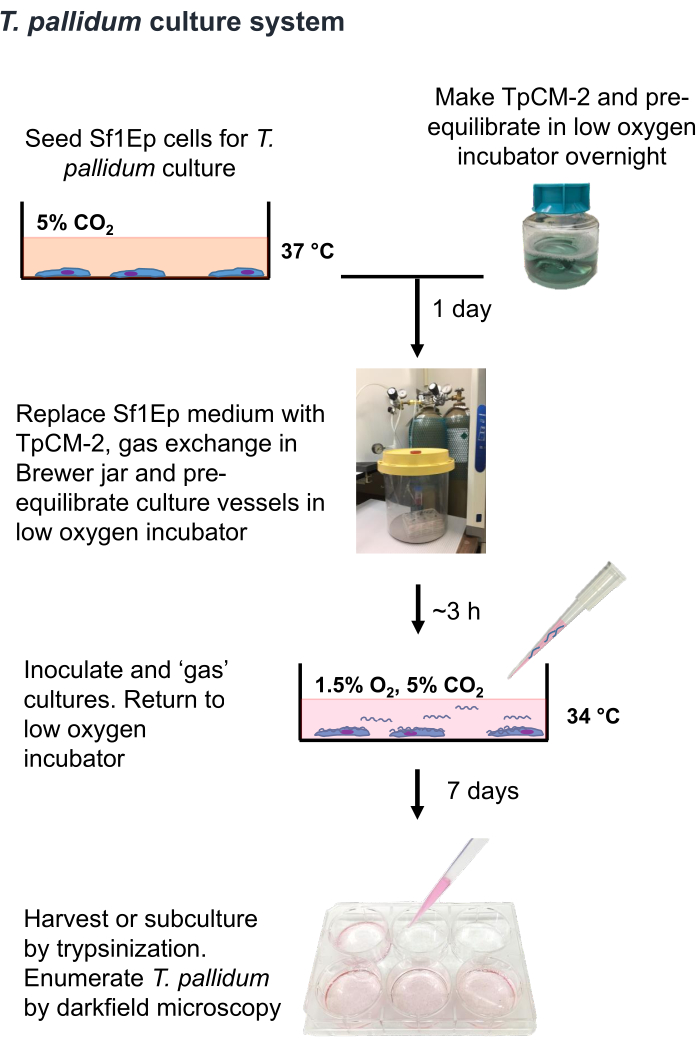
図1: T. pallidumin vitro 培養手順のフローチャート。 この図は、Edmondson and Norris (2021)19の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
図2: T. pallidum 培養試薬を低酸素環境に平衡化するためのシステムの図。 Brewerジャーベントは、Tジョイントを介して真空源(ハウスバキュームなど)およびカスタムガス混合物(5%CO2、バランス窒素および1.5%O2、5%CO2、バランス窒素)を含むガスボンベに接続されます。インライン真空計は、瓶に引き込まれた真空を測定します。真空は瓶内で約-58kPaまで引き込まれます。その後、排気されたジャーにガス混合物がゆっくりと再充填されます。ブリューワージャーは、5%のCO2を3回補充し、最終排気前に窒素のバランスを取り、95%N2、5%CO2、1.5%O2で補充します。その後、培養物または培地を瓶から取り出し、すぐに低酸素インキュベーターに移します。あるいは、Brewerジャーと最初のTジョイントの間のチューブをしっかりと固定し、チューブをTジョイントから切り離し、Brewerジャー全体を34°Cのインキュベーターに移すこともできます。この図は、Edmondson and Norris (2021)19の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
図3:Sf1Ep細胞とTpCM-2培地で培養した T. pallidum の成長曲線。 パラレルトリプリケート培養物に T.pallidumを播種しました。反復は各時点で収穫されました。結果は、これらのカルチャの平均 + SEM を表します。(A)培養ごとの T.pallidum の変化と(B)パーセントの運動性が示されています。この図は、Edmondson et al.18の許可を得て改作したものです。 この図の拡大版を表示するには、ここをクリックしてください。
図4:T. pallidum, Nichols株のin vitro培養の継代例。パラレルトリプリケート培養物にT. pallidumを播種し、1:20希釈で毎週通過させた。鋸歯状プロットは、培養ごとの T. pallidum の数と、各時点で新しい培養に移された数を示しています。結果は、3つの生物学的複製の平均±SEMを表しています。この図の拡大版を表示するには、ここをクリックしてください。
表1:培養容器の中量と播種率。この表をダウンロードするには、ここをクリックしてください。
表2: T. pallidum栽培用 培地。 すべての培地は、調製後にフィルター滅菌する必要があります。Sf1Ep培地は、4°Cで最大2ヶ月間保存できます。TpCM-2は通常、使用の1日前に作られます。解離媒体は分注して凍結する必要があります。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
Sf1Ep-TpCM-2システムは、T. pallidumの連続的なin vitro培養を促進する最初の利用可能な手順です。この生物の極端な成長要件により、システムは複雑です:1)生合成能力が限られているため、複雑な栄養ニーズ。2)活性酸素種に対する高い感受性にもかかわらず、少量の酸素に対する要件はよく理解されていません9,10,16,36;3)Sf1Ep細胞の存在に対する現在の必要性。手順を「手抜き」したくなりますが、修正を試みる前に、長期的な培養が成功するまで手順を慎重に実行することをお勧めします。T. pallidumの代謝要件に関する追加情報が蓄積するにつれて、Sf1Ep細胞の存在を必要としない無酸素状態を発症することが可能になるかもしれません。しかし、哺乳類感染中でもT. pallidumが推定30時間から33時間の倍加時間で増殖することを考えると、in vitroの成長率は遅いままである可能性が高い(系統にもよりますが、最小倍加時間は33時間から46時間)17,18。他の細菌培養と同様に、低継代ストックを維持し、「遺伝的浮動」および突然変異による関連する表現型の変化を避けるために、これらのストックから10継代未満のT.pallidum培養物で実験を行うことが推奨される。
Sf1Ep細胞は、明らかにトレポネームに必須栄養素または酵素活性を提供します。ただし、栄養素(ブドウ糖や酸素など)も消費し、低pH 9,16,39などの毒性状態を引き起こす可能性があります。したがって、T. pallidumの増殖を支えるのに十分なSf1Ep細胞を持つことと、哺乳類細胞の過剰増殖および毒性を防ぐこととの間にはバランスのとれた作業があります。Sf1Ep細胞の継代数が多いと、増殖が速くなる傾向があり、時にはT. pallidumの増殖をサポートする能力が失われます。そのため、Sf1Ep継代数をモニターし、細胞ストックを定期的に低継代凍結製剤に置き換える必要があります。Sf1Ep細胞の存在は、DNA、RNA、タンパク質含有量、酵素活性などのT. pallidumの特性の研究も複雑にします。ウサギ細胞の除去は、反復低速遠心分離(100×gで5分間)を用いてある程度まで、またはPercollまたはHypaque勾配40,41を用いてより効果的に可能である。しかし、グラジエント遠心分離法は、一般に、T. pallidumの数が多い場合にのみ有効です。T. pallidumを増殖させるための代替方法は、ウサギなどの実験動物の感染に限定されている13,14。このアプローチには倫理的な考慮事項があり、ますます高価になっています。しかし、ウサギモデルは、T. pallidumの病因と宿主の免疫応答を研究するのに非常に有用です。さらに、in vitro培養とウサギ感染中のT. pallidumの遺伝子発現、成長または行動にはいくつかの違いがある可能性が高い27。
本報告時点で、Sf1Ep-TpCM-2システムは、米国とヨーロッパの少なくとも6つの研究グループで確立されており、 T. pallidum の基礎生物学や遺伝学から抗菌薬感受性まで、さまざまなトピックで16の論文を発表しています。この謎めいた病原体を研究する上での in vitro 培養の価値は、使用の拡大と将来の改善とともに増加する可能性があります。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、米国国立衛生研究所/NIAIDからの助成金R01 AI141958によって支援されました。資金提供者は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
参考文献
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved