Method Article
Procedure per la coltivazione in vitro di Treponema pallidum, la spirocheta della sifilide
In questo articolo
Riepilogo
Questo protocollo descrive la coltivazione in vitro del patogeno della sifilide Treponema pallidum subsp. pallidum in co-coltura con cellule di mammifero. Il metodo è scalabile; può essere utilizzato per produrre grandi quantità di T. pallidum e per generare colture clonali.
Abstract
Per oltre un secolo, il Treponema pallidum subsp. pallidum, il batterio a forma di spirale che causa la sifilide, poteva essere propagato solo per inoculazione e raccolta degli organismi dai testicoli dei conigli. Nel 2018 abbiamo descritto un metodo per coltivare in modo continuativo T. pallidumin vitro. Questo sistema utilizza la co-coltura con cellule epiteliali di coniglio (cellule Sf1Ep) in un terreno di coltura tissutale contenente siero chiamato TpCM-2. Il tempo di raddoppio di T. pallidum in coltura è simile a quello stimato durante l'infezione naturale (circa 33-45 ore). L'organismo può essere coltivato in modo continuo con un tempo di passaggio standard di 1 settimana in un ambiente a basso contenuto di ossigeno (1,5%) a 34 °C. Questo articolo contiene i protocolli per la coltura di T. pallidum, i metodi per la crescita e il mantenimento delle cellule di coltura tissutale necessarie e la tecnica per generare ceppi isogenici limitando la diluizione. La capacità di coltivare T. pallidum in vitro fornisce nuove strade sperimentali per studiare e comprendere questo enigmatico organismo.
Introduzione
Il Treponema pallidum è una specie di batteri a forma di spirale (chiamati spirochete) che causa la sifilide e le infezioni correlate nell'uomo e in altri primati. La sifilide è una malattia grave con effetti a lungo termine su individui infetti e si stima che ogni anno si verifichino oltre 8 milioni di nuovi casi di sifilide in tutto ilmondo1. T. pallidum è stato suddiviso in tre sottospecie in base alle malattie che causano nell'uomo e a differenze genetiche minori: sottospecie pallidum (che causa la sifilide, malattia sessualmente trasmissibile), sottospecie pertenue (imbardata) e sottospecie endemicum (che causa bejel o sifilide endemica)2,3. T. pallidum subsp. pertenue causa anche infezioni in babbuini, scimpanzé e altri primati. Un organismo strettamente correlato chiamato Treponema paraluiscuniculi (chiamato anche Treponema paraluisleporidarum) provoca un'infezione nei conigli e nelle lepri 4,5. Tutti questi batteri sono strettamente correlati, con un'identità di sequenza del DNA superiore al 98% a livello del genoma 6,7,8. Ognuno di loro ha un singolo piccolo cromosoma circolare di circa 1,14 milioni di coppie di basi (Mb) di dimensioni. I membri di questo gruppo di T. pallidum si trovano solo in associazione con i loro ospiti mammiferi; In quanto tali, sono agenti patogeni obbligati che dipendono dalla loro specie ospite per la sopravvivenza e la crescita 9,10.
I tentativi di coltivare T. pallidum in vitro iniziarono poco dopo la sua identificazione da parte di Schaudinn e Hoffman nel 190511,12. Tuttavia, questi sforzi non sono riusciti a portare a una crescita costante e riproducibile dell'organismo. Di conseguenza, gli studi di ricerca su T. pallidum hanno richiesto la propagazione dell'organismo attraverso l'infezione sperimentale di animali da laboratorio, più comunemente il coniglio13,14. Nel 1981, Fieldsteel et al.15 introdussero un sistema di coltura tissutale che promuoveva la moltiplicazione dei ceppi di T. pallidum per un periodo fino a 2 settimane. Questo sistema ha coinvolto la co-coltura di T. pallidum con cellule epiteliali di coniglio Sf1Ep cottontail in un terreno di coltura tissutale modificato (T. pallidum Culture Medium 1, TpCM-1) basato sul Minimum Essential Medium (MEM) di Eagle e sul 20% di siero fetale bovino (FBS). Altre condizioni di coltura richieste erano l'incubazione a 34 °C in un'atmosfera contenente l'1,5% di O2 e il 5% di CO2 9,16. In questo sistema, T. pallidum si attacca alle cellule Sf1Ep e si moltiplica quando è in stretta associazione con la superficie cellulare dei mammiferi. Nonostante molti tentativi di sottocoltura e altre modifiche, il sistema di Fieldsteel et al. non è riuscito a promuovere una crescita continua in vitro.
Nel 2018, il nostro laboratorio ha riferito che l'uso di un terreno modificato chiamato TpCM-2 (in cui la MEM di Eagle è stata sostituita con un terreno di coltura tissutale più complesso, CMRL 1066) ha fornito a T. pallidum i nutrienti necessari per consentire una coltura costante a lungo termine17. Ad oggi, questa modifica ha portato a una coltura costante e continua di almeno 5 ceppi di T. pallidum subsp. pallidum (Nichols, SS14, Mexico A, UW231B e UW249B) e un ceppo di T. pallidum subsp. endemicum (Bosnia A)18,19. Ad esempio, il ceppo Nichols è stato coltivato continuamente in vitro per oltre 6 anni. Finora, i tentativi di coltivare isolati di imbardata (T. pallidum subsp. pertenue) o T. paraluiscuniculi in vitro non hanno avuto successo18. Il sistema TpCM-2 richiede ancora la presenza di cellule Sf1Ep, basse concentrazioni di ossigeno e incubazione a 34 °C, rendendo il sistema più complesso rispetto alla maggior parte delle tecniche di coltura batterica. Tuttavia, questo sistema di coltura modificato di T. pallidum è stato utile per definire ulteriormente i requisiti di crescita del batterio18, determinare le concentrazioni inibitorie minime (MIC) di composti antimicrobici e peptidi 20,21,22,23,24,25, propagare nuovi ceppi da aspirati tissutali di pazienti26, isolare popolazioni clonali del 27, caratterizzando il sistema di variazione antigenica tprK 27,28, esaminando l'espressione genica29 ed eseguendo l'analisi mutazionale 30,31,32.
Qui descriviamo i metodi attuali per la coltivazione di T. pallidum in vitro. Ci auguriamo che queste informazioni contribuiscano a facilitare l'applicazione più diffusa di questa tecnica di coltura in vitro per migliorare la diagnosi, il trattamento e la prevenzione della sifilide e delle infezioni treponemici correlate.
Protocollo
NOTA: Tutte le fasi richiedono l'uso di una tecnica asettica e di materiali e reagenti sterili. Si raccomanda l'utilizzo di una cappa a flusso laminare per colture tissutali per ridurre sia a) l'esposizione del personale a materiale infettivo sia b) la possibilità di contaminazione microbica delle colture.
1. Determinazione degli stock cellulari di Sf1Ep
NOTA: Le cellule epiteliali di coniglio Sf1Ep cottontail possono essere acquistate come ceppi congelati dall'American Type Culture Collection (vedi Tabella dei materiali). La natura a crescita lenta e il basso tasso metabolico delle cellule Sf1Ep sembrano essere fondamentali per la loro capacità di sostenere la sopravvivenza e la crescita a lungo termine di T. pallidum33; Pertanto, la sostituzione con altre colture cellulari di mammifero non è raccomandata. Le cellule Sf1Ep non sono una linea cellulare immortalizzata e possono essere mantenute solo per 25-30 passaggi in coltura. Pertanto, è importante mantenere una scorta congelata di celle Sf1Ep a basso passaggio per un uso futuro. Linee di Sf1Ep immortalizzate si presentano occasionalmente durante la coltura a lungo termine di cellule Sf1Ep. (osservazioni inedite). Queste linee spesso crescono più velocemente e sono più facili da maneggiare; tuttavia, a volte, perdono la capacità di sostenere la crescita di T. pallidum . Le linee Sf1Ep immortalate possono essere utilizzate e poi sostituite quando le spirochete iniziano a crescere lentamente.
- Preparare un terreno cellulare Sf1Ep e preriscaldarlo in un incubatore a 37 °C, 5% CO2 .
NOTA: Il terreno cellulare Sf1Ep è costituito da MEM di Eagle integrato con il 10% di FBS, 1 di aminoacidi non essenziali MEM, 2 mM di L-glutammina e 1 mM di piruvato di sodio. (vedi Tabella dei materiali). Il mezzo deve essere sterilizzato con filtro e può essere conservato a 4 °C per un massimo di 2 mesi. Gli antibiotici (come la penicillina e la streptomicina) non devono essere utilizzati nel terreno cellulare Sf1Ep perché il carry-out di tracce anche di antibiotici interferirà con la crescita di T. pallidum. - Scongelare rapidamente il brodo di Sf1Ep congelato a 37 °C. Pulire l'esterno del flaconcino con etanolo al 70%.
- Aggiungere 1 mL di terreno cellulare Sf1Ep al crioviale e mescolare delicatamente. Aggiungere la miscela madre/terreno in una provetta da centrifuga conica sterile da 15 mL contenente 5 mL di terreno cellulare Sf1Ep e mescolare delicatamente.
- Pellettare le celle mediante centrifugazione a 100 x g per 7 min. Rimuovere ed eliminare il surnatante, facendo attenzione a non disturbare il pellet cellulare.
- Risospendere delicatamente le cellule Sf1Ep scongelate in 15 mL di terreno cellulare Sf1Ep fresco e trasferirle in un pallone di coltura tissutale T75.
NOTA: Il recupero delle cellule Sf1Ep appena scongelate viene migliorato mediante centrifugazione per rimuovere il DMSO utilizzato per congelare le cellule. Tuttavia, i passaggi 1.4-1.7 possono essere omessi e le cellule scongelate dal passaggio 3 possono essere seminate direttamente in un pallone di coltura tissutale T75 contenente 14 mL di terreno cellulare Sf1Ep. Dopo l'incubazione notturna, sostituire metà del terreno con un terreno Sf1Ep fresco per diluire il DMSO residuo. - Incubare le colture di Sf1Ep in un incubatore standard per colture tissutali umidificate a 37 °C, 5% CO2. Allentare i tappi dei palloni di coltura tissutale non ventilati per mantenere il pH del terreno adeguato.
2. Cellule Sf1Ep passanti
NOTA: La crescita delle colture cellulari Sf1Ep viene monitorata con un microscopio invertito utilizzando ottiche a contrasto di fase. In genere, le cellule impiegano circa una settimana per raggiungere la confluenza. Quando le celle raggiungono la confluenza del ~90%, possono essere passate, utilizzate per la coltivazione di T. pallidum o per la preparazione di ceppi congelati. La vita della coltura può essere estesa a due settimane sostituendo metà del terreno di coltura dopo una settimana di coltura.
- Aspirare ed eliminare il terreno di coltura Sf1Ep dal pallone. Sciacquare lo strato cellulare con 5 mL di PBS sterile a temperatura ambiente (RT), quindi aspirare ed eliminare il risciacquo con PBS.
- Aggiungere 2,5 mL di tripsina-EDTA al pallone e sigillare il tappo. Agitare il matraccio avanti e indietro per coprire lo strato cellulare con tripsina-EDTA e incubare il matraccio a 37 °C per 5 minuti.
- Picchiettare delicatamente il pallone per rimuovere le cellule. Osservare al microscopio invertito per confermare la dispersione delle cellule Sf1Ep.
- Aggiungere 5 mL di terreno di coltura Sf1Ep e agitare il pallone per mescolarlo con la tripsina-EDTA e fermare l'azione della tripsina. Rimuovere le cellule Sf1Ep sospese in una provetta conica sterile.
- Quantificare le cellule utilizzando un emocitometro o un contatore automatico di cellule.
- Per mantenere le scorte cellulari funzionanti, trasferire un'aliquota (0,5-1,0 mL o ~8 x 105 cellule) della miscela di terreno/tripsina-EDTA/cellule in un nuovo pallone di coltura tissutale T75 contenente 15 mL di terreno Sf1Ep fresco.
- Per la coltura di T. pallidum , diluire le cellule nel terreno Sf1Ep a 0,25-0,5 x 105 cellule/mL e seminare in recipienti di coltura appropriati (Tabella 1).
- Per congelare le cellule di Sf1Ep, centrifugare in una centrifuga da tavolo a 100 x g per 7 minuti. Rimuovere con cautela il surnatante senza disturbare il pellet cellulare. Risospendere il pellet cellulare in terreno Sf1Ep integrato con DMSO di coltura tissutale al 10%.
- Distribuire 1 mL di sospensione cellulare in ciascun crioviale e congelare per una notte a -70 °C - -80 °C in un contenitore isolato (come un supporto per provette in polistirolo) per migliorare la ritenzione della vitalità prima di trasferire le fiale in un recipiente criogenico di azoto liquido.
3. Coltivazione di T. pallidum
ATTENZIONE: Tutte le sottospecie e i ceppi di T. pallidum sono patogeni per l'uomo e sono classificati come patogeni di livello di biosicurezza 2 (BSL-2)34. Sono necessarie misure appropriate per proteggere il personale; questi includono l'uso di guanti e altri dispositivi di protezione individuale (DPI), nonché la disinfezione di superfici, materiali e liquidi potenzialmente esposti a T. pallidum. T. pallidum è facilmente inattivato dall'esposizione al 70% di etanolo o disinfettanti disponibili in commercio. Si raccomanda l'uso costante di cappe a flusso laminare per la manipolazione di campioni contenenti T. pallidum .
NOTA: T. pallidum è un organismo microaerofilo che può essere ucciso con poche ore di esposizione ai livelli atmosferici di ossigeno 9,16,35. Pertanto, si raccomanda di limitare la manipolazione di T. pallidum nell'aria, se possibile, a meno di un'ora. Inoltre, il mezzo TpCM-2 dovrebbe essere pre-bilanciato in 1,5% O2, 5% CO2, bilanciato N2 e l'agitazione vigorosa (ad esempio, l'uso di un vortice) dovrebbe essere limitata. Poiché la coltura di T. pallidum viene tipicamente eseguita in assenza di antibiotici, è necessaria un'attenzione particolare per evitare la contaminazione con batteri o funghi. La procedura Sf1Ep-TpCM-2 per la coltura di T. pallidum è riassunta nella Figura 1 e prevede più fasi, tra cui la semina dei vasi di coltura con cellule Sf1Ep, la preparazione del terreno TpCM-2 e l'inoculazione delle colture con T. pallidum. Il siero fetale bovino inattivato termicamente (FBS) è un componente critico del mezzo e la sua efficacia varia tra i diversi fornitori e lotti19. È necessario un prescreening dell'efficacia dei lotti FBS.
- Selezionare le dimensioni delle impostazioni cultura appropriate.
NOTA: La coltura di T. pallidum è scalabile da grandi formati (come2 fiasche da 75 cm che producono ~1 x 109 T. pallidum per coltura) a piastre da 96 pozzetti (adatte per esperimenti di clonazione)17,18,19,27.- Quando si regolano le dimensioni della coltura, tenere conto del numero di cellule Sf1Ep e T . pallidum inoculate per coltura, nonché della quantità di terreno necessaria, come mostrato nella Tabella 1. Utilizzare palloni con tappi ventilati in quanto consentono la libera circolazione dei gas con una minore perdita di volume dovuta all'evaporazione.
- Utilizzare il formato della piastra a 6 pozzetti per le colture iniziali perché è conveniente includere repliche triplicate e pozzetti extra nel caso in cui si verifichi una contaminazione microbica.
- Seminare le cellule Sf1Ep 1-2 giorni prima dell'esperimento.
- Preparare una sospensione di cellule Sf1Ep mediante tripsinizzazione di colture stock, come descritto al punto 2.7.
- Determinare la concentrazione di cellule Sf1Ep nella sospensione utilizzando un ematocitometro o un contatore automatico di cellule.
- Aggiungere il numero appropriato di cellule Sf1Ep e terreno Sf1Ep (Tabella 1) a ciascuna coltura. Incubare le colture a 37 °C in un incubatore standard per colture tissutali con il 5% di CO2 fino all'uso.
- Preparare TpCM-2 1 giorno prima dell'esperimento.
NOTA: TpCM-2 può essere preparato e conservato a -20 °C per diversi mesi. Il terreno deve essere scongelato ed equilibrato nell'incubatore a basso contenuto di ossigeno il giorno prima dell'esperimento.- Ottenere soluzioni sterili per i componenti di TpCM-2 (Tabella 2) in commercio o prepararle da reagenti secchi e sterilizzarle con filtro. Conservare le soluzioni a 4 °C per un massimo di 2 mesi. Regolare il pH del tampone MOPS a 7,5 prima della sterilizzazione del filtro; in caso contrario, i componenti o il TpCM-2 finale non devono essere regolati per il pH.
NOTA: Si raccomanda l'uso di acqua distillata sterile per colture tissutali per la preparazione dei componenti del terreno. - Combinare i reagenti elencati nella Tabella 2 in un contenitore sterile, aggiungendo ditiotreitolo (DTT) come polvere secca per ultima (per minimizzarne l'ossidazione). Aumentare (o diminuire) le quantità di ciascun componente per preparare la quantità necessaria di TpCM-2. Miscelare delicatamente e sterilizzare con filtro il mezzo utilizzando un'unità filtrante da 0,22 μm.
- Allentare il coperchio del pallone contenente il TpCM-2. Pre-equilibrare il mezzo mettendolo in un barattolo anaerobico (Brewer), evacuando e riempiendo nuovamente con una miscela di gas 95% N2, 5% CO2 tre volte, quindi riempiendo con 1,5% O2, 5% CO2, miscela di gas bilanciata N2 dopo l'evacuazione finale. Un esempio di sistema per l'esecuzione di questo processo di scambio di gas è illustrato nella Figura 2.
- Trasferire rapidamente il fluido in un incubatore tri-gas configurato per fornire un'atmosfera di 1,5% O2, 5% CO2 e bilanciamento di N2 a 34 °C. In alternativa, il vaso anaerobico contenente il mezzo può essere sigillato dopo lo scambio di gas descritto al punto 3.3.3 e trasferito in un incubatore standard.
- Ottenere soluzioni sterili per i componenti di TpCM-2 (Tabella 2) in commercio o prepararle da reagenti secchi e sterilizzarle con filtro. Conservare le soluzioni a 4 °C per un massimo di 2 mesi. Regolare il pH del tampone MOPS a 7,5 prima della sterilizzazione del filtro; in caso contrario, i componenti o il TpCM-2 finale non devono essere regolati per il pH.
- La mattina dell'esperimento, controllare le colture di Sf1Ep utilizzando un microscopio invertito. Assicurarsi che le celle siano attaccate e confluenti al 5%-10%. Rimuovere asetticamente il terreno.
- Sciacquare brevemente i pozzetti utilizzando un piccolo volume (da 0,2 mL a 2 mL, a seconda delle dimensioni del recipiente) di TpCM-2 pre-bilanciato, rimuovere il risciacquo e aggiungere la quantità appropriata di TpCM-2 (Tabella 1). Equilibrare le piastre in un'atmosfera di 1,5% O2, 5% CO2 e bilanciare l'atmosfera di N2 a 34 °C per 3-4 ore come descritto in precedenza.
- Trasferire le piastre in una cappa a flusso laminare e inoculare con il numero appropriato (Tabella 1) di T. pallidum da ceppi congelati o preparati tripsinizzati da colture appena raccolte (come descritto di seguito). Possono essere utilizzati anche brodi freschi o congelati raccolti in modo asettico da conigli infetti13. Riequilibrare le piastre come descritto al punto 3.3.3 e incubare le colture in un'atmosfera di 1,5% O2, 5% CO2 e bilanciare l'N2 a 34 °C.
4. Raccolta e passaggio delle colture di T. pallidum
NOTA: Poiché la maggior parte di T. pallidum in coltura è attaccata alla superficie delle cellule Sf1Ep, è necessario dissociare i treponemi dalle cellule dei mammiferi per recuperarli e ottenere un conteggio accurato degli organismi. Tale "raccolta" e il passaggio a colture fresche avviene in genere il 7° giorno di coltura. La procedura qui descritta è per piastre a 6 pozzetti; La quantità di soluzione di tripsina-EDTA utilizzata viene regolata verso l'alto o verso il basso a seconda delle dimensioni del formato di coltura 17,19,27.
- Al momento del raccolto, rimuovere le colture dall'incubatrice. Esaminare lo strato di cellule Sf1Ep in ciascun pozzetto utilizzando un microscopio a contrasto di fase invertito e registrare la densità cellulare (ad esempio, 80% confluente) e l'aspetto. Inoltre, nota il colore del TpCM-2; l'indicatore della resazurina passa spesso dal rosa al giallo a causa del pH più basso.
- Pipettare il terreno da ciascun pozzetto in una provetta conica sterile da 15 mL, utilizzando pipette separate per ciascun pozzetto per evitare la contaminazione incrociata. Sciacquare ogni pozzetto con 0,35 ml di soluzione preriscaldata di tripsina-EDTA e aggiungere il risciacquo al terreno.
- Aggiungere altri 0,35 mL di soluzione di tripsina-EDTA a ciascun pozzetto e incubare la piastra per 5 minuti in un incubatore standard a 37 °C; un'atmosfera a basso O2 non è richiesta per questo breve periodo di tempo.
- Verificare l'arrotondamento e il distacco delle cellule Sf1Ep, che è anche correlato alla dissociazione di T. pallidum dalle cellule dei mammiferi. Monitorare questo processo utilizzando il microscopio invertito e fornire tempo aggiuntivo o una soluzione di tripsina-EDTA secondo necessità. Il processo di dissociazione è facilitato colpendo delicatamente il lato della piastra immobilizzata con un rack per provette di plastica o un oggetto simile.
- Pipettare il terreno riservato e sciacquare nel pozzetto per recuperare il T. pallidum dissociato e le cellule. Registrare il volume totale recuperato per il calcolo della resa per coltura.
- Nella maggior parte degli esperimenti, trasferire un determinato volume del T. pallidum raccolto su piastre di coltura con cellule Sf1Ep fresche e TpCM-2. In tali casi, trasferire circa 1/20del volume di coltura (ad esempio 200 μl per una coltura su piastra da 4 mL a 6 pozzetti); regola questo volume verso l'alto o verso il basso a seconda che il ceppo di T. pallidum sia a crescita rapida o lenta. Rimuovere le cellule Sf1Ep nell'inoculo mediante centrifugazione a 100 x g per 5 minuti, ma questo passaggio non è necessario per i trasferimenti di routine.
- Immediatamente dopo l'inoculazione delle piastre per un esperimento, scambiare l'atmosfera nelle piastre utilizzando il processo di evacuazione e riempimento (passaggio 3.3.3). Incubare le piastre a 34 °C all'interno del barattolo Brewer o trasferirle in un incubatore tri-gas.
- Enumerare T. pallidum mediante microscopia in campo scuro utilizzando una camera di conteggio Helber o un dispositivo analogo, seguendo le istruzioni del produttore.
NOTA: La camera Helber è un vetrino calibrato e un vetrino coprioggetti che migliora notevolmente l'accuratezza e la riproducibilità della conta batterica; La camera è facilmente disinfettabile, pulita e asciugabile utilizzando etanolo al 70% e fazzoletti di carta e può essere riutilizzata all'infinito. Idealmente, il microscopio a campo scuro dovrebbe avere un obiettivo 40x e oculari 15x. Eseguire conteggi duplicati per ogni coltura e registrare il numero di T. pallidum mobili e non mobili e qualsiasi cambiamento morfologico da registrare. La PCR quantitativa (qPCR) può essere utilizzata anche nei casi in cui non sono richieste una quantificazione e una determinazione precise della motilità17,24. - Negli esperimenti in cui il trattamento con tripsina potrebbe non essere desiderabile (come quelli che esaminano il contenuto proteico di T. pallidum), utilizzare un terreno di dissociazione EDTA per dissociare il T. pallidum e il monostrato cellulare17,19.
NOTA: Il terreno di dissociazione è costituito da FBS che è stato dializzato contro soluzione salina tamponata con fosfato (PBS) o soluzione salina basica di Earle (EBSS) senza cloruro di calcio e cloruro di magnesio per rimuovere i cationi bivalenti in un terreno di coltivazione semplificato di T. pallidum (Tabella 2). Questa procedura può richiedere un periodo di tempo più lungo (fino a 30 minuti) o un trattamento ripetuto per la dissociazione completa.
5. Congelamento e conservazione delle colture di T. pallidum
NOTA: T. pallidum può essere conservato a tempo indeterminato a una temperatura pari o inferiore a -70 °C, con una vitalità al momento dello scongelamento tipicamente del 50%-90%.
- Congelare le colture di T. pallidum al momento del raccolto con l'aggiunta del 10% (v/v) di glicerolo. Disperdere il glicerolo in tutta la preparazione attraverso un pipettaggio delicato o un'inversione. Quindi, distribuire il preparato in aliquote da 1-2 ml in fiale di congelatore con tappo a vite e porre immediatamente le fiale in un congelatore a -80 °C o in un congelatore liquido N2 .
- Per iniziare una coltura di T. pallidum da ceppi congelati, preparare innanzitutto recipienti di coltura appropriati contenenti cellule Sf1Ep e TpCM-2 come descritto nella sezione 3. Scongelare rapidamente la fiala contenente il brodo congelato di T. pallidum ; A questo proposito, è utile un uso attento di un bagnomaria a 37 °C o di un blocco riscaldante.
- Quindi, trasferire la preparazione scongelata nel recipiente o nei recipienti di coltura. Assicurarsi che il rapporto tra il volume del brodo congelato e il terreno Tp-CM2 sia pari o superiore a 1:5 per garantire una diluizione sufficiente del glicerolo a promuovere la sopravvivenza e la crescita di T. pallidum.
- Incubare la coltura in condizioni microaerobiche per 7 giorni e trasferirla in colture fresche come descritto nella sezione 4.
6. Generazione di cloni isogenici di T. pallidum
NOTA: Questa procedura è descritta in dettaglio in uno studio precedente27.
- In un esperimento tipico, preparare e pre-equilibrare due piastre da 96 pozzetti con 1000 celle Sf1Ep e 200 μL di TpCM-2 per pozzetto, come descritto nella sezione 3.
NOTA: Un pipettatore multicanale da 200 μL e serbatoi di reagenti sterili monouso compatibili semplificano notevolmente le fasi di inoculazione delle cellule Sf1Ep, di scambio del terreno e di inoculazione. - Quantificare la concentrazione di T. pallidum in una preparazione appena raccolta utilizzando un microscopio in campo scuro e una camera di Helber (passaggio 4.8). Diluire la sospensione di T. pallidum in TpCM-2 per ottenere due preparazioni con concentrazioni di 10 treponemi/mL e 40 treponemi/mL; 10 mL di ogni preparazione sono più che sufficienti per inoculare una piastra da 96 pozzetti ad ogni diluizione. Come controllo, preparare 1 mL di un'altra diluizione contenente 2 x 103 T. pallidum/mL.
- Utilizzando una pipetta standard monocanale o multicanale, inoculare 50 μL per pozzetto della preparazione da 10 T. pallidum/mL in una delle piastre da 96 pozzetti preparate, omettendo due pozzetti di controllo. Ripetere questo processo con la preparazione da 40 T. pallidum/mL e l'altra piastra. Nei due pozzetti di controllo di ciascuna piastra, inoculare la diluizione di 2 x 103 T. pallidum/mL. Questo processo produrrà piastre con (in media) 0,5 o 2 T. pallidum per pozzetto, insieme a pozzetti di controllo positivo contenenti 100 T. pallidum.
NOTA: L'efficienza di placcatura di T. pallidum è bassa in queste condizioni, quindi è probabile che anche i pozzi seminati con ~2 organismi producano popolazioni clonali. - Equilibrare le piastre con la miscela di gas a basso contenuto di O2 (passaggio 3.3.3) e incubarle in un barattolo di birra o in un incubatore tri-gas a 34 °C.
- A 7 giorni, rimuovere 100 μL di terreno da ciascun pozzetto di coltura e sostituirlo con 100 μL di TpCM-2 fresco ed equilibrato. Controllare la vitalità e la crescita di T. pallidum nei pozzetti di controllo mediante microscopia in campo scuro ed enumerazione per assicurarsi che le condizioni di coltura supportino la moltiplicazione di T. pallidum .
NOTA: Assicurarsi di utilizzare un nuovo puntale per pipetta per ogni pozzetto per evitare la contaminazione incrociata delle colture clonali. - A 14 giorni, trasferire 50 μl di surnatante di coltura da ciascun pozzetto a piastre fresche preparate come al punto 6.1.
- Ripetere l'alternanza di alimentazione e passaggio secondo necessità nei giorni 21 e 28.
- Monitorare la presenza di T. pallidum in ciascun pozzetto utilizzando la microscopia in campo scuro o la qPCR26.
NOTA: Con il lento tasso di crescita di T. pallidum e la necessaria perdita di organismi durante l'alimentazione e il trasferimento, i pozzetti seminati con 0,5 o 2 T. pallidum non sono in genere positivi con nessuno dei due metodi fino al giorno 28 o successivamente. - Una volta identificati i pozzetti positivi, tripsinizzare e trasferire questi pozzetti su piastre a 24 pozzetti per un'ulteriore espansione. Determinare la clonalità in base alla predominanza di una singola sequenza tprK e alla presenza di singole sequenze in siti eterogenei nel ceppo progenitore27.
Risultati
Utilizzando le condizioni descritte, T. pallidum mantiene tipicamente >90% di motilità e si moltiplica logaritmicamente con un tempo di raddoppio da 33 ore a 45 ore per circa 7 giorni prima di entrare nella fase stazionaria (Figura 3). Nel corso di 1 settimana, le spirochete subiscono circa 4-5 raddoppi (Figura 4). ). Inoltre, diversi ceppi di T. pallidum possono crescere a ritmi diversi. I ceppi del gruppo SS14 di T. pallidum tendono ad avere tempi di raddoppio più lenti rispetto a quelli del gruppo di Nichols17.
L'alimentazione delle colture può prolungare il tempo di coltura di diversi giorni, ma lo strato cellulare Sf1Ep spesso fallisce dopo una settimana di coltura. Inoltre, i treponemici raggiungono un limite superiore di organismi di circa 5 x 107/mL. Le colture trasferite a intervalli di 7 giorni in genere continuano la moltiplicazione logaritmica con una fase di ritardo minima o nulla. Gli organismi in fase stazionaria spesso diventano difficili da trasmettere.
La maggior parte dei T. pallidum sono attaccati alle cellule Sf1Ep. Tuttavia, nel surnatante rimane una quantità sufficiente di T. pallidum che i campioni di terreno possono essere rimossi periodicamente per verificarne la vitalità e la moltiplicazione. Se è necessaria un'attenta quantificazione, il volume del terreno rimosso deve essere misurato, il numero di T. pallidum quantificato e il numero totale di organismi rimossi deve essere aggiunto ai conteggi finali al momento del raccolto.
In studi precedenti, l'efficienza di clonazione (numero di colture positive per organismo inoculato) era del 12,5% per 2 T. pallidum inoculati per pozzetto e del 6,7% per 0,5 T. pallidum inoculati perpozzetto 27. Pertanto, è probabile che qualsiasi pozzo positivo rappresenti la crescita di un singolo organismo in uno di questi inoculi. Tuttavia, la clonalità delle popolazioni risultanti deve essere verificata esaminando la coltura per l'omogeneità in siti eterogenei nella coltura madre. Il modo più definitivo per dimostrare che la coltura è isogenica è attraverso il sequenziamento dell'intero genoma27.
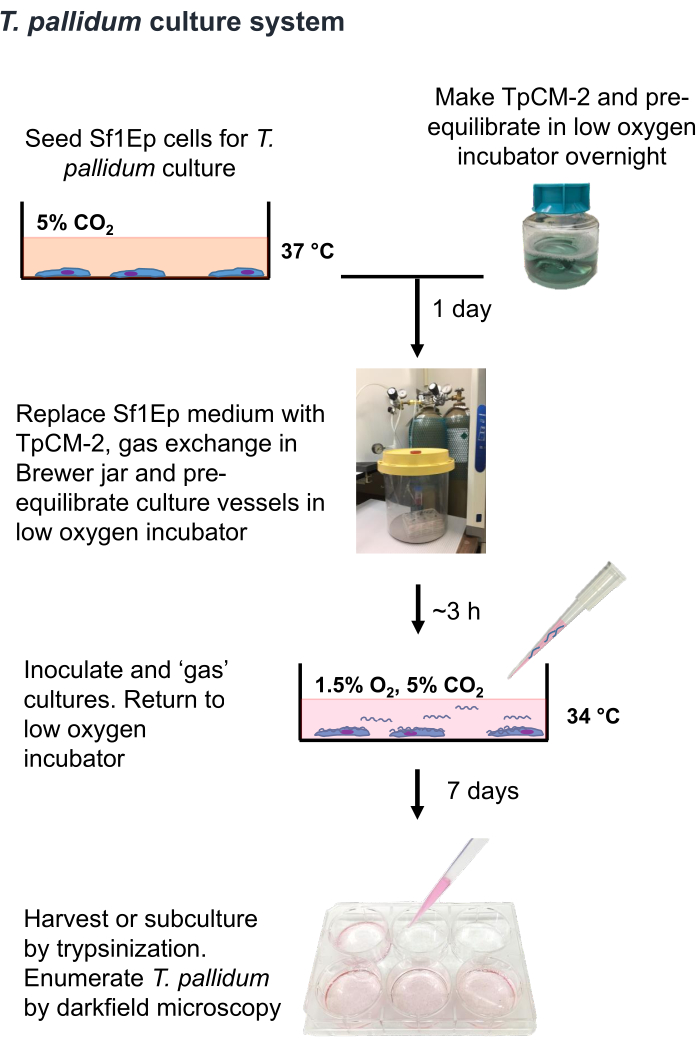
Figura 1: Diagramma di flusso della procedura di coltivazione in vitro di T. pallidumin . Questa figura è stata ristampata con il permesso di Edmondson e Norris (2021)19. Clicca qui per visualizzare una versione più grande di questa figura.
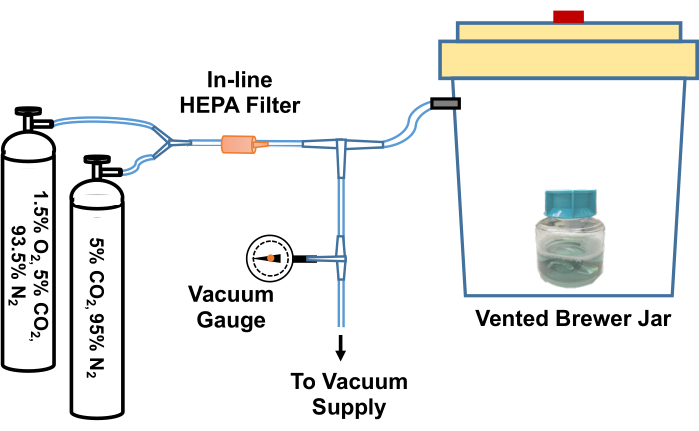
Figura 2: Diagramma del sistema per equilibrare i reagenti di coltura di T. pallidum in un ambiente a basso contenuto di ossigeno. Uno sfiato del barattolo di birra è collegato tramite un giunto a T a una fonte di vuoto (come un aspirapolvere domestico) e a bombole di gas contenenti miscele di gas personalizzate (5% CO2, azoto bilanciato e 1,5% O2, 5% CO2, azoto bilanciato). Un vacuometro in linea misura il vuoto aspirato nel barattolo. Il vuoto viene aspirato nel barattolo a circa -58 kPa. Il barattolo evacuato viene quindi riempito lentamente con le miscele di gas. Il barattolo Brewer viene riempito tre volte con il 5% di CO2, l'azoto bilanciato prima di un'evacuazione finale e riempito con il 95% di N2, il 5% di CO2, l'1,5% di O2. Le colture o i terreni vengono quindi rimossi dal barattolo e trasferiti rapidamente nell'incubatore a basso contenuto di ossigeno. In alternativa, il tubo tra il vaso Brewer e il primo giunto a T può essere bloccato saldamente, il tubo scollegato dal giunto a T e l'intero vaso Brewer può essere trasferito in un incubatore a 34 °C. Questa figura è stata ristampata con il permesso di Edmondson e Norris (2021)19. Clicca qui per visualizzare una versione più grande di questa figura.
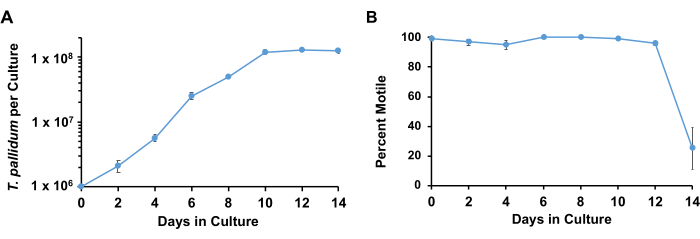
Figura 3: Curve di crescita di T. pallidum coltivate con cellule Sf1Ep con terreno TpCM-2. Colture parallele triplicate sono state seminate con T. pallidum. Le repliche sono state raccolte in ogni momento; i risultati rappresentano la media + SEM per queste culture. (A) Sono mostrate le variazioni di T. pallidum per coltura e (B) la percentuale di motilità. Questa figura è stata adattata con il permesso di Edmondson et al.18. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 4: Esempio di passaggio di coltura in vitro di T. pallidum, ceppo di Nichols. Le colture parallele di triplicato sono state seminate con T. pallidum e passate settimanalmente utilizzando una diluizione 1:20. Il grafico a dente di sega mostra il numero di T. pallidum per coltura e il numero trasferito a nuove colture in ogni momento. I risultati rappresentano la media ± SEM per tre repliche biologiche. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Volume medio e rapporti di semina per recipienti di coltura. Clicca qui per scaricare questa tabella.
Tabella 2: Terreni per la coltivazione di T. pallidum . Tutti i mezzi devono essere sterilizzati con filtro dopo la preparazione. Il terreno Sf1Ep può essere conservato a 4 °C per un massimo di due mesi. TpCM-2 viene in genere prodotto un giorno prima dell'uso. Il mezzo di dissociazione deve essere aliquotato e congelato. Clicca qui per scaricare questa tabella.
Discussione
Il sistema Sf1Ep-TpCM-2 è la prima procedura disponibile che promuove la coltura continua in vitro di T. pallidum. Il sistema è complesso a causa delle estreme esigenze di crescita di questo organismo: 1) complesse esigenze nutrizionali a causa delle limitate capacità biosintetiche; 2) un fabbisogno poco compreso di piccole quantità di ossigeno, nonostante l'elevata sensibilità alle specie reattive dell'ossigeno 9,10,16,36; e 3) l'attuale necessità della presenza di cellule Sf1Ep. Sebbene si sia tentati di "prendere scorciatoie" sulla procedura, si raccomanda di seguire attentamente i passaggi fino a quando non si ottiene una cultura di successo a lungo termine prima di provare le modifiche. Man mano che si accumulano ulteriori informazioni sui requisiti metabolici di T. pallidum, può essere possibile sviluppare condizioni assiniche che non richiedono la presenza di cellule Sf1Ep. Tuttavia, il tasso di crescita in vitro rimarrà probabilmente lento (con un tempo di raddoppio minimo compreso tra 33 e 46 ore, a seconda del ceppo)17,18, dato che T. pallidum si moltiplica a un tempo di raddoppio stimato tra 30 e 33 ore anche durante l'infezione da mammifero37,38. Come per qualsiasi coltura batterica, si raccomanda di mantenere bassi stock di passaggio e di condurre esperimenti con colture di T. pallidum che si trovano a meno di 10 passaggi da questi stock per evitare la "deriva genetica" e i cambiamenti fenotipici associati dovuti a mutazioni.
Le cellule Sf1Ep apparentemente forniscono nutrienti essenziali o attività enzimatiche ai treponemi. Tuttavia, consumano anche sostanze nutritive (come glucosio e ossigeno) e possono produrre condizioni tossiche come un pH basso 9,16,39. Pertanto, esiste un equilibrio tra l'avere un numero sufficiente di cellule Sf1Ep per supportare la moltiplicazione di T. pallidum e la prevenzione della crescita eccessiva e della tossicità delle cellule di mammifero. Un numero elevato di cellule Sf1Ep tende a crescere più velocemente e, a volte, perde la capacità di sostenere la moltiplicazione di T. pallidum. Pertanto, il numero di passaggi di Sf1Ep dovrebbe essere monitorato e le scorte cellulari dovrebbero essere sostituite periodicamente con preparati congelati a basso passaggio. La presenza di cellule Sf1Ep complica anche lo studio delle proprietà di T. pallidum come il contenuto di DNA, RNA e proteine e le attività enzimatiche. La rimozione delle celle di coniglio è possibile in una certa misura utilizzando la centrifugazione ripetuta a bassa velocità (100 x g per 5 minuti) o più efficacemente utilizzando i gradienti di Percoll o Hypaque40,41. Tuttavia, i metodi di centrifugazione in gradiente sono generalmente efficaci solo con un numero elevato di T. pallidum. I metodi alternativi per la propagazione di T. pallidum sono limitati all'infezione di animali da laboratorio come i conigli13,14. Questo approccio ha considerazioni etiche ed è diventato sempre più costoso; tuttavia, il modello di coniglio è molto utile per studiare la patogenesi di T. pallidum e le risposte immunitarie dell'ospite. Inoltre, ci sono probabilmente alcune differenze nell'espressione genica, nella crescita o nel comportamento di T. pallidum durante la coltura in vitro e l'infezione del coniglio27.
Al momento della stesura di questo rapporto, il sistema Sf1Ep-TpCM-2 è stato stabilito in almeno 6 gruppi di ricerca negli Stati Uniti e in Europa e ha portato a 16 pubblicazioni con argomenti che vanno dalla biologia di base e dalla genetica di T. pallidum alla suscettibilità antimicrobica. Il valore della coltura in vitro nello studio di questo enigmatico patogeno aumenterà probabilmente con l'ampliamento dell'uso e i miglioramenti futuri.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione R01 AI141958 dal National Institutes of Health/NIAID degli Stati Uniti. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Sigma | E8008 | |
| 10x Earle’s Balanced Salts, w/o Mg2+, Ca2+ | Gibco | 14155063 | |
| 15 and 50 mL conical sterile disposable centrifuge tubes | N/A | N/A | |
| 2 mL cryogenic vials | Corning | 430659 | |
| 6-well cell culture plates for T. pallidum cultivation | Falcon | 353046 | The plates must have low evaporation lids. |
| 70% ethanol | N/A | N/A | |
| 75 cm2 tissue culture flasks with vented caps | Corning | 43061U | |
| 93.5% nitrogen, 5% CO2, and 1.5% oxygen for pre-equilibrating medium and cultures | N/A | N/A | |
| 95% nitrogen and 5% CO2 for pre-equilibrating medium and cultures | N/A | N/A | |
| 96-well low evaporation clear, flat-bottom tissue culture-treated microplates | Corning Falcon | 353072 | |
| Adjustable multi-channel pipette with 200 ul capacity | N/A | N/A | Optional, but very helpful for cloning |
| Cell culture grade water | Sigma | W3500 | |
| CMRL 1066 without L-Glutamine or Phenol Red | US Biological | C5900-03A | |
| CO2 for tri-gas and tissue culture incubators | N/A | N/A | |
| Cryogenic liquid nitrogen cell culture storage tank | N/A | N/A | |
| D-glucose | Sigma-Aldrich | G6152 | |
| Disposable filter units, 0.2 µm , > 100 mL capacity | N/A | N/A | |
| Disposable pipets: 25 mL, 10 mL, 5 mL, aspirating | N/A | N/A | |
| DL-Dithiothreitol | Sigma-Aldrich | D9779 | |
| D-Mannitol | Sigma-Aldrich | M1902 | |
| DMSO (sterile cell culture grade ) | Sigma-Aldrich | D2650 | |
| Eagle’s MEM | Sigma-Aldrich | M4655 | |
| Fetal bovine serum, heat inactivated | Sigma-Aldrich | F4135 | We highly recommend this product. Must pre-screen for T. pallidum culture compatibility if using a different brand or catalog number. |
| Freezer with capability of maintaining -70 °C or -80 °C | N/A | N/A | For storage of T. pallidum; liquid nitrogen storage may be used instead |
| Freezing medium (Sf1Ep medium + 10% [v/v] DMSO) | N/A | N/A | |
| Gas cylinders with appropriate fittings | N/A | N/A | |
| GasPak 150 vented anaerobic jar (Brewer Jar) | Fisher Scientific | 11-816 | |
| Glycerol | N/A | N/A | |
| Helber counting chambers with Thoma rulings | Hawksley Medical and Laboratory Equipment | For quantitating T. pallidum | |
| Hemocytometer | N/A | N/A | For Sf1Ep cell quantitation |
| Incubator tank switch | NuAire | NU-1550 TankGuard Automatic CO2 Incubator Tank Switch | Optional, but very helpful in maintaining appropriate O2 conditions. |
| Inverted microscope with phase contrast optics | N/A | N/A | For viewing Sf1Ep cell cultures |
| L-Glutamine | Sigma-Aldrich | G7513 | |
| L-Histidine | Sigma-Aldrich | H6034 | |
| MEM Non-Essential Amino Acids | Gibco | 11140-050 | |
| Microscope with darkfield condensor | N/A | N/A | The microscope should have a 40x objective and 15x eyepieces. |
| MOPS | Sigma-Aldrich | M3183 | |
| Multi-channel adapter for aspirator | Integra | 155520 | Optional, but useful for cloning |
| NaHCO3 (7.5%) | Sigma-Aldrich | S8761 | |
| Nitrogen for tri-gas incubator | N/A | N/A | |
| Resazurin | Sigma-Aldrich | R7017 | |
| Sf1Ep (NBL-11) cells | American Type Culture Collection | CCL-68 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Sterile PBS (without calcium chloride and magnesium chloride) | Sigma-Aldrich | D8537 | |
| Sterile reagent reservoirs, 50 or 100 mL size | N/A | N/A | |
| T. pallidum sample, frozen or fresh | from a rabbit infection or in vitro culture | ||
| Tissue culture incubator maintained at 37 °C, 5% CO2 | N/A | N/A | |
| Tri-gas tissue culture incubator maintained at 34 °C, 5% CO2, 1.5% O2 | Thermofisher | Heracell™ VIOS 160i Tri-Gas CO2 Incubator | Optional; anaerobic jars may be used instead (see Ref. 17) |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Vacuum source (e.g. house vacuum), vacuum tubing, vacuum gauge, and connectors | N/A | N/A | |
| Water, suitable for cell culture, filter-sterilized, purified | Sigma-Aldrich | W3500 | Recommended for medium preparation; decreases culture variability |
Riferimenti
- Implementing the global health sector strategies on HIV, viral hepatitis and sexually transmitted infections, 2022-2030: Report on progress and gaps. World Health Organization Available from: https://www.who.int/publications/i/item/9789240094925 (2024)
- Antal, G. M., Lukehart, S. A., Meheus, A. Z. The endemic treponematoses. Microbes Infect. 4 (1), 83-94 (2002).
- Norris, S. J., Paster, B. J., Smibert, R. M. . Bergey's Manual of Systematic Bacteriology. 4, (2010).
- Lumeij, J. T., Mikalová, L., Šmajs, D. Is there a difference between hare syphilis and rabbit syphilis? Cross infection experiments between rabbits and hares. Vet Microbiol. 164 (1-2), 190-194 (2013).
- Knauf, S., et al. High prevalence and genetic diversity of Treponema paraluisleporidarum isolates in European lagomorphs. Microbiol Spectr. 12 (1), e0177423 (2024).
- Šmajs, D., et al. Complete genome sequence of Treponema paraluiscuniculi, strain Cuniculi A: the loss of infectivity to humans is associated with genome decay. PLoS One. 6 (5), e20415 (2011).
- Šmajs, D., Norris, S. J., Weinstock, G. M. Genetic diversity in Treponema pallidum: implications for pathogenesis, evolution and molecular diagnostics of syphilis and yaws. Infect Genet Evol. 12 (2), 191-202 (2012).
- Šmajs, D., Strouhal, M., Knauf, S. Genetics of human and animal uncultivable treponemal pathogens. Infect Genet Evol. 61, 92-107 (2018).
- Norris, S. J., Cox, D. L., Weinstock, G. M. Biology of Treponema pallidum: correlation of functional activities with genome sequence data. J Mol Microbiol Biotechnol. 3 (1), 37-62 (2001).
- Radolf, J. D., et al. Treponema pallidum, the syphilis spirochete: making a living as a stealth pathogen. Nat Rev Microbiol. 14 (12), 744-759 (2016).
- Schaudinn, F. R., Hoffman, E. Vorläufiger bericht über das Vorkommen für Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen. Arb Gesundh Amt Berlin. 22, 528-534 (1905).
- Schaudinn, F., Hoffmann, E. Über Spirochaetenbefunde im Lymphdrüsensaft Syphilitischer. Deut Med Wochenschr. 31 (18), 711-714 (1905).
- Turner, T. B., Hollander, D. H. Biology of the treponematoses. World Health Organization. , (1957).
- Lukehart, S. A., Marra, C. M. Isolation and laboratory maintenance of Treponema pallidum. Curr Protoc Microbiol. , (2007).
- Fieldsteel, A. H., Cox, D. L., Moeckli, R. A. Cultivation of virulent Treponema pallidum in tissue culture. Infect Immun. 32, 908-915 (1981).
- Cox, D. L. Culture of Treponema pallidum. Meth Enzymol. 236, 390-405 (1994).
- Edmondson, D. G., Hu, B., Norris, S. J. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio. 9 (3), e01153-e01218 (2018).
- Edmondson, D. G., DeLay, B. D., Kowis, L. E., Norris, S. J. Parameters affecting continuous in vitro culture of Treponema pallidum strains. mBio. 12 (1), e03536-e03620 (2021).
- Edmondson, D. G., Norris, S. J. In vitro cultivation of the syphilis spirochete Treponema pallidum. Curr Protoc. 1 (2), e44 (2021).
- Edmondson, D. G., Wormser, G. P., Norris, S. J. In vitro susceptibility of Treponema pallidum subsp. pallidum to doxycycline. Antimicrob Agents Chemother. 64 (10), e00979-e01020 (2020).
- Leimer, N., et al. A selective antibiotic for Lyme disease. Cell. 184 (21), 5405-5418 (2021).
- Haynes, A. M., et al. Efficacy of linezolid on Treponema pallidum, the syphilis agent: A preclinical study. EBioMedicine. 65, 103281 (2021).
- Houston, S., et al. Identification and functional characterization of peptides with antimicrobial activity From the syphilis spirochete, Treponema pallidum. Front Microbiol. 13, 888525 (2022).
- Tantalo, L. C., et al. Antimicrobial susceptibility of Treponema pallidum subspecies pallidum: an in-vitro study. Lancet Microbe. 4 (12), e994-e1004 (2023).
- Hayes, K. A., Dressler, J. M., Norris, S. J., Edmondson, D. G., Jutras, B. L. A large screen identifies beta-lactam antibiotics which can be repurposed to target the syphilis agent. NPJ Antimicrob Resist. 1 (1), 4 (2023).
- Tantalo, L. C., Molini, B. J., Bose, M., Klausner, J. D., Giacani, L. In vitro isolation of Treponema pallidum subsp. pallidum from fresh and frozen needle aspirates of primary experimental syphilis lesions. Sex Transm Dis. 50 (3), 180-183 (2023).
- Edmondson, D. G., De Lay, B. D., Hanson, B. M., Kowis, L. E., Norris, S. J. Clonal isolates of Treponema pallidum subsp. pallidum Nichols provide evidence for the occurrence of microevolution during experimental rabbit infection and in vitro culture. PLoS One. 18 (3), e0281187 (2023).
- Lin, M. J., et al. Longitudinal TprK profiling of in vivo and in vitro-propagated Treponema pallidum subsp. pallidum reveals accumulation of antigenic variants in absence of immune pressure. PLoS Negl Trop Dis. 15 (9), e0009753 (2021).
- De Lay, B. D., Cameron, T. A., De Lay, N. R., Norris, S. J., Edmondson, D. G. Comparison of transcriptional profiles of Treponema pallidum during experimental infection of rabbits and in vitro culture: Highly similar, yet different. PLoS Pathog. 17 (9), e1009949 (2021).
- Romeis, E., et al. Genetic engineering of Treponema pallidum subsp. pallidum, the syphilis spirochete. PLoS Pathog. 17 (7), e1009612 (2021).
- Phan, A., Romeis, E., Tantalo, L., Giacani, L. In vitro transformation and selection of Treponema pallidum subsp. pallidum. Curr Protoc. 2 (8), e507 (2022).
- Romeis, E., et al. Treponema pallidum subsp. pallidum with an artificially impaired TprK antigenic variation system is attenuated in the rabbit model of syphilis. bioRxiv. , 524629 (2023).
- Fieldsteel, A. H., Becker, F. A., Stout, J. G. Prolonged survival of virulent Treponema pallidum (Nichols strain) in cell-free and tissue culture systems. Infect Immun. 18, 173-182 (1977).
- U.S. Department of Health and Human Services. Biosafety in Microbiological and Biomedical Laboratories (BMBL) 6th Edition. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institutes of Health. , (2020).
- Norris, S. J., Miller, J. N., Sykes, J. A., Fitzgerald, T. J. Influence of oxygen tension, sulfhydryl compounds, and serum on the motility and virulence of Treponema pallidum (Nichols strain) in a cell- free system. Infect Immun. 22 (3), 689-697 (1978).
- Cox, C. D., Barber, M. K. Oxygen uptake by Treponema pallidum. Infect Immun. 10 (1), 123-127 (1974).
- Magnuson, H. J., Eagle, H. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain), and a consideration of its rate of multiplication in vivo. Am J Syph. 32, 1-18 (1948).
- Cumberland, M. C., Turner, T. B. The rate of multiplication of Treponema pallidum in normal and immune rabbits. Am J Syph. 33, 201-211 (1949).
- Norris, S. J., Edmondson, D. G. Factors affecting the multiplication and subculture of Treponema pallidum subsp. pallidum in a tissue culture system. Infect Immun. 53, 534-539 (1987).
- Baseman, J. B., Nichols, J. C., Rumpp, O., Hayes, N. S. Purification of Treponema pallidum from infected rabbit tissue: resolution into two treponemal populations. Infect Immun. 10, 1062-1067 (1974).
- Hanff, P. A., Norris, S. J., Lovett, M. A., Miller, J. N. Purification of Treponema pallidum, Nichols strain, by Percoll density gradient centrifugation. Sex Transm Dis. 11, 275-286 (1984).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon