A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياسات مجهر القوة الذرية للغضروف في أطراف قنافذ البحر السليمة والمتجددة
* These authors contributed equally
In This Article
Summary
في هذا البروتوكول ، نوضح كيفية تحضير أنسجة قنافذ البحر للفحص المجهري للقوة الذرية (AFM) وإجراء قياسات المسافة البادئة في غضروف الأطراف السليم والمتجدد.
Abstract
توفر القوى الميكانيكية إشارات مهمة لوظيفة الخلية الطبيعية وتكوين الأنماط في الأنسجة النامية ، وقد تمت دراسة دورها على نطاق واسع أثناء التطور الجنيني والتسبب في المرض. نسبيا ، لا يعرف سوى القليل عن هذه الإشارات أثناء تجديد.
قنافذ البحر هي كائن حي نموذجي مهم لدراسة التجديد ، نظرا لقدرته على استعادة العديد من الأعضاء والأنسجة بالكامل بعد الإصابة ، بما في ذلك الغضاريف والعظام المفقودة. نظرا لدورها الحاسم كنسيج داعم رئيسي في جسم الفقاريات ، فإن استعادة وظيفة الهيكل العظمي أثناء التجديد تتطلب استعادة الهياكل المفقودة بالإضافة إلى خصائصها الميكانيكية. يصف هذا البروتوكول طريقة لمعالجة عينات أطراف قنافذ البحر للفحص المجهري للقوة الذرية (AFM) ، وهو المعيار الذهبي لاستكشاف الخصائص الميكانيكية للخلايا والأنسجة بدقة مكانية عالية.
من خلال الاستفادة من القدرات التجديدية لقنفذ قنافذ البحر ، قامت هذه الدراسة بقياس تصلب غضروف الأطراف أثناء التوازن ومرحلتين من تجديد الأطراف: تحلل أنسجة الأنسجة وتكثيف الغضاريف. نوضح أن AFM هي أداة قيمة لاكتساب رؤى حول إعادة هيكلة الأنسجة الديناميكية والتغيرات الميكانيكية التي تحدث أثناء التجديد.
Introduction
يوفر الهيكل العظمي ، وخاصة الغضاريف والعظام ، الدعم الميكانيكي الرئيسي للأنسجة الرخوة في الجسم في الفقاريات. لذلك ، من المرجح أن يؤدي أي ضرر في نظام الهيكل العظمي إلى الإضرار بشكل كبير بالوظائف وحتى البقاء على قيد الحياة. في البشر ، تعد كسور العظام واحدة من أكثر الإصابات الرضحية شيوعا1 ، والتي يتم إصلاح معظمها في غضون أسابيع ، ولكن 5٪ -10٪ منها ستعاني من تأخير في الشفاء أو لن تتعافى تماما2،3. علاوة على ذلك ، لا يستطيع البشر التعافي من فقدان العظام أو الغضاريف علىنطاق واسع 4،5. ومع ذلك ، يمكن لبعض السمندل تجديد مجموعة متنوعة من هياكل الجسم ، بما في ذلك الأطراف الكاملة6 ، مما يجعلها نموذجا مثاليا لدراسة تجديد الهيكل العظمي.
قنافذ البحر (Ambystoma mexicanum) هو نوع من السمندل حيث تمت دراسة تجديد الأطراف على نطاق واسع. تحدث هذه العملية في أربع مراحل رئيسية متسلسلة ولكنها متداخلة: 1) التئام الجروح ، 2) الالتهاب / الانحلال النسيجي ، 3) تكوين الأريمية ، و 4) نمو / تمايز الأريمية (تمت مراجعتها في7،8). بعد البتر ، تهاجر الخلايا الكيراتينية المتاخمة لموقع الإصابة بسرعة ، وتغلق الجرح وتشكل ظهارة الجرح (WE). أثناء الالتهاب والتحلل النسيجي الذي أعقب ذلك ، يتم التخلص من مسببات الأمراض ، ويتم إزالة الحطام والخلايا التالفة ، ويتم إعادة تشكيل المصفوفة خارج الخلية (ECM) تحت سطح البتر9. يعد تحلل الأنسجة النسيجي ضروريا لتجديد الأطراف10 ، حيث يعد إفراز الإنزيمات المحللة للبروتين أمرا بالغ الأهمية ليس فقط لإعادة تشكيل ECM بشكل عام ، ولكن أيضا لإطلاق الخلايا التي تؤدي إلى ظهور الأريمية وتحرير الجزيئات النشطة بيولوجيا المعزولة في ECMنفسها 8. في الواقع ، أظهرت الدراسات في العديد من السياقات التجديدية والكائنات الحية النموذجية أن الخصائص المادية الفريدة ل ECM أثناء التحلل النسيجي قادرة على إحداث عمليات عدم التمايز أو توجيه هجرة الخلايا نحو موقع الإصابة (تمت مراجعته في11). علاوة على ذلك ، أظهر ارتشاف الأنسجة المتكلسة خلال المراحل المتأخرة من تحلل الأنسجة أنه مفتاح التكامل السليم لعناصر الهيكل العظمي للأطراف المشكلة حديثا12. بعد مرحلة الانحلال النسيجي ، تتشكل الأريمة تحت ظهارة الجرح (WE) كتراكم لأسلاف غير متمايزة ومتعددة السلالات الناتجة عن خلايا الأنسجة الناضجة غير المتمايزة أو الخلايا الجذعية المقيمة. تتكاثر خلايا الأريمة وتتمايز إلى جميع أنواع الخلايا المفقودة. أخيرا ، يحدث تشكل الأطراف ، حيث يتم تجديد الأنسجة الهيكلية من خلال تكثيف الغضروفات المشتقة من الخلايا الهيكلية التمعوجية والخلايا الليفية الجلدية المتمايزة13،14،15.
على الرغم من أن العديد من الإشارات الكيميائية الحيوية التي تنظم التغييرات في هوية الخلية وتكوين ECM قد تمتحديدها 10،13،14،16،17،18 ، إلا أن الخصائص الميكانيكية للأنسجة خلال المراحل المختلفة لتجديد الأطراف ، بالإضافة إلى تأثيرها في التجديد ، ظلت غير مستكشفة إلى حد كبير. أظهرت العديد من الدراسات أن الخلايا تستشعر وتدمج الإشارات الميكانيكية التي تنظم مصيرها وسلوكها في عدة سياقات (تمت مراجعتها في19،20). لذلك ، فإن استكمال معرفتنا الخلوية والجزيئية بتجديد الأطراف بالقياسات الميكانيكية للأنسجة سيحسن بشكل كبير فهمنا لهذه العمليات.
تم تطوير تقنيات مختلفة تسمح بالتوصيف الميكانيكي والتلاعب بالقوة للعيناتالبيولوجية 21. من بين هذه التقنيات ، أصبح الفحص المجهري للقوة الذرية (AFM) هو المعيار الذهبي في علم الأحياء الميكانيكي ، حيث يتم فحص الخصائص اللزجة المرنة للعينات البيولوجية بدقة مكانية عالية عن طريق المسافة البادئة باستخدام مستشعر القوة فائقة الحساسية ، ناتئ AFM22. نظرا لأن هذه التقنية تتطلب اتصالا مباشرا بالعينة ، فعادة ما يتم إنشاء شرائح الأنسجة ، والتي قد تكون صعبة في بعض الحالات. وبالتالي ، يجب تكييف ظروف التحضير وتحسينها لكل عينة معينة بحيث يمكن أن تظل قريبة من الظروف الفسيولوجية قدر الإمكان ويتم إنشاء الحد الأدنى من القطعالأثرية 23. يصف هذا البروتوكول كيفية قياس تصلب الأنسجة في أطراف قنافذ البحر باستخدام AFM ، مع التركيز على الأنسجة الغضروفية في الظروف السليمة ، أثناء الخضوع لتحلل الأنسجة ، وفي مراحل تكثيف الغضروف (الشكل 1 والشكل 2). يمكن توسيع هذه الطريقة لقياس أنواع الأنسجة الأخرى أيضا.
Protocol
نمت قنافذ البحر (Ambystoma mexicanum) في منشأة Axolotl التابعة لمركز العلاجات التجديدية في دريسدن (CRTD) التابع لجامعة دريسدن للتكنولوجيا (TUD). يمكن العثور على وصف كامل لظروف التربية في24. باختصار ، تم الاحتفاظ بالغرف عند 20-22 درجة مئوية مع دورة نهارية / ليلية 12/12 ساعة. تم إجراء جميع عمليات المناولة والجراحة وفقا لإرشادات لجنة الأخلاقيات المحلية وتمت الموافقة عليها من قبل Landesdirektion Sachsen ، ألمانيا.
استخدمت هذه الدراسة قنافذ البحر البيضاء (d / d) لجميع التجارب ، وهي سلالة متحولة تحدث بشكل طبيعي تفتقر إلى تصبغ الجسم (القليل من الميلانوفورات والزانثوفورات أو بدونها) ، مع قزحية العين فقط في قزحية العينين. استخدمت هذه الدراسة قنافذ البحر بقياس 8-15 سم من الخطم إلى الذيل (5-7 أشهر) دون تحيز خاص بالجنس.
1. التحضير
- قم بإعداد محلول مخزون البنزوكايين بنسبة 10٪ (وزن / حجم) الذي سيتم استخدامه للتخدير والقتل الرحيم لقنفذ قنافذ البحر (انظر أدناه). لهذا الغرض ، اخلطي 50 جم من البنزوكايين في زجاجة حجمية مع 100٪ إيثانول حتى يتم الوصول إلى حد 500 مل.
- تحضير محلول مخزون البنزوكايين بنسبة 0.03٪ (وزن / حجم).
- للحصول على 1 لتر ، امزج 50 مل من محلول ملحي 10x Tris-buffered (TBS) مع 30 مل من 10٪ (وزن / حجم) البنزوكايين و 5 مل من 4000٪ (وزن / حجم) محاليل Holtfreter مع 915 مل من الماء المقطر واخلطها طوال الليل باستخدام قضيب تقليب مغناطيسي.
- للحصول على 1 لتر من محلول 10x TBS ، اخلطي 24.2 جم من قاعدة Trizma و 90 جم من كلوريد الصوديوم مع 990 مل من الماء منزوع الأيونات. تخلط جيدا مع شريط التحريك المغناطيسي. ثم أضف ما يقرب من 10 مل من حمض الهيدروكلوريك المركز (12 م أو 37٪) واضبط درجة الحموضة 8.
- للحصول على 1 لتر من محلول هولتفريتر 4000٪ (وزن / حجم) ، اخلطي 158.4 جم من كلوريد الصوديوم ، و 11.13 جم من MgSO4 · 7 ساعات2O ، و 5.36 جم من CaCl2 · 2 H2O و 2.88 جم من KCl مع الماء منزوع الأيونات حتى 1 لتر.
- قم بإعداد 0.01٪ (وزن / حجم) تخفيف البنزوكايين العامل في خزان المياه للتخدير عن طريق تخفيف محلول المخزون 0.03٪ (وزن / حجم) 1: 3.
- للحصول على 1 لتر من المحلول ، استخدم 333 مل من محلول مخزون البنزوكايين بالإضافة إلى 666 مل من مياه الخزان.
- تحضير محلول مخزون طرطرات بوتورفانول 5 مجم / مل للتسكين. لهذا الغرض ، اخلطي 100 مجم من ملح البوتورفانول (+) - طرطرات مع 20 مل من الماء عالي النقاء. قم بتخزين الحصص عند 4 درجات مئوية.
- في يوم البتر ، قم بإعداد محلول عمل 0.5 مجم / لتر من طرطرات البوتورفانول لتقليل آلام بعد العمليات الجراحية عن طريق تخفيف محلول المرق 1: 10.000 في مياه الخزان.
- بالنسبة للحيوانات التي يقل طولها عن 8 سم ، امزج 20 ميكرولتر من محلول المرق في 200 مل من مياه الخزان.
- بالنسبة للحيوانات الكبيرة ، امزج 60 ميكرولتر من محلول المرق في 600 مل من مياه الخزان.
- قم بإعداد محلول ملحي معقم مخزن بالفوسفات البرمائي (APBS) ، وهو محلول PBS بنسبة 80٪ (حجم / حجم) ، واحتفظ به في درجة حرارة الغرفة (RT) عن طريق خلط 800 مل من DPBS مع 200 مل من الماء منزوع الأيونات.
- تحضير محلول مخزون الأنسولين 1 مجم / مل. لهذا الغرض ، اخلطي 250 مجم من مسحوق الأنسولين مع 25 مل من حمض الهيدروكلوريك 0.1 م وحركيه ببطء حتى يذوب. أثناء التقليب ، أضف 225 مل من APBS حتى يصبح المحلول صافيا. قم بفلتر معقم ، وقم بتخزين 4 مل من الكميات عند -20 درجة مئوية.
- تحضير وسط مزرعة معقم (الكل٪ (حجم / حجم): 62.5٪ L15 متوسط ، 10٪ FBS معطل بالحرارة ، 1٪ بنسلين / ستربتومايسين ، 1٪ أنسولين ، 1٪ ل-جلوتامين) واحتفظ به عند 4 درجات مئوية حتى يوم الاستخدام. في اليوم التجريبي ، قم بالتوازن مع RT قبل الاستخدام.
- بالنسبة ل 400 مل من وسط الاستزراع ، استخدم 250 مل من وسط L15 ، و 40 مل من FBS المعطل بالحرارة ، و 4 مل من البنسلين / الستربتومايسين ، و 4 مل من محلول الأنسولين (من الخطوة 1.7) ، و 4 مل من L-Glutamine ، و 98 مل من الماء المعقم منزوع الأيونات. تحضير في ظروف معقمة وفلتر معقم بعد خلط جميع المكونات. تحضير 15 مل من الحصص الصغيرة.
- تحضير 2.5٪ و 3٪ (وزن / حجم) نقطة انصهار منخفضة (lmp) - agarose في محلول APBS وتسخينه عند 70 درجة مئوية لإذابة الاغاروز تماما. تحضير الحصص في أنابيب سعة 1.5 مل وتخزينها في درجة حرارة 4 درجات مئوية حتى يوم الاستخدام.
- للحصول على 20 مل من 2.5٪ (وزن / حجم) lmp-agarose ، اخلطي 0.5 جم من lmp-agarose مع 20 مل من APBS في أنبوب 50 مل وتسخينه في حمام مائي عند 70 درجة مئوية حتى يذوب الاغاروز تماما. يجب أن يصبح الحل واضحا وشفافا. تحضير الحصص وهي لا تزال دافئة.
- للحصول على 20 مل من 3٪ (وزن / حجم) lmp-agarose ، امزج 0.6 جم من lmp-agarose مع 20 مل من APBS واستمر على النحو الوارد أعلاه.
- (اختياري): للحصول على 20 مل من 1٪ (وزن / حجم) lmp-agarose ، امزج 0.2 جم من lmp-agarose مع 20 مل من APBS واستمر على النحو الوارد أعلاه.
ملاحظة: يعتمد وقت الانصهار على تركيز lmp-agarose وقد يتراوح من 15-40 دقيقة تقريبا.
- للبتر وتركيب الأنسجة، استخدم منظار مجسمة للمجال الساطع.
- قم بتجميع أطباق بتري بلاستيكية بقطر 100 مم ، وملقط ، ومشرط ، ومقص جراحي لعمليات البتر وجمع الأنسجة.
- قم بإعداد أطباق بتري بلاستيكية بقطر 35 مم لقياسات المسافة البادئة.
- تحضير أسطوانات بطول ~ 1 سم بقطر ~ 1 سم. لهذا الغرض ، قم بتسخين قاطع من الورق المقوى تحت لهب موقد بنسن وقطع أنبوب 15 مل بالشفرة الساخنة.
- قطع مربعات صغيرة 1 سم2 من البارافيلم وتخزينها.
- قم بإعداد كتلة معدنية أو باردة عند -20 درجة مئوية عن طريق تركها في الفريزر لمدة 1 ساعة على الأقل.
- تحضير ماصات باستور البلاستيكية.
- (اختياري): تحضير محلول MEMFa المثبت (3- (N-morpholino) حمض البروبان سلفونيك [MOPS] 0.1 M درجة الحموضة 7.4 ، الإيثيلين جلايكول مكرر (2-أمينوإيثيل إيثر) -N ، N ، N ′ ، N ′ - حمض رباعي الأسيتيك [EGTA] 2 ملي مولار ، MgSO4 · 7 ساعة2O 1 ملي مولار ، 3.7٪ فورمالديهايد). لهذا ، أضف 10.465 جم من MOPS ، و 0.123 جم من MgSO4 · 7H2O ، و 2 مل من 0.5 M EDTA pH 8.0 ، وأضف الماء حتى 45 مل. أضف 5 مل من الفورمالديهايد 37٪ (وزن / حجم) إلى الحجم الإجمالي 50 مل.
2. الكواشف
- ارجع إلى جدول المواد للتعرف على الكواشف المستخدمة في هذا العمل ، ولكن يمكن أيضا استخدام مزودين تجاريين آخرين.
3. بتر قنافذ البحر وتجديد الأطراف
- قبل جميع الإجراءات التجريبية ، قم بتخدير بنسبة 0.01٪ (وزن / حجم) بنزوكائين مخفف في خزان مياه (الخطوة 1.3) لمدة 20 دقيقة ، مع التأكد من أن مخدر بعمق ولا تستجيب للمنبهات اللمسية.
- قم بإزالة قنافذ البحر من التخدير وضعها فوق طبق بتري مقاس 100 مم يحتوي على منديل ورقي مبلل بالماء المحتوي على التخدير. قم بتوجيه الطرف بشكل عمودي على محور الجسم وضع اللوحة تحت المجسم للحصول على تصور أفضل.
ملاحظة: تم استخدام مجسم مع مصباح رقبة أوزة مدمج هنا. - بتر الطرف بمشرط معقم حاد بعيد مباشرة عن المنطقة المتكلسة في منطقة الزيوغوبودال (نصف القطر / الزند) (الشكل 1 أ).
ملاحظة: الالتزام بمبدأ رعاية 3R ، يوصى باستخدام الأطراف التي تمت إزالتها في البداية عن طريق البتر كضوابط سليمة. - اترك على الطبق وقم بتغطيته بمناديل ورقية مبللة بالماء المحتوي على البنزوكايين لمدة 15 دقيقة للسماح بتخثر الدم وإغلاق الجرح.
- يجب إعادة إلى خزان يحتوي على مياه عذبة مع المسكنات (طرطرات البوتورفانول، 0.5 ملغم/لتر، من الخطوة 1.5).
- انقل إلى خزانها الأصلي الذي يحتوي على مياه عذبة بعد 24 ساعة من العلاج المسكن بعد الجراحة.
- اسمح للحيوانات بالتجدد حتى المرحلة المطلوبة من الاهتمام.
ملاحظة: تم جمع الأطراف التي تم تحليلها في يوم البتر للمرحلة السليمة و 5 أيام بعد البتر (dpa) لمرحلة الانحلال النسيجي في البالغة من العمر 5 أشهر. تم قياس مرحلة تكثيف الغضروف عند 21 نقطة في البالغة من العمر 7 أشهر.
4. تركيب الأنسجة ومعالجتها للقياسات
- قم بتسخين الأنابيب سعة 1.5 مل التي تحتوي على 2.5٪ أو 3٪ (وزن / حجم) lmp-agarose (من الخطوة 1.9) على كتلة حرارية عند 70 درجة مئوية حتى يذوب الاغاروز تماما. قم بتغيير الأنابيب إلى كتلة حرارية مختلفة عند 37 درجة مئوية واترك درجة الحرارة تتوازن قبل الاستخدام.
ملاحظة: هنا ، تم استخدام 2.5٪ lmp-agarose لقياس الأنسجة المتجددة و 3٪ للأنسجة السليمة. - قم بتغطية جانب واحد من الأسطوانات التي يبلغ طولها 1 سم (من الخطوة 1.13) بإحدى قطع البارافيلم (الخطوة 1.14) بحيث يتم إغلاقها تماما في أسفلها.
- موازنة 15 مل من الحصص من وسط الاستزراع إلى RT (من الخطوة 1.8)
- تخدير عن طريق غمرها في ماء يحتوي على مخدر (0.01٪ (وزن / حجم) بنزوكائين مخفف في مياه الخزان) لمدة 20 دقيقة على الأقل.
- قم بتصوير الأطراف تحت مجسم باستخدام برنامج يسمح بالقياسات الكمية. قم بقياس طول الهيكل محل الاهتمام واحسب كمية الأنسجة التي يجب إزالتها من الطرف البعيد للطرف حتى يتم الوصول إلى قسم الاهتمام.
- لتجديد الأطراف ، اجمعها عن طريق القطع بمشرط و / أو مقص جراحي على مستوى الكوع وتشريح الأنسجة الزائدة من الطرف. اترك الأنسجة في محلول APBS أثناء التحضير للخطوة التالية. تأكد من أن القطع عرضي (90 درجة) إلى محور الذراع السفلي لإنشاء سطح مستو. بالنسبة للأطراف السليمة ، قم بإزالة اليد عن طريق قطع منطقة الرسغ.
- قتل عن طريق تعريضها لجرعة قاتلة من التخدير (0.1٪ بنزوكائين) لمدة 20 دقيقة على الأقل. لهذا ، أضف الحجم المطلوب من محلول البنزوكايين بنسبة 10٪ (وزن / حجم) للوصول إلى تركيز 0.1٪ (وزن / حجم).
- إذا تم تخدير في 100 مل من محلول البنزوكايين 0.01٪ (وزن / حجم) ، أضف 900 ميكرولتر من محلول البنزوكايين بنسبة 10٪ (وزن / حجم).
- اشطف الأطراف عن طريق غمرها في محلول APBS.
- تأكد من أن ماصات باستور والكتلة الحرارية (المثبتة عند 37 درجة مئوية مع حصص أغروز) قريبة من محطة العمل. أخرج الكتلة الباردة من الفريزر -20 درجة مئوية وضع الأسطوانة بحيث يكون الطرف المغطى بالبارافيلم متجها لأسفل فوقها.
- أمسك الطرف المقطوع وقم بإزالة السائل الزائد برفق باستخدام المناديل الورقية. ضع الطرف على طبق نظيف ، وأضف lmp-agarose المذاب في الأعلى ، وحرك الطرف لفترة وجيزة في الاغاروز لإزاحة أي APBS متبقية من سطح الجلد.
- اعمل بسرعة ، ضع الطرف داخل الأسطوانة ، مع التأكد من توجيهه عموديا ، بحيث تكون منطقة الاهتمام متجهة لأعلى.
- أثناء إمساك الطرف برفق بالملقط ، أضف lmp-agarose داخل الأسطوانة حتى يتم تغطية الأنسجة بالكامل. قم بإزالة الملقط برفق قبل أن يتجمد الاغاروز.
- قم بإزالة الأسطوانة من الكتلة الباردة واترك الاغاروز يتجمد تماما عند RT لمدة 30 ثانية تقريبا.
- خذ كتلة الاغاروز المحتوية على الأنسجة على الفور إلى غرفة الاهتزاز ، جنبا إلى جنب مع وسط الثقافة المعقمة و APBS ، في RT.
- قم بإزالة البارافيلم من أسفل الأسطوانة وقم بتوصيل الاغاروز الذي يحتوي على الأنسجة بمرحلة الاهتزاز باستخدام غراء سيانواكريلات. تأكد من لصق كل من الاغاروز والعينة على المسرح.
- قم بغمر المرحلة في APBS للتقسيم.
ملاحظة: تشمل الأنسجة السليمة العظام / الغضاريف الأكثر صلابة ، في حين أن الأنسجة المتجددة تكون أكثر ليونة. لذلك ، يجب تعديل معلمات الاهتزاز وفقا لذلك. استخدمت هذه الدراسة المعلمات التالية: الأنسجة السليمة (السعة 1.2 مم والسرعة 0.1 مم / ثانية) والأنسجة المتجددة (السعة 0.9 مم والسرعة 0.4 مم / ثانية). - ابدأ في تقسيم الاغاروز في خطوات قصيرة (على سبيل المثال ، في خطوات 100 ميكرومتر) حتى يتم الوصول إلى طرف الأنسجة. بعد ذلك ، قم بتقسيم كتلة الأنسجة حتى تتم إزالة الجزء البعيد من الأنسجة (المحسوب في الخطوة 4.5). بهذه الطريقة ، سيكون من السهل الوصول إلى مقطع عرضي لمنطقة الاهتمام.
ملاحظة: سيحتوي قسم الأنسجة الذي تمت إزالته على السطح المجاور مباشرة للسطح الذي تم فحصه باستخدام AFM ويمكن أن يكون بمثابة مرجع لبنية الأنسجة. لذلك ، يمكن استخدامه للتحليل التكميلي المباشر أو تثبيته للتلوين اللاحق (انظر القسم 6). - قم بإزالة الكتلة المحتوية على الأنسجة بعناية من مرحلة الاهتزاز بشفرة حلاقة وإزالة جميع آثار الغراء. قم بلصق الكتلة على الفور على طبق بتري بلاستيكي مقاس 35 مم بغراء لاصق للأنسجة الجراحية وأضف ما يقرب من 2 مل من وسط الثقافة في RT لضمان تغطية الأنسجة بالكامل.
ملاحظة: سطح الأنسجة المكشوف في كتلة الاغاروز هو السطح المراد فحصه.
5. القياسات مع AFM
- قبل يوم واحد على الأقل من القياسات ، قم بإعداد الكابولي للقياسات.
ملاحظة: بالنسبة لهذا العمل ، تم تشغيل ناتئ السيليكون الخالي من الأطراف بخرز البوليسترين (قطر 20 ميكرومتر) ، وتركت رابطة الخرزة الكابولي لتقوية لمدة يوم واحد على الأقل قبل استخدامها لقياسات المسافة البادئة.- نعلق الخرز على الكابولي باستخدام غراء الايبوكسي مع وقت معالجة 5 دقائق.
- قم بخفض الكابول بسرعة بأقل قدر من التلامس على شريحة زجاجية مطلية بالغراء بحيث يتم تشكيل قطرة صغيرة من الغراء في نهايته ، ثم اجعلها تتلامس بعد ذلك مباشرة مع حبة مناسبة.
- امسك ملامسة الخرزة الكابولية لمدة ~ 10 دقائق قبل رفع الكابولي بحبة مربوطة عن السطح.
- معايرة الكابولي قبل القياسات.
ملاحظة: تمت معايرة الكابول المعدل قبل كل مجموعة من التجارب بطريقة الضوضاء الحرارية باستخدام الإجراءات المضمنة في برنامج AFM. - أدخل طبق بتري مع كتلة الأنسجة (من الخطوة 4.18) ووسط الثقافة في حامل طبق بتري في AFM واحصل على صورة نظرة عامة في الفحص المجهري الساطع (الشكل 1 ب).
ملاحظة: لاختبارات المسافة البادئة ، يتم استخدام إعداد مجهز بمسرح محرك أعلى مجهر ضوئي عمودي. قم بتركيب رأس AFM وضع الكابول فوق الأنسجة واجعل الكابول بالقرب من السطح. - اختر منطقة الاهتمام المحددة وسجل مجموعة من منحنيات مسافة القوة (الشكل 2 أ).
ملاحظة: تم استخدام نقاط ضبط القوة النسبية من 2-25 نانو نيوتن من أجل الوصول إلى أعماق المسافة البادئة المماثلة ~ 1-4 ميكرومتر للأنسجة ذات الصلابة المختلفة ، مع اقتراب وسرعة تراجع تبلغ 7.5 ميكرومتر / ثانية ، وطول z 50 ميكرومتر ، وحجم الشبكة 70 ميكرومتر × 70 ميكرومتر مع 3 × 3 نقاط. - لكل منطقة تم فحصها ، احصل على صورة مجهرية للمجال الساطع لربط القيم التي تم الحصول عليها بكل منطقة معينة في قسم الأطراف.
- بالنسبة لجميع العينات، قم بفحص 3 مناطق مختلفة على الأقل لكل نوع من الأنسجة.
ملاحظة: في جميع الحالات ، قامت هذه الدراسة بقياس 4 مناطق في وسط الغضروف و 3 مناطق في محيط منطقة الغضروف واحتفظت بالأنسجة تحت المجهر لمدة أقصاها 1 ساعة. - بمجرد انتهاء قياسات المسافة البادئة ، تخلص من الأنسجة أو أصلحتها لمزيد من التحليل.
ملاحظة: تم إصلاح العينات بعد الانتهاء من القياسات عن طريق وضعها في أنابيب سعة 2 مل تحتوي على محلول MEMFa وتثبيتها طوال الليل عند 4 درجات مئوية. تم استخدام MEMFa (الخطوة 1.17) ، ولكن يمكن أيضا استخدام محلول الفورمالديهايد 4٪ (وزن / حجم) في PBS.
6. (اختياري) معالجة أقسام الأنسجة المجاورة
- إذا تم استخدام أقسام الأنسجة المجاورة للتلوين اللاحق ، فضعها مباشرة بعد التقسيم في أنبوب صغير سعة 2 مل يحتوي على مثبت وقم بإصلاحه طوال الليل عند 4 درجات مئوية.
- للكشف عن بنية الأنسجة من خلال وضع العلامات على الهيكل الخلوي والنوى للأكتين ، اغسل 3 مرات باستخدام PBS لمدة 5 دقائق لكل منهما لإزالة المثبت والبقعة بمحلول يحتوي على الفالودين المترافق Alexa Fluor 488 (1: 250) و Hoechst 33258 (1: 10000) في PBS لمدة ساعة واحدة في RT على منصة هزازة.
- بعد ذلك ، قم بتثبيت العينات الملطخة فوق الأطباق ذات القاع الزجاجي باستخدام 1٪ (وزن / حجم) lmp-agarose في APBS المستقرة عند 37 درجة مئوية (من الخطوة 1.9). تأكد من أن السطح محل الاهتمام يواجه الزجاج. بمجرد أن يصلب الاغاروز ، قم بتغطية العينات ب PBS لمنع الجفاف.
ملاحظة: يتم تصوير العينات السليمة والقابلة للتحليل النسيجي باستخدام مجهر متحد البؤر مقلوب (تكبير 10x ومقاطع بصرية 8 ميكرومتر). الصور في الشكل 1C هي إسقاطات قصوى ل 8 أقسام بصرية.
- إذا تم استخدام قسم الأنسجة المجاورة للتحليل الفوري للمصب الذي يتطلب أنسجة جديدة (مثل استخراج الحمض النووي الريبي ، والحضانة بالأصباغ الحية ، وما إلى ذلك) ، فتأكد من العمل بسرعة واستخدام وسط زراعة الخلايا (من الخطوة 1.8) لضمان أعلى سلامة ممكنة للأنسجة.
7. تحليل البيانات وعرضها
- لحساب معامل يونغ الظاهر ، قم بتحليل منحنيات مسافة القوة باستخدام نموذج Hertz / Sneddon (Eq.1) لمسافة بادئة كروية باستخدام برنامج معالجة البيانات JPK / Bruker ، بافتراض نسبة بواسون تبلغ 0.5.
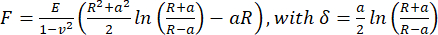 (المعادلة 1)
(المعادلة 1)
حيث R: نصف قطر المسافة البادئة ، E: معامل المرونة ، ν: نسبة بواسون ، أ: نصف قطر منطقة التلامس الدائرية بين المسافة البادئة والعينة ، δ: عمق المسافة البادئة. - لتحليل اللزجة المرنة ، قم بتحليل أجزاء الاقتراب من منحنيات المسافة البادئة للقوة في PyJibe 0.15.0 مع الامتداد "تم تصحيح نموذج هيرتز لمرونة اللزوجة باستخدام Kelvin-Voigt-Maxwell (KVM)" (بقلم Paul Müller ، https://github.com/AFM-analysis/PyJibe) 25. تعتمد وظيفة الملاءمة على نموذج وصفه Abuhattum et al.26 ، يدمج عناصر نموذج Kelvin-Voigt-Maxwell.
- قم بالمعالجة المسبقة لمنحنيات المسافة البادئة للقوة لتقدير نقطة التلامس باستخدام ملاءمة مجزأة مع خط (خط الأساس) ووظيفة ملاءمة متعددة الحدود لجزء الاقتراب.
- قم بتركيب منحنيات المسافة البادئة للقوة مع "نموذج Hertz المصحح لمرونة اللزوجة باستخدام نموذج Kelvin-Voigt-Maxwell (KVM)". من الملاءمة ، احصل على معامل يونغ غير المريح ، ومعامل يونغ الواضح ، واللزوجة الظاهرة. يمنح النموذج أيضا أوقات الاسترخاء والمسافة البادئة لماكسويل.
ملاحظة: في العديد من منحنيات المسافة البادئة للقوة التي تم تحليلها (على وجه الخصوص الأنسجة السليمة) ، كانت أوقات استرخاء ماكسويل أكبر أو أصغر بكثير من وقت المسافة البادئة ، مما يشير إلى سلوك مرن إلى حد ما أو سلوك ميكانيكي كلفن فويت ، على التوالي.
- قم بتصدير جميع القياسات إلى جدول بيانات واحسب متوسط معاملات يونغ الظاهرة لكل نوع من الأنسجة والعينة.
- رسم البيانات وتحليلها إحصائيا باستخدام البرامج المناسبة.
ملاحظة: يتم استخدام GraphPad Prism هنا ، وعند وصف النتائج ، تشير الدراسة إلى متوسط ± SD لمتوسط معاملات يونغ الظاهرة لكل عينة (معروضة في الشكل 2D-F). - اعرض الشرائح البصرية من الصور متحدة البؤر عن طريق عرضها باستخدام وظيفة الإسقاط القصوى في فيجي. اضبط سطوع وتباين كل قناة على حدة للحصول على التصور الأمثل لبقع الفلورسنت.
- قم بإنشاء لوحة الشكل باستخدام البرنامج المناسب.
ملاحظة: يتم إستخدام Affinity Designer لإنشاء اللوحات، ويتم رسم النموذج في الشكل 1A باستخدام Affinity Designer.
النتائج
باستخدام البروتوكول الموضح أعلاه ، قمنا بقياس معامل يونغ الظاهر لأنسجة الأطراف القنفذية الغضروفية في ظروف الاستتباب ("السليم") ، أثناء الانحلال النسيجي المبكر للغضروف ، ومراحل تكثيف الغضروف اللاحقة (الشكل 1 أ). قمنا أيضا بالتحقيق في الخصائص الميكانيكية ل...
Discussion
هنا ، نوضح تقنية لقياس تصلب الغضروف في أطراف قنافذ البحر باستخدام AFM. ومع ذلك ، يمكن توسيع هذه الطريقة لاستكشاف أنواع الأنسجة الأخرى أيضا. تتمثل إحدى الخطوات الرئيسية لقياسات AFM الناجحة في إعداد العينة ، والتي أثبتت أنها تمثل تحديا خاصا مع عينات قنافذ البحر. وجدنا أن فحص س...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح
Acknowledgements
نشكر جميع أعضاء مختبر Sandoval-Guzmán على الدعم المستمر والرفقة أثناء تطوير هذا العمل. نحن ممتنون أيضا ل Anja Wagner و Beate Gruhl و Judith Konantz لتفانيهم في رعاية قنافذ البحر. نشكر أيضا بول مولر على توفير رموز لتحليل بيانات AFM. تم دعم هذا العمل من قبل مرفق الفحص المجهري الخفيف التابع لمنصة CMCB التكنولوجية في TU Dresden. AT هو زميل في مركز ميلدريد شيل للمهن المبكرة في دريسدن P2 بتمويل من مساعدة السرطان الألمانية (Deutsche Krebshilfe). يتم تمويل RA من قبل منصب PI مؤقت (Eigene Stelle) من Deutsche Forschungsgemeinschaft (DFG ، مؤسسة الأبحاث الألمانية) - الذكاء الاصطناعي 214 / 1-1.
Materials
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
References
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved