Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sağlam ve Yenileyici Aksolotl Ekstremitelerde Kıkırdak Atomik Kuvvet Mikroskobu Ölçümleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokolde, aksolotl dokusunun atomik kuvvet mikroskobu (AFM) için nasıl hazırlanacağını ve sağlam ve yenileyici ekstremite kıkırdağında girinti ölçümlerinin nasıl yapılacağını gösteriyoruz.
Özet
Mekanik kuvvetler, gelişmekte olan dokularda normal hücre fonksiyonu ve patern oluşumu için önemli sinyaller sağlar ve rolleri embriyogenez ve patogenez sırasında geniş çapta incelenmiştir. Nispeten, hayvan rejenerasyonu sırasında bu sinyaller hakkında çok az şey bilinmektedir.
Aksolotl, eksik kıkırdak ve kemik de dahil olmak üzere yaralanmadan sonra birçok organ ve dokuyu tamamen eski haline getirme yeteneği göz önüne alındığında, rejenerasyon çalışması için önemli bir model organizmadır. Omurgalı vücudundaki ana destek dokusu olarak çok önemli rolü nedeniyle, rejenerasyon sırasında iskelet fonksiyonunun yeniden kazanılması, hem eksik yapıların restorasyonunu hem de mekanik özelliklerini gerektirir. Bu protokol, hücre ve doku mekanik özelliklerini yüksek uzamsal çözünürlükte araştırmak için altın standart olan atomik kuvvet mikroskobu (AFM) için aksolotl uzuv örneklerinin işlenmesi için bir yöntemi açıklar.
Aksolotlun rejeneratif yeteneklerinden yararlanan bu çalışma, homeostaz sırasında ekstremite kıkırdağının sertliğini ve ekstremite rejenerasyonunun iki aşamasını ölçtü: doku histolizi ve kıkırdak yoğunlaşması. AFM'nin dinamik doku yeniden yapılandırması ve rejenerasyon sırasında meydana gelen mekanik değişiklikler hakkında bilgi edinmek için değerli bir araç olduğunu gösteriyoruz.
Giriş
İskelet, özellikle kıkırdak ve kemikler, omurgalılarda vücudun yumuşak dokuları için ana mekanik desteği sağlar. Bu nedenle, iskelet sistemindeki herhangi bir hasarın, işlevselliği ve hatta hayatta kalmayı büyük ölçüde tehlikeye atması muhtemeldir. İnsanlarda, kemik kırıkları en yaygın travmatik yaralanmalardan biridir1, çoğu birkaç hafta içinde onarılır, ancak bunların %5-10'u iyileşmede gecikmeler yaşar veya hiçbir zaman tam olarak iyileşmez 2,3. Ayrıca, insanlar geniş kemik veya kıkırdak kaybından kurtulamazlar 4,5. Bununla birlikte, bazı semenderler, tam uzuvlar 6 da dahil olmak üzere çeşitli vücut yapılarını yenileyebilirve bu da onları iskelet rejenerasyonu çalışmaları için ideal bir model haline getirir.
Aksolotl (Ambystoma mexicanum), uzuv rejenerasyonunun kapsamlı bir şekilde incelendiği bir semender türüdür. Bu süreç dört ana ardışık ancak örtüşen aşamada gerçekleşir: 1) yara iyileşmesi, 2) iltihaplanma / histoliz, 3) blastema oluşumu ve 4) blastema büyümesi / farklılaşması (7,8'de gözden geçirilmiştir). Amputasyonu takiben, yaralanma bölgesini sınırlayan keratinositler hızla göç ederek yarayı kapatır ve yara epitelini (WE) oluşturur. Takip eden iltihaplanma ve histoliz sırasında, patojenler elimine edilir, döküntüler ve hasarlı hücreler temizlenir ve amputasyon yüzeyinin altındaki hücre dışı matris (ECM) yeniden şekillendirilir9. Doku histolizi, ekstremite rejenerasyonunungerçekleşmesi için gereklidir 10, burada proteolitik enzimlerin salgılanması sadece genel ECM yeniden şekillenmesi için değil, aynı zamanda blastema neden olan hücrelerin serbest bırakılması ve ECM'nin kendisinde tutulan biyoaktif moleküllerin serbest bırakılması için de çok önemlidir8. Aslında, birçok rejeneratif bağlam ve model organizma üzerinde yapılan çalışmalar, histoliz sırasında ECM'nin benzersiz malzeme özelliklerinin, farklılaşma süreçlerini indükleyebildiğini veya hücrelerin yaralanma bölgesine doğru göçünü yönlendirebildiğini göstermiştir (11'de gözden geçirilmiştir). Ayrıca, histolizin geç aşamalarında kalsifiye dokunun rezorpsiyonunun, yeni oluşan ekstremite iskelet elemanlarının uygun entegrasyonu için anahtar olduğu gösterilmiştir12. Histoliz aşamasını takiben, blastema, farklılaşmamış olgun doku hücrelerinden veya yerleşik kök hücrelerden kaynaklanan farklılaşmamış, çok soylu progenitörlerin bir birikimi olarak yara epiteli (WE) altında oluşur. Blastema hücreleri çoğalır ve tüm eksik hücre tiplerine farklılaşır. Son olarak, iskelet dokusunun periskeletal hücrelerden türetilen kondroprogenitörlerin ve transdiferansiye dermal fibroblastlarınyoğunlaşması yoluyla rejenere edildiği ekstremite morfogenezi gerçekleşir 13,14,15.
Hücre kimliği ve ECM bileşimindeki değişiklikleri düzenleyen biyokimyasal ipuçlarının çoğu tanımlanmış olmasına rağmen 10,13,14,16,17,18, uzuv rejenerasyonunun farklı aşamaları sırasında doku mekanik özellikleri ve bunların rejenerasyondaki etkileri büyük ölçüde keşfedilmemiş kalmıştır. Birçok çalışma, hücrelerin kaderlerini ve davranışlarını çeşitli bağlamlarda düzenleyen mekanik ipuçlarını algıladığını ve bütünleştirdiğini göstermiştir (19,20'de gözden geçirilmiştir). Bu nedenle, uzuv rejenerasyonu hakkındaki hücresel ve moleküler bilgimizi doku mekanik ölçümleriyle tamamlamak, bu süreçleri anlamamızı büyük ölçüde geliştirecektir.
Biyolojik numunelerin mekanik karakterizasyonuna ve kuvvet manipülasyonuna izin veren farklı teknikler geliştirilmiştir21. Bu teknikler arasında, atomik kuvvet mikroskobu (AFM), biyolojik numunelerin viskoelastik özelliklerinin, ultra hassas bir kuvvet sensörü olan AFM konsol22 ile girinti yapılarak yüksek uzamsal çözünürlükte incelendiği mekanobiyolojide altın standart haline gelmiştir. Bu teknik, numune ile doğrudan temas gerektirdiğinden, tipik olarak, bazı durumlarda zor olabilen doku dilimleri oluşturulur. Bu nedenle, fizyolojik koşullara mümkün olduğunca yakın kalabilmesi ve minimum artefaktların oluşabilmesi için hazırlama koşullarının her bir numune için uyarlanması ve optimize edilmesi gerekir23. Bu protokol, AFM kullanılarak, sağlam koşullarda kıkırdaklı dokulara odaklanarak, histoliz sırasında ve kıkırdak yoğunlaşma aşamalarında aksolotl ekstremitelerde doku sertliğinin nasıl ölçüleceğini açıklar (Şekil 1 ve Şekil 2). Bu yöntem diğer doku tiplerinin ölçümü için de genişletilebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Aksolotllar (Ambystoma mexicanum), Dresden Teknoloji Üniversitesi'ne (TUD) bağlı Dresden Rejeneratif Tedaviler Merkezi'nin (CRTD) Axolotl tesisinde yetiştirildi. Hayvancılık koşullarının tam bir açıklaması24'te bulunabilir. Kısaca, odalar 12/12 saat gündüz/gece döngüsü ile 20-22 °C'de tutuldu. Tüm taşıma ve cerrahi prosedürler yerel etik kurul yönergelerine uygun olarak gerçekleştirildi ve Almanya'daki Landesdirektion Sachsen tarafından onaylandı.
Bu çalışmada, tüm deneyler için beyaz (d/d) aksolotllar, vücut pigmentasyonu olmayan (melanoforlar ve ksantoforlar çok az veya hiç olmayan), iridoforlar sadece gözlerin irisinde bulunan, doğal olarak oluşan bir mutant suş kullanılmıştır. Bu çalışmada, cinsiyete özgü önyargı olmaksızın burundan kuyruğa (5-7 aylık) 8-15 cm ölçülerinde aksolotllar kullanılmıştır.
1. Hazırlık
- Aksolotlların anestezisi ve ötenazisi için kullanılacak %10'luk (a/h) bir benzokain stok solüsyonu hazırlayın (aşağıya bakınız). Bunun için hacimsel bir şişede 50 g benzokain ile %100 etanol ile 500 mL sınırına ulaşılana kadar karıştırın.
- % 0.03 (a / h) benzokain stok çözeltisi hazırlayın.
- 1 L için, 50 mL 10x Tris tamponlu salin (TBS) ile 30 mL %10 (a/h) benzokain ve 5 mL %4000 (a/h) Holtfreter solüsyonlarını 915 mL damıtılmış su ile karıştırın ve gece boyunca manyetik bir karıştırma çubuğu ile karıştırın.
- 1 L 10x TBS çözeltisi için 24.2 g Trizma bazı ve 90 g NaCl'yi 990 mL deiyonize su ile karıştırın. Manyetik bir karıştırma çubuğu ile iyice karıştırın. Daha sonra, yaklaşık 10 mL konsantre HCl (12 M veya% 37) ekleyin ve pH 8'e ayarlayın.
- 1 L %4000 (a/h) Holtfreter çözeltisi için 158.4 g NaCl, 11.13 g MgSO4·7H2O, 5.36 g CaCl2·2H2Ove 2.88 g KCl'yi deiyonize su ile 1 L'ye kadar karıştırın.
- % 0.03 (a / h) stok çözeltisini 1: 3 seyrelterek anestezi için tutma tankı suyunda% 0.01 (a / h) çalışan bir benzokain seyreltmesi hazırlayın.
- 1 L çözelti için 333 mL benzokain stok çözeltisi artı 666 mL tutma tankı suyu kullanın.
- Analjezi için 5 mg / mL'lik bir butorphanol tartrat stok çözeltisi hazırlayın. Bunun için 100 mg butorphanol (+)-tartrat tuzunu 20 mL ultra saf su ile karıştırın. Alikotları 4 °C'de saklayın.
- Amputasyonların yapıldığı gün, cerrahi işlemleri takiben hayvan ağrısını azaltmak için 0.5 mg/L butorphanol tartrat çalışma solüsyonunu bekletme tankı suyunda 1:10.000 oranında seyrelterek taze olarak hazırlayınız.
- 8 cm'den daha küçük hayvanlar için, 20 μL stok çözeltisini 200 mL tutma tankı suyuna karıştırın.
- Daha büyük hayvanlar için, 60 μL stok çözeltisini 600 mL tutma tankı suyuna karıştırın.
- % 80 (h / h) PBS çözeltisi olan steril amfibi fosfat tamponlu salin (APBS) hazırlayın ve 800 mL DPBS'yi 200 mL deiyonize su ile karıştırarak oda sıcaklığında (RT) tutun.
- 1 mg / mL insülin stok çözeltisi hazırlayın. Bunun için 250 mg insülin tozunu 25 mL HCl 0.1 M ile karıştırın ve eriyene kadar yavaşça çalkalayın. Çalkalarken, çözelti berraklaşana kadar 225 mL APBS ekleyin. Steril filtre ve 4 mL alikotları -20 ° C'de saklayın.
- Steril kültür ortamı hazırlayın (tümü % (h/h): %62,5 L15 orta, %10 ısıyla inaktive edilmiş FBS, %1 Penisilin / Streptomisin, %1 İnsülin, %1 L-Glutamin) ve kullanım gününe kadar 4 ° C'de tutun. Deney gününde, kullanmadan önce RT'ye dengeleyin.
- 400 mL kültür ortamı için 250 mL L15 ortamı, 40 mL ısıyla inaktive edilmiş FBS, 4 mL Penisilin / Streptomisin, 4 mL İnsülin çözeltisi (Adım 1.7'den itibaren), 4 mL L-Glutamin ve 98 mL deiyonize steril su kullanın. Tüm bileşenleri karıştırdıktan sonra steril koşullar altında ve steril bir filtre altında hazırlayın. 15 mL alikot hazırlayın.
- APBS çözeltisinde %2,5 ve %3 (a/h) düşük erime noktalı (lmp)-agaroz hazırlayın ve agarozu tamamen çözmek için 70 ° C'de ısıtın. Alikotları 1,5 mL'lik tüplerde hazırlayın ve kullanım gününe kadar 4 ° C'de saklayın.
- 20 mL% 2.5 (a / h) lmp-agaroz için, 50 mL'lik bir tüpte 0.5 g lmp-agarozu 20 mL APBS ile karıştırın ve agaroz tamamen eriyene kadar 70 ° C'de bir su banyosunda ısıtın. Çözümün açık ve şeffaf hale gelmesi gerekiyor. Hala sıcakken alikotlar hazırlayın.
- 20 mL% 3 (a/h) lmp-agaroz için, 0.6 g lmp-agarozu 20 mL APBS ile karıştırın ve yukarıdaki gibi devam edin.
- (İsteğe bağlı): 20 mL %1 (a/h) lmp-agaroz için 0.2 g lmp-agarozu 20 mL APBS ile karıştırın ve yukarıdaki gibi devam edin.
NOT: Erime süresi lmp-agarozun konsantrasyonuna bağlıdır ve yaklaşık 15-40 dakika arasında değişebilir.
- Amputasyon ve doku montajı için parlak alanlı bir stereoskop kullanın.
- Amputasyonlar ve doku toplama için 100 mm çapında plastik Petri kapları, forseps, neşter ve cerrahi makasları birleştirin.
- İndentasyon ölçümleri için 35 mm çapında plastik Petri kapları hazırlayın.
- ~1 cm uzunluğunda ~1 cm çapında silindirler hazırlayın. Bunun için bir karton kesiciyi Bunsen brülör alevi altında ısıtın ve ısıtılmış bıçakla 15 mL'lik bir tüp kesin.
- 1 cm'lik küçük2 kare parafilm kesin ve saklayın.
- Dondurucuda en az 1 saat bekleterek -20 °C'de metalik veya soğuk bir blok hazırlayın.
- Plastik Pasteur pipetleri hazırlayın.
- (İsteğe bağlı): Fiksatif MEMFa çözeltisi hazırlayın (3- (N-morfolino) propansülfonik asit [MOPS] 0.1 M pH 7.4, Etilen glikol-bis (2-aminoetileter) -N, N, N', N', tetraasetik asit [EGTA] 2 mM, MgSO4·7H2O 1 mM,% 3.7 formaldehit). Bunun için 10.465 g MOPS, 0.123 g MgSO4·7H2O, 2 mL 0.5 M EDTA pH 8.0 ekleyin ve 45 mL'ye kadar su ekleyin. Toplam 50 mL hacme 5 mL formaldehit% 37 (a / h) ekleyin.
2. Reaktifler
- Bu iş için kullanılan reaktifler için Malzeme Tablosuna bakın, ancak diğer ticari sağlayıcılar da kullanılabilir.
3. Axolotl amputasyonu ve uzuv rejenerasyonu
- Tüm deneysel prosedürlerden önce, hayvanı 20 dakika boyunca tank suyunda (adım 1.3) seyreltilmiş %0.01 (a/h) benzokain içinde uyuşturun, böylece hayvanların derinlemesine anestezi altında olduğundan ve dokunsal uyaranlara yanıt vermediğinden emin olun.
- Aksolotl'u anesteziden çıkarın ve anestezi içeren su ile nemlendirilmiş bir kağıt mendil içeren 100 mm'lik bir Petri kabının üzerine koyun. Uzvu vücut eksenine dik olarak yönlendirin ve daha iyi görselleştirme için plakayı stereoskopun altına yerleştirin.
NOT: Burada kompakt kaz boynu lambalı bir stereoskop kullanılmıştır. - Zeugopodial bölgenin (radius/ulna) kalsifiye bölgesinin hemen distalinde keskin bir steril neşter ile uzuv ampute edin (Şekil 1A).
NOT: 3R hayvan refahı ilkesine bağlı kalarak, başlangıçta amputasyon ile çıkarılan uzuvların sağlam kontroller olarak kullanılması önerilir. - Hayvanı tabağın üzerinde bırakın ve kanın pıhtılaşmasını ve yaranın kapanmasını sağlamak için 15 dakika boyunca benzokain içeren suyla ıslatılmış nemlendirilmiş bir kağıt mendil ile örtün.
- Hayvanları analjezikli taze tutma suyu içeren bir tanka geri koyun (butorphanol tartarat, 0.5 mg / L, adım 1.5'ten itibaren).
- Ameliyat sonrası analjezik tedaviden 24 saat sonra hayvanları taze tutma suyu içeren orijinal tanklarına taşıyın.
- İstenilen ilgi aşamasına kadar hayvanların yenilenmesine izin verin.
NOT: Analiz edilen uzuvlar, 5 aylık hayvanlarda sağlam faz için amputasyon gününde ve histoliz fazı için amputasyondan 5 gün sonra (dpa) toplandı. Kıkırdak yoğunlaşma aşaması 7 aylık hayvanlarda 21 dpa'da ölçüldü.
4. Ölçümler için doku montajı ve işlenmesi
- %2,5 veya %3 (a/h) lmp-agaroz (adım 1.9'dan itibaren) içeren 1,5 mL'lik tüpleri, agaroz tamamen eriyene kadar 70 °C'de bir termoblok üzerinde ısıtın. Tüpleri 37 °C'de farklı bir termoblokla değiştirin ve kullanmadan önce sıcaklığın dengelenmesini bekleyin.
NOT: Burada, yenilenen dokuları ölçmek için %2.5 lmp-agaroz ve sağlam dokular için %3 kullanılmıştır. - 1 cm uzunluğundaki silindirlerin bir tarafını (adım 1.13'ten itibaren) parafilm parçalarından biriyle (adım 1.14) örtün, böylece altları tamamen sızdırmaz hale gelir.
- 15 mL kültür ortamının alikotunu RT'ye dengeleyin (adım 1.8'den itibaren)
- Hayvanları en az 20 dakika boyunca anestezik içeren suya (tutma tankı suyunda seyreltilmiş %0.01 (a/h) benzokain) batırarak uyuşturun.
- Kantitatif ölçümlere izin veren bir yazılımla uzuvları bir stereoskop altında görüntüleyin. İlgilenilen yapının uzunluğunu ölçün ve ilgilenilen bölüme ulaşılana kadar uzuvun distal ucundan ne kadar doku çıkarılması gerektiğini hesaplayın.
- Uzuvları yenilemek için, dirsek hizasında bir neşter ve/veya cerrahi makasla keserek ve uzuvdaki fazla dokuyu inceleyerek toplayın. Bir sonraki adımı hazırlarken dokuyu APBS solüsyonunda bırakın. Düz bir yüzey oluşturmak için kesimin alt kol eksenine çapraz (90°) olduğundan emin olun. Sağlam uzuvlar için, karpal bölgeyi keserek elinizi çıkarın.
- Hayvanları en az 20 dakika boyunca öldürücü dozda anesteziye (% 0.1 benzokain) maruz bırakarak ötenazi yapın. Bunun için, %0,1 (a/h) konsantrasyona ulaşmak için gerekli hacimde %10 (a/h) benzokain çözeltisi ekleyin.
- Hayvanlar 100 mL% 0.01 (a / h) benzokain çözeltisi içinde anestezi altına alındıysa,% 10 (a / h) benzokain çözeltisinden 900 μL ekleyin.
- Uzuvları APBS çözeltisine batırarak durulayın.
- Pasteur pipetlerinin ve termoblokun (agaroz alikotları ile 37 °C'de stabilize edilmiş) çalışma istasyonuna yakın olduğundan emin olun. Soğuk bloğu -20 °C dondurucudan çıkarın ve silindiri parafilm kaplı ucu aşağı bakacak şekilde üzerine yerleştirin.
- Kesilen uzuvu tutun ve fazla sıvıyı kağıt mendille nazikçe çıkarın. Uzuvu temiz bir tabağa yerleştirin, erimiş lmp-agarozu üstüne ekleyin ve kalan APBS'yi cilt yüzeyinden uzaklaştırmak için uzvu agaroz içinde kısa bir süre hareket ettirin.
- Hızlı bir şekilde çalışarak, uzvu silindirin içine yerleştirin ve ilgi alanı yukarı bakacak şekilde dikey olarak yönlendirildiğinden emin olun.
- Uzuvu forseps ile nazikçe tutarken, doku tamamen kaplanana kadar silindirin içine lmp-agaroz ekleyin. Agaroz katılaşmadan önce forsepsleri yavaşça çıkarın.
- Silindiri soğuk bloktan çıkarın ve agarozun RT'de yaklaşık 30 saniye boyunca tamamen katılaşmasına izin verin.
- Doku içeren agaroz bloğunu, RT'de steril kültür ortamı alikotları ve APBS ile birlikte hemen vibratom odasına götürün.
- Parafilmi silindirin altından çıkarın ve dokuyu içeren agarozu siyanoakrilat yapıştırıcı ile vibratom aşamasına tutturun. Hem agarozun hem de numunenin sahneye yapıştırıldığından emin olun.
- Bölümlere ayırmak için sahneyi APBS'ye daldırın.
NOT: Sağlam dokular daha sert kemik/kıkırdak içerirken, yenilenen dokular daha yumuşaktır. Bu nedenle, vibratom parametrelerinin buna göre ayarlanması gerekir. Bu çalışmada aşağıdaki parametreler kullanılmıştır: İntakt dokular (amplitüd 1.2 mm ve hız 0.1 mm/s) ve rejenerasyon dokuları (amplitüd 0.9 mm ve hız 0.4 mm/s). - Doku ucuna ulaşılana kadar agarozu kısa adımlarla (ör. 100 μm'lik adımlarla) bölümlere ayırmaya başlayın. Ardından, dokunun distal kısmı (adım 4.5'te hesaplanan) çıkarılana kadar doku bloğunu bölümlere ayırın. Bu şekilde, ilgi alanının enine bir kesitine kolayca erişilebilir olacaktır.
NOT: Çıkarılan doku bölümü, AFM ile problanan yüzeye hemen bitişik yüzeyi içerecektir ve doku yapısı için bir referans görevi görebilir. Bu nedenle, doğrudan tamamlayıcı analiz için kullanılabilir veya sonraki boyama için sabitlenebilir (bkz. bölüm 6). - Doku içeren bloğu bir tıraş bıçağıyla vibratom aşamasından dikkatlice çıkarın ve tüm tutkal izlerini temizleyin. Bloğu hemen 35 mm'lik plastik bir Petri kabına cerrahi doku yapıştırıcı yapıştırıcı ile yapıştırın ve dokunun tamamen kaplandığından emin olmak için RT'de yaklaşık 2 mL kültür ortamı ekleyin.
NOT: Agaroz bloğundaki açıkta kalan doku yüzeyi, incelenecek yüzeydir.
5. AFM ile ölçümler
- Ölçümlerden en az 1 gün önce konsolu ölçümler için hazırlayın.
NOT: Bu çalışma için, uçsuz silikon konsollar polistiren boncuklarla (çap 20 μm) işlevselleştirildi ve boncuk-konsol bağı, girinti ölçümleri için kullanılmadan önce en az 1 gün güçlenmeye bırakıldı.- İşlem süresi 5 dakika olan epoksi yapıştırıcı kullanarak boncukları konsollara tutturun.
- Konsolu, sonunda küçük bir tutkal damlası oluşacak şekilde tutkal kaplı bir cam sürgün üzerine minimum temasla hızlı bir şekilde indirin ve hemen ardından uygun bir boncukla temas ettirin.
- Konsol boncuk temasını bağlı bir boncukla yüzeyden kaldırmadan önce ~ 10 dakika tutun.
- Ölçümlerden önce konsolu kalibre edin.
NOT: Modifiye edilmiş konsol, AFM yazılımının yerleşik prosedürleri kullanılarak termal gürültü yöntemiyle her deney setinden önce kalibre edilmiştir. - Petri kabını doku bloğu (adım 4.18'den itibaren) ve kültür ortamı ile birlikte AFM'nin petri kabı tutucusuna yerleştirin ve parlak alan mikroskobunda bir genel bakış görüntüsü elde edin (Şekil 1B).
NOT: Girinti testleri için, dik bir ışık mikroskobunun üzerinde bir motor kademesi ile donatılmış bir kurulum kullanılır. AFM başlığını monte edin ve konsolu dokunun üzerine yerleştirin ve konsolu yüzeye yaklaştırın. - Belirli bir ilgi alanını seçin ve bir dizi kuvvet-mesafe eğrisi kaydedin (Şekil 2A).
NOT: Farklı sertlikteki dokular için ~1-4 μm'lik karşılaştırılabilir girinti derinliklerine ulaşmak için 2-25 nN'lik bağıl kuvvet ayar noktaları, 7.5 μm/s yaklaşma ve geri çekme hızı, 50 μm z uzunluğu, ızgara boyutu 70 μm x 70 μm ve 3 x 3 nokta. - Problanan her bölge için, elde edilen değerleri uzuv bölümündeki her bir belirli bölgeyle ilişkilendirmek için bir parlak alan mikroskobu görüntüsü elde edin.
- Tüm numuneler için, doku tipi başına en az 3 farklı bölgeyi araştırın.
NOT: Tüm olgularda, bu çalışmada kıkırdak merkezinde 4 bölge ve kıkırdak bölgesinin çevresinde 3 bölge ölçüldü ve doku mikroskop altında en fazla 1 saat tutuldu. - Girinti ölçümleri bittiğinde, daha fazla analiz için dokuyu atın veya sabitleyin.
NOT: Numuneler, ölçümler tamamlandıktan sonra MEMFa çözeltisi içeren 2 mL'lik tüplere yerleştirilerek sabitlendi ve gece boyunca 4 °C'de sabitlendi. MEMFa (aşama 1.17) kullanıldı, ancak PBS'deki formaldehit% 4 (a / h) çözeltisi de kullanılabilir.
6. (İsteğe bağlı) Bitişik doku bölümlerinin işlenmesi
- Bitişik doku bölümleri sonraki boyama için kullanılıyorsa, bunları kesitlerden hemen sonra fiksatif içeren 2 mL'lik küçük bir tüpe yerleştirin ve gece boyunca 4 ° C'de sabitleyin.
- Aktin hücre iskeleti ve çekirdeklerinin etiketlenmesi yoluyla doku mimarisini ortaya çıkarmak için, fiksatifi çıkarmak için her biri 5 dakika boyunca PBS ile 3 kez yıkayın ve Alexa Fluor 488 konjuge Phalloidin (1:250) ve Hoechst 33258 (1:10000) içeren bir çözelti ile boyayın.
- Daha sonra, 37 ° C'de stabilize edilmiş APBS'de (adım 1.9'dan itibaren) %1 (a/h) lmp-agaroz kullanarak lekeli numuneleri cam tabanlı tabakların üzerinde hareketsiz hale getirin. İlgilenilen yüzeyin cama baktığından emin olun. Agaroz katılaştıktan sonra, dehidrasyonu önlemek için numuneleri PBS ile örtün.
NOT: Sağlam ve histoliz örnekleri, ters konfokal mikroskop (10x büyütme ve 8 μm optik kesitler) ile görüntülenir. Şekil 1C'deki görüntüler, 8 optik bölümün maksimum projeksiyonlarıdır.
- Bitişik doku bölümü, taze doku gerektiren (RNA ekstraksiyonu, canlı boyalarla inkübasyon vb.) hemen aşağı akış analizi için kullanılıyorsa, mümkün olan en yüksek doku bütünlüğünü sağlamak için hızlı bir şekilde çalıştığınızdan ve bir hücre kültürü ortamı (adım 1.8'den itibaren) kullandığınızdan emin olun.
7. Veri analizi ve görüntüleme
- Görünür Young modülünü hesaplamak için, JPK/Bruker veri işleme yazılımını kullanarak küresel bir girinti için Hertz/Sneddon modelini (Eşitlik 1) kullanarak, Poisson oranının 0,5 olduğunu varsayarak kuvvet-mesafe eğrilerini analiz edin.
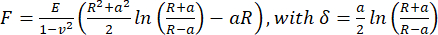 (Eşitlik 1)
(Eşitlik 1)
Burada R: girinti yarıçapı, E: elastik modül, ν: Poisson oranı, a: girinti ve numune arasındaki dairesel temas alanının yarıçapı, δ: girinti derinliği. - Viskoelastik analiz için, "Hertz modeli Kelvin-Voigt-Maxwell (KVM) kullanılarak viskoelastisite için düzeltildi" (Paul Müller, https://github.com/AFM-analysis/PyJibe) tarafından yazılmıştır) uzantısıyla PyJibe 0.15.0'daki kuvvet-girinti eğrilerinin yaklaşım kısımlarını analiz edin.25. Uyum fonksiyonu, Abuhattum ve ark.26 tarafından tanımlanan ve Kelvin-Voigt-Maxwell model elemanlarını entegre eden bir modele dayanmaktadır.
- Yaklaşma kısmı için bir çizgi (taban çizgisi) ile parça parça uyum ve bir polinom uyum fonksiyonu kullanarak temas noktasını tahmin etmek için kuvvet girinti eğrilerini önceden işleyin.
- Kuvvet-girinti eğrilerini "Kelvin-Voigt-Maxwell (KVM) modeli kullanılarak viskoelastisite için düzeltilmiş Hertz modeli"ne uydurun. Uyumdan, gevşememiş Young modülünü, görünür Young modülünü ve görünür viskoziteyi elde edin. Model ayrıca Maxwell'e gevşeme ve girinti süreleri verir.
NOT: Analiz edilen birkaç kuvvet girinti eğrisinde (özellikle sağlam doku), Maxwell gevşeme süreleri, girinti süresinden önemli ölçüde daha büyük veya daha küçüktü, bu da sırasıyla oldukça elastik davranışı veya Kelvin-Voigt mekanik davranışını gösterir.
- Tüm ölçümleri bir elektronik tabloya aktarın ve doku tipi ve numune başına medyan görünür Young modülünü hesaplayın.
- Verileri uygun yazılımla çizin ve istatistiksel olarak analiz edin.
NOT: Burada GraphPad Prizması kullanılmıştır ve sonuçları açıklarken, çalışma, numune başına medyan görünen Young modülünün ortalama ± SD'sine atıfta bulunur (Şekil 2D-F'de gösterilmiştir). - Fiji maksimum projeksiyon işleviyle yansıtarak konfokal görüntülerden optik kesitler görüntüleyin. Floresan boyamaların en iyi şekilde görselleştirilmesi için her bir kanalın parlaklığını ve kontrastını ayarlayın.
- Uygun yazılımla bir şekil paneli oluşturun.
NOT: Panelleri oluşturmak için Affinity Designer kullanılır ve Şekil 1A'daki model Affinity Designer kullanılarak çizilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yukarıda tarif edilen protokolü kullanarak, homeostatik ("Sağlam") koşullarda, erken kıkırdak histolizi ve daha sonraki kıkırdak yoğunlaşma aşamaları sırasında kıkırdaklı aksolotl ekstremite dokularının görünür Young modülünü ölçtük (Şekil 1A). Ayrıca, konsol pozisyonunu gösteren görüntülerde gösterildiği gibi, iskelet elemanlarının merkezi ve çevresi de dahil olmak üzere farklı bölgelerdeki mekanik özelliklerini de...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada, AFM ile aksolotl ekstremitelerde kıkırdak sertliğinin ölçümü için bir teknik gösteriyoruz. Bununla birlikte, bu yöntem diğer doku tiplerini de araştırmak için genişletilebilir. Başarılı AFM ölçümleri için önemli bir adım, aksolotl numunelerinde özellikle zor olduğu kanıtlanan numune hazırlamadır. Hala agaroz bloğuna gömülü olan doku yüzeyini incelemenin, doku bütünlüğünü korumanın en iyi yolu olduğunu bulduk. Bunun nedeni, aksolotl derisi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler
Teşekkürler
Sandoval-Guzmán laboratuvarının tüm üyelerine, bu çalışmanın geliştirilmesi sırasında sürekli destek ve arkadaşlık için teşekkür ederiz. Ayrıca Anja Wagner, Beate Gruhl ve Judith Konantz'a aksolotl bakımına olan bağlılıkları için minnettarız. AFM veri analizi için kodlar sağladığı için Paul Müller'e de teşekkür ederiz. Bu çalışma, TU Dresden'deki CMCB Teknoloji Platformu'nun Işık Mikroskobu Tesisi tarafından desteklenmiştir. AT, Alman Kanser Yardımı (Deutsche Krebshilfe) tarafından finanse edilen Mildred Scheel Erken Kariyer Merkezi Dresden P2'nin bir üyesidir. RA, Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) – AI 214/1-1'den bir Geçici PI pozisyonu (Eigene Stelle) tarafından finanse edilmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Referanslar
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0-2 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , Springer. Cham. (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966(2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681(2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711(2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036(2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016(2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268(2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17(2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341(2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, Springer. Dordrecht. 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078(2022).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır