このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
無傷および再生中のウーパールーパー四肢の軟骨の原子間力顕微鏡測定
* これらの著者は同等に貢献しました
要約
このプロトコルでは、原子間力顕微鏡(AFM)用のウーパールーパー組織を調製し、無傷および再生中の四肢軟骨のインデンテーション測定を行う方法を示します。
要約
機械的な力は、正常な細胞機能と発生中の組織におけるパターン形成に重要なシグナルを提供し、その役割は胚発生および病因において広く研究されてきました。それに比べて、動物の再生中のこれらのシグナルについてはほとんど知られていません。
ウーパールーパーは、損傷後に軟骨や骨の欠損など、多くの臓器や組織を完全に回復させる能力があるため、再生の研究にとって重要なモデル生物です。脊椎動物の体の主要な支持組織としての重要な役割のため、再生中に骨格機能を回復するには、失われた構造の修復とそれらの機械的特性の両方が必要です。このプロトコルは、原子間力顕微鏡(AFM)用のウーパールーパー四肢サンプルを処理する方法を記述しており、これは高い空間分解能で細胞および組織の機械的特性をプローブするためのゴールドスタンダードです。
この研究では、ウーパールーパーの再生能力を利用して、ホメオスタシス中の四肢軟骨の硬さと、組織組織分解と軟骨凝縮の2つの段階の四肢再生を測定しました。AFMは、動的組織再構築と再生中に発生する機械的変化についての洞察を得るための貴重なツールであることを示しています。
概要
骨格、特に軟骨と骨は、脊椎動物の体の軟組織の主要な機械的サポートを提供します。したがって、骨格系に損傷があると、機能や生存率が大幅に損なわれる可能性があります。人間では、骨折は最も一般的な外傷の1つであり、そのほとんどは数週間で修復されますが、これらの5%〜10%は治癒が遅れるか、完全に回復することはありません2,3。さらに、人間は広範な骨や軟骨の喪失から回復することができません4,5。しかし、一部のサンショウウオは、完全な四肢6を含むさまざまな体構造を再生できるため、骨格再生の研究に理想的なモデルとなっています。
ウーパールーパー(Ambystoma mexicanum)は、四肢の再生が広く研究されてきたサンショウウオの一種です。このプロセスは、1)創傷治癒、2)炎症/組織溶解、3)胚盤形成、および4)胚盤の成長/分化(7,8でレビュー)の4つの主要な連続した重複する段階で発生します。切断後、損傷部位に隣接するケラチノサイトが急速に移動し、創傷を閉じて創傷上皮(WE)を形成します。その後の炎症と組織溶解の間に、病原体が排除され、破片と損傷した細胞が取り除かれ、切断面の下の細胞外マトリックス(ECM)が再構築されます9。組織組織溶解は、四肢の再生が起こるために不可欠であり10、タンパク質分解酵素の分泌は、全体的なECMリモデリングだけでなく、芽球を生じさせる細胞を放出し、ECM自体に隔離された生理活性分子を遊離させるためにも重要である8。実際、多くの再生環境やモデル生物での研究で、組織溶解中のECMのユニークな材料特性が、脱分化プロセスを誘発したり、細胞の損傷部位への移動を指示したりできることが示されている(11の文献でレビュー)。さらに、組織溶解の後期段階での石灰化組織の吸収は、新たに形成された四肢骨格要素の適切な統合の鍵であることが示されています12。組織溶解段階に続いて、芽腫は、脱分化した成熟組織細胞または常在幹細胞に起因する未分化の多系統前駆細胞の蓄積として、創傷上皮(WE)の下に形成されます。ブラストメーマ細胞は増殖し、欠落しているすべての細胞タイプに分化します。最後に、四肢の形態形成が起こり、骨格組織は、骨格周囲細胞に由来する軟骨形成因子と超分化した真皮線維芽細胞13,14,15の凝縮を通じて再生される。
細胞の同一性とECM組成の変化を調節する生化学的手がかりの多くが同定されている10,13,14,16,17,18、四肢再生のさまざまな段階における組織の機械的特性、およびそれらが再生に及ぼす影響は、ほとんど解明されていない。多くの研究が、細胞がいくつかの状況で運命と行動を調節する機械的な手がかりを感知し、統合することを示している(19,20でレビュー)。したがって、四肢の再生に関する細胞的および分子的知識を組織の機械的測定で補完することで、これらのプロセスの理解が大幅に向上します。
生物学的サンプルの機械的特性評価と力の操作を可能にするさまざまな技術が開発されてきました21。これらの技術の中で、原子間力顕微鏡(AFM)は、超高感度の力センサーであるAFMカンチレバー22でインデントすることにより、生体試料の粘弾性特性を高い空間分解能でプローブするメカノバイオロジーのゴールドスタンダードとなっています。この手法ではサンプルと直接接触する必要があるため、通常、組織スライスが生成されますが、これは場合によっては困難です。したがって、調製条件は、特定のサンプルごとに適合させ最適化して、可能な限り生理学的条件に近づけることができ、アーティファクトが最小限に抑えられるようにする必要がある23。このプロトコルでは、AFMを使用してウーパールーパーの四肢の組織硬さを測定する方法を説明し、無傷の状態、組織溶解を受けている間、および軟骨凝縮段階の軟骨組織に焦点を当てています(図1および図2)。この方法は、他の組織タイプの測定にも拡張できます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ウーパールーパー(Ambystoma mexicanum)は、ドレスデン工科大学(TUD)のドレスデン再生治療センター(CRTD)のウーパールーパー施設で栽培されました。飼育条件の完全な説明は、24に記載されています。簡単に言うと、部屋は20〜22°Cに保たれ、12/12時間の昼夜サイクルで行われました。すべての取り扱いと外科的処置は、地元の倫理委員会のガイドラインに従って実施され、ドイツのザクセン州立協会によって承認されました。
この研究では、すべての実験に白色(d / d)ウーパールーパーを使用しましたが、これは体の色素沈着を欠く(メラノフォアとキサントフォアがほとんどまたはまったくない)自然に発生する突然変異株で、目の虹彩にのみイリドフォアがあります。この研究では、鼻から尾まで8〜15cm(生後5〜7か月)のウーパールーパーを使用し、性別特異的なバイアスは使用しました。
1. 事前準備
- ウーパールーパーの麻酔と安楽死に使用される10%(w / v)ベンゾカインストック溶液を準備します(以下を参照)。このためには、500 mLの制限に達するまで、50 gのベンゾカインと100%エタノールを容量ボトルに混ぜます。.
- 0.03%(w / v)ベンゾカインストック溶液を調製します。
- 1 Lの場合、50 mLの10倍トリス緩衝生理食塩水(TBS)を30 mLの10%(w/v)ベンゾカインおよび5 mLの4000%(w/v)ホルトフレッター溶液915 mLの蒸留水と混合し、マグネチックスターバーで一晩混合します。
- 1 Lの10x TBS溶液に対して、24.2 gのTrizma塩基と90 gのNaClを990 mLの脱イオン水と混合します。マグネチックスターバーでよく混ぜます。次に、約10 mLの濃縮HCl(12 Mまたは37%)を加え、pH 8に調整します。
- 1 Lの4000%(w / v)ホルトフレッター溶液の場合、158.4 gのNaCl、11.13 gのMgSO4·7H2O、5.36 gのCaCl2·2H2O、および2.88 gのKClを脱イオン水と1 Lまで混合します。
- 麻酔用の保持タンク水で0.01%(w / v)のベンゾカイン希釈液を0.03%(w / v)ストック溶液を1:3に希釈して調製します。.
- 1 Lの溶液には、333 mLのベンゾカイン原液と666 mLの保持タンク水を使用します。.
- 鎮痛薬用の5 mg / mL酒石酸ブトルファノールストック溶液を調製します。.このためには、100mgのブトルファノール(+)-酒石酸塩を20mLの超純水と混合します。アリコートは4°Cで保存してください。
- 切断の日に、新たに0.5 mg/Lの酒石酸ブトルファノールのワーキング溶液を準備して、ストック溶液を保持タンク水で1:10.000に希釈することにより、外科的処置後の動物の痛みを軽減します。
- 体長8cm未満の動物の場合は、200 mLのストック溶液を200 mLの保持タンク水に混ぜます。
- 大型動物の場合は、60 μLのストック溶液を600 mLの保持タンク水に混合します。
- 滅菌両生類リン酸緩衝生理食塩水(APBS)と80%(v / v)PBS溶液を調製し、800 mLのDPBSを200 mLの脱イオン水と混合して室温(RT)に保ちます。
- 1 mg / mLインスリンストック溶液を調製します。.このためには、250 mgのインスリン粉末を25 mLのHCl 0.1 Mと混合し、溶解するまでゆっくりと攪拌します。撹拌しながら、溶液が透明になるまで225mLのAPBSを加えます。滅菌フィルターを使用し、4 mLのアリコートを-20°Cで保存します。
- 無菌培地(全%(v/v):L15培地62.5%、熱不活化FBS10%、ペニシリン/ストレプトマイシン1%、インスリン1%、L-グルタミン1%)を調製し、使用日まで4°Cで保管してください。実験日は、使用前にRTに平衡化してください。
- 400 mLの培地には、250 mLのL15培地、40 mLの熱不活化FBS、4 mLのペニシリン/ストレプトマイシン、4 mLのインスリン溶液(ステップ1.7から)、4 mLのL-Glutamine、および98 mLの脱イオン滅菌水を使用します。無菌条件下で調製し、すべての成分を混合した後に滅菌フィルターで調製します。15mLのアリコートを準備します。
- APBS溶液中に2.5%および3%(w / v)の低融点(lmp)-アガロースを調製し、70°Cで加熱してアガロースを完全に溶解します。1.5mLのチューブにアリコートを調製し、使用日まで4°Cで保存します。
- 20 mLの2.5%(w / v)lmp-アガロースの場合、0.5 gのlmp-アガロースと20 mLのAPBSを50 mLチューブで混合し、アガロースが完全に溶けるまで70°Cのウォーターバスで加熱します。解決策は明確で透明性のあるものでなければなりません。まだ温かいうちにアリコートを準備します。
- 20 mLの3%(w / v)lmp-アガロースについて、0.6 gのlmp-アガロースを20 mLのAPBSと混合し、上記のように進めます。.
- (オプション):20 mLの1%(w / v)lmp-アガロースについて、0.2 gのlmp-アガロースと20 mLのAPBSを混合し、上記のように進めます。
注:融解時間はlmp-アガロースの濃度に依存し、約15〜40分の範囲であり得る。
- 切断および組織装着には、明視野ステレオスコープを使用します。
- 直径100mmのプラスチック製ペトリ皿、鉗子、メス、手術用ハサミを組み立てて、切断や組織採取を行います。
- くぼみ測定のために直径35mmのプラスチックペトリ皿を準備します。
- 直径~1cmの~1cmの長さの円柱を準備します。このためには、ブンゼンバーナーの炎の下で段ボールカッターを加熱し、加熱したブレードで15mLのチューブを切断します。
- パラフィルムを1cm2 マスの小さなカットして保管します。
- 金属製またはコールドブロックを-20°Cで、冷凍庫に少なくとも1時間放置して調製します。
- プラスチック製のパスツールピペットを準備します。
- (オプション):固定剤MEMFa溶液(3-(N-モルホリノ)プロパンスルホン酸[MOPS] 0.1 M pH 7.4、エチレングリコール-ビス(2-アミノエチルエーテル)-N、N、N'、N'、N'-四酢酸[EGTA] 2 mM、MgSO4.7H 2O 1 mM、3.7%ホルムアルデヒド)を調製します。このためには、10.465 gのMOPS、0.123 gのMgSO4·7H2O、2 mLの0.5 M EDTA pH 8.0を加え、45 mLになるまで水を加えます。5 mL のホルムアルデヒド 37% (w/v) を総容量 50 mL に加えます。
2. 試薬
- この作業に使用した試薬については、 Table of Materials を参照してくださいが、他の商用プロバイダーも使用できます。
3.ウーパールーパーの切断と四肢の再生
- すべての実験手順の前に、保持タンク水(ステップ1.3)で希釈した0.01%(w / v)ベンゾカインで動物に麻酔をかけます(ステップ1.3)20分間、動物が深く麻酔をかけられ、触覚刺激に反応しないことを確認します。
- ウーパールーパーを麻酔から取り出し、麻酔水で湿らせた紙ティッシュが入った100mmのシャーレの上に置きます。四肢を体の軸に対して垂直に向け、プレートをステレオスコープの下に置いて、視覚化を改善します。
注:ここでは、コンパクトなグースネックランプを備えたステレオスコープを使用しました。 - 鐘足領域(橈骨/尺骨)の石灰化領域のすぐ遠位にある鋭利な滅菌メスで四肢を切断します(図1A)。
注:3R動物福祉の原則に従い、切断によって最初に切除された手足を無傷のコントロールとして使用することをお勧めします。 - 動物を皿の上に置いたまま、ベンゾカイン含有水に浸した加湿ティッシュペーパーで15分間覆い、血液凝固と創傷閉鎖が起こるようにします。.
- 動物を鎮痛剤(酒石酸ブトルファノール、0.5 mg / L、ステップ1.5から)を含む新鮮な保持水を入れたタンクに戻します。.
- 術後鎮痛治療の24時間後に、動物を新鮮な保持水が入った元のタンクに移します。
- 目的の段階まで動物が再生するのを待ちます。
注:分析された四肢は、生後5か月の動物の無傷期の場合は切断日、組織溶解期の場合は切断後5日(dpa)に収集されました。軟骨の凝縮段階は、7か月齢の動物で21dpaで測定されました。
4. 測定のためのティッシュの取り付けと処理
- 2.5%または3%(w / v)lmp-アガロース(ステップ1.9)を含む1.5 mLチューブをサーモブロック上で70°Cでアガロースが完全に溶けるまで加熱します。チューブを37°Cで別のサーモブロックに交換し、温度を平衡化させてから使用してください。
注:ここでは、再生組織の測定に2.5%のlmp-アガロースを使用し、無傷の組織に3%を使用しました。 - 長さ1cmの円柱の片側(ステップ1.13から)をパラフィルムピースの1つ(ステップ1.14)で覆い、底部が完全に密閉されるようにします。
- 15 mL の培地を RT に平衡化します (ステップ 1.8 から)。
- 麻酔薬を含む水(0.01%(w / v)ベンゾカインを保持タンク水で希釈)に少なくとも20分間浸して、動物を麻酔します。
- ステレオスコープで手足を画像化し、ソフトウェアで定量的な測定を可能にします。対象の構造の長さを測定し、対象のセクションに到達するまで、四肢の遠位端からどれだけの組織を取り除く必要があるかを計算します。
- 手足を再生するには、肘のレベルでメスや手術用ハサミで切断し、手足から余分な組織を解剖して手足を収集します。次のステップを準備する間、組織をAPBS溶液に残します。カットが下腕軸に対して横方向(90°)になっていることを確認して、均一な表面を作成します。無傷の手足の場合は、手根骨領域を切開して手を取り除きます。
- 動物を致死量の麻酔(0.1%ベンゾカイン)に少なくとも20分間さらして安楽死させます。このためには、必要な量の10%(w / v)ベンゾカイン溶液を添加して、0.1%(w / v)濃度に到達します。
- 動物を100 mLの0.01%(w / v)ベンゾカイン溶液で麻酔した場合は、10%(w / v)ベンゾカイン溶液900 μLを追加します。.
- 手足をAPBS溶液に沈めてすすぎます。
- パスツールピペットとサーモブロック(アガロースアリコートで37°Cで安定化)が作業ステーションの近くにあることを確認します。-20°Cの冷凍庫からコールドブロックを取り出し、パラフィルムで覆われた端を下に向けてシリンダーを置きます。
- 解剖した手足をつかみ、ティッシュペーパーで余分な液体をそっと取り除きます。手足をきれいなプレートに置き、溶かしたlmp-アガロースを上に加え、アガロース内で手足を少し動かして、皮膚表面から残っているAPBSを移動します。
- すばやく作業して、手足をシリンダーの内側に配置し、関心領域が上を向くように垂直に向けられるようにします。
- 鉗子で手足を優しく保持しながら、組織が完全に覆われるまでシリンダー内にlmp-アガロースを追加します。アガロースが固まる前に鉗子をそっと取り除きます。
- シリンダーをコールドブロックから取り外し、アガロースをRTで約30秒間完全に固化させます。
- 組織含有アガロースブロックを、無菌培地アリコートおよびAPBSとともに、RTで直ちにビブラトームルームに持って行きます。
- シリンダーの底からパラフィルムをはがし、組織を含むアガロースをシアノアクリレート接着剤でビブラトームステージに取り付けます。アガロースとサンプルの両方がステージに接着されていることを確認してください。
- ステージをAPBSに沈めて切片化します。
注:無傷の組織には硬い骨/軟骨が含まれますが、再生組織はより柔らかいです。したがって、ビブラトームパラメータはそれに応じて調整する必要があります。この研究では、無傷組織(振幅1.2 mm、速度0.1 mm/s)と再生組織(振幅0.9 mm、速度0.4 mm/s)のパラメータを使用しました。 - 組織先端に到達するまで、アガロースを短いステップ(例えば、100 μmステップ)で切片化し始めます。次に、組織の遠位部分(ステップ4.5で計算)が除去されるまで、組織ブロックを切片にします。これにより、対象領域の横方向の断面に容易にアクセスできるようになります。
注:除去された組織切片には、AFMでプローブされた表面のすぐ隣の表面が含まれ、組織構造の参照として役立ちます。したがって、直接相補分析に使用することも、その後の染色のために固定することもできます(セクション6を参照)。 - 組織含有ブロックをかみそりの刃でビブラトームステージから慎重に取り除き、接着剤の痕跡をすべて取り除きます。すぐにブロックを35 mmのプラスチック製ペトリ皿に外科用組織接着接着剤で接着し、RTで約2 mLの培地を追加して、組織が完全に覆われていることを確認します。
注:アガロースブロックの露出した組織表面がプローブされる表面です。
5. AFMによる測定
- 測定の少なくとも1日前に、カンチレバーを測定用に準備します。
注:この作業では、チップレスシリコンカンチレバーをポリスチレンビーズ(直径20μm)で官能化し、ビーズ-カンチレバー結合を少なくとも1日間強化してから、インデンテーション測定に使用しました。- エポキシ接着剤を使用してカンチレバーにビーズを取り付け、処理時間は5分です。
- 接着剤でコーティングされたスライドガラスに最小限の接触でカンチレバーをすばやく下げて、その端に接着剤の小さな液滴が形成されるようにし、直後に適切なビーズと接触させます。
- カンチレバーとビードの接点を~10分間保持してから、結合したビードでカンチレバーを表面から持ち上げます。
- 測定前にカンチレバーを校正してください。
注:修正されたカンチレバーは、AFMソフトウェアの組み込み手順を使用して、熱雑音法によって各実験セットの前に較正されました。 - ティッシュブロック(ステップ4.18から)と培地を入れたペトリ皿をAFMのペトリ皿ホルダーに挿入し、明視野顕微鏡で概観画像を取得します(図1B)。
注:インデンテーションテストには、直立した光学顕微鏡の上にモーターステージを装備したセットアップが使用されます。AFMヘッドを取り付け、カンチレバーを組織上に配置し、カンチレバーを表面に近づけます。 - 特定の関心領域を選択し、力-距離曲線の配列を記録します(図2A)。
注:2-25 nNの相対力設定値を使用して、剛性の異なる組織に対して1~4 μmの同等のくぼみ深さに到達し、アプローチと収縮速度は7.5 μm/s、z長は50 μm、グリッドサイズは70 μm x 70 μm、3 x 3ポイント。 - プローブした領域ごとに、明視野顕微鏡画像を取得して、取得した値を四肢セクションの各特定の領域に関連付けます。
- すべてのサンプルについて、組織タイプごとに少なくとも3つの異なる領域を調査します。
注:すべての場合において、この研究では、軟骨の中心にある4つの領域と軟骨領域の周辺にある3つの領域を測定し、組織を最大1時間顕微鏡下に置きました。 - インデンテーション測定が終了したら、さらなる分析のために組織を廃棄または固定します。
注:サンプルは、測定終了後、MEMFa溶液を含む2 mLチューブに入れて固定し、4°Cで一晩固定しました。MEMFa(ステップ1.17)を使用しましたが、PBS中のホルムアルデヒド4%(w / v)溶液も使用できます。
6. (オプション)隣接する組織切片の処理
- 隣接する組織切片をその後の染色に使用する場合は、切片化直後に固定剤が入った小さな2 mLチューブに切片を入れ、4°Cで一晩固定します。
- アクチン細胞骨格と核の標識を通じて組織構造を明らかにするには、PBSでそれぞれ5分間3回洗浄して固定液を除去し、Alexa Fluor 488標識ファロイジン(1:250)およびHoechst 33258(1:10000)をPBSに含んだ溶液で、ロッキングプラットフォーム上のRTで1時間染色します。
- 次に、37°Cで安定化したAPBS中の1%(w / v)lmp-アガロースを使用して、ガラス底皿の上にステンドサンプルを固定化します(ステップ1.9から)。対象のサーフェスがガラスに面していることを確認します。アガロースが固まったら、脱水症状を防ぐためにサンプルをPBSで覆います。
注:インタクトサンプルと組織溶解サンプルは、倒立共焦点顕微鏡(倍率 10 倍、光学切片 8 μm)でイメージングします。 図1C の画像は、8つの光学セクションの最大投影です。
- 隣接する組織切片を新鮮な組織を必要とする即時下流の分析(RNA抽出、生色素によるインキュベーションなど)に使用する場合は、迅速に作業し、細胞培養培地(ステップ1.8から)を使用して、可能な限り最高の組織完全性を確保してください。
7. データ分析と表示
- 見かけのヤング率を計算するには、JPK/Brukerデータ処理ソフトウェアを使用して、球状圧子のHertz/Sneddonモデル(Eq.1)を使用して力-距離曲線を解析します。ポアソン比を0.5と仮定します。
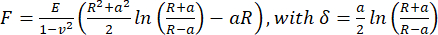 (式1)
(式1)
ここで、R:圧子半径、E:弾性率、 ν:ポアソン比、a:圧子とサンプルの間の円形接触領域の半径、δ:圧子の深さ。 - 粘弾性解析のためには、PyJibe 0.15.0 で力-押し込み曲線のアプローチ部分を "Hertz model corrected for viscoelasticity using Kelvin-Voigt-Maxwell (KVM)" (written by Paul Müller, https://github.com/AFM-analysis/PyJibe)25 で解析します。フィット関数は、Abuhattum et al.26 によって記述されたモデルに基づいており、Kelvin-Voigt-Maxwell モデル要素を統合しています。
- フォースインデンテーションカーブを前処理し、直線による区分的フィット(ベースライン)とアプローチパートの多項式フィット関数を使用して接触点を推定します。
- 力-インデンテーション曲線を「Kelvin-Voigt-Maxwell (KVM) モデルを使用して粘弾性を補正したヘルツモデル」に適合させます。フィットから、弛緩していないヤング率、見かけのヤング率、および見かけの粘度を求めます。このモデルは、マクスウェルの緩和時間とインデント時間も提供します。
注:いくつかの分析された力の押し込み曲線(特に無傷の組織)では、マクスウェル緩和時間は押し込み時間よりも有意に大きいまたは小さかったため、それぞれかなり弾性的な挙動またはケルビン・フォイトの機械的挙動が示されました。
- すべての測定値をスプレッドシートにエクスポートし、組織タイプとサンプルごとの見かけのヤング率の中央値を計算します。
- 適切なソフトウェアを使用してデータをプロットし、統計的に分析します。
注:ここではGraphPad Prismが使用されており、結果を説明する際には、サンプルあたりの見かけのヤング率の中央値の平均±SDを参照します(図2D-Fに表示)。 - 共焦点画像から光学スライスを投影することにより、Fijiの最大投影機能で光学スライスを表示します。個々のチャンネルの明るさとコントラストを調整して、蛍光染色を最適に視覚化します。
- 適切なソフトウェアでフィギュアパネルを生成します。
注:パネルの生成にはAffinity Designerを使用し、 図1A のモデルはAffinity Designerを使用して描画します。
Access restricted. Please log in or start a trial to view this content.
結果
上記のプロトコルを使用して、我々は、初期の軟骨組織溶解中、および後の軟骨凝縮段階(図1A)の間に、恒常性(「無傷」)状態で軟骨ウーパールーパー四肢組織の見かけのヤング率を測定した。また、カンチレバーの位置を示す画像に示されているように、中心と周辺を含むさまざまな領域の骨格要素の機械的特性を調査しました(
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここでは、AFMを用いてウーパールーパー四肢の軟骨硬直を測定する技術を紹介します。ただし、この方法は、他の組織タイプもプローブするために拡張できます。AFM測定を成功させるための重要なステップはサンプル調製であり、これはウーパールーパーサンプルでは特に困難であることが証明されました。その結果、アガロースブロックにまだ埋め込まれている組...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利益相反を宣言しません
謝辞
この研究の開発期間中、Sandoval-Guzmán研究室のすべてのメンバーに継続的なサポートと交際に感謝します。また、アニヤ・ワグナー、ベアテ・グリュール、ジュディス・コナンツのウーパールーパーケアへの献身にも感謝しています。また、AFMデータ解析用のコードを提供してくださったPaul Müller氏にも感謝します。この研究は、ドレスデン工科大学のCMCBテクノロジープラットフォームの光学顕微鏡施設の支援を受けました。ATは、ドイツがん援助(Deutsche Krebshilfe)が資金提供するミルドレッド・シェール・アーリー・キャリア・センター・ドレスデンP2のフェローです。RAは、Deutsche Forschungsgemeinschaft(DFG、ドイツ研究財団)のTemporary PIポジション(Eigene Stelle)– AI 214/1-1によって資金提供されています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
参考文献
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0-2 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , Springer. Cham. (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966(2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681(2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711(2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036(2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016(2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268(2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17(2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341(2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, Springer. Dordrecht. 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078(2022).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved