Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesures par microscopie à force atomique du cartilage dans des membres axolotls intacts et en régénération
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans ce protocole, nous montrons comment préparer le tissu axolotl pour la microscopie à force atomique (AFM) et effectuer des mesures d’indentation dans le cartilage des membres intact et en régénération.
Résumé
Les forces mécaniques fournissent des signaux importants pour le fonctionnement normal des cellules et la formation de motifs dans les tissus en développement, et leur rôle a été largement étudié au cours de l’embryogenèse et de la pathogenèse. En comparaison, on sait peu de choses sur ces signaux pendant la régénération des animaux.
L’axolotl est un organisme modèle important pour l’étude de la régénération, compte tenu de sa capacité à restaurer complètement de nombreux organes et tissus après une blessure, y compris le cartilage et les os manquants. En raison de son rôle crucial en tant que principal tissu de soutien dans le corps des vertébrés, la récupération de la fonction squelettique pendant la régénération nécessite à la fois la restauration des structures manquantes ainsi que de leurs propriétés mécaniques. Ce protocole décrit une méthode de traitement des échantillons de membres d’axolotl pour la microscopie à force atomique (AFM), qui est la référence pour sonder les propriétés mécaniques des cellules et des tissus à haute résolution spatiale.
Tirant parti des capacités de régénération de l’axolotl, cette étude a mesuré la rigidité du cartilage des membres pendant l’homéostasie et deux étapes de la régénération des membres : l’histolyse tissulaire et la condensation du cartilage. Nous montrons que l’AFM est un outil précieux pour mieux comprendre la restructuration dynamique des tissus et les changements mécaniques qui se produisent au cours de la régénération.
Introduction
Le squelette, en particulier le cartilage et les os, constitue le principal support mécanique des tissus mous du corps chez les vertébrés. Par conséquent, tout dommage dans le système squelettique est susceptible de compromettre considérablement la fonctionnalité et même la survie. Chez l’homme, les fractures osseuses sont l’une des blessures traumatiques les plus courantes1, dont la plupart se réparent en quelques semaines, mais 5% à 10% d’entre elles auront des retards de guérison ou ne se rétabliront jamais complètement 2,3. De plus, les humains ne sont pas en mesure de récupérer d’une perte osseuse ou cartilagineuse importante 4,5. Certaines salamandres, cependant, peuvent régénérer une variété de structures corporelles, y compris des membres entiers6, ce qui en fait un modèle idéal pour l’étude de la régénération squelettique.
L’axolotl (Ambystoma mexicanum) est un type de salamandre dont la régénération des membres a été largement étudiée. Ce processus se produit en quatre phases séquentielles principales mais qui se chevauchent : 1) la cicatrisation des plaies, 2) l’inflammation/histolyse, 3) la formation d’un blastème et 4) l’excroissance/différenciation du blastème (examiné dans 7,8). Après l’amputation, les kératinocytes bordant le site de la blessure migrent rapidement, fermant la plaie et formant l’épithélium de la plaie (EH). Au cours de l’inflammation et de l’histolyse qui s’ensuivent, les agents pathogènes sont éliminés, les débris et les cellules endommagées sont éliminés et la matrice extracellulaire (MEC) sous la surface de l’amputation est remodelée9. L’histolyse tissulaire est essentielle à la régénération des membres10, où la sécrétion d’enzymes protéolytiques est cruciale non seulement pour le remodelage global de la MEC, mais aussi pour libérer les cellules à l’origine du blastème et libérer les molécules bioactives séquestrées dans la MEC elle-même8. En fait, des études dans de nombreux contextes régénératifs et organismes modèles ont montré que les propriétés matérielles uniques de l’ECM pendant l’histolyse sont capables d’induire des processus de dédifférenciation ou de diriger la migration des cellules vers le site de la blessure (examiné dans11). De plus, la résorption du tissu calcifié au cours des derniers stades de l’histolyse s’est avérée être essentielle à la bonne intégration des éléments squelettiques des membres nouvellementformés12. Après l’étape d’histolyse, le blastème se forme sous l’épithélium de la plaie (WE) sous la forme d’une accumulation de progéniteurs indifférenciés et multi-lignées résultant de cellules de tissus matures dédifférenciées ou de cellules souches résidentes. Les cellules du blastema prolifèrent et se différencient en tous les types de cellules manquantes. Enfin, la morphogenèse des membres a lieu, où le tissu squelettique est régénéré par la condensation de chondroprogéniteurs dérivés de cellules périskélétales et de fibroblastes dermiques transdifférenciés 13,14,15.
Bien que de nombreux signaux biochimiques régulant les changements dans l’identité cellulaire et la composition de la MEC aient été identifiés 10,13,14,16,17,18, les propriétés mécaniques des tissus au cours des différentes phases de la régénération des membres, ainsi que leur influence sur la régénération, sont restées largement inexplorées. De nombreuses études ont montré que les cellules détectent et intègrent des signaux mécaniques qui régulent leur destin et leur comportement dans plusieurs contextes (examiné dans19,20). Par conséquent, compléter nos connaissances cellulaires et moléculaires de la régénération des membres par des mesures mécaniques tissulaires améliorera considérablement notre compréhension de ces processus.
Différentes techniques ont été développées pour permettre la caractérisation mécanique et la manipulation de la force des échantillons biologiques21. Parmi ces techniques, la microscopie à force atomique (AFM) est devenue la référence en mécanobiologie, dans laquelle les propriétés viscoélastiques des échantillons biologiques sont sondées à haute résolution spatiale en indentation avec un capteur de force ultrasensible, l’AFM cantilever22. Étant donné que cette technique nécessite un contact direct avec l’échantillon, des coupes de tissu sont généralement générées, ce qui peut être difficile dans certains cas. Ainsi, les conditions de préparation doivent être adaptées et optimisées pour chaque échantillon particulier afin qu’il puisse rester aussi proche que possible des conditions physiologiques et qu’un minimum d’artefacts soit généré23. Ce protocole décrit comment mesurer la rigidité tissulaire des membres axolotls à l’aide de l’AFM, en se concentrant sur les tissus cartilagineux dans des conditions intactes, pendant l’histolyse et dans les stades de condensation du cartilage (Figure 1 et Figure 2). Cette méthode peut également être étendue à la mesure d’autres types de tissus.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les axolotls (Ambystoma mexicanum) ont été cultivés dans l’installation Axolotl du Centre de thérapies régénératives de Dresde (CRTD) de l’Université de technologie de Dresde (TUD). Une description complète des conditions d’élevage se trouve dans lasection 24. Brièvement, les pièces ont été maintenues à 20-22 °C avec un cycle jour/nuit de 12/12 h. Toutes les manipulations et interventions chirurgicales ont été effectuées conformément aux directives du comité d’éthique local et ont été approuvées par la Landesdirektion Sachsen, en Allemagne.
Cette étude a utilisé des axolotls blancs (d/d) pour toutes les expériences, une souche mutante naturelle dépourvue de pigmentation corporelle (peu ou pas de mélanophores et de xanthophores), avec des iridophores uniquement dans l’iris des yeux. Cette étude a utilisé des axolotls mesurant de 8 à 15 cm du museau à la queue (âgés de 5 à 7 mois) sans biais spécifique au sexe.
1. Préparation
- Préparez une solution mère de benzocaïne à 10 % (p/v) qui sera utilisée pour l’anesthésie et l’euthanasie des axolotls (voir ci-dessous). Pour cela, mélangez dans une bouteille volumétrique 50 g de benzocaïne avec 100% d’éthanol jusqu’à ce que la limite de 500 ml soit atteinte.
- Préparez une solution mère de benzocaïne à 0,03 % (p/v).
- Pour 1 L, mélanger 50 mL de solution saline 10 fois tamponnée au Tris (TBS) avec 30 mL de benzocaïne à 10 % (p/v) et 5 mL de solutions Holtfreter’s à 4000 % (p/v) avec 915 mL d’eau distillée et mélanger toute la nuit avec un barreau d’agitation magnétique.
- Pour 1 L de solution 10x TBS, mélanger 24,2 g de base Trizma et 90 g de NaCl avec 990 mL d’eau désionisée. Bien mélanger avec un barreau magnétique. Ensuite, ajoutez environ 10 ml de HCl concentré (12 M ou 37 %) et ajustez pour obtenir un pH de 8.
- Pour 1 L de solution Holtfreter à 4000 % (p/v), mélanger 158,4 g de NaCl, 11,13 g de MgSO4·7H2O, 5,36 g de CaCl2·2H2O et 2,88 g de KCl avec de l’eau déminéralisée jusqu’à 1 L.
- Préparer une dilution de benzocaïne de travail à 0,01 % (p/v) dans l’eau du réservoir de stockage pour l’anesthésie en diluant la solution mère à 0,03 % (p/v) 1:3.
- Pour 1 L de solution, utilisez 333 mL de la solution mère de benzocaïne plus 666 mL d’eau du réservoir de rétention.
- Préparez une solution mère de tartrate de butorphanol à 5 mg/mL pour l’analgésie. Pour cela, mélangez 100 mg de sel de butorphanol (+)-tartrate avec 20 mL d’eau ultrapure. Stocker les aliquotes à 4 °C.
- Le jour de l’amputation, préparer une solution de travail de tartrate de butorphanol de 0,5 mg/L pour réduire la douleur de l’animal après des interventions chirurgicales en diluant la solution mère 1:10.000 dans l’eau du réservoir de rétention.
- Pour les animaux de moins de 8 cm de long, mélanger 20 μL de solution mère dans 200 mL d’eau de réservoir.
- Pour les gros animaux, mélanger 60 μL de solution mère dans 600 mL d’eau du réservoir de stockage.
- Préparez une solution saline tamponnée au phosphate d’amphibiens stérile, une solution de PBS à 80 % (v/v), et conservez-la à température ambiante en mélangeant 800 ml de DPBS avec 200 ml d’eau déminéralisée.
- Préparez une solution mère d’insuline à 1 mg/mL. Pour cela, mélangez 250 mg de poudre d’insuline avec 25 ml de HCl 0,1 M et agitez lentement jusqu’à dissolution. Pendant l’agitation, ajouter 225 mL d’APBS jusqu’à ce que la solution soit claire. Filtrer stérilement et stocker 4 mL d’aliquotes à -20 °C.
- Préparez le milieu de culture stérile (tous les % (v/v) : milieu L15 à 62,5 %, FBS inactivé à la chaleur à 10 %, pénicilline/streptomycine, 1 % d’insuline, 1 % de L-glutamine) et conservez-le à 4 °C jusqu’au jour de l’utilisation. Le jour de l’expérience, équilibrez en fonction de la RT avant l’utilisation.
- Pour 400 ml de milieu de culture, utilisez 250 ml de milieu L15, 40 ml de FBS inactivé par la chaleur, 4 ml de pénicilline/streptomycine, 4 ml de solution d’insuline (de l’étape 1.7), 4 ml de L-glutamine et 98 ml d’eau stérile désionisée. Préparez dans des conditions stériles et un filtre stérile après avoir mélangé tous les composants. Préparez 15 mL d’aliquotes.
- Préparez de l’agarose à bas point de fusion (lmp) à 2,5 % et 3 % (p/v) dans une solution APBS et chauffez à 70 °C pour dissoudre complètement l’agarose. Préparez les aliquotes dans des tubes de 1,5 mL et conservez-les à 4 °C jusqu’au jour de l’utilisation.
- Pour obtenir 20 ml d’agarose lmp à 2,5 % (p/v), mélanger 0,5 g d’agarose lmp avec 20 mL d’APBS dans un tube de 50 mL et chauffer au bain-marie à 70 °C jusqu’à ce que l’agarose soit complètement fondue. La solution doit devenir claire et transparente. Préparez les aliquotes encore chaudes.
- Pour 20 mL d’agarose lmp à 3 % (p/v), mélanger 0,6 g d’agarose lmp avec 20 mL d’APBS et procéder comme ci-dessus.
- (Facultatif) : Pour 20 mL de 1 % (p/v) d’agarose lmp, mélanger 0,2 g d’agarose lmp avec 20 mL d’APBS et procéder comme ci-dessus.
REMARQUE : Le temps de fusion dépend de la concentration de l’agarose lmp et peut varier d’environ 15 à 40 min.
- Pour l’amputation et le montage de tissus, utilisez un stéréoscope à fond clair.
- Assemblez des boîtes de Pétri en plastique de 100 mm de diamètre, des pinces, un scalpel et des ciseaux chirurgicaux pour les amputations et le prélèvement de tissus.
- Préparez des boîtes de Pétri en plastique de 35 mm de diamètre pour les mesures d’indentation.
- Préparez des cylindres de ~1 cm de long et de ~1 cm de diamètre. Pour cela, chauffez un coupe-carton sous la flamme d’un bec Bunsen et coupez un tube de 15 ml avec la lame chauffée.
- Coupez de petits carrés de 1 cm2 de parafilm et rangez-les.
- Préparez un bloc métallique ou froid à -20 °C en le laissant au congélateur pendant au moins 1 h.
- Préparez des pipettes Pasteur en plastique.
- (Facultatif) : Préparez une solution fixatrice de MEMFa (acide 3-(N-morpholino)propanesulfonique [MOPS] 0,1 M pH 7,4, éthylène glycol-bis (2-aminoéthyléther )-N,N,N′,N′-acide tétraacétique [EGTA] 2 mM, MgSO4·7H2O 1 mM, formaldéhyde à 3,7 %). Pour cela, ajoutez 10,465 g de MOPS, 0,123 g de MgSO4·7H2O, 2 mL de 0,5 M EDTA pH 8,0, et ajoutez de l’eau jusqu’à 45 mL. Ajouter 5 mL de formaldéhyde à 37 % (p/v) à un volume total de 50 mL.
2. Réactifs
- Reportez-vous à la table des matériaux pour connaître les réactifs utilisés pour ce travail, mais d’autres fournisseurs commerciaux peuvent également être utilisés.
3. Amputation de l’axolotl et régénération des membres
- Avant toutes les procédures expérimentales, anesthésier l’animal avec de la benzocaïne à 0,01 % (p/v) diluée dans de l’eau du réservoir de rétention (étape 1.3) pendant 20 min, en s’assurant que les animaux sont profondément anesthésiés et ne répondent pas aux stimuli tactiles.
- Retirez l’axolotl de l’anesthésie et posez-le sur une boîte de Pétri de 100 mm contenant un mouchoir en papier imbibé d’eau contenant de l’anesthésie. Orientez le membre perpendiculairement à l’axe du corps et placez la plaque sous le stéréoscope pour une meilleure visualisation.
REMARQUE : Un stéréoscope avec une lampe compacte à col de cygne a été utilisé ici. - Amputez le membre à l’aide d’un scalpel stérile pointu immédiatement distal de la zone calcifiée de la région zeugopodiale (radius/cubitus) (Figure 1A).
REMARQUE : Conformément au principe de bien-être animal 3R, il est recommandé d’utiliser les membres qui ont été initialement retirés par l’amputation comme témoins intacts. - Laissez l’animal sur la coupelle et couvrez-le d’un papier de soie humidifié imbibé d’eau contenant de la benzocaïne pendant 15 minutes pour permettre la coagulation du sang et la fermeture de la plaie.
- Remettre les animaux dans un réservoir contenant de l’eau fraîche de rétention avec des analgésiques (tartrate de butorphanol, 0,5 mg/L, à partir de l’étape 1.5).
- Déplacer les animaux dans leur réservoir d’origine contenant de l’eau de rétention fraîche 24 h après le traitement analgésique postopératoire.
- Laissez les animaux se régénérer jusqu’au stade d’intérêt souhaité.
REMARQUE : Les membres analysés ont été prélevés le jour de l’amputation pour la phase intacte et 5 jours après l’amputation (dpa) pour la phase d’histolyse chez des animaux âgés de 5 mois. Le stade de condensation du cartilage a été mesuré à 21 dpa chez des animaux âgés de 7 mois.
4. Montage et traitement des tissus pour les mesures
- Chauffer les tubes de 1,5 mL contenant 2,5 % ou 3 % (p/v) d’agarose lmp (à partir de l’étape 1.9) sur un thermobloc à 70 °C jusqu’à ce que l’agarose soit complètement fondue. Changez les tubes pour un autre thermobloc à 37 °C et laissez la température s’équilibrer avant de l’utiliser.
REMARQUE : Ici, 2,5 % d’agarose lmp a été utilisé pour mesurer la régénération des tissus et 3 % pour les tissus intacts. - Couvrez un côté des cylindres de 1 cm de long (à partir de l’étape 1.13) avec l’un des morceaux de parafilm (étape 1.14) afin qu’ils soient complètement scellés à leur fond.
- Équilibrer 15 mL d’aliquotes de milieu de culture avec la RT (à partir de l’étape 1.8)
- Anesthésier les animaux en les immergeant dans de l’eau contenant un anesthésique (benzocaïne à 0,01 % (p/v) diluée dans l’eau du réservoir de rétention) pendant au moins 20 min.
- Imagez les membres sous un stéréoscope avec un logiciel permettant des mesures quantitatives. Mesurez la longueur de la structure d’intérêt et calculez la quantité de tissu qui doit être retirée de l’extrémité distale du membre jusqu’à ce que la section d’intérêt soit atteinte.
- Pour régénérer les membres, prélevez-les en coupant avec un scalpel et/ou des ciseaux chirurgicaux au niveau du coude et en disséquant l’excès de tissu du membre. Laissez le tissu dans une solution APBS pendant la préparation de l’étape suivante. Assurez-vous que la coupe est transversale (90°) à l’axe de l’avant-bras pour créer une surface plane. Pour les membres intacts, retirez la main en coupant à travers la région carpienne.
- Euthanasier les animaux en les exposant à une dose létale d’anesthésie (0,1 % de benzocaïne) pendant au moins 20 min. Pour cela, ajoutez le volume requis de solution de benzocaïne à 10 % (p/v) pour atteindre une concentration de 0,1 % (p/v).
- Si les animaux ont été anesthésiés dans 100 ml de solution de benzocaïne à 0,01 % (p/v), ajouter 900 μL de solution de benzocaïne à 10 % (p/v).
- Rincez les membres en les immergeant dans la solution APBS.
- Veiller à ce que les pipettes Pasteur et le thermobloc (stabilisé à 37 °C avec des aliquotes d’agarose) soient proches du poste de travail. Sortez le bloc froid du congélateur à -20 °C et placez le cylindre avec l’extrémité recouverte de parafilm vers le bas sur le dessus.
- Saisissez le membre disséqué et retirez délicatement l’excès de liquide avec du papier de soie. Placez le membre sur une assiette propre, ajoutez l’agarose LMP fondue sur le dessus et déplacez brièvement le membre dans l’agarose pour déplacer tout APBS restant de la surface de la peau.
- En travaillant rapidement, placez le membre à l’intérieur du cylindre, en vous assurant qu’il est orienté verticalement, la zone d’intérêt étant tournée vers le haut.
- Tout en tenant doucement le membre avec une pince, ajoutez lmp-agarose à l’intérieur du cylindre jusqu’à ce que le tissu soit complètement recouvert. Retirez délicatement la pince avant que l’agarose ne se solidifie.
- Retirez le cylindre du bloc froid et laissez l’agarose se solidifier complètement à RT pendant environ 30 s.
- Apportez immédiatement le bloc d’agarose contenant des tissus à la salle de vibratome, avec des aliquotes de milieu de culture stériles et APBS, à RT.
- Retirez le parafilm du bas du cylindre et fixez l’agarose contenant le tissu à l’étage du vibratome avec de la colle cyanoacrylate. Assurez-vous que l’agarose et l’échantillon sont collés à la scène.
- Immergez la platine dans l’APBS pour le sectionnement.
REMARQUE : Les tissus intacts comprennent l’os / cartilage plus rigide, tandis que les tissus régénérants sont plus mous. Par conséquent, les paramètres du vibratome doivent être ajustés en conséquence. Cette étude a utilisé les paramètres suivants : tissus intacts (amplitude 1,2 mm et vitesse 0,1 mm/s) et tissus en régénération (amplitude 0,9 mm et vitesse 0,4 mm/s). - Commencez à sectionner l’agarose par petites étapes (par exemple, par pas de 100 μm) jusqu’à ce que l’extrémité du tissu soit atteinte. Ensuite, sectionnez le bloc de tissu jusqu’à ce que la partie distale du tissu (calculée à l’étape 4.5) soit retirée. De cette façon, un échantillon transversal transversal de la zone d’intérêt sera facilement accessible.
REMARQUE : La section de tissu retirée contiendra la surface immédiatement adjacente à celle sondée avec AFM et peut servir de référence pour la structure tissulaire. Par conséquent, il peut être utilisé pour une analyse complémentaire directe ou fixé pour une coloration ultérieure (voir rubrique 6). - Retirez avec précaution le bloc contenant du tissu de la scène du vibratome à l’aide d’une lame de rasoir et enlevez toute trace de colle. Collez immédiatement le bloc sur une boîte de Pétri en plastique de 35 mm avec de la colle adhésive pour tissus chirurgicaux et ajoutez environ 2 ml de milieu de culture à RT pour vous assurer que le tissu est entièrement couvert.
REMARQUE : La surface tissulaire exposée dans le bloc d’agarose est la surface à sonder.
5. Mesures avec AFM
- Au moins 1 jour avant les mesures, préparez le cantilever pour les mesures.
REMARQUE : Pour ce travail, des porte-à-faux en silicium sans pointe ont été fonctionnalisés avec des billes de polystyrène (diamètre 20 μm), et la liaison bille et porte-à-faux a été laissée à se renforcer pendant au moins 1 jour avant d’être utilisée pour les mesures d’indentation.- Fixez les perles aux porte-à-faux à l’aide de colle époxy avec un temps de traitement de 5 min.
- Abaissez rapidement le porte-à-faux avec un contact minimal sur une lame de verre enduite de colle de sorte qu’une petite gouttelette de colle se forme à son extrémité, et mettez-la immédiatement après en contact avec un cordon approprié.
- Maintenez le contact cantilever-talon pendant ~10 min avant de soulever le cantilever avec un talon lié de la surface.
- Calibrez le porte-à-faux avant les mesures.
REMARQUE : Le cantilever modifié a été étalonné avant chaque série d’expériences par la méthode du bruit thermique à l’aide des procédures intégrées du logiciel AFM. - Insérez la boîte de Pétri avec le bloc de tissu (à l’étape 4.18) et le milieu de culture dans le support de la boîte de Pétri de l’AFM et obtenez une image d’ensemble en microscopie à fond clair (Figure 1B).
REMARQUE : Pour les tests d’indentation, une configuration équipée d’un platine motorisé au-dessus d’un microscope optique droit est utilisée. Montez la tête AFM et positionnez le cantilever sur le tissu et amenez le cantilever à proximité de la surface. - Choisissez la région d’intérêt spécifique et enregistrez un ensemble de courbes force-distance (Figure 2A).
REMARQUE : Des points de consigne de force relative de 2 à 25 nN ont été utilisés afin d’atteindre des profondeurs d’indentation comparables de ~1 à 4 m pour des tissus de rigidité différente, avec une vitesse d’approche et de rétraction de 7,5 m/s, une longueur z de 50 m, une taille de grille de 70 m x 70 m avec 3 points 3. - Pour chaque région sondée, acquérez une image de microscopie à fond clair pour associer les valeurs obtenues à chaque région particulière de la section du membre.
- Pour tous les échantillons, sondez au moins 3 régions différentes par type de tissu.
REMARQUE : Dans tous les cas, cette étude a mesuré 4 régions au centre du cartilage et 3 régions à la périphérie de la région cartilagineuse et a maintenu le tissu sous le microscope pendant un maximum de 1 h. - Une fois les mesures d’indentation terminées, jetez ou fixez le tissu pour une analyse plus approfondie.
REMARQUE : Les échantillons ont été fixés après la fin des mesures en les plaçant dans des tubes de 2 mL contenant une solution de MEMFa et fixés pendant une nuit à 4 °C. MEMFa (étape 1.17) a été utilisé, mais une solution de formaldéhyde à 4 % (p/v) dans du PBS peut également être utilisée.
6. (Facultatif) Traitement de sections de tissus adjacentes
- Si les coupes de tissus adjacentes sont utilisées pour une coloration ultérieure, placez-les immédiatement après la section dans un petit tube de 2 mL contenant un fixateur et fixez-les pendant la nuit à 4 °C.
- Pour révéler l’architecture tissulaire grâce au marquage du cytosquelette d’actine et des noyaux, laver 3 fois avec du PBS pendant 5 minutes chacune pour éliminer le fixateur et colorer avec une solution contenant de la phalloïdine conjuguée Alexa Fluor 488 (1:250) et du Hoechst 33258 (1:10000) dans du PBS pendant 1 h à RT sur une plate-forme à bascule.
- Ensuite, immobiliser les échantillons colorés sur des boîtes à fond de verre à l’aide de 1 % (p/v) d’agarose lmp stabilisée à 37 °C (à partir de l’étape 1.9). Assurez-vous que la surface d’intérêt fait face au verre. Une fois que l’agarose se solidifie, recouvrez les échantillons de PBS pour éviter la déshydratation.
REMARQUE : Les échantillons intacts et d’histolyse sont imagés à l’aide d’un microscope confocal inversé (grossissement de 10x et coupes optiques de 8 μm). Les images de la figure 1C sont des projections maximales de 8 sections optiques.
- Si la section de tissu adjacente est utilisée pour une analyse en aval immédiat nécessitant des tissus frais (comme l’extraction d’ARN, l’incubation avec des colorants vivants, etc.), assurez-vous de travailler rapidement et d’utiliser un milieu de culture cellulaire (à partir de l’étape 1.8) pour garantir la plus grande intégrité possible des tissus.
7. Analyse et affichage des données
- Pour calculer le module de Young apparent, analysez les courbes force-distance à l’aide du modèle Hertz/Sneddon (Eq.1) pour un pénétrateur sphérique à l’aide du logiciel de traitement de données JPK/Bruker, en supposant un coefficient de Poisson de 0,5.
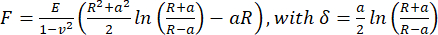 (Équation 1)
(Équation 1)
Où R : rayon du pénétrateur, E : module d’élasticité, ν : coefficient de Poisson, a : rayon de la surface de contact circulaire entre le pénétrateur et l’échantillon, δ : profondeur d’indentation. - Pour l’analyse viscoélastique, analysez les parties d’approche des courbes force-indentation dans PyJibe 0.15.0 avec l’extension « Modèle de Hertz corrigé pour la viscoélasticité à l’aide de Kelvin-Voigt-Maxwell (KVM) » (écrit par Paul Müller, https://github.com/AFM-analysis/PyJibe)25. La fonction d’ajustement est basée sur un modèle décrit par Abuhattum et al.26, intégrant des éléments du modèle Kelvin-Voigt-Maxwell.
- Pré-traitez les courbes d’indentation de force pour estimer le point de contact à l’aide d’un ajustement par morceaux avec une ligne (ligne de base) et d’une fonction d’ajustement polynomial pour la pièce d’approche.
- Ajustez les courbes force-indentation au « modèle Hertz corrigé pour la viscoélasticité à l’aide du modèle Kelvin-Voigt-Maxwell (KVM) ». À partir de l’ajustement, obtenez le module de Young non détendu, le module de Young apparent et la viscosité apparente. Le modèle donne également à Maxwell des temps de relaxation et d’indentation.
REMARQUE : Dans plusieurs courbes d’indentation de force analysées (en particulier le tissu intact), les temps de relaxation de Maxwell étaient significativement plus grands ou plus petits que le temps d’indentation, ce qui indique respectivement un comportement plutôt élastique ou un comportement mécanique de Kelvin-Voigt.
- Exportez toutes les mesures vers une feuille de calcul et calculez les modules de Young apparents médians par type de tissu et par échantillon.
- Tracez et analysez statistiquement les données à l’aide d’un logiciel approprié.
REMARQUE : Le prisme GraphPad est utilisé ici, et lors de la description des résultats, l’étude fait référence à la moyenne ± SD des modules de Young apparents médians par échantillon (illustré à la figure 2D-F). - Affichez des tranches optiques à partir d’images confocales en les projetant avec la fonction de projection maximale Fidji. Ajustez la luminosité et le contraste de chaque canal individuel pour une visualisation optimale des colorations fluorescentes.
- Générez un panneau de figures avec le logiciel approprié.
REMARQUE : Affinity Designer est utilisé pour générer les panneaux, et le modèle de la Figure 1A est dessiné à l’aide d’Affinity Designer.
Access restricted. Please log in or start a trial to view this content.
Résultats
En utilisant le protocole décrit ci-dessus, nous avons mesuré le module de Young apparent des tissus cartilagineux des membres axolotls dans des conditions homéostatiques (« intactes »), au cours de l’histolyse précoce du cartilage et des stades ultérieurs de condensation du cartilage (Figure 1A). Nous avons également sondé les propriétés mécaniques des éléments squelettiques dans différentes régions, y compris leur centre et leur périphé...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ici, nous démontrons une technique de mesure de la rigidité cartilagineuse dans les membres axolotls avec AFM. Cependant, cette méthode peut également être étendue pour sonder d’autres types de tissus. La préparation des échantillons, qui s’est avérée particulièrement difficile pour les échantillons d’axolotl, est une étape clé pour des mesures AFM réussies. Nous avons constaté que sonder la surface tissulaire qui était encore encastrée dans le bloc d’agarose é...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts
Remerciements
Nous remercions tous les membres du laboratoire Sandoval-Guzmán pour leur soutien continu et leur accompagnement pendant le développement de ce travail. Nous sommes également reconnaissants à Anja Wagner, Beate Gruhl et Judith Konantz pour leur dévouement aux soins de l’axolotl. Nous remercions également Paul Müller d’avoir fourni des codes pour l’analyse des données AFM. Ce travail a été soutenu par l’installation de microscopie optique de la plate-forme technologique CMCB à l’Université technique de Dresde. AT est membre du Mildred Scheel Early Career Center Dresde P2 financé par l’Aide allemande contre le cancer (Deutsche Krebshilfe). RA est financé par un poste de chercheur principal temporaire (Eigene Stelle) de la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) – AI 214/1-1.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Références
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0-2 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , Springer. Cham. (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966(2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681(2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711(2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036(2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016(2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268(2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17(2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341(2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, Springer. Dordrecht. 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078(2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon