È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazioni al microscopio a forza atomica della cartilagine in arti axolotl intatti e in rigenerazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo protocollo, mostriamo come preparare il tessuto axolotl per la microscopia a forza atomica (AFM) ed eseguire misurazioni dell'indentazione nella cartilagine degli arti intatta e in rigenerazione.
Abstract
Le forze meccaniche forniscono segnali importanti per la normale funzione cellulare e la formazione di pattern nei tessuti in via di sviluppo, e il loro ruolo è stato ampiamente studiato durante l'embriogenesi e la patogenesi. In confronto, si sa poco di questi segnali durante la rigenerazione animale.
L'axolotl è un importante organismo modello per lo studio della rigenerazione, data la sua capacità di ripristinare completamente molti organi e tessuti dopo una lesione, tra cui la cartilagine e l'osso mancanti. A causa del suo ruolo cruciale come principale tessuto di supporto nel corpo dei vertebrati, il recupero della funzione scheletrica durante la rigenerazione richiede sia il ripristino delle strutture mancanti che delle loro proprietà meccaniche. Questo protocollo descrive un metodo per l'elaborazione di campioni di arti axolotl per la microscopia a forza atomica (AFM), che è il gold standard per sondare le proprietà meccaniche di cellule e tessuti ad alta risoluzione spaziale.
Sfruttando le capacità rigenerative dell'axolotl, questo studio ha misurato la rigidità della cartilagine degli arti durante l'omeostasi e due fasi della rigenerazione degli arti: l'istolisi tissutale e la condensazione della cartilagine. Dimostriamo che l'AFM è uno strumento prezioso per ottenere informazioni sulla ristrutturazione dinamica dei tessuti e sui cambiamenti meccanici che si verificano durante la rigenerazione.
Introduzione
Lo scheletro, in particolare la cartilagine e le ossa, fornisce il principale supporto meccanico per i tessuti molli del corpo nei vertebrati. Pertanto, è probabile che qualsiasi danno al sistema scheletrico comprometta notevolmente la funzionalità e persino la sopravvivenza. Nell'uomo, le fratture ossee sono una delle lesioni traumatiche più comuni1, la maggior parte delle quali si ripara nel giro di poche settimane, ma il 5%-10% di queste avrà ritardi nella guarigione o non si riprenderà mai completamente 2,3. Inoltre, gli esseri umani non sono in grado di riprendersi da un'estesa perdita di ossa o cartilagine 4,5. Alcune salamandre, tuttavia, possono rigenerare una varietà di strutture corporee, compresi gli arti interi6, rendendole un modello ideale per lo studio della rigenerazione scheletrica.
L'axolotl (Ambystoma mexicanum) è un tipo di salamandra in cui la rigenerazione degli arti è stata ampiamente studiata. Questo processo avviene in quattro fasi principali sequenziali ma sovrapposte: 1) guarigione della ferita, 2) infiammazione/istolisi, 3) formazione del blastema e 4) crescita/differenziazione del blastema (rivisto in 7,8). Dopo l'amputazione, i cheratinociti che delimitano il sito della lesione migrano rapidamente, chiudendo la ferita e formando l'epitelio della ferita (WE). Durante l'infiammazione e l'istolisi che ne conseguono, gli agenti patogeni vengono eliminati, i detriti e le cellule danneggiate vengono eliminati e la matrice extracellulare (ECM) sotto la superficie di amputazione viene rimodellata9. L'istolisi tissutale è essenziale per la rigenerazione degli arti10, dove la secrezione di enzimi proteolitici è cruciale non solo per il rimodellamento complessivo della MEC, ma anche per rilasciare le cellule che danno origine al blastema e alle molecole bioattive libere sequestrate nella MEC stessa8. Infatti, studi in molti contesti rigenerativi e organismi modello hanno dimostrato che le proprietà uniche del materiale della MEC durante l'istolisi sono in grado di indurre processi di dedifferenziazione o di dirigere la migrazione delle cellule verso il sito della lesione (rivisto in11). Inoltre, il riassorbimento del tessuto calcificato durante le fasi avanzate dell'istolisi si è dimostrato fondamentale per una corretta integrazione degli elementi scheletrici degli arti di nuova formazione12. Dopo la fase di istolisi, il blastema si forma sotto l'epitelio della ferita (WE) come accumulo di progenitori indifferenziati e multi-lineage derivanti da cellule di tessuto maturo dedifferenziate o cellule staminali residenti. Le cellule di Blastema proliferano e si differenziano in tutti i tipi di cellule mancanti. Infine, avviene la morfogenesi degli arti, dove il tessuto scheletrico viene rigenerato attraverso la condensazione di condroprogenitori derivati da cellule perischeletriche e fibroblasti dermici transdifferenziati 13,14,15.
Sebbene molti degli indizi biochimici che regolano i cambiamenti nell'identità cellulare e nella composizione della ECM siano stati identificati 10,13,14,16,17,18, le proprietà meccaniche dei tessuti durante le diverse fasi della rigenerazione degli arti, così come la loro influenza nella rigenerazione, sono rimaste in gran parte inesplorate. Molti studi hanno dimostrato che le cellule percepiscono e integrano segnali meccanici che regolano il loro destino e il loro comportamento in diversi contesti (rivisto in19,20). Pertanto, integrare le nostre conoscenze cellulari e molecolari sulla rigenerazione degli arti con misurazioni meccaniche dei tessuti migliorerà notevolmente la nostra comprensione di questi processi.
Sono state sviluppate diverse tecniche che consentono la caratterizzazione meccanica e la manipolazione della forza di campioni biologici21. Tra queste tecniche, la microscopia a forza atomica (AFM) è diventata il gold standard in meccanobiologia, in cui le proprietà viscoelastiche dei campioni biologici vengono sondate ad alta risoluzione spaziale mediante indentazione con un sensore di forza ultrasensibile, l'AFM cantilever22. Poiché questa tecnica richiede il contatto diretto con il campione, in genere vengono generate fette di tessuto, che in alcuni casi possono essere difficili. Pertanto, le condizioni di preparazione devono essere adattate e ottimizzate per ogni particolare campione in modo che possa rimanere il più vicino possibile alle condizioni fisiologiche e che vengano generati artefatti minimi23. Questo protocollo descrive come misurare la rigidità tissutale negli arti axolotl utilizzando l'AFM, concentrandosi sui tessuti cartilaginei in condizioni integre, durante l'istolisi e negli stadi di condensazione della cartilagine (Figura 1 e Figura 2). Questo metodo può essere ampliato anche per la misurazione di altri tipi di tessuto.
Protocollo
Gli axolotl (Ambystoma mexicanum) sono stati coltivati nella struttura di Axolotl del Center for Regenerative Therapies Dresden (CRTD) della Dresden University of Technology (TUD). Una descrizione completa delle condizioni di allevamento può essere trovata in24. In breve, gli ambienti sono stati mantenuti a 20-22 °C con un ciclo giorno/notte di 12/12 ore. Tutte le procedure di manipolazione e chirurgiche sono state eseguite in conformità con le linee guida del comitato etico locale e sono state approvate dalla Landesdirektion Sachsen, Germania.
Questo studio ha utilizzato axolotl bianchi (d/d) per tutti gli esperimenti, un ceppo mutante presente in natura privo di pigmentazione corporea (pochi o nessun melanoforo e xantofori), con iridofori solo nell'iride degli occhi. Questo studio ha utilizzato axolotl che misurano 8-15 cm dal muso alla coda (5-7 mesi) senza pregiudizi specifici per sesso.
1. Preparazione
- Preparare una soluzione madre di benzocaina al 10% (p/v) che verrà utilizzata per l'anestesia e l'eutanasia degli axolotl (vedi sotto). Per questo, mescolare in un flacone volumetrico 50 g di benzocaina con etanolo al 100% fino a raggiungere il limite di 500 ml.
- Preparare una soluzione madre di benzocaina allo 0,03% (p/v).
- Per 1 L, miscelare 50 mL di soluzione salina tamponata con Tris (TBS) 10x con 30 mL di benzocaina al 10% (p/v) e 5 mL di soluzioni Holtfreter al 4000% (p/v) con 915 mL di acqua distillata e mescolare per una notte con un'ancoretta magnetica.
- Per 1 L di soluzione 10x TBS, mescolare 24,2 g di base Trizma e 90 g di NaCl con 990 mL di acqua deionizzata. Mescolare bene con un'ancoretta magnetica. Quindi, aggiungere circa 10 ml di HCl concentrato (12 M o 37%) e regolare per pH 8.
- Per 1 L di soluzione di Holtfreter al 4000% (p/v), miscelare 158,4 g di NaCl, 11,13 g di MgSO4.7H 2O, 5.36 g di CaCl2.2H 2O e 2.88 g di KCl con acqua deionizzata fino a 1 L.
- Preparare una diluizione di benzocaina funzionante allo 0,01% (p/v) nell'acqua del serbatoio di contenimento per l'anestesia diluendo la soluzione madre allo 0,03% (p/v) 1:3.
- Per 1 L di soluzione, utilizzare 333 mL della soluzione madre di benzocaina più 666 mL di acqua del serbatoio di contenimento.
- Preparare una soluzione madre di tartrato di butorfanolo da 5 mg/mL per l'analgesia. Per questo, mescolare 100 mg di sale di butorfanolo (+)-tartrato con 20 ml di acqua ultrapura. Conservare le aliquote a 4 °C.
- Il giorno delle amputazioni, preparare di fresco 0,5 mg/L di soluzione di lavoro di butorfanolo tartrato per ridurre il dolore dell'animale dopo le procedure chirurgiche diluendo la soluzione madre 1:10.000 nell'acqua del serbatoio di contenimento.
- Per gli animali di lunghezza inferiore a 8 cm, miscelare 20 μL di soluzione madre in 200 mL di acqua del serbatoio di contenimento.
- Per gli animali più grandi, mescolare 60 μL di soluzione madre in 600 mL di acqua del serbatoio di contenimento.
- Preparare una soluzione salina sterile tamponata con fosfato di anfibio (APBS), una soluzione di PBS all'80% (v/v) e mantenerla a temperatura ambiente (RT) mescolando 800 mL di DPBS con 200 mL di acqua deionizzata.
- Preparare 1 mg/mL di soluzione madre di insulina. Per questo, mescolare 250 mg di insulina in polvere con 25 ml di HCl 0,1 M e agitare lentamente fino a quando non si scioglie. Durante l'agitazione, aggiungere 225 ml di APBS fino a quando la soluzione non è limpida. Filtrare in modo sterile e conservare aliquote da 4 mL a -20 °C.
- Preparare il terreno di coltura sterile (tutte le % (v/v): 62,5% terreno L15, 10% FBS inattivato termicamente, 1% penicillina/streptomicina, 1% insulina, 1% L-glutammina) e mantenere a 4 °C fino al giorno dell'uso. Il giorno dell'esperimento, equilibrare a RT prima dell'uso.
- Per 400 mL di terreno di coltura, utilizzare 250 mL di terreno L15, 40 mL di FBS inattivato termicamente, 4 mL di penicillina/streptomicina, 4 mL di soluzione di insulina (dal passaggio 1.7), 4 mL di L-glutammina e 98 mL di acqua sterile deionizzata. Preparare in condizioni sterili e con un filtro sterile dopo aver miscelato tutti i componenti. Preparare 15 mL di aliquote.
- Preparare l'agarosio al 2,5% e al 3% (p/v) a basso punto di fusione (lmp) in una soluzione APBS e riscaldare a 70 °C per sciogliere completamente l'agarosio. Preparare le aliquote in provette da 1,5 mL e conservare a 4 °C fino al giorno dell'uso.
- Per 20 mL di lmp-agarosio al 2,5% (p/v), mescolare 0,5 g di lmp-agarosio con 20 mL di APBS in una provetta da 50 mL e riscaldare a bagnomaria a 70 °C fino a quando l'agarosio non si è completamente sciolto. La soluzione deve diventare chiara e trasparente. Preparare le aliquote ancora calde.
- Per 20 mL di lmp-agarosio al 3% (p/v), mescolare 0,6 g di lmp-agarosio con 20 mL di APBS e procedere come sopra.
- (Opzionale): Per 20 mL di lmp-agarosio all'1% (p/v), mescolare 0,2 g di lmp-agarosio con 20 mL di APBS e procedere come sopra.
NOTA: Il tempo di fusione dipende dalla concentrazione dell'lmp-agarosio e può variare approssimativamente da 15 a 40 minuti.
- Per l'amputazione e il montaggio dei tessuti, utilizzare uno stereoscopio a campo chiaro.
- Assembla piastre di Petri in plastica da 100 mm di diametro, pinze, bisturi e forbici chirurgiche per amputazioni e raccolta di tessuti.
- Preparare piastre di Petri in plastica da 35 mm di diametro per le misurazioni dell'indentazione.
- Preparare cilindri lunghi ~1 cm di diametro di ~1 cm. Per questo, scaldare un tagliacartone sotto la fiamma di un bruciatore Bunsen e tagliare un tubo da 15 ml con la lama riscaldata.
- Tagliare piccoli quadrati di 1 cm2 di parafilm e conservare.
- Preparare un blocco metallico o freddo a -20 °C lasciandolo in freezer per almeno 1 h.
- Preparare le pipette di plastica Pasteur.
- (Facoltativo): Preparare la soluzione fissativa di MEMFa (acido 3-(N-morfinolino)propansulfonico [MOPS] 0,1 M pH 7,4, Glicole etilenico-bis (2-amminoetiletere)-N,N,N',N'-acido tetraacetico [EGTA] 2 mM, MgSO4·7H2O 1 mM, 3,7% formaldeide). Per questo, aggiungere 10,465 g di MOPS, 0,123 g di MgSO4·7H2O, 2 mL di 0,5 M EDTA pH 8,0 e aggiungere acqua fino a 45 mL. Aggiungere 5 mL di formaldeide al 37% (p/v) per un volume totale di 50 mL.
2. Reagenti
- Fare riferimento alla Tabella dei materiali per i reagenti utilizzati per questo lavoro, ma possono essere utilizzati anche altri fornitori commerciali.
3. Amputazione di axolotl e rigenerazione degli arti
- Prima di tutte le procedure sperimentali, anestetizzare l'animale in benzocaina allo 0,01% (p/v) diluita in acqua del serbatoio di contenimento (fase 1.3) per 20 minuti, assicurandosi che gli animali siano profondamente anestetizzati e non rispondano agli stimoli tattili.
- Rimuovere l'axolotl dall'anestesia e adagiarlo sopra una capsula di Petri da 100 mm contenente un fazzoletto di carta inumidito con acqua contenente anestesia. Orientare l'arto perpendicolarmente all'asse del corpo e posizionare la piastra sotto lo stereoscopio per una migliore visualizzazione.
NOTA: Qui è stato utilizzato uno stereoscopio con una lampada compatta a collo d'oca. - Amputare l'arto con un bisturi sterile affilato immediatamente distalmente all'area calcificata della regione zeugopodiale (radio/ulna) (Figura 1A).
NOTA: Aderendo al principio del benessere animale 3R, si raccomanda di utilizzare gli arti che sono stati inizialmente rimossi dall'amputazione come controlli intatti. - Lasciare l'animale sul piatto e coprirlo con una carta velina umidificata imbevuta di acqua contenente benzocaina per 15 minuti per consentire la coagulazione del sangue e la chiusura della ferita.
- Riportare gli animali in una vasca contenente acqua di contenimento fresca con analgesici (butorfanolo tartrato, 0,5 mg/L, dal passaggio 1.5).
- Spostare gli animali nella vasca originale contenente acqua fresca di contenimento 24 ore dopo il trattamento analgesico post-operatorio.
- Consentire agli animali di rigenerarsi fino allo stadio di interesse desiderato.
NOTA: Gli arti analizzati sono stati raccolti il giorno dell'amputazione per la fase intatta e 5 giorni dopo l'amputazione (dpa) per la fase di istolisi negli animali di 5 mesi. Lo stadio di condensazione della cartilagine è stato misurato a 21 dpa negli animali di 7 mesi.
4. Montaggio ed elaborazione dei tessuti per le misurazioni
- Riscaldare le provette da 1,5 mL contenenti il 2,5% o il 3% (p/v) di lmp-agarosio (dal passaggio 1.9) su un termoblocco a 70 °C fino a quando l'agarosio non si è completamente sciolto. Sostituire i tubi con un termoblocco diverso a 37 °C e lasciare che la temperatura si equilibri prima dell'uso.
NOTA: In questo caso, il 2,5% di lmp-agarosio è stato utilizzato per misurare i tessuti rigeneranti e il 3% per i tessuti intatti. - Coprire un lato dei cilindri lunghi 1 cm (dal passaggio 1.13) con uno dei pezzi di parafilm (passaggio 1.14) in modo che siano completamente sigillati sul fondo.
- Equilibrare 15 mL di aliquote di terreno di coltura a RT (dal passaggio 1.8)
- Anestetizzare gli animali immergendoli in acqua contenente anestetico (benzocaina allo 0,01% (p/v) diluita nell'acqua del serbatoio di contenimento) per almeno 20 minuti.
- Visualizzare gli arti sotto uno stereoscopio con un software che consente misurazioni quantitative. Misurare la lunghezza della struttura di interesse e calcolare la quantità di tessuto che deve essere rimossa dall'estremità distale dell'arto fino a raggiungere la sezione di interesse.
- Per rigenerare gli arti, raccoglierli tagliandoli con un bisturi e/o forbici chirurgiche all'altezza del gomito e sezionando il tessuto in eccesso dall'arto. Lasciare il fazzoletto nella soluzione APBS mentre si prepara il passaggio successivo. Assicurarsi che il taglio sia trasversale (90°) all'asse inferiore del braccio per creare una superficie uniforme. Per gli arti intatti, rimuovere la mano tagliando la regione carpale.
- Sopprimere gli animali esponendoli a una dose letale di anestesia (0,1% benzocaina) per almeno 20 minuti. Per questo, aggiungere il volume richiesto di soluzione di benzocaina al 10% (p/v) per raggiungere una concentrazione dello 0,1% (p/v).
- Se gli animali sono stati anestetizzati in 100 ml di soluzione di benzocaina allo 0,01% (p/v), aggiungere 900 μl della soluzione di benzocaina al 10% (p/v).
- Sciacquare gli arti immergendoli in una soluzione APBS.
- Assicurarsi che le pipette Pasteur e il blocco termico (stabilizzato a 37 °C con aliquote di agarosio) siano vicini alla stazione di lavoro. Estrarre il blocco freddo dal congelatore a -20 °C e posizionare sopra il cilindro con l'estremità ricoperta di parafilm rivolta verso il basso.
- Afferrare l'arto sezionato e rimuovere delicatamente il liquido in eccesso con carta velina. Posizionare l'arto su un piatto pulito, aggiungere sopra l'lmp-agarosio fuso e muovere brevemente l'arto nell'agarosio per spostare l'APBS rimanente dalla superficie della pelle.
- Lavorando velocemente, posizionare l'arto all'interno del cilindro, assicurandosi che sia orientato verticalmente, con l'area di interesse rivolta verso l'alto.
- Tenendo delicatamente l'arto con una pinza, aggiungere lmp-agarosio all'interno del cilindro fino a coprire completamente il tessuto. Rimuovere delicatamente la pinza prima che l'agarosio si solidifichi.
- Togliere il cilindro dal blocco freddo e lasciare solidificare completamente l'agarosio a RT per circa 30 s.
- Portare immediatamente il blocco di agarosio contenente tessuto nella sala del vibratomo, insieme alle aliquote del terreno di coltura sterile e all'APBS, a RT.
- Rimuovere il parafilm dal fondo del cilindro e attaccare l'agarosio contenente il tessuto al tavolino del vibratomo con colla cianoacrilica. Assicurarsi che sia l'agarosio che il campione siano incollati al tavolino.
- Immergere il tavolino in APBS per il sezionamento.
NOTA: I tessuti intatti includono l'osso/cartilagine più rigidi, mentre i tessuti rigeneranti sono più morbidi. Pertanto, i parametri del vibratomo devono essere regolati di conseguenza. Questo studio ha utilizzato i seguenti parametri: tessuti intatti (ampiezza 1,2 mm e velocità 0,1 mm/s) e tessuti rigeneranti (ampiezza 0,9 mm e velocità 0,4 mm/s). - Iniziare a sezionare l'agarosio in brevi passaggi (ad esempio, con incrementi di 100 μm) fino a raggiungere la punta del tessuto. Quindi, sezionare il blocco di tessuto fino a rimuovere la porzione distale di tessuto (calcolata al punto 4.5). In questo modo, una sezione trasversale dell'area di interesse sarà facilmente accessibile.
NOTA: La sezione di tessuto rimossa conterrà la superficie immediatamente adiacente a quella sondata con AFM e può servire come riferimento per la struttura del tessuto. Pertanto, può essere utilizzato per analisi complementari dirette o fissato per la successiva colorazione (vedere paragrafo 6). - Rimuovere con cautela il blocco contenente il tessuto dal tavolino del vibratomo con una lama di rasoio e rimuovere ogni traccia di colla. Incollare immediatamente il blocco su una piastra di Petri di plastica da 35 mm con colla adesiva per tessuti chirurgici e aggiungere circa 2 mL di terreno di coltura a RT per assicurarsi che il tessuto sia completamente coperto.
NOTA: La superficie del tessuto esposto nel blocco di agarosio è la superficie da sondare.
5. Misurazioni con AFM
- Almeno 1 giorno prima delle misurazioni, preparare il cantilever per le misurazioni.
NOTA: Per questo lavoro, i cantilever in silicio senza punta sono stati funzionalizzati con perle di polistirene (diametro 20 μm) e il legame a sbalzo è stato lasciato rafforzare per almeno 1 giorno prima di essere utilizzato per le misure di indentazione.- Fissare le perline ai cantilever utilizzando la colla epossidica con un tempo di lavorazione di 5 minuti.
- Abbassare rapidamente il cantilever con un contatto minimo su un vetrino rivestito di colla in modo che si formi una piccola goccia di colla all'estremità e portarlo subito dopo a contatto con un cordone adatto.
- Tenere premuto il contatto cantilever-tallone per ~10 minuti prima di sollevare il cantilever con un tallone legato dalla superficie.
- Calibrare il cantilever prima delle misurazioni.
NOTA: Il cantilever modificato è stato calibrato prima di ogni serie di esperimenti con il metodo del rumore termico utilizzando le procedure integrate del software AFM. - Inserire la piastra di Petri con il blocco di tessuto (dal passaggio 4.18) e il terreno di coltura nel supporto della piastra di Petri dell'AFM e acquisire un'immagine panoramica in microscopia a campo chiaro (Figura 1B).
NOTA: Per i test di indentazione, viene utilizzata una configurazione dotata di un tavolino motore sopra un microscopio ottico verticale. Montare la testa AFM e posizionare il cantilever sopra il tessuto e portare il cantilever in prossimità della superficie. - Scegli la regione specifica di interesse e registra una serie di curve forza-distanza (Figura 2A).
NOTA: Sono stati utilizzati setpoint di forza relativa di 2-25 nN per raggiungere profondità di indentazione comparabili di ~1-4 μm per tessuti di diversa rigidità, con una velocità di avvicinamento e retrazione di 7,5 μm/s, lunghezza z di 50 μm, dimensione della griglia 70 μm x 70 μm con 3 x 3 punti. - Per ogni regione sondata, acquisire un'immagine di microscopia in campo chiaro per associare i valori ottenuti a ciascuna particolare regione nella sezione dell'arto.
- Per tutti i campioni, sondare almeno 3 regioni diverse per tipo di tessuto.
NOTA: In tutti i casi, questo studio ha misurato 4 regioni al centro della cartilagine e 3 regioni alla periferia della regione della cartilagine e ha tenuto il tessuto al microscopio per un massimo di 1 ora. - Una volta terminate le misurazioni dell'indentazione, scartare o fissare il tessuto per ulteriori analisi.
NOTA: I campioni sono stati fissati dopo aver concluso le misurazioni ponendoli in provette da 2 mL contenenti soluzione di MEMFa e fissati per una notte a 4 °C. È stato utilizzato MEMFa (passaggio 1.17), ma può essere utilizzata anche la soluzione di formaldeide al 4% (p/v) in PBS.
6. (Facoltativo) Trattamento di sezioni di tessuto adiacenti
- Se le sezioni di tessuto adiacenti vengono utilizzate per la successiva colorazione, posizionarle immediatamente dopo il sezionamento in una piccola provetta da 2 ml contenente fissativo e fissare per una notte a 4 °C.
- Per rivelare l'architettura tissutale attraverso la marcatura del citoscheletro di actina e dei nuclei, lavare 3 volte con PBS per 5 minuti ciascuno per rimuovere il fissativo e colorare con una soluzione contenente falloidina coniugata Alexa Fluor 488 (1:250) e Hoechst 33258 (1:10000) in PBS per 1 ora a RT su una piattaforma a dondolo.
- Successivamente, immobilizzare i campioni colorati sopra piastre con fondo di vetro utilizzando lmp-agarosio all'1% (p/v) in APBS stabilizzato a 37 °C (dal passaggio 1.9). Assicurati che la superficie di interesse sia rivolta verso il vetro. Una volta che l'agarosio si solidifica, coprire i campioni con PBS per prevenire la disidratazione.
NOTA: I campioni intatti e quelli di istolisi vengono sottoposti a imaging con un microscopio confocale invertito (ingrandimento 10x e sezioni ottiche da 8 μm). Le immagini nella Figura 1C sono proiezioni massime di 8 sezioni ottiche.
- Se la sezione di tessuto adiacente viene utilizzata per l'analisi immediata a valle che richiede tessuto fresco (come l'estrazione dell'RNA, l'incubazione con coloranti vivi, ecc.), assicurarsi di lavorare rapidamente e di utilizzare un terreno di coltura cellulare (dal passaggio 1.8) per garantire la massima integrità tissutale possibile.
7. Analisi e visualizzazione dei dati
- Per calcolare il modulo di Young apparente, analizzare le curve forza-distanza utilizzando il modello Hertz/Sneddon (Eq.1) per un penetratore sferico utilizzando il software di elaborazione dati JPK/Bruker, assumendo un rapporto di Poisson di 0,5.
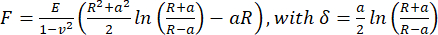 (Eq.1)
(Eq.1)
Dove R: raggio del penetratore, E: modulo elastico, ν: rapporto di Poisson, a: raggio dell'area di contatto circolare tra il penetratore e il campione, δ: profondità di indentazione. - Per l'analisi viscoelastica, analizzare le parti di avvicinamento delle curve forza-indentazione in PyJibe 0.15.0 con l'estensione "Hertz model corrected for viscoelasticity using Kelvin-Voigt-Maxwell (KVM)" (scritto da Paul Müller, https://github.com/AFM-analysis/PyJibe)25. La funzione di adattamento si basa su un modello descritto da Abuhattum et al.26, che integra elementi del modello di Kelvin-Voigt-Maxwell.
- Pre-elaborare le curve di indentazione della forza per stimare il punto di contatto utilizzando un adattamento a tratti con una linea (linea di base) e una funzione di adattamento polinomiale per la parte di avvicinamento.
- Adattare le curve forza-indentazione al "modello di Hertz corretto per la viscoelasticità utilizzando il modello Kelvin-Voigt-Maxwell (KVM)". Dall'adattamento, ottenere il modulo di Young non rilassato, il modulo di Young apparente e la viscosità apparente. Il modello fornisce anche a Maxwell tempi di rilassamento e indentazione.
NOTA: In diverse curve di indentazione della forza analizzate (in particolare il tessuto intatto), i tempi di rilassamento di Maxwell erano significativamente maggiori o inferiori al tempo di indentazione, il che indica un comportamento piuttosto elastico o un comportamento meccanico di Kelvin-Voigt, rispettivamente.
- Esporta tutte le misurazioni in un foglio di calcolo e calcola i moduli di Young apparenti mediani per tipo di tessuto e campione.
- Tracciare e analizzare statisticamente i dati con un software appropriato.
NOTA: In questo caso viene utilizzato GraphPad Prism e, nella descrizione dei risultati, lo studio si riferisce alla media ± SD dei moduli di Young apparenti mediani per campione (visualizzati nella Figura 2D-F). - Visualizza le sezioni ottiche dalle immagini confocali proiettandole con la funzione di proiezione massima delle Fiji. Regola la luminosità e il contrasto di ogni singolo canale per una visualizzazione ottimale delle colorazioni fluorescenti.
- Genera un pannello di figure con il software appropriato.
NOTA: Affinity Designer viene utilizzato per generare i pannelli e il modello nella Figura 1A viene disegnato utilizzando Affinity Designer.
Risultati
Utilizzando il protocollo sopra descritto, abbiamo misurato il modulo di Young apparente dei tessuti degli arti axolotl cartilaginei in condizioni omeostatiche ("intatte"), durante l'istolisi precoce della cartilagine e le successive fasi di condensazione della cartilagine (Figura 1A). Abbiamo anche sondato le proprietà meccaniche degli elementi scheletrici in diverse regioni, tra cui il loro centro e la loro periferia, come mostrato nelle immagini che raff...
Discussione
Qui, dimostriamo una tecnica per la misurazione della rigidità della cartilagine negli arti axolotl con AFM. Tuttavia, questo metodo può essere ampliato anche per sondare altri tipi di tessuto. Un passaggio chiave per il successo delle misure AFM è la preparazione del campione, che si è rivelata particolarmente impegnativa con i campioni di axolotl. Abbiamo scoperto che sondare la superficie del tessuto che era ancora incorporato nel blocco di agarosio era il modo migliore per preser...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse
Riconoscimenti
Ringraziamo tutti i membri del laboratorio Sandoval-Guzmán per il continuo supporto e la compagnia durante lo sviluppo di questo lavoro. Siamo anche grati ad Anja Wagner, Beate Gruhl e Judith Konantz per la loro dedizione alla cura dell'axolotl. Ringraziamo anche Paul Müller per aver fornito i codici per l'analisi dei dati AFM. Questo lavoro è stato supportato dalla Light Microscopy Facility della CMCB Technology Platform presso l'Università Tecnica di Dresda. AT è membro del Mildred Scheel Early Career Center Dresden P2 finanziato dal German Cancer Aid (Deutsche Krebshilfe). RA è finanziata da una posizione di PI temporaneo (Eigene Stelle) della Deutsche Forschungsgemeinschaft (DFG, Fondazione tedesca per la ricerca) – AI 214/1-1.
Materiali
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Riferimenti
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon