A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוסקופ כוח אטומי מדידות סחוס בגפיים אקסולוטליות שלמות ומתחדשות;
* These authors contributed equally
In This Article
Summary
בפרוטוקול זה אנו מראים כיצד להכין רקמת אקסולוטל למיקרוסקופ כוח אטומי (AFM) ולבצע מדידות הזחה בסחוס גפיים שלם ומתחדש.
Abstract
כוחות מכניים מספקים אותות חשובים לתפקוד תקין של תאים וליצירת תבניות ברקמות מתפתחות, ותפקידם נחקר רבות במהלך אמבריוגנזה ופתוגנזה. באופן יחסי, מעט מאוד ידוע על אותות אלה במהלך התחדשות בעלי חיים.
האקסולוטל הוא אורגניזם מודל חשוב לחקר התחדשות, בהתחשב ביכולתו לשחזר באופן מלא איברים ורקמות רבים לאחר פציעה, כולל סחוס ועצם חסרים. בשל תפקידה המכריע כרקמה התומכת העיקרית בגוף החולייתנים, החזרת תפקוד השלד במהלך ההתחדשות דורשת הן את שיקום המבנים החסרים והן את תכונותיהם המכניות. פרוטוקול זה מתאר שיטה לעיבוד דגימות גפיים אקסולוטליות עבור מיקרוסקופ כוח אטומי (AFM), שהוא תקן הזהב לבדיקת תכונות מכניות של תאים ורקמות ברזולוציה מרחבית גבוהה.
תוך ניצול יכולות ההתחדשות של האקסולוטל, מחקר זה מדד את נוקשות סחוס הגפיים במהלך הומאוסטזיס ושני שלבים של התחדשות גפיים: היסטוליזה של רקמות ועיבוי סחוס. אנו מראים כי AFM הוא כלי רב ערך להשגת תובנות לגבי ארגון מחדש דינמי של רקמות והשינויים המכניים המתרחשים במהלך רגנרציה.
Introduction
השלד, בעיקר הסחוס והעצמות, מספק את התמיכה המכנית העיקרית לרקמות הרכות של הגוף אצל בעלי חוליות. לכן, כל נזק במערכת השלד עלול לפגוע מאוד בתפקוד ואף בהישרדות. אצל בני אדם, שברים בעצמות הם אחת הפציעות הטראומטיות הנפוצות ביותר1, שרובן משתקמות תוך שבועות ספורים, אך 5%-10% מהן יסבלו מעיכובים בהחלמה או לעולם לא יתאוששו לחלוטין 2,3. יתר על כן, בני אדם אינם מסוגלים להתאושש מאובדן עצם או סחוס נרחב 4,5. עם זאת, חלק מהסלמנדרות יכולות לחדש מגוון מבני גוף, כולל גפיים מלאות6, מה שהופך אותן למודל אידיאלי לחקר התחדשות השלד.
אקסולוטל (שם מדעי: Ambystoma mexicanum) הוא סוג של סלמנדרה שבה התחדשות הגפיים נחקרה בהרחבה. תהליך זה מתרחש בארבעה שלבים עיקריים עוקבים אך חופפים: 1) ריפוי פצעים, 2) דלקת/היסטוליזה, 3) היווצרות בלסטמה, ו-4) צמיחת/התמיינות בלסטמה (נסקרב-7,8). לאחר הקטיעה, קרטינוציטים הגובלים באתר הפציעה נודדים במהירות, סוגרים את הפצע ויוצרים את אפיתל הפצע (WE). במהלך הדלקת וההיסטוליזה שלאחר מכן, פתוגנים מסולקים, פסולת ותאים פגומים מנוקים, והמטריצה החוץ תאית (ECM) מתחת לפני השטח לקטיעה משופצת9. היסטוליזה של רקמות חיונית להתחדשות הגפיים כדי להתרחש10, כאשר הפרשת אנזימים מפרקי חלבון חיונית לא רק לעיצוב מחדש של ECM כולל, אלא גם לשחרור התאים היוצרים את הבלסטמה ולמולקולות ביו-אקטיביות חופשיות הכלואות ב-ECM עצמו8. למעשה, מחקרים בהקשרים רגנרטיביים רבים ואורגניזמים מודל הראו כי התכונות החומריות הייחודיות של ECM במהלך היסטוליזה מסוגלות לגרום לתהליכי התמיינות או לכוון את נדידת התאים לעבר אתר הפציעה (נסקר ב-11). יתר על כן, ספיגה מחדש של רקמה מסוידת בשלבים המאוחרים של היסטוליזה הוכחה כמפתח לאינטגרציה נכונה של אלמנטים חדשים של שלד הגפיים שנוצרו12. לאחר שלב ההיסטוליזה, הבלסטמה נוצרת מתחת לאפיתל הפצע (WE) כהצטברות של אבות לא ממוינים, מרובי שושלות כתוצאה מתאי רקמה בוגרים שאינם ממוינים או תאי גזע תושבים. תאי בלסטמה מתרבים ומתמיינים לכל סוגי התאים החסרים. לבסוף, מורפוגנזה של הגפיים מתרחשת, שבה רקמת השלד מתחדשת באמצעות עיבוי של chondroprogenitors נגזר תאים periskeletal ו fibroblasts עורי transdifferentiated 13,14,15.
למרות שרבים מהרמזים הביוכימיים המווסתים שינויים בזהות התא ובהרכב ECM זוהו 10,13,14,16,17,18, התכונות המכניות של רקמות במהלך השלבים השונים של התחדשות הגפיים, כמו גם השפעתן על התחדשות, נותרו במידה רבה בלתי נחקרות. מחקרים רבים הראו כי תאים חשים ומשלבים רמזים מכניים המווסתים את גורלם והתנהגותם במספר הקשרים (נסקרוב-19,20). לכן, השלמת הידע התאי והמולקולרי שלנו על התחדשות גפיים עם מדידות מכניות של רקמות תשפר מאוד את הבנתנו את התהליכים הללו.
פותחו טכניקות שונות המאפשרות אפיון מכני ומניפולציה בכוח של דגימות ביולוגיות21. בין טכניקות אלה, מיקרוסקופ כוח אטומי (AFM) הפך לתקן הזהב במכנוביולוגיה, שבו התכונות הוויסקו-אלסטיות של דגימות ביולוגיות נבדקות ברזולוציה מרחבית גבוהה על ידי הזחה עם חיישן כוח רגיש במיוחד, AFM cantilever22. מאז טכניקה זו דורשת מגע ישיר עם הדגימה, בדרך כלל, פרוסות רקמה נוצרים, אשר יכול להיות מאתגר במקרים מסוימים. לכן, תנאי ההכנה צריכים להיות מותאמים ומותאמים לכל דגימה מסוימת, כך שהיא יכולה להישאר קרובה ככל האפשר לתנאים פיזיולוגיים וממצאים מינימליים נוצרים23. פרוטוקול זה מתאר כיצד למדוד קשיחות רקמות בגפיים אקסולוטליות באמצעות AFM, תוך התמקדות ברקמות סחוס בתנאים שלמים, בזמן שהן עוברות היסטוליזה, ובשלבי עיבוי סחוס (איור 1 ואיור 2). שיטה זו עשויה להיות מורחבת גם למדידה של סוגי רקמות אחרים.
Access restricted. Please log in or start a trial to view this content.
Protocol
אקסולוטלים (Ambystoma mexicanum) גודלו במתקן אקסולוטל של המרכז לטיפולים רגנרטיביים דרזדן (CRTD) של האוניברסיטה הטכנולוגית של דרזדן (TUD). תיאור מלא של תנאי הגידול ניתן למצוא ב24. בקצרה, החדרים נשמרו ב 20 - 22 ° C עם מחזור יום / לילה 12/12 שעות. כל הטיפול והניתוחים בוצעו בהתאם להנחיות ועדת האתיקה המקומית ואושרו על ידי Landesdirektion Sachsen, גרמניה.
מחקר זה השתמש באקסולוטלים לבנים (d/d) לכל הניסויים, זן מוטנטי טבעי חסר פיגמנטציה של הגוף (מעט מאוד מלנופורים וקסנטופורים), עם אירידופורים רק בקשתית העיניים. במחקר זה נעשה שימוש באקסולוטלים בגודל 8-15 ס"מ מהחוטם ועד הזנב (בני 5-7 חודשים) ללא הטיה ספציפית למין.
1. הכנה
- הכינו תמיסת מלאי בנזוקאין 10% (w/v) שתשמש להרדמה והמתת חסד של האקסולוטים (ראו להלן). לשם כך, מערבבים בבקבוק נפח 50 גרם של בנזוקאין עם 100% אתנול עד לגבול 500 מ"ל הושג.
- הכינו תמיסת מלאי בנזוקאין 0.03% (w/v).
- עבור 1 ליטר, יש לערבב 50 מ"ל של 10x Tris-buffered salt (TBS) עם 30 מ"ל של 10% (w/v) בנזוקאין ו-5 מ"ל של 4000% (w/v) התמיסות של Holtfreter עם 915 מ"ל מים מזוקקים ולערבב במשך הלילה עם מוט ערבוב מגנטי.
- לקבלת ליטר אחד של תמיסת 10x TBS, ערבבו 24.2 גרם בסיס Trizma ו-90 גרם NaCl עם 990 מ"ל מים שעברו דה-יוניזציה. מערבבים היטב עם מוט ערבוב מגנטי. לאחר מכן, הוסף כ -10 מ"ל של HCl מרוכז (12 M או 37%) והתאם עבור pH 8.
- עבור 1 ליטר של 4000% (w/v) הפתרון של Holtfreter, לערבב 158.4 גרם של NaCl, 11.13 גרם של MgSO4·7H2O, 5.36 גרם של CaCl2·2H2O ו 2.88 גרם של KCl עם מים deionized עד 1 L.
- הכינו דילול בנזוקאין עובד של 0.01% (w/v) בהחזקת מי מיכל להרדמה על ידי דילול תמיסת המלאי 1:3 של 0.03% (w/v).
- עבור 1 ליטר של תמיסה, השתמש 333 מ"ל של תמיסת מלאי בנזוקאין בתוספת 666 מ"ל של מי מיכל החזקה.
- הכן 5 מ"ג / מ"ל butorphanol טרטרט פתרון מלאי עבור שיכוך כאבים. לשם כך, מערבבים 100 מ"ג של מלח butorphanol (+)-טרטרט עם 20 מ"ל של מים טהורים במיוחד. יש לאחסן aliquots ב 4 °C.
- ביום הקטיעות, להכין טרי 0.5 מ"ג / ליטר butorphanol טרטרט פתרון עבודה כדי להפחית את כאבי בעלי חיים לאחר הליכים כירורגיים על ידי דילול תמיסת מלאי 1:10.000 במיכל החזקה.
- עבור בעלי חיים שאורכם קטן מ-8 ס"מ, יש לערבב 20 מיקרוליטר של תמיסת מלאי במיכל החזקה של 200 מ"ל.
- עבור בעלי חיים גדולים יותר, ערבבו 60 מיקרוליטר של תמיסת מלאי במיכל החזקה של 600 מ"ל.
- הכינו תמיסת מלח סטרילית חוצצת פוספט (APBS), תמיסת PBS של 80% (v/v), ושמרו אותה בטמפרטורת החדר (RT) על ידי ערבוב של 800 מ"ל של DPBS עם 200 מ"ל של מים שעברו דה-יוניזציה.
- הכינו תמיסת מלאי אינסולין 1 מ"ג/מ"ל. לשם כך, מערבבים 250 מ"ג אבקת אינסולין עם 25 מ"ל HCl 0.1 M ומתסיסים לאט עד להמסה. תוך כדי התססה, להוסיף 225 מ"ל של APBS עד הפתרון ברור. מסנן סטרילי, ולאחסן 4 מ"ל aliquots ב -20 ° C.
- יש להכין מדיום תרבית סטרילית (כל % (v/v): 62.5% L15 בינוני, 10% FBS מומת חום, 1% פניצילין/סטרפטומיצין, 1% אינסולין, 1% L-גלוטמין) ולשמור על טמפרטורה של 4°C עד ליום השימוש. ביום הניסוי, יש לאזן ל-RT לפני השימוש.
- עבור 400 מ"ל של מדיום תרבית, השתמש 250 מ"ל של L15 בינוני, 40 מ"ל של FBS מומת חום, 4 מ"ל של פניצילין/סטרפטומיצין, 4 מ"ל של תמיסת אינסולין (משלב 1.7), 4 מ"ל של L-גלוטמין, ו 98 מ"ל של מים סטריליים deionized. מכינים בתנאים סטריליים ומסנן סטרילי לאחר ערבוב כל הרכיבים. הכינו 15 מ"ל aliquots.
- הכינו נקודת התכה נמוכה (lmp) של 2.5% ו-3% (w/v) - אגרוז בתמיסת APBS וחממו בטמפרטורה של 70°C כדי להמיס את האגרוז לחלוטין. הכינו aliquots בצינורות 1.5 מ"ל ולאחסן ב 4 °C עד יום השימוש.
- עבור 20 מ"ל של 2.5% (w/v) lmp-agarose, לערבב 0.5 גרם של lmp-agarose עם 20 מ"ל של APBS בצינור 50 מ"ל לחמם באמבט מים ב 70 ° C עד agarose נמס לחלוטין. הפתרון צריך להיות ברור ושקוף. הכינו אליציטוטים בעודם חמים.
- עבור 20 מ"ל של 3% (w/v) lmp-agarose, לערבב 0.6 גרם של lmp-agarose עם 20 מ"ל של APBS ולהמשיך כאמור לעיל.
- (אופציונלי): עבור 20 מ"ל של 1% (w/v) lmp-agarose, לערבב 0.2 גרם של lmp-agarose עם 20 מ"ל של APBS ולהמשיך כמפורט לעיל.
הערה: זמן ההתכה תלוי בריכוז הלמ"פ-אגרוז ועשוי לנוע בין 15-40 דקות בקירוב.
- עבור קטיעה והרכבה של רקמות, השתמש בסטריאוסקופ brightfield.
- הרכיבו צלחות פטרי מפלסטיק בקוטר 100 מ"מ, מלקחיים, אזמל ומספריים כירורגיים לקטיעה ואיסוף רקמות.
- הכינו צלחות פטרי מפלסטיק בקוטר 35 מ"מ למדידות הזחה.
- הכינו צילינדרים באורך ~1 ס"מ בקוטר ~1 ס"מ. לשם כך, מחממים חותך קרטון תחת להבת מבער Bunsen וחותכים צינור 15 מ"ל עם הלהב המחומם.
- חותכים קטן 1 ס"מ2 ריבועים של parafilm וחנות.
- הכינו גוש מתכתי או קר בטמפרטורה של -20°C על ידי השארתו במקפיא למשך שעה אחת לפחות.
- מכינים פיפטות פסטר מפלסטיק.
- (אופציונלי): הכינו תמיסת MEMFa מקובעת (3-(N-מורפולינו)חומצה פרופאנסולפונית [MOPS] 0.1 M pH 7.4, אתילן גליקול-ביס (2-אמינואתילתר)-N,N,N′,N′-חומצה טטראצטית [EGTA] 2 mM, MgSO4·7H2O 1 mM, 3.7% פורמלדהיד). לשם כך, להוסיף 10.465 גרם של MOPS, 0.123 גרם של MgSO4·7H2O, 2 מ"ל של 0.5 M EDTA pH 8.0, ולהוסיף מים עד 45 מ"ל. הוסף 5 מ"ל פורמלדהיד 37% (w/v) לנפח כולל של 50 מ"ל.
2. ריאגנטים
- עיין בטבלת החומרים עבור הריאגנטים המשמשים לעבודה זו, אך ניתן להשתמש גם בספקים מסחריים אחרים.
3. קטיעת אקסולוטל והתחדשות גפיים
- לפני כל הליכי הניסוי, יש להרדים את בעל החיים ב-0.01% (w/v) בנזוקאין מדולל במי מיכל החזקה (שלב 1.3) למשך 20 דקות, ולוודא שבעלי החיים מורדמים עמוקות ואינם מגיבים לגירויי מישוש.
- הוציאו את האקסולוטל מההרדמה והניחו אותו על גבי צלחת פטרי בקוטר 100 מ"מ המכילה טישו מנייר טבול במים המכילים הרדמה. כיוון את האיבר בניצב לציר הגוף ומקם את הצלחת מתחת לסטריאוסקופ להדמיה טובה יותר.
הערה: סטריאוסקופ עם מנורת צוואר אווז קומפקטית שימש כאן. - כרתו את הגפה בעזרת אזמל סטרילי חד שמיד דיסטלי לאזור המסויד של אזור הזאוגופודיאלי (רדיוס/אולנה) (איור 1A).
הערה: בהתאם לעקרון רווחת בעלי החיים 3R, מומלץ להשתמש בגפיים שהוסרו בתחילה על ידי הקטיעה כבקרות שלמות. - השאירו את בעל החיים על הצלחת וכסו אותו בנייר טישו לח ספוג במים המכילים בנזוקאין למשך 15 דקות כדי לאפשר קרישת דם וסגירת פצעים להתרחש.
- יש להחזיר בעלי חיים למיכל המכיל מים מתוקים עם משככי כאבים (טרטרט בוטורפנול, 0.5 מ"ג/ליטר, משלב 1.5).
- העבירו את בעלי החיים למיכל המקורי שלהם המכיל מים טריים 24 שעות לאחר טיפול משככי כאבים לאחר הניתוח.
- אפשרו לבעלי חיים להתחדש עד לשלב העניין הרצוי.
הערה: הגפיים שנותחו נאספו ביום הקטיעה לשלב השלם ו-5 ימים לאחר הקטיעה (dpa) לשלב ההיסטוליזה בבעלי חיים בני 5 חודשים. שלב עיבוי הסחוס נמדד ב 21 dpa בבעלי חיים בני 7 חודשים.
4. הרכבה ועיבוד רקמות למדידות
- חממו את צינורות ה-1.5 מ"ל המכילים 2.5% או 3% (w/v) lmp-agarose (משלב 1.9) על תרמובלוק בטמפרטורה של 70°C עד שהאגרוז נמס במלואו. החליפו את הצינורות לתרמובלוק אחר ב-37°C ואפשרו לטמפרטורה להתאזן לפני השימוש.
הערה: כאן, 2.5% lmp-agarose שימש למדידת רקמות התחדשות ו -3% עבור רקמות שלמות. - כסו צד אחד של הגלילים באורך 1 ס"מ (משלב 1.13) באחד מחלקי הפרפילם (שלב 1.14) כך שיהיו אטומים לחלוטין בתחתיתם.
- שיווי משקל של 15 מ"ל aliquots של מדיום תרבות ל- RT (משלב 1.8)
- הרדימו את בעלי החיים על ידי טבילתם במים המכילים הרדמה (0.01% (w/v) בנזוקאין מדולל במי מיכל החזקה) למשך 20 דקות לפחות.
- דמיינו את הגפיים תחת סטריאוסקופ עם תוכנה המאפשרת מדידות כמותיות. למדוד את אורך מבנה הריבית ולחשב כמה רקמה צריך להסיר מהקצה הדיסטלי של האיבר עד שמגיעים לחלק הריבית.
- לחידוש הגפיים, אספו אותם על ידי חיתוך עם אזמל ו / או מספריים כירורגיים בגובה המרפק וניתוח רקמה עודפת מתוך הגפה. השאר את הרקמה בתמיסת APBS בעת הכנת השלב הבא. ודא שהחיתוך רוחבי (90°) לציר הזרוע התחתון כדי ליצור משטח אחיד. עבור הגפיים השלמות, להסיר את היד על ידי חיתוך דרך האזור הקרפלי.
- הרדימו את בעלי החיים על ידי חשיפתם למנה קטלנית של הרדמה (0.1% בנזוקאין) למשך 20 דקות לפחות. לשם כך, הוסף את הנפח הנדרש של תמיסת בנזוקאין 10% (w/v) כדי להגיע לריכוז של 0.1% (w/v).
- אם בעלי חיים הורדמו ב-100 מ"ל של 0.01% (w/v) תמיסת בנזוקאין, יש להוסיף 900 μL של תמיסת הבנזוקאין 10% (w/v).
- יש לשטוף גפיים על ידי טבילתן בתמיסת APBS.
- ודא כי פיפטות פסטר ואת thermoblock (מיוצב ב 37 ° C עם aliquots agarose) קרובים לתחנת העבודה. הוציאו את הבלוק הקר מהמקפיא בטמפרטורה של -20°C והניחו עליו את הגליל כשהקצה מכוסה הפרפילם פונה כלפי מטה.
- תפוס את האיבר המנותח והסר בעדינות את עודפי הנוזל עם נייר טישו. הניחו את האיבר על צלחת נקייה, הוסיפו את האגרוז המומס מלמעלה, והזיזו לזמן קצר את האיבר באגרוז כדי לעקור את כל הנגמ"שים שנותרו מפני העור.
- עבודה מהירה, הניחו את האיבר בתוך הצילינדר, וודאו שהוא מכוון אנכית, כאשר אזור העניין פונה כלפי מעלה.
- תוך כדי אחיזה עדינה של האיבר במלקחיים, מוסיפים למפג-אגרוז בתוך הגליל עד שהרקמה מכוסה במלואה. מסירים בעדינות את המלקחיים לפני שהאגרוז מתמצק.
- מוציאים את הצילינדר מהבלוק הקר ונותנים לאגרוז להתמצק לחלוטין ב-RT למשך כ-30 שניות.
- קח את בלוק האגרוז המכיל רקמות מיד לחדר הוויברטום, יחד עם אליציטוטים בינוניים של תרבית סטרילית ו- APBS, ב- RT.
- מוציאים את הפרפילם מתחתית הגליל ומחברים את האגרוז המכיל את הרקמה לשלב הוויברטומה בעזרת דבק ציאנואקרילט. ודא כי הן agarose ומדגם מודבקים על הבמה.
- השקיעו את הבמה ב-APBS לצורך חלוקת חלקים.
הערה: רקמות שלמות כוללות את העצם/סחוס הנוקשים יותר, בעוד שרקמות מתחדשות רכות יותר. לכן, יש להתאים את פרמטרי הוויברטומה בהתאם. מחקר זה השתמש בפרמטרים הבאים: רקמות שלמות (משרעת 1.2 מ"מ ומהירות 0.1 מ"מ לשנייה) ורקמות מתחדשות (משרעת 0.9 מ"מ ומהירות 0.4 מ"מ לשנייה). - התחילו לחתוך את האגרוז בצעדים קצרים (למשל, בצעדים של 100 מיקרומטר) עד שמגיעים לקצה הרקמה. לאחר מכן, חתך את בלוק הרקמה עד להסרת החלק הדיסטלי של הרקמה (המחושב בשלב 4.5). בדרך זו, חתך רוחבי של תחום העניין יהיה נגיש.
הערה: מקטע הרקמה שהוסר יכיל את המשטח הסמוך לזה שנבדק עם AFM ויכול לשמש כנקודת התייחסות למבנה הרקמה. לכן, הוא יכול לשמש לניתוח משלים ישיר או קבוע עבור צביעה לאחר מכן (ראה סעיף 6). - בזהירות להסיר את הבלוק המכיל רקמות משלב vibratome עם סכין גילוח ולהסיר את כל עקבות הדבק. הדביקו מיד את הבלוק על צלחת פטרי פלסטיק 35 מ"מ עם דבק דבק רקמות כירורגי והוסיפו כ -2 מ"ל של מדיום תרבית ב- RT כדי להבטיח שהרקמה מכוסה במלואה.
הערה: משטח הרקמה החשוף בגוש האגרוז הוא המשטח שיש לחקור.
5. מדידות עם AFM
- לפחות יום אחד לפני המדידות, הכינו את המזנון למדידות.
הערה: עבור עבודה זו, מיכלי סיליקון ללא קצה היו פונקציונליים עם חרוזי פוליסטירן (קוטר 20 מיקרומטר), ואת הקשר חרוז חרוז נשאר לחזק לפחות 1 יום לפני ששימש למדידות הזחה.- מצמידים חרוזים למכלים באמצעות דבק אפוקסי עם זמן עיבוד של 5 דקות.
- הורידו במהירות את המזנון במגע מינימלי על מגלשת זכוכית מצופה דבק כך שתיווצר טיפת דבק קטנה בקצהו, והביאו אותו מיד לאחר מכן למגע עם חרוז מתאים.
- החזיקו את מגע החרוז במשך ~10 דקות לפני שאתם מרימים את הקנטיליבר עם חרוז קשור מעל פני השטח.
- כייל את המזנון לפני המדידות.
הערה: המזנון שהשתנה כויל לפני כל סדרת ניסויים בשיטת הרעש התרמי תוך שימוש בפרוצדורות מובנות של תוכנת AFM. - הכניסו את צלחת הפטרי עם בלוק הרקמה (משלב 4.18) ומדיום התרבית למחזיק צלחת הפטרי של AFM וקבלו תמונת סקירה במיקרוסקופ שדה בהיר (איור 1B).
הערה: לבדיקות הזחה, נעשה שימוש במערך המצויד בבמת מנוע על גבי מיקרוסקופ אור זקוף. הרכיבו את ראש ה-AFM ומקמו את הקנטיליבר מעל הרקמה והביאו את הקנטיליבר קרוב לפני השטח. - בחרו את אזור העניין הספציפי ותיעדו מערך של עקומות מרחק כוח (איור 2A).
הערה: נקודות כוח יחסיות של 2-25 nN שימשו כדי להגיע לעומקי כניסה דומים של ~1-4 מיקרומטר עבור רקמות בעלות קשיחות שונה, עם מהירות גישה ונסיגה של 7.5 מיקרומטר לשנייה, אורך z של 50 מיקרומטר, גודל רשת 70 מיקרומטר x 70 מיקרומטר עם 3 x 3 נקודות. - עבור כל אזור שנבדק, רכשו תמונה במיקרוסקופ שדה בהיר כדי לשייך את הערכים המתקבלים לכל אזור מסוים באזור הגפיים.
- עבור כל הדגימות, בדוק לפחות 3 אזורים שונים לכל סוג רקמה.
הערה: בכל המקרים, מחקר זה מדד 4 אזורים במרכז הסחוס ו -3 אזורים בשולי אזור הסחוס ושמר את הרקמה מתחת למיקרוסקופ למשך שעה לכל היותר. - לאחר סיום מדידות ההזחה, השליכו או תקנו את הרקמה לניתוח נוסף.
הערה: הדגימות תוקנו לאחר סיום המדידות על ידי הצבתן בצינורות 2 מ"ל המכילים תמיסת MEMFa ותוקנו במשך הלילה ב -4 מעלות צלזיוס. נעשה שימוש ב- MEMFa (שלב 1.17), אך ניתן להשתמש גם בתמיסת פורמלדהיד 4% (w/v) ב- PBS.
6. עיבוד (אופציונלי) של מקטעי רקמות סמוכים
- אם חלקי הרקמה הסמוכים משמשים לצביעה הבאה, הניחו אותם מיד לאחר החתך בצינור קטן של 2 מ"ל המכיל קיבוע וקבעו לילה ב -4 מעלות צלזיוס.
- כדי לחשוף את ארכיטקטורת הרקמה באמצעות תיוג של אקטין ציטו-שלד וגרעינים, שטפו 3 פעמים עם PBS במשך 5 דקות כל אחת כדי להסיר את הקיבוע והכתם בתמיסה המכילה פלואידין מצומד Alexa Fluor 488 (1:250) ו-Hoechst 33258 (1:10000) ב-PBS למשך שעה אחת ב-RT על משטח נדנדה.
- לאחר מכן, יש לשתק את הדגימות המוכתמות על גבי כלים בעלי תחתית זכוכית באמצעות 1% (w/v) lmp-agarose ב-APBS המיוצב ב-37°C (משלב 1.9). ודא כי פני השטח של עניין פונה אל הזכוכית. לאחר שהאגרוז מתמצק, כסו את הדגימות ב-PBS כדי למנוע התייבשות.
הערה: הדגימות השלמות וההיסטוליזה מצולמות במיקרוסקופ קונפוקלי הפוך (הגדלה של פי 10 וחתכים אופטיים של 8 מיקרומטר). תמונות באיור 1C הן הקרנות מקסימליות של 8 מקטעים אופטיים.
- אם מקטע הרקמה הסמוך משמש לניתוח מיידי במורד הזרם הדורש רקמה טרייה (כמו מיצוי RNA, דגירה עם צבעים חיים וכו '), הקפד לעבוד במהירות ולהשתמש בתווך תרבית תאים (משלב 1.8) כדי להבטיח את שלמות הרקמה הגבוהה ביותר האפשרית.
7. ניתוח והצגת נתונים
- כדי לחשב את המודולוס של יאנג לכאורה, נתח את עקומות מרחק הכוח באמצעות מודל הרץ/סנדון (Eq.1) עבור אינדנטר כדורי באמצעות תוכנת עיבוד הנתונים JPK/Bruker, בהנחה שיחס פואסון הוא 0.5.
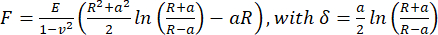 (Eq.1)
(Eq.1)
כאשר R: רדיוס indenter, E: מודולוס אלסטי, ν: יחס פואסון, a: רדיוס אזור המגע המעגלי בין הנכנס לדגימה, δ: עומק הזחה. - לניתוח ויסקו-אלסטי, נתח את חלקי הגישה של עקומות כניסת הכוח ב- PyJibe 0.15.0 עם הסיומת "מודל הרץ מתוקן עבור צמיגות באמצעות Kelvin-Voigt-Maxwell (KVM)" (נכתב על ידי פול מולר, https://github.com/AFM-analysis/PyJibe)25. פונקציית ההתאמה מבוססת על מודל שתואר על ידי Abuhattum et al.26, המשלב אלמנטים של מודל Kelvin-Voigt-Maxwell.
- עבד מראש את עקומות כניסת הכוח כדי להעריך את נקודת המגע באמצעות התאמה חתיכתית עם קו (קו בסיס) ופונקציית התאמה פולינומית עבור חלק הגישה.
- התאימו את עקומות כניסת הכוח ל"מודל הרץ מתוקן לצמיגות באמצעות מודל Kelvin-Voigt-Maxwell (KVM)". מההתאמה, השיגו את המודולוס של יאנג הלא רגוע, את המודולוס של יאנג לכאורה ואת הצמיגות הנראית לעין. המודל גם נותן למקסוול זמני הרפיה והזחה.
הערה: במספר עקומות הזחת כוח שנותחו (במיוחד הרקמה השלמה), זמני ההרפיה של מקסוול היו גדולים או קטנים משמעותית מזמן ההזחה, מה שמצביע על התנהגות אלסטית למדי או התנהגות מכנית קלווין-ווייט, בהתאמה.
- יצא את כל המדידות לגיליון אלקטרוני וחשב את המודולים החציוניים הנראים של יאנג לכל סוג רקמה ודגימה.
- התווה ונתח סטטיסטית את הנתונים באמצעות תוכנה מתאימה.
הערה: מנסרת GraphPad משמשת כאן, וכאשר מתארים את התוצאות, המחקר מתייחס לממוצע ± SD של המודולים החציוניים הנראים של יאנג לכל מדגם (מוצג באיור 2D-F). - הצג פרוסות אופטיות מתמונות קונפוקליות על-ידי הקרנתן עם פונקציית ההקרנה המרבית של פיג'י. התאם את הבהירות והניגודיות של כל ערוץ בנפרד להדמיה מיטבית של כתמים פלואורסצנטיים.
- צור לוח איור עם התוכנה המתאימה.
הערה: Affinity Designer משמש ליצירת החלוניות, והמודל באיור 1A משורטט באמצעות Affinity Designer.
Access restricted. Please log in or start a trial to view this content.
תוצאות
באמצעות הפרוטוקול שתואר לעיל, מדדנו את המודולוס לכאורה של יאנג של רקמות גפיים אקסולוטליות סחוניות בתנאים הומיאוסטטיים ("שלמים"), במהלך היסטוליזה מוקדמת של הסחוס, ובשלבי עיבוי סחוס מאוחרים יותר (איור 1A). חקרנו גם את התכונות המכניות של רכיבי השלד באזורים שו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן, אנו מדגימים טכניקה למדידת קשיחות סחוס בגפיים אקסולוטליות עם AFM. עם זאת, שיטה זו עשויה להיות מורחבת עבור חיטוט סוגי רקמות אחרים גם כן. שלב מפתח למדידות AFM מוצלחות הוא הכנת דגימות, שהתגלתה כמאתגרת במיוחד עם דגימות אקסולוטל. מצאנו כי חיטוט פני הרקמה שעדיין היו מוטמעים בג?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים
Acknowledgements
אנו מודים לכל חברי מעבדת סנדובל-גוזמן על התמיכה והחברות המתמשכות במהלך פיתוח עבודה זו. אנו אסירי תודה גם לאניה וגנר, ביאטה גרוהל וג'ודית קוננץ על מסירותן לטיפול האקסולוטלי. אנו מודים גם לפול מולר על אספקת קודים לניתוח נתוני AFM. עבודה זו נתמכה על ידי מתקן מיקרוסקופיה קלה של פלטפורמת הטכנולוגיה CMCB ב TU דרזדן. AT הוא עמית במרכז הקריירה המוקדמת של מילדרד של דרזדן P2 הממומן על ידי הסיוע הגרמני לסרטן (Deutsche Krebshilfe). RA ממומן על ידי עמדת PI זמנית (Eigene Stelle) מ- Deutsche Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית) - AI 214/1-1.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
References
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0-2 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , Springer. Cham. (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966(2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681(2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711(2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036(2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016(2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268(2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17(2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341(2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, Springer. Dordrecht. 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved