A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد نموذج معدل لإعادة تروية انسداد الشريان الدماغي الأوسط
In This Article
Summary
يصف هذا البروتوكول عملية التحضير لإعادة تروية انسداد الشريان الدماغي الأوسط عبر الشريان السباتي المشترك.
Abstract
يعد نموذج إعادة ضخ انسداد الشريان الدماغي الأوسط (MCAO / R) أمرا بالغ الأهمية لفهم الآليات المرضية للسكتة الدماغية ولتطوير الأدوية. ومع ذلك ، من بين طرق النمذجة الشائعة الاستخدام ، غالبا ما تواجه طريقة كويزومي تدقيقا بسبب ربطها بالشريان السباتي المشترك (CCA) وعدم قدرتها على تحقيق التروية الكافية. وبالمثل ، تم انتقاد طريقة لونجا لفصل وربط الشريان السباتي الخارجي (ECA). تهدف هذه الدراسة إلى تقديم طريقة إعداد نموذج معدل تحافظ على سلامة ECA ، وتتضمن إدخال خياطة نايلون أحادية الشعيرات من خلال CCA ، وإصلاح شق CCA المربوط ، والحفاظ على إعادة التروية من CCA. تم تأكيد إعادة ضخ تدفق الدم باستخدام تصوير تدفق البقع بالليزر. أظهرت طرق التقييم مثل مقياس لونجا ، ودرجة الخطورة العصبية المعدلة ، وتلطيخ كلوريد ثلاثي فينيل تترازوليوم (TTC) ، ووضع العلامات المناعية للخلايا العصبية أن هذا النهج يمكن أن يؤدي إلى تلف الأعصاب الإقفارية المستقرة. هذا البروتوكول النموذجي المعدل MCAO / R بسيط ومستقر ، ويوفر إرشادات قيمة للممارسين في مجال نقص التروية الدماغية.
Introduction
وفقا لمنظمة الصحة العالمية ، ظلت السكتة الدماغية السبب الرئيسي الثاني للوفاة في جميع أنحاء العالم على مدى العقد الماضي ، مع ارتفاع معدل الإصابة ، وارتفاع معدل الوفيات ، وارتفاع معدل الإعاقة 1,2. مع تقدم سكان العالم في السن ، من المتوقع أن يزداد معدل الإصابة بالسكتة الدماغية في البلدان النامية ، مما قد يصبح السبب الرئيسي للوفاة المبكرة والعجز لدى البالغين. بالإضافة إلى ذلك ، هناك اتجاه لحدوث السكتات الدماغية في سن أصغر3. كما أن فقدان القوى العاملة بعد السكتة الدماغية يضع عبئا ثقيلا على الأسر والمجتمع4. لذلك ، فإن تطوير علاجات آمنة وفعالة يشكل تحديا كبيرا في أبحاث السكتة الدماغية.
تعمل النماذج الحيوانية كأدوات حاسمة لدراسة الوقاية من الأمراض البشرية وعلاجها. تعتمد الترجمة الناجحة لاستراتيجيات علاج السكتة الدماغية على استنساخ وموثوقية النماذج الحيوانية للسكتة الدماغية 5,6. الشريان الدماغي الأوسط (MCA) هو موقع شائع للسكتة الدماغية السريرية ، مما يجعل نموذج MCAO أقرب نموذج للسكتة الدماغية البشرية. تم تفضيل نموذج MCAO ، الذي تم إعداده باستخدام طريقة الخياطة ، من قبل الباحثين بسبب مزايا مثل عدم حج القحف وسهولة التحكم في الوقت الإقفاري. تم استخدامه في أكثر من 40٪ من تجارب الحماية العصبية7. ومع ذلك ، على الرغم من مزاياه العديدة ، تظل التفاصيل التشغيلية لهذا النموذج موضوعا مثيرا للجدل للعديد من الباحثين.
بالنسبة لنموذج انسداد الشريان الدماغي الأوسط الناجم عن خياطة (MCAO) ، يحدث إعادة التروية عن طريق سحب الخيط. حاليا ، يتم استخدام طريقتين رئيسيتين لإدخال خياطة: طريقة كويزومي8 وطريقة لونغا9. في طريقة كويزومي ، يدخل الخيط إلى الشريان السباتي الداخلي (ICA) بشكل رئيسي من خلال شق الشريان السباتي المشترك (CCA) ، بينما في طريقة لونغا ، يمر عبر الشريان السباتي الخارجي المقطوع (ECA) إلى ICA. أثناء إعادة التروية ، تتطلب طريقة Koizumi ربط شق CCA بشكل دائم وتعتمد على دائرة Willis لإعادة التروية10. ومع ذلك ، تشير بعض الدراسات إلى أنه لا يمكن تحقيق إعادة التروية الفعالة فقط من خلال الإمداد التعويضي لدائرة ويليس بعد فقدان إمدادات CCA. علاوة على ذلك ، تظهر دائرة ويليس تباينا تشريحيا عاليا ، خاصة في الفئران C57Bl / 6 ، مما يزيد من تباين الاحتشاء ويقلل من موثوقية البيانات التجريبية. وبالتالي ، تم التشكيك في هذه الطريقة بشكل متزايد من قبل الباحثين11.
تتضمن طريقة لونجا إدخال خياطة من خلال ECA المقطوع ثم ربط الشريان السباتي الداخلي (ICA) بشكل دائم بمجرد سحب الخيط. هذا يحافظ على سالكية CCA ، مما يسمح بنضح الدم بنسبة تصل إلى 100٪ من القيم الأساسية. ومع ذلك ، تتطلب هذه الطريقة فصل الشريان السباتي الخارجي والفروع الشريانية الصغيرة ، أو قطعها ، أو تخثيرها كهربائيا ، مما يجعل الإجراء صعبا. كما أنه يعطل بنية تدفق الدم الكاملة للدماغ ، والتي تختلف عن حالة المريض السريرية12. الأهم من ذلك ، تشير الدراسات إلى أن قطع أو ربط ECA يمكن أن يسبب آفات نقص تروية في العضلات التي تتحكم في المضغ والبلع ، مما يؤثر على النظام الغذائي للحيوان ويؤدي إلى موت بعد العملية الجراحية والأضرار الحسية والحركية الشديدة في الفئران13،14.
ومن ثم، هناك حاجة ماسة إلى طريقة معدلة لإعداد النموذج لمعالجة هذه المسائل. تقدم هذه الدراسة طريقة نمذجة MCAO معدلة تعمل على إصلاح شق إدخال CCA وتحقق إعادة تروية فعالة. الإجراء بسيط وعملي وممكن ، مما يؤدي إلى تلف عصبي كبير وآفات احتشاء قابلة للتكرار ويوفر إرشادات قيمة للباحثين في السكتة الدماغية.
Protocol
تم إجراء البروتوكول التجريبي وفقا لإرشادات استخدام المختبر واللجنة المؤسسية لرعاية واستخدامها في جامعة تشنغدو للطب الصيني التقليدي (رقم السجل: 2019-DL-002). تم توثيق جميع بيانات البحوث الحيوانية باتباع إرشادات REACH (البحوث الحيوانية: الإبلاغ في تجارب الجسم الحي ). تم استخدام ذكور الفئران Sprague Dawley (SD) التي تزن 250 جم ± 20 جم وتتراوح أعمارهم بين 6-8 أسابيع لهذه الدراسة. يتم سرد التفاصيل المتعلقة بالحيوانات والكواشف والمعدات المستخدمة في جدول المواد.
1. إعداد
- تحفيز والحفاظ على التخدير العميق في الفئران باستخدام زوليتيل 50 (50 ملغ / كغ ، IM) وزيلازين هيدروكلوريد (40 ملغ / كغ ، IP). تأكد من الحفاظ على درجة حرارة الجسم عند 37 ± 0.5 درجة مئوية باستخدام مسبار مستقيمي متصل بوسادة تدفئة طوال العملية الجراحية. ضع مرهما بيطريا على عيون الفئران لمنعها من الجفاف.
- حلق الشعر من رأس وعنق الفئران. استخدم كريم مزيل الشعر لإزالة الفراء من الرأس والرقبة ، ثم اغسل الكريم بمحلول ملحي طبيعي. تطهير الجلد في موقع الجراحة عن طريق تطبيق الإيثانول والبوفيدون اليود ثلاث مرات باستخدام كرات القطن المعقمة.
- قم بعمل شق 2 سم في منتصف رأس الجرذ على طول اتجاه الخيط السهمي باستخدام مشرط ، وقم بإزالة العضلات التي تغطي الجمجمة بعناية.
- رقيقة الجمجمة على الجانب الإقفاري من الفئران باستخدام حفر الجمجمة. استخدم محلول ملحي عادي لتبريد وإزالة الحطام أثناء عملية الطحن. سجل تدفق الدم الأساسي للفئران باستخدام تصوير تباين البقع بالليزر (LSCI).
- ضع الإيثانول واليود البوفيدون ثلاث مرات على جلد الرقبة باستخدام كرات قطنية معقمة. قم بعمل شق 2 سم على طول خط الوسط من الرقبة باستخدام شفرة جراحية. استخدم المبعدات لسحب الجلد والغدد اللعابية بشكل جانبي ، وتعريض عضلات القص الترقوي الخشائي وعنق الرحم.
- افصل بين العضلات القصية الترقوية الخشائية وعنق الرحم لفضح المنطقة السباتية. تحديد تشريح الأوعية الدموية للشريان السباتي المشترك (CCA) والشريان السباتي الداخلي (ICA) والشريان السباتي الخارجي (ECA). بناء على تشريح الأوعية الدموية ، افصل CCA ، بالإضافة إلى ECA و ICA15 المشتقين من CCA.
ملاحظة: يشير التركيب التشريحي للفأر إلى أن منطقة CCA مغطاة بشكل أساسي بالعضلات القصية الترقوية الخشائية وعنق الرحم ، مع ICA و ECA المستمدة من CCA. بعد الانفصال يكشف CCA ، يمكن رؤية شوكة على شكل Y على طول CCA ، تمثل ICA و ECA. كن حذرا حتى لا تتلف العصب المبهم ، الذي يعمل بالتوازي مع CCA.
2. انسداد مولودية الجزائر
- اربط عقدة سهلة الفك على الشريان السباتي الخارجي (ECA) والشريان السباتي المشترك (CCA) باستخدام خيط حرير 3-0 لمنع تدفق الدم مؤقتا. ضع مشبك وعاء على CCA على بعد حوالي 0.5 سم من العقدة الأولى.
- صبغ إبرة حقنة 5 مل باللون الأسود. قم بإنشاء ثقب صغير في CCA باستخدام الإبرة المصبوغة باللون الأسود وقم بتمييز الثقوب باللون الأسود.
- أدخل خيوط النايلون أحادية الشعيرات في CCA من خلال العلامة السوداء. افتح مشبك الأوعية الدموية ووجه سلك النايلون إلى الشريان السباتي الداخلي (ICA) حتى يتوقف بمقاومة طفيفة. شد العقدة الثانية بإحكام للحفاظ على خياطة النايلون أحادية الشعيرات في مكانها داخل الشريان ، مما يمنع الإزاحة من وضع الانسداد.
- لاحظ وقت نقص التروية في هذه المرحلة وقم بقياس قيمة تدفق الدم على الجانب الإقفاري باستخدام LSCI. تطبيق قطرات من بوبيفاكايين على جرح الرقبة للتسكين وإغلاق الجرح. قم بإزالة قناع التخدير والسماح للفأر بالتعافي.
ملاحظة: إذا واجه خيط النايلون أحادي الشعيرات صعوبة في دخول ICA ، فسحبه قليلا وحاول إدخاله مرة أخرى.
3. إعادة ضخ MCAO
- بعد 90 دقيقة من نقص التروية ، أعد تخدير الفئران بالإيزوفلوران. قم بقياس تدفق الدم الدماغي من الجانب الإقفاري باستخدام LSCI وتأكد من عدم تحول خيوط النايلون أحادية الشعيرات.
- قم بفك العقد الموجودة على الشريان السباتي الخارجي (ECA) للسماح بإعادة تروية الدم. حرر العقدة على الشريان السباتي المشترك (CCA) ، وقم بتأمين خياطة الشعيرات الأحادية ، واسحب الخيط. ضع مشبكا وعائيا قبل خياطة الشعيرات الأحادية الثابتة لمنع النزيف.
- استبدل عقدة CCA الأولى بمشبك وعائي. استخدم الملقط لتدوير شق الوعاء بشكل جانبي (الشكل 1). ثبت الشق بملاقط واربطه باستخدام خيط 6-0 لإصلاح الشق. قم بإزالة مشبك الأوعية الدموية ، وتحقق من وجود تسربات ، وتأكد من إعادة التروية الكاملة (فيديو 1).
ملاحظة: قم بإجراء الربط لإصلاح الشق لتجنب التثبيت المفرط للأوعية الدموية ، مما قد يؤدي إلى تضيق CCA. - سجل قيم تدفق الدم القشري الدماغي باستخدام LSCI بعد ربط الشق لتأكيد نجاح عملية التروية. أغلق شق الرقبة بالغرز وقم بتطبيق 1،00،000 وحدة من البنسلين و 2 مل من المياه المالحة لمنع العدوى والجفاف.
- الحفاظ على الدفء حتى تستعيد الفئران وعيها. قدم طعاما طريا بعد الجراحة وراقب العلامات الحيوية للحيوانات.
4. تقييم وظيفة العصب وإصابة نقص تروية الدماغ
- بمجرد أن تستيقظ الفئران تماما ، سيتم تقييم وظيفتها العصبية من قبل باحثين غير مدركين للمجموعة الحيوانية. استخدم مقياس درجة لونغا (الجدول 1) ومقياس درجة الشدة العصبية المعدلة (mNSS) (الجدول 2) لتقييم الوظيفة العصبية لجميع الفئران.
- بعد 24 ساعة بعد الجراحة ، القتل الرحيم للفئران تحت التخدير الناجم عن الأيزوفلوران (4٪ إيزوفلوران عند 4 لتر / دقيقة أكسجين) عن طريق خلع عنق الرحم16 (باتباع البروتوكولات المعتمدة مؤسسيا). شطف الدماغ بالماء المثلج لإزالة أي دم متبقي.
- قسم أنسجة المخ إلى 5 أقسام وصمة عار عليها مع TTC. التقط صورا لكلا جانبي شرائح أنسجة المخ ، وقم بقياس المنطقة الإقفارية للجانبين الأمامي والخلفي باستخدام برنامج Image J ، واحسب معدل الاحتشاء باستخدام الصيغة التالية:
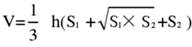
ملاحظة: يمثل S1 و S2 منطقة احتشاء الدماغ الأمامي القريب وجوانب جذع الدماغ القريبة من شرائح الدماغ ، على التوالي. يتم تصحيح منطقة الاحتشاء لكل شريحة دماغية باستخدام صيغة سوانسون ، حيث يمثل h سمك شريحة الدماغ. تسمح هذه الصيغة ، التي حددها المؤلف سابقا في البحثالسابق 17 ، بحساب أكثر دقة لحجم آفة الاحتشاء. - تحليل البيانات باستخدام البرامج الإحصائية والرسوم البيانية لتقييم معدل نجاح النموذج واستقراره.
- استخدم طريقة التألق المناعي لتسمية الخلايا العصبية القشرية في الفئران ، مما يزيد من التحقق من صحة الضرر العصبي الناجم عن هذه الطريقة. بعد 24 ساعة من نقص التروية في الفئران ، تم إجراء نضح القلب باستخدام PBS المبرد مسبقا للحصول على أنسجة المخ.
- تضمين وتجميد أنسجة المخ في أقسام. استخدم الأجسام المضادة العصبية مثل العلامة العصبية غير الناضجة Doublecortin (DCX) 18 ، وعلامة النواة العصبية Neuronal Nuclei (NeuN) 18 ، والعلامة المتغصنة للخلايا العصبية البروتين المرتبط بالأنابيب الدقيقة -2 (MAP-2) 19. مراقبة التعبير عن الخلايا العصبية الإقفارية باستخدام المجهر البؤري بالليزر.
النتائج
أظهر تصوير تدفق البقع بالليزر أنه قبل انسداد خياطة النايلون أحادية الشعيرات ، كان هناك تدفق دم وفير في منطقة الشريان الدماغي الأوسط (MCA) ، وتم تسجيل قيم تدفق الدم الأساسية للفئران. بعد انسداد MCA ، انخفضت قيمة تدفق الدم على الجانب الإقفاري من الدماغ بسرعة. قبل سحب الخيط ، تم إعادة فحص قيم تدفق...
Discussion
نموذج انسداد الشريان الدماغي الأوسط (MCAO) الناجم عن خياطة نايلون أحادية الشعيرات هو الطريقة الأكثر شيوعا المستخدمة لإعداد نماذج MCAO. تم اعتماد هذا النهج على نطاق واسع في الدراسات قبل السريرية واكتسب اعترافا من العديد من الممارسين بسبب بساطته ، وعدم الحاجة إلى حج القحف ، والحد الأدنى من الصد...
Disclosures
اي.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82173781 و 82373835) ، ومشروع أبحاث ما بعد الدكتوراه (BKS212055) ، ومشروع الابتكار العلمي والتكنولوجي لمكتب فوشان للعلوم والتكنولوجيا (2320001007331) ، ومؤسسة قوانغدونغ للبحوث الأساسية والتطبيقية (2019A1515010806) ، والمشاريع الميدانية الرئيسية (التصنيع الذكي) للجامعات العامة في مقاطعة قوانغدونغ (2020ZDZX2057) ، ومشاريع البحث العلمي (الابتكار المميز) من جنرال الجامعات في مقاطعة قوانغدونغ (2019KTSCX195).
Materials
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
References
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved