A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת מודל שונה עבור זילוח חסימת עורק מוחי אמצעי
In This Article
Summary
פרוטוקול זה מתאר את תהליך ההכנה לרפרפוזיה של חסימת עורק המוח התיכון דרך עורק התרדמה המשותף.
Abstract
מודל MCAO/R (ראשי תיבות של Middle Cerebral Artery Totion Reperfusion) חיוני להבנת המנגנונים הפתולוגיים של שבץ מוחי ולפיתוח תרופות. עם זאת, בין שיטות המידול הנפוצות, שיטת קואיזומי עומדת לעתים קרובות בפני בדיקה בשל קשירת עורק התרדמה המשותף (CCA) וחוסר יכולתה להשיג זילוח הולם. באופן דומה, שיטת לונגה ספגה ביקורת על ניתוק וקשירת עורק התרדמה החיצוני (ECA). מחקר זה נועד להציג שיטת הכנת מודל שונה השומרת על שלמות ה- ECA, כוללת החדרת תפר ניילון מונופילמנט דרך CCA, תיקון חתך CCA קשור, ושמירה על זילוח מה- CCA. רפרפוזיה של זרימת הדם אושרה באמצעות הדמיית זרימת כתמים בלייזר. שיטות הערכה כגון סולם לונגה, ציון חומרה נוירולוגית שונה, צביעת טריפנילטטרזוליום כלוריד (TTC) ותיוג אימונופלואורסצנטי של נוירונים הראו כי גישה זו עלולה לגרום נזק עצבי איסכמי יציב. פרוטוקול מודל MCAO/R שונה זה הוא פשוט ויציב, ומספק הדרכה רבת ערך למטפלים בתחום איסכמיה מוחית.
Introduction
על פי ארגון הבריאות העולמי, שבץ מוחי נותר סיבת המוות השנייה בעולם בעשור האחרון, עם שיעור היארעות גבוה, תמותה גבוהה ושיעור נכות גבוה 1,2. ככל שאוכלוסיית העולם מזדקנת, שכיחות השבץ צפויה לעלות במדינות מתפתחות, ועלולה להפוך לגורם המוביל למוות מוקדם ונכות בקרב מבוגרים. בנוסף, קיימת מגמה של שבץ מוחי להתרחש בגיל צעיר יותר3. אובדן כוח העבודה לאחר שבץ מוחי מטיל גם נטל כבד על משפחות ועל החברה4. לכן, פיתוח טיפולים בטוחים ויעילים מציב אתגר גדול בחקר השבץ.
מודלים של בעלי חיים משמשים כלים חיוניים לחקר מניעה וטיפול במחלות אנושיות. התרגום המוצלח של אסטרטגיות טיפול בשבץ מסתמך על השחזור והאמינות של מודלים של בעלי חיים שבץ 5,6. עורק המוח האמצעי (MCA) הוא אתר נפוץ לשבץ קליני, מה שהופך את מודל MCAO למודל הקרוב ביותר לשבץ איסכמי אנושי. מודל MCAO, שהוכן בשיטת התפרים, מועדף על ידי חוקרים בשל יתרונות כגון היעדר קרניוטומיה ושליטה קלה בזמן איסכמי. הוא שימש ביותר מ-40% מהניסויים בהגנה עצבית7. עם זאת, למרות יתרונותיו הרבים, הפרטים המבצעיים של מודל זה נותרו נושא שנוי במחלוקת עבור חוקרים רבים.
עבור מודל חסימת עורק המוח האמצעי המושרה על ידי התפר (MCAO), הרפרפוזיה מתרחשת על ידי משיכת התפר. כיום משתמשים בשתי שיטות עיקריות להחדרת תפרים: שיטה8 של קואיזומי ושיטה9 של לונגה. בשיטתו של קואיזומי, התפר נכנס לעורק התרדמה הפנימי (ICA) בעיקר דרך חתך עורק התרדמה המשותף (CCA), ואילו בשיטתו של לונגה הוא עובר דרך עורק התרדמה החיצוני הקטוע (ECA) לתוך האגודה למלחמה בסרטן. במהלך הרפרפוזיה, שיטת קואיזומי דורשת קשירה קבועה של חתך CCA ומסתמכת על מעגל וויליס עבור רפרפוזיה10. עם זאת, מחקרים מסוימים מצביעים על כך שרפרפוזיה יעילה אינה יכולה להיות מושגת אך ורק באמצעות אספקת פיצוי של מעגל ויליס לאחר אובדן אספקת CCA. יתר על כן, מעגל ויליס מציג שונות אנטומית גבוהה, במיוחד בעכברי C57Bl/6, מה שמגדיל את שונות האוטם ומקטין את אמינות הנתונים הניסיוניים. כתוצאה מכך, שיטה זו נחקרה יותר ויותר על ידי חוקרים11.
השיטה של לונגה כוללת החדרת תפר דרך ECA קטוע ולאחר מכן קשירת עורק התרדמה הפנימי (ICA) לצמיתות לאחר הוצאת התפר. זה שומר על פטנט CCA, ומאפשר זילוח דם עד 100% מערכי הבסיס. עם זאת, שיטה זו מחייבת הפרדה של עורק התרדמה החיצוני וענפי עורקים קטנים, כריתתם או אלקטרוקרישה שלהם, מה שהופך את ההליך למאתגר. זה גם משבש את מבנה זרימת הדם המלא של המוח, אשר שונה ממצבו של המטופל הקליני12. חשוב לציין, מחקרים מצביעים על כך שחיתוך או קשירה של ECA עלולים לגרום לנגעים איסכמיים בשרירים השולטים בלעיסה ובבליעה, להשפיע על תזונה של בעלי חיים ולהוביל למוות של בעלי חיים לאחר הניתוח ולנזק תחושתי ומוטורי חמור בחולדות13,14.
לפיכך, יש צורך דחוף בשיטת הכנת מודל שונה כדי לטפל בבעיות אלה. מחקר זה מציג שיטת מידול MCAO שונה המתקנת את חתך החדרת CCA ומשיגה רפרפוזיה יעילה. ההליך פשוט, מעשי וישום, גורם לנזק נוירולוגי משמעותי ונגעי אוטם הניתנים לשכפול ומספק הדרכה חשובה לחוקרי שבץ.
Protocol
פרוטוקול הניסוי נערך בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בחיות מעבדה באוניברסיטת צ'נגדו לרפואה סינית מסורתית (מספר שיא: 2019-DL-002). כל נתוני המחקר בבעלי חיים תועדו בהתאם להנחיות ARRIVE (Animal Research: Reporting In Vivo Experiments). במחקר זה נעשה שימוש בחולדות זכרים מסוג Sprague Dawley (SD) במשקל 250 גרם ±-20 גרם ובגילאי 6-8 שבועות. הפרטים לגבי בעלי החיים, הריאגנטים והציוד המועסקים מפורטים בטבלת החומרים.
1. הכנת בעלי חיים
- השראת ושמירה על הרדמה עמוקה בחולדות באמצעות Zoletil 50 (50mg/kg, IM) ו-Xylazine Hydrochloride (40mg/kg, IP). ודא שטמפרטורת הגוף נשמרת על 37 ± 0.5 מעלות צלזיוס באמצעות בדיקה רקטלית המחוברת לכרית חימום לאורך כל ההליך הכירורגי. מרחו משחה וטרינרית על עיני החולדה כדי למנוע מהן להתייבש.
- לגלח את השיער מהראש והצוואר של החולדות. השתמש קרם depilatory כדי להסיר פרווה מן הראש והצוואר, ולאחר מכן לשטוף את הקרם עם מלוחים רגילים. לחטא את העור באתר הניתוח על ידי מריחת אתנול ופובידון-יוד שלוש פעמים באמצעות כדורי צמר גפן סטריליים.
- בצע חתך של 2 ס"מ באמצע ראש החולדה לאורך כיוון התפר הקשת באמצעות אזמל, והסר בזהירות את השרירים המכסים את הגולגולת.
- דק את הגולגולת בצד האיסכמי של החולדה באמצעות מקדח גולגולת. השתמשו במי מלח רגילים כדי לקרר ולהסיר לכלוך במהלך תהליך הטחינה. תעד את זרימת הדם הבסיסית של החולדות באמצעות הדמיית ניגוד כתמי לייזר (LSCI).
- החל אתנול ו povidone-יוד שלוש פעמים על העור של הצוואר באמצעות כדורי צמר גפן סטרילי. בצע חתך של 2 ס"מ לאורך קו האמצע של הצוואר באמצעות להב כירורגי. השתמש retractors כדי למשוך לרוחב את העור ואת בלוטות הרוק, לחשוף את sternocleidomastoid ואת שרירי צוואר הרחם.
- להפריד את שרירי sternocleidomastoid ואת צוואר הרחם כדי לחשוף את שטח התרדמה. זהה את האנטומיה של כלי הדם של עורק התרדמה המשותף (CCA), עורק התרדמה הפנימי (ICA) ועורק התרדמה החיצוני (ECA). בהתבסס על אנטומיה של כלי הדם, להפריד את CCA, כמו גם ECA נגזר CCA ו ICA15.
הערה: המבנה האנטומי של החולדה מצביע על כך שאזור CCA מכוסה בעיקר על ידי שרירי סטרנוקלידומסטואיד וצוואר הרחם, כאשר ICA ו- ECA נגזרים מה- CCA. לאחר שההפרדה חושפת את ה-CCA, ניתן לראות מזלג בצורת Y לאורך ה-CCA, המייצג את ה-ICA וה-ECA. היזהר שלא לפגוע בעצב התועה, המקביל ל- CCA.
2. הסתרה של MCA
- קשרו קשר קל להתיר את הסבך מעל עורק התרדמה החיצוני (ECA) ועורק התרדמה המשותף (CCA) באמצעות חוט משי 3-0 כדי לחסום זמנית את זרימת הדם. מקם אטב כלי על CCA כ 0.5 ס"מ מהקשר הראשון.
- צובעים את המחט של מזרק 5 מ"ל שחור. צור נקב קטן ב- CCA באמצעות המחט הצבועה בשחור וסמן את חורי הסיכה בשחור.
- הכנס את תפר הניילון מונופילמנט לתוך CCA דרך הסימן השחור. פתח את אטב כלי הדם והנחה את חוט הניילון לתוך עורק התרדמה הפנימי (ICA) עד שהוא נעצר עם התנגדות קלה. הדקו היטב את הקשר השני כדי לשמור על תפר הניילון מונופילמנט במקומו בתוך העורק, ולמנוע תזוזה ממצב החסימה.
- שימו לב לזמן האיסכמיה בשלב זה ומדדו את ערך זרימת הדם בצד האיסכמי באמצעות LSCI. לנהל טיפות של bupivacaine לפצע הצוואר עבור שיכוך כאבים וסגירת הפצע. הסירו את מסכת ההרדמה ואפשרו לחולדה להחלים.
הערה: אם תפר הניילון מונופילמנט נתקל בקושי להיכנס לאגודה למלחמה בסרטן, יש לסגת מעט ולנסות להחדיר שוב.
3. זילוח של MCAO
- לאחר 90 דקות של איסכמיה, הרדימו מחדש את החולדות עם איזופלורן. למדוד את זרימת הדם במוח מהצד האיסכמי באמצעות LSCI ולוודא שתפר הניילון מונופילמנט לא זז.
- להתיר את הקשרים על עורק התרדמה החיצוני (ECA) כדי לאפשר זילוח דם. שחררו את הקשר בעורק התרדמה המשותף (CCA), הדקו את תפר המונופילמנט ומשכו את התפר. יש למרוח אטב כלי דם לפני תפר המונופילמנט הקבוע כדי למנוע דימום.
- החלף את קשר CCA הראשון עם קליפס כלי דם. השתמשו בפינצטה כדי לסובב את חתך כלי הדם לצדדים (איור 1). הדקו את החתך בפינצטה וקשרו אותו באמצעות חוט 6-0 לתיקון החתך. הסר את אטב כלי הדם, בדוק אם יש דליפות ואשר זילוח מלא (וידאו 1).
הערה: בצע קשירה כדי לתקן את החתך כדי למנוע הידוק כלי דם מוגזם, אשר עלול להוביל להיצרות CCA. - רשום ערכי זרימת דם בקליפת המוח באמצעות LSCI לאחר קשירת חתך כדי לאשר זילוח מוצלח. סגור את החתך בצוואר עם תפרים ולתת 1,00,000 יחידות של פניצילין ו 2 מ"ל של מלוחים כדי למנוע זיהום והתייבשות.
- שמרו על חום עד שהחולדות חוזרות להכרה. הציעו מזון רך לאחר הניתוח ועקבו אחר הסימנים החיוניים של בעלי החיים.
4. הערכת תפקוד עצבי ופגיעה איסכמית מוחית
- לאחר שהחולדות התעוררו במלואן, התפקוד העצבי שלהן יוערך על ידי חוקרים שאינם מודעים לקיבוץ בעלי החיים. השתמשו בסולם ציוני לונגה (טבלה 1) ובסולם ציון החומרה הנוירולוגית המתוקנת (mNSS) (טבלה 2) כדי להעריך את התפקוד הנוירולוגי של כל החולדות.
- לאחר 24 שעות לאחר הניתוח, יש להרדים את החולדות תחת הרדמה הנגרמת על ידי איזופלורן (4% איזופלורן בחמצן של 4 ליטר לדקה) באמצעות נקע צוואר הרחם16 (בהתאם לפרוטוקולים שאושרו במוסד). שטפו את המוח במי קרח כדי להסיר את שאריות הדם.
- מחלקים את רקמת המוח ל-5 חלקים ומכתימים אותם ב-TTC. צלם תמונות של שני הצדדים של פרוסות רקמת המוח, מדוד את האזור האיסכמי של הצד הקדמי והאחורי באמצעות תוכנת Image J, וחשב את קצב האוטם באמצעות הנוסחה הבאה:
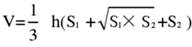
הערה: S1 ו-S2 מייצגים את אזור האוטם של המוח הקדמי הפרוקסימלי וצד גזע המוח הפרוקסימלי של פרוסות המוח, בהתאמה. אזור האוטם של כל פרוסת מוח מתוקן באמצעות נוסחת סוונסון, כאשר h מייצג את עובי פרוסת המוח. נוסחה זו, שתוארה בעבר על ידי המחבר במחקר קודם17, מאפשרת חישוב מדויק יותר של גודל הנגע אוטם. - נתח את הנתונים באמצעות תוכנות סטטיסטיות וגרפיות כדי להעריך את שיעור ההצלחה והיציבות של המודל.
- השתמש בשיטת immunofluorescence כדי לתייג נוירונים קליפת המוח בחולדות, אימות נוסף את הנזק העצבי שנגרם על ידי שיטה זו. לאחר 24 שעות של איסכמיה-רפרפוזיה בחולדות, בוצע זילוח לב באמצעות PBS מקורר מראש כדי להשיג רקמת מוח.
- להטמיע ולהקפיא את רקמת המוח למקטעים. השתמש בנוגדנים עצביים כגון הסמן העצבי הלא בשל Doublecortin (DCX)18, סמן הגרעין העצבי Neuronal Nuclei (NeuN)18, והסמן הדנדריטי של נוירון חלבון הקשור למיקרוטובול-2 (MAP-2)19. שימו לב לביטוי של נוירונים איסכמיים באמצעות מיקרוסקופ קונפוקלי בלייזר.
תוצאות
הדמיית זרימת כתמי לייזר הראתה כי לפני חסימת תפר הניילון מונופילמנט, הייתה זרימת דם בשפע באזור עורק המוח האמצעי (MCA), ונרשמו ערכי זרימת הדם הבסיסיים של החולדות. בעקבות חסימת MCA, ערך זרימת הדם בצד האיסכמי של המוח ירד במהירות. לפני משיכת התפר, ערכי זרימת הדם בצד האיסכמי נבדקו מחדש כדי לאשר אם התפ...
Discussion
מודל חסימת עורק המוח האמצעי (MCAO) המושרה על ידי תפר ניילון מונופילמנט הוא השיטה הנפוצה ביותר המשמשת להכנת דגמי MCAO. גישה זו אומצה באופן נרחב במחקרים פרה-קליניים וזכתה להכרה מצד מטפלים רבים בשל פשטותה, חוסר הצורך בקרניוטומיה, טראומה כירורגית מינימלית ויכולת להשיג רפרפוזיה.
ישנ...
Disclosures
ללא.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (82173781 ו -82373835), פרויקט מחקר פוסט-דוקטורט (BKS212055), פרויקט חדשנות מדע וטכנולוגיה של פושאן הלשכה למדע וטכנולוגיה (2320001007331), קרן המחקר הבסיסית והיישומית של גואנגדונג (2019A1515010806), פרויקטי שדה מרכזיים (ייצור חכם) של אוניברסיטאות כלליות במחוז גואנגדונג (2020ZDZX2057), ופרויקטי המחקר המדעי (חדשנות אופיינית) של כללי אוניברסיטאות במחוז גואנגדונג (2019KTSCX195).
Materials
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
References
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved