É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de um modelo modificado para reperfusão de oclusão da artéria cerebral média
Neste Artigo
Resumo
Este protocolo descreve o processo de preparação para a reperfusão da oclusão da artéria cerebral média através da artéria carótida comum.
Resumo
O modelo de reperfusão de oclusão da artéria cerebral média (MCAO/R) é crucial para a compreensão dos mecanismos patológicos do AVC e para o desenvolvimento de medicamentos. No entanto, entre os métodos de modelagem comumente usados, o método de Koizumi frequentemente enfrenta escrutínio devido à sua ligadura da artéria carótida comum (CCA) e sua incapacidade de alcançar reperfusão adequada. Da mesma forma, o método de Longa tem sido criticado por desconectar e ligar a artéria carótida externa (ECA). Este estudo tem como objetivo apresentar um método de preparo de modelo modificado que preserve a integridade da ECA, envolva a inserção de uma sutura de náilon monofilamentar através da CCA, reparando a incisão ligada da CCA e mantendo a reperfusão da CCA. A reperfusão do fluxo sanguíneo foi confirmada por meio de imagens de fluxo de manchas a laser. Métodos de avaliação como a escala de Longa, Modified Neurological Severity Score, coloração com cloreto de trifeniltetrazólio (TTC) e marcação de imunofluorescência de neurônios demonstraram que essa abordagem poderia induzir danos estáveis ao nervo isquêmico. Este protocolo de modelo MCAO/R modificado é simples e estável, fornecendo orientação valiosa para os profissionais no campo da isquemia cerebral.
Introdução
De acordo com a Organização Mundial da Saúde, o AVC permaneceu como a segunda principal causa de morte em todo o mundo na última década, com alta taxa de incidência, alta mortalidade e alta taxa de incapacidade 1,2. À medida que a população global envelhece, espera-se que a incidência de AVC aumente nos países em desenvolvimento, tornando-se potencialmente a principal causa de morte prematura e incapacidade em adultos. Além disso, há uma tendência de ocorrência de acidentes vasculares cerebrais em uma idade mais jovem3. A perda da força de trabalho após um AVC também sobrecarrega as famílias e a sociedade4. Portanto, o desenvolvimento de tratamentos seguros e eficazes representa um grande desafio na pesquisa do AVC.
Os modelos animais servem como ferramentas cruciais para estudar a prevenção e o tratamento de doenças humanas. A tradução bem-sucedida das estratégias de tratamento do AVC depende da reprodutibilidade e confiabilidade dos modelos animais de AVC 5,6. A artéria cerebral média (ACM) é um local comum para AVC clínico, tornando o modelo MCAO o modelo mais próximo do AVC isquêmico humano. O modelo MCAO, elaborado pelo método de sutura, tem sido favorecido pelos pesquisadores devido a vantagens como a ausência de craniotomia e o fácil controle do tempo isquêmico. Tem sido utilizado em mais de 40% dos experimentos neuroprotetores7. No entanto, apesar de suas inúmeras vantagens, os detalhes operacionais desse modelo permanecem um tópico controverso para muitos pesquisadores.
Para o modelo de oclusão da artéria cerebral média induzida por sutura (MCAO), a reperfusão ocorre pela retirada da sutura. Atualmente, dois métodos principais são usados para a inserção da sutura: o método de Koizumi8 e o método de Longa9. No método de Koizumi, a sutura entra na artéria carótida interna (ACI) principalmente através da incisão da artéria carótida comum (ACC), enquanto no método de Longa, passa pela artéria carótida externa (ACE) cortada para a ACI. Durante a reperfusão, o método de Koizumi requer a ligação permanente da incisão da ACC e depende do círculo de Willis para a reperfusão10. No entanto, alguns estudos sugerem que a reperfusão efetiva não pode ser alcançada apenas por meio do suprimento compensatório do círculo de Willis após a perda do suprimento de CCA. Além disso, o círculo de Willis exibe alta variabilidade anatômica, especialmente em camundongos C57Bl/6, aumentando a variabilidade do infarto e reduzindo a confiabilidade dos dados experimentais. Consequentemente, esse método tem sido cada vez mais questionado por pesquisadores11.
O método de Longa envolve a inserção de uma sutura através da ACE cortada e, em seguida, a ligação permanente da artéria carótida interna (ACI) assim que a sutura é retirada. Isso preserva a permeabilidade da CCA, permitindo a perfusão sanguínea de até 100% dos valores basais. No entanto, esse método requer a separação da artéria carótida externa e pequenos ramos arteriais, cortando-os ou eletrocoagulando-os, tornando o procedimento desafiador. Também interrompe a estrutura completa do fluxo sanguíneo do cérebro, que difere do estado clínicodo paciente 12. É importante ressaltar que estudos indicam que o corte ou ligadura da ECA pode causar lesões isquêmicas nos músculos que controlam a mastigação e a deglutição, afetando a dieta animal e levando à morte pós-operatória do animal e danos sensoriais e motores graves em ratos13,14.
Portanto, um método de preparação de modelo modificado é urgentemente necessário para resolver esses problemas. Este estudo apresenta um método de modelagem MCAO modificado que repara a incisão de inserção do CCA e alcança uma reperfusão eficaz. O procedimento é simples, prático e viável, induzindo danos neurológicos significativos e lesões replicáveis de infarto e fornecendo orientações valiosas para pesquisadores de AVC.
Protocolo
O protocolo experimental foi conduzido em conformidade com as diretrizes do Comitê de Uso e Uso de Animais de Laboratório e Cuidados Institucionais com Animais da Universidade de Medicina Tradicional Chinesa de Chengdu (número de registro: 2019-DL-002). Todos os dados de pesquisa com animais foram documentados seguindo as diretrizes ARRIVE (Animal Research: Reporting In Vivo Experiments). Ratos machos da raça Sprague Dawley (SD) pesando 250 g ± 20 g e com idade entre 6 e 8 semanas foram utilizados para este estudo. As especificidades sobre os animais, reagentes e equipamentos empregados estão listadas na Tabela de Materiais.
1. Preparação animal
- Induzir e manter anestesia profunda em ratos usando Zoletil 50 (50mg/kg, IM) e Cloridrato de Xilazina (40mg/kg, IP). Certifique-se de que a temperatura corporal seja mantida em 37 ± 0.5 °C usando uma sonda retal conectada a uma almofada de aquecimento durante todo o procedimento cirúrgico. Aplique pomada veterinária nos olhos do rato para evitar que sequem.
- Raspe o cabelo da cabeça e pescoço dos ratos. Use creme depilatório para remover o pelo da cabeça e pescoço e, em seguida, lave o creme com soro fisiológico. Desinfetar a pele no local da cirurgia aplicando etanol e iodopovidona três vezes com bolas de algodão estéreis.
- Faça uma incisão de 2 cm no meio da cabeça do rato ao longo da direção da sutura sagital usando um bisturi e remova cuidadosamente os músculos que cobrem o crânio.
- Afine o crânio no lado isquêmico do rato usando uma broca de crânio. Use solução salina normal para resfriar e remover detritos durante o processo de moagem. Registre o fluxo sanguíneo basal dos ratos usando imagens de contraste de manchas a laser (LSCI).
- Aplique etanol e iodopovidona três vezes na pele do pescoço usando bolas de algodão estéreis. Faça uma incisão de 2 cm ao longo da linha média do pescoço usando uma lâmina cirúrgica. Use afastadores para puxar lateralmente a pele e as glândulas salivares, expondo os músculos esternocleidomastóideo e cervical.
- Separe os músculos esternocleidomastóideo e cervical para expor o território carotídeo. Identifique a anatomia vascular da artéria carótida comum (ACC), da artéria carótida interna (ACI) e da artéria carótida externa (ACE). Com base na anatomia vascular, separe a ACC, bem como a ECA derivada da CCA e a ICA15.
NOTA: A estrutura anatômica do rato indica que a região CCA é coberta principalmente pelos músculos esternocleidomastóideo e cervical, com a ACI e a ECA derivadas da CCA. Depois que a separação expõe o CCA, um garfo em forma de Y pode ser visto ao longo do CCA, representando o ICA e o ECA. Tenha cuidado para não danificar o nervo vago, que corre paralelo ao CCA.
2. Oclusão do MCA
- Dê um nó facilmente desembaraçado sobre a artéria carótida externa (ECA) e a artéria carótida comum (CCA) usando um fio de seda 3-0 para bloquear temporariamente o fluxo sanguíneo. Posicione um clipe de vaso no CCA a aproximadamente 0.5 cm do primeiro nó.
- Pinte a agulha de uma seringa de 5 mL de preto. Faça um pequeno furo no CCA usando a agulha tingida de preto e marque os orifícios em preto.
- Insira a sutura de náilon monofilamento no CCA através da marca preta. Abra o clipe vascular e guie o fio de náilon na Artéria Carótida Interna (ACI) até que ele pare com leve resistência. Aperte o segundo nó com segurança para manter a sutura de náilon monofilamento no lugar dentro da artéria, evitando o deslocamento da posição de bloqueio.
- Observe o tempo de isquemia neste ponto e meça o valor do fluxo sanguíneo no lado isquêmico usando LSCI. Administre gotas de bupivacaína na ferida do pescoço para analgesia e fechamento da ferida. Remova a máscara de anestesia e permita que o rato se recupere.
NOTA: Se a sutura de náilon monofilamentar tiver dificuldade em entrar na ACI, retraia-a ligeiramente e tente inserir novamente.
3. Reperfusão de MCAO
- Após 90 min de isquemia, reanestesiar os ratos com isoflurano. Meça o fluxo sanguíneo cerebral do lado isquêmico usando LSCI e certifique-se de que a sutura de náilon monofilamentar não tenha se deslocado.
- Desatar os nós na artéria carótida externa (ECA) para permitir a reperfusão sanguínea. Solte o nó na artéria carótida comum (CCA), prenda a sutura do monofilamento e retire a sutura. Aplique um clipe vascular antes da sutura de monofilamento fixa para evitar sangramento.
- Substitua o primeiro nó CCA por um clipe vascular. Use uma pinça para girar a incisão do vaso lateralmente (Figura 1). Prenda a incisão com uma pinça e ligue-a com fio 6-0 para reparar a incisão. Remova o clipe vascular, verifique se há vazamentos e confirme a reperfusão completa (Vídeo 1).
NOTA: Realize a ligadura para reparar a incisão para evitar o pinçamento excessivo do vaso, o que pode levar à estenose CCA. - Registre os valores do fluxo sanguíneo cortical cerebral usando LSCI após a ligadura da incisão para confirmar a reperfusão bem-sucedida. Feche a incisão cervical com suturas e administre 1,00,000 unidades de penicilina e 2 mL de solução salina para prevenir infecção e desidratação.
- Mantenha o calor até que os ratos recuperem a consciência. Ofereça alimentos macios pós-operatórios e monitore os sinais vitais dos animais.
4. Avaliação da função nervosa e lesão isquêmica cerebral
- Uma vez que os ratos tenham despertado completamente, sua função neural será avaliada por pesquisadores que desconhecem o agrupamento de animais. Utilize a escala de pontuação de Longa (Tabela 1) e a escala de pontuação de gravidade neurológica modificada (mNSS) (Tabela 2) para avaliar a função neurológica de todos os ratos.
- Após 24 h pós-operatório, eutanasiar os ratos sob anestesia induzida por isoflurano (isoflurano a 4% a 4 L/min de oxigênio) via luxação cervical16 (seguindo protocolos aprovados institucionalmente). Enxágue o cérebro com água gelada para remover o sangue restante.
- Divida o tecido cerebral em 5 seções e core-as com TTC. Capture imagens de ambos os lados das fatias de tecido cerebral, meça a área isquêmica da frente e de trás usando o software Image J e calcule a taxa de infarto usando a seguinte fórmula:
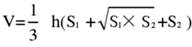
NOTA: S1 e S2 representam a área do infarto dos lados proximal do prosencéfalo e do tronco encefálico proximal das fatias cerebrais, respectivamente. A área do infarto de cada fatia do cérebro é corrigida usando a fórmula de Swanson, onde h representa a espessura da fatia do cérebro. Essa fórmula, previamente delineada pelo autor em pesquisas anteriores17, permite um cálculo mais preciso do tamanho da lesão do infarto. - Analise os dados usando software estatístico e gráfico para avaliar a taxa de sucesso e a estabilidade do modelo.
- Empregue o método de imunofluorescência para marcar neurônios corticais em ratos, validando ainda mais o dano neuronal causado por este método. Após 24 h de isquemia-reperfusão em ratos, foi realizada perfusão cardíaca com PBS pré-resfriado para obtenção de tecido cerebral.
- Incorpore e congele o tecido cerebral em seções. Use anticorpos neuronais, como o marcador neuronal imaturo Doublecortin (DCX)18, o marcador de núcleo neuronal Neuronal Nuclei (NeuN)18 e o marcador dendrítico de neurônios Microtubule-associated protein-2 (MAP-2)19. Observe a expressão de neurônios isquêmicos usando microscopia confocal a laser.
Resultados
A imagem de fluxo de manchas a laser demonstrou que, antes da oclusão da sutura de náilon monofilamentar, havia fluxo sanguíneo abundante na área da artéria cerebral média (ACM), e os valores basais de fluxo sanguíneo dos ratos foram registrados. Após a oclusão da ACM, o valor do fluxo sanguíneo no lado isquêmico do cérebro diminuiu rapidamente. Antes de retirar a sutura, os valores do fluxo sanguíneo no lado isquêmico foram verificados novamente para confirmar se a sutura estava ocluindo a ACM. Os resultad...
Discussão
O modelo de oclusão da artéria cerebral média (MCAO) induzido por uma sutura de náilon monofilamentar é o método mais comum usado para a preparação de modelos MCAO. Essa abordagem é amplamente adotada em estudos pré-clínicos e ganhou reconhecimento de muitos profissionais devido à sua simplicidade, falta de necessidade de craniotomia, trauma cirúrgico mínimo e capacidade de obter reperfusão.
Existem duas técnicas cirúrgicas clássicas para o filamento intraluminal MCAO: o mét...
Divulgações
Nenhum.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (82173781 e 82373835), projeto de pesquisa de pós-doutorado (BKS212055), Projeto de Inovação em Ciência e Tecnologia do Departamento de Ciência e Tecnologia de Foshan (2320001007331), Fundação de Pesquisa Básica e Aplicada de Guangdong (2019A1515010806), Principais Projetos de Campo (Manufatura Inteligente) das Universidades Gerais da Província de Guangdong (2020ZDZX2057) e os Projetos de Pesquisa Científica (Inovação Característica) da General Universidades na província de Guangdong (2019KTSCX195).
Materiais
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Referências
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados