Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модифицированная модельная подготовка для реперфузии окклюзии средней мозговой артерии
В этой статье
Резюме
Этот протокол описывает процесс подготовки к реперфузии окклюзии средней мозговой артерии через общую сонную артерию.
Аннотация
Модель реперфузии окклюзии средней мозговой артерии (MCAO/R) имеет решающее значение для понимания патологических механизмов инсульта и разработки лекарственных препаратов. Тем не менее, среди широко используемых методов моделирования метод Коидзуми часто подвергается тщательному изучению из-за его лигирования общей сонной артерии (ОСА) и его неспособности достичь адекватной реперфузии. Аналогичным образом, метод Лонга подвергался критике за отсоединение и перевязку наружной сонной артерии (ЭХА). Данное исследование направлено на внедрение модифицированного метода подготовки модели, который сохраняет целостность ЭХА, включает в себя введение монофиламентного нейлонового шва через ОСА, восстановление лигированного разреза ОСА и поддержание реперфузии от ОСА. Реперфузия кровотока подтверждена с помощью лазерной спекл-визуализации. Методы оценки, такие как шкала Лонга, модифицированная шкала неврологической тяжести, окрашивание трифенилтетразолия хлорида (ТТС) и иммунофлуоресцентное мечение нейронов, продемонстрировали, что этот подход может индуцировать стабильное ишемическое повреждение нервов. Этот модифицированный протокол модели MCAO/R прост и стабилен, предоставляя ценные рекомендации для практикующих врачей в области ишемии головного мозга.
Введение
По данным Всемирной организации здравоохранения, инсульт остается второй по значимости причиной смерти во всем мире в течение последнего десятилетия, с высоким уровнем заболеваемости, высокой смертностью и высоким коэффициентом инвалидности 1,2. По мере старения населения мира ожидается, что заболеваемость инсультом в развивающихся странах будет расти, что потенциально может стать основной причиной преждевременной смерти и инвалидности среди взрослых. Кроме того, существует тенденция к тому, что инсульты случаются в более раннем возрасте3 лет. Потеря рабочей силы после инсульта также ложится тяжелым бременем на семьи и общество4. Таким образом, разработка безопасных и эффективных методов лечения представляет собой серьезную проблему в исследованиях инсульта.
Животные модели служат важнейшими инструментами для изучения профилактики и лечения заболеваний человека. Успешная трансляция стратегий лечения инсульта зависит от воспроизводимости и надежности моделей пациентов с инсультомна животных 5,6. Средняя мозговая артерия (МКА) является распространенным местом для клинического инсульта, что делает модель МЦАО наиболее близкой моделью к ишемическому инсульту человека. Модель MCAO, полученная с использованием шовного метода, была одобрена исследователями благодаря таким преимуществам, как отсутствие трепанации черепа и легкий контроль времени ишемии. Он был использован более чем в 40% нейропротекторных экспериментов7. Однако, несмотря на многочисленные преимущества, эксплуатационные детали этой модели остаются спорной темой для многих исследователей.
Для модели окклюзии средней мозговой артерии (MCAO), вызванной швом, реперфузия происходит путем удаления шва. В настоящее время для наложения швов используются два основных метода: методКоидзуми 8 и метод Лонги9. В методе Коидзуми шов входит во внутреннюю сонную артерию (ВСА) в основном через разрез общей сонной артерии (ОСА), в то время как в методе Лонги он проходит через разорванную наружную сонную артерию (ОСА) в ВСА. Во время реперфузии метод Коидзуми требует постоянного лигирования разреза CCA и опирается на круг Виллиса для реперфузии10. Тем не менее, некоторые исследования показывают, что эффективная реперфузия не может быть достигнута исключительно за счет компенсаторного питания виллизиева круга после потери запаса ОСА. Кроме того, круг Виллиса демонстрирует высокую анатомическую вариабельность, особенно у мышей C57Bl/6, увеличивая вариабельность инфаркта и снижая надежность экспериментальных данных. Следовательно, этот метод все чаще ставится под сомнениеисследователями11.
Метод Лонга включает в себя наложение шва через разорванную ЭКА, а затем постоянное перевязку внутренней сонной артерии (ВСА) после снятия шва. Это сохраняет проходимость CCA, позволяя проводить перфузию крови до 100% от исходных значений. Однако этот метод требует отделения наружной сонной артерии и небольших артериальных ветвей, их отрезания или электрокоагуляции, что делает процедуру сложной. Он также нарушает полную структуру кровотока в мозге, что отличается от клинического состояния пациента12. Важно отметить, что исследования показывают, что разрезание или лигирование ECA может вызвать ишемические повреждения в мышцах, контролирующих жевание и глотание, влияя на рацион животных и приводя к послеоперационной смерти животных и серьезным сенсорным и двигательнымповреждениям у крыс.
Следовательно, для решения этих проблем срочно необходим модифицированный метод подготовки моделей. В этом исследовании представлен модифицированный метод моделирования MCAO, который восстанавливает разрез при введении CCA и обеспечивает эффективную реперфузию. Процедура проста, практична и осуществима, вызывая значительные неврологические повреждения и воспроизводимые поражения инфаркта, а также предоставляя ценные рекомендации для исследователей инсульта.
протокол
Протокол эксперимента был проведен в соответствии с рекомендациями Комитета по использованию лабораторных животных и Комитета по уходу и использованию институциональных животных Университета традиционной китайской медицины Чэнду (регистрационный номер: 2019-DL-002). Все данные исследований на животных были задокументированы в соответствии с рекомендациями ARRIVE. Для исследования были использованы самцы крыс Sprague Dawley (SD) массой от 250 г ± 20 г в возрасте 6-8 недель. Особенности использования животных, реагентов и оборудования приведены в Таблице материалов.
1. Подготовка животных
- Вызывайте и поддерживайте глубокую анестезию у крыс с помощью Золетила 50 (50 мг/кг, внутримышечно) и гидрохлорида ксилазина (40 мг/кг, внутримышечно). Следите за тем, чтобы температура тела поддерживалась на уровне 37 ± 0,5 °C с помощью ректального зонда, подключенного к грелке, на протяжении всей хирургической процедуры. Нанесите ветеринарную мазь на глаза крысы, чтобы предотвратить их пересыхание.
- Сбрейте шерсть с головы и шеи крыс. Используйте крем для депиляции, чтобы удалить шерсть с головы и шеи, затем смойте крем обычным физиологическим раствором. Продезинфицируйте кожу в месте операции, трижды нанеся этанол и повидон-йод с помощью стерильных ватных шариков.
- Сделайте разрез в 2 см посередине головы крысы по направлению сагиттального шва с помощью скальпеля, и аккуратно удалите мышцы, покрывающие череп.
- Истончите череп на ишемизированной стороне крысы с помощью сверла для черепа. Используйте обычный физиологический раствор для охлаждения и удаления мусора в процессе измельчения. Запишите исходный уровень кровотока крыс с помощью лазерной спекл-контрастной визуализации (LSCI).
- Нанесите этанол и повидон-йод трижды на кожу шеи с помощью стерильных ватных шариков. Сделайте разрез 2 см по средней линии шеи с помощью хирургического лезвия. Используйте ретракторы, чтобы боково оттянуть кожу и слюнные железы, обнажая грудино-ключично-сосцевидные и шейные мышцы.
- Отделите грудино-ключично-сосцевидную и шейную мышцы, чтобы обнажить сонную артерию. Определите сосудистую анатомию общей сонной артерии (ОСА), внутренней сонной артерии (ВСА) и наружной сонной артерии (ЭКА). Основываясь на анатомии сосудов, разделите CCA, а также ECA и ICA15, производные от CCA.
ПРИМЕЧАНИЕ: Анатомическое строение крысы указывает на то, что область ОСА в основном покрыта грудино-ключично-сосцевидными и шейными мышцами, при этом ВСА и ОСА происходят от ОСА. После того, как разделение обнажает CCA, вдоль CCA можно увидеть Y-образную вилку, представляющую ICA и ECA. Будьте осторожны, чтобы не повредить блуждающий нерв, который проходит параллельно ОСА.
2. Окклюзия MCA
- Завяжите легко распутывающийся узел над наружной сонной артерией (ECA) и общей сонной артерией (CCA) с помощью шелковой нити 3-0, чтобы временно блокировать кровоток. Расположите зажим для судна на CCA примерно в 0,5 см от первого узла.
- Покрасьте иглу шприца объемом 5 мл в черный цвет. Сделайте небольшой прокол в ОСА с помощью иглы, окрашенной в черный цвет, и отметьте отверстия черным цветом.
- Вставьте монофиламентный нейлоновый шов в CCA через черную метку. Откройте сосудистый зажим и введите нейлоновую проволоку во внутреннюю сонную артерию (ВСА) до упора с небольшим сопротивлением. Надежно затяните второй узел, чтобы монофиламентный нейлоновый шов оставался на месте внутри артерии, предотвращая смещение из блокирующего положения.
- Обратите внимание на время ишемии в этот момент и измерьте значение кровотока на ишемической стороне с помощью LSCI. Капли бупивакаина закапывают в рану на шее для обезболивания и закрытия раны. Снимите маску для анестезии и дайте крысе восстановиться.
ПРИМЕЧАНИЕ: Если шовный материал из мононити из нейлона сталкивается с трудностями при введении в ICA, слегка втяните его и повторите попытку введения.
3. Реперфузия МЦАО
- После 90 минут ишемии повторно обезболите крыс изофлураном. Измерьте мозговой кровоток с ишемической стороны с помощью LSCI и убедитесь, что монофиламентный нейлоновый шов не сместился.
- Развяжите узлы на наружной сонной артерии (ЭКА), чтобы обеспечить реперфузию крови. Отпустите узел на общей сонной артерии (ОЦА), зафиксируйте монофиламентный шов и снимите шов. Наложите сосудистый зажим перед несъемным монофиламентным швом, чтобы предотвратить кровотечение.
- Замените первый узел CCA сосудистым зажимом. С помощью пинцета поверните разрез сосуда в сторону (рисунок 1). Зажмите разрез пинцетом и перевяжите его с помощью нити 6-0 для восстановления разреза. Снимите сосудистый зажим, проверьте наличие подтеканий и подтвердите полную реперфузию (Видео 1).
ПРИМЕЧАНИЕ: Выполните лигирование для восстановления разреза, чтобы избежать чрезмерного зажима сосуда, которое может привести к стенозу CCA. - Запишите показатели кровотока в коре головного мозга с помощью LSCI после лигирования разреза для подтверждения успешной реперфузии. Закройте разрез на шее швами и введите 1 00 000 единиц пенициллина и 2 мл физиологического раствора для предотвращения инфекции и обезвоживания.
- Сохраняйте тепло до тех пор, пока крысы не придут в сознание. Предлагайте мягкую пищу после операции и следите за жизненными показателями животных.
4. Оценка нервной функции и ишемического повреждения головного мозга
- Как только крысы полностью проснутся, их нервная функция будет оценена исследователями, не знающими о группировке животных. Используйте шкалу Лонга (Таблица 1) и модифицированную шкалу неврологической тяжести (mNSS) (Таблица 2) для оценки неврологической функции всех крыс.
- Через 24 ч после операции усыпить крыс под индуцированной изофлураном анестезией (4% изофлуран при концентрации кислорода 4 л/мин) путем вывиха шейки матки16 (в соответствии с институционально утвержденными протоколами). Промойте мозг ледяной водой, чтобы удалить остатки крови.
- Разделите ткани мозга на 5 участков и окрасьте их с помощью ТТС. Сделайте снимки обеих сторон срезов мозговой ткани, измерьте ишемизированную область передней и задней сторон с помощью программного обеспечения Image J и рассчитайте частоту инфаркта по следующей формуле:
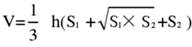
ПРИМЕЧАНИЕ: S1 и S2 представляют собой область инфаркта проксимального отдела переднего мозга и проксимальной стороны ствола мозга соответственно. Площадь инфаркта каждого среза мозга корректируется с помощью формулы Свенсона, где h представляет толщину среза мозга. Эта формула, ранее изложенная автором в предыдущем исследовании17, позволяет более точно рассчитать размер поражения инфаркта. - Анализируйте данные с помощью статистического и графического программного обеспечения, чтобы оценить успешность и стабильность модели.
- Используйте метод иммунофлуоресценции для мечения корковых нейронов у крыс, дополнительно подтверждая повреждение нейронов, вызванное этим методом. После 24 ч ишемии-реперфузии у крыс проводили перфузию сердца с использованием предварительно охлажденного PBS для получения мозговой ткани.
- Внедрите и заморозьте мозговую ткань на срезы. Используйте нейрональные антитела, такие как незрелый нейрональный маркер Doublecortin (DCX)18, маркер ядра нейрона Neuronal Nuclei (NeuN)18 и нейронный дендритный маркер Microtubule-ассоциированный белок-2 (MAP-2)19. Наблюдайте за экспрессией ишемических нейронов с помощью лазерной конфокальной микроскопии.
Результаты
Лазерная визуализация спекл-потока показала, что до окклюзии монофиламентного нейлонового шва в области средней мозговой артерии (МКА) наблюдался обильный кровоток, и были зарегистрированы исходные значения кровотока крыс. После окклюзии MCA величина кровотока на ишемизированной стор...
Обсуждение
Модель окклюзии средней мозговой артерии (MCAO), индуцированная монофиламентным нейлоновым швом, является наиболее распространенным методом, используемым для подготовки моделей MCAO. Этот подход широко применяется в доклинических исследованиях и получил признание многих практикующих в?...
Раскрытие информации
Никакой.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (82173781 и 82373835), Исследовательским проектом для постдокторантов (BKS212055), Проектом научно-технических инноваций Фошаньского научно-технического бюро (2320001007331), Фондом фундаментальных и прикладных фундаментальных исследований провинции Гуандун (2019A1515010806), Ключевыми полевыми проектами (интеллектуальное производство) общих университетов провинции Гуандун (2020ZDZX2057) и Научно-исследовательскими проектами (характерные инновации) общего Университеты провинции Гуандун (2019KTSCX195).
Материалы
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Ссылки
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены