Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Orta Serebral Arter Oklüzyonu Reperfüzyonu için Modifiye Bir Model Hazırlığı
Bu Makalede
Özet
Bu protokol, ortak karotis arter yoluyla orta serebral arter oklüzyonu reperfüzyonu için hazırlık sürecini tanımlar.
Özet
Orta serebral arter oklüzyonu reperfüzyon (MCAO/R) modeli, inmenin patolojik mekanizmalarının anlaşılması ve ilaç geliştirilmesi için çok önemlidir. Bununla birlikte, yaygın olarak kullanılan modelleme yöntemleri arasında, Koizumi yöntemi, ortak karotis arterin (CCA) ligasyonu ve yeterli reperfüzyon elde edememesi nedeniyle sıklıkla incelemeyle karşı karşıyadır. Benzer şekilde, Longa yöntemi, dış karotis arterin (ECA) bağlantısını kesmek ve bağlamak için eleştirilmiştir. Bu çalışma, ECA'nın bütünlüğünü koruyan, CCA'dan monofilament naylon sütürün sokulmasını, bağlanmış CCA insizyonunun onarılmasını ve CCA'dan reperfüzyonun sürdürülmesini içeren modifiye bir model hazırlama yöntemini tanıtmayı amaçlamaktadır. Kan akımının reperfüzyonu, lazer benek akışı görüntüleme kullanılarak doğrulandı. Longa ölçeği, Modifiye Nörolojik Şiddet Skoru, trifeniltetrazolyum klorür (TTC) boyaması ve nöronların immünofloresan etiketlemesi gibi değerlendirme yöntemleri, bu yaklaşımın stabil iskemik sinir hasarına neden olabileceğini göstermiştir. Bu modifiye MCAO/R model protokolü basit ve stabil olup, serebral iskemi alanındaki uygulayıcılar için değerli rehberlik sağlar.
Giriş
Dünya Sağlık Örgütü'ne göre, inme, yüksek insidans oranı, yüksek mortalite ve yüksek sakatlık oranı 1,2 ile son on yılda dünya çapında ikinci önde gelen ölüm nedeni olmaya devam etmiştir. Küresel nüfus yaşlandıkça, gelişmekte olan ülkelerde inme insidansının artması ve potansiyel olarak yetişkinlerde erken ölüm ve sakatlığın önde gelen nedeni haline gelmesi beklenmektedir. Ek olarak, felçlerin daha genç yaşta ortaya çıkma eğilimi vardır3. Felç sonrası iş gücü kaybı da ailelere ve topluma ağır bir yük getirmektedir4. Bu nedenle, güvenli ve etkili tedavilerin geliştirilmesi inme araştırmalarında büyük bir zorluk teşkil etmektedir.
Hayvan modelleri, insan hastalıklarının önlenmesi ve tedavisini incelemek için çok önemli araçlar olarak hizmet eder. İnme tedavi stratejilerinin başarılı çevirisi, inme hayvan modellerinintekrarlanabilirliğine ve güvenilirliğine dayanır 5,6. Orta serebral arter (MCA), klinik inme için yaygın bir bölgedir ve MCAO modelini insan iskemik inmeye en yakın model yapar. Sütür yöntemi kullanılarak hazırlanan MCAO modeli, kraniyotomi olmaması ve iskemik zamanın kolay kontrol edilebilmesi gibi avantajları nedeniyle araştırmacılar tarafından tercih edilmiştir. Nöroprotektif deneylerin %40'ından fazlasında kullanılmıştır7. Bununla birlikte, sayısız avantajına rağmen, bu modelin operasyonel detayları birçok araştırmacı için tartışmalı bir konu olmaya devam etmektedir.
Dikişe bağlı orta serebral arter tıkanıklığı (MCAO) modeli için reperfüzyon, dikişin geri çekilmesiyle gerçekleşir. Şu anda, sütür yerleştirme için iki ana yöntem kullanılmaktadır: Koizumi'nin yöntemi8 ve Longa'nın yöntemi9. Koizumi'nin yönteminde sütür, internal karotis artere (ICA) esas olarak ortak karotis arter (CCA) insizyonundan girerken, Longa'nın yönteminde kopmuş dış karotis arterden (ECA) ICA'ya geçer. Reperfüzyon sırasında, Koizumi yöntemi CCA insizyonunun kalıcı olarak bağlanmasını gerektirir ve reperfüzyon10 için Willis çemberine dayanır. Bununla birlikte, bazı çalışmalar, etkili reperfüzyonun, CCA arzını kaybettikten sonra yalnızca Willis çemberinin telafi edici arzı yoluyla elde edilemeyeceğini göstermektedir. Ayrıca, Willis çemberi, özellikle C57Bl / 6 farelerinde yüksek anatomik değişkenlik sergiler, enfarktüs değişkenliğini arttırır ve deneysel veri güvenilirliğini azaltır. Sonuç olarak, bu yöntem araştırmacılar tarafından giderek daha fazla sorgulanmaya başlanmıştır11.
Longa'nın yöntemi, kopmuş ECA'dan bir sütür yerleştirilmesini ve ardından sütür çekildikten sonra internal karotis arterin (ICA) kalıcı olarak bağlanmasını içerir. Bu, CCA açıklığını koruyarak başlangıç değerlerinin% 100'üne kadar kan perfüzyonuna izin verir. Ancak bu yöntemde eksternal karotis arter ile küçük arter dallarının ayrılması, kesilmesi veya elektrokoagüle edilmesi işlemi zorlaştırmaktadır. Aynı zamanda beynin tam kan akış yapısını bozar, bu da klinik hastanın durumundanfarklıdır 12. Önemli olarak, çalışmalar, ECA'nın kesilmesinin veya bağlanmasının çiğneme ve yutmayı kontrol eden kaslarda iskemik lezyonlara neden olabileceğini, hayvan diyetini etkileyebileceğini ve sıçanlarda postoperatif hayvan ölümüne ve ciddi duyusal ve motor hasara yol açabileceğini göstermektedir13,14.
Bu nedenle, bu sorunları ele almak için acilen değiştirilmiş bir model hazırlama yöntemine ihtiyaç vardır. Bu çalışma, CCA yerleştirme insizyonunu onaran ve etkili reperfüzyon sağlayan modifiye bir MCAO modelleme yöntemini tanıtmaktadır. Prosedür basit, pratik ve uygulanabilir olup, önemli nörolojik hasara ve tekrarlanabilir enfarktüs lezyonlarına neden olur ve inme araştırmacıları için değerli rehberlik sağlar.
Protokol
Deney protokolü, Chengdu Geleneksel Çin Tıbbı Üniversitesi'nde Laboratuvar Hayvanlarının Kullanımı ve Kurumsal Hayvan Bakımı ve Kullanımı Komitesi yönergelerine uygun olarak yürütülmüştür (Kayıt numarası: 2019-DL-002). Tüm hayvan araştırma verileri, ARRIVE (Hayvan Araştırmaları: İn Vivo Deneylerin Raporlanması) yönergelerine göre belgelenmiştir. Bu çalışma için 250 g ± 20 g ağırlığında ve 6-8 haftalık erkek Sprague Dawley (SD) sıçanları kullanıldı. Kullanılan hayvanlar, reaktifler ve ekipmanla ilgili ayrıntılar Malzeme Tablosunda listelenmiştir.
1. Hayvan hazırlama
- Zoletil 50 (50 mg / kg, IM) ve Ksilazin Hidroklorür (40 mg / kg, IP) kullanarak sıçanlarda derin anesteziyi indükleyin ve koruyun. Cerrahi prosedür boyunca bir ısıtma yastığına bağlı bir rektal prob kullanarak vücut sıcaklığının 37 ± 0,5 °C'de tutulduğundan emin olun. Kurumasını önlemek için farenin gözlerine veteriner merhemi sürün.
- Sıçanların baş ve boynundan saçları tıraş edin. Baş ve boyundaki tüyleri çıkarmak için tüy dökücü krem kullanın, ardından kremi normal tuzlu suyla yıkayın. Steril pamuk topları kullanarak üç kez etanol ve povidon-iyot uygulayarak cerrahi bölgedeki cildi dezenfekte edin.
- Bir neşter kullanarak sıçan kafasının ortasında sagital sütür yönü boyunca 2 cm'lik bir kesi yapın ve kafatasını kaplayan kasları dikkatlice çıkarın.
- Bir kafatası matkabı kullanarak farenin iskemik tarafındaki kafatasını inceltin. Öğütme işlemi sırasında soğumak ve kalıntıları temizlemek için normal tuzlu su kullanın. Lazer benek kontrast görüntüleme (LSCI) kullanarak sıçanların temel kan akışını kaydedin.
- Steril pamuk topları kullanarak boynun derisine üç kez etanol ve povidon-iyot uygulayın. Cerrahi bir bıçak kullanarak boynun orta hattı boyunca 2 cm'lik bir kesi yapın. Cildi ve tükürük bezlerini yanal olarak geri çekmek, sternokleidomastoid ve servikal kasları açığa çıkarmak için ekartörler kullanın.
- Karotis bölgesini ortaya çıkarmak için sternokleidomastoid ve servikal kasları ayırın. Ortak karotis arter (CCA), internal karotis arter (ICA) ve dış karotis arterin (ECA) vasküler anatomisini tanımlayın. Vasküler anatomiye dayanarak, CCA'nın yanı sıra CCA'dan türetilen ECA ve ICA15'i ayırın.
NOT: Sıçanın anatomik yapısı, CCA bölgesinin esas olarak sternokleidomastoid ve servikal kaslarla kaplı olduğunu ve CCA'dan türetilen ICA ve ECA ile birlikte olduğunu gösterir. Ayırma CCA'yı açığa çıkardıktan sonra, CCA boyunca ICA ve ECA'yı temsil eden Y şeklinde bir çatal görülebilir. CCA'ya paralel uzanan vagus sinirine zarar vermemek için dikkatli olun.
2. MCA'nın tıkanması
- Kan akışını geçici olarak engellemek için 3-0 ipek iplik kullanarak dış karotis arter (ECA) ve ortak karotis arter (CCA) üzerine kolayca çözülen bir düğüm atın. CCA'nın üzerine ilk düğümden yaklaşık 0.5 cm uzakta bir damar klipsi yerleştirin.
- 5 mL'lik bir şırınganın iğnesini siyaha boyayın. Siyaha boyanmış iğneyi kullanarak CCA'da küçük bir delik oluşturun ve iğne deliklerini siyah olarak işaretleyin.
- Monofilament naylon sütürü siyah işaretten CCA'ya yerleştirin. Vasküler klipsi açın ve naylon teli hafif bir dirençle durana kadar Dahili Karotis Arterine (ICA) yönlendirin. Monofilament naylon ipliği arterin içinde yerinde tutmak için ikinci düğümü güvenli bir şekilde sıkın ve blokaj konumundan yer değiştirmesini önleyin.
- Bu noktada iskemi zamanını not edin ve LSCI kullanarak iskemik taraftaki kan akış değerini ölçün. Analjezi ve yara kapanması için boyun yarasına bupivakain damlaları uygulayın. Anestezi maskesini çıkarın ve farenin iyileşmesine izin verin.
NOT: Monofilament naylon sütür ICA'ya girmekte zorluk çekiyorsa, hafifçe geri çekin ve tekrar takmayı deneyin.
3. MCAO'nun Reperfüzyonu
- 90 dakikalık iskeminin ardından, sıçanları izofluran ile yeniden uyuşturun. LSCI kullanarak iskemik taraftan serebral kan akışını ölçün ve monofilament naylon sütürün kaymadığından emin olun.
- Kan reperfüzyonuna izin vermek için dış karotis arter (ECA) üzerindeki düğümleri çözün. Ortak karotis arter (CCA) üzerindeki düğümü serbest bırakın, monofilament ipliği sabitleyin ve dikişi geri çekin. Kanamayı önlemek için sabit monofilament sütürün önüne vasküler bir klips uygulayın.
- İlk CCA düğümünü vasküler bir klipsle değiştirin. Damar kesisini yana doğru döndürmek için cımbız kullanın (Şekil 1). Kesi cımbızla kelepçeleyin ve kesiği onarmak için 6-0 iplik kullanarak bağlayın. Vasküler klipsi çıkarın, sızıntı olup olmadığını kontrol edin ve tam reperfüzyonu onaylayın (Video 1).
NOT: CCA darlığına yol açabilecek aşırı damar klemplenmesini önlemek için insizyonu onarmak için ligasyon yapın. - Başarılı reperfüzyonu doğrulamak için insizyon ligasyonundan sonra LSCI kullanarak serebral kortikal kan akışı değerlerini kaydedin. Boyun kesisini dikişlerle kapatın ve enfeksiyon ve dehidrasyonu önlemek için 1.000.000 ünite penisilin ve 2 mL salin uygulayın.
- Sıçanlar bilincini geri kazanana kadar sıcaklığı koruyun. Ameliyat sonrası yumuşak yiyecekler verin ve hayvanların yaşamsal belirtilerini izleyin.
4. Sinir fonksiyonunun ve serebral iskemik hasarın değerlendirilmesi
- Sıçanlar tamamen uyandıktan sonra, sinirsel işlevleri, hayvan gruplamasından habersiz araştırmacılar tarafından değerlendirilecektir. Tüm sıçanların nörolojik fonksiyonunu değerlendirmek için Longa skoru ölçeğini (Tablo 1) ve modifiye nörolojik şiddet skoru (mNSS) ölçeğini (Tablo 2) kullanın.
- Ameliyattan 24 saat sonra, sıçanları izofluran kaynaklı anestezi altında (4 L / dak oksijende% 4 izofluran) servikal dislokasyon16 yoluyla (kurumsal olarak onaylanmış protokolleri izleyerek) ötenazi yapın. Kalan kanı çıkarmak için beyni buzlu suyla durulayın.
- Beyin dokusunu 5 bölüme ayırın ve TTC ile boyayın. Beyin dokusu dilimlerinin her iki tarafının görüntülerini yakalayın, Image J yazılımını kullanarak ön ve arka tarafların iskemik alanını ölçün ve aşağıdaki formülü kullanarak enfarktüs oranını hesaplayın:
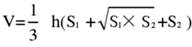
NOT: S1 ve S2 , sırasıyla beyin dilimlerinin proksimal ön beyin ve proksimal beyin sapı taraflarının enfarktüs alanını temsil eder. Her beyin diliminin enfarktüs alanı, h'nin beyin diliminin kalınlığını temsil ettiği Swanson formülü kullanılarak düzeltilir. Yazar tarafından daha önce önceki araştırma17'de özetlenen bu formül, enfarktüs lezyon boyutunun daha doğru bir şekilde hesaplanmasına izin verir. - Modelin başarı oranını ve kararlılığını değerlendirmek için istatistiksel ve grafik yazılımı kullanarak verileri analiz edin.
- Sıçanlarda kortikal nöronları etiketlemek için immünofloresan yöntemini kullanın ve bu yöntemin neden olduğu nöronal hasarı daha da doğrulayın. Sıçanlarda 24 saatlik iskemi-reperfüzyondan sonra, beyin dokusu elde etmek için önceden soğutulmuş PBS kullanılarak kardiyak perfüzyon yapıldı.
- Beyin dokusunu bölümlere ayırın ve dondurun. Olgunlaşmamış nöronal belirteç Doublecortin (DCX)18, nöronal çekirdek belirteci Nöronal Çekirdekler (NeuN)18 ve nöron dendritik belirteç Mikrotübül ile ilişkili protein-2 (MAP-2)19 gibi nöronal antikorları kullanın. Lazer konfokal mikroskopi kullanarak iskemik nöronların ekspresyonunu gözlemleyin.
Sonuçlar
Lazer benek akımı görüntüleme, monofilament naylon sütürün tıkanmasından önce orta serebral arter (MCA) bölgesinde bol miktarda kan akımı olduğunu gösterdi ve sıçanların başlangıç kan akış değerleri kaydedildi. MCA'nın tıkanmasını takiben, beynin iskemik tarafındaki kan akış değeri hızla azaldı. Sütür çekilmeden önce, iskemik taraftaki kan akış değerleri, sütürün MCA'yı tıkayıp tıkamadığını doğrulamak için tekrar kontrol edildi. Sonuçlar kan akışında sadece hafif...
Tartışmalar
Monofilament naylon sütür ile indüklenen orta serebral arter oklüzyonu (MCAO) modeli, MCAO modellerinin hazırlanmasında kullanılan en yaygın yöntemdir. Bu yaklaşım klinik öncesi çalışmalarda yaygın olarak benimsenmiştir ve basitliği, kraniyotomi ihtiyacının olmaması, minimal cerrahi travma ve reperfüzyon elde etme yeteneği nedeniyle birçok uygulayıcı tarafından kabul görmüştür.
İntraluminal filament MCAO için iki klasik cerrahi teknik vardır: Koizumi yöntemi<...
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82173781 ve 82373835), Doktora Sonrası araştırma projesi (BKS212055), Foshan Bilim ve Teknoloji Bürosu Bilim ve Teknoloji İnovasyon Projesi (2320001007331), Guangdong Temel ve Uygulamalı Temel Araştırma Vakfı (2019A1515010806), Guangdong Eyaletindeki Genel Üniversitelerin Anahtar Alan Projeleri (Akıllı Üretim) (2020ZDZX2057) ve Genel Bilimsel Araştırma Projeleri (Karakteristik Yenilik) tarafından desteklenmiştir. Guangdong Eyaletindeki Üniversiteler (2019KTSCX195).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Referanslar
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır