Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine modifizierte Modellpräparation für die Reperfusion des Verschlusses der mittleren Hirnarterie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt den Prozess der Vorbereitung auf die Reperfusion des Verschlusses der mittleren Hirnarterie über die Arteria carotis communis.
Zusammenfassung
Das Modell der Reperfusion des Verschlusses der mittleren Hirnarterie (MCAO/R) ist entscheidend für das Verständnis der pathologischen Mechanismen des Schlaganfalls und für die Entwicklung von Medikamenten. Unter den häufig verwendeten Modellierungsmethoden wird die Koizumi-Methode jedoch häufig unter die Lupe genommen, da sie die Halsschlagader (CCA) ligiert und nicht in der Lage ist, eine angemessene Reperfusion zu erreichen. In ähnlicher Weise wurde die Longa-Methode dafür kritisiert, dass sie die Arteria carotis externa (ECA) trennt und ligiert. Diese Studie zielt darauf ab, eine modifizierte Modellvorbereitungsmethode einzuführen, die die Integrität der ECA bewahrt, das Einführen einer monofilen Nylonnaht durch die CCA, die Reparatur des ligierten CCA-Schnitts und die Aufrechterhaltung der Reperfusion aus der CCA beinhaltet. Die Reperfusion des Blutflusses wurde mit Hilfe der Laser-Speckle-Flow-Bildgebung bestätigt. Bewertungsmethoden wie die Longa-Skala, der Modified Neurological Severity Score, die Färbung von Triphenyltetrazoliumchlorid (TTC) und die Immunfluoreszenzmarkierung von Neuronen zeigten, dass dieser Ansatz eine stabile Schädigung des ischämischen Nervs induzieren kann. Dieses modifizierte MCAO/R-Modellprotokoll ist einfach und stabil und bietet Praktikern eine wertvolle Orientierungshilfe auf dem Gebiet der zerebralen Ischämie.
Einleitung
Nach Angaben der Weltgesundheitsorganisation ist der Schlaganfall in den letzten zehn Jahren die zweithäufigste Todesursache weltweit geblieben, mit einer hohen Inzidenzrate, einer hohen Sterblichkeit und einer hohen Behinderungsrate 1,2. Mit der Alterung der Weltbevölkerung wird erwartet, dass die Inzidenz von Schlaganfällen in den Entwicklungsländern zunehmen wird und möglicherweise zur Hauptursache für vorzeitigen Tod und Behinderung bei Erwachsenen wird. Darüber hinaus gibt es einen Trend, dass Schlaganfälle in einem jüngeren Alter auftreten3 Jahre. Auch der Verlust der Erwerbsbevölkerung nach einem Schlaganfall stellt eine schwere Belastung für Familien und die Gesellschaftdar 4. Daher stellt die Entwicklung sicherer und wirksamer Therapien eine große Herausforderung in der Schlaganfallforschung dar.
Tiermodelle dienen als wichtige Werkzeuge für die Untersuchung der Prävention und Behandlung menschlicher Krankheiten. Die erfolgreiche Umsetzung von Schlaganfallbehandlungsstrategien hängt von der Reproduzierbarkeit und Zuverlässigkeit von Schlaganfall-Tiermodellen ab 5,6. Die mittlere Hirnarterie (MCA) ist eine häufige Stelle für klinische Schlaganfälle, was das MCAO-Modell zum Modell macht, das dem menschlichen ischämischen Schlaganfall am nächsten kommt. Das MCAO-Modell, das mit der Nahtmethode hergestellt wurde, wurde von Forschern aufgrund von Vorteilen wie dem Fehlen eines Kraniotomie und der einfachen Kontrolle der ischämischen Zeit bevorzugt. Es wurde in über 40 % der neuroprotektiven Experimente eingesetzt7. Trotz seiner zahlreichen Vorteile bleiben die operationellen Details dieses Modells für viele Forscher ein umstrittenes Thema.
Beim Modell des nahtinduzierten Verschlusses der mittleren Hirnarterie (MCAO) erfolgt die Reperfusion durch Zurückziehen der Naht. Derzeit werden zwei Hauptmethoden für das Einführen von Nähten verwendet: Koizumis Methode8 und die Methode9 von Longa. Bei der Koizumi-Methode tritt die Naht hauptsächlich durch den Schnitt der Arteria carotis communis (CCA) in die Arteria carotis interna (ICA) ein, während sie bei der Longa-Methode durch die durchtrennte Arteria carotis externa (ECA) in die ICA gelangt. Während der Reperfusion erfordert die Koizumi-Methode eine dauerhafte Ligatur der CCA-Inzision und stützt sich für die Reperfusion auf den Willis-Kreis10. Einige Studien deuten jedoch darauf hin, dass eine effektive Reperfusion nicht allein durch die kompensatorische Versorgung des Willis-Kreises nach Verlust der CCA-Versorgung erreicht werden kann. Darüber hinaus weist der Willis-Kreis eine hohe anatomische Variabilität auf, insbesondere bei C57Bl/6-Mäusen, was die Infarktvariabilität erhöht und die Zuverlässigkeit der experimentellen Daten verringert. Infolgedessen wurde diese Methode von Forschern zunehmend in Frage gestellt11.
Bei der Longa-Methode wird eine Naht durch die durchtrennte ECA eingeführt und dann die Arteria carotis interna (ICA) dauerhaft ligiert, sobald die Naht gezogen wird. Dadurch bleibt die CCA-Durchgängigkeit erhalten und eine Blutperfusion von bis zu 100 % der Ausgangswerte möglich. Bei dieser Methode müssen jedoch die Arteria carotis externa und die kleinen arteriellen Äste getrennt, abgeschnitten oder elektrokoaguliert werden, was den Eingriff zu einer Herausforderung macht. Es stört auch die gesamte Blutflussstruktur des Gehirns, die sich vom klinischen Zustand des Patienten unterscheidet12. Wichtig ist, dass Studien darauf hinweisen, dass das Schneiden oder Ligatieren der ECA ischämische Läsionen in den Muskeln verursachen kann, die das Kauen und Schlucken steuern, die Ernährung der Tiere beeinträchtigen und bei Ratten zum postoperativen Tod der Tiere und zu schweren sensorischen und motorischen Schäden führenkönnen 13,14.
Daher ist eine modifizierte Modellvorbereitungsmethode dringend erforderlich, um diese Probleme zu lösen. In dieser Studie wird eine modifizierte MCAO-Modellierungsmethode vorgestellt, die den CCA-Insertionsschnitt repariert und eine effektive Reperfusion erzielt. Das Verfahren ist einfach, praktisch und durchführbar, führt zu erheblichen neurologischen Schäden und replizierbaren Infarktläsionen und bietet Schlaganfallforschern eine wertvolle Orientierungshilfe.
Protokoll
Das Versuchsprotokoll wurde in Übereinstimmung mit den Richtlinien des Ausschusses für die Verwendung von Labortieren und des institutionellen Tierpflege- und -verwendungsausschusses an der Universität für Traditionelle Chinesische Medizin in Chengdu (Aktenzeichen: 2019-DL-002) durchgeführt. Alle Tierforschungsdaten wurden nach den ARRIVE-Richtlinien (Animal Research: Reporting In Vivo Experiments) dokumentiert. Für diese Studie wurden männliche Sprague Dawley (SD) Ratten mit einem Gewicht von 250 g ± 20 g und einem Alter von 6-8 Wochen verwendet. Die Einzelheiten zu den verwendeten Tieren, Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Tiere
- Einleitung und Aufrechterhaltung einer Tiefenanästhesie bei Ratten mit Zoletil 50 (50 mg/kg, IM) und Xylazinhydrochlorid (40 mg/kg, IP). Stellen Sie sicher, dass die Körpertemperatur während des gesamten chirurgischen Eingriffs bei 37 ± 0,5 °C gehalten wird, indem Sie eine Rektalsone verwenden, die mit einem Heizkissen verbunden ist. Tragen Sie Veterinärsalbe auf die Augen der Ratte auf, um ein Austrocknen zu verhindern.
- Rasieren Sie die Haare von Kopf und Hals der Ratten. Verwenden Sie Enthaarungscreme, um das Fell von Kopf und Hals zu entfernen, und waschen Sie die Creme dann mit normaler Kochsalzlösung ab. Desinfizieren Sie die Haut an der Operationsstelle, indem Sie Ethanol und Povidon-Jod dreimal mit sterilen Wattebällchen auftragen.
- Machen Sie mit einem Skalpell einen 2 cm langen Schnitt in der Mitte des Rattenkopfes entlang der Sagittalnaht und entfernen Sie vorsichtig die Muskeln, die den Schädel bedecken.
- Verdünne den Schädel auf der ischämischen Seite der Ratte mit einem Schädelbohrer. Verwenden Sie normale Kochsalzlösung, um sich während des Schleifvorgangs abzukühlen und Ablagerungen zu entfernen. Erfassen Sie den Ausgangsblutfluss der Ratten mit Hilfe der Laser-Speckle-Kontrastbildgebung (LSCI).
- Tragen Sie Ethanol und Povidon-Jod dreimal mit sterilen Wattebällchen auf die Haut des Halses auf. Machen Sie mit einer chirurgischen Klinge einen 2 cm langen Schnitt entlang der Mittellinie des Halses. Verwenden Sie Retraktoren, um die Haut und die Speicheldrüsen seitlich zurückzuziehen und die Sternocleidomastoideus- und Halsmuskulatur freizulegen.
- Trennen Sie die Muskeln sternocleidomastoideus und die Halsmuskulatur, um das Halsschlagadergebiet freizulegen. Identifizieren Sie die vaskuläre Anatomie der Arteria carotis communis (CCA), der Arteria carotis interna (ICA) und der Arteria carotis externa (ECA). Trennen Sie basierend auf der Gefäßanatomie die CCA sowie die von CCA abgeleitete ECA und ICA15.
HINWEIS: Die anatomische Struktur der Ratte deutet darauf hin, dass die CCA-Region hauptsächlich von den Muskeln sternocleidomastoideus und der Halsmuskulatur bedeckt ist, wobei die ICA und ECA von der CCA abgeleitet sind. Nachdem die Trennung den CCA freigelegt hat, ist eine Y-förmige Gabel entlang des CCA zu sehen, die den ICA und den ECA darstellt. Seien Sie vorsichtig, um den Vagusnerv, der parallel zum CCA verläuft, nicht zu beschädigen.
2. Okklusion des MCA
- Binden Sie einen leicht zu entwirrenden Knoten über die Arteria carotis externa (ECA) und die Arteria carotis communis (CCA) mit einem 3-0 Seidenfaden, um den Blutfluss vorübergehend zu blockieren. Positionieren Sie einen Gefäßclip ca. 0,5 cm vom ersten Knoten entfernt auf dem CCA.
- Färben Sie die Nadel einer 5-ml-Spritze schwarz. Machen Sie mit der schwarz gefärbten Nadel einen kleinen Einstich in den CCA und markieren Sie die Nadellöcher in schwarz.
- Führen Sie das monofile Nylonnaht durch die schwarze Markierung in das CCA ein. Öffnen Sie den Gefäßclip und führen Sie den Nylondraht in die Arteria carotis interna (ICA), bis er mit leichtem Widerstand anhält. Ziehen Sie den zweiten Knoten fest an, um die monofile Nylonnaht in der Arterie an Ort und Stelle zu halten und ein Verschieben aus der Blockierposition zu verhindern.
- Notieren Sie sich zu diesem Zeitpunkt den Zeitpunkt der Ischämie und messen Sie den Blutflusswert auf der ischämischen Seite mittels LSCI. Verabreichen Sie Tropfen Bupivacain auf die Halswunde zur Analgesie und zum Wundverschluss. Entfernen Sie die Anästhesiemaske und lassen Sie die Ratte sich erholen.
HINWEIS: Wenn das monofile Nylon-Nahtmaterial Schwierigkeiten beim Eindringen in das ICA hat, ziehen Sie es leicht zurück und versuchen Sie erneut, es einzuführen.
3. Reperfusion von MCAO
- Nach 90 Minuten Ischämie betäuben Sie die Ratten erneut mit Isofluran. Messen Sie den zerebralen Blutfluss von der ischämischen Seite mit LSCI und stellen Sie sicher, dass sich die monofile Nylonnaht nicht verschoben hat.
- Löse die Knoten an der Arteria carotis externa (ECA), um eine Blutreperfusion zu ermöglichen. Lösen Sie den Knoten an der Arteria carotis communis (CCA), befestigen Sie die monofile Naht und ziehen Sie die Naht zurück. Legen Sie einen Gefäßclip vor die feste monofile Naht, um Blutungen zu vermeiden.
- Ersetzen Sie den ersten CCA-Knoten durch einen Gefäßclip. Drehen Sie den Gefäßschnitt mit einer Pinzette seitlich (Abbildung 1). Klemmen Sie den Schnitt mit einer Pinzette und ligieren Sie ihn mit einem 6-0-Faden, um den Schnitt zu reparieren. Entfernen Sie den Gefäßclip, prüfen Sie, ob er undicht ist, und bestätigen Sie die vollständige Reperfusion (Video 1).
HINWEIS: Führen Sie eine Ligatur durch, um den Schnitt zu reparieren und eine übermäßige Gefäßklemmung zu vermeiden, die zu einer CCA-Stenose führen könnte. - Zeichnen Sie die Werte des zerebralen kortikalen Blutflusses mit LSCI nach der Inzisionsligatur auf, um eine erfolgreiche Reperfusion zu bestätigen. Schließen Sie den Halsschnitt mit Nähten und verabreichen Sie 1.00.000 Einheiten Penicillin und 2 ml Kochsalzlösung, um Infektionen und Dehydrierung zu verhindern.
- Halten Sie die Wärme aufrecht, bis die Ratten wieder zu Bewusstsein kommen. Bieten Sie nach der Operation weiches Futter an und überwachen Sie die Vitalfunktionen der Tiere.
4. Beurteilung der Nervenfunktion und der zerebralen ischämischen Schädigung
- Sobald die Ratten vollständig erwacht sind, wird ihre neuronale Funktion von Forschern bewertet, die die Tiergruppe nicht kennen. Verwenden Sie die Longa-Score-Skala (Tabelle 1) und die modifizierte mNSS-Skala (Severity Score) (Tabelle 2), um die neurologische Funktion aller Ratten zu bewerten.
- Nach 24 Stunden nach der Operation werden die Ratten unter Isofluran-induzierter Anästhesie (4 % Isofluran bei 4 l/min Sauerstoff) mittels Zervixdislokation16 eingeschläfert (gemäß den institutionell anerkannten Protokollen). Spülen Sie das Gehirn mit Eiswasser ab, um das restliche Blut zu entfernen.
- Teilen Sie das Hirngewebe in 5 Abschnitte und färben Sie diese mit TTC. Nehmen Sie Bilder von beiden Seiten der Hirngewebeschnitte auf, messen Sie den ischämischen Bereich der Vorder- und Rückseite mit der Image J-Software und berechnen Sie die Infarktrate mit der folgenden Formel:
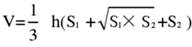
HINWEIS: S1 und S2 stellen den Infarktbereich des proximalen Vorderhirns bzw. der proximalen Hirnstammseite der Hirnschnitte dar. Die Infarktfläche jedes Hirnschnitts wird mit der Swanson-Formel korrigiert, wobei h die Dicke des Hirnschnitts darstellt. Diese Formel, die der Autor bereits in früheren Forschungen17 skizziert hat, ermöglicht eine genauere Berechnung der Größe der Infarktläsion. - Analysieren Sie die Daten mit Hilfe von Statistik- und Grafiksoftware, um die Erfolgsquote und Stabilität des Modells zu bewerten.
- Die Immunfluoreszenzmethode wird zur Markierung kortikaler Neuronen bei Ratten eingesetzt, um die durch diese Methode verursachten neuronalen Schäden weiter zu validieren. Nach 24 Stunden Ischämie-Reperfusion bei Ratten wurde eine Herzperfusion mit vorgekühltem PBS durchgeführt, um Hirngewebe zu gewinnen.
- Betten Sie das Hirngewebe ein und frieren Sie es in Abschnitte ein. Verwenden Sie neuronale Antikörper wie den unreifen neuronalen Marker Doublecortin (DCX)18, den neuronalen Kernmarker Neuronale Kerne (NeuN)18 und den dendritischen Neuronenmarker Microtubuli-associated protein-2 (MAP-2)19. Beobachten Sie die Expression ischämischer Neuronen mit der konfokalen Lasermikroskopie.
Ergebnisse
Die Laser-Speckle-Flow-Bildgebung zeigte, dass vor dem Verschluss der monofilen Nylonnaht ein reichlicher Blutfluss im Bereich der mittleren Hirnarterie (MCA) vorhanden war, und die Ausgangswerte des Blutflusses der Ratten wurden aufgezeichnet. Nach dem Verschluss des MCA nahm der Blutflusswert auf der ischämischen Seite des Gehirns rapide ab. Vor dem Ziehen der Naht wurden die Blutflusswerte auf der ischämischen Seite erneut überprüft, um zu bestätigen, ob die Naht das MCA verschließt. Die Ergebnisse zeigten nur e...
Diskussion
Das Modell des Verschlusses der mittleren Hirnarterie (MCAO), das durch eine monofile Nylonnaht induziert wird, ist die gebräuchlichste Methode zur Vorbereitung von MCAO-Modellen. Dieser Ansatz wird in präklinischen Studien häufig übernommen und hat aufgrund seiner Einfachheit, der fehlenden Notwendigkeit einer Kraniotomie, des minimalen chirurgischen Traumas und der Fähigkeit, eine Reperfusion zu erreichen, von vielen Praktikern Anerkennung gefunden.
Es gibt zwei klassische Operationstec...
Offenlegungen
Nichts.
Danksagungen
Diese Arbeit wurde unterstützt von der National Natural Science Foundation of China (82173781 und 82373835), dem Postdoktoranden-Forschungsprojekt (BKS212055), dem Science and Technology Innovation Project des Foshan Science and Technology Bureau (2320001007331), der Guangdong Basic and Applied Basic Research Foundation (2019A1515010806), Key Field Projects (Intelligent Manufacturing) der General Universities in der Provinz Guangdong (2020ZDZX2057) und den Scientific Research Projects (Charakteristische Innovation) der General Universitäten in der Provinz Guangdong (2019KTSCX195).
Materialien
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Referenzen
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten