JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
중뇌동맥 폐색 재관류를 위한 수정된 모델 준비
요약
이 프로토콜은 총경동맥을 통한 중뇌동맥 폐색 재관류를 준비하는 과정을 설명합니다.
초록
중뇌동맥 폐색 재관류(MCAO/R) 모델은 뇌졸중의 병리학적 메커니즘을 이해하고 약물 개발에 매우 중요합니다. 그러나 일반적으로 사용되는 모델링 방법 중 Koizumi 방법은 총경동맥(CCA)의 결찰과 적절한 재관류를 달성할 수 없기 때문에 종종 면밀한 조사에 직면합니다. 마찬가지로, Longa 방법은 외부 경동맥(ECA)을 분리하고 결찰하는 것에 대해 비판을 받았습니다. 이 연구는 ECA의 무결성을 보존하고, CCA를 통해 모노필라멘트 나일론 봉합사를 삽입하고, 결찰된 CCA 절개를 복구하고, CCA로부터 재관류를 유지하는 수정된 모델 준비 방법을 소개하는 것을 목표로 합니다. 혈류의 재관류는 레이저 스페클 플로우 이미징을 사용하여 확인되었습니다. Longa 척도, Modified Neurological Severity Score, 트리페닐테트라졸륨 클로라이드(TTC) 염색 및 뉴런의 면역형광 표지와 같은 평가 방법은 이 접근법이 안정적인 허혈성 신경 손상을 유도할 수 있음을 입증했습니다. 이 수정된 MCAO/R 모델 프로토콜은 간단하고 안정적이어서 뇌허혈 분야의 실무자에게 귀중한 지침을 제공합니다.
서문
세계보건기구(WHO)에 따르면 뇌졸중은 지난 10년 동안 전 세계적으로 두 번째로 큰 사망 원인으로 남아 있으며 높은 발병률, 높은 사망률 및 높은 장애율을 보이고 있습니다 1,2. 전 세계 인구가 고령화됨에 따라 개발도상국에서 뇌졸중 발병률이 증가할 것으로 예상되며, 이는 잠재적으로 성인의 조기 사망 및 장애의 주요 원인이 될 수 있습니다. 또한 뇌졸중은3세의 젊은 나이에 발생하는 경향이 있습니다. 뇌졸중 후 노동력의 상실은 가족과 사회에 큰 부담을 준다4. 따라서 안전하고 효과적인 치료법의 개발은 뇌졸중 연구에서 중요한 과제가 되고 있습니다.
동물 모델은 인간 질병의 예방 및 치료를 연구하기 위한 중요한 도구 역할을 합니다. 뇌졸중 치료 전략의 성공적인 전환은 뇌졸중 동물 모델 5,6의 재현성과 신뢰성에 달려 있다. 중뇌동맥(MCA)은 임상적 뇌졸중의 흔한 부위이므로 MCAO 모델은 인간 허혈성 뇌졸중에 가장 가까운 모델입니다. 봉합법을 사용하여 제조된 MCAO 모델은 개두술이 없고 허혈 시간을 쉽게 제어할 수 있다는 장점으로 인해 연구자들에 의해 선호되었습니다. 신경 보호 실험의 40% 이상에서 활용되었습니다7. 그러나 수많은 장점에도 불구하고 이 모델의 운영 세부 사항은 많은 연구자들에게 논란의 여지가 있는 주제로 남아 있습니다.
봉합사 유도 중뇌동맥 폐색(MCAO) 모델의 경우 봉합사를 빼냄으로써 재관류가 발생합니다. 현재 봉합사 삽입에는 Koizumi의 방법8 과 Longa의 방법9의 두 가지 주요 방법이 사용됩니다. 고이즈미의 방법에서는 봉합사가 주로 총경동맥(CCA) 절개를 통해 내경동맥(ICA)으로 들어가는 반면, Longa의 방법은 절단된 외부 경동맥(ECA)을 통해 ICA로 들어갑니다. 재관류 중 Koizumi 방법은 CCA 절개를 영구적으로 결찰해야 하며 재관류를 위해 Willis 서클10에 의존합니다. 그러나 일부 연구에서는 CCA 공급을 잃은 후 Willis 서클의 보상 공급만으로는 효과적인 재관류를 달성할 수 없다고 제안합니다. 더욱이, Willis 서클은 특히 C57Bl/6 마우스에서 높은 해부학적 변동성을 나타내어 경색 변동성을 증가시키고 실험 데이터 신뢰성을 감소시킵니다. 결과적으로, 이 방법은 연구자들에 의해 점점 더 의문시되고 있다11.
Longa의 방법은 절단된 ECA를 통해 봉합사를 삽입한 다음 봉합사를 빼낸 후 내부 경동맥(ICA)을 영구적으로 결찰하는 것입니다. 이렇게 하면 CCA 개통성이 보존되어 기준선 값의 최대 100%까지 혈액 관류가 가능합니다. 그러나 이 방법은 외부 경동맥과 작은 동맥 가지를 분리하거나 절단하거나 전기 응고를 해야 하기 때문에 시술이 까다롭습니다. 또한 뇌의 전체 혈류 구조를 방해하는데, 이는 임상 환자의 상태와 다르다12. 중요한 것은, 연구에 따르면 ECA를 절단하거나 결찰하는 것은 씹고 삼키는 것을 제어하는 근육에 허혈성 병변을 일으켜 동물 식단에 영향을 미치고 쥐에서 수술 후 동물 죽음과 심각한 감각 및 운동 손상을 유발할 수 있습니다13,14.
따라서 이러한 문제를 해결하기 위해 수정된 모델 준비 방법이 시급히 필요합니다. 본 연구에서는 CCA 삽입 절개를 복구하고 효과적인 재관류를 달성하는 수정된 MCAO 모델링 방법을 소개합니다. 이 시술은 간단하고 실용적이며 실현 가능하여 심각한 신경학적 손상과 복제 가능한 경색 병변을 유발하고 뇌졸중 연구자에게 귀중한 지침을 제공합니다.
프로토콜
실험 프로토콜은 Chengdu University of Traditional Chinese Medicine(기록 번호: 2019-DL-002)의 실험 동물 사용 및 기관 동물 관리 및 사용 위원회 지침에 따라 수행되었습니다. 모든 동물 연구 데이터는 ARRIVE(Animal Research: Reporting In Vivo Experiments) 지침에 따라 문서화되었습니다. 이 연구에는 체중이 250g ± 20g이고 6-8주가 된 수컷 Sprague Dawley(SD) 쥐가 활용되었습니다. 사용된 동물, 시약 및 장비에 대한 세부 사항은 재료 표에 나열되어 있습니다.
1. 동물 준비
- Zoletil 50(50mg/kg, IM) 및 Xylazine Hydrochloride(40mg/kg, IP)를 사용하여 쥐의 깊은 마취를 유도하고 유지합니다. 수술 절차 내내 가열 패드에 연결된 직장 프로브를 사용하여 체온이 37 ± 0.5 °C로 유지되도록 합니다. 쥐의 눈에 수의학 연고를 바르면 눈이 건조해지는 것을 방지할 수 있습니다.
- 쥐의 머리와 목에서 털을 면도하십시오. 제모 크림을 사용하여 머리와 목의 털을 제거한 다음 생리 식염수로 크림을 씻어냅니다. 멸균 면봉을 사용하여 에탄올과 포비돈-요오드를 3회 도포하여 수술 부위의 피부를 소독합니다.
- 메스를 사용하여 시상 봉합사 방향을 따라 쥐의 머리 중앙을 2cm 절개하고 두개골을 덮고 있는 근육을 조심스럽게 제거합니다.
- 두개골 드릴을 사용하여 쥐의 허혈성 쪽의 두개골을 얇게 만듭니다. 생리 식염수를 사용하여 연삭 과정에서 이물질을 식히고 제거하십시오. 레이저 스페클 콘트라스트 이미징(LSCI)을 사용하여 쥐의 기준선 혈류를 기록합니다.
- 에탄올과 포비돈 요오드를 멸균 면봉을 사용하여 목 피부에 세 번 바릅니다. 수술용 칼날을 사용하여 목의 정중선을 따라 2cm 절개합니다. 견인기를 사용하여 피부와 타액선을 측면으로 당겨 흉쇄유돌근과 경추근을 노출시킵니다.
- 흉쇄유돌근과 경추근을 분리하여 경동맥 영역을 노출시킵니다. 총경동맥(CCA), 내경동맥(ICA) 및 외경동맥(ECA)의 혈관 해부학을 식별합니다. 혈관 해부학적 구조에 따라 CCA와 CCA 유래 ECA 및 ICA15를 분리합니다.
참고: 쥐의 해부학적 구조는 CCA 영역이 주로 흉쇄유돌근과 경추근으로 덮여 있음을 나타내며, ICA와 ECA는 CCA에서 파생됩니다. 분리 시 CCA가 노출된 후 CCA를 따라 ICA 및 ECA를 나타내는 Y자형 포크를 볼 수 있습니다. CCA와 평행하게 뻗어 있는 미주 신경을 손상시키지 않도록 주의하십시오.
2. MCA의 폐색
- 3-0 실크 실을 사용하여 외부 경동맥(ECA)과 총경동맥(CCA)에 쉽게 풀린 매듭을 묶어 혈류를 일시적으로 차단합니다. 첫 번째 매듭에서 약 0.5cm 떨어진 CCA에 용기 클립을 놓습니다.
- 5mL 주사기의 바늘을 검은색으로 염색합니다. 검은색으로 염색된 바늘을 사용하여 CCA에 작은 구멍을 뚫고 핀홀을 검은색으로 표시합니다.
- 모노필라멘트 나일론 봉합사를 블랙 마크를 통해 CCA에 삽입합니다. 혈관 클립을 열고 나일론 와이어를 내부 경동맥(ICA)으로 안내하여 약간의 저항으로 멈출 때까지 합니다. 두 번째 매듭을 단단히 조여 모노필라멘트 나일론 봉합사가 동맥 내부의 제자리에 유지되도록 하여 차단 위치에서 변위를 방지합니다.
- 이 시점에서 허혈 시간을 기록하고 LSCI를 사용하여 허혈 측의 혈류 값을 측정합니다. 진통제와 상처 봉합을 위해 목 상처에 부피바카인 방울을 투여합니다. 마취 마스크를 제거하고 쥐가 회복할 수 있도록 합니다.
알림: 모노필라멘트 나일론 봉합사가 ICA에 들어가는 데 어려움이 있으면 약간 집어넣고 다시 삽입을 시도하십시오.
3. MCAO의 재관류
- 90분의 허혈 후 이소플루란으로 쥐를 다시 마취합니다. LSCI를 사용하여 허혈성 쪽에서 대뇌 혈류를 측정하고 모노필라멘트 나일론 봉합사가 이동하지 않았는지 확인합니다.
- 혈액 재관류를 허용하기 위해 외부 경동맥(ECA)의 매듭을 풉니다. 총경동맥(CCA)의 매듭을 풀고 모노필라멘트 봉합사를 고정한 다음 봉합사를 빼냅니다. 출혈을 방지하기 위해 고정된 모노필라멘트 봉합사 앞에 혈관 클립을 적용합니다.
- 첫 번째 CCA 매듭을 혈관 클립으로 교체합니다. 핀셋을 사용하여 혈관 절개 부위를 옆으로 회전시킵니다(그림 1). 절개 부위를 핀셋으로 고정하고 6-0 실로 결찰하여 절개 부위를 복구합니다. 혈관 클립을 제거하고 누출 여부를 확인하고 완전한 재관류를 확인합니다(비디오 1).
알림: CCA 협착증으로 이어질 수 있는 과도한 혈관 클램프를 피하기 위해 절개 부위를 복구하기 위해 결찰을 수행합니다. - 성공적인 재관류를 확인하기 위해 절개 결찰 후 LSCI를 사용하여 대뇌 피질 혈류 값을 기록합니다. 목 절개 부위를 봉합사로 봉합하고 감염 및 탈수를 방지하기 위해 페니실린 1,00,000 단위와 식염수 2mL를 투여합니다.
- 쥐가 의식을 회복할 때까지 따뜻함을 유지하십시오. 수술 후 부드러운 음식을 제공하고 동물의 활력 징후를 모니터링하십시오.
4. 신경 기능 및 뇌허혈성 손상 평가
- 쥐가 완전히 깨어나면, 동물들의 분류를 모르는 연구자들에 의해 그들의 신경 기능이 평가될 것이다. Longa 점수 척도(표 1)와 수정된 신경학적 중증도 점수(mNSS) 척도(표 2)를 활용하여 모든 쥐의 신경학적 기능을 평가합니다.
- 수술 후 24시간 후, 자궁경부 탈구16(기관에서 승인된 프로토콜에 따름)을 통해 이소플루란 유도 마취(4L/min 산소에서 4% 이소플루란) 하에 쥐를 안락사시킵니다. 얼음물로 뇌를 헹구어 남아 있는 피를 제거합니다.
- 뇌 조직을 5개 부분으로 나누어 TTC로 염색합니다. 뇌 조직 절편의 양쪽 이미지를 캡처하고, Image J 소프트웨어를 사용하여 앞면과 뒷면의 허혈 영역을 측정하고, 다음 공식을 사용하여 경색률을 계산합니다.
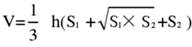
참고 : S1 및 S2 는 각각 뇌 절편의 근위 전뇌 및 근위 뇌간 측면의 경색 영역을 나타냅니다. 각 뇌 절편의 경색 영역은 Swanson의 공식을 사용하여 보정되며, 여기서 h는 뇌 절편의 두께를 나타냅니다. 저자가 선행 연구17에서 이전에 설명한 이 공식은 경색 병변 크기를 보다 정확하게 계산할 수 있게 해줍니다. - 통계 및 그래프 소프트웨어를 사용하여 데이터를 분석하여 모델의 성공률과 안정성을 평가합니다.
- 면역형광 방법을 사용하여 쥐의 대뇌 피질 뉴런을 표지하고 이 방법으로 인한 신경 세포 손상을 추가로 검증합니다. 쥐에서 24 시간의 허혈 재관류 후, 사전 냉각 된 PBS를 사용하여 심장 관류를 수행하여 뇌 조직을 얻었습니다.
- 뇌 조직을 절편으로 삽입하고 동결합니다. 미성숙 신경세포 마커 Doublecortin (DCX)18, 신경세포 핵 마커 Neuronal Nuclei (NeuN)18 및 뉴런 수지상 마커 Microtubule-associated protein-2 (MAP-2)19와 같은 신경세포 항체를 사용합니다. 레이저 컨포칼 현미경을 사용하여 허혈성 뉴런의 발현을 관찰합니다.
결과
레이저 스페클 플로우 이미징은 모노필라멘트 나일론 봉합사가 폐색되기 전에 중간 대뇌 동맥(MCA) 영역에 풍부한 혈류가 있음을 보여주었고 쥐의 기준선 혈류 값이 기록되었습니다. MCA의 폐색 후, 뇌의 허혈성 쪽의 혈류 값이 급격히 감소했습니다. 봉합사를 빼내기 전에 허혈성 측의 혈류 값을 다시 확인하여 봉합사가 MCA를 막고 있는지 확인했습니다. 그 결과 혈류에 약간의 변화만 나타났다. 봉?...
토론
모노필라멘트 나일론 봉합사에 의해 유도된 중뇌동맥폐색(MCAO) 모델은 MCAO 모델을 준비하는 데 사용되는 가장 일반적인 방법입니다. 이 접근법은 전임상 연구에서 널리 채택되고 있으며 단순성, 개두술의 필요성 부족, 최소한의 외상 및 재관류 능력으로 인해 많은 의사들로부터 인정을 받았습니다.
내강 필라멘트 MCAO에는 Koizumi 방법8 과 Longa 방법
공개
없음.
감사의 말
이 연구는 중국국가자연과학재단(82173781, 82373835), 박사후 연구 프로젝트(BKS212055), 포산과학기술국(2320001007331) 과학기술혁신사업, 광둥성기초응용기초연구재단(2019A1515010806), 광동성 일반대학 중점현장프로젝트(지능화)(2020ZDZX2057), 일반과학연구사업(특성혁신)의 지원을 받았다. 광동성 대학(2019KTSCX195).
자료
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
참고문헌
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유