Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation d’un modèle modifié pour la reperfusion de l’occlusion de l’artère cérébrale moyenne
Dans cet article
Résumé
Ce protocole décrit le processus de préparation à la reperfusion de l’occlusion de l’artère cérébrale moyenne via l’artère carotide commune.
Résumé
Le modèle de reperfusion de l’occlusion de l’artère cérébrale moyenne (MCAO/R) est crucial pour comprendre les mécanismes pathologiques de l’AVC et pour le développement de médicaments. Cependant, parmi les méthodes de modélisation couramment utilisées, la méthode Koizumi fait souvent l’objet d’un examen minutieux en raison de sa ligature de l’artère carotide commune (ACC) et de son incapacité à obtenir une reperfusion adéquate. De même, la méthode Longa a été critiquée pour déconnecter et ligaturer l’artère carotide externe (ECA). Cette étude vise à introduire une méthode de préparation de modèle modifiée qui préserve l’intégrité de l’ECA, implique l’insertion d’une suture en nylon monofilament à travers l’ACC, la réparation de l’incision ligaturée de l’ACC et le maintien de la reperfusion de l’ECA. La reperfusion du flux sanguin a été confirmée à l’aide de l’imagerie laser du flux de chatoiement. Des méthodes d’évaluation telles que l’échelle de Longa, le score de gravité neurologique modifié, la coloration au chlorure de triphényltétrazolium (TTC) et le marquage par immunofluorescence des neurones ont démontré que cette approche pouvait induire des lésions nerveuses ischémiques stables. Ce protocole de modèle MCAO/R modifié est simple et stable, fournissant des conseils précieux aux praticiens dans le domaine de l’ischémie cérébrale.
Introduction
Selon l’Organisation mondiale de la santé, l’AVC est resté la deuxième cause de décès dans le monde au cours de la dernière décennie, avec un taux d’incidence élevé, une mortalité élevée et un taux d’invalidité élevé 1,2. À mesure que la population mondiale vieillit, l’incidence des accidents vasculaires cérébraux devrait augmenter dans les pays en développement, devenant potentiellement la principale cause de décès prématurés et d’invalidité chez les adultes. De plus, les accidents vasculaires cérébraux ont tendance à survenir à un âge plus jeune de3 ans. La perte de main-d’œuvre après un accident vasculaire cérébral fait également peser un lourd fardeau sur les familles et la société4. Par conséquent, la mise au point de traitements sûrs et efficaces pose un défi majeur dans la recherche sur l’AVC.
Les modèles animaux sont des outils cruciaux pour l’étude de la prévention et du traitement des maladies humaines. L’application réussie des stratégies de traitement de l’AVC repose sur la reproductibilité et la fiabilité des modèles animaux d’AVC 5,6. L’artère cérébrale moyenne (ACM) est un site courant pour l’AVC clinique, ce qui fait du modèle MCAO le modèle le plus proche de l’AVC ischémique humain. Le modèle MCAO, préparé à l’aide de la méthode de suture, a été privilégié par les chercheurs en raison d’avantages tels que l’absence de craniotomie et le contrôle facile du temps ischémique. Il a été utilisé dans plus de 40 % des expériences neuroprotectrices7. Cependant, malgré ses nombreux avantages, les détails opérationnels de ce modèle restent un sujet controversé pour de nombreux chercheurs.
Pour le modèle d’occlusion de l’artère cérébrale moyenne induite par suture (MCAO), la reperfusion se produit en retirant la suture. Actuellement, deux méthodes principales sont utilisées pour l’insertion de sutures : la méthode8 de Koizumi et la méthode9 de Longa. Dans la méthode de Koizumi, la suture pénètre dans l’artère carotide interne (ICA) principalement par l’incision de l’artère carotide commune (ACC), tandis que dans la méthode de Longa, elle passe par l’artère carotide externe sectionnée (ECA) dans l’ICA. Pendant la reperfusion, la méthode Koizumi nécessite une ligature permanente de l’incision CCA et s’appuie sur le cercle de Willis pour la reperfusion10. Cependant, certaines études suggèrent qu’une reperfusion efficace ne peut pas être obtenue uniquement par l’apport compensatoire du cercle de Willis après avoir perdu l’approvisionnement en ACC. De plus, le cercle de Willis présente une grande variabilité anatomique, en particulier chez les souris C57Bl/6, ce qui augmente la variabilité de l’infarctus et réduit la fiabilité des données expérimentales. Par conséquent, cette méthode est de plus en plus remise en question par les chercheurs11.
La méthode de Longa consiste à insérer une suture à travers l’ECA sectionné, puis à ligaturer de façon permanente l’artère carotide interne (ICA) une fois la suture retirée. Cela préserve la perméabilité de l’ACC, permettant une perfusion sanguine jusqu’à 100 % des valeurs de base. Cependant, cette méthode nécessite de séparer l’artère carotide externe et les petites branches artérielles, de les couper ou de les électrocoaguler, ce qui rend la procédure difficile. Il perturbe également la structure complète du flux sanguin du cerveau, qui diffère de l’état cliniquedu patient 12. Il est important de noter que des études indiquent que la coupe ou la ligature de l’ECA peut provoquer des lésions ischémiques dans les muscles contrôlant la mastication et la déglutition, affectant l’alimentation animale et entraînant la mort postopératoire de l’animal et de graves lésions sensorielles et motrices chez les rats13,14.
Par conséquent, une méthode de préparation de modèle modifiée est nécessaire de toute urgence pour résoudre ces problèmes. Cette étude présente une méthode de modélisation MCAO modifiée qui répare l’incision d’insertion de l’ACC et permet d’obtenir une reperfusion efficace. La procédure est simple, pratique et réalisable, induisant des dommages neurologiques importants et des lésions d’infarctus reproductibles et fournissant des conseils précieux aux chercheurs sur l’AVC.
Protocole
Le protocole expérimental a été réalisé conformément aux directives du Comité d’utilisation des animaux de laboratoire et du Comité institutionnel de soin et d’utilisation des animaux de l’Université de médecine traditionnelle chinoise de Chengdu (Numéro d’enregistrement : 2019-DL-002). Toutes les données de la recherche animale ont été documentées conformément aux directives ARRIVE (Animal Research : Reporting In Vivo Experiments). Des rats Sprague Dawley (SD) mâles pesant 250 g ± 20 g et âgés de 6 à 8 semaines ont été utilisés pour cette étude. Les détails concernant les animaux, les réactifs et l’équipement utilisés sont énumérés dans la table des matériaux.
1. Préparation des animaux
- Induire et maintenir une anesthésie profonde chez le rat à l’aide de Zoletil 50 (50 mg/kg, IM) et de chlorhydrate de xylazine (40 mg/kg, IP). Assurez-vous que la température corporelle est maintenue à 37 ± 0,5 °C à l’aide d’une sonde rectale reliée à un coussin chauffant tout au long de l’intervention chirurgicale. Appliquez une pommade vétérinaire sur les yeux du rat pour éviter qu’ils ne se dessèchent.
- Rasez les poils de la tête et du cou des rats. Utilisez une crème dépilatoire pour enlever la fourrure de la tête et du cou, puis lavez la crème avec une solution saline normale. Désinfectez la peau au niveau du site chirurgical en appliquant trois fois de l’éthanol et de la povidone iodée à l’aide de boules de coton stériles.
- Faites une incision de 2 cm au milieu de la tête du rat dans le sens de la suture sagittale à l’aide d’un scalpel et retirez soigneusement les muscles recouvrant le crâne.
- Amincir le crâne du côté ischémique du rat à l’aide d’une perceuse à crâne. Utilisez une solution saline normale pour refroidir et éliminer les débris pendant le processus de broyage. Enregistrez le flux sanguin de base des rats à l’aide de l’imagerie par contraste de chatoiement laser (LSCI).
- Appliquez trois fois de l’éthanol et de la povidone iodée sur la peau du cou à l’aide de boules de coton stériles. Faites une incision de 2 cm le long de la ligne médiane du cou à l’aide d’une lame chirurgicale. Utilisez des écarteurs pour tirer latéralement la peau et les glandes salivaires, exposant les muscles sternocléido-mastoïdiens et cervicaux.
- Séparez les muscles sterno-cléidomastoïdien et cervicaux pour exposer le territoire carotide. Identifier l’anatomie vasculaire de l’artère carotide commune (ACC), de l’artère carotide interne (ICA) et de l’artère carotide externe (ECA). D’après l’anatomie vasculaire, séparez l’ACC, ainsi que l’ECA dérivé de l’ACC et l’ICA15.
REMARQUE : La structure anatomique du rat indique que la région CCA est principalement couverte par les muscles sterno-cléidomastoïdiens et cervicaux, l’ICA et l’ECA étant dérivés de l’ACC. Une fois que la séparation a exposé l’ACC, une fourche en forme de Y peut être observée le long de l’ACC, représentant l’ACC et l’ACE. Veillez à ne pas endommager le nerf vague, qui est parallèle à l’ACC.
2. Occlusion du MCA
- Faites un nœud facilement démêlé sur l’artère carotide externe (ECA) et l’artère carotide commune (ACC) à l’aide d’un fil de soie 3-0 pour bloquer temporairement la circulation sanguine. Placez une pince de récipient sur le CCA à environ 0,5 cm du premier nœud.
- Teindre l’aiguille d’une seringue de 5 mL en noir. Créez une petite perforation dans l’ACC à l’aide de l’aiguille teinte en noir et marquez les trous d’épingle en noir.
- Insérez la suture en nylon monofilament dans le CCA à travers la marque noire. Ouvrez le clip vasculaire et guidez le fil de nylon dans l’artère carotide interne (ICA) jusqu’à ce qu’il s’arrête avec une légère résistance. Serrez fermement le deuxième nœud pour maintenir la suture en nylon monofilament en place à l’intérieur de l’artère, empêchant ainsi le déplacement de la position de blocage.
- Notez le moment de l’ischémie à ce stade et mesurez la valeur du débit sanguin du côté ischémique à l’aide de LSCI. Administrez des gouttes de bupivacaïne sur la plaie cervicale pour l’analgésie et la fermeture de la plaie. Retirez le masque d’anesthésie et laissez le rat récupérer.
REMARQUE : Si la suture en nylon monofilament rencontre des difficultés pour pénétrer dans l’ICA, rétractez-la légèrement et essayez à nouveau de l’insérer.
3. Reperfusion du MCAO
- Après 90 min d’ischémie, anesthésier à nouveau les rats avec de l’isoflurane. Mesurez le débit sanguin cérébral du côté ischémique à l’aide de LSCI et assurez-vous que la suture en nylon monofilament n’a pas bougé.
- Défaites les nœuds sur l’artère carotide externe (ECA) pour permettre la reperfusion sanguine. Relâchez le nœud sur l’artère carotide commune (ACC), fixez la suture du monofilament et retirez la suture. Appliquez un clip vasculaire avant la suture fixe du monofilament pour éviter les saignements.
- Remplacez le premier nœud CCA par une pince vasculaire. À l’aide d’une pince à épiler, faites pivoter l’incision du vaisseau sur le côté (Figure 1). Clampez l’incision avec une pince à épiler et ligaturez-la à l’aide d’un fil 6-0 pour réparer l’incision. Retirez le clip vasculaire, vérifiez qu’il n’y a pas de fuites et confirmez la reperfusion complète (Vidéo 1).
REMARQUE : Effectuez une ligature pour réparer l’incision afin d’éviter un clampage excessif des vaisseaux, ce qui pourrait entraîner une sténose CCA. - Enregistrez les valeurs de débit sanguin cortical cérébral à l’aide de LSCI après la ligature par incision pour confirmer la réussite de la reperfusion. Fermez l’incision du cou avec des sutures et administrez 1 000 000 unités de pénicilline et 2 ml de solution saline pour prévenir l’infection et la déshydratation.
- Maintenez la chaleur jusqu’à ce que les rats reprennent conscience. Offrez de la nourriture molle après la chirurgie et surveillez les signes vitaux des animaux.
4. Évaluation de la fonction nerveuse et de l’ischémie cérébrale
- Une fois que les rats se seront complètement réveillés, leur fonction neuronale sera évaluée par des chercheurs ignorant le regroupement des animaux. Utiliser l’échelle de score de Longa (tableau 1) et l’échelle de score de gravité neurologique modifiée (mNSS) (tableau 2) pour évaluer la fonction neurologique de tous les rats.
- Après 24 heures après la chirurgie, euthanasier les rats sous anesthésie induite par l’isoflurane (4 % d’isoflurane à 4 L/min d’oxygène) par luxation cervicale16 (selon les protocoles approuvés par l’établissement). Rincez le cerveau à l’eau glacée pour éliminer le sang restant.
- Divisez le tissu cérébral en 5 sections et colorez-les avec du TTC. Capturez des images des deux côtés des coupes de tissu cérébral, mesurez la zone ischémique des côtés avant et arrière à l’aide du logiciel Image J et calculez le taux d’infarctus à l’aide de la formule suivante :
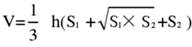
REMARQUE : S1 et S2 représentent respectivement la zone d’infarctus du cerveau antérieur proximal et du tronc cérébral proximal des tranches de cerveau. La zone d’infarctus de chaque tranche de cerveau est corrigée à l’aide de la formule de Swanson, où h représente l’épaisseur de la tranche de cerveau. Cette formule, précédemment décrite par l’auteur dans des recherches antérieures17, permet un calcul plus précis de la taille de la lésion d’infarctus. - Analysez les données à l’aide d’un logiciel de statistiques et de graphiques pour évaluer le taux de réussite et la stabilité du modèle.
- Utiliser la méthode d’immunofluorescence pour marquer les neurones corticaux chez les rats, validant ainsi les dommages neuronaux causés par cette méthode. Après 24 h d’ischémie-reperfusion chez le rat, une perfusion cardiaque à l’aide de PBS pré-refroidi a été réalisée pour prélever du tissu cérébral.
- Intégrez et congelez le tissu cérébral en sections. Utilisez des anticorps neuronaux tels que le marqueur neuronal immature Doublecortin (DCX)18, le marqueur du noyau neuronal Neuronal Nuclei (NeuN)18 et le marqueur dendritique neuronal Microtubule-associated protein-2 (MAP-2)19. Observez l’expression des neurones ischémiques à l’aide de la microscopie confocale laser.
Résultats
L’imagerie laser du flux de chatoiement a démontré qu’avant l’occlusion de la suture en nylon monofilament, il y avait un flux sanguin abondant dans la région de l’artère cérébrale moyenne (ACM), et les valeurs de base du débit sanguin des rats ont été enregistrées. Suite à l’occlusion de l’ACM, la valeur du débit sanguin du côté ischémique du cerveau a rapidement diminué. Avant de retirer la suture, les valeurs de débit sanguin du côté ischémique ont été revérifiées pour confirmer si ...
Discussion
Le modèle d’occlusion de l’artère cérébrale moyenne (MCAO) induit par une suture en nylon monofilament est la méthode la plus couramment utilisée pour préparer les modèles MCAO. Cette approche est largement adoptée dans les études précliniques et a été reconnue par de nombreux praticiens en raison de sa simplicité, de l’absence de besoin de craniotomie, d’un traumatisme chirurgical minime et de sa capacité à réaliser une reperfusion.
Il existe deux techniques chirurgic...
Déclarations de divulgation
Aucun.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (82173781 et 82373835), le projet de recherche postdoctorale (BKS212055), le projet d’innovation scientifique et technologique du Bureau des sciences et de la technologie de Foshan (2320001007331), la Fondation de recherche fondamentale et appliquée du Guangdong (2019A1515010806), les principaux projets de terrain (fabrication intelligente) des universités générales de la province du Guangdong (2020ZDZX2057) et les projets de recherche scientifique (innovation caractéristique) de la Universités de la province du Guangdong (2019KTSCX195).
matériels
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Références
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon