需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大脑中动脉闭塞再灌注的改良模型制备
摘要
该协议描述了准备通过颈总动脉进行大脑中动脉闭塞再灌注的过程。
摘要
大脑中动脉闭塞再灌注 (MCAO/R) 模型对于理解卒中的病理机制和药物开发至关重要。然而,在常用的建模方法中,小泉法由于结扎颈总动脉 (CCA) 且无法实现足够的再灌注而经常面临审查。同样,Longa 方法因断开和结扎颈外动脉 (ECA) 而受到批评。本研究旨在介绍一种改进的模型制备方法,该方法保留了 ECA 的完整性,包括通过 CCA 插入单丝尼龙缝合线,修复结扎的 CCA 切口,并维持 CCA 的再灌注。使用激光斑点流成像确认血流再灌注。Longa 量表、改良神经严重程度评分、氯化三苯基四唑 (TTC) 染色和神经元免疫荧光标记等评估方法表明,这种方法可以诱导稳定的缺血性神经损伤。这种改进的 MCAO/R 模型方案简单稳定,为脑缺血领域的从业者提供了有价值的指导。
引言
根据世界卫生组织的数据,在过去十年中,中风一直是全球第二大死因,发病率高、死亡率高、残疾率高 1,2。随着全球人口老龄化,预计发展中国家的中风发病率将增加,可能成为成人过早死亡和残疾的主要原因。此外,中风有发生在年轻年龄的趋势3。中风后劳动力的流失也给家庭和社会带来了沉重的负担4。因此,开发安全有效的治疗方法对中风研究构成了重大挑战。
动物模型是研究人类疾病预防和治疗的重要工具。卒中治疗策略的成功转化取决于卒中动物模型的可重复性和可靠性 5,6。大脑中动脉 (MCA) 是临床卒中的常见部位,使 MCAO 模型成为最接近人类缺血性卒中的模型。使用缝合法制备的 MCAO 模型因其无需开颅手术和易于控制缺血时间等优点而受到研究人员的青睐。它已被用于超过 40% 的神经保护实验7。然而,尽管它有许多优点,但该模型的操作细节对许多研究人员来说仍然是一个有争议的话题。
对于缝合诱导的大脑中动脉闭塞 (MCAO) 模型,通过撤回缝合线进行再灌注。目前,缝合插入主要采用两种方法:小泉的方法8 和 Longa 的方法9。在 Koizumi 的方法中,缝合线主要通过颈总动脉 (CCA) 切口进入颈内动脉 (ICA),而在 Longa 的方法中,它通过切断的颈外动脉 (ECA) 进入 ICA。在再灌注过程中,小泉法需要永久结扎 CCA 切口,并依靠 Willis 环进行再灌注10。然而,一些研究表明,在失去 CCA 供应后,仅通过对 Willis 环的补偿供应,不能仅通过补偿性供应来实现有效的再灌注。此外,Willis 环表现出很高的解剖变异性,尤其是在 C57Bl/6 小鼠中,增加了梗死变异性并降低了实验数据的可靠性。因此,这种方法越来越多地受到研究人员的质疑11。
Longa 的方法包括通过切断的 ECA 插入缝合线,然后在缝合线拔出后永久结扎颈内动脉 (ICA)。这保持了 CCA 通畅性,允许血液灌注高达基线值的 100%。然而,这种方法需要将颈外动脉和小动脉分支分开,切断它们或电凝它们,使手术具有挑战性。它还会破坏大脑的全血流结构,这与临床患者的状态不同12。重要的是,研究表明,切割或结扎 ECA 会导致控制咀嚼和吞咽的肌肉出现缺血性病变,影响动物饮食并导致大鼠术后动物死亡和严重的感觉和运动损伤13,14。
因此,迫切需要一种改进的模型制备方法来解决这些问题。本研究介绍了一种改进的 MCAO 建模方法,该方法可修复 CCA 插入切口并实现有效的再灌注。该程序简单、实用、可行,可诱导严重的神经损伤和可复制的梗死病变,为卒中研究人员提供有价值的指导。
研究方案
实验方案是按照成都中医药大学实验动物使用和机构动物护理和使用委员会指南(记录编号:2019-DL-002)进行的。所有动物研究数据均按照 ARRIVE(动物研究 :体内实验 报告)指南进行记录。本研究使用体重 250 g ± 20 g 且年龄为 6-8 周龄的雄性 Sprague Dawley (SD) 大鼠。有关所用动物、试剂和设备的详细信息列在 材料表中。
1. 动物准备
- 使用 Zoletil 50 (50mg/kg, IM) 和盐酸甲苯噻嗪 (40mg/kg, IP) 诱导并维持大鼠的深度麻醉。确保在整个手术过程中使用连接到加热垫的直肠探针将体温保持在 37 ± 0.5 °C。在大鼠的眼睛上涂抹兽药膏,以防止它们干燥。
- 剃掉大鼠头部和颈部的毛发。使用脱毛膏去除头部和颈部的皮毛,然后用生理盐水洗掉乳霜。使用无菌棉球涂抹乙醇和聚维酮碘 3 次,对手术部位的皮肤进行消毒。
- 用手术刀沿矢状缝合线的方向在大鼠头部中间切开 2 厘米,小心地去除覆盖颅骨的肌肉。
- 使用颅骨钻头将大鼠缺血侧的颅骨变薄。在研磨过程中使用生理盐水冷却并清除碎屑。使用激光散斑对比成像 (LSCI) 记录大鼠的基线血流。
- 使用无菌棉球将乙醇和聚维酮碘涂抹在颈部皮肤上 3 次。使用手术刀片沿颈部中线切开 2 厘米。使用牵开器横向拉回皮肤和唾液腺,露出胸锁乳突肌和颈椎肌肉。
- 将胸锁乳突肌和颈椎肌分开,露出颈动脉区域。确定颈总动脉 (CCA)、颈内动脉 (ICA) 和颈外动脉 (ECA) 的血管解剖结构。根据血管解剖结构,将 CCA 以及 CCA 衍生的 ECA 和 ICA15 分开。
注:大鼠的解剖结构表明 CCA 区域主要被胸锁乳突肌和颈肌覆盖,其中 ICA 和 ECA 来源于 CCA。分离后露出 CCA,沿着 CCA 可以看到一个 Y 形叉子,代表 ICA 和 ECA。小心不要损伤与 CCA 平行的迷走神经。
2. MCA 的闭塞
- 使用 3-0 丝线在颈外动脉 (ECA) 和颈总动脉 (CCA) 上打一个容易解开的结,以暂时阻止血流。将容器夹放在 CCA 上,距离第一个结约 0.5 厘米。
- 将 5 mL 注射器的针头染成黑色。使用黑色染色的针头在 CCA 中打一个小孔,并用黑色标记针孔。
- 通过黑色标记将单丝尼龙缝合线插入 CCA。打开血管夹,将尼龙丝引导至颈内动脉 (ICA),直到它因轻微阻力而停止。牢固地拧紧第二个结,将单丝尼龙缝合线保持在动脉内,防止从阻塞位置移位。
- 记下此时的缺血时间,并使用 LSCI 测量缺血侧的血流值。将布比卡因滴剂滴到颈部伤口上,以镇痛和闭合伤口。取下麻醉面罩,让大鼠恢复。
注意:如果单丝尼龙缝合线难以进入 ICA,请稍微缩回并再次尝试插入。
3. MCAO 的再灌注
- 缺血 90 分钟后,用异氟醚重新麻醉大鼠。使用 LSCI 测量来自缺血侧的脑血流,并确保单丝尼龙缝合线没有移动。
- 解开颈外动脉 (ECA) 上的结,以便血液再灌注。松开颈总动脉 (CCA) 上的结,固定单丝缝合线,然后撤回缝合线。在固定单丝缝合线之前应用血管夹以防止出血。
- 用血管夹替换第一个 CCA 结。使用镊子将血管切口侧向旋转(图 1)。用镊子夹住切口,并使用 6-0 线结扎以修复切口。取下血管夹,检查是否有渗漏,并确认完全再灌注(视频 1)。
注意:进行结扎以修复切口,以避免过度夹住血管,这可能导致 CCA 狭窄。 - 切口结扎后使用 LSCI 记录脑皮层血流值,以确认再灌注成功。用缝合线闭合颈部切口,并给予 1,00,000 单位青霉素和 2 mL 生理盐水,以防止感染和脱水。
- 保持温暖,直到大鼠恢复意识。术后提供软食并监测动物的生命体征。
4. 神经功能与脑缺血性损伤的评估
- 一旦大鼠完全醒来,研究人员将评估它们的神经功能,而不了解动物分组。利用 Longa 评分量表(表 1)和改良的神经严重程度评分 (mNSS) 量表(表 2)来评估所有大鼠的神经功能。
- 手术后 24 小时后,在异氟醚诱导的麻醉下(4% 异氟醚,4 L/min 氧气) 通过 颈椎脱位16 (遵循机构批准的方案)对大鼠实施安乐死。用冰水冲洗大脑以去除任何残留的血液。
- 将脑组织分成 5 个部分并用 TTC 染色。捕获脑组织切片两侧的图像,使用 Image J 软件测量前后两侧的缺血面积,并使用以下公式计算梗死率:
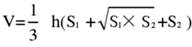
注:S1 和 S2 分别代表脑切片近端前脑和近端脑干侧的梗死区域。使用 Swanson 公式校正每个脑切片的梗塞区域,其中 h 表示脑切片的厚度。该公式由作者先前在先前的研究17 中概述,允许更准确地计算梗死病变的大小。 - 使用统计和绘图软件分析数据,以评估模型的成功率和稳定性。
- 采用免疫荧光法标记大鼠的皮层神经元,进一步验证该方法引起的神经元损伤。大鼠缺血再灌注 24 小时后,使用预冷 PBS 进行心脏灌注以获得脑组织。
- 将脑组织嵌入并冷冻成切片。使用神经元抗体,例如未成熟神经元标志物双皮质素 (DCX)18、神经元核标志物神经元核 (NeuN)18 和神经元树突状标志物微管相关蛋白-2 (MAP-2)19。使用激光共聚焦显微镜观察缺血神经元的表达。
结果
激光斑点血流成像显示,在单丝尼龙缝合线闭塞前,大脑中动脉 (MCA) 区血流充沛,记录大鼠基线血流值。MCA 闭塞后,大脑缺血侧的血流值迅速下降。在撤回缝线之前,重新检查缺血侧的血流值,以确认缝线是否阻塞了 MCA。结果表明血流仅发生轻微变化。撤回缝合线后,血流灌注迅速恢复(图2)。 视频 1 还显示了颈总动脉的强劲充盈脉搏,表明该方法可以?...
讨论
由单丝尼龙缝合线诱导的大脑中动脉闭塞 (MCAO) 模型是制备 MCAO 模型的最常用方法。这种方法在临床前研究中被广泛采用,并因其简单、无需开颅手术、手术创伤最小以及能够实现再灌注而获得许多从业者的认可。
腔内细丝 MCAO 有两种经典的手术技术:小泉法8 和 Longa 法9。这些方法之间的主要区别在于如何引入缝合线以闭塞 MCA。在 Koizu...
披露声明
没有。
致谢
这项工作得到了国家自然科学基金(82173781和82373835)、博士后科研项目(BKS212055)、佛山市科学技术局科技创新项目(2320001007331)、广东省基础与应用基础研究基金(2019A1515010806)、广东省通用高校重点领域项目(智能制造)(2020ZDZX2057)和通用科研项目(特色创新)的支持。广东省大学排名 (2019KTSCX195).
材料
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
参考文献
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。