このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
中大脳動脈閉塞再灌流のための修正モデル調製
要約
このプロトコルは、総頸動脈を介した中大脳動脈閉塞再灌流の準備プロセスを説明しています。
要約
中大脳動脈閉塞再灌流(MCAO/R)モデルは、脳卒中の病理学的メカニズムを理解し、医薬品開発に不可欠です。しかし、一般的に使用されているモデリング手法の中で、小泉法は総頸動脈(CCA)の結紮と適切な再灌流を達成できないため、しばしば精査に直面します。同様に、ロンガ法は、外頸動脈(ECA)を切断して結紮することで批判されてきました。この研究は、ECAの完全性を維持する修正モデル調製方法を紹介することを目的としており、CCAを介してモノフィラメントナイロン縫合糸を挿入し、結紮されたCCA切開を修復し、CCAからの再灌流を維持します。血流の再灌流は、レーザースペックルフローイメージングを用いて確認した。ロンガスケール、修正神経重症度スコア、塩化トリフェニルテトラゾリウム(TTC)染色、ニューロンの免疫蛍光標識などの評価方法は、このアプローチが安定した虚血性神経損傷を誘発できることを実証しました。この修正されたMCAO/Rモデルプロトコルはシンプルで安定しており、脳虚血の分野の開業医に貴重なガイダンスを提供します。
概要
世界保健機関(WHO)によると、脳卒中は過去10年間、世界で2番目に多い死因であり続けており、高い発生率、高い死亡率、高い障害率1,2。世界人口の高齢化に伴い、脳卒中の発生率は発展途上国で増加すると予想されており、成人の早期死亡や障害の主な原因になる可能性があります。さらに、脳卒中は3歳未満で発生する傾向があります。脳卒中による労働力の喪失は、家族や社会にも大きな負担をかけています4。そのため、脳卒中研究において、安全で効果的な治療法の開発は大きな課題となっています。
動物モデルは、ヒトの疾患の予防と治療を研究するための重要なツールとして機能します。脳卒中治療戦略の翻訳が成功するかどうかは、脳卒中動物モデルの再現性と信頼性にかかっています5,6。中大脳動脈(MCA)は臨床脳梗塞の一般的な部位であり、MCAOモデルはヒトの虚血性脳卒中に最も近いモデルとなっています。縫合法を使用して調製されたMCAOモデルは、開頭術が不要で虚血時間の制御が容易であるなどの利点により、研究者に好まれています。これは、神経保護実験の40%以上で利用されています7。しかし、その多くの利点にもかかわらず、このモデルの運用上の詳細は、多くの研究者にとって物議を醸すトピックのままです。
縫合糸誘発中大脳動脈閉塞 (MCAO) モデルでは、縫合糸を抜くことで再灌流が行われます。現在、縫合糸の挿入には、コイズミの方法8 とロンガの方法9の2つの主要な方法が使用されています。小泉氏の方法では、縫合糸は主に総頸動脈(CCA)切開部から内頸動脈(ICA)に入りますが、ロンガ氏の方法では、切断された外頸動脈(ECA)を通過してICAに入ります。再灌流中、小泉法はCCA切開部を永久にライゲーションする必要があり、再灌流10についてはウィリスの円に依存する。ただし、一部の研究では、CCA供給を失った後、ウィリスの円の代償供給だけでは効果的な再灌流を達成できないことが示唆されています。さらに、ウィリスの輪は、特にC57Bl/6マウスで高い解剖学的変動性を示し、梗塞の変動性を高め、実験データの信頼性を低下させます。その結果、この方法は研究者によってますます疑問視されています11。
Longaの方法は、切断されたECAに縫合糸を挿入し、縫合糸が抜かれたら内頸動脈(ICA)を永久に結紮することを含みます。これにより、CCAの開存性が維持され、ベースライン値の100%までの血液灌流が可能になります。しかし、この方法では、外頸動脈と小さな動脈枝を分離したり、切り取ったり、電気凝固させたりする必要があるため、手続きが難しくなります。また、臨床患者の状態とは異なる脳の完全な血流構造を混乱させます12。重要なことに、ECAの切断または結紮は、咀嚼と嚥下を制御する筋肉に虚血性病変を引き起こし、動物の食事に影響を与え、ラット13,14の術後動物の死亡と重度の感覚および運動障害につながる可能性があることを研究が示しています。
したがって、これらの問題に対処するためには、修正されたモデル準備方法が緊急に必要とされています。本研究では、CCA挿入切開部を修復し、効果的な再灌流を実現する修正MCAOモデリング法を紹介する。この処置は、シンプルで実用的、かつ実現可能であり、重大な神経学的損傷と再現可能な梗塞病変を誘発し、脳卒中研究者に貴重なガイダンスを提供します。
プロトコル
実験プロトコルは、成都中医薬大学の実験動物の使用および施設用動物管理および使用委員会のガイドラインに準拠して実施されました(記録番号:2019-DL-002)。すべての動物実験データは、ARRIVE(Animal Research: Reporting In Vivo Experiments)ガイドラインに従って文書化されています。この研究では、体重250g±20g、生後6〜8週齢の雄のSprague Dawley(SD)ラットを利用しました。使用する動物、試薬、および機器に関する詳細は、 資料表に記載されています。
1.動物の調理
- ゾレチル50(50mg / kg、IM)およびキシラジン塩酸塩(40mg / kg、IP)を使用してラットに深部麻酔を誘発し、維持します。.外科的処置全体を通して、加熱パッドに接続された直腸プローブを使用して、体温が37±0.5°Cに維持されていることを確認してください。ラットの目に獣医軟膏を塗布して、乾燥を防ぎます。
- ネズミの頭と首から毛を剃ります。脱毛クリームを使用して頭と首の毛皮を取り除き、通常の生理食塩水でクリームを洗い流します。滅菌コットンボールを使用して、エタノールとポビドンヨードを3回塗布することにより、手術部位の皮膚を消毒します。
- ラットの頭の中央に矢状縫合糸の方向に沿ってメスで2cm切開し、頭蓋骨を覆っている筋肉を慎重に取り除きます。
- 頭蓋骨ドリルを使用して、ラットの虚血側の頭蓋骨を薄くします。通常の生理食塩水を使用して、粉砕プロセス中に冷却し、破片を取り除きます。レーザースペックルコントラストイメージング(LSCI)を使用して、ラットのベースライン血流を記録します。
- エタノールとポビドンヨードを滅菌コットンボールを使用して首の皮膚に3回塗布します。サージカルブレードを使用して、首の正中線に沿って2cmの切開を行います。リトラクターを使用して、皮膚と唾液腺を横方向に引き戻し、胸鎖乳突筋と頸部筋を露出させます。
- 胸鎖乳突筋と頸筋を分離して、頸動脈領域を露出させます。総頸動脈(CCA)、内頸動脈(ICA)、および外部頸動脈(ECA)の血管解剖学的構造を特定します。血管の解剖学的構造に基づいて、CCAとCCA由来のECAおよびICA15を分離します。
注:ラットの解剖学的構造は、CCA領域が主に胸鎖乳突筋と頸部筋によって覆われており、ICAとECAはCCAに由来することを示しています。分離によってCCAが露出した後、CCAに沿ってY字型のフォークが見られ、ICAとECAを表しています。CCAと平行に走る迷走神経を傷つけないように注意してください。
2. MCAの閉塞
- 外頸動脈(ECA)と総頸動脈(CCA)に3-0の絹糸を使用して、簡単にほどける結び目を結び、一時的に血流を遮断します。容器クリップをCCAの最初の結び目から約0.5cmの位置に配置します。
- 5mLシリンジの針を黒く染めます。黒く染めた針でCCAに小さな穴を開け、ピンホールに黒く印をつけます。
- モノフィラメントナイロン縫合糸をブラックマークからCCAに挿入します。血管クリップを開き、ナイロンワイヤーを内頸動脈(ICA)に導き、わずかな抵抗で停止します。モノフィラメントナイロン縫合糸を動脈内の所定の位置に保持するために、2番目の結び目をしっかりと締めて、ブロッキング位置からの変位を防ぎます。
- この時点での虚血の時間に注意し、LSCIを使用して虚血側の血流値を測定します。鎮痛と創傷閉鎖のために、ブピバカインを首の傷に滴下します。.麻酔マスクを取り外し、ラットが回復するのを待ちます。
注:モノフィラメントナイロン縫合糸がICAに入るのが難しい場合は、少し引っ込めて再度挿入を試みます。
3. MCAOの再灌流
- 90分間の虚血後、ラットにイソフルランで再麻酔をかけます。.LSCIを使用して虚血側からの脳血流を測定し、モノフィラメントナイロン縫合糸がずれていないことを確認します。
- 外頸動脈(ECA)の結び目をほどいて、血液の再灌流を可能にします。総頸動脈(CCA)の結び目を緩め、モノフィラメント縫合糸を固定し、縫合糸を引き出します。出血を防ぐために、固定されたモノフィラメント縫合糸の前に血管クリップを取り付けます。
- 最初のCCAノットを血管クリップに交換します。ピンセットを使用して、血管の切開部を横に回転させます(図1)。切開部をピンセットで固定し、6-0スレッドを使用して結紮して切開部を修復します。血管クリップを取り外し、漏れがないか確認し、完全な再灌流を確認します(ビデオ1)。
注意: 結紮を行って切開部を修復し、CCA狭窄につながる可能性のある血管の過度のクランプを回避します。 - 切開結灌後にLSCIを使用して脳皮質血流値を記録し、再灌流が成功したことを確認します。縫合糸で首の切開部を閉じ、1,00,000ユニットのペニシリンと2mLの生理食塩水を投与して、感染と脱水症を防ぎます。
- ネズミが意識を取り戻すまで暖かさを保ちます。手術後に柔らかい食事を提供し、動物のバイタルサインを監視します。
4. 神経機能の評価と脳虚血性損傷
- ラットが完全に覚醒すると、その神経機能は、動物のグループ化に気づいていない研究者によって評価されます。Longa スコア スケール (表 1) と修正神経重症度スコア (mNSS) スケール (表 2) を利用して、すべてのラットの神経機能を評価します。
- 手術後 24 時間後、イソフルラン誘発麻酔 (4% イソフルラン、4 L/分の酸素) 下でラットを頸部脱臼16 (施設で承認されたプロトコルに従う) で安楽死させます。氷水で脳を洗い流し、残っている血液を取り除きます。
- 脳組織を5つのセクションに分け、TTCで染色します。脳組織切片の両側の画像を取得し、Image Jソフトウェアを使用して表側と裏側の虚血領域を測定し、次の式を使用して梗塞率を計算します。
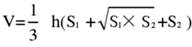
注:S1 とS2 は、それぞれ脳スライスの近位前脳と近位脳幹側の梗塞領域を表しています。各脳スライスの梗塞領域は、スワンソンの公式を使用して矯正されます(hは脳スライスの厚さを表します)。この式は、著者が以前の研究17で以前に概説したもので、梗塞病変のサイズをより正確に計算することを可能にします。 - 統計ソフトウェアとグラフ作成ソフトウェアを使用してデータを分析して、モデルの成功率と安定性を評価します。
- 免疫蛍光法を使用してラットの皮質ニューロンを標識し、この方法によって引き起こされるニューロンの損傷をさらに検証します。ラットの虚血再灌流の24時間後、脳組織を得るために予冷PBSを使用した心臓灌流が行われました。
- 脳組織を埋め込んでセクションに凍結します。未熟な神経細胞マーカーDoublecortin(DCX)18、神経細胞核マーカーのNeuronal Nuclei(NeuN)18、およびニューロン樹状物質マーカーの微小管関連タンパク質-2(MAP-2)19などの神経細胞抗体を使用してください。レーザー共焦点顕微鏡を使用して虚血性ニューロンの発現を観察します。
結果
レーザースペックルフローイメージングにより、モノフィラメントナイロン縫合糸の閉塞前に、中大脳動脈(MCA)領域に豊富な血流があり、ラットのベースライン血流値が記録されたことが示されました。MCAの閉塞後、脳の虚血側の血流値は急速に減少しました。縫合糸を抜く前に、虚血側の血流値を再確認して、縫合糸がMCAを閉塞しているかどうかを確認しました。結果は、血流のわずかな?...
ディスカッション
モノフィラメントナイロン縫合糸によって誘発される中大脳動脈閉塞(MCAO)モデルは、MCAOモデルの準備に使用される最も一般的な方法です。このアプローチは前臨床試験で広く採用されており、そのシンプルさ、開頭術の必要性の欠如、最小限の外科的外傷、および再灌流を達成する能力により、多くの開業医から認められています。
管腔内フィラメントMCAOには、小泉法...
開示事項
何一つ。
謝辞
この研究は、中国国家自然科学基金会(82173781および82373835)、ポスドク研究プロジェクト(BKS212055)、佛山科学技術局の科学技術イノベーションプロジェクト(2320001007331)、広東省基礎応用基礎研究基金会(2019A1515010806)、広東省の一般大学の主要フィールドプロジェクト(インテリジェント製造)(2020ZDZX2057)、および一般科学研究プロジェクト(特性イノベーション)の支援を受けました。広東省の大学(2019KTSCX195)。
資料
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
参考文献
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved