A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نشاط شبيه بالنوبات عالية الجودة من شرائح الدماغ الحادة باستخدام نظام صفيف أقطاب كهربائية دقيقة عالي الكثافة من أكسيد المعادن وأشباه الموصلات
* These authors contributed equally
In This Article
Summary
هنا ، نحدد بروتوكولا لاستخدام أنظمة صفيف الأقطاب الكهربائية الدقيقة عالية الكثافة التكميلية لأكسيد المعادن وأشباه الموصلات (CMOS-HD-MEAs) لتسجيل النشاط الشبيه بالنوبات من شرائح الدماغ خارج الجسم الحي .
Abstract
يمكن لأنظمة مصفوفة الأقطاب الكهربائية الدقيقة عالية الكثافة لأشباه الموصلات المعدنية التكميلية (CMOS-HD-MEA) تسجيل النشاط الفسيولوجي العصبي من مزارع الخلايا وشرائح الدماغ خارج الجسم الحي بتفاصيل فيزيولوجية كهربية غير مسبوقة. تم تحسين CMOS-HD-MEAs لأول مرة لتسجيل نشاط وحدة عصبية عالية الجودة من مزارع الخلايا ولكن ثبت أيضا أنها تنتج بيانات عالية الجودة من شرائح الشبكية والمخيخ الحادة. استخدم الباحثون مؤخرا CMOS-HD-MEAs لتسجيل إمكانات الحقل المحلي (LFPs) من شرائح دماغ القوارض القشرية الحادة. أحد LFP المثير للاهتمام هو النشاط الشبيه بالنوبات. في حين أن العديد من المستخدمين قد أنتجوا تصريفات صرعية قصيرة وعفوية باستخدام CMOS-HD-MEAs ، فإن قلة من المستخدمين ينتجون نشاطا شبيها بالنوبات عالية الجودة. قد تساهم العديد من العوامل في هذه الصعوبة ، بما في ذلك الضوضاء الكهربائية ، والطبيعة غير المتسقة لإنتاج نشاط يشبه النوبات عند استخدام غرف التسجيل المغمورة ، والقيود التي تسجلها رقائق 2D CMOS-MEA فقط من سطح شريحة الدماغ. يجب أن تمكن التقنيات المفصلة في هذا البروتوكول المستخدمين من حث وتسجيل نشاط شبيه بالنوبات عالية الجودة باستمرار من شرائح الدماغ الحادة باستخدام نظام CMOS-HD-MEA. بالإضافة إلى ذلك ، يحدد هذا البروتوكول المعالجة المناسبة لرقائق CMOS-HD-MEA ، وإدارة المحاليل وشرائح الدماغ أثناء التجريب ، وصيانة المعدات.
Introduction
تعد أنظمة صفيف الأقطاب الكهربائية الدقيقة عالية الكثافة (HD-MEA) المتاحة تجاريا ، والتي تشمل شريحة MEA مع الآلاف من نقاط التسجيل 1,2 ومنصة MEA لتضخيم البيانات ورقمنتها ، أداة ناشئة لأبحاث الفيزيولوجيا الكهربية. تستخدم أنظمة HD-MEA هذه تقنية أشباه الموصلات المعدنية التكميلية (CMOS) لتسجيل البيانات الفيزيولوجية الكهربية بحساسية عالية من مزارع الخلايا ومستحضرات شرائح الدماغ خارج الجسم الحي. توفر أنظمة MEA هذه دقة مكانية وزمانية غير مسبوقة لأبحاث الفسيولوجيا العصبية من خلال كثافة عالية للأقطاب الكهربائية ونسب إشارة إلى ضوضاءعالية الجودة 3. تم استخدام هذه التقنية في الغالب لدراسة إمكانات العمل خارج الخلية ، ولكن يمكنها أيضا التقاط إمكانات المجال المحلي عالية الجودة (LFPs) من مختلف مستحضرات شرائح الدماغ العصبية4،5،6،7،8،9،10،11،12،13،14،15. نظرا لقدرة التسجيل عالية الدقة المذكورة أعلاه لأنظمة CMOS-HD-MEA ، يمكن للمستخدمين تتبع النشاط الفيزيولوجي الكهربي بدقة مكانية كبيرة16،17،18. وهذه الإمكانية ذات صلة خاصة بتتبع أنماط انتشار LFPsللشبكة 5،12،15،19،20،21. لذلك ، يمكن أن توفر أنظمة CMOS-HD-MEA فهما غير مسبوق لأنماط انتشار النشاط الفسيولوجي والمرضي من مختلف مستحضرات زراعة الخلايا وشرائح الدماغ. وتجدر الإشارة بشكل خاص إلى أن هذه القدرات لأنظمة CMOS-HD-MEA يمكن أن تسمح للباحثين بمقارنة أنماط النوبات في مناطق الدماغ المختلفة في وقت واحد وفحص كيفية تأثير المركبات المختلفة المضادة للصرع على هذه الأنماط. من خلال القيام بذلك ، فإنه يوفر طريقة مبتكرة لدراسة التكون الشعاعي وانتشار ictal ولفهم كيف يعطل علم الصيدلة نشاط الشبكة المرضية7،10،14. لذلك ، يمكن أن تساهم هذه القدرات الجديدة لأنظمة CMOS-HD-MEA بشكل كبير في البحث عن الاضطرابات العصبية ، فضلا عن المساعدة في أبحاث اكتشاف الأدوية5،7،11،22. نهدف إلى تقديم تفاصيل حول استخدام أنظمة CMOS-HD-MEA لدراسة النشاط الشبيه بالنوبات.
عند استخدام أنظمة CMOS-HD-MEA لدراسة LFPs ، مثل نشاط الصرع في شرائح الدماغ الحادة ، يمكن للمستخدمين مواجهة العديد من التحديات ، بما في ذلك الضوضاء الكهربائية المنهكة ، والحفاظ على صحة الشريحة أثناء التجربة ، واكتشاف إشارة الجودة من شريحة CMOS-MEA ثنائية الأبعاد (2D) التي تسجل فقط من سطح شريحة الدماغ. يصف هذا البروتوكول الخطوات الأساسية لتأريض منصة MEA والمعدات الأخرى المستخدمة في التجارب بشكل صحيح ، وهي خطوة حاسمة قد تتطلب التخصيص الفردي لكل إعداد مختبر. بالإضافة إلى ذلك ، نناقش خطوات للمساعدة في الحفاظ على صحة شريحة الدماغ أثناء التسجيلات الطويلة في الغرف المغمورة المستخدمة مع أنظمة CMOS-HD-MEA23،24،25. بالإضافة إلى ذلك ، على عكس طرق التسجيل الكهربية الأكثر شيوعا ، والتي تسجل من أعماق شريحة الدماغ ، تستخدم معظم أنظمة CMOS-HD-MEA رقائق 2D التي لا تخترق الشريحة. لذلك ، تتطلب هذه الأنظمة طبقة خارجية عصبية صحية لإنتاج غالبية إشارات LFP المسجلة. وتشمل التحديات الأخرى تصور الكم الهائل من البيانات التي تم إنشاؤها بواسطة الآلاف من الأقطاب الكهربائية. للتغلب على هذه التحديات ، نوصي ببروتوكول بسيط ولكنه فعال يزيد من احتمالية تحقيق نشاط صرع شبكي عالي الجودة ينتشر عبر شريحة الدماغ. نقوم أيضا بتضمين وصف موجز لواجهة المستخدم الرسومية (GUI) المتاحة للجمهور التي طورناها مع الموارد المرتبطة بها للمساعدة في تصور البيانات10.
وقد وفرت المنشورات السابقة بروتوكولات ذات صلة لاستخدام أنظمة التسجيل في الاتفاقات البيئية المتعددة الأطراف26 و27 و28 و29. ومع ذلك ، يهدف هذا العمل إلى مساعدة المجربين الذين يستخدمون أنظمة CMOS-HD-MEA مع رقائق 2D ، وتحديدا أولئك الذين يسعون إلى دراسة نشاط الصرع عالي الجودة من شرائح الدماغ. بالإضافة إلى ذلك ، نقارن اثنين من أكثر عمليات التلاعب بالحلول شيوعا لتحريض النشاط الشبيه بالنوبات ، وهما نماذج 0 Mg2+ و 4-AP ، لمساعدة المستخدمين على تحديد الوسائط المتشنجة الأكثر ملاءمة لتطبيقهم المحدد. على الرغم من أن البروتوكول يركز في المقام الأول على توليد نشاط يشبه النوبات ، إلا أنه يمكن تعديله لاستكشاف الظواهر الفيزيولوجية الكهربية الأخرى باستخدام شرائح الدماغ.
Protocol
تمت الموافقة على الإجراءات التي تنطوي على الفئران من قبل اللجنة المؤسسية لرعاية واستخدام (IACUC) في جامعة بريغهام يونغ. تم استخدام ذكور وإناث (ن = 8) C57BL / 6 الفئران التي تتراوح أعمارها بين P21 على الأقل في التجارب التالية.
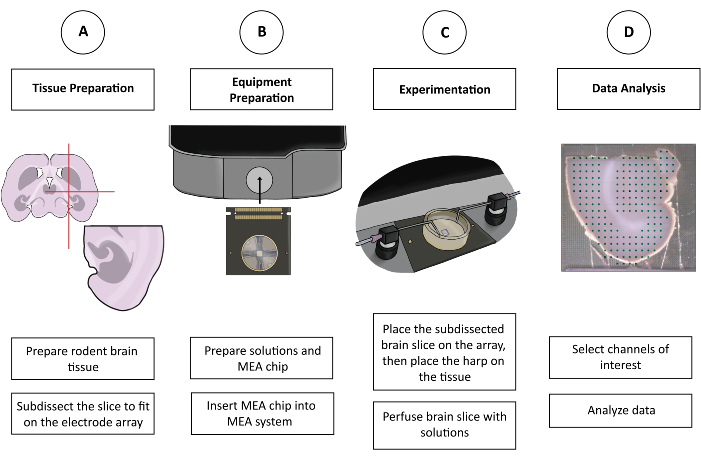
الشكل 1: الشكل التخطيطي لتجربة CMOS-HD-MEA. (A) يتم تحضير شريحة الدماغ بطريقة القطع المفضلة لدى الشخص ويتم تشريحها لتناسب MEA. (ب) إعداد الحلول وشريحة CMOS-HD-MEA. (ج) توضع شريحة الدماغ المقطعة على مصفوفة الأقطاب الكهربائية وتغمرها المحاليل المناسبة. (د) يتم اختيار القنوات ذات الصلة من البيانات التي تم جمعها. ثم يتم إعداد البيانات للتحليل في البرنامج المفضل للمستخدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم | التركيز (مللي مول) | ز / لتر | ||
| كلوريد الصوديوم (كلوريد الصوديوم) | 126 | 7.36 | ||
| كلوريد البوتاسيوم (KCl) | 3.5 | 0.261 | ||
| فوسفات الصوديوم ثنائي الهيدروجين (NaH2PO4) | 1.26 | 0.151 | ||
| بيكربونات الصوديوم (NaHCO3) | 26 | 2.18 | ||
| الجلوكوز (C6H12O6) | 10 | 1.80 | ||
| كلوريد المغنيسيوم (MgCl2) | 1 (من 1 مليون سهم) | 1 مل | ||
| كلوريد الكالسيوم (CaCl2) | 2 (من 1 مليون سهم) | 2 مل | ||
الجدول 1: محلول aCSF.
1. إعداد الحلول
- إعداد الحلول التجريبية.
- تحضير 1 لتر من السائل النخاعي الاصطناعي (aCSF) (انظر الجدول 1 للحصول على التفاصيل).
- تحضير 1 لتر من محلول مؤيد للاختلاج.
ملاحظة: استخدمت المحاليل المستخدمة لتوليد نشاط شبيه بالنوبات في هذا البروتوكول إما aCSF مع 100 ميكرومتر 4-أمينوبيريدين (4-AP) أو aCSF خالية من أيونات المغنيسيوم. - كربوجينات جميع المحاليل لمدة 10 دقائق على الأقل قبل الاستخدام باستخدام الأحجار المسامية.
- احصل على كأس زجاجية للتخلص من المحاليل.
- ضع 1 لتر من السائل الدماغي الشوكي ، و 1 لتر من محلول مؤيد للاختلاج ، والكأس المهملة على سطح قريب من نظام التروية.
- تحضير حلول غرفة القطع والإمساك
- قم بإعداد 0.5 لتر من aCSF ، مع حذف CaCl2 وإضافة 3 mM MgCl2 (مقابل 1 mM) لإنشاء محلول قطع فريد. احتفظ بهذا المحلول لاستخدامه في تحضير شريحة دماغ القوارض عن طريق وضعه بالقرب من منطقة تحضير شريحة الدماغ الحادة.
- تحضير 0.5 لتر من السائل الدماغي الشوكي ووضعه في حجرة الأنسجة التي سيتم استخدامها للاحتفاظ بالشرائح لاستخدامها في التجارب. أدخل الحجارة المسامية في غرفة تثبيت الأنسجة وكربوجين المحلول لمدة 10 دقائق على الأقل قبل وضع الشرائح الفرعية في الحجرة.
2. تحضير شرائح دماغ القوارض
- قم بإعداد جميع الحلول كما هو موضح أعلاه (انظر القسم 1). تأكد من أن جميع المحاليل يتم كربوجينها بشكل صحيح أثناء عملية التحضير.
ملاحظة: يوصى باستخدام محلول القطع (انظر القسم 1.2) ، ولكن يمكن استخدام محاليل القطع الأخرى للحصول على شرائح دماغية عالية الجودة ، مثل محلول قطع السكروز30. - استخدم ميكروتوم مهتز لصنع شرائح دماغ القوارض 350 ميكرومتر. يتم سرد بروتوكولات استخدام هذه الأدوات في المراجع30،31،32،33.
- قم بإعداد شرائح دماغ القوارض لتناسب منطقة قطب التسجيل في شريحة MEA (انظر الشكل 2). استخدم شفرة جراحية بحجم 10 لتشريح الشرائح ، كما هو موضح في الشكل 1 أ والشكل 2 أ ، عن طريق لف الشفرة برفق ذهابا وإيابا على شريحة الدماغ. أداء تشريح فرعي في غرفة قطع microtome تهتز. توخ الحذر حتى لا تتلف شريحة الدماغ التي تم تشريحها.
- ضع الشرائح الفرعية في حجرة تمسك الأنسجة مملوءة ب aCSF. تأكد من كربنة الحجرة لمدة 10 دقائق على الأقل قبل إضافة الشرائح الفرعية المقطعة.
3. إعداد المعدات
- تحضير رقائق ونظام MEA (الشكل 2 والشكل 3)
ملاحظة: يمكن للمواد الصلبة مثل البلاستيك والمعادن أن تتلف شريحة MEA بسهولة إذا اتصلت بقوة بالجزء السفلي من الشريحة جيدا. عند استخدام الماصات لنقل المحلول داخل أو خارج الرقائق ، لا تلامس الجزء السفلي من الشريحة جيدا بالماصة ، خاصة الأقطاب المرجعية الموجودة على جانبي بئر الرقاقة وأقطاب التسجيل في وسط بئر الرقاقة (الشكل 2C). بدلا من ذلك ، أضف المحلول عن طريق التمرير فوق قاع بئر الشريحة أو عن طريق الاتصال أو تقريب الحواف البلاستيكية لبئر الشريحة. لسحب كل المحلول بسهولة ، قم بإمالة الشريحة قليلا للسماح للمحلول بالتجمع على جانب واحد من الشريحة جيدا وإزالته من أعلى المحلول المجمع ، أو استخدم مسحا مضادا للكهرباء الساكنة للربت برفق على المناطق التي لا تزال تحتوي على الحل. لا تنقل الشريحة عن طريق إمساك الشريحة جيدا أو دبابيس الرقاقة (الشكل 2C). يمكن أن يحتوي بئر الرقاقة على حوالي 4 مل من المحلول. بالنسبة للخطوات اللاحقة ، املأ الشريحة جيدا بحوالي 2 مل من المحلول إذا لم يتم تحديد خلاف ذلك.- قم بتعيين ماصات النقل للمهام المختلفة قبل البدء في إعداد الشريحة. قم بتسمية ماصة نقل واحدة للإيثانول ، وواحدة للنفايات ، وأخرى ل aCSF ، وغيرها لأي حلول متبقية لمنع الخلط غير المقصود.
- املأ بئر شريحة MEA بإيثانول مقاوم 190 بحيث يتم تغطية قاع بئر الرقاقة بالكامل (الشكل 3). دع الإيثانول يجلس لمدة 30-60 ثانية ، ثم قم بإزالته باستخدام ماصة مهملة.
- املأ بئر شريحة MEA ب aCSF وقم بإزالتها باستخدام ماصة مهملة لشطف الإيثانول المتبقي من بئر الرقاقة. أضف وإزالة aCSF من بئر الشريحة ثلاث مرات ، باستخدام نفايات وماصات aCSF المحددة مسبقا. بعد غسل الشريحة جيدا ثلاث مرات ، أضف aCSF واتركها لمدة 30 ثانية على الأقل.
ملاحظة: تظهر أقطاب التسجيل أقل قدر من الضوضاء من التفاعلات الكارهة للماء عندما يظل aCSF في الغرفة لمدة 45 دقيقة على الأقل بعد الشطف بالإيثانول و aCSF. - قبل إرساء شريحة MEA ، بلل منديلا مضادا للكهرباء الساكنة بإيثانول مقاوم 190 واستخدمه لمسح دبابيس الشريحة (الشكل 2C).
- حرك شريحة MEA برفق في منصة MEA وقم بإشراك آلية الإرساء لتثبيت الشريحة في مكانها.
- تحقق من أقطاب التسجيل والرجوع للفقاعات (الشكل 2C). في حالة وجود فقاعات ، خذ فرشاة طلاء نظيفة وامسح برفق على الأقطاب الكهربائية لإزالتها.
- تحقق من الشريحة بحثا عن الضوضاء باستخدام برنامج CMOS-HD-MEA34 وامسح خريطة الألوان الزائفة بصريا بحثا عن الفقاعات أو التذبذبات غير البيولوجية أو الارتفاعات الناتجة عن التداخل الكهربائي. قم بتأريض نظام MEA بشكل مناسب لإبطال أي ضوضاء تمت مواجهتها.
ملاحظة: سيعتمد إعداد التأريض على بيئة التسجيل. بالنسبة للتجارب في هذا البروتوكول ، تم تأريض منصة MEA ونظام التروية.
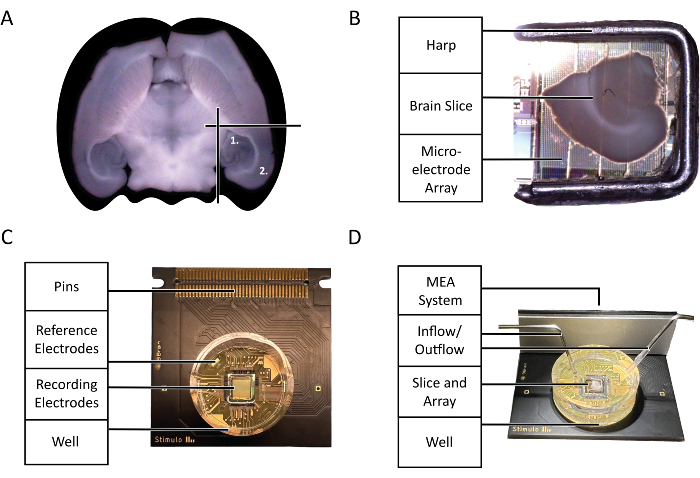
الشكل 2: مخططات التكوين والتكنولوجيا. (أ) رسم تخطيطي لاختيار شرائح دماغ الفأر الحادة المستخدمة في التجربة التي أبرزها هذا البروتوكول. (1) منطقة الحصين (2) منطقة القشرة المخية الحديثة. (ب) الوضع الصحيح لشريحة دماغ الفأر الحادة والقيثارة على مصفوفة الأقطاب الكهربائية الدقيقة (MEA). ج: تشريح شريحة 3Brain Accura CMOS-HD-MEA. د: التكوين الصحيح لمداخل ومنافذ التروية. يجب أن يكون الإدخال عميقا في بئر الرقاقة ، بينما يجب أن يكون الإخراج على الجانب الآخر من المدخل في الجزء العلوي من بئر الشريحة لضمان التدفق المستمر ل aCSF الطازج المؤكسج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
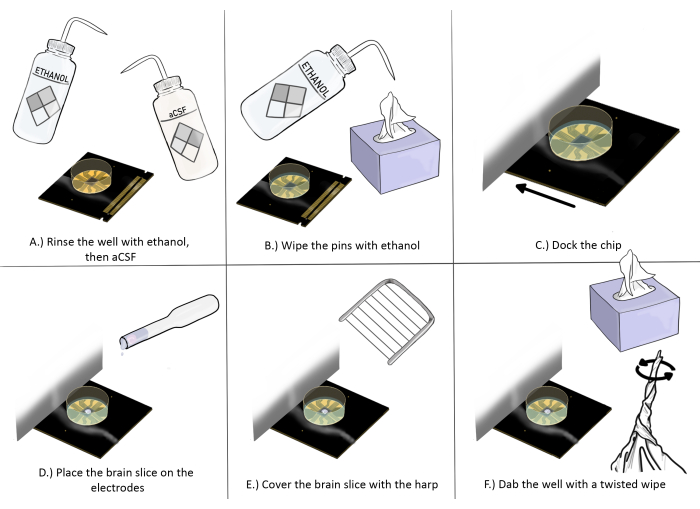
الشكل 3: رسم تخطيطي لإعداد الرقاقة ووضعها لتجارب شرائح الدماغ. (أ) اشطف الرقاقة جيدا بالإيثانول مرة واحدة ، ثم aCSF ثلاث مرات. (ب) امسح المسامير بالإيثانول باستخدام مناديل مضادة للكهرباء الساكنة. (ج) إرساء الشريحة. د: ضع شريحة الدماغ على الأقطاب الكهربائية. (ه) ضع القيثارة على شريحة الدماغ (انظر الشكل 2 للحصول على إرشادات التنسيب المناسب). (F) ضع زاوية بئر أقطاب التسجيل بالقرب من شريحة الدماغ بمسح ملتوي مضاد للكهرباء الساكنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التجريب
- وضع شريحة الدماغ
- ضع قيثارة بلاتينية في قارب وزن (أو سطح نظيف آخر) بالقرب من منصة MEA. قم بتغطية القيثارة بحوالي 3 مل من aCSF لتقليل ميولها الكارهة للماء.
- استخدم المقص لإزالة الجزء الرفيع من ماصة النقل. قطع ثلث ، حوالي 1.5 بوصة ، من طرف الماصة.
ملاحظة: لن تؤدي هذه الماصة المعدلة إلى تضييق أو إتلاف شريحة الدماغ أثناء التجميع والنقل. - اجمع شريحة دماغ من حجرة الاحتفاظ بالشريحة باستخدام الماصة المعدلة. قم بتوزيع شريحة الدماغ وأي محلول في الماصة برفق في بئر الشريحة. لوضع الشريحة بشكل صحيح ، حرر برفق المزيد من aCSF من ماصة النقل لمعالجة موضع شريحة الدماغ أو استخدم فرشاة رسم ناعمة لإنشاء تيار في المحلول يدفع شريحة الدماغ إلى أقطاب التسجيل. قلل من ملامسة أقطاب التسجيل أو شريحة الدماغ لتقليل الضرر.
- باستخدام الملقط ، ضع القيثارة برفق فوق شريحة الدماغ مع الخيوط لأسفل للضغط على الشريحة على أقطاب التسجيل. تجنب ملامسة مصفوفة الأقطاب الكهربائية مع القيثارة. قم بتوجيه القيثارة بحيث يواجه الجانب بدون إطار نحو إبرة التدفق ، ولا يتصل إطار القيثارة بأي من أقطاب التسجيل (الشكل 2C ، D).
- خذ ماصة التخلص منها وقم بإزالة السائل الدماغي الشوكي الزائد. خذ مسحا مضادا للكهرباء الساكنة ، وقم بلف زاوية لإنشاء طرف ، واستخدمه لامتصاص aCSF المتبقي المحيط بأقطاب التسجيل دون لمس أقطاب التسجيل أو شريحة الدماغ أو القيثارة (الشكل 2).
- باستخدام ماصة aCSF المخصصة ، أضف بسرعة ما يكفي من aCSF الكربوجيني لتغطية شريحة الدماغ ، حوالي 2 مل.
- كرر الخطوة 4.1.5. و 4.1.6. مرتين أخريين.
- املأ البئر ب aCSF الكربوجيني حتى يمتلئ البئر تقريبا ، حوالي 3 مل.
- التقط صورة لشريحة الدماغ على شريحة MEA باستخدام المجهر أو الكاميرا. تأكد من أن الصورة ذات دقة عالية بما يكفي لرؤية حدود صفيف قطب التسجيل وتشريح شريحة الدماغ.
- تشغيل التجربة
- تشغيل نظام التروية
- ضع أنابيب التدفق الداخلة والخارجة في الدورق المملوء ب aCSF وإبر التدفق الداخلة والخارجة في بئر الرقاقة. ضع إبرة التدفق بالقرب من قاع الشريحة خارج أقطاب التسجيل مباشرة. ضع إبرة التدفق الخارجي بالقرب من الجزء العلوي من بئر الرقاقة باتجاه الحافة بحيث يرتفع السائل تقريبا إلى حافة بئر الرقاقة ، حوالي 4 مل ، ويتم غمر الشريحة طوال التجربة (الشكل 2 د).
- اضبط تدفق التروية على 5 مل/دقيقة وتدفق التروية الخارجة على 7 مل/دقيقة.
ملاحظة: يوصى بأن يتجاوز معدل التدفق الخارج معدل التدفق لتجنب تجاوز المحلول من بئر الشريحة ولإنشاء تيار محلول فوق شريحة الدماغ. - قم بتشغيل التدفق الداخل والخارج. قم بإزالة إبرة التدفق من بئر الشريحة حتى تبدأ الإبرة في إخراج المحلول بدلا من الهواء. ثم ضع الإبرة مرة أخرى إلى موضعها داخل البئر كما هو موضح في الخطوة 4.2.1.1.
- استخدم سخان المحلول للحفاظ على المحلول عند درجة الحرارة الفسيولوجية أو بالقرب منها ، حوالي 34-37 درجة مئوية.
- دع السائل الدماغي النخاعي يتغلغل على شريحة الدماغ لمدة 10 دقائق. سيسمح ذلك للشريحة بالتكيف مع بيئة التسجيل.
- بعد انقضاء 10 دقائق ، حرك أنبوب التدفق إلى الدورق المهمل. بعد ذلك، حرك أنبوب التدفق إلى الكأس الزجاجية التي تحتوي على المحلول المؤيد للاختلاج. اسمح بإخراج السائل الدماغي النخاعي غير المتشنج من نظام التروية إلى الدورق المهملة لمدة 10 دقائق.
- انقل أنبوب التدفق الخارج إلى الكأس الزجاجية التي تحتوي على المحلول المؤيد للاختلاج.
- دع المحلول المؤيد للاختلاج يدور حتى تنتهي التجربة.
- إذا تجاوزت مدة تسجيل الشريحة 2 ساعة ، ففكر في إعداد محلول آخر مؤيد للاختلاج لتعويض استهلاك الجلوكوز لشريحة الدماغ النشطة.
- تبادل شرائح الدماغ
- قم بإيقاف تشغيل التدفق. قم بإيقاف تشغيل التدفق الخارجي بعد 10-15 ثانية.
- استخدم الملقط لإزالة القيثارة ووضعها على قارب وزن أو سطح آخر.
- استخدم ماصة معدلة لاستخراج شريحة الدماغ والتخلص منها. لا تلمس الأقطاب الكهربائية المرجعية أو مجموعة أقطاب التسجيل (الشكل 2C).
- ضع أنبوب التدفق في الكأس الزجاجية التي تحتوي على محلول السائل الدماغي النخاعي غير المتشنج. ضع أنبوب التدفق الخارج في الدورق المهمل. اترك إبر التدفق والتدفق في الشريحة جيدا. قم بتشغيل نظام التروية لمدة 10 دقائق لإزالة كل المحلول المتبقي المؤيد للاختلاج من بئر الرقاقة ونظام التروية. ابدأ عملية التجريب مرة أخرى بشريحة دماغية جديدة (تبدأ من الخطوة 4.1).
- تشغيل نظام التروية
- الانتهاء من التجربة
- تنظيف الحفارة
- قم بإزالة القيثارة وشريحة الدماغ والمحلول من البئر ، على التوالي.
- قم بفك شريحة MEA ، وضعها على سطح نظيف ، واملأ الشريحة جيدا بالماء منزوع الأيونات.
- تخلص من الماء منزوع الأيونات لإزالة أي أملاح متبقية من محاليل السائل الدماغي النخاعي.
- باستخدام ماصة النقل ، املأ الشريحة جيدا بمحلول منظف. حرك طرف ماصة النقل في بئر الشريحة ووجهها إلى أقطاب التسجيل. قم بالضغط بسرعة وبشكل متكرر على المنظف وإطلاقه في ماصة النقل لغسل المنظف بقوة فوق أقطاب التسجيل لمدة 1 دقيقة. دع المنظف يرتاح لمدة 5-10 دقائق.
- قم بإزالة المنظف ، ثم اشطف الشريحة جيدا 4-6 مرات بالماء منزوع الأيونات لإزالة محلول المنظف وأي مواد مذابة متبقية.
- قم بإزالة كل الماء من بئر الرقاقة ، ثم ضع منديلا مضادا للكهرباء الساكنة فوق شريحة MEA واتركه طوال الليل للسماح للرقاقة بالجفاف.
- ضع وعاء وزن أو صفيحة أخرى مانعة لتسرب الماء على منصة تسجيل MEA حيث استقرت شريحة MEA سابقا. ضع القيثارة في وسط اللوحة وضع إبر التدفق والتدفق على جانبي القيثارة.
- نظف نظام التروية والقيثارة عن طريق إرسال 50 mL من الماء، و50 mL من الإيثانول المقاوم 140، و200 mL من الماء، على الترتيب، عبر الأنبوب إلى الكأس الزجاجية المهملة.
ملاحظة: في هذا الوقت ، يمكن زيادة سرعات التروية لتقليل وقت التنظيف ، ولكن يجب أن تتجاوز سرعة التدفق الخارجي دائما سرعة التدفق لتجنب الفيضانات. - نظف حصوات الكربوكين عن طريق وضعها في كأس من الماء المقطر وإرسال الكربوجين عبر الأنبوب لمدة 5 دقائق. ضعها لترتاح على سطح جاف ونظيف طوال الليل وقم بتغطيتها لتجنب تراكم الغبار.
- تنظيف الحفارة
5. تحليل البيانات
ملاحظة: هناك مجموعة متنوعة من حزم التحليل المستخدمة لتحليل البيانات الفيزيولوجية الكهربية التي تنتجها CMOS-HD-MEAs ، بما في ذلك BrainWave من 3Brain ، وفارز سبايك آخر (YASS) ، وأدوات Python المخصصة34،35،36،37. قمنا باستخراج البيانات من تنسيق ملف بيانات BrainWave لاستخدامها في منصة تحليل Xenon LFP لإنشاء البيانات المعروضة في الشكل 4 والشكل 5. تم استخدام كود Matlab المخصص لتحليل البيانات في الشكل 6. بروتوكولات منصة تحليل Xenon LFP متاحة للجمهور10. خطوات البروتوكول التالية خاصة بالتسجيلات التي تم إجراؤها باستخدام Brainwave 438 ؛ بالنسبة للأنظمة الأخرى ، راجع الوثائق الداعمة المتعلقة بتلك الأنظمة34،35،36،37. وترد أدناه نظرة عامة على خطوات التحليل المتخذة لإنتاج البيانات باستخدام هذا البروتوكول. للحصول على تفاصيل كاملة حول كيفية تصدير البيانات وتصورها وتحليلها، بما في ذلك مقاطع الفيديو التعليمية وجميع ملفات التعليمات البرمجية ذات الصلة، راجع39.
- تصدير ملف التسجيل للتحليل.
- قم بإنشاء مجلد لملف (ملفات) تسجيل البيانات الذي سيتم تقليله.
- قم بقص الصورة التي تم التقاطها أثناء الخطوة 4.1.9 لتضمين صفيف التسجيل فقط مع شرائح الدماغ.
- افتح ملف ExportToHDF5-ChannelSelection.py (يمكن الوصول إلى ملف الكود هذا على GitHub ضمن xenon-lfp-analysis/code-files/3Brain-processing40) وانسخ والصق عنوان URL المدرج في الجزء العلوي من النافذة في متصفح الإنترنت.
- أدخل مسار الملف لملف تسجيل البيانات وقم بتحميل الصورة التي تم اقتصاصها للصفيف المرتبط بالتسجيل.
- ضمن تحديد قنوات للتصدير، استخدم أداة التحديد الحر لتحديد مناطق الحصين والقشرة المخية الحديثة المعروضة على الصورة التي تم اقتصاصها للمصفوفة.
- قم بتعيين كل من عدد الصفوف المراد تخطيها وعدد الأعمدة المراد تخطيها إلى 2.
ملاحظة: غالبا ما تكون ملفات التسجيل كبيرة ؛ إذا كان ذلك مناسبا للتحليل المطلوب ، يمكن تقليل البيانات المصدرة. توجد خيارات لتقليل العينة مكانيا (عن طريق تخطي صفوف وأعمدة أقطاب التسجيل) وزمنيا (عن طريق الاختزال إلى تردد أخذ عينات أقل). في التحليل ، يتم تخطي كل صفين وعمودين ؛ وهذا يسمح باختزال البيانات مكانيا دون التحيز لقنوات معينة. كل قناة متباعدة بما فيه الكفاية بحيث يمكن أن تكون الاختلافات في النشاط كبيرة بينهما ؛ لذلك ، لا يتم إجراء حساب متوسط للقناة. عند تخطي صفوف وأعمدة الأقطاب الكهربائية ، لا يتم تضمين البيانات من القنوات غير المحددة عند تصدير ملف الإخراج. - اضبط تردد الاختزال على 300 هرتز.
- انقر زر تصدير القنوات لإنشاء ملف تحديد القناة.
ملاحظة: سيقوم البرنامج تلقائيا بحفظ ملف اختيار القناة في المجلد حيث يتم حفظ ملف تسجيل البيانات. - افتح ملف ExportToHDF5-ExtractDownsample.py (الموجود أيضا على GitHub ضمن xenon-lfp-analysis/code-files/3brain-processing40) ، والصق مسار ملف المجلد الذي يحتوي على ملف (ملفات) اختيار القناة وملف (ملفات) تسجيل البيانات ، واضغط على Enter على لوحة المفاتيح لإنشاء الإصدار المختزل من ملف تسجيل البيانات.
- استخدام منصة التحليل
- في موجه أوامر الكمبيوتر ، اكتب run_lfp_analysis واضغط على Enter لفتح منصة التحليل.
- أدخل مسارات ملف الصورة وملف التسجيل المختزل وانقر فوق إرسال.
- ضمن تحديد نطاق زمني للتحليل، حدد التسجيل بأكمله.
- ضمن تحديد قنوات للمؤامرات ، قم بتمييز الحصين كمجموعة -1 والقشرة المخية الحديثة كمجموعة-2.
- ضمن القناة النقطية، اضبط العتبة على 0.06 مللي فولت والمدة الزمنية على 0.02 ثانية.
- انقر فوق تطبيق الإعدادات وإنشاء البيانات النقطية.
- استخدم المخطط النقطي لاستكشاف القنوات المختلفة التي تعرض أنماط النشاط محل الاهتمام.
ملاحظة: انظر الشكل 4 للحصول على أمثلة على النشاط الشبيه بالنوبات عالي الجودة (الشكل 4A-D) مقابل النشاط دون المستوى الأمثل (الشكل 4E-F).
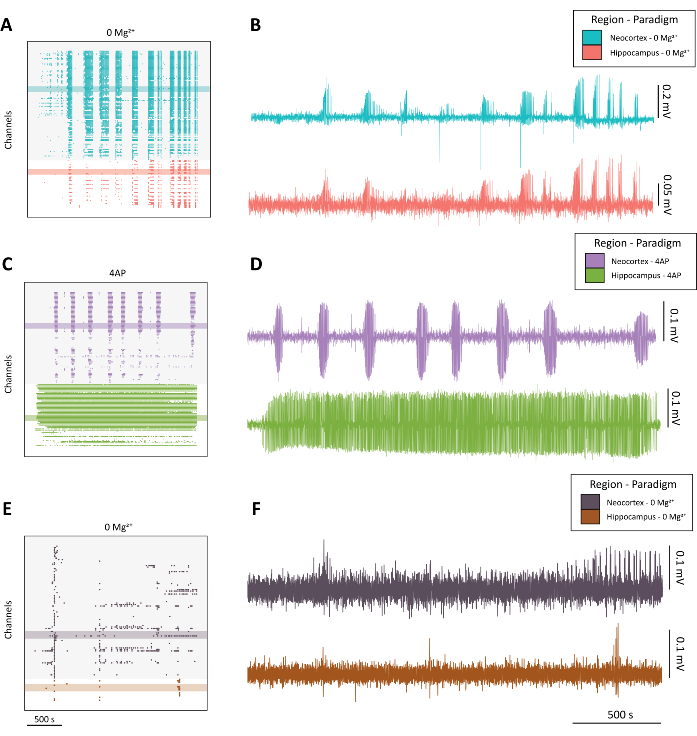
الشكل 4: مثال على تطور نشاط الصرع من نماذج 0 Mg2+ و 4-AP. (أ) مثال على مخطط نقطي من تطبيق aCSF مع 0 Mg2+ على مدار 40 دقيقة تقريبا. (B) مثال على آثار الفيزيولوجيا الكهربية المأخوذة من القشرة المخية الحديثة (الأزرق) والحصين (الأحمر) التي توضح نشاط الصرع من نموذج 0 Mg2+ . (ج) مثال على مخطط نقطي من التطبيق 100 mM 4-AP على مدار 40 دقيقة تقريبا. (د) مثال على آثار الفيزيولوجيا الكهربية المأخوذة من القشرة المخية الحديثة (أرجواني) والحصين (أخضر) توضح نشاط الصرع من تطبيق 4-AP. (ه) مثال على مخطط نقطي من تطبيق aCSF مع 0 Mg2+ على مدار 40 دقيقة تقريبا يظهر نشاط الانفجار بدلا من النشاط الشبيه بالنوبات كما هو موجود في الآثار التمثيلية الأخرى. (F) مثال على آثار الفيزيولوجيا الكهربية المأخوذة من القشرة المخية الحديثة (الأرجواني الداكن) والحصين (الصدأ) التي توضح نشاطا دون المستوى الأمثل من نموذج 0 Mg2+ المخصص للمقارنة مع النشاط الشبيه بالنوبات النوعية الموجود في B و D. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
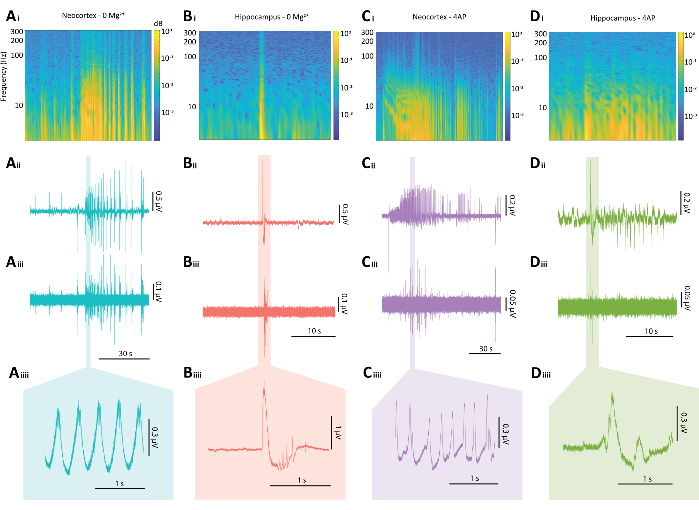
الشكل 5: النتائج التمثيلية لتصريفات الصرع من كل من نماذج 0 Mg2+ و 4-AP. (أ) أمثلة على مخططات لحدث نموذجي يشبه نوبة القشرة المخية الحديثة الناجم عن نموذج 0 Mg2+ بما في ذلك (Ai) مخطط طيفي من حدث يشبه النوبة ، (Aii) التتبع الفيزيولوجي الكهربي المرتبط به ، (Aiii) مرشح تمرير عالي 80 هرتز مطبق على التتبع من Aii ، (Aiiii) وقسم مكبر من التتبع من Aii. (ب) أمثلة على مخططات لانفجار صرع قرني نموذجي ناتج عن نموذج 0 Mg2+ بما في ذلك (Bi) مخطط طيفي لانفجار الصرع ، (Bii) التتبع الكهربي المرتبط به ، (Biii) مرشح تمرير عالي 80 هرتز مطبق على التتبع من Bii ، (Biiii) وقسم مكبرة من التتبع من Bii (C) مثال على مخططات لحدث نموذجي يشبه نوبة القشرة المخية الحديثة الناجم عن نموذج 4-AP بما في ذلك (Ci) مخطط طيفي لنشاط الصرع ، (Cii) التتبع الكهربي المرتبط به ، (Ciii) مرشح تمرير عالي 80 هرتز مطبق على التتبع من Cii ، (Ciiii) وقسم مكبرة من التتبع من Cii (D) مثال على مخططات انفجار الصرع الحصين تحت نموذج 4-AP بما في ذلك (Di) مخطط طيفي لنشاط الصرع ، (Dii) التتبع الفيزيولوجي الكهربي المرتبط به ، (Diii) مرشح تمرير عالي 80 هرتز مطبق على التتبع من Dii ، (Diiii) وقسم مكبرة من التتبع من Dii. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
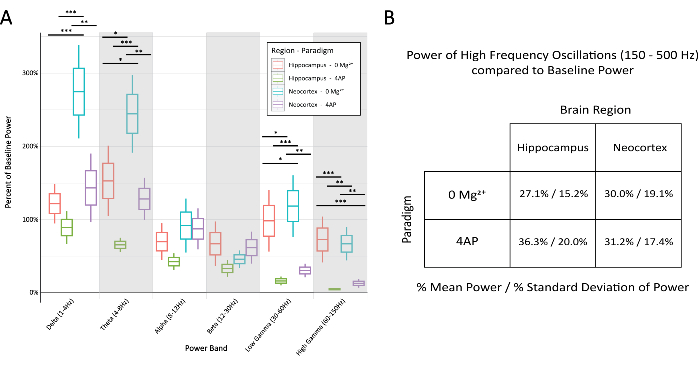
الشكل 6: مقارنة النسبة المئوية لقوة خط الأساس في النطاقات المختلفة عبر النموذج ومنطقة الدماغ أثناء إفرازات الصرع النمطية. (أ) كانت القدرة أثناء تفريغ الصرع مختلفة بشكل كبير بين النماذج ومناطق الدماغ لمعظم نطاقات التردد (2-way ANOVA مع اختبار Tukey ، * P < 0.05 ، ** P < 0.001 ، ***P < 0.0001). يمثل الخط الأوسط لكل مربع المتوسط ، وحدود المربع ±1 الخطأ المعياري للمتوسط (SEM) ، والخطوط الخارجية ±2 SEM. (ب) أظهرت كل من النماذج ومناطق الدماغ قوة محدودة في النطاقات المتعلقة بنشاط التردد العالي فوق 150 هرتز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
كما هو معتاد عند تصور النشاط من العديد من القنوات1،4،5،10 ، نجد أنه من المفيد أولا إنشاء مخطط نقطي للبيانات التي نحصل عليها باستخدام CMOS-HD-MEA (الشكل 4A ، C ، E). يمكن أن تخلق ...
Discussion
يتضمن هذا البروتوكول إرشادات محددة تتعلق بإدارة شرائح الدماغ الحادة التي تعالج المشكلات الشائعة التي يواجهها مستخدمو CMOS-HD-MEA ، وهي تطوير الضوضاء تحت شريحة الدماغ والحفاظ على بيئة صحية لشريحة الدماغ. يحدث تطور الضوضاء تحت الشريحة عندما لا تلتصق الشريحة بشكل صحيح بالمصفو...
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح مرتبط بهذه الدراسة البحثية.
Acknowledgements
يشكر المؤلفون أعضاء مختبر باريش السابقين والحاليين على تعديلاتهم على هذه المخطوطة. نود أيضا أن نشكر أليساندرو ماكيوني من 3Brain على ملاحظاته حول هذا العمل. تم تمويل هذا العمل من قبل جائزة AES / EF Junior Investigator ومن قبل كليات علوم الحياة والعلوم الفيزيائية والرياضية بجامعة بريغهام يونغ.
Materials
| Name | Company | Catalog Number | Comments |
| 2D Workbench | Cloudray | LM04CLLD26B | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| Accura Chip | 3Brain | Accura HD-MEA | CMOS-HD-MEA chip |
| Agarose | Thermo Fisher Scientific | BP160-100 | |
| Vibration isolation table | Kinetic Systems | 91010124 | |
| Beaker for the slice holding chamber, 270 mL | VWR | 10754-772 | |
| BioCam | 3Brain | BioCAM DupleX | CMOS-HD-MEA platform |
| Brainwave Software | 3Brain | Version 4 | CMOS-HD-MEA software |
| Calcium Chloride | Thermo Fisher Scientific | BP510-500 | |
| Carbogen | Airgas | X02OX95C2003102 | |
| Carbogen | Airgas | 12005 | |
| Carbogen Stones | Supelco | 59277 | |
| Compresstome | Precissionary | VF-300-0Z | |
| Computer | Dell | Precission3650 | |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | |
| Detergent | Metrex | 10-4100-0000 | |
| D-Glucose | Macron Fine Chemicals | 4912-12 | |
| Dihydrogen Sodium Phosphate | Thermo Fisher Scientific | BP329-500 | |
| DinoCam | Dino-Lite | AM73915MZTL | |
| Ethanol | Thermo Fisher Scientific | A407P-4 | |
| Forceps | Fine Science Tools | 11980-13 | |
| Hot plate | Thermo Fisher Scientific | SP88857200 | |
| Ice Machine | Hoshizaki | F801MWH | |
| Inflow and outflow needles | Jensen Global | JG 18-3.0X | |
| Inline Solution Heater | Warner Instruments | SH-27B | |
| Isofluorine | Dechra | 08PB-STE22002-0122 | |
| Kim Wipes | Thermo Fisher Scientific | 06-666 | |
| Magnesium Chloride | Thermo Fisher Scientific | FLM33500 | |
| Micropipets | Gilson | F144069 | |
| Mili-Q Water Filter | Mili-Q | ZR0Q008WW | |
| Paintbrush | Daler Rowney | AF85 Round: 0 | |
| Paper Filter | Whatman | EW-06648-24 | |
| Parafilm | American National Can | PM996 | |
| Perfusion System | Multi Channel System | PPS2 | |
| Pipetor | Thermo Fisher Scientific | FB14955202 | |
| Platinum Harp | 3Brain | 3Brain | |
| Potassium Chloride | Thermo Fisher Scientific | P330-3 | |
| Razor blade | Personna | BP9020 | |
| Scale | Metter Toledo | AB204 | |
| Scissors | Solingen | 92008 | |
| Slice Holding Chamber | Custom | Custom | Custom 3D Printer Design, available upon request |
| Sodium Bicarbonate | Macron Fine Chemicals | 7412-06 | |
| Sodium Chloride | Thermo Fisher Scientific | S271-3 | |
| Temperature Control Box | Warner Instruments | TC344B | |
| Transfer Pipettes | Genesee Scientific | 30-200 | |
| Tubing | Tygon | B-44-3 TPE | |
| Vibratome VZ-300 | Precissionary | VF-00-VM-NC | |
| Weigh Boat | Electron Microscopy Sciences | 70040 |
References
- Obien, M. E. J., Frey, U. Large-scale, high-resolution microelectrode arrays for interrogation of neurons and networks. Adv Neurobiol. 22, 83-123 (2019).
- Schroter, M., et al. Functional imaging of brain organoids using high-density microelectrode arrays. MRS Bull. 47 (6), 530-544 (2022).
- Miccoli, B., et al. High-density electrical recording and impedance imaging with a multi-modal CMOS multi-electrode array chip. Front Neurosci. 13, 641 (2019).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471 (2023).
- Ferrea, E., et al. high-resolution electrophysiological imaging of field potentials in brain slices with microelectronic multielectrode arrays. Front Neural Circuits. 6, 80 (2012).
- Gagliano, G., et al. Non-linear frequency dependence of neurovascular coupling in the cerebellar cortex implies vasodilation-vasoconstriction competition. Cells. 11 (6), 1047 (2022).
- Goodchild, S. J., et al. Molecular pharmacology of selective Na(V)1.6 and dual Na(V)1.6/Na(V)1.2 channel inhibitors that suppress excitatory neuronal activity ex vivo. ACS Chem Neurosci. 15 (6), 1169-1184 (2024).
- Hu, X., Khanzada, S., Klutsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834 (2022).
- Kim, S., et al. Alteration of neural network and hippocampal slice activation through exosomes derived from 5XFAD nasal lavage fluid. Int J Mol Sci. 24 (18), 14064 (2023).
- Mahadevan, A., Codadu, N. K., Parrish, R. R. Xenon LFP analysis platform is a novel graphical user interface for analysis of local field potential from large-scale MEA recordings. Front Neurosci. 16, 904931 (2022).
- Medrihan, L., Ferrea, E., Greco, B., Baldelli, P., Benfenati, F. Asynchronous GABA release is a key determinant of tonic inhibition and controls neuronal excitability: A study in the synapsin II-/- mouse. Cereb Cortex. 25 (10), 3356-3368 (2015).
- Monteverdi, A., Di Domenico, D., D'Angelo, E., Mapelli, L. Anisotropy and frequency dependence of signal propagation in the cerebellar circuit revealed by high-density multielectrode array recordings. Biomedicines. 11 (5), 1475 (2023).
- Obien, M. E. J., Hierlemann, A., Frey, U. Accurate signal-source localization in brain slices by means of high-density microelectrode arrays. Sci Rep. 9 (1), 788 (2019).
- Thouta, S., et al. Pharmacological determination of the fractional block of Nav channels required to impair neuronal excitability and ex vivo seizures. Front Cell Neurosci. 16, 964691 (2022).
- Tognolina, M., Monteverdi, A., D'Angelo, E. Discovering microcircuit secrets with multi-spot imaging and electrophysiological recordings: The example of cerebellar network dynamics. Front Cell Neurosci. 16, 805670 (2022).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays. Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Maccione, A., et al. Experimental investigation on spontaneously active hippocampal cultures recorded by means of high-density MEAs: Analysis of the spatial resolution effects. Front Neuroeng. 3, 4 (2010).
- van Vliet, E., et al. Electrophysiological recording of re-aggregating brain cell cultures on multi-electrode arrays to detect acute neurotoxic effects. Neurotoxicology. 28 (6), 1136-1146 (2007).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. Annu Int Conf IEEE Eng Med Biol Soc. 2022, 3111-3114 (2022).
- Veleanu, M., et al. Modified climbing fiber/Purkinje cell synaptic connectivity in the cerebellum of the neonatal phencyclidine model of schizophrenia. Proc Natl Acad Sci U S A. 119 (21), e2122544119 (2022).
- Giansante, G., et al. Neuronal network activity and connectivity are impaired in a conditional knockout mouse model with PCDH19 mosaic expression. Mol Psychiatry. , (2023).
- Dossi, E., Blauwblomme, T., Nabbout, R., Huberfeld, G., Rouach, N. Multi-electrode array recordings of human epileptic postoperative cortical tissue. J Vis Exp. (92), e51870 (2014).
- Hajos, N., et al. Maintaining network activity in submerged hippocampal slices: importance of oxygen supply. Eur J Neurosci. 29 (2), 319-327 (2009).
- Hill, M. R., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. J Neurosci Methods. 195 (1), 15-23 (2011).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE Translational Task Force of the ILAE. Epilepsia. 58 (Suppl 4), 40-52 (2017).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), 2056 (2010).
- Lin, C. H., Lee, J. K., LaBarge, M. A. Fabrication and use of microenvironment microarrays (MEArrays). J Vis Exp. (68), 4152 (2012).
- Panuccio, G., Colombi, I., Chiappalone, M. Recording and modulation of epileptiform activity in rodent brain slices coupled to microelectrode arrays. J Vis Exp. 135, 57548 (2018).
- Patel, C., Muthuswamy, J. High efficiency, site-specific transfection of adherent cells with siRNA using microelectrode arrays (MEA). J Vis Exp. 67, e4415 (2012).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Papouin, T., Haydon, P. G. Obtaining acute brain slices. Bio Protoc. 8 (2), e2699 (2018).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. J Vis Exp. 132, 53825 (2018).
- Van Hoeymissen, E., Philippaert, K., Vennekens, R., Vriens, J., Held, K. Horizontal hippocampal slices of the mouse brain. J Vis Exp. (163), 61753 (2020).
- . 3Brain Available from: https://www.3brain.com/ (2022)
- Bridges, D. C., Tovar, K. R., Wu, B., Hansma, P. K., Kosik, K. S. MEA Viewer: A high-performance interactive application for visualizing electrophysiological data. PLoS One. 13 (2), e0192477 (2018).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc Natl Acad Sci U S A. 113 (27), 7337-7344 (2016).
- Maccione, A., et al. Microelectronics, bioinformatics and neurocomputation for massive neuronal recordings in brain circuits with large scale multielectrode array probes. Brain Res Bull. 119 (Pt B), 118-126 (2015).
- . 3Brain Available from: https://www.3brain.com/products/software/brainwave4 (2022)
- Mahadevan, A. . Xenon LFP Analysis. , (2022).
- Mahadevan, A. . xenon-lfp-analysis github. , (2022).
- Codadu, N. K., et al. Divergent paths to seizure-like events. Physiol Rep. 7 (19), e14226 (2019).
- Kirsch, G. E., Drewe, J. A. Gating-dependent mechanism of 4-aminopyridine block in two related potassium channels. J Gen Physiol. 102 (5), 797-816 (1993).
- Levesque, M., Salami, P., Behr, C., Avoli, M. Temporal lobe epileptiform activity following systemic administration of 4-aminopyridine in rats. Epilepsia. 54 (4), 596-604 (2013).
- Myers, T. L., Gonzalez, O. C., Stein, J. B., Bazhenov, M. Characterizing concentration-dependent neural dynamics of 4-Aminopyridine-induced epileptiform activity. Epilepsy J. 4 (2), 128 (2018).
- Perreault, P., Avoli, M. Physiology and pharmacology of epileptiform activity induced by 4-aminopyridine in rat hippocampal slices. J Neurophysiol. 65 (4), 771-785 (1991).
- Rutecki, P. A., Lebeda, F. J., Johnston, D. 4-Aminopyridine produces epileptiform activity in hippocampus and enhances synaptic excitation and inhibition. J Neurophysiol. 57 (6), 1911-1924 (1987).
- Chen, Y., Chad, J. E., Cannon, R. C., Wheal, H. V. Reduced Mg2+ blockade of synaptically activated N-methyl-D-aspartate receptor-channels in CA1 pyramidal neurons in kainic acid-lesioned rat hippocampus. Neuroscience. 88 (3), 727-739 (1999).
- Fujiwara-Tsukamoto, Y., Isomura, Y., Takada, M. Comparable GABAergic mechanisms of hippocampal seizure-like activity in posttetanic and low-Mg2+ conditions. J Neurophysiol. 95 (3), 2013-2019 (2006).
- Swartzwelder, H. S., Anderson, W. W., Wilson, W. A. Mechanism of electrographic seizure generation in the hippocampal slice in Mg2+-free medium: the role of GABAa inhibition. Epilepsy Res. 2 (4), 239-245 (1988).
- Trevelyan, A. J., Graham, R. T., Parrish, R. R., Codadu, N. K. Synergistic positive feedback mechanisms underlying seizure initiation. Epilepsy Curr. 23 (1), 38-43 (2023).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81 (1-2), 103-111 (1998).
- Hajos, N., Mody, I. Establishing a physiological environment for visualized in vitro brain slice recordings by increasing oxygen supply and modifying aCSF content. J Neurosci Methods. 183 (2), 107-113 (2009).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Andrew, R. D., et al. The critical role of spreading depolarizations in early brain injury: Consensus and contention. Neurocrit Care. 37 (Suppl 1), 83-101 (2022).
- Devonshire, I. M., Dommett, E. J., Grandy, T. H., Halliday, A. C., Greenfield, S. A. Environmental enrichment differentially modifies specific components of sensory-evoked activity in rat barrel cortex as revealed by simultaneous electrophysiological recordings and optical imaging in vivo. Neuroscience. 170 (2), 662-669 (2010).
- Parrish, R. R., Codadu, N. K., Mackenzie-Gray Scott, C., Trevelyan, A. J. Feedforward inhibition ahead of ictal wavefronts is provided by both parvalbumin- and somatostatin-expressing interneurons. J Physiol. 597 (8), 2297-2314 (2019).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Curr Opin Neurobiol. 50, 171-178 (2018).
- Yaksi, E., Jamali, A., Diaz Verdugo, C., Jurisch-Yaksi, N. Past, present and future of zebrafish in epilepsy research. FEBS J. 288 (24), 7243-7255 (2021).
- He, M. F., et al. Ex vivo calcium imaging for drosophila model of epilepsy. J Vis Exp. 200, 65825 (2023).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Commun Biol. 4 (1), 136 (2021).
- Parrish, R. R., Grady, J., Codadu, N. K., Trevelyan, A. J., Racca, C. Simultaneous profiling of activity patterns in multiple neuronal subclasses. J Neurosci Methods. 303, 16-29 (2018).
- Valderhaug, V. D., et al. Criticality as a measure of developing proteinopathy in engineered human neural networks. bioRxiv. , (2020).
- Carleo, G., Lee, Y. -. S., Secondo, A., Miceli, F., Taglialatela, M. Multi-electrode array (MEASs) to investigate pathogenetic disease mechanisms and pharmacological properties in iPSC-derived neurons modelling neuropsychiatric diseases. , 667-672 (2022).
- Ruz, I. D., Schultz, S. R. Localising and classifying neurons from high density MEA recordings. J Neurosci Methods. 233, 115-128 (2014).
- Franke, F., Natora, M., Boucsein, C., Munk, M. H. J., Obermayer, K. An online spike detection and spike classification algorithm capable of instantaneous resolution of overlapping spikes. J Comput Neurosci. 29 (1-2), 127-148 (2010).
- Vollgraf, R., Obermayer, K. Improved optimal linear filters for the discrimination of multichannel waveform templates for spike-sorting applications. IEEE Signal Processing Letters. 13 (3), 121-124 (2006).
- Muller, J., et al. High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels. Lab Chip. 15 (13), 2767-2780 (2015).
- Mapelli, L., et al. implementation, and functional validation of a new generation of microneedle 3D high-density CMOS multi-electrode array for brain tissue and spheroids. bioRxiv. , (2022).
- Reddy, D. S., Kuruba, R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci. 14 (9), 18284-18318 (2013).
- Parrish, R. R., Trevelyan, A. J. Stress-testing the brain to understand its breaking points. J Physiol. 596 (11), 2033-2034 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved