Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высококачественная судорожная активность из острых срезов головного мозга с использованием комплементарной системы микроэлектродных матриц высокой плотности металл-оксид-полупроводник
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы описываем протокол использования комплементарных систем микроэлектродных матриц высокой плотности (CMOS-HD-MEAs) для регистрации судорожной активности из срезов мозга ex vivo .
Аннотация
Комплементарные системы микроэлектродной матрицы высокой плотности металл-оксид-полупроводник (CMOS-HD-MEA) могут регистрировать нейрофизиологическую активность клеточных культур и срезов мозга ex vivo с беспрецедентной электрофизиологической детализацией. КМОП-HD-MEA сначала были оптимизированы для регистрации высококачественной активности нейронных единиц из клеточных культур, но также было показано, что они производят качественные данные из острых срезов сетчатки и мозжечка. Исследователи недавно использовали CMOS-HD-MEA для регистрации локальных полевых потенциалов (LFP) из острых корковых срезов мозга грызунов. Одним из LFP, представляющим интерес, является судорожная активность. В то время как многие пользователи производят кратковременные, спонтанные эпилептиформные разряды с помощью CMOS-HD-MEA, лишь немногие пользователи надежно демонстрируют качественную судорожную активность. Многие факторы могут способствовать этой трудности, в том числе электрический шум, непостоянный характер создания судорожной активности при использовании погружных записывающих камер и ограничение, заключающееся в том, что 2D CMOS-MEA чипы записывают только с поверхности среза мозга. Методы, описанные в этом протоколе, должны позволить пользователям последовательно индуцировать и регистрировать высококачественную судорожную активность из острых срезов мозга с помощью системы CMOS-HD-MEA. Кроме того, в этом протоколе описывается надлежащее обращение с чипами CMOS-HD-MEA, управление растворами и срезами мозга во время экспериментов, а также техническое обслуживание оборудования.
Введение
Коммерчески доступные системы микроэлектродных матриц высокой плотности (HD-MEA), которые включают в себя чип MEA с тысячами точек записи 1,2 и платформу MEA для усиления и оцифровки данных, являются новым инструментом для электрофизиологических исследований. В этих системах HD-MEA используется комплементарная технология металл-оксид-полупроводник (CMOS) для записи электрофизиологических данных с высокой чувствительностью от клеточных культур и препаратов среза мозга ex vivo. Эти системы MEA обеспечивают беспрецедентное пространственное и временное разрешение нейрофизиологических исследований благодаря высокой плотности электродов и качественному соотношению сигнал/шум3. Эта технология в основном используется для изучения потенциалов внеклеточного действия, но она также может захватывать высококачественные потенциалы локального поля (LFP) из различных препаратов нейронных срезов мозга 4,5,6,7,8,9,10,11,12,13,14,15 . Благодаря вышеупомянутой возможности записи с высоким разрешением систем CMOS-HD-MEA, пользователи могут отслеживать электрофизиологическую активность с большой пространственной точностью16,17,18. Эта возможность особенно актуальна для отслеживания шаблонов распространения сетевых LFP 5,12,15,19,20,21. Таким образом, системы CMOS-HD-MEA могут обеспечить беспрецедентное понимание закономерностей распространения физиологической и патологической активности из различных клеточных культур и препаратов срезов мозга. Следует особо отметить, что эти возможности систем CMOS-HD-MEA могут позволить исследователям сопоставлять паттерны припадков в разных областях мозга одновременно и анализировать, как различные противоэпилептические соединения влияют на эти паттерны. Таким образом, он предоставляет инновационный метод для изучения иктогенеза и распространения иктала, а также для понимания того, как фармакология нарушает патологическую сетевую активность 7,10,14. Таким образом, эти новые возможности систем CMOS-HD-MEA могут внести значительный вклад в исследование неврологических расстройств, а также помочь в исследованиях по разработке лекарств 5,7,11,22. Мы стремимся предоставить подробную информацию об использовании систем CMOS-HD-MEA для изучения судорожной активности.
При использовании систем CMOS-HD-MEA для изучения LFP, таких как эпилептиформная активность в острых срезах мозга, пользователи могут столкнуться со многими проблемами, включая изнурительный электрический шум, сохранение среза здоровым во время экспериментов и обнаружение качественного сигнала от двумерного (2D) чипа CMOS-MEA, который записывает только с поверхности среза мозга. В этом протоколе описываются основные шаги по правильному заземлению платформы MEA и другого оборудования, используемого в экспериментах, что является важным этапом, который может потребовать индивидуальной настройки для каждой лабораторной установки. Кроме того, мы обсуждаем шаги, которые помогут сохранить срез мозга здоровым во время длительных записей в погружных камерах, используемых с системами CMOS-HD-MEA 23,24,25. Кроме того, в отличие от более распространенных электрофизиологических методов записи, которые записывают из глубины среза мозга, большинство систем CMOS-HD-MEA используют 2D-чипы, которые не проникают в срез. Таким образом, эти системы нуждаются в здоровом внешнем слое нейронов для производства большинства записанных сигналов LFP. Другие проблемы включают в себя визуализацию огромного количества данных, генерируемых тысячами электродов. Чтобы преодолеть эти проблемы, мы рекомендуем простой, но эффективный протокол, который увеличивает вероятность достижения высококачественной сетевой эпилептиформной активности, распространяющейся по всему срезу мозга. Мы также включаем краткое описание общедоступного графического пользовательского интерфейса (GUI), который мы разработали вместе с соответствующими ресурсами для помощи в визуализации данных10.
В предыдущих публикациях были представлены соответствующие протоколы для использования систем регистрации MEA 26,27,28,29. Тем не менее, эта работа направлена на помощь экспериментаторам, использующим системы CMOS-HD-MEA с 2D-чипами, особенно тем, кто стремится изучить высококачественную эпилептиформную активность из срезов мозга. Кроме того, мы сравниваем две наиболее распространенные манипуляции с растворами для индукции судорожной активности, а именно парадигмы 0 мг2+ и 4-AP, чтобы помочь пользователям определить наиболее подходящие конвульсивные среды для их конкретного применения. Хотя протокол ориентирован в первую очередь на генерацию судорожной активности, он может быть модифицирован для изучения других электрофизиологических явлений с использованием срезов мозга.
Access restricted. Please log in or start a trial to view this content.
протокол
Процедуры с участием мышей были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) в Университете имени Бригама Янга. Самцы и самки (n = 8) мышей C57BL/6 в возрасте не менее P21 использовались в следующих экспериментах.
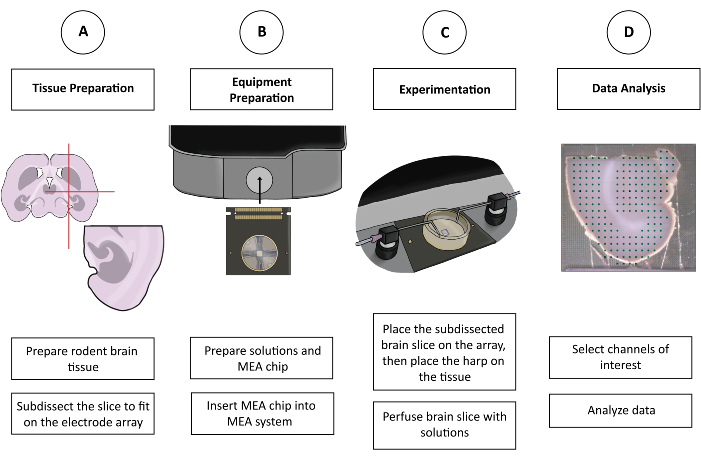
Рисунок 1: Схематический рисунок эксперимента CMOS-HD-MEA. (A) Срез мозга подготавливается предпочитаемым методом резки и подразделяется по размеру на MEA. (B) Подготовьте растворы и микросхему CMOS-HD-MEA. (C) Подрасчлененный срез мозга помещается на электродную решетку и купается в соответствующих растворах. (D) Из собранных данных выбираются соответствующие каналы. Затем данные подготавливаются для анализа в предпочитаемой пользователем программе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Имя | Концентрация (мМ) | г/л | ||
| Хлорид натрия (NaCl) | 126 | 7.36 | ||
| Хлорид калия (KCl) | 3.5 | 0.261 | ||
| Дигидрофосфат натрия (2PO4) | 1.26 | 0.151 | ||
| Бикарбонат натрия (NaHCO3) | 26 | 2.18 | ||
| Глюкоза (С6Ч12О6) | 10 | 1.80 | ||
| Хлорид магния (MgCl2) | 1 (из 1 М склада) | 1 мл | ||
| Хлорид кальция (CaCl2) | 2 (из 1 М стока) | 2 мл | ||
Таблица 1: Решение aCSF.
1. Приготовление растворов
- Подготовьте экспериментальные растворы.
- Приготовьте 1 л искусственной спинномозговой жидкости (аКСФ) (подробнее см. Таблицу 1 ).
- Приготовьте 1 л просудорожного раствора.
Примечание: Растворы, используемые для создания судорожной активности в этом протоколе, использовали либо aCSF со 100 μM 4-аминопиридином (4-AP), либо aCSF без ионов магния. - Перед применением все растворы карбогенировать не менее чем за 10 минут с использованием пористых камней.
- Приобретите стакан для отбрасывания растворов.
- Поместите 1 л кислотномозговой жидкости, 1 л просудорожного раствора и выброшенный стакан на поверхность, близкую к перфузионной системе.
- Подготовка решений для камер резки и выдержки
- Приготовьте 0,5 л кислотномозговой жидкости, исключив CaCl2 и добавив 3 мМ MgCl2(вместо 1 мМ), чтобы создать уникальное режущее решение. Сохраните этот раствор для использования при приготовлении среза мозга грызунов, поместив его рядом с областью подготовки острого среза мозга.
- Приготовьте 0,5 л аКСФ и поместите его в камеру для хранения тканей, которая будет использоваться для хранения ломтиков для использования в экспериментах. Вставьте пористые камни в камеру для удержания тканей и карбогенируйте раствор в течение не менее 10 минут, прежде чем поместить в камеру подрассеченные ломтики.
2. Готовим срезы мозга грызуна
- Приготовьте все растворы, как описано выше (см. раздел 1). Убедитесь, что все растворы правильно карбогенированы в процессе приготовления.
ПРИМЕЧАНИЕ: Рекомендуется использовать режущий раствор (см. раздел 1.2), но для получения качественных срезов мозга можно использовать и другие режущие растворы, такие как раствор для резки сахарозы30. - С помощью вибрирующего микротома сделайте срезы мозга грызуна размером 350 мкм. Протоколы использования этих инструментов перечислены в справочниках 30,31,32,33.
- Подготовьте срезы мозга грызунов, чтобы они поместились на регистрирующем электроде чипа MEA (см. рисунок 2). Используйте хирургическое лезвие размера 10, чтобы подразделить срезы, как показано на Рисунке 1А и Рисунке 2А , осторожно перекатывая лезвие вперед и назад по срезу мозга. Выполните субдиссекцию в камере резки вибрирующего микротома. Соблюдайте осторожность, чтобы не повредить подрасчлененный срез мозга.
- Поместите подрассеченные срезы в тканевую камеру, заполненную ХКБ. Убедитесь, что камера была карбогенирована в течение не менее 10 минут, прежде чем добавлять подразделенные ломтики.
3. Подготовка оборудования
- Подготовка микросхем и системы MEA (Рисунок 2 и Рисунок 3)
ПРИМЕЧАНИЕ: Твердые материалы, такие как пластик и металлы, могут легко повредить микросхему MEA, если они сильно соприкасаются с нижней частью чипа. При использовании пипеток для переноса раствора внутрь или из чипов не соприкасайтесь с нижней частью чипа с пипеткой, особенно с электродами сравнения по бокам ячейки чипа и записывающими электродами в центре ячейки чипа (рис. 2C). Вместо этого добавьте раствор, наведя курсор на дно ячейки стружки или соприкоснувшись с пластиковыми краями ячейки или приблизившись к ним. Чтобы легко вытащить весь раствор, слегка наклоните стружку, чтобы раствор успел скапливаться на одной стороне стружки, и удалите его с верхней части скапливающегося раствора, или используйте антистатическую салфетку, чтобы слегка промокнуть участки, где все еще находится раствор. Не транспортируйте стружку, хорошо удерживая микросхему или штифты для стружки (Рисунок 2C). Колодец чипа может вместить примерно 4 мл раствора. На последующих этапах хорошо заполните чип примерно 2 мл раствора, если не указано иное.- Назначьте трансферные пипетки для различных задач перед началом подготовки чипов. Пометьте одну переводную дозатор для этанола, одну — для отходов, третью — для аCSF, а третьи — для любых оставшихся растворов, чтобы предотвратить непреднамеренное смешивание.
- Заполните лунку чипа MEA 190-градусным этанолом так, чтобы дно колодца чипа было полностью закрыто (рис. 3). Дайте этанолу постоять 30-60 с, затем удалите его с помощью пипетки.
- Заполните лунку чипа MEA аминокислотой и удалите ее с помощью пипетки, чтобы вымыть остатки этанола из микросхемы. Добавьте и удалите aCSF из чипа три раза с помощью ранее обозначенных пипеток для отходов и aCSF. Хорошо промыв чип три раза, добавьте aCSF и дайте ему постоять не менее 30 с.
ПРИМЕЧАНИЕ: Регистрирующие электроды демонстрируют наименьшее количество шума от гидрофобных взаимодействий, когда aCSF остается в камере не менее 45 минут после промывки этанолом и aCSF. - Перед установкой чипа MEA на док-станцию смочите антистатическую салфетку этанолом 190-градусной прослойки и протрите контактами чипа (рис. 2C).
- Аккуратно вставьте микросхему MEA в платформу MEA и задействуйте стыковочный механизм, чтобы зафиксировать микросхему на месте.
- Проверьте записывающие электроды и электроды сравнения на наличие пузырьков (рис. 2C). Если пузырьки присутствуют, возьмите чистую кисть и слегка проведите по электродам, чтобы удалить их.
- Проверьте микросхему на наличие шума с помощью программного обеспечения CMOS-HD-MEA34 и визуально отсканируйте карту ложных цветов на наличие пузырьков, небиологических колебаний или скачков, вызванных электрическими помехами. Заземлите систему MEA соответствующим образом, чтобы свести на нет любой возникающий шум.
ПРИМЕЧАНИЕ: Настройка заземления будет зависеть от среды записи. Для экспериментов по этому протоколу платформа MEA и перфузионная система были заземлены.
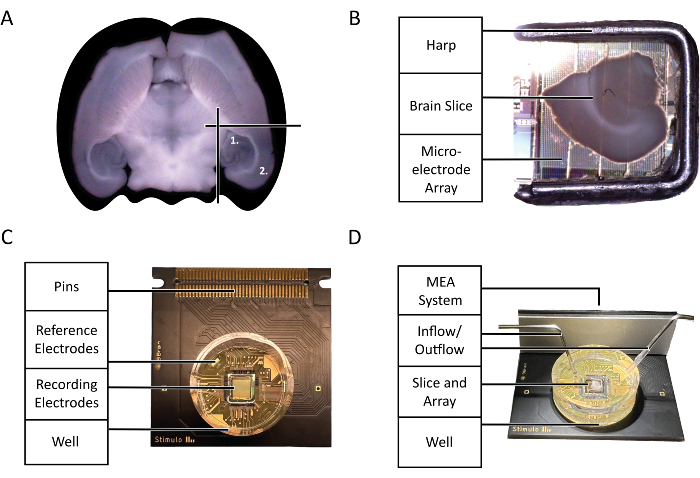
Рисунок 2: Конфигурационные и технологические схемы. (А) Диаграмма отбора острых срезов мозга мыши, использованных в эксперименте, выделенном в этом протоколе. (1) Область гиппокампа (2) Область неокортекса. (B) Правильное размещение острого среза мозга мыши и арфы на микроэлектродной решетке (MEA). (C) Анатомия чипа 3Brain Accura CMOS-HD-MEA. (D) Правильная конфигурация входных и выходных отверстий для перфузии. Вход должен находиться глубоко в колодце чипа, тогда как выход должен находиться на противоположной стороне входного отверстия в верхней части колодца чипа, чтобы гарантировать постоянный поток свежего, насыщенного кислородом аCSF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
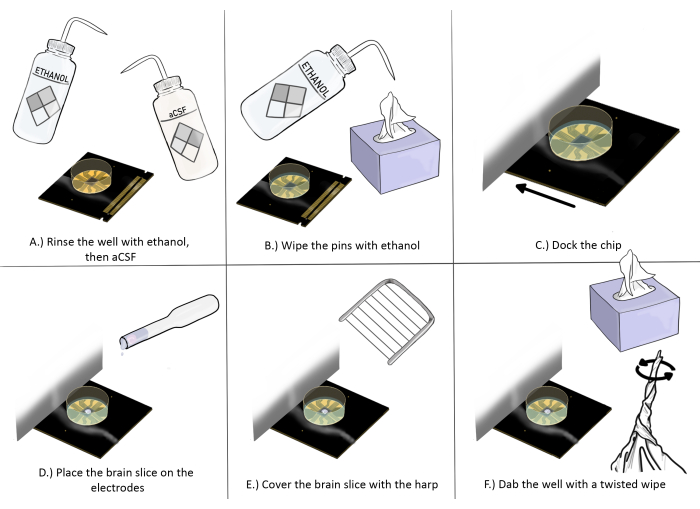
Рисунок 3: Принципиальная схема подготовки и размещения чипа для экспериментов со срезом мозга. (A) Хорошо промойте чип этанолом один раз, затем aCSF три раза. (B) Протрите контакты этанолом с помощью антистатической салфетки. (C) Установите чип в док-станцию. (D) Поместите срез мозга на электроды. (E) Поместите арфу на срез мозга (см. Рисунок 2 для правильных рекомендаций по размещению). (F) Промокните угол лунки записывающих электродов рядом с срезом мозга скрученной антистатической салфеткой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Экспериментирование
- Размещение среза мозга
- Поместите платиновую арфу в весовую лодку (или другую чистую поверхность) рядом с платформой MEA. Накройте арфу примерно 3 мл аКСФ, чтобы уменьшить ее гидрофобные тенденции.
- С помощью ножниц удалите тонкую часть переводной пипетки. Отрежьте треть, примерно 1,5 дюйма, кончика пипетки.
ПРИМЕЧАНИЕ: Эта модифицированная пипетка не сдавливает и не повреждает срез мозга во время сбора и транспортировки. - Соберите срез мозга из камеры для удержания среза с помощью модифицированной пипетки. Аккуратно выдавите срез мозга и любой раствор из пипетки в чип в лунку. Чтобы правильно расположить срез, аккуратно выпустите больше aCSF из передаточной пипетки, чтобы манипулировать положением среза мозга, или используйте мягкую кисть для создания тока в растворе, который толкает срез мозга на записывающие электроды. Ограничьте контакт с записывающими электродами или срезом мозга, чтобы свести к минимуму повреждение.
- С помощью щипцов аккуратно поместите арфу на срез мозга нитями вниз, чтобы прижать срез к записывающим электродам. Избегайте контакта электродной решетки с арфой. Расположите арфу так, чтобы сторона без рамы была обращена к входной игле, а рама арфы не соприкасалась ни с одним из записывающих электродов (рис. 2C, D).
- Возьмите выброшенную пипетку и удалите излишки кислотномозговой жидкости. Возьмите антистатическую салфетку, скрутите уголок, чтобы получился наконечник, и используйте его, чтобы впитать оставшийся aCSF вокруг записывающих электродов, не касаясь записывающих электродов, среза мозга или арфы (рисунок 2).
- С помощью специальной пипетки aCSF быстро добавьте достаточное количество карбогенированного aCSF, чтобы покрыть срез мозга, около 2 мл.
- Повторите шаг 4.1.5. и 4.1.6. еще два раза.
- Заполните лунку карбогенированным аCSF до тех пор, пока лунка не заполнится примерно на 3/4, около 3 мл.
- Сфотографируйте срез мозга на чипе MEA с помощью микроскопа или камеры. Убедитесь, что фотография имеет достаточно высокое разрешение, чтобы увидеть границы записывающей электродной решетки и анатомию среза мозга.
- Проведение эксперимента
- Эксплуатация перфузионной системы
- Поместите входную и выходную трубки в стакан, наполненный aCSF, а входные и выходные иглы - в отверстие для чипа. Поместите входную иглу близко к нижней части микросхемы, сразу за записывающими электродами. Поместите иглу оттока близко к верхней части чипа по направлению к краю так, чтобы жидкость поднималась почти до краев чипа, около 4 мл, и срез был погружен в воду на протяжении всего эксперимента (рис. 2D).
- Установите приток перфузии на 5 мл/мин, а отток перфузии на 7 мл/мин.
ПРИМЕЧАНИЕ: Рекомендуется, чтобы скорость оттока превышала скорость притока, чтобы избежать перелива раствора из микросхемы и создать ток раствора над срезом мозга. - Включите приток и отток. Хорошо снимите входную иглу с чипа до тех пор, пока игла не начнет выводить раствор вместо воздуха. Затем верните иглу на свое место внутри микросхемы, как описано в шаге 4.2.1.1.
- Используйте нагреватель раствора, чтобы поддерживать физиологическую температуру раствора на уровне или близкой к ней, около 34-37 °C.
- Дайте аКСФ перфузировать срез мозга в течение 10 минут. Это позволит слайсу приспособиться к среде записи.
- По истечении 10 минут переместите выпускную трубку к стакану для выброса. Затем переместите впускную трубку к стакану, содержащему просудорожный раствор. Дайте несудорожному аккренокислому фильтру вымыться из перфузионной системы в стакан для выброса в течение 10 минут.
- Перенесите отводящую трубку в стакан, содержащий просудорожный раствор.
- Дайте просудорожному раствору цикличность до окончания эксперимента.
- Если продолжительность записи среза превышает 2 ч, рассмотрите возможность приготовления другого просудорожного раствора для компенсации потребления глюкозы активным срезом мозга.
- Обмен срезами мозга
- Отключите приток. Через 10-15 с выключите отток.
- С помощью щипцов снимите арфу и положите ее на весовую лодку или другую поверхность.
- С помощью модифицированной пипетки извлеките и отбросьте срез мозга. Не прикасайтесь к электродам сравнения или решетке записывающих электродов (Рисунок 2C).
- Поместите впускную трубку в стакан, содержащий не вызывающий судорог раствор aCSF. Поместите отводящую трубку в стакан для выброса. Хорошо оставьте иглы притока и оттока в чипе. Запустите перфузионную систему в течение 10 минут, чтобы удалить весь остаточный просудорожный раствор из микросхемы и перфузионной системы. Начните процесс эксперимента заново с нового среза мозга (начиная с шага 4.1).
- Эксплуатация перфузионной системы
- Завершение эксперимента
- Очистка буровой установки
- Извлеките из лунки арфу, срез мозга и раствор соответственно.
- Отстыкуйте чип MEA, поместите его на чистую поверхность и хорошо заполните чип деионизированной водой.
- Выбросьте деионизированную воду, чтобы очистить все соли, оставшиеся от растворов aCSF.
- С помощью переводной пипетки хорошо заполните чип раствором моющего средства. Наведите кончик переводной пипетки в ячейку чипа и направьте его на записывающие электроды. Быстро и многократно выдавите и выпустите моющее средство в переводную пипетку, чтобы энергично смыть моющее средство на записывающих электродах в течение 1 минуты. Дайте моющему средству отдохнуть 5-10 минут.
- Удалите моющее средство, затем хорошо промойте чип 4-6 раз деионизированной водой, чтобы удалить раствор моющего средства и любые оставшиеся растворенные вещества.
- Хорошо удалите всю воду из чипа, затем нанесите антистатическую салфетку на чип MEA и оставьте на ночь, чтобы чип хорошо высох.
- Поместите весы или другую водонепроницаемую пластину на платформу регистрации MEA в том месте, где ранее находился чип MEA. Поместите арфу в центр тарелки и поместите иглы притока и оттока по обе стороны от арфы.
- Очистите перфузионную систему и арфузу, направив 50 мл воды, 50 мл 140-градусного этанола и 200 мл воды соответственно через трубку в стакан для выброса.
ПРИМЕЧАНИЕ: В это время скорость перфузии может быть увеличена, чтобы сократить время очистки, но скорость оттока всегда должна превышать скорость входа, чтобы избежать затопления. - Очистите камни карбогена, поместив их в стакан с дистиллированной водой и отправив карбоген через трубку на 5 минут. Положите их на сухую чистую поверхность на ночь и накройте крышкой, чтобы избежать скопления пыли.
- Очистка буровой установки
5. Анализ данных
ПРИМЕЧАНИЕ: Существуют различные аналитические пакеты, используемые для анализа электрофизиологических данных, полученных с помощью CMOS-HD-MEA, включая BrainWave от 3Brain, Yet Another Spike Sorter (YASS) и пользовательские инструменты Python 34,35,36,37. Мы извлекли данные из формата файла данных BrainWave для использования в платформе Xenon LFP Analysis для получения данных, представленных на рисунках 4 и 5. Для анализа данных был использован пользовательский код Matlab, показанный на рисунке 6. Протоколы для платформы Xenon LFP Analysis находятся в открытом доступе10. Следующие шаги протокола относятся к записям, сделанным с помощью Brainwave 438; Для других систем см. сопроводительную документацию, относящуюся к этим системам 34,35,36,37. Ниже приведен обзор этапов анализа, предпринятых для получения данных с помощью этого протокола. Полные сведения об экспорте, визуализации и анализе данных, включая обучающие видеоролики и все соответствующие файлы кода, см.в пункте 39.
- Экспортируйте файл записи для анализа.
- Создайте папку для файлов записи данных, которые будут дискретизированы.
- Обрежьте изображение, сделанное на шаге 4.1.9, чтобы включить в него только массив записей со срезами мозга.
- Откройте файл ExportToHDF5-ChannelSelection.py (этот файл кода можно найти на GitHub по адресу xenon-lfp-analysis/code-files/3Brain-processing40) и скопируйте и вставьте URL-адрес, указанный в верхней части окна, в интернет-браузер.
- Введите путь к файлу записи данных и загрузите обрезанное изображение массива, связанного с записью.
- В разделе «Выбрать каналы для экспорта» используйте инструмент выбора лассо, чтобы выбрать области гиппокампа и неокортекса, показанные на обрезанном изображении массива.
- Задайте количество строк для пропуска и количество столбцов для пропуска равными 2.
ПРИМЕЧАНИЕ: Файлы записи часто имеют большой размер; Если это подходит для желаемого анализа, экспортируемые данные могут быть уменьшены. Существуют варианты понижения дискретизации в пространстве (путем пропуска строк и столбцов записывающих электродов) и во времени (путем понижения дискретизации до более низкой частоты дискретизации). При анализе пропускаются каждые 2 строки и 2 столбца; Это позволяет понижать дискретизацию данных в пространстве без смещения в определенные каналы. Каждый канал находится достаточно далеко друг от друга, поэтому различия в активности между ними могут быть значительными; Поэтому усреднение каналов не производится. При пропуске строк и столбцов электродов данные из невыбранных каналов не включаются при экспорте выходного файла. - Установите частоту понижения частоты дискретизации на 300 Гц.
- Нажмите кнопку «Экспорт каналов », чтобы создать файл выбора канала.
ПРИМЕЧАНИЕ: Программное обеспечение автоматически сохранит файл выбора канала в папку, в которой сохранен файл записи данных. - Откройте файл ExportToHDF5-ExtractDownsample.py (также найденный на GitHub по адресу xenon-lfp-analysis/code-files/3brain-processing40), вставьте путь к папке, содержащей файлы выбора каналов и файлы записи данных, и нажмите клавишу Enter на клавиатуре, чтобы создать версию записи данных с уменьшенной дискретизацией.
- Использование аналитической платформы
- В командной строке компьютера введите run_lfp_analysis и нажмите клавишу Enter, чтобы открыть платформу анализа.
- Введите пути к файлам изображения и файла записи с уменьшенной дискретизацией и нажмите «Отправить».
- В разделе Выберите временной диапазон для анализа выберите всю запись.
- В разделе «Выбор каналов для графиков» выделите гиппокамп как группу 1, а неокортекс — как группу 2.
- В разделе Растр канала установите Пороговое значение на 0,06 мВ и Продолжительность времени на 0,02 с.
- Нажмите Применить настройки и Создать растр.
- Используйте растровый график для изучения различных каналов, которые показывают интересующие вас закономерности активности.
ПРИМЕЧАНИЕ: На рисунке 4 приведены примеры высококачественной судорожной активности (рисунок 4A-D) по сравнению с субоптимальной активностью (рисунок 4E-F).
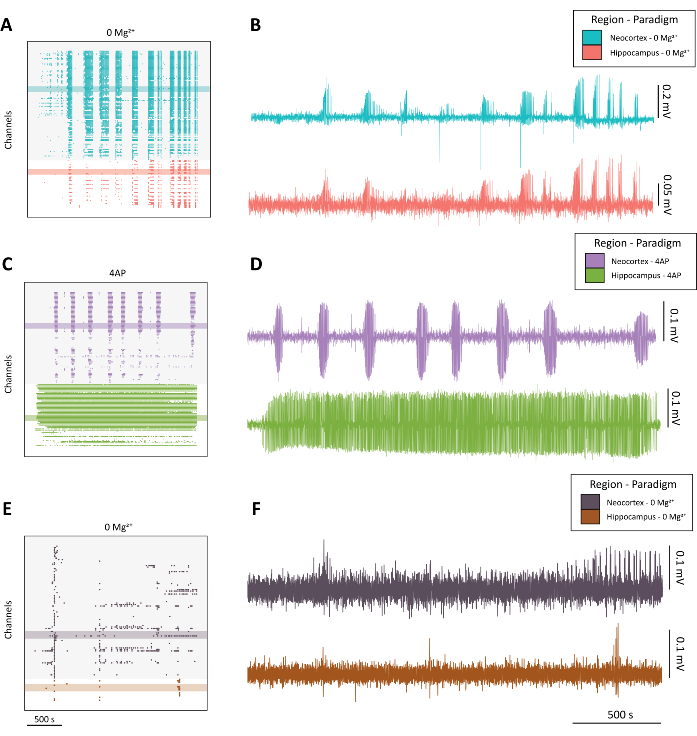
Рисунок 4: Пример развития эпилептиформной активности в парадигмах 0 Mg2+ и 4-AP. (A) Пример растрового графика из применения aCSF с 0 Mg2+ в течение примерно 40 мин. (B) Пример электрофизиологических следов, взятых из неокортекса (синий) и гиппокампа (красный), демонстрирующих эпилептиформную активность в парадигме 0 Mg2+ . (C) Пример растрового графика из приложения 100 мМ 4-AP в течение приблизительно 40 мин. (D) Пример электрофизиологических следов, взятых из неокортекса (фиолетовый) и гиппокампа (зеленый), демонстрирующих эпилептиформную активность при применении 4-AP. (E) Пример растрового графика из применения aCSF с 0 Mg2+ в течение примерно 40 минут, показывающий взрывную активность в отличие от судорожной активности, как это было обнаружено в других репрезентативных следах. (F) Пример электрофизиологических следов, взятых из неокортекса (темно-фиолетовый) и гиппокампа (ржавчина), демонстрирующих неоптимальную активность в парадигме 0 Mg2+ , предназначенный для сравнения с качественной судорожной активностью, обнаруженной у B и D. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
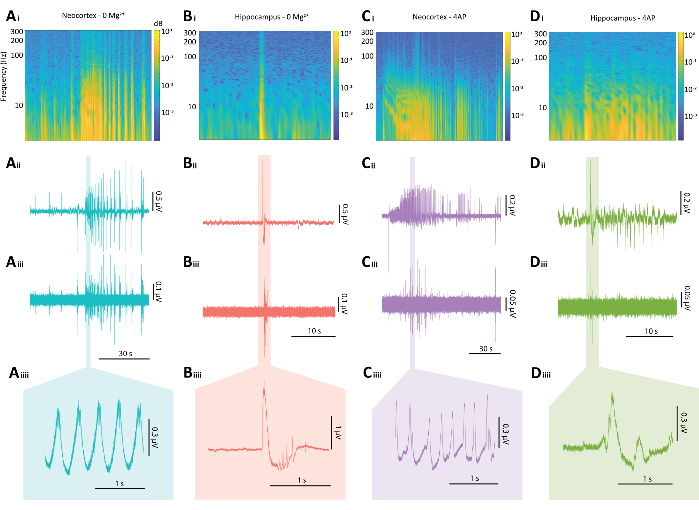
Рисунок 5: Репрезентативные результаты эпилептиформных разрядов в парадигмах 0 Mg2+ и 4-AP. (A) Примеры графиков типичного судорогоподобного события в неокортексе, индуцированного парадигмой 0 Mg2+ , включая (Ai) спектрограмму из припадочного события, (Aii) связанный с ним электрофизиологический след, (Aiii) фильтр высоких частот 80 Гц, примененный к следу от Aii, (Aiiii) и увеличенный участок следа от Aii. (B) Примеры графиков типичного эпилептиформного взрыва гиппокампа, вызванного парадигмой 0 Mg2+ , включая (Bi) спектрограмму эпилептиформного взрыва, (Bii) связанный с ним электрофизиологический след, (Biii) фильтр высоких частот 80 Гц, примененный к следу от Bii, (Biiii) и увеличенный участок следа от Bii (C) Примеры графиков типичного события, похожего на припадок неокортекса, вызванного парадигмой 4-AP, включая (Ci) спектрограмма эпилептиформной активности, (Cii) связанный электрофизиологический след, (Ciii) фильтр высоких частот 80 Гц, примененный к следу от Cii, (Ciiii) и увеличенный участок следа от Cii (D) Примеры графиков эпилептиформного взрыва гиппокампа в парадигме 4-AP, включая (Di) спектрограмму эпилептиформной активности, (Dii) связанный электрофизиологический след, (Diii) фильтр высоких частот с частотой 80 Гц, примененный к кривой от Dii, (Diiii) и увеличенный участок кривой от Dii. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
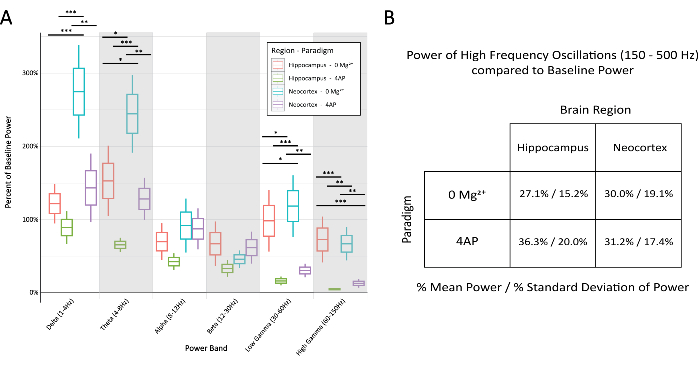
(A) Мощность во время эпилептиформных разрядов значительно различалась между парадигмами и областями мозга для большинства частотных диапазонов (2-way ANOVA с тестом Тьюки, *P < 0,05, **P < 0,001, ***P < 0,0001). Средняя линия для каждого блока представляет среднее значение, границы квадрата ±1 стандартная ошибка среднего (SEM), а крайние линии ±2 SEM. (B) Обе парадигмы и области мозга продемонстрировали ограниченную мощность в диапазонах, связанных с высокочастотной активностью выше 150 Гц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Как это обычно бывает при визуализации активности из многих каналов 1,4,5,10, мы считаем целесообразным сначала построить растровый график данных, полученных с помощью CMOS-HD-MEA (рис. 4A,C,E)....
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Этот протокол включает в себя конкретные рекомендации, связанные с лечением острого среза мозга, которые решают общие проблемы, с которыми сталкиваются пользователи CMOS-HD-MEA, а именно развитие шума под срезом мозга и поддержание здоровой среды для среза мозга. Развитие...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что нет никаких конфликтов интересов, связанных с этим научным исследованием.
Благодарности
Авторы благодарят бывших и нынешних сотрудников лаборатории Пэрриша за их правки в этой рукописи. Мы также хотели бы поблагодарить Алессандро Маччоне из 3Brain за его отзыв об этой работе. Эта работа была профинансирована премией AES/EF Junior Investigator Award и колледжами естественных наук и физико-математических наук Университета имени Бригама Янга.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 2D Workbench | Cloudray | LM04CLLD26B | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| Accura Chip | 3Brain | Accura HD-MEA | CMOS-HD-MEA chip |
| Agarose | Thermo Fisher Scientific | BP160-100 | |
| Vibration isolation table | Kinetic Systems | 91010124 | |
| Beaker for the slice holding chamber, 270 mL | VWR | 10754-772 | |
| BioCam | 3Brain | BioCAM DupleX | CMOS-HD-MEA platform |
| Brainwave Software | 3Brain | Version 4 | CMOS-HD-MEA software |
| Calcium Chloride | Thermo Fisher Scientific | BP510-500 | |
| Carbogen | Airgas | X02OX95C2003102 | |
| Carbogen | Airgas | 12005 | |
| Carbogen Stones | Supelco | 59277 | |
| Compresstome | Precissionary | VF-300-0Z | |
| Computer | Dell | Precission3650 | |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | |
| Detergent | Metrex | 10-4100-0000 | |
| D-Glucose | Macron Fine Chemicals | 4912-12 | |
| Dihydrogen Sodium Phosphate | Thermo Fisher Scientific | BP329-500 | |
| DinoCam | Dino-Lite | AM73915MZTL | |
| Ethanol | Thermo Fisher Scientific | A407P-4 | |
| Forceps | Fine Science Tools | 11980-13 | |
| Hot plate | Thermo Fisher Scientific | SP88857200 | |
| Ice Machine | Hoshizaki | F801MWH | |
| Inflow and outflow needles | Jensen Global | JG 18-3.0X | |
| Inline Solution Heater | Warner Instruments | SH-27B | |
| Isofluorine | Dechra | 08PB-STE22002-0122 | |
| Kim Wipes | Thermo Fisher Scientific | 06-666 | |
| Magnesium Chloride | Thermo Fisher Scientific | FLM33500 | |
| Micropipets | Gilson | F144069 | |
| Mili-Q Water Filter | Mili-Q | ZR0Q008WW | |
| Paintbrush | Daler Rowney | AF85 Round: 0 | |
| Paper Filter | Whatman | EW-06648-24 | |
| Parafilm | American National Can | PM996 | |
| Perfusion System | Multi Channel System | PPS2 | |
| Pipetor | Thermo Fisher Scientific | FB14955202 | |
| Platinum Harp | 3Brain | 3Brain | |
| Potassium Chloride | Thermo Fisher Scientific | P330-3 | |
| Razor blade | Personna | BP9020 | |
| Scale | Metter Toledo | AB204 | |
| Scissors | Solingen | 92008 | |
| Slice Holding Chamber | Custom | Custom | Custom 3D Printer Design, available upon request |
| Sodium Bicarbonate | Macron Fine Chemicals | 7412-06 | |
| Sodium Chloride | Thermo Fisher Scientific | S271-3 | |
| Temperature Control Box | Warner Instruments | TC344B | |
| Transfer Pipettes | Genesee Scientific | 30-200 | |
| Tubing | Tygon | B-44-3 TPE | |
| Vibratome VZ-300 | Precissionary | VF-00-VM-NC | |
| Weigh Boat | Electron Microscopy Sciences | 70040 |
Ссылки
- Obien, M. E. J., Frey, U. Large-scale, high-resolution microelectrode arrays for interrogation of neurons and networks. Adv Neurobiol. 22, 83-123 (2019).
- Schroter, M., et al. Functional imaging of brain organoids using high-density microelectrode arrays. MRS Bull. 47 (6), 530-544 (2022).
- Miccoli, B., et al. High-density electrical recording and impedance imaging with a multi-modal CMOS multi-electrode array chip. Front Neurosci. 13, 641(2019).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471(2023).
- Ferrea, E., et al. high-resolution electrophysiological imaging of field potentials in brain slices with microelectronic multielectrode arrays. Front Neural Circuits. 6, 80(2012).
- Gagliano, G., et al. Non-linear frequency dependence of neurovascular coupling in the cerebellar cortex implies vasodilation-vasoconstriction competition. Cells. 11 (6), 1047(2022).
- Goodchild, S. J., et al. Molecular pharmacology of selective Na(V)1.6 and dual Na(V)1.6/Na(V)1.2 channel inhibitors that suppress excitatory neuronal activity ex vivo. ACS Chem Neurosci. 15 (6), 1169-1184 (2024).
- Hu, X., Khanzada, S., Klutsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834(2022).
- Kim, S., et al. Alteration of neural network and hippocampal slice activation through exosomes derived from 5XFAD nasal lavage fluid. Int J Mol Sci. 24 (18), 14064(2023).
- Mahadevan, A., Codadu, N. K., Parrish, R. R. Xenon LFP analysis platform is a novel graphical user interface for analysis of local field potential from large-scale MEA recordings. Front Neurosci. 16, 904931(2022).
- Medrihan, L., Ferrea, E., Greco, B., Baldelli, P., Benfenati, F. Asynchronous GABA release is a key determinant of tonic inhibition and controls neuronal excitability: A study in the synapsin II-/- mouse. Cereb Cortex. 25 (10), 3356-3368 (2015).
- Monteverdi, A., Di Domenico, D., D'Angelo, E., Mapelli, L. Anisotropy and frequency dependence of signal propagation in the cerebellar circuit revealed by high-density multielectrode array recordings. Biomedicines. 11 (5), 1475(2023).
- Obien, M. E. J., Hierlemann, A., Frey, U. Accurate signal-source localization in brain slices by means of high-density microelectrode arrays. Sci Rep. 9 (1), 788(2019).
- Thouta, S., et al. Pharmacological determination of the fractional block of Nav channels required to impair neuronal excitability and ex vivo seizures. Front Cell Neurosci. 16, 964691(2022).
- Tognolina, M., Monteverdi, A., D'Angelo, E. Discovering microcircuit secrets with multi-spot imaging and electrophysiological recordings: The example of cerebellar network dynamics. Front Cell Neurosci. 16, 805670(2022).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays. Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Maccione, A., et al. Experimental investigation on spontaneously active hippocampal cultures recorded by means of high-density MEAs: Analysis of the spatial resolution effects. Front Neuroeng. 3, 4(2010).
- van Vliet, E., et al. Electrophysiological recording of re-aggregating brain cell cultures on multi-electrode arrays to detect acute neurotoxic effects. Neurotoxicology. 28 (6), 1136-1146 (2007).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. Annu Int Conf IEEE Eng Med Biol Soc. 2022, 3111-3114 (2022).
- Veleanu, M., et al. Modified climbing fiber/Purkinje cell synaptic connectivity in the cerebellum of the neonatal phencyclidine model of schizophrenia. Proc Natl Acad Sci U S A. 119 (21), e2122544119(2022).
- Giansante, G., et al. Neuronal network activity and connectivity are impaired in a conditional knockout mouse model with PCDH19 mosaic expression. Mol Psychiatry. , (2023).
- Dossi, E., Blauwblomme, T., Nabbout, R., Huberfeld, G., Rouach, N. Multi-electrode array recordings of human epileptic postoperative cortical tissue. J Vis Exp. (92), e51870(2014).
- Hajos, N., et al. Maintaining network activity in submerged hippocampal slices: importance of oxygen supply. Eur J Neurosci. 29 (2), 319-327 (2009).
- Hill, M. R., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. J Neurosci Methods. 195 (1), 15-23 (2011).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE Translational Task Force of the ILAE. Epilepsia. 58 (Suppl 4), 40-52 (2017).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), 2056(2010).
- Lin, C. H., Lee, J. K., LaBarge, M. A. Fabrication and use of microenvironment microarrays (MEArrays). J Vis Exp. (68), 4152(2012).
- Panuccio, G., Colombi, I., Chiappalone, M. Recording and modulation of epileptiform activity in rodent brain slices coupled to microelectrode arrays. J Vis Exp. 135, 57548(2018).
- Patel, C., Muthuswamy, J. High efficiency, site-specific transfection of adherent cells with siRNA using microelectrode arrays (MEA). J Vis Exp. 67, e4415(2012).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Papouin, T., Haydon, P. G. Obtaining acute brain slices. Bio Protoc. 8 (2), e2699(2018).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. J Vis Exp. 132, 53825(2018).
- Van Hoeymissen, E., Philippaert, K., Vennekens, R., Vriens, J., Held, K. Horizontal hippocampal slices of the mouse brain. J Vis Exp. (163), 61753(2020).
- 3Brain. , Available from: https://www.3brain.com/ (2022).
- Bridges, D. C., Tovar, K. R., Wu, B., Hansma, P. K., Kosik, K. S. MEA Viewer: A high-performance interactive application for visualizing electrophysiological data. PLoS One. 13 (2), e0192477(2018).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc Natl Acad Sci U S A. 113 (27), 7337-7344 (2016).
- Maccione, A., et al. Microelectronics, bioinformatics and neurocomputation for massive neuronal recordings in brain circuits with large scale multielectrode array probes. Brain Res Bull. 119 (Pt B), 118-126 (2015).
- 3Brain. , BrainWave 4 https://www.3brain.com/products/software/brainwave4 (2022).
- Mahadevan, A. Xenon LFP Analysis. , https://xenon-lfp-analysis.readthedocs.io/en/latest/Installation.html (2022).
- Mahadevan, A. xenon-lfp-analysis github. , https://github.com/MicroBrew09/xenon-lfp-analysis (2022).
- Codadu, N. K., et al. Divergent paths to seizure-like events. Physiol Rep. 7 (19), e14226(2019).
- Kirsch, G. E., Drewe, J. A. Gating-dependent mechanism of 4-aminopyridine block in two related potassium channels. J Gen Physiol. 102 (5), 797-816 (1993).
- Levesque, M., Salami, P., Behr, C., Avoli, M. Temporal lobe epileptiform activity following systemic administration of 4-aminopyridine in rats. Epilepsia. 54 (4), 596-604 (2013).
- Myers, T. L., Gonzalez, O. C., Stein, J. B., Bazhenov, M. Characterizing concentration-dependent neural dynamics of 4-Aminopyridine-induced epileptiform activity. Epilepsy J. 4 (2), 128(2018).
- Perreault, P., Avoli, M. Physiology and pharmacology of epileptiform activity induced by 4-aminopyridine in rat hippocampal slices. J Neurophysiol. 65 (4), 771-785 (1991).
- Rutecki, P. A., Lebeda, F. J., Johnston, D. 4-Aminopyridine produces epileptiform activity in hippocampus and enhances synaptic excitation and inhibition. J Neurophysiol. 57 (6), 1911-1924 (1987).
- Chen, Y., Chad, J. E., Cannon, R. C., Wheal, H. V. Reduced Mg2+ blockade of synaptically activated N-methyl-D-aspartate receptor-channels in CA1 pyramidal neurons in kainic acid-lesioned rat hippocampus. Neuroscience. 88 (3), 727-739 (1999).
- Fujiwara-Tsukamoto, Y., Isomura, Y., Takada, M. Comparable GABAergic mechanisms of hippocampal seizure-like activity in posttetanic and low-Mg2+ conditions. J Neurophysiol. 95 (3), 2013-2019 (2006).
- Swartzwelder, H. S., Anderson, W. W., Wilson, W. A. Mechanism of electrographic seizure generation in the hippocampal slice in Mg2+-free medium: the role of GABAa inhibition. Epilepsy Res. 2 (4), 239-245 (1988).
- Trevelyan, A. J., Graham, R. T., Parrish, R. R., Codadu, N. K. Synergistic positive feedback mechanisms underlying seizure initiation. Epilepsy Curr. 23 (1), 38-43 (2023).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81 (1-2), 103-111 (1998).
- Hajos, N., Mody, I. Establishing a physiological environment for visualized in vitro brain slice recordings by increasing oxygen supply and modifying aCSF content. J Neurosci Methods. 183 (2), 107-113 (2009).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Andrew, R. D., et al. The critical role of spreading depolarizations in early brain injury: Consensus and contention. Neurocrit Care. 37 (Suppl 1), 83-101 (2022).
- Devonshire, I. M., Dommett, E. J., Grandy, T. H., Halliday, A. C., Greenfield, S. A. Environmental enrichment differentially modifies specific components of sensory-evoked activity in rat barrel cortex as revealed by simultaneous electrophysiological recordings and optical imaging in vivo. Neuroscience. 170 (2), 662-669 (2010).
- Parrish, R. R., Codadu, N. K., Mackenzie-Gray Scott, C., Trevelyan, A. J. Feedforward inhibition ahead of ictal wavefronts is provided by both parvalbumin- and somatostatin-expressing interneurons. J Physiol. 597 (8), 2297-2314 (2019).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Curr Opin Neurobiol. 50, 171-178 (2018).
- Yaksi, E., Jamali, A., Diaz Verdugo, C., Jurisch-Yaksi, N. Past, present and future of zebrafish in epilepsy research. FEBS J. 288 (24), 7243-7255 (2021).
- He, M. F., et al. Ex vivo calcium imaging for drosophila model of epilepsy. J Vis Exp. 200, 65825(2023).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Commun Biol. 4 (1), 136(2021).
- Parrish, R. R., Grady, J., Codadu, N. K., Trevelyan, A. J., Racca, C. Simultaneous profiling of activity patterns in multiple neuronal subclasses. J Neurosci Methods. 303, 16-29 (2018).
- Valderhaug, V. D., et al. Criticality as a measure of developing proteinopathy in engineered human neural networks. bioRxiv. , (2020).
- Multi-electrode array (MEASs) to investigate pathogenetic disease mechanisms and pharmacological properties in iPSC-derived neurons modelling neuropsychiatric diseases. Carleo, G., Lee, Y. -S., Secondo, A., Miceli, F., Taglialatela, M. 2022 IEEE International Conference on Metrology for Extended Reality, Artificial Intelligence and Neural Engineering (MetroXRAINE), , Rome, Italy. 667-672 (2022).
- Ruz, I. D., Schultz, S. R. Localising and classifying neurons from high density MEA recordings. J Neurosci Methods. 233, 115-128 (2014).
- Franke, F., Natora, M., Boucsein, C., Munk, M. H. J., Obermayer, K. An online spike detection and spike classification algorithm capable of instantaneous resolution of overlapping spikes. J Comput Neurosci. 29 (1-2), 127-148 (2010).
- Vollgraf, R., Obermayer, K. Improved optimal linear filters for the discrimination of multichannel waveform templates for spike-sorting applications. IEEE Signal Processing Letters. 13 (3), 121-124 (2006).
- Muller, J., et al. High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels. Lab Chip. 15 (13), 2767-2780 (2015).
- Mapelli, L., et al. implementation, and functional validation of a new generation of microneedle 3D high-density CMOS multi-electrode array for brain tissue and spheroids. bioRxiv. , (2022).
- Reddy, D. S., Kuruba, R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci. 14 (9), 18284-18318 (2013).
- Parrish, R. R., Trevelyan, A. J. Stress-testing the brain to understand its breaking points. J Physiol. 596 (11), 2033-2034 (2018).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены