A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פעילות דמוית פרכוסית באיכות גבוהה מפרוסות מוח חריפות באמצעות מערכת משלימה של מערך מיקרואלקטרודות בצפיפות גבוהה של מתכת-תחמוצת-מוליכים למחצה
* These authors contributed equally
In This Article
Summary
כאן, אנו מתארים פרוטוקול לשימוש במערכות משלימות של מערך מיקרואלקטרודות בצפיפות גבוהה של תחמוצת מתכת מוליכים למחצה (CMOS-HD-MEAs) כדי לתעד פעילות דמוית התקף מפרוסות מוח ex vivo .
Abstract
מערכות משלימות של מערך מיקרואלקטרודות בצפיפות גבוהה של תחמוצת מתכת מוליכים למחצה (CMOS-HD-MEA) יכולות לתעד פעילות נוירופיזיולוגית מתרביות תאים ומפרוסות מוח ex vivo בפירוט אלקטרופיזיולוגי חסר תקדים. CMOS-HD-MEAs עברו אופטימיזציה ראשונה לתיעוד פעילות יחידה עצבית באיכות גבוהה מתרביות תאים, אך הוכחו גם כמפיקים נתונים איכותיים מפרוסות חריפות ברשתית ובמוח הקטן. חוקרים השתמשו לאחרונה ב-CMOS-HD-MEAs כדי לרשום פוטנציאלי שדה מקומיים (LFPs) מפרוסות מוח חריפות של מכרסמים בקליפת המוח. אחד ממוקדי העניין הוא פעילות דמוית התקף. בעוד משתמשים רבים הפיקו הפרשות אפילפטיפורמיות קצרות וספונטניות באמצעות CMOS-HD-MEAs, משתמשים מעטים מייצרים באופן אמין פעילות דמוית התקף איכותי. גורמים רבים עשויים לתרום לקושי זה, כולל רעש חשמלי, האופי הלא עקבי של הפקת פעילות דמוית התקף בעת שימוש בתאי הקלטה שקועים, והמגבלה ששבבי CMOS-MEA דו-ממדיים מקליטים רק מפני השטח של פרוסת המוח. הטכניקות המפורטות בפרוטוקול זה אמורות לאפשר למשתמשים לגרום ולתעד באופן עקבי פעילות דמוית התקף באיכות גבוהה מפרוסות מוח חריפות באמצעות מערכת CMOS-HD-MEA. בנוסף, פרוטוקול זה מתאר את הטיפול הנכון בשבבי CMOS-HD-MEA, ניהול תמיסות ופרוסות מוח במהלך ניסויים ותחזוקת ציוד.
Introduction
מערכות זמינות מסחרית של מערך מיקרואלקטרודות בצפיפות גבוהה (HD-MEA), הכוללות שבב MEA עם אלפי נקודות הקלטה 1,2 ופלטפורמת MEA להגברה ודיגיטציה של הנתונים, הן כלי מתפתח למחקר אלקטרופיזיולוגי. מערכות HD-MEA אלה משתמשות בטכנולוגיית מוליכים למחצה משלימים של תחמוצת מתכת (CMOS) כדי להקליט נתונים אלקטרופיזיולוגיים עם רגישות גבוהה מתרביות תאים ותכשירים לפרוסות מוח ex vivo. מערכות MEA אלה מעניקות רזולוציה מרחבית וזמנית חסרת תקדים למחקר נוירופיזיולוגי באמצעות צפיפות אלקטרודות גבוהה ויחסי אות לרעש איכותיים3. טכנולוגיה זו שימשה בעיקר לחקר פוטנציאלי פעולה חוץ-תאיים, אך היא יכולה גם ללכוד פוטנציאלי שדה מקומיים באיכות גבוהה (LFPs) מתכשירים שונים של פרוסות מוח עצביות 4,5,6,7,8,9,10,11,12,13,14,15 . בשל יכולת ההקלטה ברזולוציה גבוהה שהוזכרה לעיל של מערכות CMOS-HD-MEA, משתמשים יכולים לעקוב אחר פעילות אלקטרופיזיולוגית בדיוק מרחבי רב 16,17,18. יכולת זו רלוונטית במיוחד למעקב אחר דפוסי התפשטות של LFPsברשת 5,12,15,19,20,21. לכן, מערכות CMOS-HD-MEA יכולות לספק הבנה חסרת תקדים של דפוסי ההתפשטות של פעילות פיזיולוגית ופתולוגית מתרביות תאים שונות ותכשירי פרוסות מוח. יש לציין במיוחד כי יכולות אלה של מערכות CMOS-HD-MEA יכולות לאפשר לחוקרים להשוות דפוסי התקפים של אזורי מוח שונים בו זמנית ולהעריך כיצד תרכובות אנטי-אפילפטיות שונות משפיעות על דפוסים אלה. בכך הוא מספק שיטה חדשנית לחקר איקטוגנזה והתפשטות איקטלית ולהבנת האופן שבו פרמקולוגיה משבשת את פעילות הרשת הפתולוגית 7,10,14. לכן, יכולות חדשות אלה של מערכות CMOS-HD-MEA יכולות לתרום באופן משמעותי לחקר הפרעות נוירולוגיות, כמו גם לסייע במחקר גילוי תרופות 5,7,11,22. אנו שואפים לספק פרטים על השימוש במערכות CMOS-HD-MEA כדי לחקור פעילות דמוית התקף.
בעת שימוש במערכות CMOS-HD-MEA לחקר LFPs, כגון פעילות אפילפטיפורמית בפרוסות מוח חריפות, משתמשים יכולים להתמודד עם אתגרים רבים, כולל רעש חשמלי מתיש, שמירה על בריאות הפרוסה במהלך ניסויים, וזיהוי אות איכות משבב CMOS-MEA דו-ממדי (2D) המקליט רק מפני השטח של פרוסת המוח. פרוטוקול זה מתאר שלבים בסיסיים להארקה נכונה של פלטפורמת MEA וציוד אחר המשמש לניסויים, שלב חיוני שעשוי לדרוש התאמה אישית אישית עבור כל הגדרת מעבדה. בנוסף, אנו דנים בצעדים שיסייעו לשמור על בריאות פרוסת המוח במהלך הקלטות ארוכות בתאים השקועים המשמשים במערכות CMOS-HD-MEA 23,24,25. בנוסף, בניגוד לשיטות הקלטה אלקטרופיזיולוגיות נפוצות יותר, המקליטות מעומק פרוסת המוח, רוב מערכות CMOS-HD-MEA משתמשות בשבבים דו-ממדיים שאינם חודרים לתוך הפרוסה. לכן, מערכות אלה דורשות שכבה חיצונית עצבית בריאה כדי לייצר את רוב אותות ה- LFP המוקלטים. אתגרים אחרים כוללים ויזואליזציה של כמות עצומה של נתונים שנוצרו על ידי אלפי אלקטרודות. כדי להתגבר על אתגרים אלה, אנו ממליצים על פרוטוקול פשוט אך יעיל המגדיל את הסיכוי להשיג פעילות אפילפטיפורמית איכותית ברשת המתפשטת על פני פרוסת המוח. אנו כוללים גם תיאור קצר של ממשק משתמש גרפי (GUI) הזמין לציבור שפיתחנו עם משאבים משויכים כדי לסייע בתצוגה חזותית של נתונים10.
פרסומים קודמים סיפקו פרוטוקולים קשורים לשימוש במערכות הקלטה MEA 26,27,28,29. עם זאת, עבודה זו נועדה לסייע לנסיינים המשתמשים במערכות CMOS-HD-MEA עם שבבים דו-ממדיים, במיוחד אלה המבקשים לחקור פעילות אפילפטיפורמית באיכות גבוהה מפרוסות מוח. בנוסף, אנו משווים שתיים ממניפולציות הפתרון הנפוצות ביותר להשראת פעילות דמוית התקף, כלומר פרדיגמות 0 Mg2+ ו- 4-AP, כדי לעזור למשתמשים לזהות את המדיה העוויתית המתאימה ביותר ליישום הספציפי שלהם. למרות שהפרוטוקול מתמקד בעיקר ביצירת פעילות דמוית התקף, ניתן לשנות אותו כדי לחקור תופעות אלקטרופיזיולוגיות אחרות באמצעות פרוסות מוח.
Protocol
נהלים המערבים עכברים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת בריגהם יאנג. זכרים ונקבות (n = 8) עכברי C57BL/6 שגילם לפחות P21 שימשו בניסויים הבאים.
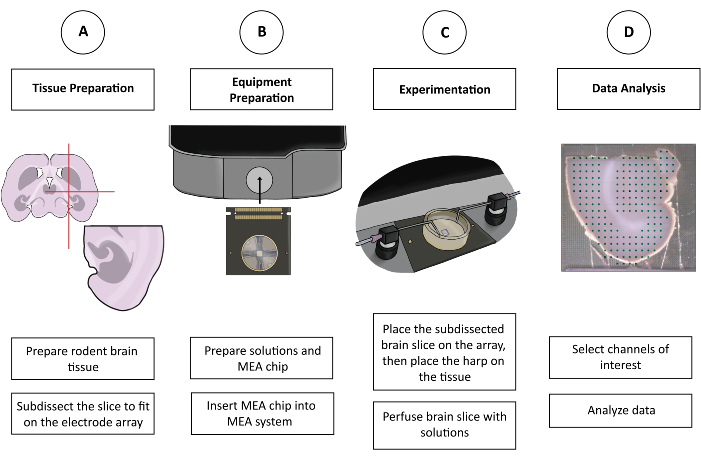
איור 1: איור סכמטי של ניסויי CMOS-HD-MEA. (A) פרוסת המוח מוכנה לפי שיטת החיתוך המועדפת על האדם, ונחתכת כך שתתאים ל-MEA. (B) הכינו את התמיסות ואת שבב CMOS-HD-MEA. (C) פרוסת המוח המנותחת מונחת על מערך האלקטרודות וטובלת בתמיסות המתאימות. (ד) נבחרים ערוצים רלוונטיים מתוך הנתונים שנאספים. הנתונים מוכנים לאחר מכן לניתוח בתוכנית המועדפת על המשתמש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שם | ריכוז (mM) | ז/ל | ||
| נתרן כלורי (NaCl) | 126 | 7.36 | ||
| אשלגן כלורי (KCl) | 3.5 | 0.261 | ||
| דימימן נתרן פוספט (NaH2PO4) | 1.26 | 0.151 | ||
| סודיום ביקרבונט (NaHCO3) | 26 | 2.18 | ||
| גלוקוז (C6H12O6) | 10 | 1.80 | ||
| מגנזיום כלורי (MgCl2) | 1 (ממלאי 1 M) | 1 מ"ל | ||
| סידן כלורי (CaCl2) | 2 (ממלאי 1 M) | 2 מ"ל | ||
טבלה 1: פתרון aCSF.
1. הכנת פתרונות
- הכינו את הפתרונות הניסיוניים.
- הכן 1 ליטר של נוזל מוחי מלאכותי (aCSF) (ראה טבלה 1 לפרטים).
- הכינו 1 ליטר של תמיסה פרו-פרכוסית.
הערה: פתרונות המשמשים ליצירת פעילות דמוית התקף בפרוטוקול זה השתמשו ב- aCSF עם 100 מיקרומטר 4-Aminopyridine (4-AP) או aCSF ללא יוני מגנזיום. - קרבוגני את כל התמיסות לפחות 10 דקות לפני השימוש באמצעות אבנים נקבוביות.
- השג להשלכת פתרונות.
- מניחים 1 L של aCSF, 1 L של תמיסה פרו-פרכוסית, ואת הכד להשליך על משטח קרוב למערכת הזלוף.
- הכנת פתרונות תא החיתוך והאחיזה
- הכינו 0.5 ליטר של aCSF, תוך השמטת CaCl2 והוספת 3 מ"מ MgCl2 (בניגוד ל-1 מ"מ) ליצירת פתרון חיתוך ייחודי. שמור פתרון זה לשימוש בהכנת פרוסת מוח מכרסם על ידי הצבתו ליד אזור הכנת פרוסת המוח החריף.
- הכינו 0.5 ליטר של aCSF והניחו אותו בתא אחיזת רקמות שישמש לשמירת פרוסות לשימוש בניסויים. הכניסו אבנים נקבוביות לתא האחיזה של הרקמה וקרבוגנט את התמיסה למשך 10 דקות לפחות לפני הנחת הפרוסות החתוכות בתא.
2. הכנת פרוסות מוח מכרסמים
- הכן את כל הפתרונות כמתואר לעיל (ראה סעיף 1). ודא כי כל הפתרונות הם carbogenated כראוי במהלך תהליך ההכנה.
הערה: פתרון החיתוך (ראה סעיף 1.2) מומלץ, אך ניתן להשתמש בתמיסות חיתוך אחרות כדי להשיג פרוסות מוח איכותיות, כגון תמיסת חיתוך סוכרוז30. - השתמשו במיקרוטום רוטט כדי ליצור פרוסות מוח של מכרסמים בגודל 350 מיקרומטר. פרוטוקולים לשימוש במכשירים אלה מפורטים בהפניות 30,31,32,33.
- הכינו את פרוסות המוח של המכרסם כך שיתאימו לאזור אלקטרודות ההקלטה של שבב MEA (ראו איור 2). השתמשו בלהב כירורגי בגודל 10 כדי לנתח את הפרוסות, כפי שמוצג באיור 1A ובאיור 2A , על-ידי גלגול עדין של הלהב קדימה ואחורה על פרוסת המוח. בצע את תת-הדיסקציה בתא חיתוך המיקרוטום הרוטט. היזהרו שלא לפגוע בפרוסת המוח המנותחת.
- הניחו את הפרוסות החתוכות בתא אחיזת רקמות מלא ב-aCSF. ודאו שהתא עבר קרבוגניות במשך 10 דקות לפחות לפני הוספת הפרוסות שנחתכו.
3. הכנת ציוד
- הכנת שבבי MEA ומערכת MEA (איור 2 ואיור 3)
הערה: חומרים קשים כמו פלסטיק ומתכות יכולים בקלות להזיק לשבב MEA אם הם באים במגע בכוח עם תחתית השבב היטב. בעת שימוש בפיפטות להעברת התמיסה לתוך השבבים או החוצה מהם, אין ליצור מגע עם תחתית באר השבב עם הפיפטה, במיוחד לא עם אלקטרודות הייחוס בצידי באר השבב ועם אלקטרודות ההקלטה במרכז באר השבב (איור 2C). במקום זאת, הוסף את הפתרון על ידי ריחוף מעל תחתית באר השבב או על ידי מגע או קירוב קצוות הפלסטיק של השבב היטב. כדי לשלוף את כל התמיסות בקלות, הטו מעט את השבב כדי לאפשר לתמיסה להיאגר לצד אחד של השבב היטב והסירו אותו מראש התמיסה המאוגמת, או השתמשו במגבון אנטי סטטי כדי לטפוח קלות באזורים שעדיין מכילים את התמיסה. אל תעביר את השבב על-ידי החזקת השבב היטב או הפינים (איור 2C). באר השבב יכולה להכיל כ -4 מ"ל של פתרון. עבור השלבים הבאים, מלא היטב את השבב עם כ 2 מ"ל של פתרון אם לא צוין אחרת.- לייעד פיפטות העברה למשימות שונות לפני תחילת הכנת שבב. יש לסמן פיפטת העברה אחת עבור אתנול, אחת עבור פסולת, אחרת עבור aCSF ואחרות עבור כל הפתרונות הנותרים כדי למנוע ערבוב לא מכוון.
- מלאו את הבאר של שבב MEA באתנול חסין 190 כך שתחתית באר השבב תהיה מכוסה לחלוטין (איור 3). תן אתנול לשבת במשך 30-60 שניות, ולאחר מכן להסיר אותו עם פיפטה להשליך.
- ממלאים את הבאר של שבב MEA עם aCSF ולהסיר אותו עם פיפטה להשליך כדי לשטוף אתנול שאריות מתוך השבב היטב. הוסף והסר aCSF מבאר השבב שלוש פעמים, באמצעות פיפטות הפסולת וה- aCSF שיועדו בעבר. לאחר שטיפת השבב היטב שלוש פעמים, להוסיף aCSF ולתת לו לעמוד לפחות 30 s.
הערה: אלקטרודות ההקלטה מציגות את כמות הרעש הקטנה ביותר מאינטראקציות הידרופוביות כאשר aCSF נשאר בתא לפחות 45 דקות לאחר שטיפה עם אתנול ו- aCSF. - לפני העגינה של שבב MEA, הרטיבו מגבון אנטי-סטטי עם אתנול 190-proof, והשתמשו בו כדי לנגב את הפינים של השבב (איור 2C).
- החלק בעדינות את שבב MEA לתוך פלטפורמת MEA והפעל את מנגנון העגינה כדי לנעול את השבב למקומו.
- בדקו את אלקטרודות ההקלטה והייחוס לאיתור בועות (איור 2C). אם יש בועות, קחו מברשת צבע נקייה וטאטאו קלות את האלקטרודות כדי להסיר אותן.
- בדוק את השבב עבור רעש באמצעות תוכנת CMOS-HD-MEA34 וסרוק חזותית את מפת הצבעים הכוזבת עבור בועות, תנודות לא ביולוגיות, או קוצים הנגרמים על ידי הפרעות חשמליות. הארקו את מערכת MEA כראוי כדי לשלול כל רעש שנתקלים בו.
הערה: הגדרת ההארקה תלויה בסביבת ההקלטה. לצורך הניסויים בפרוטוקול זה, פלטפורמת MEA ומערכת הזילוח היו מקורקעות.
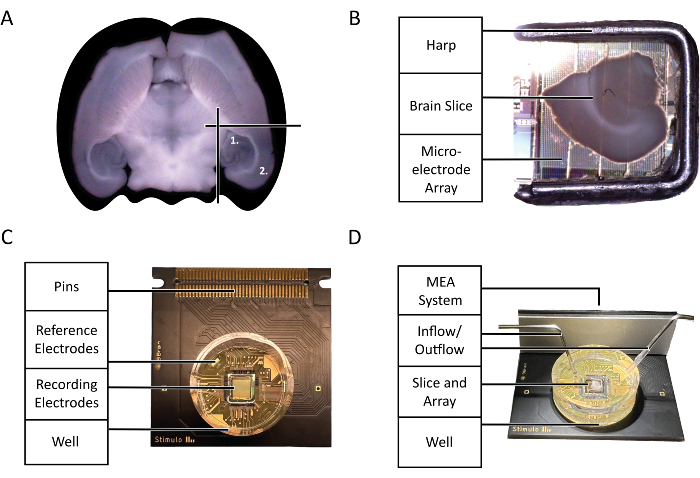
איור 2: דיאגרמות תצורה וטכנולוגיה. (A) דיאגרמה של בחירת פרוסות מוח חריפות של עכבר ששימשו בניסוי המודגשת על-ידי פרוטוקול זה. (1) אזור ההיפוקמפוס (2) אזור הניאוקורטקס. (B) המיקום הנכון של פרוסת מוח ונבל חריפים של עכבר על מערך המיקרואלקטרודות (MEA). (C) האנטומיה של שבב 3Brain Accura CMOS-HD-MEA. (D) התצורה הנכונה של כניסות ושקעי זילוח. הקלט צריך להיות עמוק בתוך השבב היטב, בעוד שהפלט צריך להיות בצד הנגדי של הכניסה בחלק העליון של באר השבב כדי להבטיח זרימה קבועה של aCSF טרי ומחומצן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
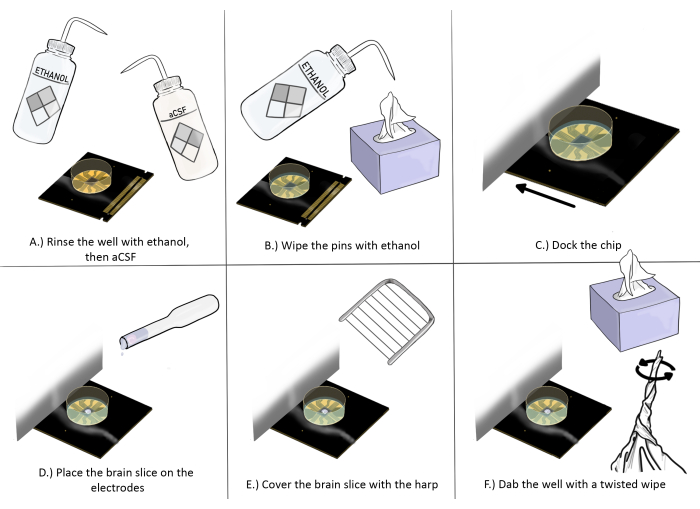
איור 3: דיאגרמה סכמטית של הכנת שבבים ומיקום שלהם עבור ניסויים בפרוסות מוח. (A) שטפו היטב את השבב באתנול פעם אחת, ואז aCSF שלוש פעמים. (B) נגבו את הפינים באתנול באמצעות מגבון אנטי-סטטי. (C) עגן את השבב. (D) הניחו את פרוסת המוח על האלקטרודות. (E) הניחו את הנבל על פרוסת המוח (ראו איור 2 להנחיות מיקום נכון). (F) טפחו את פינת הבאר של אלקטרודות ההקלטה ליד פרוסת המוח עם מגבון אנטי-סטטי מעוות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ניסויים
- הצבת פרוסת המוח
- הניחו נבל פלטינה בסירת שקילה (או משטח נקי אחר) ליד פלטפורמת MEA. כסו את הנבל בכ-3 מ"ל של aCSF כדי להפחית את נטיותיו ההידרופוביות.
- השתמש במספריים כדי להסיר את החלק הדק של פיפטת העברה. חותכים שליש, כ-1.5 אינץ', מקצה הפיפטה.
הערה: פיפטה שונה זו לא תכווץ או תפגע בפרוסת המוח במהלך האיסוף וההובלה. - אספו פרוסת מוח מתא החזקת הפרוסה עם פיפטה שעברה שינוי. מוציאים בעדינות את פרוסת המוח וכל תמיסה בפיפטה לתוך השבב היטב. כדי למקם את הפרוסה כראוי, שחררו בעדינות עוד aCSF מפיפטת העברה כדי לתפעל את מיקום פרוסת המוח או השתמשו במברשת צבע רכה כדי ליצור זרם בתמיסה שדוחף את פרוסת המוח לאלקטרודות הקלטה. הגבל את המגע עם אלקטרודות ההקלטה או פרוסת המוח כדי למזער נזק.
- בעזרת מלקחיים, הניחו בעדינות את הנבל על פרוסת המוח כשהחוטים כלפי מטה כדי ללחוץ את הפרוסה על אלקטרודות ההקלטה. הימנע ממגע עם מערך האלקטרודות עם הנבל. כיוון הנבל כך שהצד ללא מסגרת פונה לכיוון מחט הזרימה, ומסגרת הנבל לא תבוא במגע עם אף אחת מאלקטרודות ההקלטה (איור 2C, D).
- קח פיפטה להשליך ולהסיר עודף aCSF. קחו מגבון אנטי-סטטי, סובבו פינה כדי ליצור קצה, והשתמשו בו כדי לספוג את ה-aCSF שנותר סביב אלקטרודות ההקלטה מבלי לגעת באלקטרודות ההקלטה, בפרוסת המוח או בנבל (איור 2).
- באמצעות פיפטה aCSF ייעודית, להוסיף במהירות מספיק aCSF carbogenated כדי לכסות את פרוסת המוח, כ 2 מ"ל.
- חזור על שלב 4.1.5. ו-4.1.6. עוד פעמיים.
- ממלאים את הבאר ב-aCSF קרבוגני עד שהבאר מלאה בערך 3/4, כ-3 מ"ל.
- צלם תמונה של פרוסת המוח על שבב MEA עם מיקרוסקופ או מצלמה. ודא שלתמונה יש רזולוציה גבוהה מספיק כדי לראות את גבולות מערך אלקטרודות ההקלטה ואת האנטומיה של פרוסת המוח.
- הרצת הניסוי
- הפעלת מערכת הזילוח
- מניחים את צינורות הזרימה והזרימה לתוך הכד המלא ב- aCSF ומחטי הזרימה והזרימה לתוך השבב היטב. הניחו את מחט הזרימה קרוב לתחתית השבב ממש מחוץ לאלקטרודות ההקלטה. הניחו את מחט הזרימה קרוב לחלק העליון של באר השבב לכיוון הקצה כך שהנוזל יעלה כמעט עד לשולי באר השבב, כ-4 מ"ל, והפרוסה תהיה שקועה לאורך כל הניסוי (איור 2D).
- הגדר את זרימת הזילוח ל- 5 מ"ל/דקה ואת זרימת הזילוח ל- 7 מ"ל/דקה.
הערה: מומלץ שקצב הזרימה יעלה על קצב הזרימה כדי למנוע גלישת תמיסה מבאר השבב וכדי ליצור זרם תמיסה על פרוסת המוח. - הפעל את הזרימה והיציאה. הסר את מחט הזרימה מבאר השבב עד שהמחט מתחילה להפיק תמיסה במקום אוויר. לאחר מכן, החזיר את המחט למקומה בתוך השבב כמתואר בשלב 4.2.1.1.
- השתמש במחמם תמיסה כדי לשמור על התמיסה בטמפרטורה פיזיולוגית או קרוב אליה, סביב 34-37 מעלות צלזיוס.
- תן aCSF לחורר מעל פרוסת המוח במשך 10 דקות. פעולה זו תאפשר לפרוסה להתאים את עצמה לסביבת ההקלטה.
- לאחר שחלפו 10 דקות, העבר את צינור הזרימה אל כד ההשלכה. לאחר מכן, העבירו את צינור הזרימה לכד המכיל את התמיסה הפרו-פרכוסית. יש לשטוף את ה-aCSF הלא-פרכוסי ממערכת הזילוח לתוך ההשלכה למשך 10 דקות.
- מעבירים את צינור הזרימה לתוך הכד המכיל את התמיסה הפרו-פרכוסית.
- תנו לתמיסה הפרו-פרכוסית לעבור מחזור עד לסיום הניסוי.
- אם משך רישום הפרוסה עולה על שעתיים, שקלו להכין תמיסה פרו-פרכוסית אחרת כדי לקזז את צריכת הגלוקוז של פרוסת המוח הפעילה.
- החלפת פרוסות מוח
- כבה את הזרימה. כבה את הזרימה 10-15 שניות לאחר מכן.
- השתמשו במלקחיים כדי להסיר את הנבל והניחו אותו על סירת שקילה או משטח אחר.
- השתמש פיפטה שונה כדי לחלץ ולהשליך את פרוסת המוח. אין לגעת באלקטרודות הייחוס או במערך אלקטרודות ההקלטה (איור 2C).
- הניחו את צינור הזרימה לתוך הכד המכיל את תמיסת aCSF שאינה פרכוסית. הניחו את צינור הזרימה בכד ההשלכה. השאירו היטב את מחטי הזרימה והזרימה בשבב. הפעל את מערכת הזילוח למשך 10 דקות כדי להסיר את כל התמיסה הפרו-פרכוסית השיורית מבאר השבבים וממערכת הזילוח. התחילו שוב את תהליך הניסוי עם פרוסת מוח חדשה (החל משלב 4.1).
- הפעלת מערכת הזילוח
- סיום הניסוי
- ניקוי האסדה
- מוציאים את הנבל, פרוסת המוח והתמיסה מהבאר, בהתאמה.
- שחררו את שבב MEA, הניחו אותו על משטח נקי ומלאו את השבב היטב במים נטולי יונים.
- השליכו את המים שעברו דה-יוניזציה כדי לנקות את כל המלחים שנותרו מתמיסות ה-aCSF.
- באמצעות פיפטה העברה, למלא את השבב היטב עם פתרון דטרגנט. העבר את קצה פיפטת ההעברה היטב בשבב והצבע אותו על אלקטרודות ההקלטה. יש לסחוט ולשחרר במהירות ובאופן חוזר ונשנה את חומר הניקוי לתוך פיפטת ההעברה כדי לשטוף במרץ את חומר הניקוי מעל אלקטרודות ההקלטה למשך דקה אחת. תנו לחומר הניקוי לנוח במשך 5-10 דקות.
- הסר את חומר הניקוי, ולאחר מכן שטוף את השבב היטב 4-6 פעמים עם מים deionized כדי להסיר את תמיסת דטרגנט ואת כל המומסים שנותרו.
- הוציאו את כל המים מבאר השבב, ואז הניחו מגבון אנטי סטטי על שבב MEA והשאירו למשך הלילה כדי לאפשר לשבב להתייבש היטב.
- הניחו סירת שקילה או צלחת אטומה אחרת למים על פלטפורמת ההקלטה MEA שבה שבב MEA נח בעבר. מניחים את הנבל במרכז הצלחת ומניחים את מחטי הזרימה והזרימה משני צדי הנבל.
- נקו את מערכת הזילוח והנבל על ידי שליחת 50 מ"ל מים, 50 מ"ל אתנול 140 ו-200 מ"ל מים, בהתאמה, דרך הצינור לתוך כד ההשלכה.
הערה: בשלב זה, ניתן להגדיל את מהירויות הזילוח כדי לקצר את זמן הניקוי, אך מהירות הזרימה חייבת תמיד לחרוג ממהירות הכניסה כדי למנוע הצפה. - נקו את אבני הקרבוגן על ידי הכנסתן לכוס מים מזוקקים ושליחת הקרבוגן דרך הצינור למשך 5 דקות. הניחו אותם על משטח יבש ונקי למשך הלילה וכסו אותם כדי למנוע הצטברות אבק.
- ניקוי האסדה
5. ניתוח נתונים
הערה: קיימות מגוון חבילות ניתוח המשמשות לניתוח נתונים אלקטרופיזיולוגיים המיוצרים על ידי CMOS-HD-MEAs, כולל BrainWave מ-3Brain, Another Spike Sorter (YASS) וכלי Python מותאמים אישית 34,35,36,37. חילצנו נתונים מתבנית קובץ הנתונים של BrainWave לשימוש בפלטפורמת ניתוח LFP של קסנון כדי להפיק את הנתונים המוצגים באיור 4 ובאיור 5. קוד Matlab מותאם אישית שימש לניתוח הנתונים באיור 6. פרוטוקולים עבור פלטפורמת Xenon LFP Analysis זמינים לציבור10. שלבי הפרוטוקול הבאים ספציפיים להקלטות שבוצעו עם Brainwave 438; עבור מערכות אחרות, עיין בתיעוד תומך הקשור למערכות אלה 34,35,36,37. סקירה כללית של שלבי הניתוח שננקטו כדי להפיק את הנתונים באמצעות פרוטוקול זה מובאת להלן. לקבלת פרטים מלאים על אופן הייצוא, התצוגה החזותית והניתוח של נתונים, כולל סרטוני הדרכה וכל קבצי הקוד הרלוונטיים, ראה39.
- ייצא את קובץ ההקלטה לניתוח.
- צור תיקייה עבור קבצי הקלטת הנתונים שיקבלו דגימת צמצום.
- חתוך את התמונה שצולמה במהלך שלב 4.1.9 כדי לכלול רק את מערך ההקלטה עם פרוסות המוח.
- פתח את קובץ ExportToHDF5-ChannelSelection.py (ניתן לגשת לקובץ קוד זה ב- GitHub תחת xenon-lfp-analysis/code-files/3Brain-processing40) והעתק והדבק את כתובת האתר הרשומה בראש החלון לדפדפן אינטרנט.
- הזן את נתיב הקובץ עבור קובץ הקלטת הנתונים והעלה את התמונה החתוכה של המערך המשויך להקלטה.
- תחת 'בחר ערוצים לייצוא', השתמש בכלי בחירת כלי הקפה (לאסו) כדי לבחור את אזורי ההיפוקמפוס והאזור הניאו-קורטיקלי המוצגים בתמונה החתוכה של המערך.
- הגדר הן את מספר השורות שיש לדלג עליהן והן את מספר העמודות שיש לדלג עליהן ל- 2.
הערה: קבצי הקלטה הם לעתים קרובות גדולים; אם מתאים לניתוח הרצוי, ניתן לבצע דגימת הפחתה של הנתונים המיוצאים. קיימות אפשרויות לדגימת הפחתה מרחבית (על ידי דילוג על שורות ועמודות של אלקטרודות הקלטה) וזמנית (על ידי דגימת הפחתה לתדירות דגימה נמוכה יותר). בניתוח, כל 2 שורות ו 2 עמודות מדלגים; זה מאפשר הפחתת דגימה של הנתונים באופן מרחבי מבלי להיות מוטה לערוצים מסוימים. כל ערוץ רחוק מספיק זה מזה כך שהבדלי הפעילות יכולים להיות משמעותיים ביניהם; לכן, לא מבוצע ממוצע ערוץ. בעת דילוג על שורות ועמודות של האלקטרודות, הנתונים מערוצים שלא נבחרו אינם נכללים בעת ייצוא קובץ הפלט. - הגדר את תדירות הפחתת הדגימה ל- 300 הרץ.
- לחצו על הלחצן 'ייצוא ערוצים ' ליצירת קובץ בחירת הערוצים.
הערה: התוכנה תשמור באופן אוטומטי את קובץ בחירת הערוץ בתיקיה שבה נשמר קובץ הקלטת הנתונים. - פתח את קובץ ExportToHDF5-ExtractDownsample.py (נמצא גם ב- GitHub תחת xenon-lfp-analysis/code-files/3brain-processing40), הדבק את נתיב הקובץ של התיקיה המכילה את קבצי בחירת הערוצים ואת קבצי הקלטת הנתונים, ולחץ על Enter במקלדת כדי ליצור את גרסת הדגימה המופחתת של קובץ הקלטת הנתונים.
- שימוש בפלטפורמת הניתוח
- בשורת הפקודה של המחשב, הקלד run_lfp_analysis ולחץ על Enter כדי לפתוח את פלטפורמת הניתוח.
- הזינו את נתיבי הקבצים של התמונה ושל קובץ ההקלטה שבוצע בו דגימה מופחתת ולחצו על 'שלח'.
- תחת בחר טווח זמן לניתוח, בחר את ההקלטה כולה.
- תחת Select Channels for plotts, סמן את ההיפוקמפוס כקבוצה-1 ואת הניאו-קורטקס כקבוצה-2.
- תחת רסטר ערוץ, הגדר את הסף ל- 0.06 mV ואת משך הזמן ל- 0.02 שניות.
- לחץ על Apply Settings and Generate Raster.
- השתמש בתרשים הרסטר כדי לחקור ערוצים שונים המציגים דפוסי פעילות של עניין.
הערה: ראו איור 4 דוגמאות לפעילות דמוית התקף באיכות גבוהה (איור 4A-D) לעומת פעילות תת-אופטימלית (איור 4E-F).
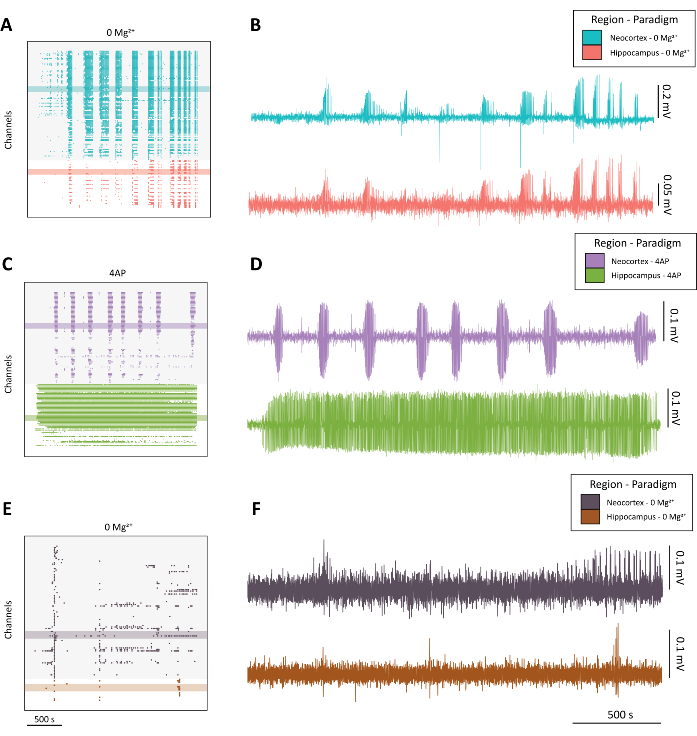
איור 4: דוגמה לפעילות אפילפטיפורמית מתפתחת מפרדיגמות 0 Mg2+ ו-4-AP. (A) תרשים רסטר לדוגמה מיישום aCSF עם 0 מ"ג2+ במשך כ-40 דקות. (B) עקבות אלקטרופיזיולוגיים לדוגמה שנלקחו מהניאו-קורטקס (כחול) וההיפוקמפוס (אדום) המדגימים פעילות אפילפטיפורמית מפרדיגמת 0 Mg2+ . (C) תרשים רסטר לדוגמה מהיישום 100 mM 4-AP במשך כ-40 דקות. (D) עקבות אלקטרופיזיולוגיים לדוגמה שנלקחו מהניאו-קורטקס (סגול) וההיפוקמפוס (ירוק) המדגימים פעילות אפילפטית מהיישום של 4-AP. (E) תרשים רסטר לדוגמה מיישום aCSF עם 0 Mg2+ במשך כ-40 דקות המציג פעילות מתפרצת בניגוד לפעילות דמוית התקף כפי שנמצא בעקבותיהם המייצגים האחרים. (F) עקבות אלקטרופיזיולוגיים לדוגמה שנלקחו מהניאו-קורטקס (סגול כהה) וההיפוקמפוס (חלודה) המדגימים פעילות תת-אופטימלית מפרדיגמת 0 Mg2+ המיועדת להשוואה לפעילות דמוית התקף איכותית המצויה ב-B ו-D. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
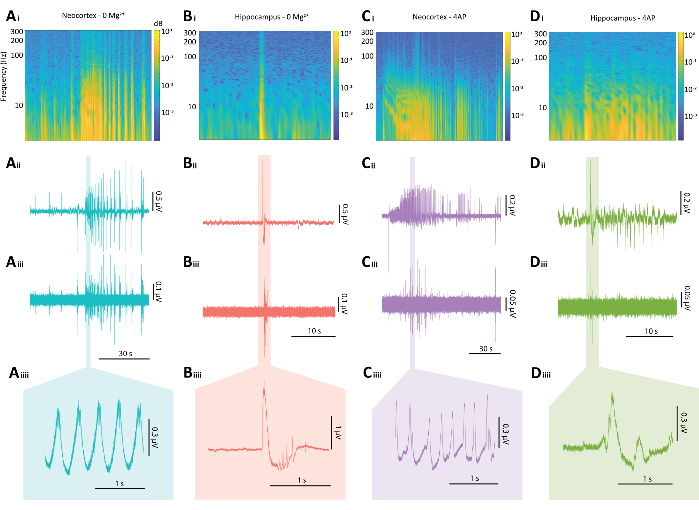
איור 5: תוצאות מייצגות של הפרשות אפילפטיפורמיות הן מפרדיגמות 0 Mg2+ והן מפרדיגמות 4-AP. (A) תרשימים לדוגמה של אירוע דמוי התקף ניאו-קורטיקלי טיפוסי המושרה על ידי פרדיגמת 0 Mg2+ כולל (Ai) ספקטוגרמה מאירוע דמוי התקף, (Aii) העקבות האלקטרופיזיולוגיות הקשורות, (Aiii) מסנן מעבר גבוה של 80 הרץ שהוחל על העקבה מ-Aii, (Aiiii) וקטע מוגדל של העקבה מ-Aii. (B) תרשימים לדוגמה של פרץ אפילפטיפורמי טיפוסי בהיפוקמפוס המושרה על ידי פרדיגמת 0 Mg2+ כולל (Bi) ספקטוגרמה של פרץ אפילפטיפורמי, (Bii) העקבות האלקטרופיזיולוגיות הקשורות, (Biii) מסנן מעבר גבוה של 80 הרץ שהוחל על העקבה מ- Bii, (Biiii) וקטע מוגדל של העקבה מ- Bii (C) חלקות לדוגמה של אירוע דמוי התקף ניאוקורטיקלי טיפוסי המושרה על ידי פרדיגמת 4-AP כולל (Ci) ספקטוגרמה של פעילות אפילפטיפורמית, (Cii) העקבות האלקטרופיזיולוגיות הקשורות, (Ciii) מסנן מעבר גבוה של 80 הרץ שהוחל על העקבה מ-Cii, (Ciiii) וקטע מוגדל של העקבות מ-Cii (D) חלקות לדוגמה של התפרצות אפילפטיפורמית בהיפוקמפוס תחת פרדיגמת 4-AP כולל (Di) ספקטוגרמה של פעילות אפילפטיפורמית, (Dii) העקבות האלקטרופיזיולוגיות הקשורות, (Diii) מסנן מעבר גבוה של 80 הרץ שהוחל על העקבה מ- Dii, (Diiii) ומקטע מוגדל של העקבה מ- Dii. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
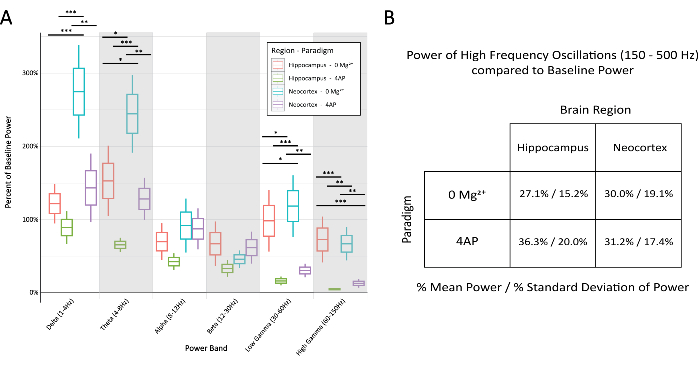
איור 6: השוואה של אחוזי ההספק הבסיסי ברצועות השונות על פני פרדיגמה ואזור במוח במהלך הפרשות אפילפטיפורמיות סטריאוטיפיות. (A) ההספק במהלך הפרשות אפילפטיפורמיות היה שונה באופן משמעותי בין הפרדיגמות ואזורי המוח עבור רוב תחומי התדרים (ANOVA דו-כיווני עם מבחן Tukey, *P < 0.05, **P < 0.001, ***P < 0.0001). הקו האמצעי עבור כל תיבה מייצג את הממוצע, את גבולות התיבה ±1 שגיאת תקן של הממוצע (SEM), ואת הקווים החיצוניים ביותר ±2 SEM. (B) הן הפרדיגמות והן אזורי המוח הדגימו עוצמה מוגבלת ברצועות הקשורות לפעילות בתדר גבוה מעל 150 הרץ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
כפי שנהוג כאשר אנו ממחישים פעילות מערוציםרבים 1,4,5,10, אנו מוצאים שזה מועיל ליצור תחילה תרשים רסטר של הנתונים שאנו רוכשים עם CMOS-HD-MEA (איור 4A,C,E). תרשים זה יכול ליצור מבט מ?...
Discussion
פרוטוקול זה כולל הנחיות ספציפיות הקשורות לניהול פרוסות מוח חריפות המטפלות בבעיות נפוצות העומדות בפני משתמשי CMOS-HD-MEA, כלומר פיתוח רעש מתחת לפרוסת המוח ושמירה על סביבה בריאה עבור פרוסת המוח. התפתחות רעש מתחת לפרוסה מתרחשת כאשר הפרוסה אינה נצמדת כראוי למערך; אם פרוסת המוח א...
Disclosures
המחברים מצהירים כי אין ניגודי אינטרסים הקשורים למחקר זה.
Acknowledgements
המחברים מודים לחברי מעבדת פאריש בעבר ובהווה על עריכתם בכתב יד זה. ברצוננו גם להודות לאלסנדרו Maccione מ-3Brain על המשוב שלו על עבודה זו. עבודה זו מומנה על ידי פרס AES/EF Junior Investigator Award ועל ידי המכללות למדעי החיים ולמדעים פיזיקליים ומתמטיים של אוניברסיטת בריגהם יאנג.
Materials
| Name | Company | Catalog Number | Comments |
| 2D Workbench | Cloudray | LM04CLLD26B | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| Accura Chip | 3Brain | Accura HD-MEA | CMOS-HD-MEA chip |
| Agarose | Thermo Fisher Scientific | BP160-100 | |
| Vibration isolation table | Kinetic Systems | 91010124 | |
| Beaker for the slice holding chamber, 270 mL | VWR | 10754-772 | |
| BioCam | 3Brain | BioCAM DupleX | CMOS-HD-MEA platform |
| Brainwave Software | 3Brain | Version 4 | CMOS-HD-MEA software |
| Calcium Chloride | Thermo Fisher Scientific | BP510-500 | |
| Carbogen | Airgas | X02OX95C2003102 | |
| Carbogen | Airgas | 12005 | |
| Carbogen Stones | Supelco | 59277 | |
| Compresstome | Precissionary | VF-300-0Z | |
| Computer | Dell | Precission3650 | |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | |
| Detergent | Metrex | 10-4100-0000 | |
| D-Glucose | Macron Fine Chemicals | 4912-12 | |
| Dihydrogen Sodium Phosphate | Thermo Fisher Scientific | BP329-500 | |
| DinoCam | Dino-Lite | AM73915MZTL | |
| Ethanol | Thermo Fisher Scientific | A407P-4 | |
| Forceps | Fine Science Tools | 11980-13 | |
| Hot plate | Thermo Fisher Scientific | SP88857200 | |
| Ice Machine | Hoshizaki | F801MWH | |
| Inflow and outflow needles | Jensen Global | JG 18-3.0X | |
| Inline Solution Heater | Warner Instruments | SH-27B | |
| Isofluorine | Dechra | 08PB-STE22002-0122 | |
| Kim Wipes | Thermo Fisher Scientific | 06-666 | |
| Magnesium Chloride | Thermo Fisher Scientific | FLM33500 | |
| Micropipets | Gilson | F144069 | |
| Mili-Q Water Filter | Mili-Q | ZR0Q008WW | |
| Paintbrush | Daler Rowney | AF85 Round: 0 | |
| Paper Filter | Whatman | EW-06648-24 | |
| Parafilm | American National Can | PM996 | |
| Perfusion System | Multi Channel System | PPS2 | |
| Pipetor | Thermo Fisher Scientific | FB14955202 | |
| Platinum Harp | 3Brain | 3Brain | |
| Potassium Chloride | Thermo Fisher Scientific | P330-3 | |
| Razor blade | Personna | BP9020 | |
| Scale | Metter Toledo | AB204 | |
| Scissors | Solingen | 92008 | |
| Slice Holding Chamber | Custom | Custom | Custom 3D Printer Design, available upon request |
| Sodium Bicarbonate | Macron Fine Chemicals | 7412-06 | |
| Sodium Chloride | Thermo Fisher Scientific | S271-3 | |
| Temperature Control Box | Warner Instruments | TC344B | |
| Transfer Pipettes | Genesee Scientific | 30-200 | |
| Tubing | Tygon | B-44-3 TPE | |
| Vibratome VZ-300 | Precissionary | VF-00-VM-NC | |
| Weigh Boat | Electron Microscopy Sciences | 70040 |
References
- Obien, M. E. J., Frey, U. Large-scale, high-resolution microelectrode arrays for interrogation of neurons and networks. Adv Neurobiol. 22, 83-123 (2019).
- Schroter, M., et al. Functional imaging of brain organoids using high-density microelectrode arrays. MRS Bull. 47 (6), 530-544 (2022).
- Miccoli, B., et al. High-density electrical recording and impedance imaging with a multi-modal CMOS multi-electrode array chip. Front Neurosci. 13, 641 (2019).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471 (2023).
- Ferrea, E., et al. high-resolution electrophysiological imaging of field potentials in brain slices with microelectronic multielectrode arrays. Front Neural Circuits. 6, 80 (2012).
- Gagliano, G., et al. Non-linear frequency dependence of neurovascular coupling in the cerebellar cortex implies vasodilation-vasoconstriction competition. Cells. 11 (6), 1047 (2022).
- Goodchild, S. J., et al. Molecular pharmacology of selective Na(V)1.6 and dual Na(V)1.6/Na(V)1.2 channel inhibitors that suppress excitatory neuronal activity ex vivo. ACS Chem Neurosci. 15 (6), 1169-1184 (2024).
- Hu, X., Khanzada, S., Klutsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834 (2022).
- Kim, S., et al. Alteration of neural network and hippocampal slice activation through exosomes derived from 5XFAD nasal lavage fluid. Int J Mol Sci. 24 (18), 14064 (2023).
- Mahadevan, A., Codadu, N. K., Parrish, R. R. Xenon LFP analysis platform is a novel graphical user interface for analysis of local field potential from large-scale MEA recordings. Front Neurosci. 16, 904931 (2022).
- Medrihan, L., Ferrea, E., Greco, B., Baldelli, P., Benfenati, F. Asynchronous GABA release is a key determinant of tonic inhibition and controls neuronal excitability: A study in the synapsin II-/- mouse. Cereb Cortex. 25 (10), 3356-3368 (2015).
- Monteverdi, A., Di Domenico, D., D'Angelo, E., Mapelli, L. Anisotropy and frequency dependence of signal propagation in the cerebellar circuit revealed by high-density multielectrode array recordings. Biomedicines. 11 (5), 1475 (2023).
- Obien, M. E. J., Hierlemann, A., Frey, U. Accurate signal-source localization in brain slices by means of high-density microelectrode arrays. Sci Rep. 9 (1), 788 (2019).
- Thouta, S., et al. Pharmacological determination of the fractional block of Nav channels required to impair neuronal excitability and ex vivo seizures. Front Cell Neurosci. 16, 964691 (2022).
- Tognolina, M., Monteverdi, A., D'Angelo, E. Discovering microcircuit secrets with multi-spot imaging and electrophysiological recordings: The example of cerebellar network dynamics. Front Cell Neurosci. 16, 805670 (2022).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays. Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Maccione, A., et al. Experimental investigation on spontaneously active hippocampal cultures recorded by means of high-density MEAs: Analysis of the spatial resolution effects. Front Neuroeng. 3, 4 (2010).
- van Vliet, E., et al. Electrophysiological recording of re-aggregating brain cell cultures on multi-electrode arrays to detect acute neurotoxic effects. Neurotoxicology. 28 (6), 1136-1146 (2007).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. Annu Int Conf IEEE Eng Med Biol Soc. 2022, 3111-3114 (2022).
- Veleanu, M., et al. Modified climbing fiber/Purkinje cell synaptic connectivity in the cerebellum of the neonatal phencyclidine model of schizophrenia. Proc Natl Acad Sci U S A. 119 (21), e2122544119 (2022).
- Giansante, G., et al. Neuronal network activity and connectivity are impaired in a conditional knockout mouse model with PCDH19 mosaic expression. Mol Psychiatry. , (2023).
- Dossi, E., Blauwblomme, T., Nabbout, R., Huberfeld, G., Rouach, N. Multi-electrode array recordings of human epileptic postoperative cortical tissue. J Vis Exp. (92), e51870 (2014).
- Hajos, N., et al. Maintaining network activity in submerged hippocampal slices: importance of oxygen supply. Eur J Neurosci. 29 (2), 319-327 (2009).
- Hill, M. R., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. J Neurosci Methods. 195 (1), 15-23 (2011).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE Translational Task Force of the ILAE. Epilepsia. 58 (Suppl 4), 40-52 (2017).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), 2056 (2010).
- Lin, C. H., Lee, J. K., LaBarge, M. A. Fabrication and use of microenvironment microarrays (MEArrays). J Vis Exp. (68), 4152 (2012).
- Panuccio, G., Colombi, I., Chiappalone, M. Recording and modulation of epileptiform activity in rodent brain slices coupled to microelectrode arrays. J Vis Exp. 135, 57548 (2018).
- Patel, C., Muthuswamy, J. High efficiency, site-specific transfection of adherent cells with siRNA using microelectrode arrays (MEA). J Vis Exp. 67, e4415 (2012).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Papouin, T., Haydon, P. G. Obtaining acute brain slices. Bio Protoc. 8 (2), e2699 (2018).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. J Vis Exp. 132, 53825 (2018).
- Van Hoeymissen, E., Philippaert, K., Vennekens, R., Vriens, J., Held, K. Horizontal hippocampal slices of the mouse brain. J Vis Exp. (163), 61753 (2020).
- . 3Brain Available from: https://www.3brain.com/ (2022)
- Bridges, D. C., Tovar, K. R., Wu, B., Hansma, P. K., Kosik, K. S. MEA Viewer: A high-performance interactive application for visualizing electrophysiological data. PLoS One. 13 (2), e0192477 (2018).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc Natl Acad Sci U S A. 113 (27), 7337-7344 (2016).
- Maccione, A., et al. Microelectronics, bioinformatics and neurocomputation for massive neuronal recordings in brain circuits with large scale multielectrode array probes. Brain Res Bull. 119 (Pt B), 118-126 (2015).
- . 3Brain Available from: https://www.3brain.com/products/software/brainwave4 (2022)
- Mahadevan, A. . Xenon LFP Analysis. , (2022).
- Mahadevan, A. . xenon-lfp-analysis github. , (2022).
- Codadu, N. K., et al. Divergent paths to seizure-like events. Physiol Rep. 7 (19), e14226 (2019).
- Kirsch, G. E., Drewe, J. A. Gating-dependent mechanism of 4-aminopyridine block in two related potassium channels. J Gen Physiol. 102 (5), 797-816 (1993).
- Levesque, M., Salami, P., Behr, C., Avoli, M. Temporal lobe epileptiform activity following systemic administration of 4-aminopyridine in rats. Epilepsia. 54 (4), 596-604 (2013).
- Myers, T. L., Gonzalez, O. C., Stein, J. B., Bazhenov, M. Characterizing concentration-dependent neural dynamics of 4-Aminopyridine-induced epileptiform activity. Epilepsy J. 4 (2), 128 (2018).
- Perreault, P., Avoli, M. Physiology and pharmacology of epileptiform activity induced by 4-aminopyridine in rat hippocampal slices. J Neurophysiol. 65 (4), 771-785 (1991).
- Rutecki, P. A., Lebeda, F. J., Johnston, D. 4-Aminopyridine produces epileptiform activity in hippocampus and enhances synaptic excitation and inhibition. J Neurophysiol. 57 (6), 1911-1924 (1987).
- Chen, Y., Chad, J. E., Cannon, R. C., Wheal, H. V. Reduced Mg2+ blockade of synaptically activated N-methyl-D-aspartate receptor-channels in CA1 pyramidal neurons in kainic acid-lesioned rat hippocampus. Neuroscience. 88 (3), 727-739 (1999).
- Fujiwara-Tsukamoto, Y., Isomura, Y., Takada, M. Comparable GABAergic mechanisms of hippocampal seizure-like activity in posttetanic and low-Mg2+ conditions. J Neurophysiol. 95 (3), 2013-2019 (2006).
- Swartzwelder, H. S., Anderson, W. W., Wilson, W. A. Mechanism of electrographic seizure generation in the hippocampal slice in Mg2+-free medium: the role of GABAa inhibition. Epilepsy Res. 2 (4), 239-245 (1988).
- Trevelyan, A. J., Graham, R. T., Parrish, R. R., Codadu, N. K. Synergistic positive feedback mechanisms underlying seizure initiation. Epilepsy Curr. 23 (1), 38-43 (2023).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81 (1-2), 103-111 (1998).
- Hajos, N., Mody, I. Establishing a physiological environment for visualized in vitro brain slice recordings by increasing oxygen supply and modifying aCSF content. J Neurosci Methods. 183 (2), 107-113 (2009).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Andrew, R. D., et al. The critical role of spreading depolarizations in early brain injury: Consensus and contention. Neurocrit Care. 37 (Suppl 1), 83-101 (2022).
- Devonshire, I. M., Dommett, E. J., Grandy, T. H., Halliday, A. C., Greenfield, S. A. Environmental enrichment differentially modifies specific components of sensory-evoked activity in rat barrel cortex as revealed by simultaneous electrophysiological recordings and optical imaging in vivo. Neuroscience. 170 (2), 662-669 (2010).
- Parrish, R. R., Codadu, N. K., Mackenzie-Gray Scott, C., Trevelyan, A. J. Feedforward inhibition ahead of ictal wavefronts is provided by both parvalbumin- and somatostatin-expressing interneurons. J Physiol. 597 (8), 2297-2314 (2019).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Curr Opin Neurobiol. 50, 171-178 (2018).
- Yaksi, E., Jamali, A., Diaz Verdugo, C., Jurisch-Yaksi, N. Past, present and future of zebrafish in epilepsy research. FEBS J. 288 (24), 7243-7255 (2021).
- He, M. F., et al. Ex vivo calcium imaging for drosophila model of epilepsy. J Vis Exp. 200, 65825 (2023).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Commun Biol. 4 (1), 136 (2021).
- Parrish, R. R., Grady, J., Codadu, N. K., Trevelyan, A. J., Racca, C. Simultaneous profiling of activity patterns in multiple neuronal subclasses. J Neurosci Methods. 303, 16-29 (2018).
- Valderhaug, V. D., et al. Criticality as a measure of developing proteinopathy in engineered human neural networks. bioRxiv. , (2020).
- Carleo, G., Lee, Y. -. S., Secondo, A., Miceli, F., Taglialatela, M. Multi-electrode array (MEASs) to investigate pathogenetic disease mechanisms and pharmacological properties in iPSC-derived neurons modelling neuropsychiatric diseases. , 667-672 (2022).
- Ruz, I. D., Schultz, S. R. Localising and classifying neurons from high density MEA recordings. J Neurosci Methods. 233, 115-128 (2014).
- Franke, F., Natora, M., Boucsein, C., Munk, M. H. J., Obermayer, K. An online spike detection and spike classification algorithm capable of instantaneous resolution of overlapping spikes. J Comput Neurosci. 29 (1-2), 127-148 (2010).
- Vollgraf, R., Obermayer, K. Improved optimal linear filters for the discrimination of multichannel waveform templates for spike-sorting applications. IEEE Signal Processing Letters. 13 (3), 121-124 (2006).
- Muller, J., et al. High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels. Lab Chip. 15 (13), 2767-2780 (2015).
- Mapelli, L., et al. implementation, and functional validation of a new generation of microneedle 3D high-density CMOS multi-electrode array for brain tissue and spheroids. bioRxiv. , (2022).
- Reddy, D. S., Kuruba, R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci. 14 (9), 18284-18318 (2013).
- Parrish, R. R., Trevelyan, A. J. Stress-testing the brain to understand its breaking points. J Physiol. 596 (11), 2033-2034 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved