Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tamamlayıcı Metal Oksit Yarı İletken Yüksek Yoğunluklu Mikroelektrot Dizi Sistemi Kullanılarak Akut Beyin Dilimlerinden Yüksek Kaliteli Nöbet Benzeri Aktivite
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, ex vivo beyin dilimlerinden nöbet benzeri aktiviteyi kaydetmek için tamamlayıcı metal oksit yarı iletken yüksek yoğunluklu mikroelektrot dizi sistemlerini (CMOS-HD-MEA'lar) kullanmak için bir protokol özetliyoruz.
Özet
Tamamlayıcı metal oksit yarı iletken yüksek yoğunluklu mikroelektrot dizisi (CMOS-HD-MEA) sistemleri, hücre kültürlerinden ve ex vivo beyin dilimlerinden nörofizyolojik aktiviteyi benzeri görülmemiş elektrofizyolojik ayrıntılarla kaydedebilir. CMOS-HD-MEA'lar ilk olarak hücre kültürlerinden yüksek kaliteli nöronal ünite aktivitesini kaydetmek için optimize edildi, ancak aynı zamanda akut retinal ve serebellar dilimlerden kaliteli veriler ürettiği de gösterildi. Araştırmacılar son zamanlarda akut, kortikal kemirgen beyin dilimlerinden yerel alan potansiyellerini (LFP'ler) kaydetmek için CMOS-HD-MEA'ları kullandılar. İlgilenilen bir LFP, nöbet benzeri aktivitedir. Birçok kullanıcı CMOS-HD-MEA'ları kullanarak kısa, spontan epileptiform deşarjlar üretmiş olsa da, çok az kullanıcı güvenilir bir şekilde kaliteli nöbet benzeri aktivite üretir. Elektriksel gürültü, batık kayıt odaları kullanılırken nöbet benzeri aktivite üretmenin tutarsız doğası ve 2D CMOS-MEA çiplerinin yalnızca beyin diliminin yüzeyinden kayıt yapmasının sınırlandırılması dahil olmak üzere birçok faktör bu zorluğa katkıda bulunabilir. Bu protokolde ayrıntılı olarak açıklanan teknikler, kullanıcıların bir CMOS-HD-MEA sistemi ile akut beyin dilimlerinden yüksek kaliteli nöbet benzeri aktiviteyi tutarlı bir şekilde indüklemesini ve kaydetmesini sağlamalıdır. Ek olarak, bu protokol CMOS-HD-MEA yongalarının uygun şekilde işlenmesini, deney sırasında çözeltilerin ve beyin dilimlerinin yönetimini ve ekipman bakımını ana hatlarıyla belirtir.
Giriş
Binlerce kayıt noktasına 1,2 sahip bir MEA çipi ve verileri yükseltmek ve sayısallaştırmak için bir MEA platformu içeren ticari olarak temin edilebilen yüksek yoğunluklu mikroelektrot dizisi (HD-MEA) sistemleri, elektrofizyolojik araştırmalar için gelişmekte olan bir araçtır. Bu HD-MEA sistemleri, hücre kültürlerinden ve ex vivo beyin dilimi preparatlarından elde edilen elektrofizyolojik verileri yüksek hassasiyetle kaydetmek için tamamlayıcı metal oksit yarı iletken (CMOS) teknolojisini kullanır. Bu MEA sistemleri, yüksek elektrot yoğunluğu ve kaliteli sinyal-gürültü oranları aracılığıyla nörofizyolojik araştırmalara benzeri görülmemiş uzamsal ve zamansal çözünürlük sağlar3. Bu teknoloji çoğunlukla hücre dışı aksiyon potansiyellerini incelemek için kullanılmıştır, ancak aynı zamanda çeşitli nöronal beyin dilimi preparatlarındanyüksek kaliteli yerel alan potansiyellerini (LFP'ler) yakalayabilir 4,5,6,7,8,9,10,11,12,13,14,15 . CMOS-HD-MEA sistemlerinin yukarıda belirtilen yüksek çözünürlüklü kayıt özelliği sayesinde, kullanıcılar elektrofizyolojik aktiviteyi büyük bir uzamsal doğrulukla izleyebilir 16,17,18. Bu özellik, özellikle 5,12,15,19,20,21 ağ LFP'lerinin yayılma modellerini izlemek için önemlidir. Bu nedenle, CMOS-HD-MEA sistemleri, çeşitli hücre kültürü ve beyin dilimi preparatlarından fizyolojik ve patolojik aktivitenin yayılma modellerinin benzeri görülmemiş bir şekilde anlaşılmasını sağlayabilir. Özellikle, CMOS-HD-MEA sistemlerinin bu yetenekleri, araştırmacıların aynı anda farklı beyin bölgelerinin nöbet modellerini karşılaştırmasına ve çeşitli anti-epileptik bileşiklerin bu kalıpları nasıl etkilediğini analiz etmesine izin verebilir. Bunu yaparak, iktogenez ve iktal yayılımını incelemek ve farmakolojinin patolojik ağ aktivitesini nasıl bozduğunu anlamak için yenilikçi bir yöntem sağlar 7,10,14. Bu nedenle, CMOS-HD-MEA sistemlerinin bu yeni kapasiteleri, nörolojik bozuklukların araştırılmasına önemli ölçüde katkıda bulunabilir ve ayrıca ilaç keşif araştırmalarına yardımcı olabilir 5,7,11,22. Nöbet benzeri aktiviteyi incelemek için CMOS-HD-MEA sistemlerinin kullanımı hakkında ayrıntılı bilgi vermeyi amaçlıyoruz.
Akut beyin dilimlerindeki epileptiform aktivite gibi LFP'leri incelemek için CMOS-HD-MEA sistemlerini kullanırken, kullanıcılar elektriksel gürültüyü zayıflatmak, deney sırasında dilimi sağlıklı tutmak ve yalnızca beyin diliminin yüzeyinden kayıt yapan iki boyutlu (2D) CMOS-MEA çipinden kaliteli bir sinyal tespit etmek gibi birçok zorlukla karşılaşabilir. Bu protokol, MEA platformunun ve deneyde kullanılan diğer ekipmanların uygun şekilde topraklanması için temel adımları açıklar ve bu, her laboratuvar kurulumu için ayrı özelleştirme gerektirebilecek çok önemli bir adımdır. Ek olarak, CMOS-HD-MEA sistemleri 23,24,25 ile kullanılan batık odacıklarda uzun kayıtlar sırasında beyin diliminin sağlıklı kalmasına yardımcı olacak adımları tartışıyoruz. Ek olarak, beyin diliminin derinliklerinden kayıt yapan daha yaygın elektrofizyolojik kayıt yöntemlerinin aksine, çoğu CMOS-HD-MEA sistemi, dilime nüfuz etmeyen 2D çipler kullanır. Bu nedenle, bu sistemler kaydedilen LFP sinyallerinin çoğunu üretmek için sağlıklı bir nöronal dış tabakaya ihtiyaç duyar. Diğer zorluklar arasında binlerce elektrot tarafından üretilen büyük miktarda veriyi görselleştirmek yer alıyor. Bu zorlukların üstesinden gelmek için, beyin dilimi boyunca yayılan yüksek kaliteli ağ epileptiform aktivitesi elde etme olasılığını artıran basit ama etkili bir protokol öneriyoruz. Ayrıca, veri görselleştirmeye yardımcı olmak için ilgili kaynaklarla birlikte geliştirdiğimiz genel kullanıma açık bir grafik kullanıcı arayüzünün (GUI) kısa bir açıklamasını da ekliyoruz10.
Önceki yayınlar, MEA kayıt sistemlerinin kullanımı için ilgili protokolleri sağlamıştır 26,27,28,29. Bununla birlikte, bu çalışma, 2D çipli CMOS-HD-MEA sistemlerini kullanan deneycilere, özellikle de beyin dilimlerinden yüksek kaliteli epileptiform aktiviteyi incelemek isteyenlere yardımcı olmayı amaçlamaktadır. Ek olarak, kullanıcıların kendi özel uygulamaları için en uygun konvülsan ortamı belirlemelerine yardımcı olmak için nöbet benzeri aktivitenin indüksiyonu için en yaygın çözüm manipülasyonlarından ikisini, yani 0 Mg2 + ve 4-AP paradigmalarını karşılaştırıyoruz. Protokol esas olarak nöbet benzeri aktivitenin üretilmesine odaklanmış olsa da, beyin dilimleri kullanılarak diğer elektrofizyolojik olayları keşfetmek için değiştirilebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Fareleri içeren prosedürler, Brigham Young Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı. Aşağıdaki deneylerde en az P21 yaşına kadar olan erkek ve dişi (n = 8) C57BL / 6 fareleri kullanıldı.
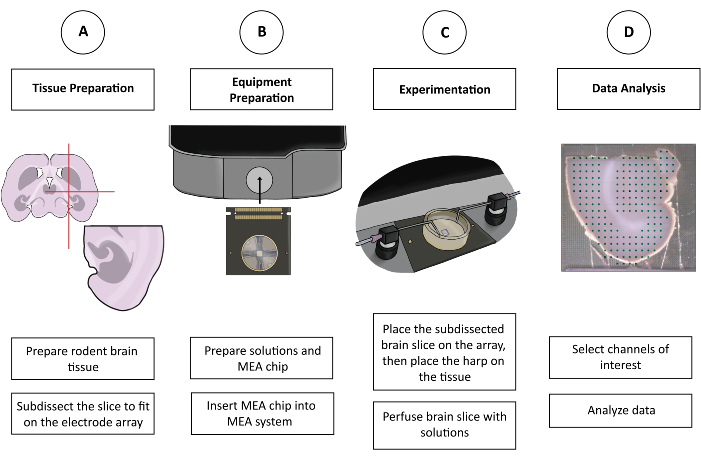
Şekil 1: CMOS-HD-MEA deneyinin şematik şekli. (A) Beyin dilimi, kişinin tercih ettiği kesme yöntemiyle hazırlanır ve MEA'ya uyacak şekilde alt parçalara ayrılır. (B) Çözeltileri ve CMOS-HD-MEA çipini hazırlayın. (C) Alt diseke beyin dilimi elektrot dizisine yerleştirilir ve uygun solüsyonlarla yıkanır. (D) Toplanan verilerden ilgili kanallar seçilir. Veriler daha sonra kullanıcının tercih ettiği programda analiz için hazırlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Ad | Konsantrasyon (mM) | g/L | ||
| Sodyum Klorür (NaCl) | 126 | 7.36 | ||
| Potasyum Klorür (KCl) | 3.5 | 0.261 | ||
| Dihidrojen Sodyum Fosfat (NaH2PO4) | 1.26 | 0.151 | ||
| Sodyum Bikarbonat (NaHCO3) | 26 | 2.18 | ||
| Glikoz (C6H12O6) | 10 | 1.80 | ||
| Magnezyum Klorür (MgCl2) | 1 adet (1 M stoktan) | 1 mL | ||
| Kalsiyum Klorür (CaCl2) | 2 (1 M stoktan) | 2 mL | ||
Tablo 1: aCSF çözümü.
1. Çözümlerin hazırlanması
- Deneysel çözümleri hazırlayın.
- 1 L yapay beyin omurilik sıvısı (aCSF) hazırlayın (ayrıntılar için Tablo 1'e bakınız).
- 1 L pro-konvülsan çözelti hazırlayın.
NOT: Bu protokolde nöbet benzeri aktivite oluşturmak için kullanılan solüsyonlarda ya 100 μM 4-Aminopiridin (4-AP) içeren aCSF ya da magnezyum iyonları içermeyen aCSF kullanılmıştır. - Gözenekli taşlar kullanarak kullanmadan önce tüm çözeltileri en az 10 dakika boyunca karbonjenize edin.
- Çözeltileri atmak için bir beher edinin.
- 1 L aCSF, 1 L pro-konvülsan çözelti ve atılan kabı perfüzyon sistemine yakın bir yüzeye yerleştirin.
- Kesme ve tutma haznesi çözümlerinin hazırlanması
- Benzersiz bir kesme çözeltisi oluşturmak için CaCl2'yi atlayarak ve 3 mM MgCl2 (1 mM'nin aksine) ekleyerek 0,5 L aCSF hazırlayın. Bu solüsyonu, akut beyin dilimi hazırlama alanının yakınına yerleştirerek kemirgen beyin dilimi hazırlığında kullanmak üzere saklayın.
- 0,5 L aCSF hazırlayın ve deneyde kullanılmak üzere dilimleri tutmak için kullanılacak bir doku tutma odasına yerleştirin. Gözenekli taşları doku tutma odasına yerleştirin ve alt disseke dilimleri odaya yerleştirmeden önce çözeltiyi en az 10 dakika karbojenize edin.
2. Kemirgen beyin dilimlerinin hazırlanması
- Tüm çözümleri yukarıda açıklandığı gibi hazırlayın (bkz. bölüm 1). Hazırlama işlemi sırasında tüm çözeltilerin uygun şekilde karbonjene edildiğinden emin olun.
NOT: Kesme solüsyonu (bakınız bölüm 1.2) tavsiye edilir, ancak kaliteli beyin dilimleri elde etmek için sakaroz kesme solüsyonu30 gibi başka kesme solüsyonları da kullanılabilir. - 350 μm kemirgen beyin dilimleri yapmak için titreşimli bir mikrotom kullanın. Bu enstrümanların kullanımına ilişkin protokoller30,31,32,33 referanslarında listelenmiştir.
- Kemirgen beyin dilimlerini MEA çipinin kayıt elektrot alanına sığacak şekilde hazırlayın (bkz. Şekil 2). Şekil 10A ve Şekil 1A'da gösterildiği gibi, bıçağı beyin dilimi üzerinde hafifçe ileri geri yuvarlayarak dilimleri alt incelemek için 2 numara bir cerrahi bıçak kullanın. Alt diseksiyonu titreşimli mikrotom kesme odasında gerçekleştirin. Alt diseke edilmiş beyin dilimine zarar vermemek için dikkatli olun.
- Alt disseke edilmiş dilimleri aCSF ile doldurulmuş bir doku tutma odasına yerleştirin. Alt disseke dilimleri eklemeden önce haznenin en az 10 dakika karbonjene edildiğinden emin olun.
3. Ekipman hazırlığı
- MEA çiplerinin ve sisteminin hazırlanması (Şekil 2 ve Şekil 3)
NOT: Plastikler ve metaller gibi sert malzemeler, çipin altına iyice temas ederlerse MEA çipine kolayca zarar verebilir. Çözeltiyi çiplerin içine veya dışına aktarmak için pipetler kullanırken, çipin alt kısmını, özellikle talaş yuvasının yanlarındaki referans elektrotları ve talaş yuvasının ortasındaki kayıt elektrotları olmak üzere pipetle iyice temas ettirmeyin. Bunun yerine, çözeltiyi talaş kuyusunun alt kısmının üzerine getirerek veya talaşın plastik kenarlarına temas ederek veya yaklaştırarak ekleyin. Tüm çözeltiyi kolayca çıkarmak için, çözeltinin çipin bir tarafına iyice birikmesini sağlamak için çipi hafifçe eğin ve havuzlanan solüsyonun üstünden çıkarın veya hala solüsyonun bulunduğu alanlara hafifçe vurmak için antistatik bir mendil kullanın. Çipi iyi tutarak veya çip pimlerini tutarak çipi taşımayın (Şekil 2C). Çip kuyusu yaklaşık 4 mL çözelti tutabilir. Sonraki adımlar için, aksi belirtilmedikçe çipi yaklaşık 2 mL çözelti ile iyice doldurun.- Talaş hazırlamaya başlamadan önce çeşitli görevler için transfer pipetleri belirleyin. İstenmeyen karıştırmayı önlemek için bir transfer pipetini etanol için, birini atık için, diğerini aCSF için ve diğerlerini kalan çözeltiler için etiketleyin.
- MEA çipinin kuyusunu 190 geçirmez etanol ile doldurun, böylece çip kuyusunun tabanı tamamen kaplanır (Şekil 3). Etanolü 30-60 saniye bekletin, ardından bir pipetle çıkarın.
- MEA çipinin kuyusunu aCSF ile doldurun ve kalan etanolü çip kuyusundan durulamak için atılan bir pipetle çıkarın. Önceden belirlenmiş atık ve aCSF pipetlerini kullanarak aCSF'yi talaş kuyusundan üç kez ekleyin ve çıkarın. Çipi üç kez iyice yıkadıktan sonra aCSF ekleyin ve en az 30 saniye bekletin.
NOT: Kayıt elektrotları, aCSF, etanol ve aCSF ile durulandıktan sonra en az 45 dakika boyunca haznede kaldığında hidrofobik etkileşimlerden en az miktarda gürültü sergiler. - MEA çipini yerleştirmeden önce, antistatik bir mendili 190 geçirmez etanol ile ıslatın ve çipin pimlerini silmek için kullanın (Şekil 2C).
- MEA çipini yavaşça MEA platformuna kaydırın ve çipi yerine kilitlemek için yerleştirme mekanizmasını devreye sokun.
- Kabarcıklar için kayıt ve referans elektrotlarını kontrol edin (Şekil 2C). Kabarcıklar varsa, temiz bir boya fırçası alın ve çıkarmak için elektrotları hafifçe süpürün.
- CMOS-HD-MEA yazılımını34 kullanarak çipte parazit olup olmadığını kontrol edin ve yanlış renk haritasını kabarcıklar, biyolojik olmayan salınımlar veya elektriksel parazitin neden olduğu ani yükselmeler için görsel olarak tarayın. Karşılaşılan herhangi bir gürültüyü ortadan kaldırmak için MEA sistemini uygun şekilde topraklayın.
NOT: Topraklama kurulumu kayıt ortamına bağlı olacaktır. Bu protokoldeki deneyler için MEA platformu ve perfüzyon sistemi topraklandı.
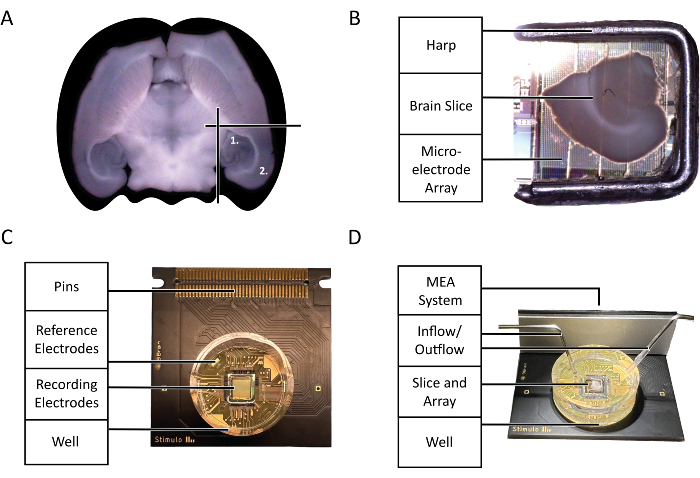
Şekil 2: Konfigürasyon ve teknoloji diyagramları. (A) Bu protokol tarafından vurgulanan deneyde kullanılan akut fare beyin dilimlerinin seçiminin diyagramı. (1) Hipokampal bölge (2) Neokorteks bölgesi. (B) Akut fare beyin diliminin ve arpının mikroelektrot Dizisi (MEA) üzerine uygun şekilde yerleştirilmesi. (C) 3Brain Accura CMOS-HD-MEA çipinin anatomisi. (D) Perfüzyon giriş ve çıkışlarının uygun konfigürasyonu. Giriş, çip kuyusunun derinliklerinde olmalı, oysa çıkış, sürekli bir taze, oksijenli aCSF akışını garanti etmek için çip kuyusunun üst kısmındaki girişin karşı tarafında olmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
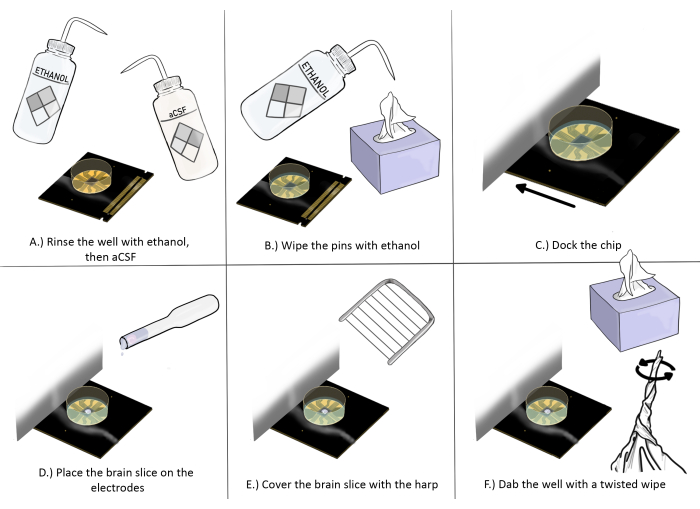
Şekil 3: Beyin dilimi deneyleri için çip hazırlama ve yerleştirme şematik diyagramı. (A) Çipi bir kez etanol ile iyice durulayın, ardından üç kez aCSF ile durulayın. (B) Antistatik bir mendil kullanarak pimleri etanol ile silin. (C) Çipi yerleştirin. (D) Beyin dilimini elektrotların üzerine yerleştirin. (E) Arpı beyin diliminin üzerine yerleştirin (uygun yerleştirme yönergeleri için Şekil 2'ye bakın). (F) Kayıt elektrotlarının kuyusunun köşesini beyin dilimine yakın bir yere bükülmüş antistatik bir mendille sürün. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Deney
- Beyin diliminin yerleştirilmesi
- MEA platformunun yakınındaki bir tartı teknesine (veya başka bir temiz yüzeye) bir platin arp yerleştirin. Hidrofobik eğilimlerini azaltmak için arpı yaklaşık 3 mL aCSF ile kaplayın.
- Bir transfer pipetinin ince uçlu kısmını çıkarmak için makas kullanın. Pipet ucunun üçte birini, yaklaşık 1,5 inçini kesin.
NOT: Bu modifiye edilmiş pipet, toplama ve taşıma sırasında beyin dilimini daraltmaz veya zarar vermez. - Modifiye edilmiş pipet ile dilim tutma odasından bir beyin dilimi toplayın. Beyin dilimini ve pipetteki herhangi bir çözeltiyi nazikçe çip kuyusuna dağıtın. Dilimi düzgün bir şekilde konumlandırmak için, beyin diliminin konumunu manipüle etmek için bir transfer pipetinden yavaşça daha fazla aCSF bırakın veya çözeltide beyin dilimini kayıt elektrotlarına iten bir akım oluşturmak için yumuşak bir boya fırçası kullanın. Hasarı en aza indirmek için kayıt elektrotları veya beyin dilimi ile teması sınırlayın.
- Forseps kullanarak, dilimi kayıt elektrotlarının üzerine bastırmak için arpı iplikler aşağı bakacak şekilde beyin diliminin üzerine nazikçe yerleştirin. Elektrot dizisine arp ile temas etmekten kaçının. Arpı, çerçevesiz tarafı giriş iğnesine bakacak ve arpın çerçevesi kayıt elektrotlarının hiçbirine temas etmeyecek şekilde yönlendirin (Şekil 2C, D).
- Atılan bir pipet alın ve fazla aCSF'yi çıkarın. Antistatik bir mendil alın, bir uç oluşturmak için bir köşeyi çevirin ve kayıt elektrotlarına, beyin dilimine veya arpa dokunmadan kayıt elektrotlarını çevreleyen kalan aCSF'yi emmek için kullanın (Şekil 2).
- Belirlenmiş bir aCSF pipeti kullanarak, beyin dilimini kaplayacak kadar hızlı bir şekilde yaklaşık 2 mL karbojene aCSF ekleyin.
- Adım 4.1.5'i tekrarlayın. ve 4.1.6. iki kez daha.
- Kuyu kabaca 3/4 dolu, yaklaşık 3 mL olana kadar kuyuyu karbojene aCSF ile doldurun.
- Mikroskop veya kamera ile MEA çipi üzerindeki beyin diliminin fotoğrafını çekin. Fotoğrafın, kayıt elektrot dizisinin sınırlarını ve beyin diliminin anatomisini görmek için yeterince yüksek çözünürlüğe sahip olduğundan emin olun.
- Denemeyi çalıştırma
- Perfüzyon sisteminin çalıştırılması
- Giriş ve çıkış borularını aCSF ile doldurulmuş behere ve giriş ve çıkış iğnelerini talaş kuyusuna yerleştirin. Giriş iğnesini, kayıt elektrotlarının hemen dışına, çipin dibine yakın bir yere yerleştirin. Çıkış iğnesini talaşın üst kısmına yakın bir yere iyice kenara doğru yerleştirin, böylece sıvı talaş kuyusunun neredeyse ağzına kadar yaklaşık 4 mL yükselir ve dilim deney boyunca suya batırılır (Şekil 2D).
- Perfüzyon girişini 5 mL / dk'ya ve perfüzyon çıkışını 7 mL / dk'ya ayarlayın.
NOT: Çözeltinin çip kuyusundan dışarı taşmasını önlemek ve beyin dilimi üzerinde bir çözelti akımı oluşturmak için çıkış hızının giriş hızını aşması önerilir. - Giriş ve çıkış akışını açın. İğne hava yerine çözelti çıkarmaya başlayana kadar giriş iğnesini çip kuyusundan çıkarın. Ardından, iğneyi adım 4.2.1.1'de açıklandığı gibi çipin içindeki konumuna geri yerleştirin.
- Çözeltiyi 34-37 °C civarında fizyolojik sıcaklıkta veya yakınında tutmak için bir çözelti ısıtıcısı kullanın.
- aCSF'nin 10 dakika boyunca beyin dilimi üzerinde perfüze olmasına izin verin. Bu, dilimin kayıt ortamına uyum sağlamasına izin verecektir.
- 10 dakika geçtikten sonra, çıkış borusunu atılan behere getirin. Ardından, giriş tüpünü pro-konvülsan çözeltiyi içeren behere hareket ettirin. Konvülsan olmayan aCSF'nin perfüzyon sisteminden 10 dakika boyunca atılan behere atılmasına izin verin.
- Çıkış tüpünü, pro-konvülsan çözeltiyi içeren behere aktarın.
- Deney bitene kadar pro-konvülsan çözelti döngüsüne izin verin.
- Dilim kayıt süresi 2 saati aşarsa, aktif beyin diliminin glikoz tüketimini dengelemek için başka bir pro-konvülsan çözelti hazırlamayı düşünün.
- Beyin dilimlerini değiş tokuş etmek
- Girişi kapatın. 10-15 saniye sonra çıkışı kapatın.
- Arpı çıkarmak için forseps kullanın ve bir tartı teknesine veya başka bir yüzeye yerleştirin.
- Beyin dilimini çıkarmak ve atmak için değiştirilmiş bir pipet kullanın. Referans elektrotlarına veya kayıt elektrot dizisine dokunmayın (Şekil 2C).
- Giriş tüpünü, konvülsan olmayan aCSF solüsyonunu içeren behere yerleştirin. Çıkış borusunu atılan behere yerleştirin. Giriş ve çıkış iğnelerini çip kuyusunda bırakın. Tüm kalıntı pro-konvülsan solüsyonu çip kuyusundan ve perfüzyon sisteminden çıkarmak için perfüzyon sistemini 10 dakika çalıştırın. Deney sürecine yeni bir beyin dilimi ile tekrar başlayın (adım 4.1'den başlayarak).
- Perfüzyon sisteminin çalıştırılması
- Deneyin bitirilmesi
- Teçhizatın temizlenmesi
- Sırasıyla arpı, beyin dilimini ve çözeltiyi kuyudan çıkarın.
- MEA çipini çıkarın, temiz bir yüzeye yerleştirin ve çipi deiyonize suyla iyice doldurun.
- ACES çözeltilerinden kalan tuzları temizlemek için deiyonize suyu atın.
- Bir transfer pipeti kullanarak, çipi bir deterjan solüsyonuyla iyice doldurun. Transfer pipetinin ucunu çip yuvasının içine getirin ve kayıt elektrotlarına doğrultun. Deterjanı kayıt elektrotları üzerinde 1 dakika boyunca kuvvetlice yıkamak için transfer pipetine hızlı ve tekrar tekrar deterjan sıkın ve bırakın. Deterjanı 5-10 dakika dinlendirin.
- Deterjanı çıkarın, ardından deterjan solüsyonunu ve kalan çözünen maddeleri çıkarmak için çipi deiyonize suyla 4-6 kez iyice durulayın.
- Çip kuyusundan tüm suyu çıkarın, ardından MEA çipinin üzerine antistatik bir mendil yerleştirin ve çipin iyice kurumasını sağlamak için gece boyunca bırakın.
- MEA çipinin daha önce dinlendiği MEA kayıt platformuna bir tartım botu veya başka bir su geçirmez plaka yerleştirin. Arpı plakanın ortasına yerleştirin ve giriş ve çıkış iğnelerini arpın her iki tarafına yerleştirin.
- Perfüzyon sistemini ve arpı, sırasıyla 50 mL su, 50 mL 140 geçirmez etanol ve 200 mL su ile borudan atılan behere göndererek temizleyin.
NOT: Şu anda, temizleme süresini azaltmak için perfüzyon hızları artırılabilir, ancak taşmayı önlemek için çıkış hızı her zaman giriş hızını aşmalıdır. - Karbojen taşlarını damıtılmış su dolu bir behere koyarak ve karbojeni 5 dakika boyunca borudan göndererek temizleyin. Gece boyunca kuru, temiz bir yüzeyde dinlenmeye bırakın ve toz birikmesini önlemek için üzerlerini örtün.
- Teçhizatın temizlenmesi
5. Veri analizi
NOT: CMOS-HD-MEA'lar tarafından üretilen elektrofizyolojik verileri analiz etmek için kullanılan, 3Brain'den BrainWave, Yet Another Spike Sorter (YASS) ve özel Python araçları 34,35,36,37 dahil olmak üzere çeşitli analiz paketleri vardır. Şekil 4 ve Şekil 5'te sunulan verileri oluşturmak için Xenon LFP Analiz platformunda kullanılmak üzere BrainWave veri dosyası formatından veri çıkardık. Şekil 6'daki verileri analiz etmek için özel Matlab kodu kullanılmıştır. Xenon LFP Analiz platformu için protokoller halka açıktır10. Aşağıdaki protokol adımları Brainwave 438 ile yapılan kayıtlara özeldir; Diğer sistemler için, bu sistemlerle ilgili destekleyici belgelerebakın 34,35,36,37. Bu protokol ile verilerin üretilmesi için atılan analiz adımlarına genel bir bakış aşağıda verilmiştir. Öğretici videolar ve ilgili tüm kod dosyaları da dahil olmak üzere verilerin nasıl dışa aktarılacağı, görselleştirileceği ve analiz edileceğiyle ilgili tüm ayrıntılar içinbkz. 39.
- Analiz için kayıt dosyasını dışa aktarın.
- Altörneklenecek veri kayıt dosyaları için bir klasör oluşturun.
- Adım 4.1.9 sırasında çekilen görüntüyü, yalnızca beyin dilimlerini içeren kayıt dizisini içerecek şekilde kırpın.
- ExportToHDF5-ChannelSelection.py dosyasını açın (bu kod dosyasına GitHub'da xenon-lfp-analysis/code-files/3Brain-processing40 altında erişilebilir) ve pencerenin üst kısmında listelenen URL'yi kopyalayıp bir internet tarayıcısına yapıştırın.
- Veri kayıt dosyası için dosya yolunu girin ve kayıtla ilişkili dizinin kırpılmış görüntüsünü yükleyin.
- Dışa Aktarma için Kanal Seç altında, dizinin kırpılmış görüntüsünde gösterilen hipokampal ve neokortikal bölgeleri seçmek için kement seçme aracını kullanın.
- Hem atlanacak satır sayısını hem de atlanacak sütun sayısını 2 olarak ayarlayın.
NOT: Kayıt dosyaları genellikle büyüktür; İstenen analiz için uygunsa, dışa aktarılan veriler alt örneklenebilir. Uzamsal olarak (kayıt elektrotlarının satırlarını ve sütunlarını atlayarak) ve zamansal olarak (daha düşük bir örnekleme frekansına altörnekleme yaparak) altörnekleme seçenekleri mevcuttur. Analizde her 2 satır ve 2 sütun atlanır; Bu, verilerin belirli kanallara önyargılı olmadan uzamsal olarak alt örneklenmesine izin verir. Her kanal, aralarındaki aktivite farklılıklarının önemli olabileceği kadar birbirinden yeterince uzaktır; Bu nedenle, kanal ortalaması alınmaz. Elektrotların satırlarını ve sütunlarını atlarken, çıktı dosyası dışa aktarıldığında seçilmeyen kanallardan gelen veriler dahil edilmez. - Altörnekleme frekansını 300 Hz olarak ayarlayın.
- Kanal seçim dosyasını oluşturmak için Kanalları Dışa Aktar düğmesini tıklayın.
NOT: Yazılım, kanal seçim dosyasını otomatik olarak veri kayıt dosyasının kaydedildiği klasöre kaydedecektir. - ExportToHDF5-ExtractDownsample.py dosyasını açın (GitHub'da xenon-lfp-analysis/code-files/3brain-processing40 altında da bulunur), kanal seçim dosyalarını ve veri kayıt dosyalarını içeren klasörün dosya yolunu yapıştırın ve veri kayıt dosyasının alt örneklenmiş sürümünü oluşturmak için klavyede enter tuşuna basın.
- Analiz platformunu kullanma
- Bilgisayarın komut istemine run_lfp_analysis yazın ve analiz platformunu açmak için enter tuşuna basın.
- Görüntünün ve altörneklenmiş kayıt dosyasının dosya yollarını girin ve gönder'i tıklayın.
- Analiz için Bir Zaman Aralığı Seçin altında, kaydın tamamını seçin.
- Grafikler için Kanalları Seç altında, hipokampusu Grup-1 ve neokorteksi Grup-2 olarak vurgulayın.
- Kanal Raster altında, Eşik'i 0,06 mV'a ve Zaman Süresi'ni 0,02 s'ye ayarlayın.
- Ayarları Uygula ve Raster Oluştur'u tıklayın.
- İlgilenilen etkinlik kalıplarını gösteren farklı kanalları keşfetmek için raster grafiğini kullanın.
NOT: Yüksek kaliteli nöbet benzeri aktivite (Şekil 4A-D) ve suboptimal aktivite (Şekil 4E-F) örnekleri için Şekil 4'e bakınız.
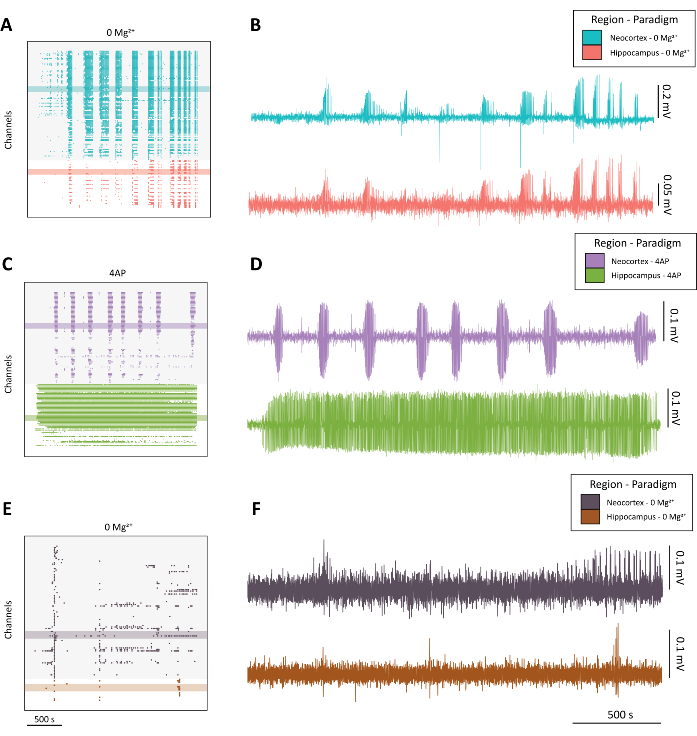
Şekil 4: 0 Mg2 + ve 4-AP paradigmalarından gelişen epileptiform aktivite örneği. (A) Yaklaşık 40 dakika boyunca 0 Mg2+ ile aCSF uygulamasından örnek raster çizimi. (B) 0 Mg2+ paradigmasından epileptiform aktivite gösteren neokorteks (mavi) ve hipokampustan (kırmızı) alınan örnek elektrofizyoloji izleri. (C) Yaklaşık 40 dakika boyunca 100 mM 4-AP uygulamasından örnek raster çizimi. (D) Neokorteks (mor) ve hipokampustan (yeşil) alınan ve 4-AP uygulamasından epileptiform aktivite gösteren örnek elektrofizyoloji izleri. (E) Diğer temsili izlerde bulunan nöbet benzeri aktivitenin aksine patlama aktivitesi gösteren yaklaşık 40 dakika boyunca 0 Mg2+ ile aCSF uygulamasından örnek raster çizimi. (F) Neokorteks (koyu mor) ve hipokampustan (pas) alınan ve 0 Mg2+ paradigmasından optimal altı aktivite gösteren örnek elektrofizyoloji izleri, B ve D'de bulunan kaliteli nöbet benzeri aktivite ile karşılaştırmayı amaçlamaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
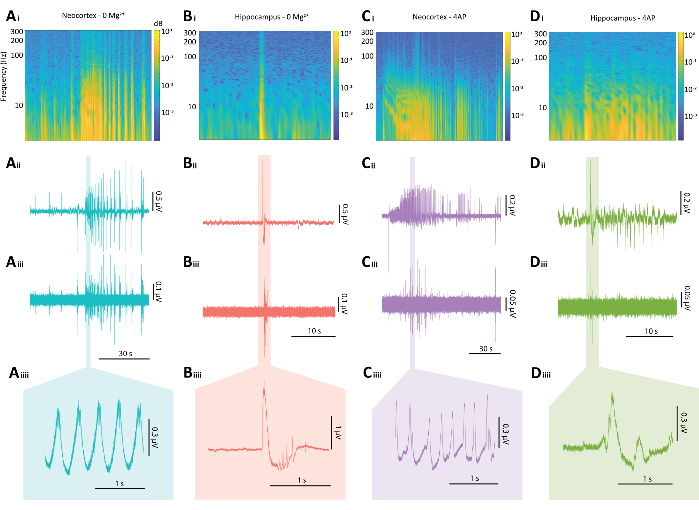
Şekil 5: Hem 0 Mg2 + hem de 4-AP paradigmalarından epileptiform deşarjların temsili sonuçları. (A) (Ai) nöbet benzeri bir olaydan bir spektrogram, (Aii) ilişkili elektrofizyolojik iz, (Aiii) Aii'den ize uygulanan 80 Hz yüksek geçiren bir filtre, (Aiiii) ve Aii'den izin büyütülmüş bir kesiti dahil olmak üzere 0 Mg2+ paradigması tarafından indüklenen tipik bir neokortikal nöbet benzeri olayın örnek grafikleri. (B) (Bi) epileptiform patlamanın bir spektrogramı, (Bii) ilişkili elektrofizyolojik iz, (Biii) Bii'den ize uygulanan 80 Hz yüksek geçiren bir filtre, (Biiii) Bii'den ize uygulanan 80 Hz yüksek geçiren bir filtre, (Biiii) ve Bii'den izin büyütülmüş bir bölümü dahil olmak üzere 0 Mg2+ paradigması tarafından indüklenen tipik bir hipokampal epileptiform patlamanın örnek grafikleri (Ci) epileptiform aktivitenin bir spektrogramı, (Cii) ilişkili elektrofizyolojik iz, (Ciii) Cii'den ize uygulanan 80 Hz yüksek geçiren bir filtre, (Ciiii) ve Cii'den izin büyütülmüş bir bölümü (D) (Di) epileptiform aktivitenin bir spektrogramı, (Dii) ilişkili elektrofizyolojik iz dahil olmak üzere 4-AP paradigması altında bir hipokampal epileptiform patlamanın örnek grafikleri, (Diii) Dii'den gelen ize uygulanan 80 Hz yüksek geçiren bir filtre, (Diiii) ve Dii'den gelen izin büyütülmüş bir bölümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
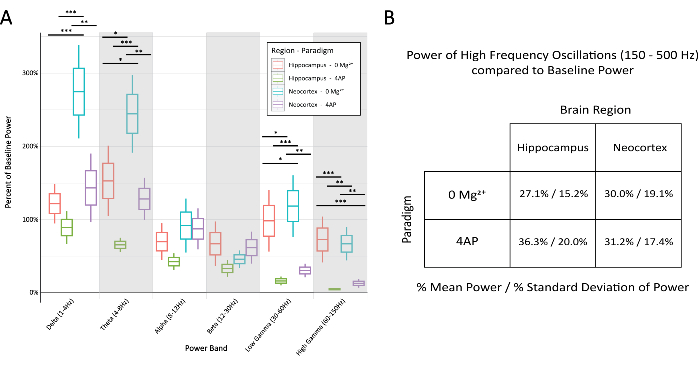
Şekil 6: Stereotipik epileptiform deşarjlar sırasında paradigma ve beyin bölgesindeki çeşitli bantlardaki temel güç yüzdesinin karşılaştırılması. (A) Epileptiform deşarjlar sırasındaki güç, çoğu frekans bandı için paradigmalar ve beyin bölgeleri arasında önemli ölçüde farklıydı (Tukey testi ile 2 yönlü ANOVA, *P < 0.05, **P < 0.001, ***P < 0.0001). Her kutu için orta çizgi ortalamayı, kutunun kenarlıkları ±1 ortalamanın standart hatasını (SEM) ve en dıştaki çizgiler ±2 SEM'i temsil eder. (B) Hem paradigmalar hem de beyin bölgeleri, 150 Hz'nin üzerindeki yüksek frekanslı aktiviteyle ilgili bantlarda sınırlı güç gösterdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Birçok kanal 1,4,5,10'dan gelen etkinliği görselleştirirken standart olduğu gibi, öncelikle CMOS-HD-MEA ile elde ettiğimiz verilerin bir raster grafiğini oluşturmanın faydalı olduğunu düşünüyoruz (Şekil 4A,C,E). Bu çizim, her bir kanalı y ekseninde ve zamanı x ekseninde görünt...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, CMOS-HD-MEA kullanıcılarının karşılaştığı yaygın sorunları, yani beyin dilimi altında gürültü gelişimini ve beyin dilimi için sağlıklı bir ortamın sürdürülmesini ele alan akut beyin dilimi yönetimi ile ilgili özel kılavuzları içerir. Dilimin altında gürültü oluşumu, dilim diziye düzgün bir şekilde yapışmadığında meydana gelir; Beyin dilimi yeterince yapışmazsa, dilimin altında hava cepleri oluşabilir ve bu da gürültüye neden ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, bu araştırma çalışmasıyla ilişkili herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, bu el yazması üzerindeki düzenlemeleri için eski ve mevcut Parrish laboratuvar üyelerine teşekkür eder. Bu çalışma hakkındaki geri bildirimleri için 3Brain'den Alessandro Maccione'ye de teşekkür ederiz. Bu çalışma, AES / EF Genç Araştırmacı Ödülü ve Brigham Young Üniversitesi Yaşam Bilimleri ve Fiziksel ve Matematik Bilimleri Kolejleri tarafından finanse edilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2D Workbench | Cloudray | LM04CLLD26B | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| Accura Chip | 3Brain | Accura HD-MEA | CMOS-HD-MEA chip |
| Agarose | Thermo Fisher Scientific | BP160-100 | |
| Vibration isolation table | Kinetic Systems | 91010124 | |
| Beaker for the slice holding chamber, 270 mL | VWR | 10754-772 | |
| BioCam | 3Brain | BioCAM DupleX | CMOS-HD-MEA platform |
| Brainwave Software | 3Brain | Version 4 | CMOS-HD-MEA software |
| Calcium Chloride | Thermo Fisher Scientific | BP510-500 | |
| Carbogen | Airgas | X02OX95C2003102 | |
| Carbogen | Airgas | 12005 | |
| Carbogen Stones | Supelco | 59277 | |
| Compresstome | Precissionary | VF-300-0Z | |
| Computer | Dell | Precission3650 | |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | |
| Detergent | Metrex | 10-4100-0000 | |
| D-Glucose | Macron Fine Chemicals | 4912-12 | |
| Dihydrogen Sodium Phosphate | Thermo Fisher Scientific | BP329-500 | |
| DinoCam | Dino-Lite | AM73915MZTL | |
| Ethanol | Thermo Fisher Scientific | A407P-4 | |
| Forceps | Fine Science Tools | 11980-13 | |
| Hot plate | Thermo Fisher Scientific | SP88857200 | |
| Ice Machine | Hoshizaki | F801MWH | |
| Inflow and outflow needles | Jensen Global | JG 18-3.0X | |
| Inline Solution Heater | Warner Instruments | SH-27B | |
| Isofluorine | Dechra | 08PB-STE22002-0122 | |
| Kim Wipes | Thermo Fisher Scientific | 06-666 | |
| Magnesium Chloride | Thermo Fisher Scientific | FLM33500 | |
| Micropipets | Gilson | F144069 | |
| Mili-Q Water Filter | Mili-Q | ZR0Q008WW | |
| Paintbrush | Daler Rowney | AF85 Round: 0 | |
| Paper Filter | Whatman | EW-06648-24 | |
| Parafilm | American National Can | PM996 | |
| Perfusion System | Multi Channel System | PPS2 | |
| Pipetor | Thermo Fisher Scientific | FB14955202 | |
| Platinum Harp | 3Brain | 3Brain | |
| Potassium Chloride | Thermo Fisher Scientific | P330-3 | |
| Razor blade | Personna | BP9020 | |
| Scale | Metter Toledo | AB204 | |
| Scissors | Solingen | 92008 | |
| Slice Holding Chamber | Custom | Custom | Custom 3D Printer Design, available upon request |
| Sodium Bicarbonate | Macron Fine Chemicals | 7412-06 | |
| Sodium Chloride | Thermo Fisher Scientific | S271-3 | |
| Temperature Control Box | Warner Instruments | TC344B | |
| Transfer Pipettes | Genesee Scientific | 30-200 | |
| Tubing | Tygon | B-44-3 TPE | |
| Vibratome VZ-300 | Precissionary | VF-00-VM-NC | |
| Weigh Boat | Electron Microscopy Sciences | 70040 |
Referanslar
- Obien, M. E. J., Frey, U. Large-scale, high-resolution microelectrode arrays for interrogation of neurons and networks. Adv Neurobiol. 22, 83-123 (2019).
- Schroter, M., et al. Functional imaging of brain organoids using high-density microelectrode arrays. MRS Bull. 47 (6), 530-544 (2022).
- Miccoli, B., et al. High-density electrical recording and impedance imaging with a multi-modal CMOS multi-electrode array chip. Front Neurosci. 13, 641(2019).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471(2023).
- Ferrea, E., et al. high-resolution electrophysiological imaging of field potentials in brain slices with microelectronic multielectrode arrays. Front Neural Circuits. 6, 80(2012).
- Gagliano, G., et al. Non-linear frequency dependence of neurovascular coupling in the cerebellar cortex implies vasodilation-vasoconstriction competition. Cells. 11 (6), 1047(2022).
- Goodchild, S. J., et al. Molecular pharmacology of selective Na(V)1.6 and dual Na(V)1.6/Na(V)1.2 channel inhibitors that suppress excitatory neuronal activity ex vivo. ACS Chem Neurosci. 15 (6), 1169-1184 (2024).
- Hu, X., Khanzada, S., Klutsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834(2022).
- Kim, S., et al. Alteration of neural network and hippocampal slice activation through exosomes derived from 5XFAD nasal lavage fluid. Int J Mol Sci. 24 (18), 14064(2023).
- Mahadevan, A., Codadu, N. K., Parrish, R. R. Xenon LFP analysis platform is a novel graphical user interface for analysis of local field potential from large-scale MEA recordings. Front Neurosci. 16, 904931(2022).
- Medrihan, L., Ferrea, E., Greco, B., Baldelli, P., Benfenati, F. Asynchronous GABA release is a key determinant of tonic inhibition and controls neuronal excitability: A study in the synapsin II-/- mouse. Cereb Cortex. 25 (10), 3356-3368 (2015).
- Monteverdi, A., Di Domenico, D., D'Angelo, E., Mapelli, L. Anisotropy and frequency dependence of signal propagation in the cerebellar circuit revealed by high-density multielectrode array recordings. Biomedicines. 11 (5), 1475(2023).
- Obien, M. E. J., Hierlemann, A., Frey, U. Accurate signal-source localization in brain slices by means of high-density microelectrode arrays. Sci Rep. 9 (1), 788(2019).
- Thouta, S., et al. Pharmacological determination of the fractional block of Nav channels required to impair neuronal excitability and ex vivo seizures. Front Cell Neurosci. 16, 964691(2022).
- Tognolina, M., Monteverdi, A., D'Angelo, E. Discovering microcircuit secrets with multi-spot imaging and electrophysiological recordings: The example of cerebellar network dynamics. Front Cell Neurosci. 16, 805670(2022).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays. Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Maccione, A., et al. Experimental investigation on spontaneously active hippocampal cultures recorded by means of high-density MEAs: Analysis of the spatial resolution effects. Front Neuroeng. 3, 4(2010).
- van Vliet, E., et al. Electrophysiological recording of re-aggregating brain cell cultures on multi-electrode arrays to detect acute neurotoxic effects. Neurotoxicology. 28 (6), 1136-1146 (2007).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. Annu Int Conf IEEE Eng Med Biol Soc. 2022, 3111-3114 (2022).
- Veleanu, M., et al. Modified climbing fiber/Purkinje cell synaptic connectivity in the cerebellum of the neonatal phencyclidine model of schizophrenia. Proc Natl Acad Sci U S A. 119 (21), e2122544119(2022).
- Giansante, G., et al. Neuronal network activity and connectivity are impaired in a conditional knockout mouse model with PCDH19 mosaic expression. Mol Psychiatry. , (2023).
- Dossi, E., Blauwblomme, T., Nabbout, R., Huberfeld, G., Rouach, N. Multi-electrode array recordings of human epileptic postoperative cortical tissue. J Vis Exp. (92), e51870(2014).
- Hajos, N., et al. Maintaining network activity in submerged hippocampal slices: importance of oxygen supply. Eur J Neurosci. 29 (2), 319-327 (2009).
- Hill, M. R., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. J Neurosci Methods. 195 (1), 15-23 (2011).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE Translational Task Force of the ILAE. Epilepsia. 58 (Suppl 4), 40-52 (2017).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), 2056(2010).
- Lin, C. H., Lee, J. K., LaBarge, M. A. Fabrication and use of microenvironment microarrays (MEArrays). J Vis Exp. (68), 4152(2012).
- Panuccio, G., Colombi, I., Chiappalone, M. Recording and modulation of epileptiform activity in rodent brain slices coupled to microelectrode arrays. J Vis Exp. 135, 57548(2018).
- Patel, C., Muthuswamy, J. High efficiency, site-specific transfection of adherent cells with siRNA using microelectrode arrays (MEA). J Vis Exp. 67, e4415(2012).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Papouin, T., Haydon, P. G. Obtaining acute brain slices. Bio Protoc. 8 (2), e2699(2018).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. J Vis Exp. 132, 53825(2018).
- Van Hoeymissen, E., Philippaert, K., Vennekens, R., Vriens, J., Held, K. Horizontal hippocampal slices of the mouse brain. J Vis Exp. (163), 61753(2020).
- 3Brain. , Available from: https://www.3brain.com/ (2022).
- Bridges, D. C., Tovar, K. R., Wu, B., Hansma, P. K., Kosik, K. S. MEA Viewer: A high-performance interactive application for visualizing electrophysiological data. PLoS One. 13 (2), e0192477(2018).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc Natl Acad Sci U S A. 113 (27), 7337-7344 (2016).
- Maccione, A., et al. Microelectronics, bioinformatics and neurocomputation for massive neuronal recordings in brain circuits with large scale multielectrode array probes. Brain Res Bull. 119 (Pt B), 118-126 (2015).
- 3Brain. , BrainWave 4 https://www.3brain.com/products/software/brainwave4 (2022).
- Mahadevan, A. Xenon LFP Analysis. , https://xenon-lfp-analysis.readthedocs.io/en/latest/Installation.html (2022).
- Mahadevan, A. xenon-lfp-analysis github. , https://github.com/MicroBrew09/xenon-lfp-analysis (2022).
- Codadu, N. K., et al. Divergent paths to seizure-like events. Physiol Rep. 7 (19), e14226(2019).
- Kirsch, G. E., Drewe, J. A. Gating-dependent mechanism of 4-aminopyridine block in two related potassium channels. J Gen Physiol. 102 (5), 797-816 (1993).
- Levesque, M., Salami, P., Behr, C., Avoli, M. Temporal lobe epileptiform activity following systemic administration of 4-aminopyridine in rats. Epilepsia. 54 (4), 596-604 (2013).
- Myers, T. L., Gonzalez, O. C., Stein, J. B., Bazhenov, M. Characterizing concentration-dependent neural dynamics of 4-Aminopyridine-induced epileptiform activity. Epilepsy J. 4 (2), 128(2018).
- Perreault, P., Avoli, M. Physiology and pharmacology of epileptiform activity induced by 4-aminopyridine in rat hippocampal slices. J Neurophysiol. 65 (4), 771-785 (1991).
- Rutecki, P. A., Lebeda, F. J., Johnston, D. 4-Aminopyridine produces epileptiform activity in hippocampus and enhances synaptic excitation and inhibition. J Neurophysiol. 57 (6), 1911-1924 (1987).
- Chen, Y., Chad, J. E., Cannon, R. C., Wheal, H. V. Reduced Mg2+ blockade of synaptically activated N-methyl-D-aspartate receptor-channels in CA1 pyramidal neurons in kainic acid-lesioned rat hippocampus. Neuroscience. 88 (3), 727-739 (1999).
- Fujiwara-Tsukamoto, Y., Isomura, Y., Takada, M. Comparable GABAergic mechanisms of hippocampal seizure-like activity in posttetanic and low-Mg2+ conditions. J Neurophysiol. 95 (3), 2013-2019 (2006).
- Swartzwelder, H. S., Anderson, W. W., Wilson, W. A. Mechanism of electrographic seizure generation in the hippocampal slice in Mg2+-free medium: the role of GABAa inhibition. Epilepsy Res. 2 (4), 239-245 (1988).
- Trevelyan, A. J., Graham, R. T., Parrish, R. R., Codadu, N. K. Synergistic positive feedback mechanisms underlying seizure initiation. Epilepsy Curr. 23 (1), 38-43 (2023).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81 (1-2), 103-111 (1998).
- Hajos, N., Mody, I. Establishing a physiological environment for visualized in vitro brain slice recordings by increasing oxygen supply and modifying aCSF content. J Neurosci Methods. 183 (2), 107-113 (2009).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Andrew, R. D., et al. The critical role of spreading depolarizations in early brain injury: Consensus and contention. Neurocrit Care. 37 (Suppl 1), 83-101 (2022).
- Devonshire, I. M., Dommett, E. J., Grandy, T. H., Halliday, A. C., Greenfield, S. A. Environmental enrichment differentially modifies specific components of sensory-evoked activity in rat barrel cortex as revealed by simultaneous electrophysiological recordings and optical imaging in vivo. Neuroscience. 170 (2), 662-669 (2010).
- Parrish, R. R., Codadu, N. K., Mackenzie-Gray Scott, C., Trevelyan, A. J. Feedforward inhibition ahead of ictal wavefronts is provided by both parvalbumin- and somatostatin-expressing interneurons. J Physiol. 597 (8), 2297-2314 (2019).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Curr Opin Neurobiol. 50, 171-178 (2018).
- Yaksi, E., Jamali, A., Diaz Verdugo, C., Jurisch-Yaksi, N. Past, present and future of zebrafish in epilepsy research. FEBS J. 288 (24), 7243-7255 (2021).
- He, M. F., et al. Ex vivo calcium imaging for drosophila model of epilepsy. J Vis Exp. 200, 65825(2023).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Commun Biol. 4 (1), 136(2021).
- Parrish, R. R., Grady, J., Codadu, N. K., Trevelyan, A. J., Racca, C. Simultaneous profiling of activity patterns in multiple neuronal subclasses. J Neurosci Methods. 303, 16-29 (2018).
- Valderhaug, V. D., et al. Criticality as a measure of developing proteinopathy in engineered human neural networks. bioRxiv. , (2020).
- Multi-electrode array (MEASs) to investigate pathogenetic disease mechanisms and pharmacological properties in iPSC-derived neurons modelling neuropsychiatric diseases. Carleo, G., Lee, Y. -S., Secondo, A., Miceli, F., Taglialatela, M. 2022 IEEE International Conference on Metrology for Extended Reality, Artificial Intelligence and Neural Engineering (MetroXRAINE), , Rome, Italy. 667-672 (2022).
- Ruz, I. D., Schultz, S. R. Localising and classifying neurons from high density MEA recordings. J Neurosci Methods. 233, 115-128 (2014).
- Franke, F., Natora, M., Boucsein, C., Munk, M. H. J., Obermayer, K. An online spike detection and spike classification algorithm capable of instantaneous resolution of overlapping spikes. J Comput Neurosci. 29 (1-2), 127-148 (2010).
- Vollgraf, R., Obermayer, K. Improved optimal linear filters for the discrimination of multichannel waveform templates for spike-sorting applications. IEEE Signal Processing Letters. 13 (3), 121-124 (2006).
- Muller, J., et al. High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels. Lab Chip. 15 (13), 2767-2780 (2015).
- Mapelli, L., et al. implementation, and functional validation of a new generation of microneedle 3D high-density CMOS multi-electrode array for brain tissue and spheroids. bioRxiv. , (2022).
- Reddy, D. S., Kuruba, R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci. 14 (9), 18284-18318 (2013).
- Parrish, R. R., Trevelyan, A. J. Stress-testing the brain to understand its breaking points. J Physiol. 596 (11), 2033-2034 (2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır