Method Article
التنشيط البصري الوراثي للخلايا العصبية اللاإرادية القلبية الجوهرية في قلوب الفئران المستعصية
In This Article
Summary
يوضح هذا البروتوكول طريقة للتحفيز البصري الوراثي للخلايا العصبية القلبية الجوهرية في قلوب الفئران المعدلة وراثيا. يستخدم النهج الموصوف للتحقيق في حركية التنشيط المفاجئ للخلايا العصبية القلبية في القلوب خارج الجسم الحي والتفاعلات بين النشاط الكوليني والكاتيكولامينرجيك.
Abstract
يعد التوازن بين التنشيط الكوليني والكاتيكولامين ضروريا للحفاظ على صحة القلب. يمكن استجواب التفاعل بين هذه المسارات باستخدام علم البصريات الوراثي من خلال التعبير الانتقائي عن channelrhodopsin-2 (ChR2) في الخلايا العصبية اللاإرادية للقلب. تسمح هذه التطبيقات القلبية لعلم البصريات الوراثي بدراسة الإطلاق الجوهري للناقلات العصبية بطريقة زمانية مكانية. توضح هذه الطريقة نهجا خارج الجسم الحي للتحفيز البصري الوراثي المحدد للخلايا العصبية القلبية في قلوب الفئران المنفخة. تم تربية الفئران المعدلة وراثيا للتعبير عن ChR2 في الخلايا العصبية أسيتيل ترانسفيراز الكولين (ChAT) أو هيدروكسيلاز التيروزين (TH) في جميع أنحاء الجسم. تم تحضير مصباح LED صغير (465 نانومتر) مغطى بمطاط مراط سيليكون لتحفيز الخلايا العصبية في الأذين الأيمن التي تغذي العقدة الجيبية الأذينية. تم توصيل micro-LED بمولد وظيفي تم ضبطه على نبض الموجات عند 10 هرتز بعرض نبضة 30 مللي ثانية. تم استئصال القلوب ذات التعبير المؤكد وتحريكها إلى الوراء على نظام Langendorff الذي يدور محلول Krebs-Henseleit. تم تسجيل مخطط كهربية القلب (ECG) ودرجة الحرارة ومعدل التدفق التاجي باستخدام برنامج LabChart. بمجرد استقرار القلب ، تم وضع micro-LED على الأذين الأيمن واختباره للاستجابة المثلى لمعدل ضربات القلب. يجمع تطبيق هذا النهج بين الإطلاق الجوهري للناقل العصبي الكولين (أستيل كولين) أثناء التنشيط البصري الوراثي لقلب الفأر ChAT-ChR2 في وقت واحد مع زيادة الناقل العصبي الكاثيكولامينرجي الخارجي (النورادرينالين) المضاف إلى البرفيهيوم. يتم تقديم التغيرات الناتجة في معدل ضربات القلب أثناء التنشيط المتزامن للكولين والكاتيكولامينرجيك. تصف هذه الطريقة نهجا تجريبيا قيما للتحقيق في حركية تنشيط الخلايا العصبية اللاإرادية الجوهرية المفاجئة في القلوب المنفخة والتفاعلات بين نشاط الكولين القلبي والكاتيكولامينرجيك.
Introduction
علم البصريات الوراثي هو طريقة لإدخال البروتينات الحساسة للضوء (opsins) في مجموعات الخلايا المستهدفة. يتيح ذلك التعديل الزماني المكاني لخلايا وأنسجة معينة لا يمكن تحقيقها باستخدام الوسائل الكهربائية أوالكيميائية 1. أصبحت التطبيقات القلبية لعلم البصريات الوراثي شائعة بشكل متزايد على مدار ال 15 عاما الماضية2. يؤدي التحفيز الضوئي للأوبسينات المثيرة مثل channelrhodopsin-2 (ChR2) ، وهو كاتيون ، في الخلايا العضلية القلبية أو الخلايا العصبية إلى إزالة الاستقطاب الخلوي ، مما يتسبب في تغيرات في إيقاع القلب3. هناك طريقتان للتعبير بشكل انتقائي عن opsins في مجموعات الخلايا باستخدام نهج Cre-lox: التنبيغ الفيروسي4 والتهجين للحيوانات المعدلة وراثيا5. يمكن تحقيق التعبير الانتقائي عن ChR2 في الخلايا العصبية اللاإرادية المحددة عن طريق التهجين لإنشاء ذرية تعبر عن ChR2 إما في الخلايا العصبية الكولينية أو الكاثيكولامينية باستخدام محفزات خاصةبالخلايا 6. يمكن تزاوج أحد الوالدين الذي لديه جين ChR2 floxed مع أحد الوالدين الذي يعبر عن Cre recombinase تحت سيطرة محفز مثل هيدروكسيلاز التيروزين (TH ، الخلايا العصبية الكاتيكولامينيرجية) أو أسيتيل ترانسفيراز الكولين (ChAT ، الخلايا العصبية الكولبينية). ثم يعبر النسل عن ChR2 في الخلايا العصبية TH أو ChAT في جميع أنحاء الجسم7.
يمكن التحقيق في الاستجابة الوظيفية للقلب للتنشيط الحاد للخلايا العصبية اللاإرادية باستخدام التعبير الذي يحركه المروج عن ChR2 داخل مجموعات عصبية معينة ، على سبيل المثال الخلايا العصبية الكولينية أو الكاتيكولامينية. يمكن أن تختلف الفاصل الزمني لنبض التحفيز الضوئي وشدة للتحكم في معدل إزالة الاستقطاب لتلك الخلايا العصبية التي تعبر عن ChR2 لدراسة كيفية تعديل مستويات التنشيط العصبي لوظيفة القلب8. بالنسبة لهذه الطريقة ، سيتم استخدام الخلايا العصبية للإشارة إلى أي أجسام خلوية و / أو محاور و / أو إسقاطات محورية يتم تنشيطها بصريا من أجل البساطة. من الممكن أيضا الجمع بين التحفيز الضوئي والتنشيط الكيميائي عن طريق إدخال الأدوية أو الناقلات العصبية لاستجواب التأثيرات المتزامنة على نظم القلب والانقباض9. على سبيل المثال ، يمكن دمج التحفيز الشريطي البصري الوراثي مع حقن النورادرينالين الخارجي (NE) لفحص تأثير التنشيط اللاإرادي المتزامن في القلب. يتميز إجراء مثل هذه الدراسات باستخدام قلوب معزولة منفوخة بميزة توفير منصة تجريبية يتم التحكم فيها جيدا لدراسة التغييرات الوظيفية الناتجة عن التنشيط الضوئي10. يمكن مراقبة التغييرات في مورفولوجيا تخطيط القلب ومعدل ضربات القلب ومعدل التدفق التاجي بينما يتم التحكم بإحكام في درجة الحرارة والأكسجين وضغط التروية.
الهدف من هذا البروتوكول هو تقديم نهج تجريبي لتنشيط مجموعة معينة من الخلايا العصبية اللاإرادية في قلوب الفئران لدراسة التغيرات في معدل ضربات القلب. كما يتم تقديم بناء واستخدام جهاز micro-LED للتنشيط البصري الوراثي في القلوب المنفعة. تم استئصال قلوب الفئران التي تعبر عن ChR2 في الخلايا العصبية الكولينية أو الكاتيكولامينرجية وتحريكها إلى الوراء بمحلول Krebs-Henseleit المؤكسج عند ضغط ثابت. ChR2 تم التعبير عنها في الخلايا العصبية في الأذين الأيمن (RA) بمعدل نبض 10 هرتز مع عرض نبضة 30 مللي ثانية. تم حساب معدل ضربات القلب اللحظي باستخدام فاصل RR ومراقبة التغيرات أثناء التحفيز الضوئي. كما تم وصف مثال على تجربة لدراسة حركية معدل ضربات القلب أثناء التحفيز الضوئي للخلايا العصبية ChAT البصرية الجوهرية في وقت واحد مع تنشيط بيتا الأدرينالية باستخدام النورادرينالين الخارجية.
Protocol
تمت الموافقة على جميع بروتوكولات من قبل لجنة رعاية واستخدامه بجامعة جورج واشنطن واتبعت دليل المعهد الوطني للصحة لرعاية واستخدام المختبر.
1. بناء مصدر ضوء Micro-LED
- تحت مجهر تشريح في منطقة جيدة التهوية ، قم بلحام الأطراف المجردة من سلكين نحاسيين معزولين ، بطول 20 سم على الأقل ، إلى نقاط التلامس الخاصة ب 465 نانومتر micro-LED (الشكل 1). اختبر اللحام عن طريق توصيل LED بمصدر طاقة وتشغيله.
- قم بقص الجزء السفلي 1 سم من طرف ماصة مفلترة سعة 200 ميكرولتر. ادفع الفلتر للخارج باستخدام قضيب صغير القطر. أدخل مؤشر LED الصغير بأسلاك في طرف الماصة بحيث يكون مؤشر LED متدفقا مع نهاية الطرف. استبدل الفلتر الموجود أعلى طرف الماصة لتثبيت مؤشر LED والأسلاك في مكانها، ثم قم بلصق حواف مؤشر LED بطرف الماصة. دع الغراء الفائق يجف.
- تحضير المطاط الصناعي السيليكوني عن طريق الجمع بين القاعدة وعامل المعالجة بنسبة 10: 1 واخلطهم جيدا. قم بإزالة أي فقاعات من الخليط باستخدام غرفة مفرغة أو عن طريق الطرد المركزي.
- خذ أنبوب طرد مركزي سعة 0.5 مل وقم بتسجيل الجوانب لتسهيل إزالة LED (يمكن أيضا إضافة مواد التشحيم إلى داخل الأنبوب هنا إذا رغبت في ذلك). قم بلصق الجزء الخارجي من الأنبوب لضمان عدم حدوث تسرب. صب ما يقرب من 0.2 مل من خليط المطاط الصناعي من السيليكون في الأنبوب ثم ضع طرف ماصة micro-LED في الأنبوب، مع ترك مسافة لا تقل عن 1 مم بين مؤشر LED وأسفل الأنبوب. إذا تشكلت الفقاعات ، فاضغط على أنبوب الطرد المركزي على سطح صلب لإخراجها.
ملاحظة: يمكن طلاء طرف الماصة بشكل استباقي بالمطاط الصناعي السيليكوني لتقليل تكوين الفقاعات عند وضع مؤشر LED. - ضع أنبوب الطرد المركزي micro-LED في وضع مستقيم في فرن أو حاضنة مختبر 50 درجة مئوية واتركه لمدة 8 ساعات على الأقل أو طوال الليل. ارتد قفازات مقاومة للحرارة عند التفاعل مع الفرن. بمجرد تقوية المطاط الصناعي ، قم بإزالة LED من أنبوب الطرد المركزي. إذا كان المطاط الصناعي لا يزال لزجا ، ضعه في الفرن مرة أخرى.
- بمجرد الشفاء التام ، قم بإزالة أي مطاط صناعي زائد من طرف LED بسكين أداة مساعدة دقيقة ، مع ترك ما لا يزيد عن 1 مم. سيؤدي التغليف المناسب لمصباح LED إلى تقليل تسخين الأنسجة أثناء التحفيز الضوئي.
- حدد الطاقة الضوئية لمصباح LED باستخدام مقياس الطاقة البصرية. قم بتشغيل عداد الطاقة واضبط إعدادات الطول الموجي لقراءة 465 نانومتر. ضع مؤشر LED في خط مع مستشعر طاقة الصمام الثنائي الضوئي وقم بتشغيل مؤشر LED باستخدام مولد الوظائف. سينتج عداد الطاقة الضوئية قراءة بالواط. احسب الإشعاع بقسمة قراءة الطاقة على مساحة السطح المضيء (0.88 مم2).
ملاحظة: يجب أن يكون الإشعاع المثالي حوالي 2.4 ميجاوات/مم2 للتنشيط المناسب للفصل 211.
2. التحضير التجريبي
- قم بتربية الفئران وفقا للمنشور السابق للتعبير عن ChR2 إما في الخلايا العصبية الكولينية (ChAT-ChR2) أو الخلايا العصبية الكاتينية (TH-ChR2) 12 (الشكل 2). تأكيد التعبير عن TH-Cre أو ChAT-Cre في الفئران المستخدمة في التجارب باستخدام نهج التنميط الجيني كما هو موضحسابقا 12.
- قم بإعداد ما لا يقل عن 225 مل من محلول Krebs-Henseleit (KH) (بالملليمتر: 118 كلوريد الصوديوم ، 4.7 كيلو كلوريد ، 1.25 كلوريدالمتسلسل 2 ، 0.57 مجم4 ، 25 NaHCO3 ، 1.17 KH2PO4 ، 6 جلوكوز) والتصفية باستخدام مرشح غشاء نترات السليلوز 0.2 ميكرومتر. اضبط درجة الحموضة على 7.4 عند الأكسجين باستخدام 95٪ O2 و 5٪ CO2.
- اشطف نظام نضح لانجندورف بالماء النقي قبل التجربة وقم بإزالة أي ماء زائد قبل بدء التجربة.
- أضف مرشحا غشائيا 10 ميكرومتر إلى النظام قبل تدوير أي كيلوهيدروجين في الساعة. قم بتشغيل الحمامات المائية المضبوطة للحفاظ على درجة حرارة التعقيم عند 37 درجة مئوية بمعدلات تدفق تتراوح بين 2-5 مل / دقيقة.
- أضف 175 مل من KH إلى نظام التروية وابدأ الدورة الدموية. قم بفقاعة المحلول بنسبة 95٪ O2 / 5٪ CO2 لتوفير الأكسجين الكافي.
ملاحظة: يختلف حجم تداول KH من نظام إلى آخر اعتمادا على أحجام الأنابيب والخزانات. - قم بمعايرة مقياس التدفق عن طريق إيقاف التدفق عبر نظام التروية باستخدام محبس والضغط على زر الصفر في مقياس التدفق.
- قم بإعداد برنامج للحصول على البيانات الفسيولوجية مثل LabChart ليحتوي على 12 قناة: درجة حرارة حمام القلب ، ودرجة حرارة تعقيم الأبهر ، ويؤدي تخطيط القلب من I-III بالإضافة إلى أربعة خيوط محسوبة إضافية ، وحساب معدل ضربات القلب ، ومعدل التدفق ، وإخراج مولد الوظيفة لتتبع نبضات LED.
- باستخدام القناة المخصصة لمعدل ضربات القلب ، احسب معدل ضربات القلب في LabChart مع تعيين ميزة القياسات الدورية لاكتشاف مخطط كهربية القلب للماوس على الرصاص I. يستخدم امتداد محور القلب في LabChart الرصاص الأول والرصاص الثاني لحساب الرصاص III و aVR و aVL و aVF.
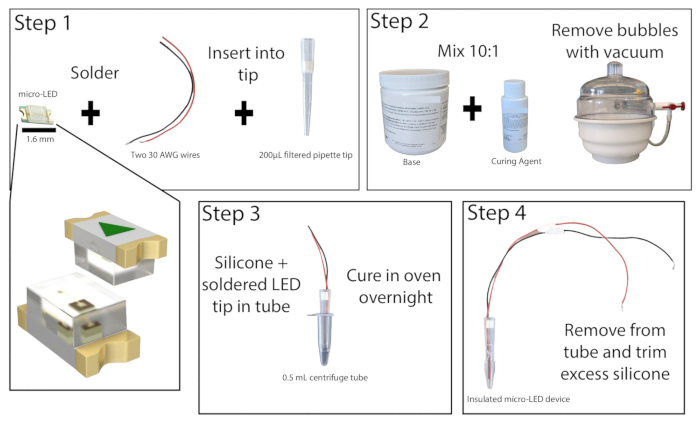
الشكل 1: بناء Micro-LED. نظرة عامة مبسطة على خطوات إنشاء مصدر ضوء micro-LED. يتم لحام سلكين بمصباح LED الصغير وإدخاله في طرف ماصة سعة 200 ميكرولتر، ثم يتم لصقهما بشكل فائق (الخطوة 1). يتم خلط مطاط السيليكون بنسبة 10: 1 ويوضع في غرفة مفرغة لإزالة الفقاعات (الخطوة 2). يسكب المطاط الصناعي السيليكوني في أنبوب طرد مركزي دقيق ، ويتم إدخال طرف ماصة micro-LED والسماح له بالمعالجة طوال الليل (الخطوة 3). ثم تتم إزالة micro-LED المعزول من الأنبوب ، ويجب قص السيليكون الزائد (الخطوة 4). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
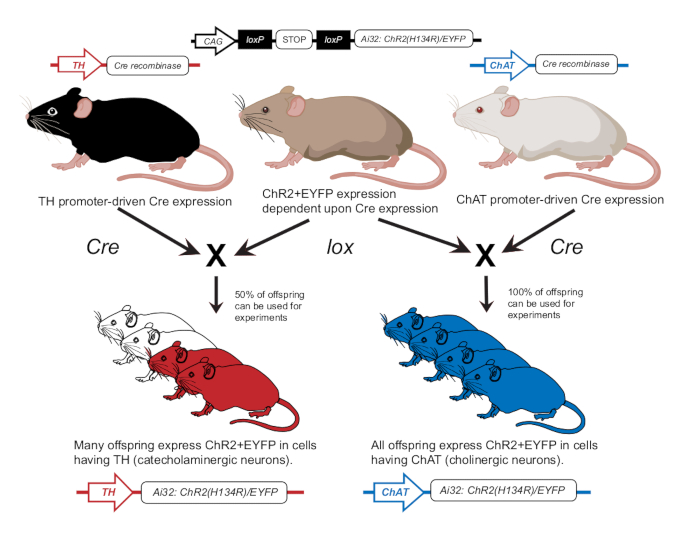
الشكل 2: مخطط تربية الفئران المعدلة وراثيا. يتم تهجين الفأر الأم الذي يحتوي على جين ChR2 المعتمد على lox مع فأر آخر مع مروج Cre. ينتج الفأر الأم الذي يحتوي على محفز هيدروكسيلاز التيروزين (TH) Cre ذرية متغايرة الزيجوت حيث يعبر 50٪ عن ChR2 في خلايا الكاتيكولامين. الفأر الأم مع الكولين أسيتيل ترانسفيراز (ChAT) Cre سوف ينتج ذرية متماثلة اللواقح حيث 100٪ سوف تعبر عن ChR2 في الخلايا اتروبين. يتم تأكيد التعبير عن طريق التنميط الجيني. تم تعديل هذا الرقم بإذن من12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. استئصال القلب والتروية
- قبل الاستئصال ، يتم تطبيق 250 وحدة من الهيبارين (حوالي 8 وحدة / جم) عن طريق الحقن داخل الصفاق باستخدام حقنة 1 مل. انتظر 10 دقائق على الأقل قبل الجراحة.
- ضع فأرا بالغا في غرفة تحريض التخدير. قم بإدارة ~ 4٪ إيزوفلوران وانتظر حتى يتباطأ معدل التنفس ويتعمق أخرج الماوس من الغرفة وتحقق من توقف منعكس الألم عن طريق قرصة إصبع القدم قبل إجراء خلع عنق الرحم.
- امسك عملية الخنجري بزوج من الملقط واقطع في تجويف البطن باستخدام مقص جراحي. افتح التجويف الصدري عن طريق قطع الحجاب الحاجز بعناية. قطع الضلوع لكشف القلب والرئتين. أمسك الرئتين برفق واستئصال القلب والرئتين.
- ضع القلب في طبق من KH الهيبارين. قم بإزالة الرئتين وأي قطع كبيرة من الدهون. ضع القلب النظيففي طبق 2 من KH الهيباريني تحت مجهر تشريح مضبوطة على تكبير 2x. حدد موقع الشريان الأورطي وحركه فوق القنية باستخدام ملقط دقيق. قم بتأمين القلب في قنية باستخدام خياطة حريرية 4-0.
ملاحظة: يمكن إجراء القنية على الجليد لتقليل النشاط الأيضي للقلب. - اغسل حقنة بلعة من KH الهيباريني من خلال القنية لإزالة الدم من الشريان التاجي قبل وضعه على نظام التروية.
- قم بتوصيل القلب المقنن بنظام التروية وضعه في طبق PDMS المليء بالقرعة. ضع أقطاب إبرة تخطيط القلب في طبق PDMS وفقا لمثلث أينثوفن13. تأقلم القلب لمدة 5 دقائق على الأقل.
- قم بتدوير القلب بحيث يمكن الوصول إلى الأذين الأيسر وقم بقطع ثقب ~ 1 مم في الأذين الأيسر باستخدام مقص صغير ذاتي الفتح. أدخل أنبوبا قطره 1 مم من خلال هذه الشريحة في البطين الأيسر لتحرير الانحياج المحاصر هناك.
ملاحظة: قد يؤدي وجود مجهر تشريح لفحص القلب إلى تحسين سهولة هذه الخطوة. - قم بتدوير القلب بحيث يكون التهاب المفاصل الروماتويدي متجها لأعلى ، ويمكن الوصول إلى العقدة الجيبية الأذينية (SA) للإضاءة (الشكل 3).
- اضبط أقطاب تخطيط القلب حسب الحاجة عن طريق تحريك الأقطاب الكهربائية بالقرب من القلب أو غمرها في التعجيد لاستقبال الإشارات بنسبة إشارة إلى ضوضاء مناسبة. قد تختلف الإعدادات بناء على أجهزة وبرامج الحصول على ECG المستخدمة. استخدمت هذه الطريقة وحدة Einthoven Goldberger مع كسب 2000 ومرشح قطع 500 هرتز ، وتضمنت إعدادات البرنامج مرشح التيار الكهربائي وتردد أخذ العينات 1000 هرتز.
4. التنشيط البصري الوراثي
- قم بتوصيل جهاز micro-LED بمجموعة مولدات وظائف لإنتاج موجات نبضية عند المعلمات التالية: تردد 10 هرتز ، عرض نبضة 30 مللي ثانية ، سعة10 فولت pp.
- ضع micro-LED برفق على عقدة SA. تجنب الضغط بشدة باستخدام micro-LED لأنه قد يؤدي إلى انخفاض معدل ضربات القلب ووظيفته.
- قم بتشغيل مولد الوظائف وقياس التغيرات في معدل ضربات القلب من التحفيز الضوئي. تشير التغيرات الفورية في معدل ضربات القلب إلى التنشيط الفعال. يتسبب التنشيط الكاتيكولامينرجي في ارتفاع هائل في معدل ضربات القلب10 ، بينما يؤدي التنشيط الكوليني إلى انخفاض فوري8.
- قم بإيقاف تشغيل مولد الوظائف. اسمح لمعدل ضربات القلب بالعودة إلى مستويات ما قبل التنشيط.
- إذا أدى التنشيط البصري الوراثي إلى تغيير معدل ضربات القلب أقل من 100 نبضة في الدقيقة ، فقم بتغيير موضع micro-LED لإضاءة الخلايا العصبية في التهاب المفاصل الروماتويدي بشكل أفضل. كرر حسب الضرورة.
5. الإجراء التجريبي وتحليل البيانات
- لاختبار الفرضية القائلة بأن التحفيز الشريطي البصري الجوهري يمكن أن يثبط التنشيط الخارجي للبيتا الأدرينالية بواسطة النورادرينالين (NE) ، قم بإعداد 10 ميكرومتر و 100 ميكرومتر من محاليل مخزون NE في طعام الدخان.
- أضف جرعة بلعة من NE إلى نظام التروية بواسطة منفذ الحقن. بمجرد زيادة معدل ضربات القلب ، قم بتشغيل micro-LED لمدة ~ 10 ثوان. أطفئ الضوء وراقب التغيرات في معدل ضربات القلب.
- بعد عودة معدل ضربات القلب إلى إيقاع الجيوب الأنفية ، قم بزيادة جرعة NE وكرر التحفيز البصري الوراثي. استمر في تناول كل جرعة من NE.
- في نهاية الدراسة ، قم بإيقاف تشغيل إمدادات الغاز ، وإزالة القلب من النظام ، واحتفظ به في المثبت ، حسب الضرورة.
- اشطف خزانات وأنابيب نظام التروية بماء DI أو منظف حسب الحاجة. جفف النظام جيدا لمنع العفن.
- احفظ ملف LabChart. تصدير إشارة معدل ضربات القلب وقنوات تخطيط القلب للتحليل والعرض الرسومي دون اتصال بالإنترنت.
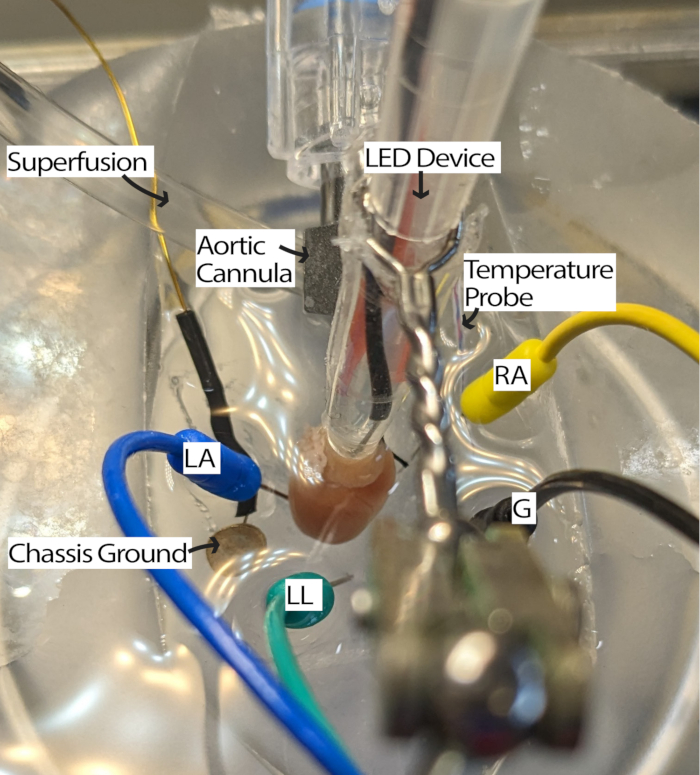
الشكل 3: تكوين حمام قلب الفأر. قلب فأر مقنن يظهر وضع جهاز LED وأقطاب كهربائية لتخطيط القلب. يوجد أرض للهيكل لتقليل الضوضاء من الإلكترونيات المحيطة. يتم وضع أقطاب إبرة تخطيط القلب على أساس مثلث أينثوفن. الاختصارات: LA = الذراع اليسرى. RA = الذراع الأيمن. LL = الساق اليسرى ؛ ز = أرض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يجب أن يكون نظام التروية بالضغط الثابت Langendorff (الشكل 4) قادرا على الحفاظ على معدلات ضربات قلب الفئران التي لا تقل عن 300 نبضة في الدقيقة لأكثر من ساعة إذا تم الحفاظ على الأكسجين المناسب ودرجة الحرارة والتدفق التاجي. مع هذا الإعداد ، تعتمد درجة حرارة انحطار الأبهر على التدفق التاجي ، لذلك قد تحتاج درجات حرارة حمام الماء إلى التعديل مع تغير معدل التدفق للحفاظ على درجة حرارة الأبهر عند 37 درجة مئوية. تتراوح معدلات التدفق التاجي لقلب الفأر عادة من 1.5-4.5 مل / دقيقة ، اعتمادا على حجم القلب. يعد الحفاظ على درجة حرارة الانحيم عند 37 درجة مئوية أثناء تقلبات معدل التدفق أمرا ضروريا لوظيفة القلب المتسقة وهو مهم بشكل خاص للتروية بالضغط المستمر. تم تصميم نظام التروية الموصوف للحفاظ على ضغط هيدروستاتيكي يبلغ 70 مم زئبق من خلال ارتفاع عمود التنشط. يتم تحقيق ذلك من خلال معدل المضخة الذي يوفر فيضانا ثابتا من الخزان العلوي. يمكن استكمال الإنفوز ب 20 ميكرومتر من موسع الأوعية الدموية كروماكالين لتحسين والحفاظ على التدفق الطبيعي أو فوق الطبيعي للشريان التاجي لضمان أكسجة عضلة القلبالكاملة 14.
يجب أن يؤدي التحفيز الضوئي للخلايا العصبية الكولينية في قلوب الفئران ChAT-ChR2 عند عرض النبضة 10 هرتز و 30 مللي ثانية إلى انخفاض فوري تقريبا في معدل ضربات القلب. يجب أن يؤدي التحفيز الضوئي الفعال للخلايا العصبية الكولينية في القلوب المغذية بشكل كاف إلى انخفاض معدل ضربات القلب بما لا يقل عن 100 نبضة في الدقيقة. يوضح الشكل 5 انخفاضا فوريا قدره 75 نبضة في الدقيقة عند تشغيل مؤشر LED الصغير الذي يستمر في الانخفاض حتى يصل إلى الحد الأقصى للانخفاض يبلغ 135 نبضة في الدقيقة. في غضون نصف ثانية من إيقاف تشغيل micro-LED ، يرتفع معدل ضربات القلب إلى 175 نبضة في الدقيقة قبل العودة تدريجيا إلى مستويات ما قبل التحفيز. يتم تقديم مخطط كهربية القلب بستة خيوط لتوضيح الاختلافات في الفاصل الزمني للRR قبل وأثناء وبعد التحفيز (الشكل 5 ب). يتم حساب العملاء المتوقعين aVR و aVL و aVF في برنامج LabChart باستخدام العملاء المحتملين الأول والثاني.
يؤدي التحفيز الضوئي للخلايا العصبية الكاتيكولامينرجية في قلوب الفئران TH-ChR2 إلى تغيير تدريجي (أسي) في معدل ضربات القلب مقارنة بالتحفيز الضوئي للخلايا العصبية الكولبينية. من المحتمل أن يكون هذا ناتجا عن تنشيط beta1-adrenergic الذي يتطلب نظام المراسلة الثاني من cAMP الذي ينشط PKA ، والذي يفسفرة البروتينات المستهدفة ، في حين أن التنشيط المسكاريني لا يفعل ذلك. يوضح الشكل 6 زيادة معدل ضربات القلب بمقدار 135 نبضة في الدقيقة على مدار 10 ثوان. هناك حاجة إلى 10 ثوان إضافية بعد إطفاء الضوء للعودة إلى إيقاع الجيوب الأنفية الطبيعي. إذا لم يتم عزل micro-LED بشكل صحيح ، فقد يسخن القلب ، مما يتسبب في زيادة معدل ضربات القلب. استجابة التسخين هذه أقل كثافة من تحفيز TH-ChR2. لذلك ، فإن التغيير في معدل ضربات القلب أقل وضوحا.
يتمثل أحد تطبيقات هذا البروتوكول في استخدام التحفيز البصري الوراثي لإزالة استقطاب الخلايا العصبية ، مما يؤدي إلى إطلاق الناقلات العصبية الداخلية مع إضافة ناقلات عصبية خارجية إلى الريفوزات في نفس الوقت. يوضح الشكل 7 أ إطلاق الأسيتيل كولين الذاتي من قلب فأر ChAT-ChR2 مع جرعة بلعة من NE مضافة إلى الريفوزات. بدون وجود NE ، تسبب التحفيز الضوئي في انخفاض معدل ضربات القلب بأكثر من 100 نبضة في الدقيقة وحافظ على هذا الانخفاض طوال مدة التحفيز. بينما مع جرعة كبيرة من NE (2000 نانومتر) ، كان الحد الأقصى لانخفاض معدل ضربات القلب أثناء التحفيز الضوئي 40 نبضة في الدقيقة. بدأ معدل ضربات القلب في الارتفاع على الفور ، ووصل تقريبا إلى مستويات ما قبل التحفيز قبل إطفاء الضوء. تشير هذه النتيجة إلى أن قمع البصريات الوراثية لمعدل ضربات القلب عن طريق التحفيز الضوئي للخلايا العصبية ChAT لم يكن قادرا على قمع الزيادات في معدل ضربات القلب الناتجة عن جرعة عالية من NE ، مما تسبب في وقت أقصر من تثبيط معدل ضربات القلب وانخفاض معدل ضربات القلب (الشكل 7 ب). تتوافق هذه النتائج مع العمل السابق في الكبيرة التي أظهرت كتلة العقدة البطينية البطينية التدريجية أثناء تحفيز العصب المبهم المتزامن والعقد النجمية12،13.
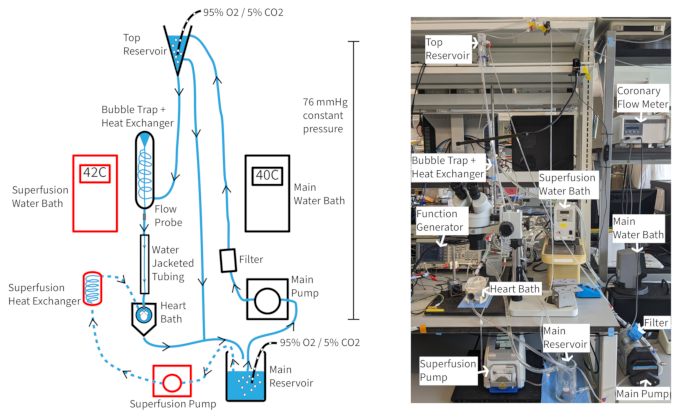
الشكل 4: الإعداد التجريبي. رسم تخطيطي لنظام التروية. تظهر الأسهم اتجاه الإنشاء. يشار إلى انحيم الصخ الفائق بخطوط متقطعة والمكونات محددة باللون الأحمر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
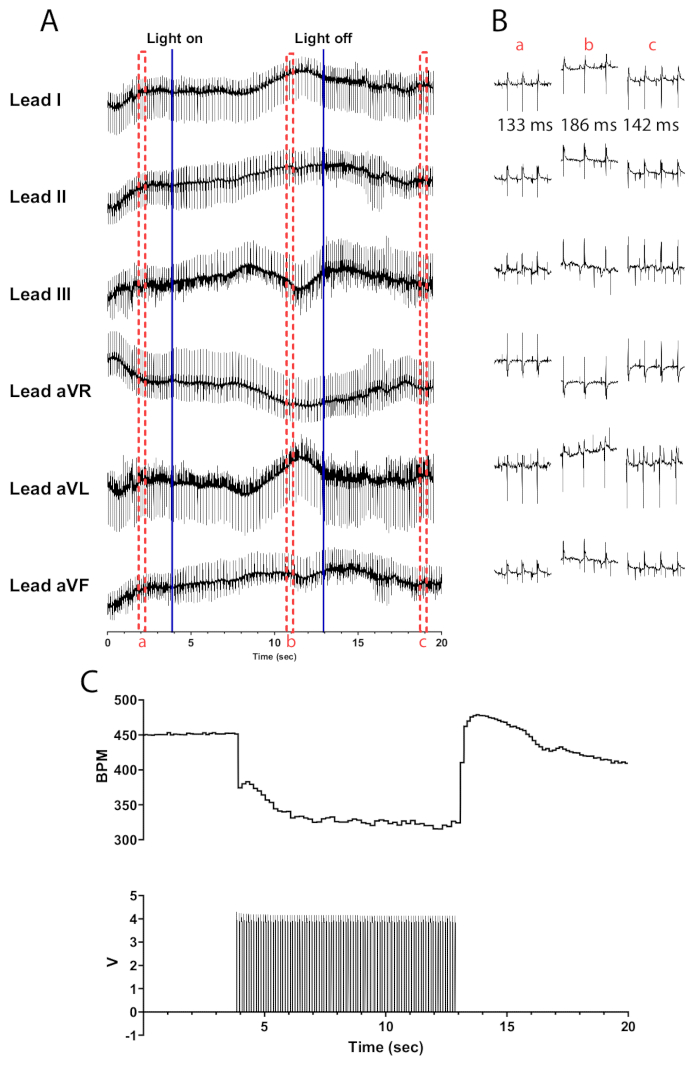
الشكل 5: استجابة التحفيز الضوئي الكولينية التمثيلية. (أ) مخطط كهربية القلب 6 رصاص أثناء التنشيط البصري الوراثي ChAT-ChR2. تشير الخطوط الزرقاء الصلبة إلى تشغيل / إيقاف تشغيل micro-LED. تشير المربعات المتقطعة الحمراء إلى وقت المقتطفات (B). (ب) مقتطفات نصف ثانية من إشارة مخطط كهربية القلب قبل (أ) وأثناءها (ب) وبعد التحفيز الضوئي (ج). يظهر الفاصل الزمني RR لكل قسم. (ج) يظهر معدل ضربات القلب (أعلى) جنبا إلى جنب مع موجات النبض من مولد دالة (أسفل). يبدأ معدل ضربات القلب من 450 نبضة في الدقيقة وينخفض إلى 315 نبضة في الدقيقة بعد 8 ثوان من التحفيز الضوئي قبل أن يعود إلى 410 نبضة في الدقيقة بعد 7 ثوان من انتهاء التحفيز الضوئي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
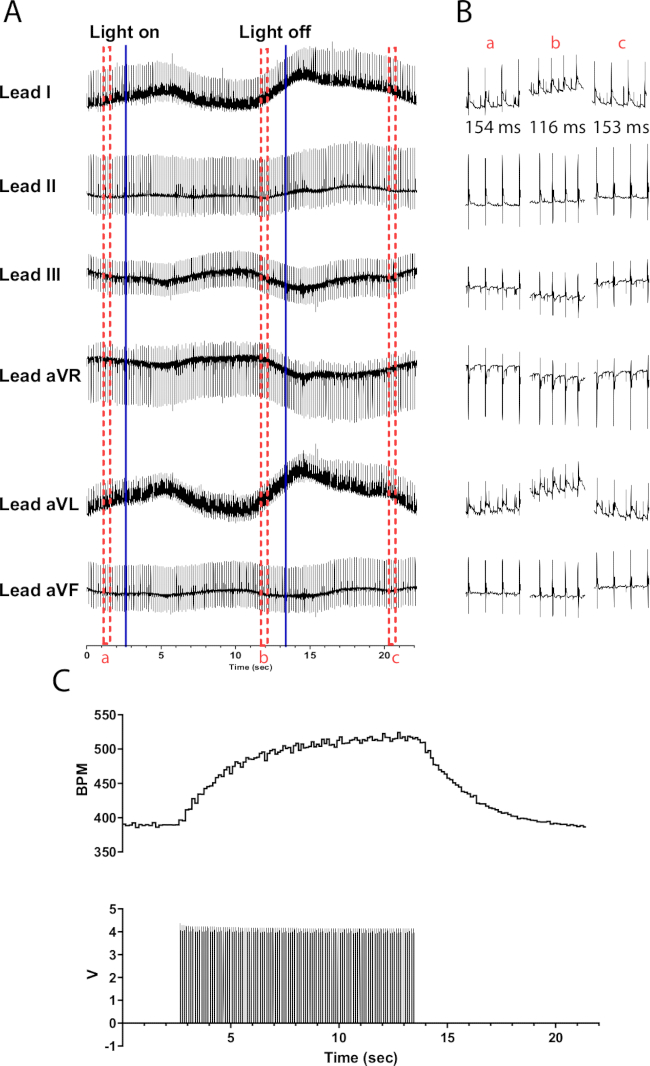
الشكل 6: استجابة التحفيز الضوئي التمثيلية الكاتيكولامينرجية. (أ) مخطط كهربية القلب 6 رصاص أثناء التنشيط البصري الوراثي TH-ChR2. تشير الخطوط الزرقاء الصلبة إلى تشغيل / إيقاف تشغيل micro-LED. تشير المربعات المتقطعة الحمراء إلى وقت المقتطفات (B). (ب) مقتطفات نصف ثانية من إشارة مخطط كهربية القلب قبل (أ) وأثناءها (ب) وبعد التحفيز الضوئي (ج). يظهر الفاصل الزمني RR لكل قسم. (ج) يظهر معدل ضربات القلب (أعلى) جنبا إلى جنب مع موجات النبض من مولد دالة (أسفل). يبدأ معدل ضربات القلب من 390 نبضة في الدقيقة ويصل إلى 525 نبضة في الدقيقة بعد 10 ثوان من التحفيز الضوئي قبل أن يعود إلى 390 نبضة في الدقيقة بعد 8 ثوان من انتهاء التحفيز الضوئي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
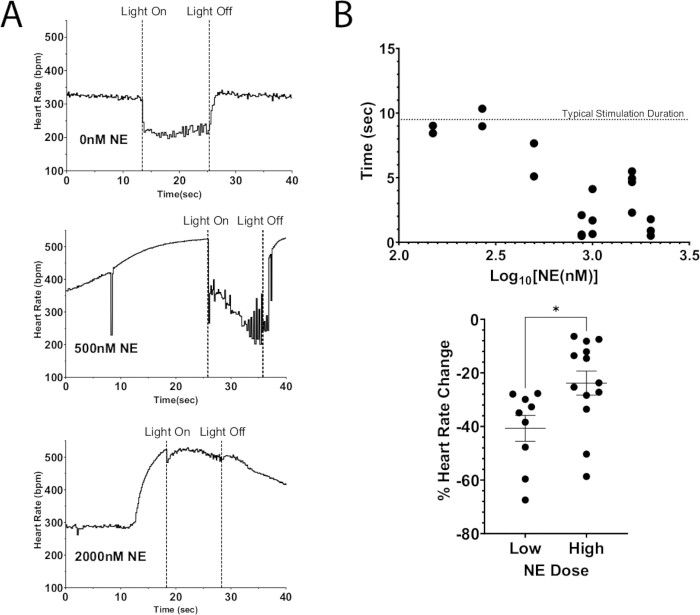
الشكل 7: التحفيز الضوئي كوليني مع NE الخارجية. (أ) استجابة معدل ضربات القلب أثناء التحفيز الضوئي ChAT-ChR2 مع زيادة جرعات NE المضافة إلى التنشط. بمجرد أن يصل معدل ضربات القلب إلى الحد الأقصى للزيادة بسبب NE ، تم تشغيل micro-LED لمدة 10 ثوان تقريبا. كان قمع معدل ضربات القلب لا يزال ممكنا عند الجرعات العالية من NE ، لكن مدة التحفيز انخفضت مع زيادة الجرعة. (ب) مقدار الوقت الذي ظل فيه معدل ضربات القلب مكبوطا. ظلت الأوقات الأقرب إلى 10 ثوان مكبوتة بشكل عام طوال مدة التحفيز. (ج) كان الانخفاض في معدل ضربات القلب أثناء التحفيز الضوئي أقل حدة عند الجرعات الأعلى من NE مقارنة بالجرعات المنخفضة. أدت الجرعات المنخفضة إلى انخفاض متوسط معدل ضربات القلب بنسبة 40٪ ، بينما انخفضت الجرعات الأعلى بنسبة 25٪ فقط. تم إجراء اختبار t غير متزاوج لتقييم الدلالة الإحصائية. عرض كخطأ معياري للمتوسط * p < 0.05. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أنتج التحفيز البصري الوراثي للخلايا العصبية اللاإرادية القلبية الجوهرية مستويات مماثلة من استجابة معدل ضربات القلب كتحفيز كهربائي للعصب المبهم أو العقد النجمية14،15. ومع ذلك ، فإن التحفيز الكهربائي للقلوب المستعصية المفعمة يفتقر إلى ميزة القدرة على استهداف مجموعات معينة من الخلايا العصبية بسهولة. يوفر التنشيط الدوائي فائدة استهداف مستقبلات معينة ولكن ليس له خصوصية مكانية ، ويعتمد وقت الاستجابة على معدل تدفق الشريان التاجي. يوفر التنشيط البصري الوراثي فائدة الاستجابة شبه الفورية ، واستهداف مجموعات الخلايا العصبية ، والقدرة على تغيير مستوى التحفيز الضوئي16. في هذا البروتوكول ، أوضحنا أيضا كيفية إنشاء مصدر ضوء بسيط ومنخفض التكلفة للتحفيز الضوئي للخلايا العصبية القلبية الجوهرية.
سيسهل تطوير فهم إضافي لتأثير الجهاز العصبي داخل القلب تشخيص وعلاج أمراض القلب والأوعية الدموية بشكل أفضل. يتيح التعبير الانتقائي ل ChR2 اختبار فرضيات جديدة تتعلق بنشاط مجموعات أعصاب معينة أثناء المرض. يمكن استجواب مجموعات الأعصاب في جميع أنحاء القلب بهذه الطريقة ، مثل العقد القلبية الجوهرية حول الأوردة الرئوية أو في جميع أنحاء البطينين. على سبيل المثال ، في نماذج الفئران لاحتشاء عضلة القلب ، يمكن أن يكون التحفيز الضوئي للخلايا العصبية اللاإرادية الجوهرية مفيدا في استجواب التغيرات الفيزيولوجية الكهربية في أنسجة المنطقة الحدودية مع تطور الاحتشاء وخضوع الخلايا العصبية للتمايز17. في هذا البروتوكول ، نصف مثالا آخر يتضمن تجارب خاضعة للرقابة للاستجابات القلبية الحادة للتنشيط المتزامن للمسارات الكولينية والكاتيكولامينرجية حيث يسمح الجمع بين العوامل البصرية والوراثية والدوائية بفحص استجابات الجرعة الفريدة. هذا التنشيط المتزامن هو ظاهرة مرتبطة بالغرق ، والمعروفة باسم الصراع اللاإرادي ، والتي لم يتم توضيحها بالكاملبعد 18. بالإضافة إلى ذلك ، بالنظر إلى مجموعات الضوء والصبغة والمرشحات المناسبة ، يمكن دمج هذا البروتوكول مع رسم الخرائط البصرية للقلب لدراسة الآثار الحادة لتحفيز الخلايا العصبية اللاإرادية على الفيزيولوجيا الكهربية للقلب وآليات عدم انتظام ضربات القلبالعصبي 19 ، 20 ، 21.
هناك العديد من المفاهيم المهمة التي يجب مراعاتها عند استخدام هذا البروتوكول لدراسة الجهاز العصبي القلبي الجوهري في القلوب المستعصصة. قلوب الفئران حساسة للتغيرات الطفيفة في بيئة التروية. تعد مراقبة معدل ضربات القلب عن كثب مفيدة لتحديد مشاكل التروية التاجية التي قد تسبب انخفاض أكسجة عضلة القلب ونقص التروية وضعف وظائف القلب. يوصي البروتوكول بتزويد البرحيد بالأكسجين في كل من الخزان الرئيسي والعلوي للحد من المشكلات المحتملة. يساعد غمر أنبوب الأكسجين بالكامل على ضمان مستويات الأكسجين المثلى في الريش. يمكن تسليط مصباح يدوي فوق بنفسجي على القلب للكشف عن مضان NADH مما يشير إلى نقص الأكسجة / نقص التروية ، ويمكن تعديل الأكسجين وفقا لذلك19،20. تعتمد درجة حرارة التعقيم على معدل التدفق التاجي أثناء التروية بالضغط المستمر. إذا انخفض معدل التدفق التاجي ، فقد تنخفض درجة حرارة تعقيم الأبهر أيضا بسبب التبريد في الأنبوب القريب من قنية الأبهر ، مما يؤدي إلى انخفاض معدل ضربات القلب. يمكن أن تساعد زيادة درجة حرارة الحمام المائي بالتعطير في عكس هذه المشكلة. يستخدم هذا البروتوكول أيضا حلقة الصهر للحفاظ على درجة حرارة حمام القلب 37 درجة مئوية. قد تتطلب القطرات في درجة حرارة حمام القلب زيادة معدل تدفق الصهار. يعد micro-LED مصدرا آخر للتغيرات المحتملة في درجة حرارة القلب لأن درجة حرارة التهاب المفاصل الروماتويدي يمكن أن ترتفع أثناء التحفيز الضوئي. إذا كان المطاط الصناعي السيليكوني الذي يغلف الجهاز رقيقا جدا ، فقد يسخن المصباح الصغير ويسخن عقدة SA ، مما يؤدي إلى زيادة غير متوقعة في معدل ضربات القلب. يمكن أن يكون اختبار مصدر ضوء micro-LED على قلب من النوع البري مفيدا لقياس مستويات التسخين. يجب ألا يتسبب مؤشر LED الصغير في زيادة معدل ضربات القلب بأكثر من 10٪ على مدى 30 ثانية. في حالة حدوث ذلك ، يجب استبدال المطاط الصناعي السيليكوني.
الهدف من تجارب القلب خارج الجسم الحي هو إعادة إنشاء ظروف فسيولوجية قريبة بمتغيرات يمكن التحكم فيها ، لكنها تأتي مع قيود22. الريشات البلورية هي المعيار لهذه التجارب. ومع ذلك ، يمكن أن يحد من توصيل الأكسجين إلى الميتوكوندريا في ظل ظروف الضغط العالي23،24. علاوة على ذلك ، يفتقر الإنشاب إلى الهرمونات المنتشرة التي تحدث بشكل طبيعي في الجسم الحي. هناك قيود إضافية تتمثل في أن شدة الضوء المتغيرة ووضع المصباح الصغير يمكن أن يؤدي إلى تفاوتات محلية في التحفيز العصبي ، لذلك يلزم دائما إجراء بعض التعديلات في وضع المصباح الصغير فوق القلب قبل بدء بروتوكول تجريبي.
باختصار ، يوضح هذا البروتوكول نهجا خارج الجسم الحي للتحفيز البصري الوراثي المحدد للخلايا العصبية القلبية في قلوب الفئران المنفعة. تم إنشاء مصدر ضوء micro-LED لتحفيز الخلايا العصبية في الأذين الأيمن. جمع تطبيق هذا النهج بين الإطلاق الجوهري للأستيل كولين أثناء التنشيط البصري الوراثي لقلب الفأر ChAT-ChR2 في وقت واحد مع زيادة NE الخارجية. تم تقديم التغيرات الناتجة في معدل ضربات القلب أثناء التنشيط المتزامن للكاتيكولامينرجيك والكولين. يصف هذا البروتوكول نهجا تجريبيا قيما للتحقيق في حركية التنشيط المفاجئ للخلايا العصبية اللاإرادية الجوهرية في القلوب المنفخة والتفاعلات بين النشاط الكولين القلبي والكاتيكولامينرجيك.
Disclosures
لا يوجد تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة R01 HL144157 إلى MWK ، والمعاهد الوطنية للصحة R01 HL144157 إلى EE و MWK ، و NIH R01s HL147279 و HL146169 إلى MWK و DM ، وزمالة كولينز المتميزة للدكتوراه في RR.
Materials
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
References
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved