Method Article
切除灌注小鼠心脏中内源性心脏自主神经神经元的光遗传学激活
摘要
该方案说明了一种对转基因小鼠心脏中内在心脏进行光遗传学刺激的方法。所描述的方法用于研究 离体 灌注心脏中心脏突然激活的动力学以及胆碱能和儿茶酚胺能活性之间的相互作用。
摘要
胆碱能和儿茶酚胺能激活的平衡对于维持心脏健康是必要的。通过在心脏自主神经神经元中选择性表达通道视紫红质-2 (ChR2),可以使用光遗传学来询问这些通路之间的相互作用。光遗传学的这种心脏应用允许以时空方式研究神经递质的内在释放。该方法说明了一种对灌注小鼠心脏中心脏神经元进行特异性光遗传学刺激的 离体 方法。转基因小鼠被培育为在全身的胆碱乙酰转移酶 (ChAT) 或酪氨酸羟化酶 (TH) 神经元中表达 ChR2。制备了包裹在硅橡胶中的微型 LED (465 nm),用于刺激支配窦房结的右心房神经元。micro-LED 连接到函数发生器,该函数发生器设置为 10 Hz、脉冲宽度为 30 ms 的脉冲波。切除已确认表达的心脏,并在 Langendorff 系统循环 Krebs-Henseleit 溶液上逆行灌注。使用 LabChart 软件记录心电图 (ECG) 、温度和冠状动脉流速。一旦心脏稳定下来,将 micro-LED 放置在右心房并测试最佳心率反应。这种方法的一个应用结合了 ChAT-ChR2 小鼠心脏光遗传学激活过程中胆碱能神经递质(乙酰胆碱)的内在释放与添加到灌注液中的外源性儿茶酚胺能神经递质(去甲肾上腺素)的增加。显示了在同时进行胆碱能和儿茶酚胺能激活期间产生的心率变化。该方法描述了一种有价值的实验方法,用于研究灌注心脏中突然内在自主神经激活的动力学以及心脏胆碱能和儿茶酚胺能活性之间的相互作用。
引言
光遗传学是一种将光敏蛋白 (opsin) 引入目标细胞群的方法。这使得特定细胞和组织的时空调节成为可能,而这些调节是用电或化学手段无法实现的 1。在过去的 15 年里,光遗传学的心脏应用越来越受欢迎2。心肌细胞或神经元中兴奋性视蛋白(如通道视紫红质-2 (ChR2)(一种阳离子)的光刺激导致细胞去极化,从而导致心律变化3。使用 Cre-lox 方法在细胞群中选择性表达视蛋白有两种方法:病毒转导4 和杂交转基因动物5。ChR2 在特定自主神经神经元中的选择性表达可以通过杂交来实现,以使用细胞特异性启动子产生在胆碱能或儿茶酚胺能神经元中表达 ChR2 的后代6。具有絮凝 ChR2 基因的亲本可以与在酪氨酸羟化酶(TH,儿茶酚胺能神经元)或胆碱乙酰转移酶(ChAT,胆碱能神经元)等启动子的控制下表达 Cre 重组酶的亲本交配。然后,后代在全身的 TH 或 ChAT 神经元中表达 ChR27。
可以使用特定神经元群(例如胆碱能或儿茶酚胺能神经元)中 ChR2 的启动子驱动表达来研究心脏对自主神经急性激活的功能反应。可以改变光刺激脉冲间隔和强度以控制那些表达 ChR2 的神经元的去极化率,以研究神经激活水平如何调节心脏功能8。对于这种方法,为简单起见,神经元将用于指代任何被光遗传学激活的细胞体、轴突和/或轴突投射。也可以通过引入药物或神经递质将光刺激与化学激活相结合,以询问对心律和收缩力的同时影响9。例如,光遗传学胆碱能刺激可以与注射外源性去甲肾上腺素 (NE) 相结合,以检查心脏中同时自主神经激活的影响。使用离体灌注心脏进行此类研究的优势在于提供了一个控制良好的实验平台来研究光活化引起的功能变化10。可以监测心电图形态、心率和冠状动脉流速的变化,同时严格控制体温、氧合和灌注压。
该协议的目的是提出一种实验方法来激活小鼠心脏中的特定自主神经元群以研究心率的变化。还介绍了用于灌注心脏光遗传学激活的 micro-LED 装置的构建和用途。切除在胆碱能或儿茶酚胺能神经元中表达 ChR2 的小鼠的心脏,并在恒压下用含氧 Krebs-Henseleit 溶液逆行灌注。右心房 (RA) 神经元中表达的 ChR2 以 10 Hz 的脉冲速率和 30 ms 的脉冲宽度进行光刺激。使用 RR 间期计算瞬时心率,并监测光刺激期间的变化。还描述了一个示例实验,该实验研究内源性光遗传学 ChAT 神经元光刺激期间的心率动力学,同时使用外源性去甲肾上腺素进行 β-肾上腺素能激活。
研究方案
所有动物规程均已获得乔治华盛顿大学动物护理和使用委员会的批准,并遵循美国国立卫生研究院的实验动物护理和使用指南。
1. Micro-LED 光源构建
- 在通风良好的区域进行解剖显微镜检查,将两根至少 20 cm 长的绝缘铜线的剥皮端焊接到 465 nm micro-LED 的接触点上(图 1)。通过将 LED 连接到电源并打开它来测试焊接。
- 切下 200 μL 过滤移液器吸头的底部 1 cm。使用小直径杆将过滤器推出。将带电线的 micro-LED 插入移液器吸头,使 LED 与吸头末端齐平。更换移液器吸头顶部的过滤器,将 LED 和导线固定到位,然后将 LED 的边缘用强力胶粘在移液器吸头上。让强力胶干燥。
- 将基料和固化剂以 10:1 的比例混合,制备有机硅弹性体,并充分混合。使用真空室或离心去除混合物中的任何气泡。
- 取 0.5 mL 离心管并在侧面划痕,以便更容易去除 LED(如果需要,也可以在此处向管内添加润滑剂)。用胶带封住管子的外部,以确保没有泄漏。将大约 0.2 mL 的硅弹性体混合物倒入试管中,然后将 micro-LED 移液器吸头放入试管中,在 LED 和试管底部之间至少留出 1 mm 的空间。如果形成气泡,请在坚硬的表面上敲击离心管以使其脱落。
注意:移液器吸头可以抢先涂上硅胶弹性体,以减少放置 LED 时形成气泡。 - 将离心管 micro-LED 直立置于 50 °C 实验室烘箱或培养箱中,放置至少 8 小时或过夜。与烤箱互动时戴上耐热手套。弹性体硬化后,从离心管中取出 LED。如果弹性体仍然粘稠,请将其放回烤箱中。
- 完全固化后,用精密美工刀去除 LED 尖端上多余的弹性体,留下不超过 1 毫米的弹性体。LED 的正确封装将最大限度地减少光刺激过程中组织的加热。
- 使用光功率计确定 LED 的光功率。打开功率计并调整波长设置以读取 465 nm。将 LED 与光电二极管功率传感器对齐,并使用函数发生器打开 LED。光功率计将产生以瓦特为单位的读数。通过将功率读数除以照明表面的面积 (0.88 mm2) 来计算辐照度。
注:理想的辐照度应约为 2.4 mW/mm2 ,以便适当激活 ChR211。
2. 实验准备
- 根据先前的出版物繁殖小鼠,在胆碱能神经元 (ChAT-ChR2) 或儿茶酚胺能神经元 (TH-ChR2) 中表达 ChR212(图 2)。如前所述,使用基因分型方法确认用于实验的小鼠中 TH-Cre 或 ChAT-Cre 的表达12。
- 准备至少 225 mL 的 Krebs-Henseleit (KH) 溶液(以 mM 为单位:118 NaCl、4.7 KCl、1.25 CaCl2、0.57 MgSO4、25 NaHCO3、1.17 KH 2 PO4、6 葡萄糖)并使用 0.2 μm 硝酸纤维素膜过滤器过滤。使用 95% O2 和 5% CO2 充氧时,将 pH 调节至 7.4。
- 实验前用纯净水冲洗 Langendorff 灌注系统,并在开始实验前去除多余的水。
- 在循环任何 KH 之前,向系统中添加 10 μm 膜过滤器。打开水浴,将灌注液温度保持在 37 °C,流速在 2-5 mL/min 之间。
- 向灌注系统中加入 175 mL KH 并开始循环。用 95% O2 / 5% CO2 使溶液起泡,以提供足够的氧合。
注:KH 循环体积因系统而异,具体取决于管路和储液槽尺寸。 - 使用旋塞阀停止流经灌注系统的流量,然后按量计上的 归零按钮 ,以校准流量计。
- 准备一个生理数据采集软件,例如 LabChart,具有 12 个通道:心脏浴温度、主动脉灌注液温度、心电图导联 I-III 加上四个额外的计算导联、心率计算、流速和函数发生器输出,以跟踪 LED 脉冲。
- 使用为心率保留的通道,在 LabChart 中计算心率,并设置循环测量功能以检测导联 I 上的小鼠心电图。LabChart 的心轴扩展使用导联 I 和导联 II 来计算导联 III、aVR、aVL 和 aVF。
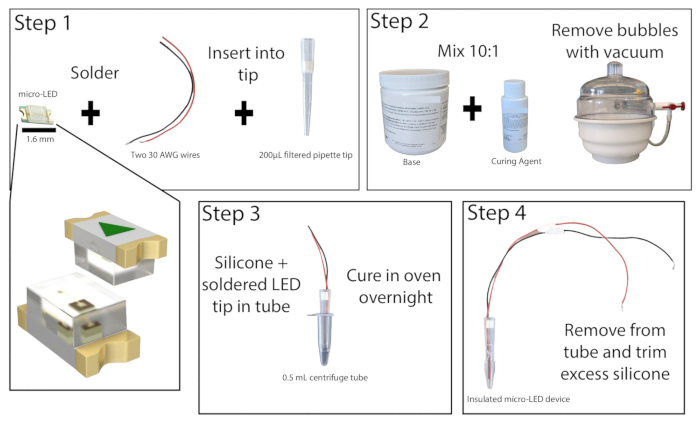
图 1:Micro-LED 结构。 构建 micro-LED 光源的步骤的简化概述。将两根电线焊接到 micro-LED 上,并插入 200 μL 移液器吸头,然后进行强力胶合(步骤 1)。有机硅弹性体以 10:1 的比例混合,并置于真空室中以去除气泡(步骤 2)。将有机硅弹性体倒入微量离心管中,插入 micro-LED 移液器吸头并使其固化过夜(步骤 3)。然后从管中取出绝缘的 micro-LED,并修剪多余的硅胶(步骤 4)。 请单击此处查看此图的较大版本。
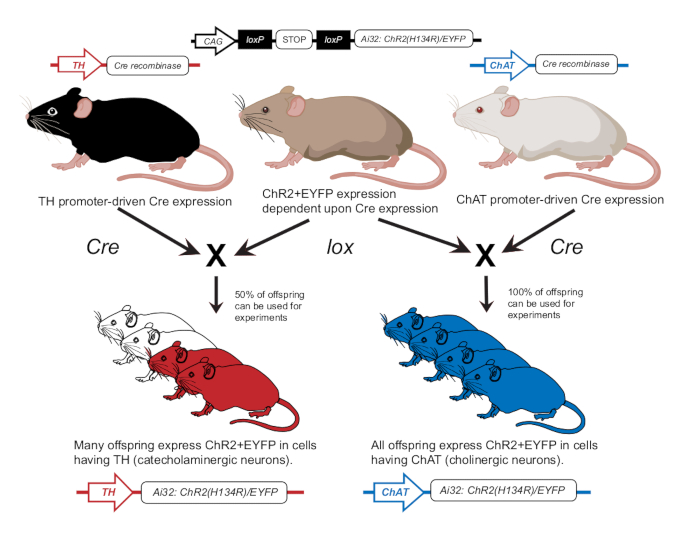
图 2:转基因小鼠育种方案。 具有 lox 依赖性 ChR2 基因的亲本小鼠与另一只具有 Cre 启动子的小鼠杂交。具有酪氨酸羟化酶 (TH) Cre 启动子的亲本小鼠将产生杂合子后代,其中 50% 将在儿茶酚胺能细胞中表达 ChR2。具有胆碱乙酰转移酶 (ChAT) Cre 启动子的亲本小鼠将产生纯合子后代,其中 100% 将在胆碱能细胞中表达 ChR2。通过基因分型确认表达。此数字已经12 许可修改。 请单击此处查看此图的较大版本。
3. 心脏切除和灌注
- 切除前,使用 1 mL 注射器通过腹膜内注射给予 250 单位肝素(约 8 U/g)。手术前至少等待 10 分钟。
- 将成年小鼠置于麻醉诱导室中。施用 ~4% 异氟醚并等待呼吸速率减慢和加深。从腔室中取出鼠标,并在进行颈椎脱位之前通过捏脚趾验证疼痛反射是否停止。
- 用一把镊子固定剑突,然后用手术剪刀切入腹腔。小心地切开隔膜,打开胸腔。切开肋骨,露出心脏和肺。轻轻抓住肺部并切除心脏和肺部。
- 将心脏放入肝素化 KH 的培养皿中。去除肺和任何大块脂肪。将清洁后的心脏放入第2 个肝 素化 KH 培养皿中,在设置为 2 倍放大倍率的解剖显微镜下。找到主动脉并使用细镊将其滑过套管。使用 4-0 丝缝合线将心脏固定在套管上。
注意:可以在冰上进行插管,以减少心脏的代谢活动。 - 通过套管冲洗推注肝素化 KH,以去除冠状动脉中的血液,然后再将其放置在灌注系统上。
- 将空心连接到灌注系统,并将其放入装满灌注液的 PDMS 培养皿中。根据 Einthoven 三角形13 将 ECG 针电极放入 PDMS 培养皿中。让心脏适应至少 5 分钟。
- 旋转心脏,使左心房可触及,并用一把微型自开剪刀在左心房上切一个 ~1 毫米的孔。将一根直径为 1 mm 的管子穿过该切片插入左心室,以释放困在那里的灌注液。
注意:使用解剖显微镜观察心脏可能会提高此步骤的便利性。 - 旋转心脏,使 RA 朝上,并且窦房结 (SA) 可以进行照明(图 3)。
- 根据需要调整 ECG 电极,将电极移近心脏或将其浸入灌注液中,以接收具有适当信噪比的信号。设置可能因所使用的 ECG 采集硬件和软件而异。该方法使用增益为 2000 的 Einthoven Goldberger 模块和 500 Hz 截止滤波器,软件设置包括电源滤波器和 1000 Hz 采样频率。
4. 光遗传学激活
- 将 micro-LED 设备连接到函数发生器组,以产生以下参数的脉冲波:10 Hz 频率、30 ms 脉冲宽度、10Vpp 振幅。
- 将 micro-LED 轻轻放在 SA 节点上。避免用力按压 micro-LED,因为这可能会导致心率和功能下降。
- 打开函数发生器并测量光刺激的心率变化。心率的即时变化表明有效激活。儿茶酚胺能激活导致心率呈指数级上升10,而胆碱能激活导致心率立即下降8。
- 关闭函数生成器。让心率恢复到激活前的水平。
- 如果光遗传学激活导致心率变化小于 100 bpm,请重新定位 micro-LED 以更好地照亮 RA 的神经元。根据需要重复。
5. 实验程序和数据分析
- 为了检验内在光遗传学胆碱能刺激可以抑制去甲肾上腺素 (NE) 的外源性 β-肾上腺素能激活的假设,在烟雾食品中制备 10 μM 和 100 μM 的 NE 储备溶液。
- 通过注射口向灌注系统中添加推注剂量的 NE。一旦心率增加达到平台期,打开 micro-LED ~10 秒。关灯并监测心率变化。
- 心率恢复到窦性心律后,增加 NE 的剂量并重复光遗传学刺激。继续每剂 NE。
- 在研究结束时,关闭气体供应,从系统中取出心脏,并在必要时将其保存在固定剂中。
- 根据需要用去离子水或清洁剂冲洗灌注系统储液槽和管道。彻底擦干系统以防止发霉。
- 保存 LabChart 文件。导出心率信号和 ECG 通道,用于离线分析和图形演示。
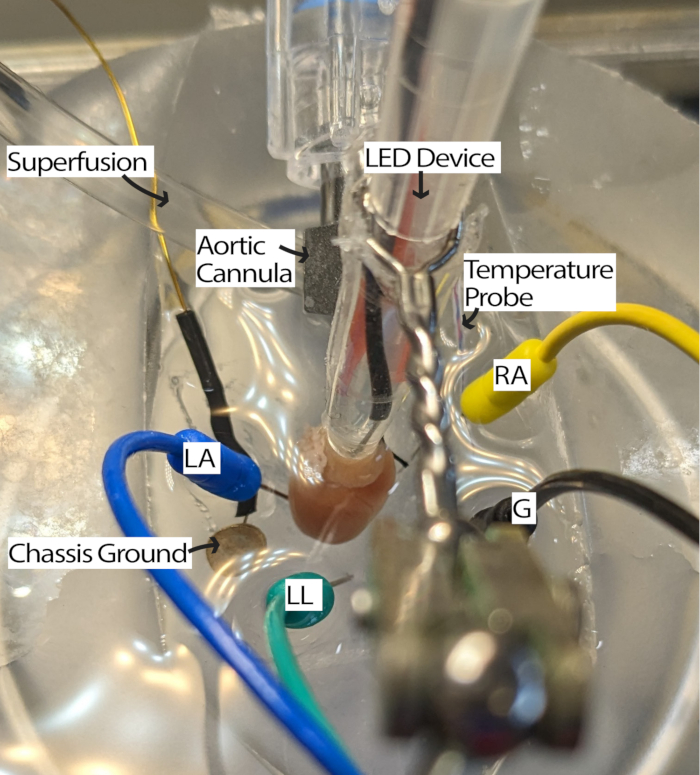
图 3:小鼠心脏浴配置。 空心小鼠心脏,显示 LED 设备和 ECG 电极的位置。存在机箱接地以减少周围电子设备的噪音。心电图针电极是根据 Einthoven 三角形放置的。缩写: LA = 左臂;RA = 右臂;LL = 左腿;G = 接地。 请单击此处查看此图的较大版本。
结果
如果维持适当的氧合、温度和冠状动脉血流,Langendorff 恒压灌注系统 (图 4) 应该能够将小鼠心率维持至少 300 bpm 超过一个小时。在这种设置下,主动脉灌注液温度取决于冠状动脉血流,因此可能需要随着流速的变化调整水浴温度,以将主动脉温度保持在 37 °C。 小鼠心脏冠状动脉流速通常在 1.5-4.5 mL/min 之间,具体取决于心脏的大小。在流速波动期间,将灌注液温度保持在 37 °C 对于一致的心脏功能是必要的,对于恒压灌注尤其重要。所描述的灌注系统旨在通过灌注液柱高度保持 70 mmHg 的静水压力。这是通过泵速实现的,该泵速可从顶部储液槽提供一致的溢流。灌注液可以补充 20 μM 血管扩张剂 cromakalin 以改善和维持正常或超正常的冠状动脉血流,以确保心肌完全氧合14。
以 10 Hz 和 30 ms 脉冲宽度对 ChAT-ChR2 小鼠心脏中的胆碱能神经元进行光刺激应导致心率几乎瞬间下降。在充分灌注的心脏中,胆碱能神经元的有效光刺激应导致心率降低至少 100 bpm。 图 5 显示,当 micro-LED 打开时,立即下降了 75 bpm,然后继续下降,直到达到 135 bpm 的最大下降。在关闭 micro-LED 后的半秒内,心率增加到 175 bpm,然后逐渐恢复到刺激前的水平。提出了一个六导联心电图来说明刺激之前、期间和之后 RR 间期的差异(图5B)。导联 aVR、aVL 和 aVF 在 LabChart 软件中使用导联 I 和 II 进行计算。
与胆碱能神经元的光刺激相比,TH-ChR2 小鼠心脏中儿茶酚胺能神经元的光刺激会导致心率发生更缓慢(指数)的变化。这可能是由于 β1-肾上腺素能激活需要 cAMP 的第二个信使系统激活 PKA,PKA 磷酸化靶蛋白,而毒蕈碱激活则不会。 图 6 显示,在 10 秒内心率增加 135 次/分。关灯后需要额外 10 秒才能恢复正常的窦性心律。如果 micro-LED 没有正确绝缘,它可能会加热心脏,导致心率加快。这种加热反应比 TH-ChR2 刺激要小;因此,心率的变化不太明显。
该方案的一个应用是使用光遗传学刺激使神经元去极化,导致内源性神经递质的释放,同时将外源性神经递质添加到灌注液中。图 7A 说明了在灌注液中加入推注剂量的 NE 后,ChAT-ChR2 小鼠心脏释放的内源性乙酰胆碱。在没有 NE 存在的情况下,光刺激导致心率下降超过 100 bpm,并在刺激期间保持这种下降。而使用大剂量的 NE (2000 nM) 时,光刺激期间的最大心率下降为 40 bpm。心率立即开始上升,几乎达到关灯前的刺激水平。该结果表明,ChAT 神经元光刺激对心率的光遗传学抑制无法完全抑制高剂量 NE 导致的心率增加,从而导致心率抑制时间缩短和心率降低降低(图 7B)。这些结果与之前在大型动物中的工作一致,这些工作表明在同时刺激迷走神经和星状神经节期间进行性 AV 结阻滞12,13。
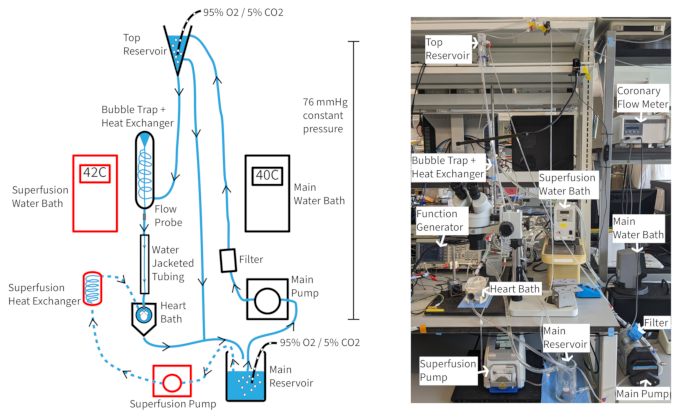
图 4:实验装置。灌注系统示意图。 箭头显示灌注液的方向。Superfusion 灌注液用虚线表示,组分用红色轮廓表示。 请单击此处查看此图的较大版本。
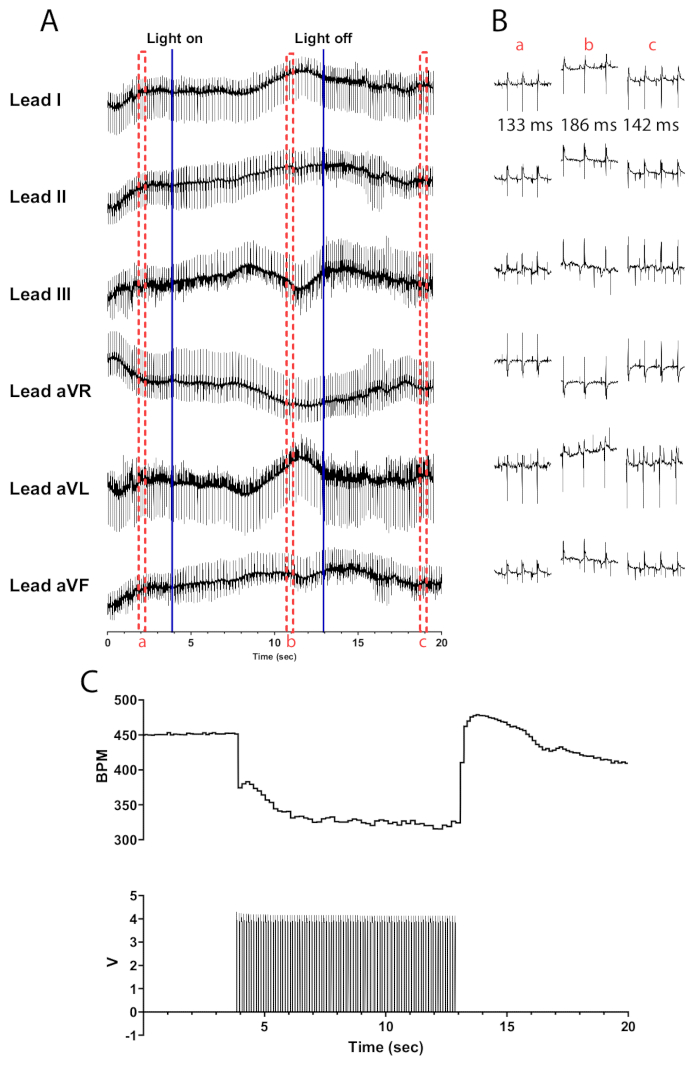
图 5: 代表性的胆碱能光刺激反应。(A) ChAT-ChR2 光遗传学激活期间的 6 导联心电图。蓝色实线表示 micro-LED 正在打开/关闭。红色虚线框表示 (B) 代码段的时间。 (B) 光刺激之前 (a)、期间 (b) 和之后 (c) 的 ECG 信号的半秒片段。每个部分都显示了 RR 间期。 (C) 心率(上)与来自函数发生器(下)的脉搏波一起显示。心率从 450 bpm 开始,在 315 s 光刺激后下降到 8 bpm,然后在光刺激结束后 7 s 恢复到 410 bpm。 请单击此处查看此图的较大版本。
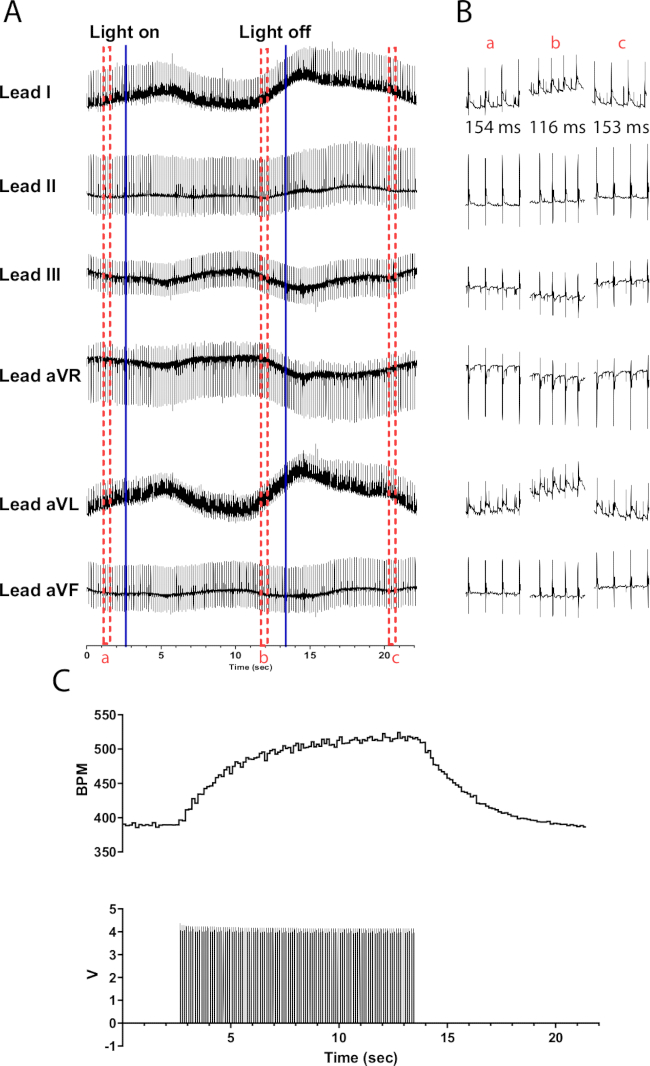
图 6:代表性的儿茶酚胺能光刺激反应。(A) TH-ChR2 光遗传学激活期间的 6 导联心电图。蓝色实线表示 micro-LED 正在打开/关闭。红色虚线框表示 (B) 代码段的时间。(B) 光刺激之前 (a)、期间 (b) 和之后 (c) 的 ECG 信号的半秒片段。每个部分都显示了 RR 间期。 (C) 心率(上)与来自函数发生器(下)的脉搏波一起显示。心率从 390 次/分开始,在光刺激 10 秒后达到峰值到 525 次/分,然后在光刺激结束后 8 秒恢复到 390 次/分。 请单击此处查看此图的较大版本。
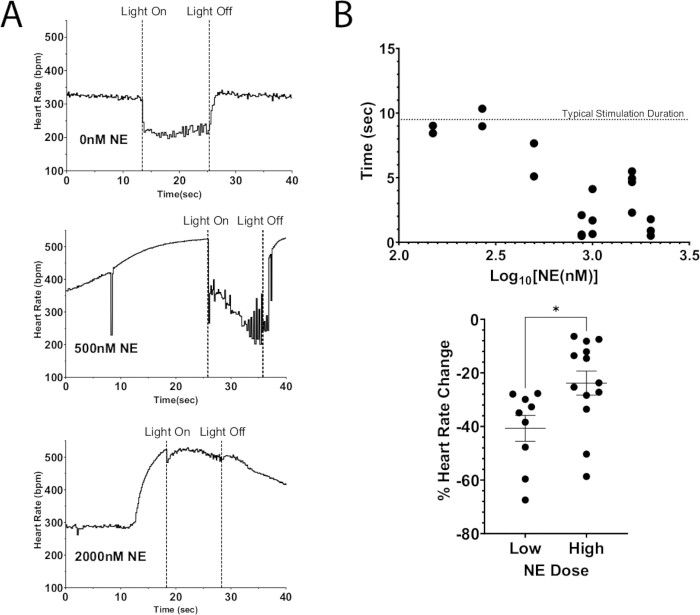
图 7:外源性 NE 的胆碱能光刺激。(A) 在灌注液中添加增加剂量的 NE 后 ChAT-ChR2 光刺激期间的心率反应。一旦心率因 NE 而达到最大增加,micro-LED 就会亮起约 10 秒。在高剂量 NE 下仍然可以抑制心率,但刺激持续时间随着剂量的增加而减少。(B) 心率保持抑制的时间量。接近 10 秒的时间通常在整个刺激持续时间内保持抑制状态。(C) 与低剂量 NE 相比,高剂量 NE 时光刺激期间心率下降的严重程度较低。低剂量导致心率平均降低 40%,而高剂量仅下降 25%。进行未配对的 t 检验以评估统计学意义。表示为均值 * p < 0.05 的标准误差。请单击此处查看此图的较大版本。
讨论
内在心脏自主神经元的光遗传学刺激产生的心率反应水平与迷走神经或星状神经节的电刺激相当14,15。然而,对切除的灌注心脏进行电刺激缺乏能够轻松靶向特定神经元群的优势。药物激活具有靶向特异性受体的好处,但没有空间特异性,响应时间取决于冠状动脉流速。光遗传学激活提供了近乎瞬时响应、靶向神经元群以及改变光刺激水平的能力的好处16。在该协议中,我们还解释了如何构建一种简单、低成本的光源来光刺激内在的心脏神经元。
进一步了解心内神经系统的影响将有助于更好地诊断和治疗心血管疾病。ChR2 的选择性表达能够测试与疾病期间特定神经群活动相关的新假设。可以通过这种方式询问整个心脏的神经群,例如肺静脉周围或整个心室的内在心脏神经节。例如,在心肌梗死的小鼠模型中,随着梗死的演变和神经元的转分化,内在自主神经神经元的光刺激可能有助于询问边界区组织的电生理变化17。在该方案中,我们描述了另一个示例,涉及急性心脏反应对胆碱能和儿茶酚胺能途径同时激活的对照实验,其中光遗传学和药理学药物的组合允许检查独特的剂量反应。这种并发激活是一种与溺水相关的现象,称为自主神经冲突,尚未完全阐明18。此外,在适当的光、染料和滤光片组合下,该方案可以与心脏光学标测相结合,以研究自主神经元刺激对心脏电生理学和神经-心律失常机制的急性影响 19,20,21。
使用该方案研究切除灌注心脏中的内在心脏时,需要考虑几个重要概念。小鼠心脏对灌注环境的微小变化很敏感。密切监测心率有助于识别可能导致心肌低氧合、缺血和心脏功能不良的冠状动脉灌注问题。该方案建议在主储液槽和顶部储液槽处对灌注液充氧,以限制潜在问题。完全浸没充氧管有助于保证灌注液中的最佳氧气含量。可以用紫外线手电筒照射心脏,露出指示缺氧/缺血的 NADH 荧光,并且可以相应地调整氧合19,20。灌注液温度取决于恒压灌注期间的冠状动脉流速。如果冠状动脉流速下降,主动脉灌注液温度也可能由于主动脉插管近端的管道冷却而下降,从而导致心率降低。提高灌注液水浴温度有助于扭转这一问题。该方案还利用超级融合回路来维持 37 °C 的心脏浴温度。 心脏浴温下降可能需要增加超导流速。micro-LED 是心脏温度潜在变化的另一个来源,因为 RA 的温度在光刺激过程中可能会升高。如果包裹设备的有机硅弹性体太薄,那么 micro-LED 可能会变热并加热 SA 结,从而导致心率意外增加。在野生型心脏上测试 micro-LED 光源可用于测量加热水平。micro-LED 不应导致心率在 30 秒内增加超过 10%。如果发生这种情况,应更换有机硅弹性体。
离体灌注心脏实验的目标是用可控变量重现接近生理的条件,但它们有局限性22。晶体灌注液是这些实验的标准品;然而,它可以在高压力条件下限制氧气输送到线粒体23,24。此外,灌注液缺乏体内自然存在的循环激素。另一个限制是可变的光强度和 micro-LED 的位置会导致神经刺激的局部差异,因此在开始实验方案之前,始终需要对 micro-LED 在心脏上方的位置进行一些调整。
总之,该方案说明了一种对灌注小鼠心脏中心脏神经元进行特异性光遗传学刺激的 离体 方法。构建了一个 micro-LED 光源来刺激右心房的神经元。这种方法的应用结合了 ChAT-ChR2 小鼠心脏光遗传学激活过程中乙酰胆碱的内在释放与外源性 NE 的增加。显示了在同时儿茶酚胺能和胆碱能激活期间产生的心率变化。该方案描述了一种有价值的实验方法,用于研究灌注心脏中突然内在自主神经激活的动力学以及心脏胆碱能和儿茶酚胺能活性之间的相互作用。
披露声明
无需申报利益冲突。
致谢
这项工作得到了 HL144157 到 MWK 的 NIH R01、EE 和 MWK 的 NIH R01 HL144157、MWK 和 DM 的 NIH R01 HL147279 和 HL146169,以及 RR 的柯林斯杰出博士奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
参考文献
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。