Method Article
Optogenetische Aktivierung von intrinsischen kardialen autonomen Neuronen in exzidierten perfundierten Mausherzen
In diesem Artikel
Zusammenfassung
Dieses Protokoll veranschaulicht ein Verfahren zur optogenetischen Stimulation von intrinsischen Herzneuronen in transgenen Mausherzen. Der beschriebene Ansatz wird verwendet, um die Kinetik der plötzlichen Aktivierung von Herzneuronen in ex vivo perfundierten Herzen und die Wechselwirkungen zwischen cholinerger und katecholaminerger Aktivität zu untersuchen.
Zusammenfassung
Ein Gleichgewicht von cholinerger und katecholaminerger Aktivierung ist notwendig, um die Herzgesundheit zu erhalten. Die Untersuchung der Interaktion zwischen diesen Signalwegen kann mit Hilfe der Optogenetik durch selektive Expression von Channelrhodopsin-2 (ChR2) in kardialen autonomen Neuronen erfolgen. Solche kardialen Anwendungen der Optogenetik ermöglichen die Untersuchung der intrinsischen Freisetzung von Neurotransmittern auf raumzeitliche Weise. Diese Methode veranschaulicht einen ex vivo Ansatz zur spezifischen optogenetischen Stimulation von Herzneuronen in perfundierten Mausherzen. Transgene Mäuse wurden gezüchtet, um ChR2 entweder in Neuronen der Cholinacetyltransferase (ChAT) oder der Tyrosinhydroxylase (TH) im ganzen Körper zu exprimieren. Eine Mikro-LED (465 nm), die von einem Silikonelastomer umhüllt ist, wurde für die Stimulation der Neuronen des rechten Vorhofs präpariert, die den Sinusknoten innervieren. Die Micro-LED wurde mit einem Funktionsgenerator verbunden, der auf Pulswellen bei 10 Hz mit einer Pulsbreite von 30 ms eingestellt ist. Herzen mit bestätigter Expression wurden exzidiert und retrograd auf einer zirkulierenden Krebs-Henseleit-Lösung des Langendorff-Systems perfundiert. Das Elektrokardiogramm (EKG), die Temperatur und die koronare Flussrate wurden mit der LabChart-Software aufgezeichnet. Sobald sich das Herz stabilisiert hatte, wurde die Mikro-LED auf dem rechten Vorhof platziert und auf eine optimale Herzfrequenzreaktion getestet. Eine Anwendung dieses Ansatzes kombiniert die intrinsische Freisetzung von cholinergen Neurotransmittern (Acetylcholin) während der optogenetischen Aktivierung eines ChAT-ChR2-Mausherzens gleichzeitig mit einer Erhöhung des exogenen katecholaminergen Neurotransmitters (Noradrenalin), der dem Perfusat zugesetzt wird. Die daraus resultierenden Veränderungen der Herzfrequenz während der gleichzeitigen cholinergen und katecholaminergen Aktivierung werden dargestellt. Diese Methode beschreibt einen wertvollen experimentellen Ansatz zur Untersuchung der Kinetik der plötzlichen intrinsischen autonomen Neuronenaktivierung in perfundierten Herzen und der Wechselwirkungen zwischen kardialer cholinerger und katecholaminerger Aktivität.
Einleitung
Die Optogenetik ist eine Methode, um lichtempfindliche Proteine (Opsine) in Zielzellpopulationen einzuschleusen. Dies ermöglicht eine raumzeitliche Modulation spezifischer Zellen und Gewebe, die mit elektrischen oder chemischen Mitteln nicht erreicht werden kann1. Kardiale Anwendungen der Optogenetik sind in den letzten 15 Jahren immer beliebter geworden2. Die Photostimulation von exzitatorischen Opsinen wie Channelrhodopsin-2 (ChR2), einem Kationen, in kardialen Myozyten oder Neuronen führt zu einer zellulären Depolarisation, die zu Veränderungen des Herzrhythmus führt3. Es gibt zwei Möglichkeiten, Opsine in Zellpopulationen mit dem Cre-lox-Ansatz selektiv zu exprimieren: virale Transduktion4 und Kreuzung transgener Tiere5. Die selektive Expression von ChR2 in spezifischen autonomen Neuronen kann durch Kreuzung erreicht werden, um Nachkommen zu erzeugen, die ChR2 entweder in cholinergen oder katecholaminergen Neuronen unter Verwendung zellspezifischer Promotoren exprimieren6. Ein Elternteil mit einem floxierten ChR2-Gen kann mit einem Elternteil gepaart werden, der Cre-Rekombinase unter der Kontrolle eines Promotors wie Tyrosinhydroxylase (TH, katecholaminerge Neuronen) oder Cholinacetyltransferase (ChAT, cholinerge Neuronen) exprimiert. Die Nachkommen exprimieren ChR2 dann entweder in TH- oder ChAT-Neuronen im ganzen Körper7.
Die funktionelle Reaktion des Herzens auf die akute Aktivierung autonomer Neuronen kann mit Hilfe der Promotor-gesteuerten Expression von ChR2 in spezifischen neuronalen Populationen, beispielsweise cholinergen oder katecholaminergen Neuronen, untersucht werden. Das Pulsintervall und die Intensität der Photostimulation können variiert werden, um die Depolarisationsrate dieser ChR2-exprimierenden Neuronen zu kontrollieren und zu untersuchen, wie das Ausmaß der neuronalen Aktivierung die Herzfunktion moduliert8. Für diese Methode werden Neuronen verwendet, um sich der Einfachheit halber auf alle Zellkörper, Axone und/oder axonalen Projektionen zu beziehen, die optogenetisch aktiviert sind. Es ist auch möglich, die Photostimulation mit der chemischen Aktivierung durch die Einführung von Medikamenten oder Neurotransmittern zu kombinieren, um gleichzeitige Auswirkungen auf den Herzrhythmus und die Kontraktilität zu untersuchen9. Zum Beispiel kann die optogenetische cholinerge Stimulation mit der Injektion von exogenem Noradrenalin (NE) kombiniert werden, um die Auswirkungen der gleichzeitigen autonomen Aktivierung im Herzen zu untersuchen. Die Durchführung solcher Studien mit isolierten perfundierten Herzen hat den Vorteil, dass sie eine gut kontrollierte experimentelle Plattform bietet, um funktionelle Veränderungen zu untersuchen, die durch Photoaktivierung verursacht werden10. Veränderungen der EKG-Morphologie, der Herzfrequenz und der koronaren Flussrate können überwacht werden, während Temperatur, Sauerstoffversorgung und Perfusionsdruck streng kontrolliert werden.
Das Ziel dieses Protokolls ist es, einen experimentellen Ansatz zur Aktivierung einer spezifischen Population autonomer Neuronen in Mäuseherzen vorzustellen, um Veränderungen der Herzfrequenz zu untersuchen. Ebenfalls vorgestellt wird der Aufbau und die Verwendung eines Mikro-LED-Bauelements zur optogenetischen Aktivierung in perfundierten Herzen. Herzen von Mäusen, die ChR2 in cholinergen oder katecholaminergen Neuronen exprimierten, wurden herausgeschnitten und retrograd mit einer sauerstoffhaltigen Krebs-Henseleit-Lösung bei konstantem Druck perfundiert. ChR2, das in den Neuronen des rechten Vorhofs (RA) exprimiert wurde, wurde mit einer Pulsrate von 10 Hz und einer Pulsbreite von 30 ms photostimuliert. Die momentane Herzfrequenz wurde anhand des RR-Intervalls berechnet und auf Veränderungen während der Photostimulation überwacht. Ein Beispielexperiment zur Untersuchung der Herzfrequenzkinetik während der intrinsischen optogenetischen Photostimulation von ChAT-Neuronen gleichzeitig mit beta-adrenerger Aktivierung unter Verwendung von exogenem Noradrenalin wird ebenfalls beschrieben.
Protokoll
Alle Tierprotokolle wurden vom Animal Care and Use Committee der George Washington University genehmigt und folgten dem Leitfaden des National Institute of Health für die Pflege und Verwendung von Labortieren.
1. Konstruktion der Mikro-LED-Lichtquelle
- Löten Sie unter einem Präpariermikroskop in einem gut belüfteten Bereich die abisolierten Enden von zwei isolierten Kupferdrähten mit einer Länge von mindestens 20 cm an die Kontaktpunkte einer 465-nm-Mikro-LED (Abbildung 1). Testen Sie das Löten, indem Sie die LED an eine Stromquelle anschließen und einschalten.
- Schneiden Sie die unteren 1 cm einer gefilterten Pipettenspitze mit 200 μl ab. Schieben Sie den Filter mit einer Stange mit kleinem Durchmesser heraus. Setzen Sie die Micro-LED mit Drähten so in die Pipettenspitze ein, dass die LED bündig mit dem Ende der Spitze abschließt. Setzen Sie den Filter oben an der Pipettenspitze wieder ein, um die LED und die Drähte an Ort und Stelle zu halten, und kleben Sie dann die Ränder der LED mit Sekundenkleber an die Pipettenspitze. Lass den Sekundenkleber trocknen.
- Bereiten Sie das Silikonelastomer vor, indem Sie die Basis und das Härter im Verhältnis 10:1 kombinieren und gut mischen. Entfernen Sie alle Blasen aus der Mischung mit einer Vakuumkammer oder durch Zentrifugieren.
- Nehmen Sie ein 0,5-ml-Zentrifugenröhrchen und ritzen Sie die Seiten ein, um das Entfernen der LED zu erleichtern (auf Wunsch kann hier auch Schmiermittel in die Innenseite des Röhrchens gegeben werden). Kleben Sie die Außenseite des Schlauchs ab, um sicherzustellen, dass kein Auslaufen entsteht. Gießen Sie ca. 0,2 ml der Silikonelastomermischung in das Röhrchen und setzen Sie dann die Mikro-LED-Pipettenspitze in das Röhrchen ein, wobei Sie mindestens 1 mm Abstand zwischen der LED und dem Boden des Röhrchens lassen. Wenn sich Blasen gebildet haben, klopfen Sie das Zentrifugenröhrchen auf eine harte Oberfläche, um sie zu lösen.
HINWEIS: Die Pipettenspitze kann präventiv mit Silikonelastomer beschichtet werden, um die Blasenbildung beim Platzieren der LED zu reduzieren. - Stellen Sie das Zentrifugenröhrchen micro-LED aufrecht in einen 50 °C heißen Laborofen oder Inkubator und lassen Sie es mindestens 8 h oder über Nacht stehen. Tragen Sie hitzebeständige Handschuhe, wenn Sie mit dem Ofen interagieren. Sobald das Elastomer ausgehärtet ist, entfernen Sie die LED aus dem Zentrifugenröhrchen. Wenn das Elastomer noch klebrig ist, legen Sie es wieder in den Ofen.
- Entfernen Sie nach dem vollständigen Aushärten überschüssiges Elastomer mit einem Präzisionsmesser von der Spitze der LED, so dass nicht mehr als 1 mm übrig bleibt. Die richtige Verkapselung der LED minimiert die Erwärmung des Gewebes während der Photostimulation.
- Bestimmen Sie die optische Leistung der LED mit einem optischen Leistungsmesser. Schalten Sie das Leistungsmessgerät ein und passen Sie die Wellenlängeneinstellungen so an, dass 465 nm angezeigt werden. Platzieren Sie die LED in einer Linie mit einem Fotodioden-Leistungssensor und schalten Sie die LED mit dem Funktionsgenerator ein. Der optische Leistungsmesser liefert einen Messwert in Watt. Berechnen Sie die Bestrahlungsstärke, indem Sie den Messwert durch die Fläche der beleuchteten Fläche (0,88 mm2) dividieren.
HINWEIS: Die ideale Bestrahlungsstärke sollte ca. 2,4 mW/mm2 betragen, um ChR211 angemessen zu aktivieren.
2. Experimentelle Vorbereitung
- Züchten Sie Mäuse in Übereinstimmung mit früheren Veröffentlichungen, um ChR2 entweder in cholinergen Neuronen (ChAT-ChR2) oder katecholaminergen Neuronen (TH-ChR2) zu exprimieren12 (Abbildung 2). Bestätigung der Expression von TH-Cre oder ChAT-Cre bei Mäusen, die für Experimente verwendet wurden, unter Verwendung eines Genotypisierungsansatzes, wie zuvor beschrieben12.
- Bereiten Sie mindestens 225 ml Krebs-Henseleit (KH)-Lösung vor (in mM: 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 Glukose) und filtrieren Sie mit einem 0,2 μm Zellulosenitrat-Membranfilter. Stellen Sie den pH-Wert auf 7,4 ein, wenn er mit 95 %O 2 und 5 % CO2 angereichert ist.
- Spülen Sie das Langendorff-Perfusionssystem vor dem Experiment mit gereinigtem Wasser und entfernen Sie überschüssiges Wasser, bevor Sie mit dem Experiment beginnen.
- Fügen Sie dem System einen 10-μm-Membranfilter hinzu, bevor KH zirkuliert. Schalten Sie die Wasserbäder ein, die so eingestellt sind, dass die Perfusattemperatur bei 37 °C bei Durchflussraten zwischen 2-5 mL/min gehalten wird.
- Geben Sie 175 mL KH in das Perfusionssystem und beginnen Sie mit der Durchblutung. Blasen Sie die Lösung mit 95 % O2 / 5 % CO2 , um eine ausreichende Sauerstoffversorgung zu gewährleisten.
HINWEIS: Das zirkulierende KH-Volumen variiert von System zu System, abhängig von den Schlauch- und Behältergrößen. - Kalibrieren Sie den Durchflussmesser, indem Sie den Durchfluss durch das Perfusionssystem mit einem Absperrhahn stoppen und die Nulltaste am Durchflussmesser drücken.
- Bereiten Sie eine physiologische Datenerfassungssoftware wie LabChart mit 12 Kanälen vor: Herzbadtemperatur, Aortenperfusattemperatur, EKG-Ableitungen I-III plus vier zusätzliche berechnete Ableitungen, Herzfrequenzberechnung, Flussrate und Funktionsgeneratorausgang zur Verfolgung von LED-Impulsen.
- Berechnen Sie die Herzfrequenz in LabChart unter Verwendung des für die Herzfrequenz reservierten Kanals mit der Funktion für zyklische Messungen zur Erkennung des Maus-EKGs auf Ableitung I. Die Herzachsenerweiterung von LabChart verwendet Ableitung I und Ableitung II, um Ableitung III, aVR, aVL und aVF zu berechnen.
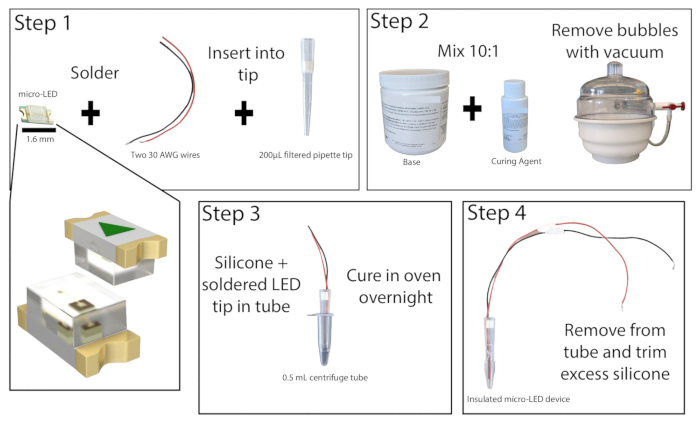
Abbildung 1: Micro-LED-Bauweise. Vereinfachte Übersicht über die Schritte zum Bau einer Micro-LED-Lichtquelle. Zwei Drähte werden an die Mikro-LED gelötet und in eine 200 μL Pipettenspitze gesteckt und dann mit Sekundenkleber versehen (Schritt 1). Silikonelastomer wird im Verhältnis 10:1 gemischt und in eine Vakuumkammer gegeben, um Blasen zu entfernen (Schritt 2). Das Silikonelastomer wird in ein Mikrozentrifugenröhrchen gegossen, die Mikro-LED-Pipettenspitze wird eingeführt und über Nacht aushärten gelassen (Schritt 3). Anschließend wird die isolierte Mikro-LED aus der Röhre entfernt und überschüssiges Silikon sollte abgeschnitten werden (Schritt 4). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
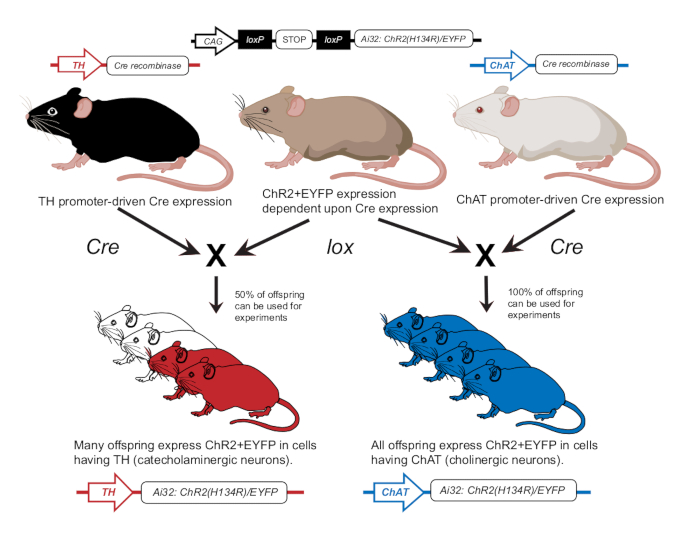
Abbildung 2: Transgenes Mauszuchtschema. Eine Elternmaus mit dem lox-abhängigen ChR2-Gen wird mit einer anderen Maus mit einem Cre-Promotor gekreuzt. Eine Elternmaus mit Tyrosinhydroxylase (TH) Cre-Promotor produziert heterozygote Nachkommen, bei denen 50% ChR2 in katecholaminergen Zellen exprimieren. Eine Elternmaus mit Cholin-Acetyltransferase (ChAT) Cre-Promotor wird homozygote Nachkommen produzieren, bei denen 100% ChR2 in cholinergen Zellen exprimieren. Die Expression wird durch Genotypisierung bestätigt. Diese Abbildung wurde mit Genehmigung von12 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Exzision und Perfusion des Herzens
- Vor der Exzision verabreichen Sie 250 Einheiten Heparin (ca. 8 U/g) durch intraperitoneale Injektion mit einer 1-ml-Spritze. Warten Sie mindestens 10 Minuten, bevor Sie operiert werden.
- Legen Sie eine erwachsene Maus in eine Anästhesie-Induktionskammer. Verabreichen Sie ~4% Isofluran und warten Sie, bis sich die Atmungsfrequenz verlangsamt und vertieft. Nehmen Sie die Maus aus der Kammer und überprüfen Sie die Beendigung des Schmerzreflexes durch Zusammenkneifen der Zehen, bevor Sie eine Gebärmutterhalsluxation durchführen.
- Halten Sie den Xiphoid-Prozess mit einer Pinzette fest und schneiden Sie mit einer chirurgischen Schere in die Bauchhöhle. Öffnen Sie die Brusthöhle, indem Sie vorsichtig durch das Zwerchfell schneiden. Schneiden Sie durch die Rippen, um Herz und Lunge freizulegen. Fassen Sie vorsichtig die Lunge und entfernen Sie das Herz und die Lunge.
- Legen Sie das Herz in eine Schüssel mit heparinisiertem KH. Entferne die Lunge und alle großen Fettstücke. Legen Sie das gereinigte Herz in eine 2. Schale mit heparinisiertem KH unter ein Präpariermikroskop mit 2-facher Vergrößerung. Lokalisieren Sie die Aorta und schieben Sie sie mit einer feinen Pinzette über die Kanüle. Befestigen Sie das Herz mit einer 4-0-Seidennaht an einer Kanüle.
HINWEIS: Die Kanülierung kann auf Eis erfolgen, um die Stoffwechselaktivität des Herzens zu reduzieren. - Spülen Sie eine Bolusinjektion von heparinisiertem KH durch die Kanüle, um Blut aus den Herzkranzgefäßen zu entfernen, bevor es auf das Perfusionssystem gelegt wird.
- Verbinden Sie das kanülierte Herz mit dem Perfusionssystem und legen Sie es in die mit Perfusat gefüllte PDMS-Schale. Legen Sie die EKG-Nadelelektroden entsprechend dem Einthovenschen Dreieck13 in die PDMS-Schale. Akklimatisieren Sie das Herz für mindestens 5 Minuten.
- Drehen Sie das Herz so, dass der linke Vorhof zugänglich ist, und schneiden Sie mit einer selbstöffnenden Mikroschere ein ~1 mm Loch in den linken Vorhof. Führen Sie einen Schlauch mit einem Durchmesser von 1 mm durch diese Scheibe in den linken Ventrikel ein, um das dort eingeschlossene Perfusat freizusetzen.
HINWEIS: Ein Präpariermikroskop zum Betrachten des Herzens kann diesen Schritt erleichtern. - Drehen Sie das Herz so, dass die RA nach oben zeigt und der Sinusknoten (SA) für die Beleuchtung zugänglich ist (Abbildung 3).
- Passen Sie die EKG-Elektroden nach Bedarf an, indem Sie die Elektroden näher an das Herz bringen oder sie in Perfusat tauchen, um die Signale mit einem geeigneten Signal-Rausch-Verhältnis zu empfangen. Die Einstellungen können je nach verwendeter Hardware und Software für die EKG-Erfassung variieren. Bei diesem Verfahren wurde ein Einthoven Goldberger-Modul mit einer Verstärkung von 2000 und einem 500-Hz-Cut-Off-Filter verwendet, und die Softwareeinstellungen umfassten einen Netzfilter und eine Abtastfrequenz von 1000 Hz.
4. Optogenetische Aktivierung
- Schließen Sie das Micro-LED-Gerät an ein Funktionsaggregat an, um Pulswellen mit folgenden Parametern zu erzeugen: 10 Hz Frequenz, 30 ms Pulsbreite, 10 Vpp Amplitude.
- Platzieren Sie die Micro-LED vorsichtig auf dem SA-Knoten. Vermeiden Sie es, mit der Micro-LED zu stark zu drücken, da dies zu einer Verringerung der Herzfrequenz und der Funktion führen kann.
- Schalten Sie den Funktionsgenerator ein und messen Sie die Veränderungen der Herzfrequenz durch die Photostimulation. Sofortige Veränderungen der Herzfrequenz deuten auf eine effektive Aktivierung hin. Die katecholaminerge Aktivierung führt zu einem exponentiellen Anstieg der Herzfrequenz10, während die cholinerge Aktivierung zu einem sofortigen Abfall führt8.
- Schalten Sie den Funktionsgenerator aus. Lassen Sie die Herzfrequenz auf das Niveau vor der Aktivierung zurückkehren.
- Wenn die optogenetische Aktivierung zu einer Änderung der Herzfrequenz von weniger als 100 Schlägen pro Minute führt, positionieren Sie die Mikro-LED neu, um die Neuronen der RA besser zu beleuchten. Wiederholen Sie den Vorgang bei Bedarf.
5. Experimentelles Vorgehen und Datenanalyse
- Um die Hypothese zu testen, dass die intrinsische optogenetische cholinerge Stimulation die exogene beta-adrenerge Aktivierung durch Noradrenalin (NE) unterdrücken kann, werden 10 μM und 100 μM Stammlösungen von NE in einem Rauchfutter hergestellt.
- Geben Sie eine Bolusdosis NE durch eine Injektionsöffnung in das Perfusionssystem. Sobald der Anstieg der Herzfrequenz ein Plateau erreicht hat, schalten Sie die Micro-LED für ~10 s ein. Schalten Sie das Licht aus und überwachen Sie Änderungen der Herzfrequenz.
- Nachdem die Herzfrequenz wieder in den Sinusrhythmus zurückgekehrt ist, erhöhen Sie die Dosis von NE und wiederholen Sie die optogenetische Stimulation. Fahren Sie mit jeder Dosis NE fort.
- Schalten Sie am Ende der Studie die Gaszufuhr aus, entfernen Sie das Herz aus dem System und bewahren Sie es bei Bedarf in einem Fixiermittel auf.
- Spülen Sie die Reservoire und Schläuche des Perfusionssystems nach Bedarf mit DI-Wasser oder Reinigungsmittel aus. Trocknen Sie das System gründlich ab, um Schimmel zu vermeiden.
- Speichern Sie die LabChart-Datei. Exportieren Sie das Herzfrequenzsignal und die EKG-Kanäle für die Offline-Analyse und grafische Darstellung.
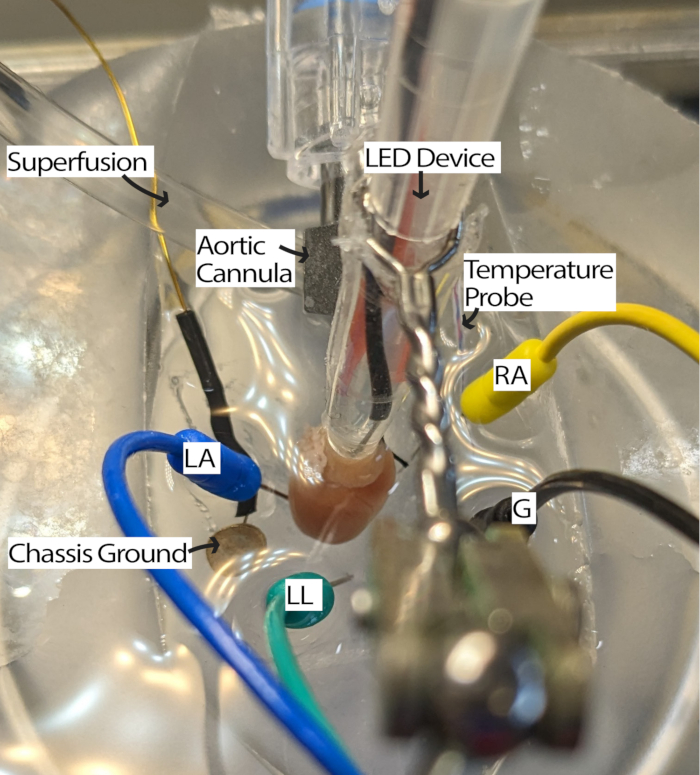
Abbildung 3: Konfiguration des Maus-Herzbades. Ein kanüliertes Mausherz zeigt die Platzierung des LED-Geräts und der EKG-Elektroden. Eine Gehäusemasse ist vorhanden, um Geräusche von der umgebenden Elektronik zu reduzieren. EKG-Nadelelektroden werden in Anlehnung an das Einthoven-Dreieck platziert. Abkürzungen: LA = linker Arm; RA = rechter Arm; LL = linkes Bein; G = Masse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Ein Langendorff-Perfusionssystem mit konstantem Druck (Abbildung 4) sollte in der Lage sein, die Herzfrequenz der Maus von mindestens 300 Schlägen pro Minute für weit über eine Stunde aufrechtzuerhalten, wenn eine angemessene Sauerstoffversorgung, Temperatur und koronarer Fluss aufrechterhalten werden. Bei diesem Aufbau hängt die Temperatur des Aortenperfusats vom koronaren Fluss ab, so dass die Temperaturen im Wasserbad möglicherweise angepasst werden müssen, wenn sich die Durchflussrate ändert, um die Aortentemperatur bei 37 °C zu halten. Die koronaren Flussraten des Mausherzens liegen in der Regel zwischen 1,5 und 4,5 ml/min, abhängig von der Größe des Herzens. Die Aufrechterhaltung der Perfusattemperatur bei 37 °C bei Flussratenschwankungen ist für eine gleichbleibende Herzfunktion notwendig und besonders wichtig für eine konstante Druckperfusion. Das beschriebene Perfusionssystem ist so ausgelegt, dass es einen hydrostatischen Druck von 70 mmHg über die Höhe der Perfusatsäule aufrechterhält. Dies wird durch eine Pumprate erreicht, die einen gleichmäßigen Überlauf aus dem oberen Behälter gewährleistet. Das Perfusat kann mit 20 μM des Vasodilatators Cromakalin ergänzt werden, um den normalen oder supranormalen Koronarfluss zu verbessern und aufrechtzuerhalten und eine vollständige Sauerstoffversorgung des Myokards zu gewährleisten14.
Die Photostimulation cholinerger Neuronen in ChAT-ChR2-Mausherzen bei 10 Hz und 30 ms Pulsbreite sollte zu einem nahezu sofortigen Abfall der Herzfrequenz führen. Eine effiziente Photostimulation cholinerger Neuronen in ausreichend durchbluteten Herzen sollte zu einer Verringerung der Herzfrequenz um mindestens 100 Schläge pro Minute führen. Abbildung 5 zeigt einen sofortigen Abfall von 75 Schlägen pro Minute beim Einschalten der Mikro-LED, der weiter abnimmt, bis er einen maximalen Abfall von 135 Schlägen pro Minute erreicht. Innerhalb einer halben Sekunde nach dem Ausschalten der Micro-LED steigt die Herzfrequenz auf 175 Schläge pro Minute, bevor sie allmählich auf das Niveau vor der Stimulation zurückkehrt. Es wird ein EKG mit sechs Ableitungen vorgestellt, um die Unterschiede im RR-Intervall vor, während und nach der Stimulation zu veranschaulichen (Abbildung 5B). Die Ableitungen aVR, aVL und aVF werden in der LabChart-Software mit den Ableitungen I und II berechnet.
Die Photostimulation von katecholaminergen Neuronen in TH-ChR2-Mausherzen bewirkt eine allmählichere (exponentielle) Veränderung der Herzfrequenz im Vergleich zur Photostimulation cholinerger Neuronen. Dies wird wahrscheinlich durch die beta1-adrenerge Aktivierung verursacht, die das zweite Botensystem von cAMP aktiviert, das PKA aktiviert, das Zielproteine phosphoryliert, während dies bei der muskarinischen Aktivierung nicht der Fall ist. Abbildung 6 zeigt einen Anstieg der Herzfrequenz um 135 Schläge pro Minute im Verlauf von 10 s. Nach dem Ausschalten des Lichts werden weitere 10 s benötigt, um zum normalen Sinusrhythmus zurückzukehren. Wenn die Mikro-LED nicht richtig isoliert ist, kann sie das Herz erwärmen, was zu einem Anstieg der Herzfrequenz führt. Diese Erwärmungsreaktion ist weniger intensiv als die TH-ChR2-Stimulation; Daher ist die Veränderung der Herzfrequenz weniger ausgeprägt.
Eine Anwendung dieses Protokolls besteht darin, optogenetische Stimulation zur Depolarisierung von Neuronen zu verwenden, was zur Freisetzung endogener Neurotransmitter führt, während gleichzeitig exogene Neurotransmitter zum Perfusat hinzugefügt werden. Abbildung 7A zeigt die endogene Acetylcholinfreisetzung aus einem ChAT-ChR2-Mausherz mit einer Bolusdosis NE, die dem Perfusat zugesetzt wurde. Ohne NE führte die Photostimulation zu einem Abfall der Herzfrequenz um mehr als 100 Schläge pro Minute und hielt diesen Abfall für die Dauer der Stimulation aufrecht. Bei einer hohen Dosis von NE (2000 nM) betrug der maximale Herzfrequenzabfall während der Photostimulation 40 Schläge pro Minute. Die Herzfrequenz begann sofort zu steigen und erreichte fast das Niveau vor der Stimulation, bevor das Licht ausgeschaltet wurde. Dieses Ergebnis deutet darauf hin, dass die optogenetische Unterdrückung der Herzfrequenz durch die Photostimulation der ChAT-Neuronen nicht in der Lage war, den Anstieg der Herzfrequenz infolge einer hohen Dosis von NE vollständig zu unterdrücken, was zu einer kürzeren Zeit der Herzfrequenzunterdrückung und einer geringeren Abnahme der Herzfrequenz führte (Abbildung 7B). Diese Ergebnisse stimmen mit früheren Arbeiten an Großtieren überein, die eine progressive AV-Knotenblockade bei gleichzeitiger Stimulation des Nervus vagusis und der Sternganglien zeigten12,13.
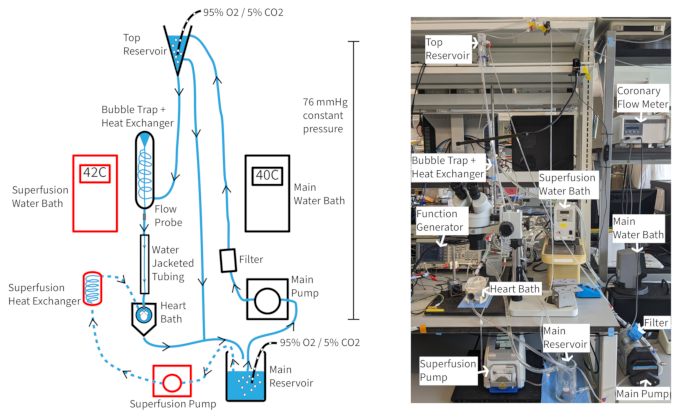
Abbildung 4: Versuchsaufbau. Diagramm des Perfusionssystems. Pfeile zeigen die Richtung des Perfusats an. Superfusionsperfusat wird durch gestrichelte Linien angezeigt und Komponenten sind rot umrandet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
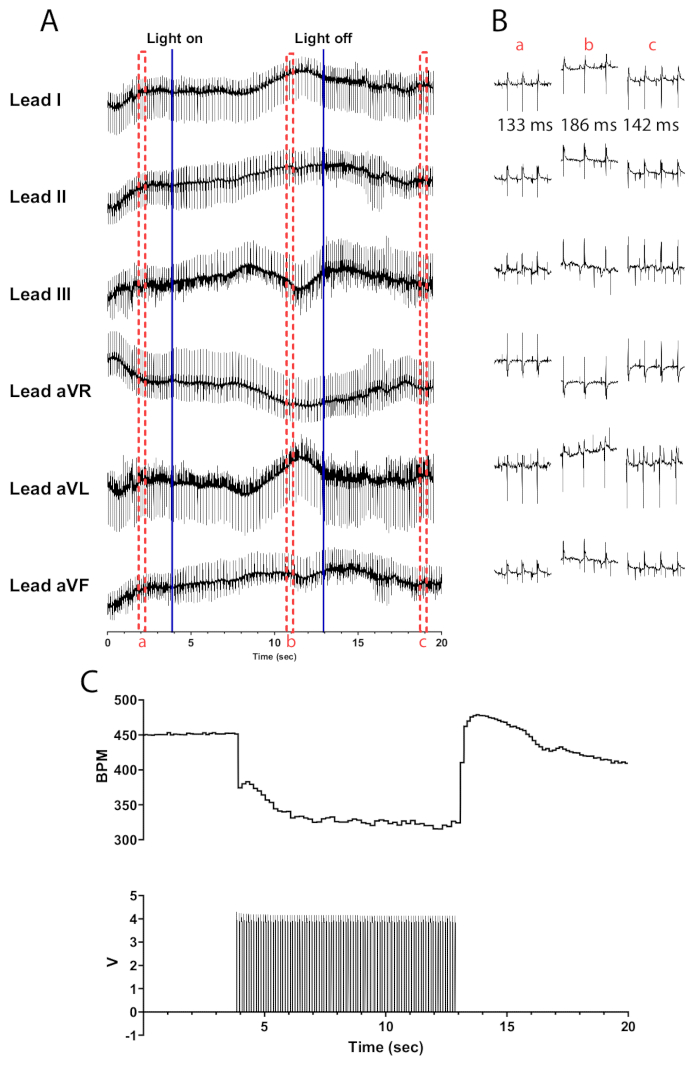
Abbildung 5: Repräsentative cholinerge Photostimulationsreaktion. (A) Ein 6-Kanal-EKG während der optogenetischen Aktivierung von ChAT-ChR2. Durchgehende blaue Linien zeigen an, dass die Mikro-LED ein- und ausgeschaltet wird. Rote gestrichelte Felder zeigen die Zeit für (B)-Snippets an. (B) Halbsekunden-Ausschnitte des EKG-Signals vor (a), während (b) und nach der Photostimulation (c). Das RR-Intervall wird für jeden Abschnitt angezeigt. (C) Die Herzfrequenz (oben) wird zusammen mit den Pulswellen eines Funktionsgenerators (unten) angezeigt. Die Herzfrequenz beginnt bei 450 Schlägen pro Minute und sinkt nach 8 s Photostimulation auf 315 Schläge pro Minute, bevor sie 7 s nach Beendigung der Photostimulation wieder auf 410 Schläge pro Minute zurückkehrt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
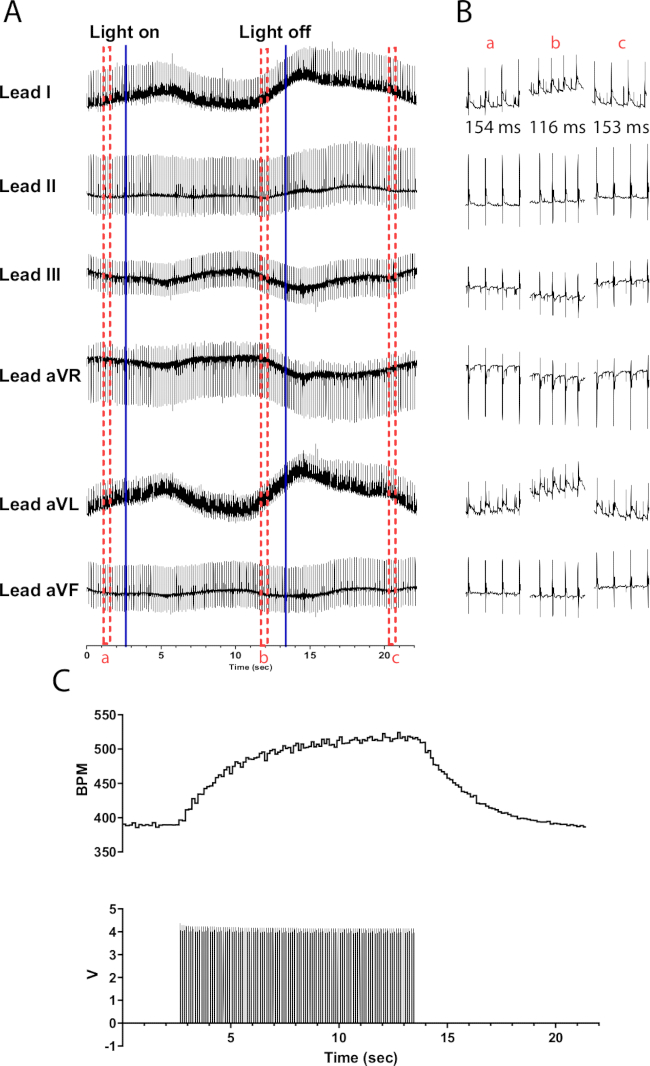
Abbildung 6: Repräsentative katecholaminerge Photostimulationsreaktion. (A) Ein 6-Kanal-EKG während der optogenetischen Aktivierung von TH-ChR2. Durchgehende blaue Linien zeigen an, dass die Mikro-LED ein- und ausgeschaltet wird. Rote gestrichelte Felder zeigen die Zeit für (B)-Snippets an. (B) Halbsekunden-Ausschnitte des EKG-Signals vor (a), während (b) und nach der Photostimulation (c). Das RR-Intervall wird für jeden Abschnitt angezeigt. (C) Die Herzfrequenz (oben) wird zusammen mit den Pulswellen eines Funktionsgenerators (unten) angezeigt. Die Herzfrequenz beginnt bei 390 Schlägen pro Minute und erreicht nach 10 Sekunden Photostimulation einen Spitzenwert von 525 Schlägen pro Minute, bevor sie 8 Sekunden nach Beendigung der Photostimulation wieder auf 390 Schläge pro Minute zurückkehrt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
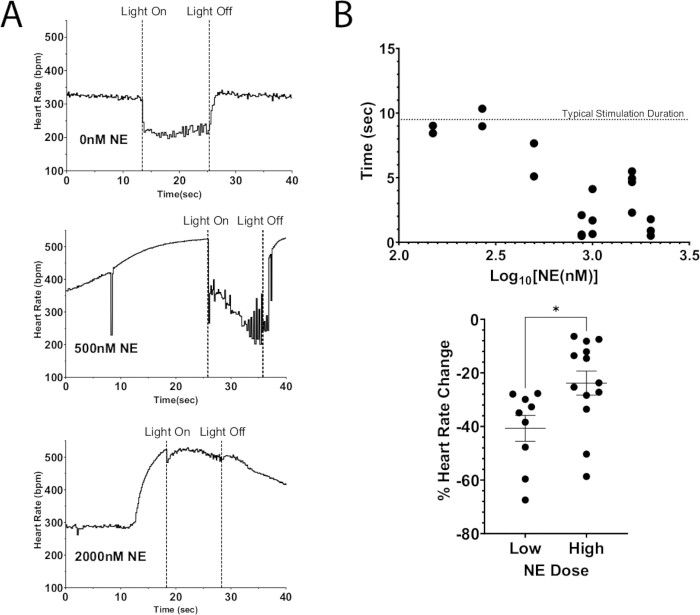
Abbildung 7: Cholinerge Photostimulation mit exogenem NE. (A) Herzfrequenzreaktion während der ChAT-ChR2-Photostimulation mit steigenden Dosen von NE zum Perfusat. Sobald die Herzfrequenz einen maximalen Anstieg aufgrund von NE erreichte, wurde die Mikro-LED für ca. 10 s eingeschaltet. Eine Unterdrückung der Herzfrequenz war bei hohen Dosen von NE immer noch möglich, aber die Dauer der Stimulation nahm mit zunehmender Dosis ab. (B) Die Zeit, die die Herzfrequenz unterdrückt blieb. Zeiten, die näher an 10 s lagen, blieben im Allgemeinen für die gesamte Dauer der Stimulation unterdrückt. (C) Der Abfall der Herzfrequenz während der Photostimulation war bei höheren NE-Dosen weniger schwerwiegend als bei niedrigen Dosen. Niedrige Dosen führten zu einer durchschnittlichen Abnahme der Herzfrequenz um 40 %, während höhere Dosen nur um 25 % sanken. Zur Beurteilung der statistischen Signifikanz wurde ein ungepaarter t-Test durchgeführt. Dargestellt als Standardfehler des Mittelwerts * p < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die optogenetische Stimulation intrinsischer kardialer autonomer Neuronen führte zu einer vergleichbaren Herzfrequenzreaktion wie die elektrische Stimulation des Vagusnervs oder der Sternganglien 14,15. Bei der elektrischen Stimulation von exzidierten perfundierten Herzen fehlt jedoch der Vorteil, dass bestimmte Neuronenpopulationen leicht angegriffen werden können. Die pharmakologische Aktivierung bietet den Vorteil, dass sie auf spezifische Rezeptoren abzielt, hat aber keine räumliche Spezifität, und die Reaktionszeit hängt von der koronaren Flussrate ab. Die optogenetische Aktivierung bietet den Vorteil einer nahezu sofortigen Reaktion, die Ausrichtung auf neuronale Populationen und die Möglichkeit, das Niveau der Photostimulation zu verändern16. In diesem Protokoll haben wir auch erklärt, wie man eine einfache, kostengünstige Lichtquelle für die Photostimulation der intrinsischen Herzneuronen konstruiert.
Die Entwicklung eines besseren Verständnisses der Auswirkungen des intrakardialen Nervensystems wird eine bessere Diagnose und Behandlung von Herz-Kreislauf-Erkrankungen ermöglichen. Die selektive Expression von ChR2 ermöglicht es, neue Hypothesen über die Aktivität bestimmter Nervenpopulationen während der Erkrankung zu testen. Nervenpopulationen im gesamten Herzen könnten auf diese Weise abgefragt werden, wie z. B. intrinsische Herzganglien um die Lungenvenen oder in den Ventrikeln. Zum Beispiel könnte in Mausmodellen für Myokardinfarkte die Photostimulation von intrinsischen autonomen Neuronen nützlich sein, um elektrophysiologische Veränderungen im Grenzzonengewebe zu untersuchen, während sich der Infarkt entwickelt und Neuronen eine Transdifferenzierung durchlaufen17. In diesem Protokoll beschreiben wir ein weiteres Beispiel mit kontrollierten Experimenten akuter kardialer Reaktionen auf die gleichzeitige Aktivierung cholinerger und katecholaminerger Signalwege, bei denen die Kombination von optogenetischen und pharmakologischen Wirkstoffen die Untersuchung einzigartiger Dosiswirkungen ermöglicht. Diese gleichzeitige Aktivierung ist ein Phänomen, das mit dem Ertrinken in Verbindung gebracht wird und als autonomer Konflikt bekannt ist und noch nicht vollständig geklärt ist18. Darüber hinaus kann dieses Protokoll bei geeigneten Licht-, Farbstoff- und Filterkombinationen mit kardialem optischem Mapping kombiniert werden, um die akuten Auswirkungen der autonomen Neuronenstimulation auf die kardiale Elektrophysiologie und die Mechanismen der neurokardialen Arrhythmie zu untersuchen 19,20,21.
Es gibt mehrere wichtige Konzepte, die bei der Verwendung dieses Protokolls zur Untersuchung des intrinsischen kardialen Nervensystems bei exzidierten perfundierten Herzen zu berücksichtigen sind. Mausherzen reagieren empfindlich auf geringfügige Veränderungen des Perfusionsmilieus. Eine genaue Überwachung der Herzfrequenz ist nützlich, um Probleme mit der koronaren Perfusion zu identifizieren, die zu einer geringen Sauerstoffversorgung des Myokards, Ischämie und einer schlechten Herzfunktion führen können. Das Protokoll empfiehlt, das Perfusat sowohl am Haupt- als auch am oberen Reservoir mit Sauerstoff zu versorgen, um mögliche Probleme zu begrenzen. Das vollständige Eintauchen des Sauerstoffschlauchs trägt dazu bei, einen optimalen Sauerstoffgehalt im Perfusat zu gewährleisten. Eine ultraviolette Taschenlampe kann auf das Herz gerichtet werden, um die NADH-Fluoreszenz anzuzeigen, die auf Hypoxie/Ischämie hinweist, und die Sauerstoffversorgung kann entsprechend angepasst werden19,20. Die Perfusattemperatur hängt von der koronaren Flussrate während der Perfusion mit konstantem Druck ab. Wenn die koronare Flussrate abnimmt, kann auch die Temperatur des Aortenperfusats aufgrund der Abkühlung des Schlauchs proximal der Aortenkanüle sinken, was zu einer niedrigeren Herzfrequenz führt. Eine Erhöhung der Temperatur des Perfusatwasserbads kann helfen, dieses Problem umzukehren. Bei diesem Protokoll wird auch eine Superfusionsschleife verwendet, um eine Herzbadtemperatur von 37 °C aufrechtzuerhalten. Ein Abfall der Herzbadtemperatur kann eine Erhöhung der Superfusionsflussrate erfordern. Die Mikro-LED ist eine weitere Quelle für mögliche Veränderungen der Herztemperatur, da die Temperatur der RA während der Photostimulation ansteigen kann. Wenn das Silikonelastomer, das das Gerät umgibt, zu dünn ist, kann sich die Mikro-LED erwärmen und den SA-Knoten erwärmen, was zu einem unerwarteten Anstieg der Herzfrequenz führt. Das Testen der Mikro-LED-Lichtquelle an einem Wildtyp-Herz kann nützlich sein, um den Heizgrad zu messen. Die Micro-LED sollte über 30 s keinen Anstieg der Herzfrequenz um mehr als 10% verursachen. In diesem Fall sollte das Silikonelastomer ausgetauscht werden.
Das Ziel von ex vivo perfundierten Herzexperimenten ist es, nahezu physiologische Bedingungen mit kontrollierbaren Variablen nachzubilden, aber sie sind mit Einschränkungen verbunden22. Kristalloides Perfusat ist der Standard für diese Experimente; Es kann jedoch die Sauerstoffzufuhr zu den Mitochondrien unter Bedingungen mit hohem Stress einschränken 23,24. Darüber hinaus fehlen dem Perfusat zirkulierende Hormone, die in vivo natürlich vorkommen würden. Eine weitere Einschränkung besteht darin, dass eine variable Lichtintensität und Platzierung der Mikro-LED zu lokalen Unterschieden bei der neuronalen Stimulation führen kann, so dass vor Beginn eines experimentellen Protokolls immer einige Anpassungen bei der Positionierung der Mikro-LED über dem Herzen erforderlich sind.
Zusammenfassend lässt sich sagen, dass dieses Protokoll einen ex vivo Ansatz zur spezifischen optogenetischen Stimulation von Herzneuronen in perfundierten Mausherzen darstellt. Eine Mikro-LED-Lichtquelle wurde konstruiert, um die Neuronen des rechten Vorhofs zu stimulieren. Eine Anwendung dieses Ansatzes kombinierte die intrinsische Freisetzung von Acetylcholin während der optogenetischen Aktivierung eines ChAT-ChR2-Mausherzens gleichzeitig mit einer Erhöhung des exogenen NE. Die daraus resultierenden Veränderungen der Herzfrequenz während der gleichzeitigen katecholaminergen und cholinergen Aktivierung wurden vorgestellt. Dieses Protokoll beschreibt einen wertvollen experimentellen Ansatz zur Untersuchung der Kinetik der plötzlichen intrinsischen autonomen Neuronenaktivierung in perfundierten Herzen und der Wechselwirkungen zwischen cholinerger und katecholaminerger Aktivität im Herzen.
Offenlegungen
Keine Interessenkonflikte zu deklarieren.
Danksagungen
Diese Arbeit wurde unterstützt durch NIH R01 HL144157 zu MWK, NIH R01 HL144157 zu EE und MWK und NIH R01s HL147279 und HL146169 zu MWK und DM sowie ein Collins Distinguished Doctoral Fellowship zu RR.
Materialien
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Referenzen
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten