Method Article
Attivazione optogenetica dei neuroni autonomici cardiaci intrinseci nei cuori di topo perfusi asportati
In questo articolo
Riepilogo
Questo protocollo illustra un metodo per la stimolazione optogenetica dei neuroni cardiaci intrinseci nei cuori di topo transgenici. L'approccio descritto è utilizzato per studiare la cinetica dell'attivazione improvvisa dei neuroni cardiaci in cuori perfusi ex vivo e le interazioni tra attività colinergica e catecolaminergica.
Abstract
Un equilibrio di attivazione colinergica e catecolaminergica è necessario per mantenere la salute del cuore. L'interrogazione dell'interazione tra queste vie può essere effettuata utilizzando l'optogenetica attraverso l'espressione selettiva della canalrodopsina-2 (ChR2) nei neuroni autonomi cardiaci. Tali applicazioni cardiache dell'optogenetica consentono lo studio del rilascio intrinseco di neurotrasmettitori in modo spaziotemporale. Questo metodo illustra un approccio ex vivo per la stimolazione optogenetica specifica dei neuroni cardiaci in cuori di topo perfusi. I topi transgenici sono stati allevati per esprimere ChR2 nei neuroni della colina acetiltransferasi (ChAT) o della tirosina idrossilasi (TH) in tutto il corpo. Un micro-LED (465 nm) racchiuso in un elastomero siliconico è stato preparato per stimolare i neuroni dell'atrio destro che innervano il nodo senoatriale. Il micro-LED è stato collegato a un generatore di funzioni impostato su onde impulsive a 10 Hz con un'ampiezza di impulso di 30 ms. I cuori con espressione confermata sono stati asportati e perfusi retrogradamente su una soluzione di Krebs-Henseleit circolante nel sistema di Langendorff. L'elettrocardiogramma (ECG), la temperatura e la velocità del flusso coronarico sono stati registrati utilizzando il software LabChart. Una volta che il cuore si è stabilizzato, il micro-LED è stato posizionato sull'atrio destro e testato per una risposta ottimale della frequenza cardiaca. Un'applicazione di questo approccio combina il rilascio intrinseco di neurotrasmettitore colinergico (acetilcolina) durante l'attivazione optogenetica di un cuore di topo ChAT-ChR2 simultaneamente con l'aumento del neurotrasmettitore catecolaminergico esogeno (noradrenalina) aggiunto al perfusato. Vengono presentate le variazioni risultanti nella frequenza cardiaca durante l'attivazione colinergica e catecolaminergica simultanea. Questo metodo descrive un valido approccio sperimentale per studiare la cinetica dell'improvvisa attivazione intrinseca dei neuroni autonomici nei cuori perfusi e le interazioni tra attività colinergica cardiaca e catecolaminergica.
Introduzione
L'optogenetica è un metodo per introdurre proteine sensibili alla luce (opsine) in popolazioni cellulari mirate. Ciò consente la modulazione spazio-temporale di cellule e tessuti specifici che non può essere ottenuta utilizzando mezzi elettrici o chimici1. Le applicazioni cardiache dell'optogenetica sono diventate sempre più popolari negli ultimi 15 anni2. La fotostimolazione delle opsine eccitatorie come la canalrodopsina-2 (ChR2), un catione, nei miociti o nei neuroni cardiaci provoca la depolarizzazione cellulare, causando cambiamenti nel ritmo cardiaco3. Esistono due modi per esprimere selettivamente le opsine nelle popolazioni cellulari utilizzando l'approccio Cre-lox: la trasduzione virale4 e l'incrocio di animali transgenici5. L'espressione selettiva di ChR2 in specifici neuroni autonomici può essere ottenuta mediante incrocio per creare prole che esprime ChR2 in neuroni colinergici o catecolaminergici utilizzando promotori cellulo-specifici6. Un genitore con un gene ChR2 floxato può essere accoppiato con un genitore che esprime Cre ricombinasi sotto il controllo di un promotore come la tirosina idrossilasi (TH, neuroni catecolaminergici) o la colina acetiltransferasi (ChAT, neuroni colinergici). La prole esprime quindi ChR2 nei neuroni TH o ChAT in tutto il corpo7.
La risposta funzionale del cuore all'attivazione acuta dei neuroni autonomi può essere studiata utilizzando l'espressione guidata dal promotore di ChR2 all'interno di specifiche popolazioni neuronali, ad esempio neuroni colinergici o catecolaminergici. L'intervallo e l'intensità dell'impulso di fotostimolazione possono essere variati per controllare il tasso di depolarizzazione di quei neuroni che esprimono ChR2 per studiare come i livelli di attivazione neurale modulano la funzione cardiaca8. Per questo metodo, i neuroni saranno utilizzati per riferirsi a qualsiasi corpo cellulare, assone e/o proiezioni assonali che sono attivate optogeneticamente per semplicità. È anche possibile combinare la fotostimolazione con l'attivazione chimica mediante l'introduzione di farmaci o neurotrasmettitori per interrogare gli effetti simultanei sul ritmo cardiaco e sulla contrattilità9. Ad esempio, la stimolazione colinergica optogenetica può essere combinata con l'iniezione di noradrenalina esogena (NE) per esaminare l'impatto dell'attivazione autonomica concomitante nel cuore. Condurre tali studi utilizzando cuori isolati perfusi ha il vantaggio di fornire una piattaforma sperimentale ben controllata per studiare i cambiamenti funzionali causati dalla fotoattivazione10. I cambiamenti nella morfologia dell'ECG, nella frequenza cardiaca e nella velocità del flusso coronarico possono essere monitorati mentre la temperatura, l'ossigenazione e la pressione di perfusione sono strettamente controllate.
L'obiettivo di questo protocollo è quello di presentare un approccio sperimentale per attivare una specifica popolazione di neuroni autonomi in cuori di topo per studiare i cambiamenti nella frequenza cardiaca. Viene inoltre presentata la costruzione e l'utilizzo di un dispositivo micro-LED per l'attivazione optogenetica in cuori perfusi. I cuori di topi che esprimevano ChR2 in neuroni colinergici o catecolaminergici sono stati asportati e perfusi retrogradamente con una soluzione ossigenata di Krebs-Henseleit a pressione costante. I ChR2 espressi nei neuroni dell'atrio destro (RA) sono stati fototimulati a una frequenza di pulsazione di 10 Hz con un'ampiezza di impulso di 30 ms. La frequenza cardiaca istantanea è stata calcolata utilizzando l'intervallo RR e monitorata per i cambiamenti durante la fotostimolazione. Viene anche descritto un esperimento di esempio per studiare la cinetica della frequenza cardiaca durante la fotostimolazione optogenetica intrinseca del neurone ChAT contemporaneamente all'attivazione beta-adrenergica utilizzando noradrenalina esogena.
Protocollo
Tutti i protocolli sugli animali sono stati approvati dal Comitato per la cura e l'uso degli animali della George Washington University e hanno seguito la Guida del National Institute of Health per la cura e l'uso degli animali da laboratorio.
1. Costruzione della sorgente luminosa Micro-LED
- Al microscopio da dissezione in un'area ben ventilata, saldare le estremità spellate di due fili di rame isolati, lunghi almeno 20 cm, ai punti di contatto di un micro-LED da 465 nm (Figura 1). Testare la saldatura collegando il LED a una fonte di alimentazione e accendendolo.
- Tagliare il fondo di 1 cm di un puntale per pipetta filtrato da 200 μl. Spingere il filtro verso l'esterno utilizzando un'asta di piccolo diametro. Inserire il micro-LED con i fili nel puntale della pipetta in modo che il LED sia a filo con l'estremità del puntale. Riposizionare il filtro nella parte superiore del puntale della pipetta per tenere in posizione il LED e i cavi, quindi incollare i bordi del LED al puntale della pipetta. Lascia asciugare la supercolla.
- Preparare l'elastomero siliconico combinando la base e l'agente indurente in un rapporto di 10:1 e mescolare bene. Eliminare eventuali bolle dal composto utilizzando una camera a vuoto o mediante centrifugazione.
- Prendi una provetta da centrifuga da 0,5 ml e incidi i lati per facilitare la rimozione del LED (il lubrificante può anche essere aggiunto all'interno della provetta qui, se lo si desidera). Fissare con nastro adesivo l'esterno del tubo per assicurarsi che non ci siano perdite. Versare circa 0,2 mL della miscela di elastomero siliconico nella provetta, quindi posizionare la punta della pipetta micro-LED nella provetta, lasciando almeno 1 mm di spazio tra il LED e il fondo della provetta. Se si sono formate delle bolle, picchiettare la provetta da centrifuga su una superficie dura per rimuoverle.
NOTA: Il puntale della pipetta può essere rivestito preventivamente con elastomero siliconico per ridurre la formazione di bolle durante il posizionamento del LED. - Posizionare la provetta da centrifuga micro-LED in posizione verticale in un forno da laboratorio o in un'incubatrice a 50 °C e lasciarla agire per almeno 8 ore o durante la notte. Indossare guanti resistenti al calore quando si interagisce con il forno. Una volta che l'elastomero si è indurito, rimuovere il LED dalla provetta da centrifuga. Se l'elastomero è ancora appiccicoso, rimettilo in forno.
- Una volta completamente indurito, rimuovere l'elastomero in eccesso dalla punta del LED con un taglierino di precisione, lasciando non più di 1 mm. Il corretto incapsulamento del LED ridurrà al minimo il riscaldamento del tessuto durante la fotostimolazione.
- Determinare la potenza ottica del LED utilizzando un misuratore di potenza ottica. Accendere il misuratore di potenza e regolare le impostazioni della lunghezza d'onda per leggere 465 nm. Posizionare il LED in linea con un sensore di potenza a fotodiodo e accendere il LED con il generatore di funzioni. Il misuratore di potenza ottica produrrà una lettura in watt. Calcolare l'irraggiamento dividendo la lettura della potenza per l'area della superficie illuminata (0,88 mm2).
NOTA: L'irraggiamento ideale deve essere di circa 2,4 mW/mm2 per un'attivazione appropriata di ChR211.
2. Preparazione sperimentale
- Allevare i topi in conformità con la pubblicazione precedente per esprimere ChR2 nei neuroni colinergici (ChAT-ChR2) o nei neuroni catecolaminergici (TH-ChR2)12 (Figura 2). Confermare l'espressione di TH-Cre o ChAT-Cre nei topi utilizzati per esperimenti utilizzando un approccio di genotipizzazione come descritto in precedenza12.
- Preparare almeno 225 mL di soluzione di Krebs-Henseleit (KH) (in mM: 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 glucosio) e filtrare utilizzando un filtro a membrana in nitrato di cellulosa da 0,2 μm. Regolare il pH a 7,4 quando ossigenato utilizzando il 95% di O2 e il 5% di CO2.
- Sciacquare il sistema di perfusione di Langendorff con acqua purificata prima dell'esperimento e rimuovere l'acqua in eccesso prima di iniziare l'esperimento.
- Aggiungere un filtro a membrana da 10 μm al sistema prima che il KH venga fatto circolare. Accendere i bagnomaria impostati per mantenere la temperatura del perfusato a 37 °C a velocità di flusso comprese tra 2-5 mL/min.
- Aggiungere 175 mL di KH al sistema di perfusione e iniziare la circolazione. Far bollire la soluzione con il 95% di O2 / 5% di CO2 per fornire un'adeguata ossigenazione.
NOTA: Il volume di circolazione KH varia da sistema a sistema a seconda delle dimensioni dei tubi e del serbatoio. - Calibrare il flussometro arrestando il flusso attraverso il sistema di perfusione con un rubinetto di arresto e premendo il pulsante zero sul flussometro.
- Prepara un software di acquisizione dati fisiologici come LabChart per avere 12 canali: temperatura del bagno cardiaco, temperatura del perfusato aortico, derivazioni ECG I-III più quattro derivazioni calcolate aggiuntive, calcolo della frequenza cardiaca, portata e uscita del generatore di funzioni per tracciare gli impulsi LED.
- Utilizzando il canale riservato alla frequenza cardiaca, è possibile calcolare la frequenza cardiaca in LabChart con la funzione di misurazione ciclica impostata per rilevare l'ECG del mouse sulla derivazione I. L'estensione dell'asse cardiaco di LabChart utilizza la derivazione I e la derivazione II per calcolare la derivazione III, aVR, aVL e aVF.
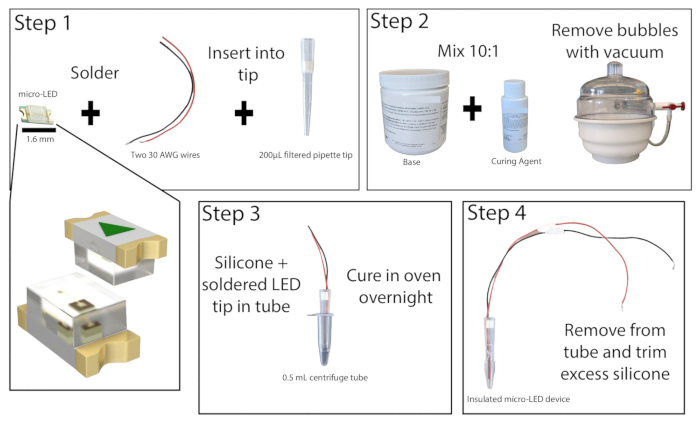
Figura 1: Costruzione di micro-LED. Panoramica semplificata dei passaggi per la costruzione di una sorgente luminosa micro-LED. Due fili vengono saldati al micro-LED e inseriti in un puntale per pipetta da 200 μl, quindi incollati in supercolla (passaggio 1). L'elastomero siliconico viene miscelato in un rapporto 10:1 e posto in una camera a vuoto per rimuovere le bolle (fase 2). L'elastomero siliconico viene versato in una provetta per microcentrifuga e il puntale della pipetta micro-LED viene inserito e lasciato indurire durante la notte (Passaggio 3). Il micro-LED isolato viene quindi rimosso dal tubo e il silicone in eccesso deve essere tagliato (passaggio 4). Clicca qui per visualizzare una versione più grande di questa figura.
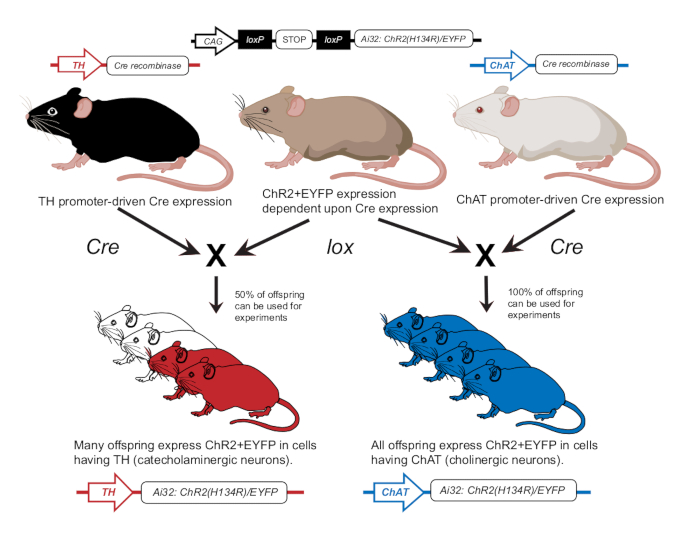
Figura 2: Schema di allevamento di topi transgenici. Un topo genitore con il gene ChR2 lox-dipendente viene incrociato con un altro topo con un promotore Cre. Un topo genitore con promotore della tirosina idrossilasi (TH) Cre produrrà una prole eterozigote in cui il 50% esprimerà ChR2 nelle cellule catecolaminergiche. Un topo genitore con promotore Cre della colina acetiltransferasi (ChAT) produrrà una prole omozigote in cui il 100% esprimerà ChR2 nelle cellule colinergiche. L'espressione è confermata dalla genotipizzazione. Questa cifra è stata modificata con il permesso di12. Clicca qui per visualizzare una versione più grande di questa figura.
3. Escissione e perfusione cardiaca
- Prima dell'escissione, somministrare 250 unità di eparina (circa 8 U/g) mediante iniezione intraperitoneale utilizzando una siringa da 1 ml. Attendere almeno 10 minuti prima dell'intervento.
- Metti un topo adulto in una camera di induzione dell'anestesia. Somministrare ~4% di isoflurano e attendere che la frequenza respiratoria rallenti e si approfondisca. Rimuovere il topo dalla camera e verificare la cessazione di un riflesso del dolore con il pizzico delle dita dei piedi prima di eseguire la lussazione cervicale.
- Tenere il processo xifoideo con un paio di pinze e tagliare la cavità addominale usando le forbici chirurgiche. Aprire la cavità toracica tagliando con cura il diaframma. Taglia le costole per esporre il cuore e i polmoni. Afferra delicatamente i polmoni e asporta il cuore e i polmoni.
- Metti il cuore in un piatto di KH eparinizzato. Rimuovere i polmoni e tutti i pezzi di grasso grossi. Posizionare il cuore pulito in unaseconda piastra di KH eparinizzato sotto un microscopio da dissezione impostato su un ingrandimento 2x. Localizzare l'aorta e farla scorrere sulla cannula utilizzando una pinza fine. Fissare il cuore a una cannula utilizzando una sutura di seta 4-0.
NOTA: L'incannulamento può essere eseguito sul ghiaccio per ridurre l'attività metabolica del cuore. - Lavare un'iniezione in bolo di KH eparinizzato attraverso la cannula per rimuovere il sangue dalle coronarie prima di essere posizionato sul sistema di perfusione.
- Collegare il cuore cannulato al sistema di perfusione e posizionarlo nel piatto PDMS riempito di perfusato. Posizionare gli elettrodi dell'ago ECG nel piatto PDMS secondo il triangolo di Einthoven13. Acclimatare il cuore per almeno 5 minuti.
- Ruota il cuore in modo che l'atrio sinistro sia accessibile e taglia un foro di ~1 mm nell'atrio sinistro con un paio di micro forbici ad apertura automatica. Inserire un tubo di 1 mm di diametro attraverso questa fetta nel ventricolo sinistro per rilasciare il perfusato intrappolato lì.
NOTA: Avere un microscopio da dissezione per guardare il cuore può migliorare la facilità di questo passaggio. - Ruotare il cuore in modo che l'artrite reumatoide sia rivolta verso l'alto e che il nodo senoatriale (SA) sia accessibile per l'illuminazione (Figura 3).
- Regolare gli elettrodi ECG secondo necessità avvicinandoli al cuore o immergendoli nel perfusato per ricevere i segnali con un rapporto segnale/rumore adeguato. Le impostazioni possono variare in base all'hardware e al software di acquisizione ECG utilizzati. Questo metodo utilizzava un modulo Goldberger di Einthoven con un guadagno di 2000 e un filtro di cut-off a 500 Hz, e le impostazioni del software includevano un filtro di rete e una frequenza di campionamento di 1000 Hz.
4. Attivazione optogenetica
- Collegare il dispositivo micro-LED a un generatore di funzioni impostato per produrre onde di impulso ai seguenti parametri: frequenza 10 Hz, larghezza dell'impulso 30 ms, ampiezzapp 10 V.
- Posizionare delicatamente il micro-LED sul nodo SA. Evitare di premere troppo forte con il micro-LED in quanto potrebbe causare una diminuzione della frequenza cardiaca e della funzione.
- Attiva il generatore di funzioni e misura le variazioni della frequenza cardiaca dovute alla fotostimolazione. Cambiamenti immediati nella frequenza cardiaca indicano un'attivazione efficace. L'attivazione catecolaminergica provoca un aumento esponenziale della frequenza cardiaca10, mentre l'attivazione colinergica provoca un calo immediato8.
- Spegnere il generatore di funzioni. Consentire alla frequenza cardiaca di tornare ai livelli pre-attivazione.
- Se l'attivazione optogenetica provoca una variazione della frequenza cardiaca inferiore a 100 bpm, riposizionare il micro-LED per illuminare meglio i neuroni dell'AR. Ripetere se necessario.
5. Procedura sperimentale e analisi dei dati
- Per verificare l'ipotesi che la stimolazione colinergica optogenetica intrinseca possa sopprimere l'attivazione beta-adrenergica esogena da parte della noradrenalina (NE), preparare soluzioni madre di 10 μM e 100 μM di NE in un alimento fumifero.
- Aggiungere una dose in bolo di NE al sistema di perfusione mediante una porta di iniezione. Una volta che l'aumento della frequenza cardiaca si stabilizza, accendi il micro-LED per ~10 s. Spegnere la luce e monitorare le variazioni della frequenza cardiaca.
- Dopo che la frequenza cardiaca è tornata al ritmo sinusale, aumentare la dose di NE e ripetere la stimolazione optogenetica. Continuare per ogni dose di NE.
- Al termine dello studio, chiudere le forniture di gas, rimuovere il cuore dal sistema e conservarlo in fissativo, se necessario.
- Sciacquare i serbatoi e i tubi del sistema di perfusione con acqua deionizzata o detergente, se necessario. Asciugare accuratamente il sistema per prevenire la formazione di muffa.
- Salva il file LabChart. Esporta il segnale della frequenza cardiaca e i canali ECG per l'analisi offline e la presentazione grafica.
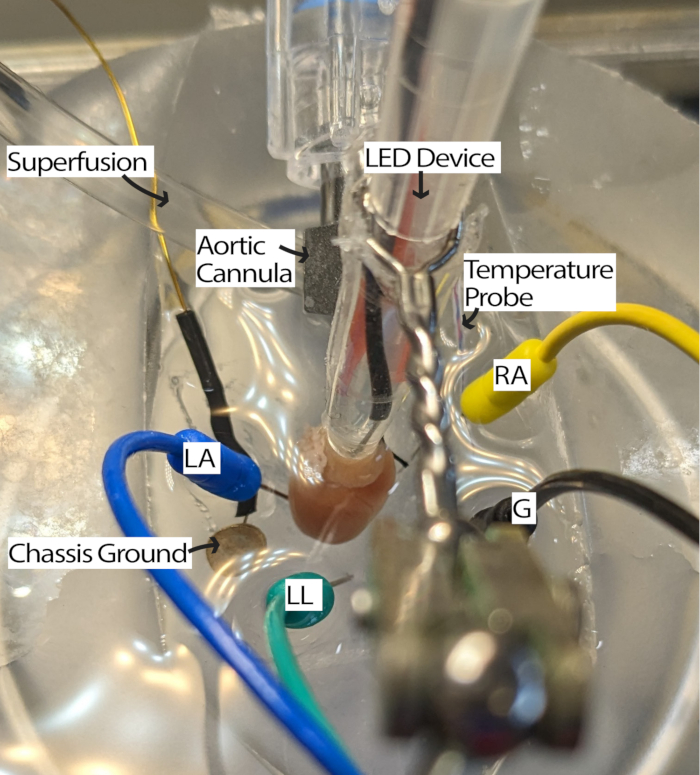
Figura 3: Configurazione del bagno cardiaco del topo. Un cuore di topo cannulato che mostra il posizionamento del dispositivo LED e degli elettrodi ECG. È presente una messa a terra del telaio per ridurre il rumore dell'elettronica circostante. Gli elettrodi ad ago ECG sono posizionati in base al triangolo di Einthoven. Abbreviazioni: LA = braccio sinistro; RA = braccio destro; LL = gamba sinistra; G = terra. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Un sistema di perfusione a pressione costante di Langendorff (Figura 4) dovrebbe essere in grado di mantenere una frequenza cardiaca di almeno 300 bpm per oltre un'ora se vengono mantenuti l'ossigenazione, la temperatura e il flusso coronarico appropriati. Con questa configurazione, la temperatura del perfusato aortico si basa sul flusso coronarico, quindi potrebbe essere necessario regolare le temperature del bagno d'acqua al variare della portata per mantenere la temperatura aortica a 37 °C. Le velocità del flusso coronarico cardiaco di topo variano in genere da 1,5 a 4,5 ml/min, a seconda delle dimensioni del cuore. Il mantenimento della temperatura del perfusato a 37 °C durante le fluttuazioni della portata è necessario per una funzione cardiaca costante ed è particolarmente importante per la perfusione a pressione costante. Il sistema di perfusione descritto è progettato per mantenere una pressione idrostatica di 70 mmHg attraverso l'altezza della colonna di perfusi. Ciò si ottiene con una velocità della pompa che fornisce un trabocco costante dal serbatoio superiore. Il perfusato può essere integrato con 20 μM di vasodilatatore cromakalin per migliorare e mantenere il flusso coronarico normale o sovranormale per garantire la completa ossigenazione del miocardio14.
La fotostimolazione dei neuroni colinergici nei cuori di topo ChAT-ChR2 a 10 Hz e 30 ms di larghezza dell'impulso dovrebbe provocare un calo quasi istantaneo della frequenza cardiaca. Un'efficiente fotostimolazione dei neuroni colinergici in cuori adeguatamente perfusi dovrebbe portare a una riduzione della frequenza cardiaca di almeno 100 bpm. La Figura 5 mostra un calo immediato di 75 bpm all'accensione del micro-LED che continua a scendere fino a raggiungere una diminuzione massima di 135 bpm. Entro mezzo secondo dallo spegnimento del micro-LED, la frequenza cardiaca aumenta a 175 bpm prima di tornare gradualmente ai livelli pre-stimolazione. Viene presentato un ECG a sei derivazioni per illustrare le differenze nell'intervallo RR prima, durante e dopo la stimolazione (Figura 5B). Le derivazioni aVR, aVL e aVF vengono calcolate nel software LabChart utilizzando le derivazioni I e II.
La fotostimolazione dei neuroni catecolaminergici nei cuori di topo TH-ChR2 provoca un cambiamento più graduale (esponenziale) della frequenza cardiaca rispetto alla fotostimolazione dei neuroni colinergici. Ciò è probabilmente causato dall'attivazione beta1-adrenergica che richiede il secondo sistema messaggero del cAMP che attiva PKA, che fosforila le proteine bersaglio, mentre l'attivazione muscarinica non lo fa. La Figura 6 mostra un aumento della frequenza cardiaca di 135 bpm nel corso di 10 s. Sono necessari altri 10 secondi dopo lo spegnimento della luce per tornare al normale ritmo sinusale. Se il micro-LED non è adeguatamente isolato, potrebbe riscaldare il cuore, causando un aumento della frequenza cardiaca. Questa risposta di riscaldamento è meno intensa della stimolazione TH-ChR2; Pertanto, la variazione della frequenza cardiaca è meno pronunciata.
Un'applicazione di questo protocollo consiste nell'utilizzare la stimolazione optogenetica per depolarizzare i neuroni, portando al rilascio di neurotrasmettitori endogeni e contemporaneamente aggiungendo neurotrasmettitori esogeni al perfusato. La Figura 7A illustra il rilascio endogeno di acetilcolina da un cuore di topo ChAT-ChR2 con una dose in bolo di NE aggiunta al perfusato. Senza la presenza di EN, la fotostimolazione ha causato un calo della frequenza cardiaca di oltre 100 bpm e ha mantenuto questo calo per tutta la durata della stimolazione. Mentre con una grande dose di NE (2000 nM), il calo massimo della frequenza cardiaca durante la fotostimolazione è stato di 40 bpm. La frequenza cardiaca ha iniziato immediatamente a salire, raggiungendo quasi i livelli di pre-stimolazione prima che la luce si spegnesse. Questo risultato indica che la soppressione optogenetica della frequenza cardiaca mediante fotostimolazione neuronale ChAT non è stata in grado di sopprimere completamente gli aumenti della frequenza cardiaca derivanti da un'alta dose di NE, causando un tempo più breve di soppressione della frequenza cardiaca e diminuzioni inferiori della frequenza cardiaca (Figura 7B). Questi risultati sono coerenti con il lavoro precedente in animali di grandi dimensioni che hanno dimostrato un blocco progressivo del nodo AV durante la stimolazione simultanea del nervo vagale e dei gangli stellati12,13.
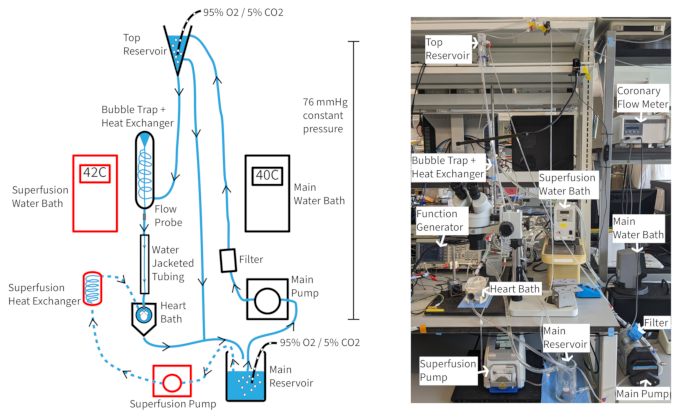
Figura 4: Configurazione sperimentale. Schema del sistema di perfusione. Le frecce mostrano la direzione di perfusazione. Il perfusato di superfusione è indicato da linee tratteggiate e i componenti sono delineati in rosso. Clicca qui per visualizzare una versione più grande di questa figura.
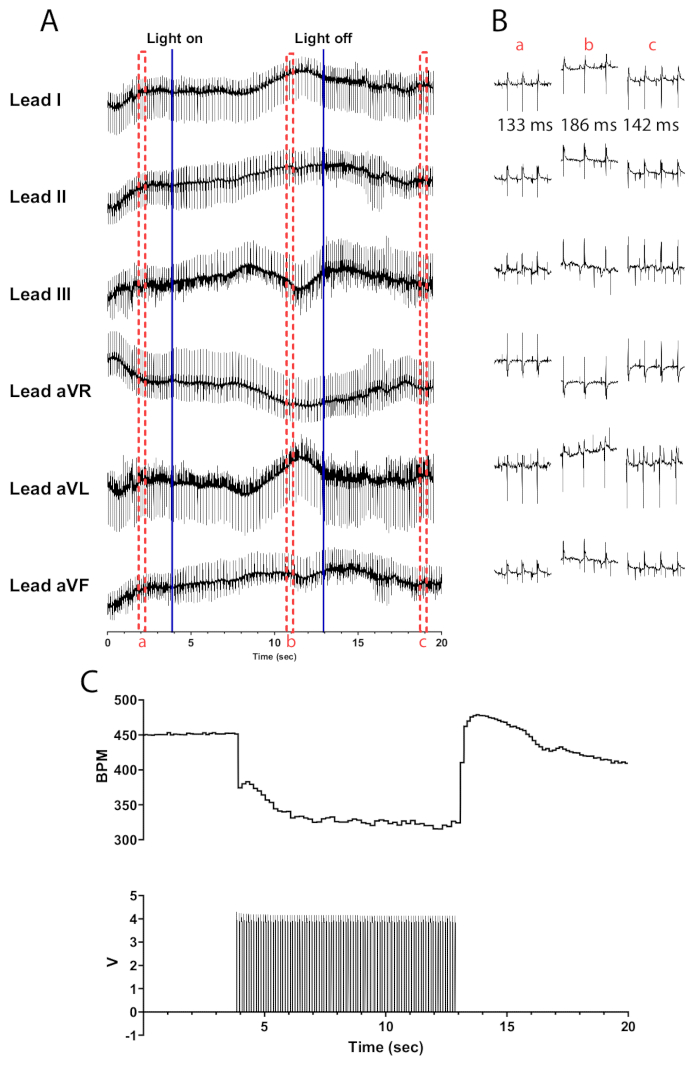
Figura 5: Risposta rappresentativa alla fotostimolazione colinergica. (A) Un ECG a 6 derivazioni durante l'attivazione optogenetica ChAT-ChR2. Le linee blu continue indicano che il micro-LED è in fase di accensione/spegnimento. Le caselle tratteggiate rosse indicano l'ora per gli snippet (B). (B) Frammenti di mezzo secondo del segnale ECG prima (a), durante (b) e dopo la fotostimolazione (c). L'intervallo RR viene visualizzato per ogni sezione. (C) La frequenza cardiaca (in alto) viene visualizzata insieme alle onde del polso da un generatore di funzioni (in basso). La frequenza cardiaca inizia a 450 bpm e scende a 315 bpm dopo 8 s di fotostimolazione prima di tornare a 410 bpm 7 s dopo la fine della fotostimolazione. Clicca qui per visualizzare una versione più grande di questa figura.
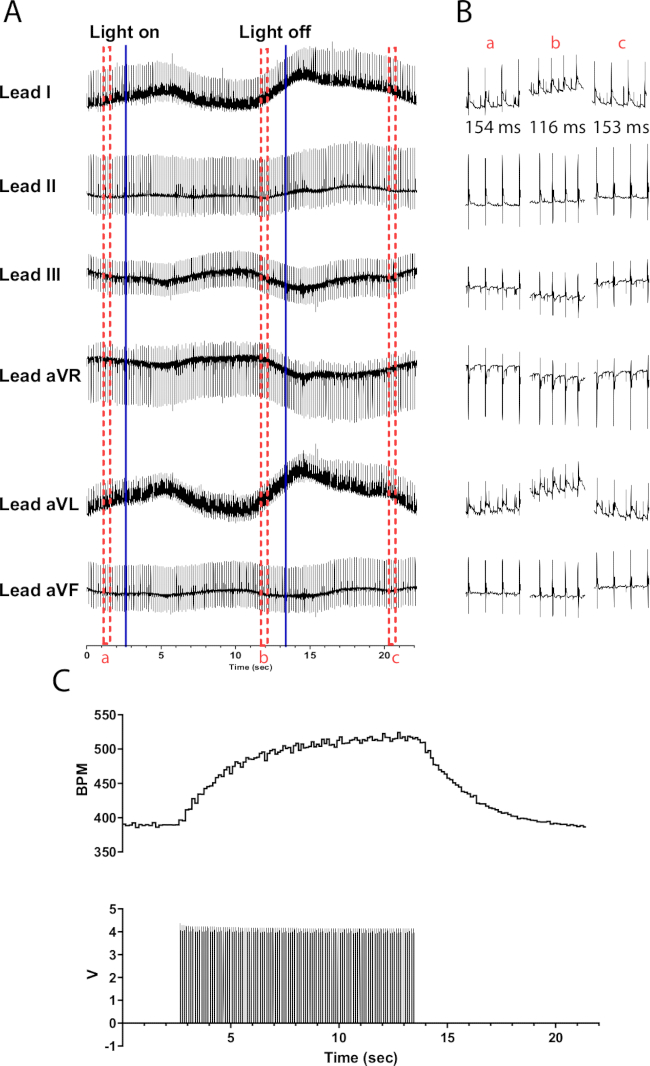
Figura 6: Risposta rappresentativa alla fotostimolazione catecolaminergica. (A) Un ECG a 6 derivazioni durante l'attivazione optogenetica TH-ChR2. Le linee blu continue indicano che il micro-LED è in fase di accensione/spegnimento. Le caselle tratteggiate rosse indicano l'ora per gli snippet (B). (B) Frammenti di mezzo secondo del segnale ECG prima (a), durante (b) e dopo la fotostimolazione (c). L'intervallo RR viene visualizzato per ogni sezione. (C) La frequenza cardiaca (in alto) viene visualizzata insieme alle onde del polso da un generatore di funzioni (in basso). La frequenza cardiaca inizia a 390 bpm e raggiunge il picco a 525 bpm dopo 10 s di fotostimolazione prima di tornare a 390 bpm 8 s dopo la fine della fotostimolazione. Clicca qui per visualizzare una versione più grande di questa figura.
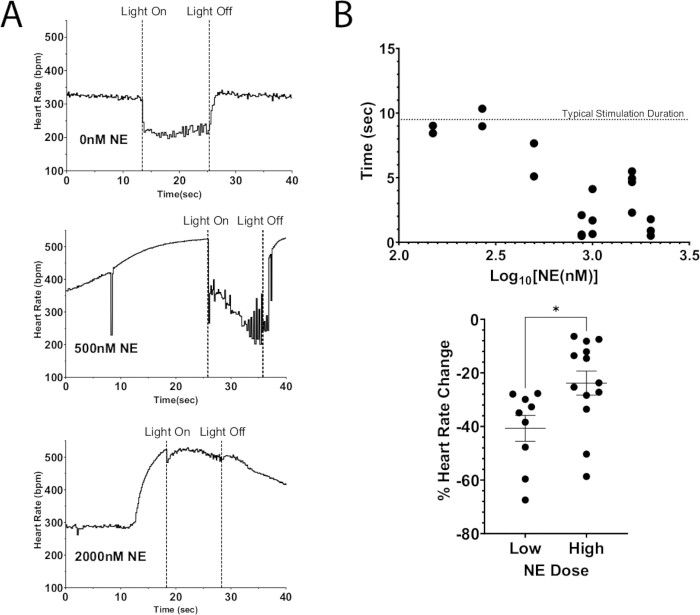
Figura 7: Fotostimolazione colinergica con EN esogena. (A) Risposta della frequenza cardiaca durante la fotostimolazione ChAT-ChR2 con dosi crescenti di NE aggiunte per perfusare. Una volta che la frequenza cardiaca ha raggiunto un aumento massimo dovuto a NE, il micro-LED è stato acceso per circa 10 s. La soppressione della frequenza cardiaca era ancora possibile ad alte dosi di NE, ma la durata della stimolazione diminuiva all'aumentare della dose. (B) La quantità di tempo in cui la frequenza cardiaca è rimasta soppressa. Tempi più vicini a 10 s generalmente rimanevano soppressi per l'intera durata della stimolazione. (C) Il calo della frequenza cardiaca durante la fotostimolazione è stato meno grave a dosi più elevate di NE rispetto a dosi basse. Dosi basse hanno comportato una diminuzione media della frequenza cardiaca del 40%, mentre dosi più elevate sono diminuite solo del 25%. È stato eseguito un t-test non accoppiato per valutare la significatività statistica. Presentato come errore standard della media * p < 0,05. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La stimolazione optogenetica dei neuroni autonomici cardiaci intrinseci ha prodotto livelli di risposta della frequenza cardiaca paragonabili a quelli della stimolazione elettrica del nervo vago o dei gangli stellati14,15. La stimolazione elettrica dei cuori perfusi asportati, tuttavia, manca del vantaggio di essere in grado di colpire facilmente specifiche popolazioni di neuroni. L'attivazione farmacologica offre il vantaggio di mirare a recettori specifici, ma non ha specificità spaziale e il tempo di risposta dipende dalla velocità del flusso coronarico. L'attivazione optogenetica offre il vantaggio di una risposta quasi istantanea, il targeting delle popolazioni neuronali e la capacità di modificare il livello di fotostimolazione16. In questo protocollo, abbiamo anche spiegato come costruire una sorgente luminosa semplice e a basso costo per la fotostimolazione dei neuroni cardiaci intrinseci.
Lo sviluppo di un'ulteriore comprensione dell'impatto del sistema nervoso intracardiaco faciliterà una migliore diagnosi e trattamento delle malattie cardiovascolari. L'espressione selettiva di ChR2 consente di testare nuove ipotesi relative all'attività di specifiche popolazioni nervose durante la malattia. Le popolazioni nervose in tutto il cuore potrebbero essere interrogate in questo modo, come i gangli cardiaci intrinseci intorno alle vene polmonari o in tutti i ventricoli. Ad esempio, in modelli murini di infarto miocardico, la fotostimolazione dei neuroni autonomici intrinseci potrebbe essere utile per interrogare i cambiamenti elettrofisiologici nel tessuto della zona di confine mentre l'infarto evolve e i neuroni subiscono la transdifferenziazione17. In questo protocollo, descriviamo un altro esempio che coinvolge esperimenti controllati di risposte cardiache acute all'attivazione simultanea di vie colinergiche e catecolaminergiche in cui la combinazione di agenti optogenetici e farmacologici consente di esaminare risposte di dose uniche. Questa attivazione concomitante è un fenomeno associato all'annegamento, noto come conflitto autonomo, che deve ancora essere completamente chiarito18. Inoltre, date appropriate combinazioni di luce, colorante e filtro, questo protocollo può essere combinato con la mappatura ottica cardiaca per studiare gli effetti acuti della stimolazione dei neuroni autonomici sull'elettrofisiologia cardiaca e sui meccanismi di aritmia neuro-cardiaca 19,20,21.
Ci sono diversi concetti importanti da considerare quando si utilizza questo protocollo per studiare il sistema nervoso cardiaco intrinseco nei cuori perfusi asportati. I cuori dei topi sono sensibili a lievi cambiamenti nell'ambiente di perfusione. Il monitoraggio attento della frequenza cardiaca è utile per identificare i problemi di perfusione coronarica che possono causare bassa ossigenazione del miocardio, ischemia e scarsa funzionalità cardiaca. Il protocollo raccomanda di ossigenare il perfusato sia nel serbatoio principale che in quello superiore per limitare potenziali problemi. L'immersione completa del tubo di ossigenazione aiuta a garantire livelli ottimali di ossigeno nel perfusato. Una torcia a raggi ultravioletti può essere puntata sul cuore per rivelare la fluorescenza del NADH che indica ipossia/ischemia e l'ossigenazione può essere regolata di conseguenza19,20. La temperatura del perfusato dipende dalla portata coronarica durante la perfusione a pressione costante. Se la velocità del flusso coronarico diminuisce, la temperatura del perfusato aortico può anche diminuire a causa del raffreddamento nel tubo prossimale alla cannula aortica, con conseguente riduzione della frequenza cardiaca. Aumentare la temperatura del bagnomaria perfusato può aiutare a invertire questo problema. Questo protocollo utilizza anche un circuito di superfusione per mantenere una temperatura del bagno cardiaco di 37 °C. I cali della temperatura del bagno cardiaco possono richiedere un aumento della portata di superfusione. Il micro-LED è un'altra fonte di potenziali cambiamenti nella temperatura cardiaca perché la temperatura dell'artrite reumatoide potrebbe aumentare durante la fotostimolazione. Se l'elastomero siliconico che avvolge il dispositivo è troppo sottile, il micro-LED potrebbe riscaldarsi e riscaldare il nodo SA, provocando un aumento inaspettato della frequenza cardiaca. Testare la sorgente luminosa micro-LED su un cuore di tipo selvatico può essere utile per misurare i livelli di riscaldamento. Il micro-LED non deve causare un aumento della frequenza cardiaca superiore al 10% in 30 s. In tal caso, l'elastomero siliconico deve essere sostituito.
L'obiettivo degli esperimenti sul cuore perfuso ex vivo è quello di ricreare condizioni fisiologiche vicine con variabili controllabili, ma presentano limitazioni22. Il perfusato cristalloide è lo standard per questi esperimenti; tuttavia, può limitare l'apporto di ossigeno ai mitocondri in condizioni di forte stress23,24. Inoltre, il perfusato manca di ormoni circolanti che si troverebbero naturalmente in vivo. Un'ulteriore limitazione è che l'intensità della luce variabile e il posizionamento del micro-LED possono causare disparità locali nella stimolazione neurale, quindi sono sempre necessari alcuni aggiustamenti nel posizionamento del micro-LED sopra il cuore prima di iniziare un protocollo sperimentale.
In sintesi, questo protocollo illustra un approccio ex vivo per la stimolazione optogenetica specifica di neuroni cardiaci in cuori di topo perfusi. È stata costruita una sorgente luminosa micro-LED per stimolare i neuroni dell'atrio destro. Un'applicazione di questo approccio ha combinato il rilascio intrinseco di acetilcolina durante l'attivazione optogenetica di un cuore di topo ChAT-ChR2 contemporaneamente all'aumento di NE esogeno. Sono state presentate le variazioni risultanti nella frequenza cardiaca durante l'attivazione simultanea catecolaminergica e colinergica. Questo protocollo descrive un valido approccio sperimentale per studiare la cinetica dell'improvvisa attivazione intrinseca dei neuroni autonomici nei cuori perfusi e le interazioni tra attività colinergica cardiaca e catecolaminergica.
Divulgazioni
Nessun conflitto di interessi da dichiarare.
Riconoscimenti
Questo lavoro è stato supportato da NIH R01 HL144157 a MWK, NIH R01 HL144157 a EE e MWK e NIH R01 HL147279 e HL146169 a MWK e DM e da una Collins Distinguished Doctoral Fellowship a RR.
Materiali
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Riferimenti
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon