Method Article
הפעלה אופטוגנטית של נוירונים אוטונומיים לבביים פנימיים בלבבות עכברים שנכרתו
In This Article
Summary
פרוטוקול זה מדגים שיטה לגירוי אופטוגנטי של נוירונים לבביים פנימיים בלבבות עכברים טרנסגניים. הגישה המתוארת משמשת לחקירת הקינטיקה של הפעלה פתאומית של נוירונים לבביים בלבבות ex vivo ויחסי הגומלין בין פעילות כולינרגית לפעילות קטכולמינרגית.
Abstract
איזון של הפעלה כולינרגית וקטכולמינרגית הכרחי לשמירה על בריאות הלב. חקירת האינטראקציה בין מסלולים אלה יכולה להיעשות באמצעות אופטוגנטיקה באמצעות ביטוי סלקטיבי של channelrhodopsin-2 (ChR2) בנוירונים אוטונומיים לבביים. יישומים לבביים כאלה של אופטוגנטיקה מאפשרים לחקור את השחרור הפנימי של נוירוטרנסמיטורים בצורה מרחבית-זמנית. שיטה זו מדגימה גישה ex vivo לגירוי אופטוגנטי ספציפי של נוירונים לבביים בלבבות עכברים מפוצצים. עכברים טרנסגניים גודלו כדי לבטא ChR2 בתאי עצב של כולין אצטיל טרנספראז (ChAT) או טירוזין הידרוקסילאז (TH) בכל הגוף. מיקרו-LED (465 ננומטר) עטוף באלסטומר סיליקון הוכן לגירוי הנוירונים של הפרוזדור הימני המעצבבים את הצומת הסינו-פרוזדור. המיקרו-LED חובר למחולל פונקציות שהוגדר לגלי דופק ב-10 הרץ עם רוחב דופק של 30 אלפיות השנייה. לבבות עם ביטוי מאושר נכרתו והוחדרו לאחור על מערכת לנגנדורף המזרימה תמיסת קרבס-הנסלייט. אלקטרוקרדיוגרמה (ECG), טמפרטורה וקצב זרימה כלילית תועדו באמצעות תוכנת LabChart. לאחר שהלב התייצב, המיקרו-LED הונח על האטריום הימני ונבדק לתגובת דופק אופטימלית. יישום של גישה זו משלב שחרור פנימי של נוירוטרנסמיטר כולינרגי (אצטילכולין) במהלך הפעלה אופטוגנטית של לב עכבר ChAT-ChR2 במקביל להגדלת המוליך העצבי הקטכולאמינרגי האקסוגני (נוראדרנלין) שנוסף לפרפוזה. מוצגים השינויים הנובעים מכך בקצב הלב במהלך ההפעלה הכולינרגית והקטכולמינרגית בו זמנית. שיטה זו מתארת גישה ניסויית רבת ערך לחקירת הקינטיקה של הפעלת נוירונים אוטונומיים פנימיים פתאומיים בלבבות מפוצצים והאינטראקציות בין פעילות כולינרגית ללב וקטכולמינרגית.
Introduction
אופטוגנטיקה היא שיטה להחדרת חלבונים רגישים לאור (אופסינים) לאוכלוסיות תאים ממוקדות. זה מאפשר אפנון מרחבי-זמני של תאים ורקמות ספציפיים שלא ניתן להשיג באמצעים חשמליים או כימיים1. יישומים לבביים של אופטוגנטיקה הפכו פופולריים יותר ויותר במהלך 15 השנים האחרונות2. פוטוסטימולציה של אופסינים מעוררים כגון channelrhodopsin-2 (ChR2), קטיון, במיוציטים או נוירונים לבביים גורמת לדפולריזציה תאית, הגורמת לשינויים בקצב הלב3. ישנן שתי דרכים לבטא באופן סלקטיבי אופסינים באוכלוסיות תאים באמצעות גישת Cre-lox: התמרה ויראלית4 והכלאה של בעלי חיים טרנסגניים5. ביטוי סלקטיבי של ChR2 בנוירונים אוטונומיים ספציפיים יכול להתבצע על ידי הכלאה כדי ליצור צאצאים המבטאים ChR2 בנוירונים כולינרגיים או קטכולמינרגיים באמצעות מקדמים ספציפיים לתא6. הורה אחד עם גן ChR2 פלוקסי יכול להזדווג עם הורה המבטא Cre recombinase בשליטת מקדם כגון טירוזין הידרוקסילאז (TH, נוירונים קטכולמינרגיים) או כולין אצטילטרנספראז (ChAT, נוירונים כולינרגיים). לאחר מכן הצאצאים מבטאים ChR2 בתאי עצב TH או ChAT בכל הגוף7.
ניתן לחקור את התגובה התפקודית של הלב להפעלה חריפה של נוירונים אוטונומיים באמצעות ביטוי מונע מקדם של ChR2 בתוך אוכלוסיות עצביות ספציפיות, למשל נוירונים כולינרגיים או קטכולמינרגיים. ניתן לשנות את מרווח הדופק והעוצמה של גירוי פוטו כדי לשלוט בקצב הדפולריזציה של אותם נוירונים המבטאים ChR2 כדי לחקור כיצד רמות ההפעלה העצבית מווסתות את תפקוד הלב8. עבור שיטה זו, נוירונים ישמשו להתייחסות לכל גופי התא, האקסונים ו/או הקרנות אקסונליות המופעלות באופן אופטוגנטי לשם הפשטות. אפשר גם לשלב גירוי פוטו עם הפעלה כימית על ידי הכנסת תרופות או נוירוטרנסמיטורים כדי לחקור השפעות בו זמנית על קצב הלב והתכווצות9. לדוגמה, ניתן לשלב גירוי כולינרגי אופטוגנטי עם הזרקת נוראדרנלין אקסוגני (NE) כדי לבחון את ההשפעה של הפעלה אוטונומית במקביל בלב. לביצוע מחקרים כאלה באמצעות לבבות מבודדים יש יתרון בכך שהוא מספק פלטפורמה ניסויית מבוקרת היטב לחקר שינויים תפקודיים הנגרמים על ידי פוטו-אקטיבציה10. ניתן לעקוב אחר שינויים במורפולוגיה של א.ק.ג, קצב הלב וקצב הזרימה הכלילית תוך שליטה הדוקה על הטמפרטורה, החמצון ולחץ הזלוף.
מטרת פרוטוקול זה היא להציג גישה ניסיונית להפעלת אוכלוסייה ספציפית של נוירונים אוטונומיים בלבבות עכברים כדי לחקור שינויים בקצב הלב. כמו כן מוצג הבנייה והשימוש במכשיר מיקרו-LED להפעלה אופטוגנטית בלבבות מפוצצים. לבבות מעכברים המבטאים ChR2 בתאי עצב כולינרגיים או קטכולמינרגיים נכרתו והוחדרו רטרוגרדית עם תמיסת קרבס-הנסלייט מחומצנת בלחץ קבוע. ChR2 המתבטא בתאי העצב של הפרוזדור הימני (RA) עבר פוטוסטימולציה בקצב דופק של 10 הרץ עם רוחב פולס של 30 אלפיות השנייה. הדופק המיידי חושב באמצעות מרווח RR וניטר שינויים במהלך גירוי האור. מתואר גם ניסוי לדוגמה לחקר קינטיקה של קצב הלב במהלך גירוי פוטו-גירוי של נוירון ChAT אופטוגנטי פנימי במקביל להפעלה בטא-אדרנרגית באמצעות נוראדרנלין אקסוגני.
Protocol
כל הפרוטוקולים לבעלי חיים אושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של אוניברסיטת ג'ורג' וושינגטון ועקבו אחר המדריך של המכון הלאומי לבריאות לטיפול ושימוש בחיות מעבדה.
1. בניית מקור אור מיקרו-LED
- תחת מיקרוסקופ מנתח באזור מאוורר היטב, הלחמו את הקצוות המופשטים של שני חוטי נחושת מבודדים, באורך של 20 ס"מ לפחות, לנקודות המגע של מיקרו-LED 465 ננומטר (איור 1). בדוק את ההלחמה על ידי חיבור הנורית למקור חשמל והפעלתה.
- חותכים את החלק התחתון של 1 ס"מ של קצה פיפטה מסונן של 200 מיקרוליטר. דחוף את המסנן החוצה באמצעות מוט בקוטר קטן. הכנס את המיקרו-LED עם חוטים לקצה הפיפטה כך שהנורית תהיה צמודה עם קצה הקצה. החזר את המסנן בחלק העליון של קצה הפיפטה כדי להחזיק את הנורית והחוטים במקומם, ולאחר מכן הדבק את שולי ה-LED לקצה הפיפטה. הניחו לדבק-העל להתייבש.
- הכן אלסטומר סיליקון על ידי שילוב הבסיס וחומר הריפוי ביחס של 10:1 וערבב היטב. הסר את כל הבועות מהתערובת באמצעות תא ואקום או על ידי צנטריפוגה.
- קח צינור צנטריפוגה של 0.5 מ"ל וציין את הצדדים כדי להקל על הסרת הנורית (ניתן להוסיף כאן חומר סיכה גם לחלק הפנימי של הצינור אם תרצה). הדביקו את החלק החיצוני של הצינור כדי להבטיח שלא תהיה דליפה. יוצקים כ-0.2 מ"ל מתערובת אלסטומר הסיליקון לתוך הצינור ולאחר מכן מניחים את קצה הפיפטה של המיקרו-LED לתוך הצינור, ומשאירים לפחות 1 מ"מ מרווח בין ה-LED לתחתית הצינור. אם נוצרו בועות, הקש על צינור הצנטריפוגה על משטח קשה כדי לעקור אותן.
הערה: ניתן לצפות את קצה הפיפטה מראש באלסטומר סיליקון כדי להפחית את היווצרות הבועות בעת הנחת הנורית. - הנח את צינור הצנטריפוגה מיקרו-LED זקוף בתנור מעבדה או חממה של 50 מעלות צלזיוס והשאיר למשך 8 שעות לפחות או לילה. ללבוש כפפות עמידות בחום בעת אינטראקציה עם התנור. לאחר שהאלסטומר מתקשה, הסר את הנורית מצינור הצנטריפוגה. אם האלסטומר עדיין דביק, החזירו אותו לתנור.
- לאחר ריפוי מלא, הסר את כל עודפי האלסטומר מקצה ה-LED בעזרת סכין שירות מדויקת, והשאיר לא יותר מ-1 מ"מ. עטיפה נכונה של ה-LED תמזער את חימום הרקמה במהלך גירוי האור.
- קבע את ההספק האופטי של ה-LED באמצעות מד מתח אופטי. הפעל את מד הכוח והתאם את הגדרות אורך הגל לקריאת 465 ננומטר. הנח את הנורית בקו אחד עם חיישן כוח פוטו-דיודה והפעל את הנורית עם מחולל הפונקציות. מד הכוח האופטי יפיק קריאה בוואט. חשב קרינה על ידי חלוקת קריאת ההספק בשטח המשטח המואר (0.88 מ"מ2).
הערה: הקרינה האידיאלית צריכה להיות כ-2.4 mW/mm2 להפעלה מתאימה של ChR211.
2. הכנה לניסויים
- לגדל עכברים בהתאם לפרסומים קודמים כדי לבטא ChR2 בנוירונים כולינרגיים (ChAT-ChR2) או בנוירונים קטכולמינרגיים (TH-ChR2)12 (איור 2). אשר ביטוי של TH-Cre או ChAT-Cre בעכברים המשמשים לניסויים באמצעות גישת גנוטיפ כפי שתואר קודם לכן12.
- הכן לפחות 225 מ"ל של תמיסת Krebs-Henseleit (KH) (במ"מ: 118 NaCl, 4.7 KCl, 1.25 CaCl2, 0.57 MgSO4, 25 NaHCO3, 1.17 KH2PO4, 6 גלוקוז) וסנן באמצעות מסנן קרום תאית חנקתי 0.2 מיקרומטר. התאם את ה-pH ל-7.4 כאשר הוא מחומצן באמצעות 95% O2 ו-5% CO2.
- שטפו את מערכת הזלוף של לנגנדורף במים מטוהרים לפני הניסוי והסירו עודפי מים לפני תחילת הניסוי.
- הוסף מסנן ממברנה של 10 מיקרומטר למערכת לפני הפצת KH כלשהו. הפעל את אמבטיות המים המוגדרות כדי לשמור על טמפרטורת הפרפוזה על 37 מעלות צלזיוס בקצבי זרימה בין 2-5 מ"ל לדקה.
- הוסף 175 מ"ל KH למערכת הזלוף והתחל במחזור. מבעבעים את התמיסה עם 95% O2 / 5% CO2 כדי לספק חמצון מתאים.
הערה: נפח זרימת KH ישתנה ממערכת למערכת בהתאם לגדלי הצינורות והמאגרים. - כייל את מד הזרימה על ידי עצירת הזרימה דרך מערכת הזלוף עם תא עצירה ולחיצה על כפתור האפס במד הזרימה.
- הכן תוכנה לרכישת נתונים פיזיולוגיים כגון LabChart שתכלול 12 ערוצים: טמפרטורת אמבט לב, טמפרטורת פרפוזה אבי העורקים, מובילי א.ק.ג I-III בתוספת ארבעה מוליכים ממוחשבים נוספים, חישוב דופק, קצב זרימה ופלט מחולל פונקציות למעקב אחר פולסי LED.
- באמצעות הערוץ השמור לדופק, חשב את הדופק ב-LabChart עם תכונת המדידות המחזוריות המוגדרת לזיהוי א.ק.ג של עכבר ב-Lead I. הרחבת ציר הלב של LabChart משתמשת ב-Lead I ו-Lead II כדי לחשב את Lead III, aVR, aVL ו-aVF.
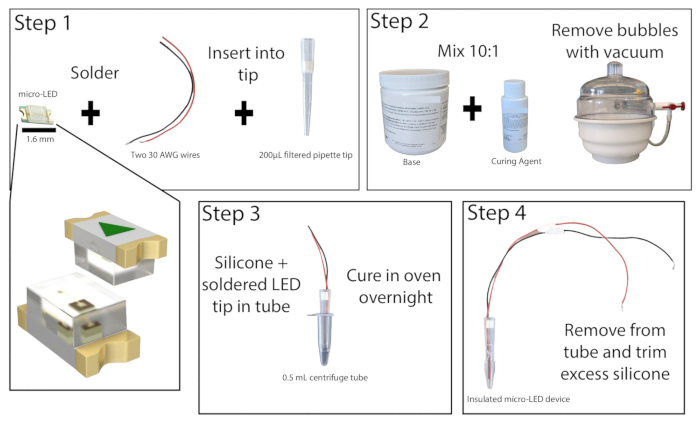
איור 1: מבנה מיקרו-LED. סקירה פשוטה של שלבים לבניית מקור אור מיקרו-LED. שני חוטים מולחמים למיקרו-LED ומוכנסים לקצה פיפטה של 200 מיקרוליטר, ואז מודבקים (שלב 1). אלסטומר סיליקון מעורבב ביחס של 10:1 ומונח בתא ואקום להסרת בועות (שלב 2). אלסטומר הסיליקון מוזג לתוך צינור מיקרוצנטריפוגה, וקצה הפיפטה של המיקרו-LED מוחדר ומניח לו להתרפא למשך הלילה (שלב 3). לאחר מכן מסירים את המיקרו-LED המבודד מהצינור, ויש לקצץ עודפי סיליקון (שלב 4). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
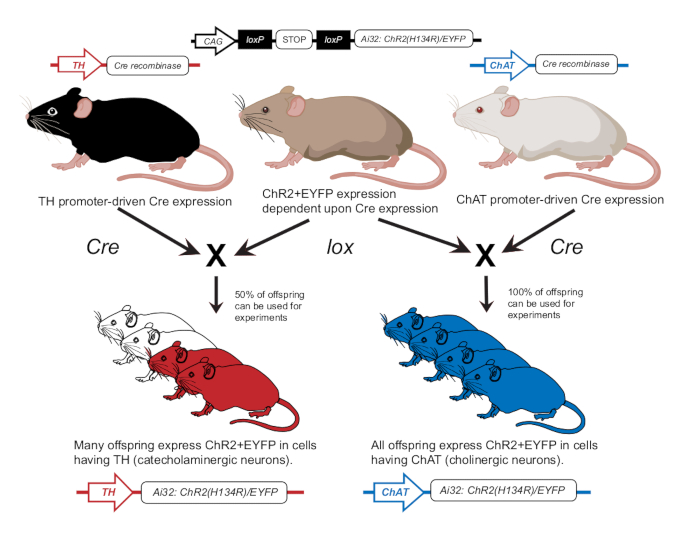
איור 2: תוכנית גידול עכברים טרנסגניים. עכבר הורה עם הגן ChR2 התלוי בלוקס עובר הכלאה עם עכבר אחר עם מקדם Cre. עכבר הורה עם מקדם טירוזין הידרוקסילאז (TH) Cre יפיק צאצאים הטרוזיגוטיים כאשר 50% יבטאו ChR2 בתאים קטכולמינרגיים. עכבר הורה עם מקדם כולין אצטיל טרנספראז (ChAT) Cre יפיק צאצאים הומוזיגוטיים כאשר 100% יבטאו ChR2 בתאים כולינרגיים. הביטוי מאושר באמצעות גנוטיפ. נתון זה שונה באישורמ-12. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. כריתת לב וזלוף
- לפני הכריתה, יש לתת 250 יחידות של הפרין (כ-8 U/g) בהזרקה תוך צפקית באמצעות מזרק של 1 מ"ל. יש להמתין לפחות 10 דקות לפני הניתוח.
- הנח עכבר בוגר בתא אינדוקציה להרדמה. יש לתת ~4% איזופלורן ולהמתין עד שקצב הנשימה יואט ויעמיק. הסר את העכבר מהתא וודא את הפסקת רפלקס הכאב על ידי צביטה בבוהן לפני ביצוע פריקת צוואר הרחם.
- החזק את תהליך ה-xiphoid עם זוג מלקחיים וחתוך לתוך חלל הבטן בעזרת מספריים כירורגיים. פתח את חלל בית החזה על ידי חיתוך בזהירות דרך הסרעפת. חותכים את הצלעות כדי לחשוף את הלב והריאות. תפסו בעדינות את הריאות והוציאו את הלב והריאות.
- מניחים את הלב בצלחת של KH הפריני. הסר את הריאות וכל חתיכות השומן הגדולות. מניחים את הלב הנקיבצלחת 2 של KH הפריני תחת מיקרוסקופ מנתח המוגדר להגדלה פי 2. אתר את אבי העורקים והחלק אותו על הצינורית באמצעות מלקחיים עדינים. אבטח את הלב לצינורית באמצעות תפר משי 4-0.
הערה: ניתן לבצע קנולציה על קרח כדי להפחית את הפעילות המטבולית של הלב. - שטוף זריקת בולוס של KH הפריני דרך הצינורית כדי להסיר דם מהכליליים לפני הנחתו על מערכת הזלוף.
- חבר את הלב המשונן למערכת הזלוף והנח אותו בצלחת PDMS מלאה בפרפוזה. הנח אלקטרודות מחט א.ק.ג לתוך צלחת ה-PDMS לפי המשולש של איינטהובן13. התאקלמו בלב למשך 5 דקות לפחות.
- סובב את הלב כך שהאטריום השמאלי יהיה נגיש וחתוך חור של ~1 מ"מ באטריום השמאלי בעזרת מספריים מיקרו לפתיחה עצמית. הכנס צינור בקוטר 1 מ"מ דרך פרוסה זו לחדר השמאלי כדי לשחרר פרפוזה הכלואה שם.
הערה: מיקרוסקופ מנתח כדי להסתכל על הלב עשוי לשפר את הקלות של שלב זה. - סובבו את הלב כך שה-RA פונה כלפי מעלה, והצומת הסינו-פרוזדורי (SA) יהיה נגיש להארה (איור 3).
- התאם את אלקטרודות האק"ג לפי הצורך על ידי הזזת אלקטרודות קרוב יותר ללב או טבילתן בפרפוזה כדי לקבל את האותות עם יחס אות לרעש מתאים. ההגדרות עשויות להשתנות בהתאם לחומרה ולתוכנה של רכישת אק"ג שבשימוש. שיטה זו השתמשה במודול איינתהובן גולדברגר עם הגבר של 2000 ומסנן ניתוק של 500 הרץ, והגדרות התוכנה כללו מסנן רשת ותדר דגימה של 1000 הרץ.
4. הפעלה אופטוגנטית
- חבר את מכשיר המיקרו-LED למחולל פונקציות המוגדר להפקת גלי דופק בפרמטרים הבאים: תדר 10 הרץ, רוחב דופק של 30 אלפיות השנייה, משרעת10V pp .
- הנח את המיקרו-LED בעדינות על צומת ה-SA. הימנע מלחיצה חזקה מדי עם המיקרו-LED מכיוון שהיא עלולה לגרום לירידה בקצב הלב ובתפקוד.
- הפעל את מחולל הפונקציות ומדוד את השינויים בקצב הלב מגירוי אור. שינויים מיידיים בקצב הלב מצביעים על הפעלה יעילה. הפעלה קטכולמינרגית גורמת לעלייה אקספוננציאלית בקצב הלב10, בעוד שהפעלה כולינרגית גורמת לירידה מיידית8.
- כבה את מחולל הפונקציות. אפשר לקצב הלב לחזור לרמות שלפני ההפעלה.
- אם הפעלה אופטוגנטית גורמת לשינוי דופק של פחות מ-100 פעימות לדקה, מקם מחדש את המיקרו-LED כדי להאיר טוב יותר את הנוירונים של ה-RA. חזור על הפעולה לפי הצורך.
5. הליך ניסויי וניתוח נתונים
- כדי לבחון את ההשערה שגירוי כולינרגי אופטוגנטי פנימי יכול לדכא הפעלה אקסוגנית של בטא-אדרנרגי על ידי נוראדרנלין (NE), הכינו תמיסות מלאי של 10 מיקרומטר ו-100 מיקרומטר של NE במזון אדים.
- הוסף מנת בולוס של NE למערכת הזלוף על ידי יציאת הזרקה. לאחר שקצב הלב עולה במישור, הפעל את המיקרו-LED למשך ~10 שניות. כבה את האור ועקוב אחר שינויים בדופק.
- לאחר שקצב הלב חוזר לקצב הסינוס, הגדילו את המינון של NE וחזרו על הגירוי האופטוגנטי. יש להמשיך עבור כל מנה של NE.
- בסיום המחקר יש לכבות את אספקת הגז, להוציא את הלב מהמערכת ולשמר אותו בקיבוע, לפי הצורך.
- שטפו את מאגרי מערכת הזילוף והצינורות במי DI או בחומר ניקוי לפי הצורך. יבש את המערכת היטב כדי למנוע טחב.
- שמור את קובץ LabChart. ייצא את אות הדופק וערוצי האק"ג לניתוח לא מקוון והצגה גרפית.
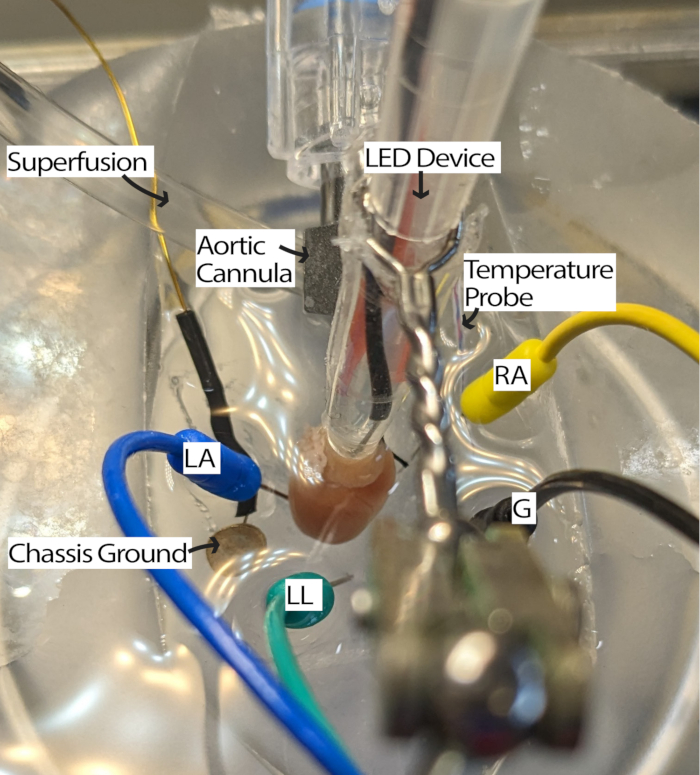
איור 3: תצורת אמבט לב עכבר. לב עכבר מגולגל המציג מיקום של מכשיר LED ואלקטרודות א.ק.ג. הארקת שלדה קיימת כדי להפחית את הרעש מהאלקטרוניקה שמסביב. אלקטרודות מחט א.ק.ג ממוקמות על בסיס המשולש של איינטהובן. קיצורים: LA = זרוע שמאל; RA = זרוע ימין; LL = רגל שמאל; G = קרקע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
מערכת זלוף בלחץ קבוע של לנגנדורף (איור 4) אמורה להיות מסוגלת לשמור על קצב לב של עכבר של לפחות 300 פעימות לדקה במשך הרבה יותר משעה אם נשמרים חמצון, טמפרטורה וזרימה כלילית מתאימים. עם הגדרה זו, טמפרטורת הפרפוזה של אבי העורקים מסתמכת על זרימה כלילית, כך שייתכן שיהיה צורך להתאים את טמפרטורות אמבט המים כאשר קצב הזרימה משתנה כדי לשמור על טמפרטורת אבי העורקים על 37 מעלות צלזיוס. קצב הזרימה הכלילית של לב העכבר נע בדרך כלל בין 1.5-4.5 מ"ל לדקה, תלוי בגודל הלב. שמירה על טמפרטורת פרפוזה ב-37 מעלות צלזיוס במהלך תנודות בקצב הזרימה נחוצה לתפקוד עקבי של הלב וחשובה במיוחד לזלוף בלחץ קבוע. מערכת הזלוף המתוארת נועדה לשמור על לחץ הידרוסטטי של 70 מ"מ כספית דרך גובה עמוד הפרפוזה. זה מושג עם קצב משאבה המספק הצפה עקבית מהמאגר העליון. ניתן להשלים את הפרפוזה עם 20 מיקרומטר של מרחיב כלי הדם קרומקלין כדי לשפר ולשמור על זרימה כלילית תקינה או על-תקינה כדי להבטיח חמצון מלא של שריר הלב14.
גירוי פוטו של נוירונים כולינרגיים בלבבות עכברים ChAT-ChR2 ברוחב דופק של 10 הרץ ו-30 אלפיות השנייה אמור לגרום לירידה כמעט מיידית בקצב הלב. גירוי פוטו יעיל של נוירונים כולינרגיים בלבבות עם חדירה מספקת אמור להוביל לירידה בקצב הלב של לפחות 100 פעימות לדקה. איור 5 מראה ירידה מיידית של 75 bpm כאשר המיקרו-LED מופעל שממשיך לרדת עד שהוא מגיע לירידה מקסימלית של 135 bpm. תוך חצי שנייה מכיבוי המיקרו-LED, קצב הלב עולה ל-175 פעימות לדקה לפני שהוא חוזר בהדרגה לרמות שלפני הגירוי. א.ק.ג בעל שישה מוליכים מוצג כדי להמחיש את ההבדלים במרווח RR לפני, במהלך ואחרי הגירוי (איור 5B). לידים aVR, aVL ו-aVF מחושבים בתוכנת LabChart באמצעות לידים I ו-II.
גירוי פוטוסטימולציה של נוירונים קטכולמינרגיים בלבבות עכברים TH-ChR2 גורם לשינוי הדרגתי (אקספוננציאלי) יותר בקצב הלב בהשוואה לגירוי פוטו של נוירונים כולינרגיים. זה ככל הנראה נגרם על ידי הפעלה בטא-אדרנרגית שדורשת את מערכת השליחים השנייה של cAMP שמפעילה PKA, שמזרחנת חלבוני מטרה, בעוד שהפעלה מוסקרינית לא. איור 6 מדגים עלייה של 135 פעימות לדקה במהלך 10 שניות. יש צורך ב-10 שניות נוספות לאחר כיבוי האור כדי לחזור לקצב סינוס רגיל. אם המיקרו-LED אינו מבודד כראוי, הוא עלול לחמם את הלב ולגרום לעלייה בקצב הלב. תגובת חימום זו פחות אינטנסיבית מגירוי TH-ChR2; לכן, השינוי בקצב הלב פחות בולט.
יישום אחד של פרוטוקול זה הוא שימוש בגירוי אופטוגנטי כדי לבצע דה-פולריזציה של נוירונים, מה שמוביל לשחרור נוירוטרנסמיטורים אנדוגניים ובמקביל הוספת נוירוטרנסמיטורים אקסוגניים לפרפוזה. איור 7A ממחיש שחרור אצטילכולין אנדוגני מלב עכבר ChAT-ChR2 עם מינון בולוס של NE שנוסף לפרפוזה. ללא נוכחות NE, גירוי פוטו גרם לקצב הלב לרדת ביותר מ-100 פעימות לדקה ושמר על ירידה זו למשך הגירוי. בעוד שעם מינון גדול של NE (2000 ננומטר), ירידת הדופק המקסימלית במהלך גירוי האור הייתה 40 פעימות לדקה. קצב הלב החל מיד לעלות, וכמעט הגיע לרמות שלפני הגירוי לפני כיבוי האור. תוצאה זו מצביעה על כך שדיכוי אופטוגנטי של קצב הלב על ידי גירוי פוטו-גירוי נוירולוגי של ChAT לא הצליח לדכא באופן מלא עליות בקצב הלב כתוצאה ממינון גבוה של NE, מה שגרם לזמן קצר יותר של דיכוי קצב הלב ולירידה נמוכה יותר בקצב הלב (איור 7B). תוצאות אלה עולות בקנה אחד עם עבודה קודמת בבעלי חיים גדולים שהדגימו חסימה מתקדמת של בלוטת AV במהלך גירוי בו-זמני של עצב הנרתיק וגרעיני הכוכבים12,13.
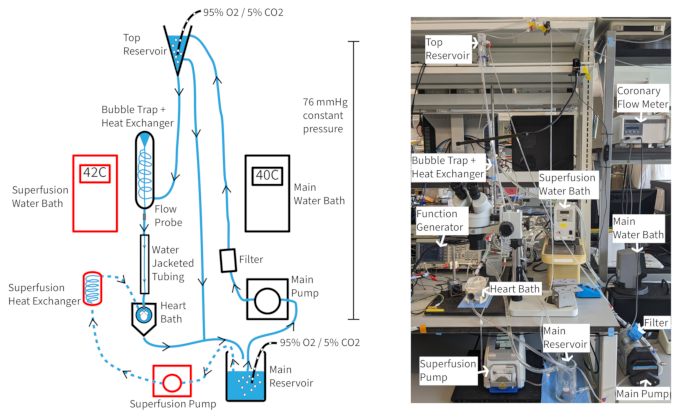
איור 4: מערך ניסוי. תרשים של מערכת הזלוף. החצים מראים את כיוון הפרפוזה. פרפוזאט סופר-פיוזאט מסומן על ידי קווים מקווקווים ורכיבים מסומנים באדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
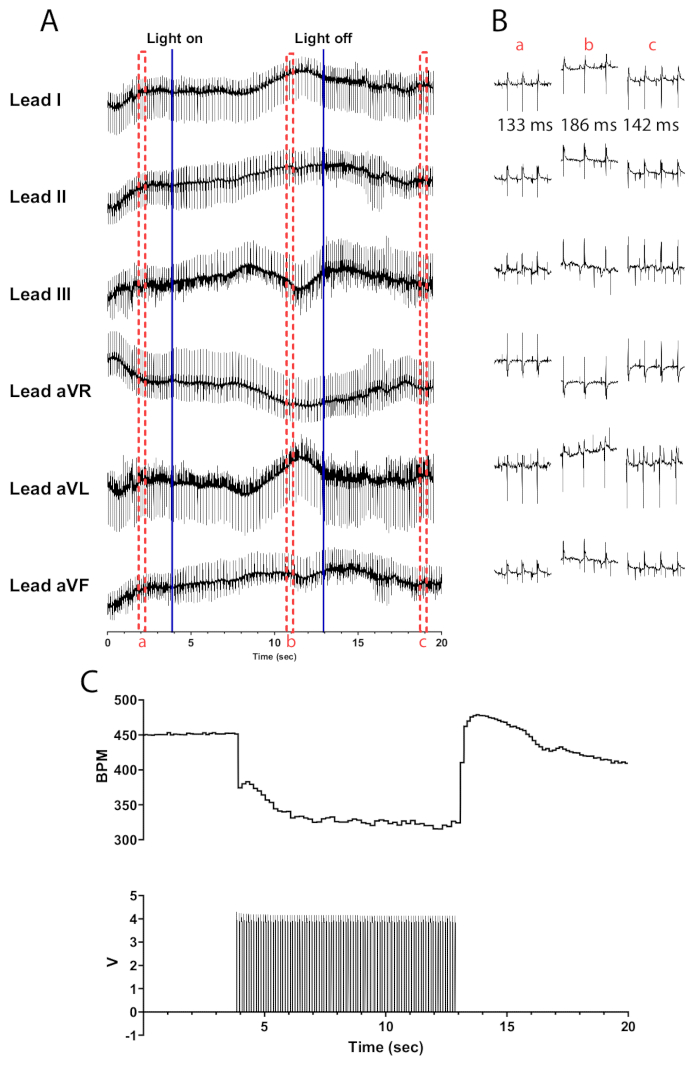
איור 5: תגובת פוטוסטימולציה כולינרגית מייצגת. (A) א.ק.ג 6 עופרת במהלך הפעלה אופטוגנטית של ChAT-ChR2. קווים כחולים מלאים מציינים את הדלקה/כיבוי של המיקרו-LED. תיבות מקווקווים אדומות מציינות את הזמן עבור (B) גזירי קוד. (B) קטעי חצי שנייה של אות האק"ג לפני (a), במהלך (b) ואחרי גירוי פוטוסטימוי (c). מרווח RR מוצג עבור כל קטע. (C) קצב הלב (למעלה) מוצג יחד עם גלי דופק ממחולל פונקציות (למטה). קצב הלב מתחיל ב-450 פעימות לדקה ויורד ל-315 פעימות לדקה לאחר 8 שניות של גירוי פוטוסטימול, לפני שהוא חוזר ל-410 פעימות לדקה 7 שניות לאחר סיום הפוטוסטימול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
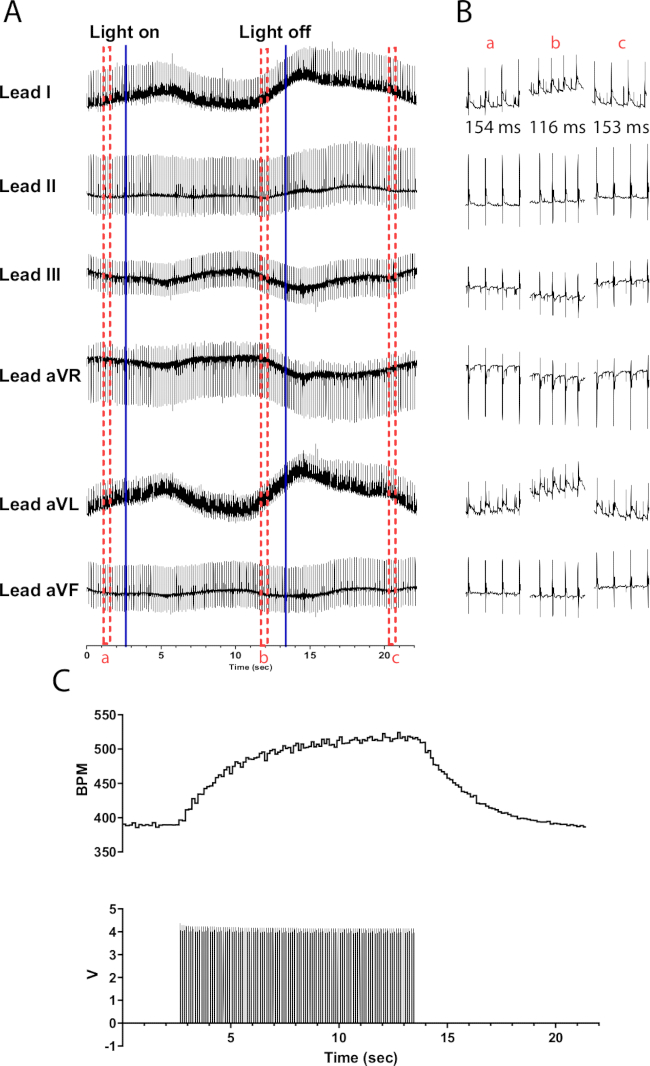
איור 6: תגובת פוטוסטימולציה קטכולמינרגית מייצגת. (A) א.ק.ג עם 6 עופרת במהלך הפעלה אופטוגנטית של TH-ChR2. קווים כחולים מלאים מציינים את הדלקה/כיבוי של המיקרו-LED. תיבות מקווקווים אדומות מציינות את הזמן עבור (B) גזירי קוד. (B) קטעי חצי שנייה של אות האק"ג לפני (a), במהלך (b) ואחרי גירוי פוטוסטימוי (c). מרווח RR מוצג עבור כל קטע. (C) קצב הלב (למעלה) מוצג יחד עם גלי דופק ממחולל פונקציות (למטה). קצב הלב מתחיל ב-390 פעימות לדקה ומגיע לשיא ל-525 פעימות לדקה לאחר 10 שניות של גירוי פוטוסטימול, לפני שהוא חוזר ל-390 פעימות לדקה 8 שניות לאחר סיום הפוטוסטימול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
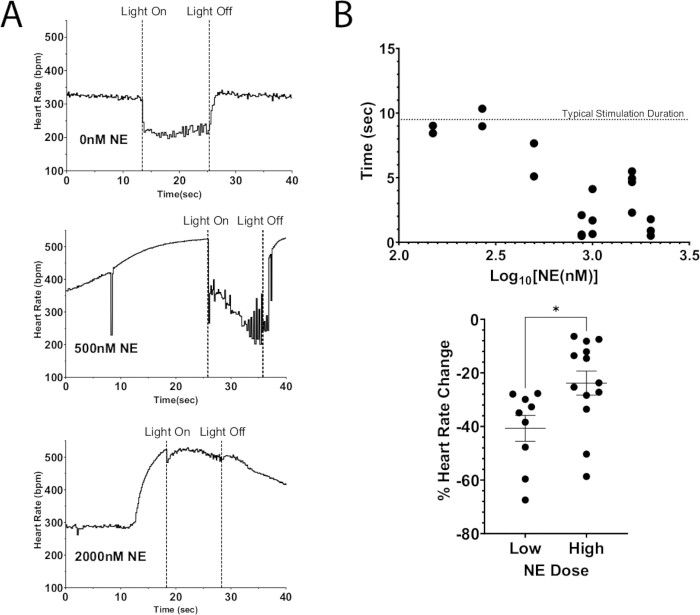
איור 7: גירוי פוטו כולינרגי עם NE אקסוגני. (A) תגובת דופק במהלך גירוי פוטו ChAT-ChR2 עם מינונים הולכים וגדלים של NE שנוספו לפרפוסט. ברגע שהדופק הגיע לעלייה מקסימלית עקב NE, המיקרו-LED הופעל למשך כ-10 שניות. דיכוי קצב הלב עדיין היה אפשרי במינונים גבוהים של NE, אך משך הגירוי ירד ככל שהמינון עלה. (B) משך הזמן שבו קצב הלב נשאר מדוכא. זמנים קרובים יותר ל-10 שניות נשארו בדרך כלל מודחקים למשך כל משך הגירוי. (C) הירידה בקצב הלב במהלך גירוי האור הייתה פחות חמורה במינונים גבוהים יותר של NE מאשר במינונים נמוכים. מינונים נמוכים הביאו לירידה ממוצעת בקצב הלב של 40%, בעוד שמינונים גבוהים יותר ירדו רק ב-25%. מבחן t לא מזווג בוצע כדי להעריך מובהקות סטטיסטית. מוצג כטעות תקן של הממוצע * p < 0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
גירוי אופטוגנטי של נוירונים אוטונומיים לבביים פנימיים ייצר רמות דומות של תגובת קצב לב כמו גירוי חשמלי של עצב הוואגוס או גרעיני הכוכבים14,15. גירוי חשמלי של לבבות כרותים, לעומת זאת, חסר את היתרון של היכולת לכוון בקלות לאוכלוסיות נוירונים ספציפיות. הפעלה פרמקולוגית מציעה את היתרון של התמקדות בקולטנים ספציפיים אך אין לה ספציפיות מרחבית, וזמן התגובה תלוי בקצב הזרימה הכלילית. הפעלה אופטוגנטית מספקת את היתרון של תגובה כמעט מיידית, מיקוד של אוכלוסיות עצביות והיכולת לשנות את רמת הגירוי הפוטולוגי16. בפרוטוקול זה, הסברנו גם כיצד לבנות מקור אור פשוט ובעלות נמוכה לפוטוסטימולציה של תאי העצב הלבביים הפנימיים.
פיתוח הבנה נוספת של השפעת מערכת העצבים התוך-לבבית יקל על אבחון וטיפול טובים יותר במחלות לב וכלי דם. ביטוי סלקטיבי של ChR2 מאפשר לבחון השערות חדשות הקשורות לפעילות של אוכלוסיות עצבים ספציפיות במהלך המחלה. אוכלוסיות עצבים ברחבי הלב יכולות להיחקר בדרך זו, כגון גרעיני לב פנימיים סביב ורידי הריאה או בכל החדרים. לדוגמה, במודלים של עכברים של אוטם שריר הלב, גירוי פוטו של נוירונים אוטונומיים פנימיים יכול להיות שימושי לחקירת שינויים אלקטרופיזיולוגיים ברקמת אזור הגבול כאשר האוטם מתפתח ונוירונים עוברים טרנסדיפרנציאציה17. בפרוטוקול זה, אנו מתארים דוגמה נוספת הכוללת ניסויים מבוקרים של תגובות לב חריפות להפעלה בו-זמנית של מסלולים כולינרגיים וקטכולמינרגיים שבהם השילוב של גורמים אופטוגנטיים ופרמקולוגיים מאפשר לבחון תגובות מינון ייחודיות. הפעלה בו-זמנית זו היא תופעה הקשורה לטביעה, הידועה כקונפליקט אוטונומי, שטרם הובהר במלואו18. בנוסף, בהינתן שילובי אור, צבע ומסננים מתאימים, ניתן לשלב פרוטוקול זה עם מיפוי אופטי לבבי כדי לחקור את ההשפעות החריפות של גירוי נוירונים אוטונומיים על אלקטרופיזיולוגיה של הלב ומנגנוני הפרעות קצב נוירו-לב 19,20,21.
ישנם מספר מושגים חשובים שיש לקחת בחשבון בעת שימוש בפרוטוקול זה כדי לחקור את מערכת העצבים הלבבית הפנימית בלבבות שנכרתו. לבבות עכברים רגישים לשינויים קלים בסביבת הזילוף. ניטור מדוקדק של קצב הלב שימושי לזיהוי בעיות בזלוף כלילי שעלולות לגרום לחמצון נמוך של שריר הלב, איסכמיה ותפקוד לב לקוי. הפרוטוקול ממליץ לחמצן את הפרפוזה הן במאגר הראשי והן במאגר העליון כדי להגביל בעיות פוטנציאליות. טבילה מלאה של צינורות החמצון עוזרת להבטיח רמות חמצן אופטימליות בפרפוסט. ניתן להאיר פנס אולטרה סגול על הלב כדי לחשוף פלואורסצנטיות NADH המעידה על היפוקסיה/איסכמיה, וניתן להתאים את החמצון בהתאם19,20. טמפרטורת הפרפוזה תלויה בקצב הזרימה הכלילי במהלך זלוף בלחץ קבוע. אם קצב הזרימה הכלילי יורד, טמפרטורת הפרפוזה של אבי העורקים עשויה לרדת גם עקב קירור בצינור הפרוקסימלי לצינורית אבי העורקים, וכתוצאה מכך קצב לב נמוך יותר. הגדלת טמפרטורת אמבט מי הפרפוזה יכולה לעזור להפוך את הבעיה הזו. פרוטוקול זה משתמש גם בלולאת סופר-פיוז'ן כדי לשמור על טמפרטורת אמבט לב של 37 מעלות צלזיוס. ירידה בטמפרטורת אמבט הלב עשויה לדרוש הגברת קצב זרימת הסופר-עירוי. המיקרו-LED הוא מקור נוסף לשינויים פוטנציאליים בטמפרטורת הלב מכיוון שטמפרטורת ה-RA עלולה לעלות במהלך גירוי האור. אם אלסטומר הסיליקון שעוטף את המכשיר דק מדי, המיקרו-LED עלול להתחמם ולחמם את צומת ה-SA, וכתוצאה מכך עלייה בלתי צפויה בקצב הלב. בדיקת מקור האור המיקרו-LED על לב מסוג בר יכולה להיות שימושית כדי לאמוד את רמות החימום. המיקרו-LED לא אמור לגרום לעליית דופק של יותר מ-10% במשך 30 שניות. אם זה קורה, יש להחליף את אלסטומר הסיליקון.
המטרה של ניסויי לב ex vivo היא לשחזר תנאים פיזיולוגיים קרובים עם משתנים הניתנים לשליטה, אך הם מגיעים עם מגבלות22. פרפוזה קריסטלואידית היא הסטנדרט לניסויים אלה; עם זאת, זה יכול להגביל את אספקת החמצן למיטוכונדריה בתנאי לחץ גבוהים23,24. יתר על כן, הפרפוזה חסרה הורמונים במחזור הדם שיופיעו באופן טבעי in vivo. מגבלה נוספת היא שעוצמת האור המשתנה והמיקום של המיקרו-LED יכולים לגרום לפערים מקומיים בגירוי העצבי, ולכן תמיד נדרשות התאמות מסוימות במיקום המיקרו-LED מעל הלב לפני תחילת פרוטוקול ניסוי.
לסיכום, פרוטוקול זה ממחיש גישה ex vivo לגירוי אופטוגנטי ספציפי של נוירונים לבביים בלבבות עכברים מפוצצים. מקור אור מיקרו-LED נבנה כדי לעורר את הנוירונים של הפרוזדור הימני. יישום של גישה זו שילב שחרור פנימי של אצטילכולין במהלך הפעלה אופטוגנטית של לב עכבר ChAT-ChR2 בו זמנית עם הגדלת NE אקסוגני. הוצגו השינויים שנוצרו בקצב הלב במהלך ההפעלה הקטכולאמינרגית והכולינרגית בו זמנית. פרוטוקול זה מתאר גישה ניסויית רבת ערך לחקירת הקינטיקה של הפעלה פתאומית של נוירונים אוטונומיים פנימיים בלבבות מפוצצים והאינטראקציות בין פעילות כולינרגית ללב ופעילות קטכולמינרגית.
Disclosures
אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי NIH R01 HL144157 ל-MWK, NIH R01 HL144157 ל-EE ו-MWK, ו-NIH R01s HL147279 ו-HL146169 ל-MWK ו-DM, ומלגת דוקטורט מכובדת של קולינס ל-RR.
Materials
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
References
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved