Method Article
Eksize Edilmiş Perfüze Fare Kalplerinde İntrinsik Kardiyak Otonomik Nöronların Optogenetik Aktivasyonu
Bu Makalede
Özet
Bu protokol, transgenik fare kalplerinde intrinsik kardiyak nöronların optogenetik stimülasyonu için bir yöntemi göstermektedir. Açıklanan yaklaşım, ex vivo perfüze kalplerde ani kardiyak nöron aktivasyonunun kinetiğini ve kolinerjik ve katekolaminerjik aktivite arasındaki etkileşimleri araştırmak için kullanılır.
Özet
Kalp sağlığını korumak için kolinerjik ve katekolaminerjik aktivasyon dengesi gereklidir. Bu yollar arasındaki etkileşimin sorgulanması, kardiyak otonomik nöronlarda channelrhodopsin-2'nin (ChR2) seçici ekspresyonu yoluyla optogenetik kullanılarak yapılabilir. Optogenetiğin bu tür kardiyak uygulamaları, nörotransmiterlerin içsel salınımının uzay-zamansal bir şekilde incelenmesine izin verir. Bu yöntem, perfüze fare kalplerinde kardiyak nöronların spesifik optogenetik stimülasyonu için ex vivo bir yaklaşımı göstermektedir. Transgenik fareler, vücuttaki kolin asetiltransferaz (ChAT) veya tirozin hidroksilaz (TH) nöronlarında ChR2'yi eksprese etmek için yetiştirildi. Sinoatriyal düğümü innerve eden sağ atriyumun nöronlarını uyarmak için silikon elastomer içine yerleştirilmiş bir mikro LED (465 nm) hazırlandı. Mikro LED, 30 ms darbe genişliğine sahip 10 Hz'de darbe dalgalarına ayarlanmış bir fonksiyon jeneratörüne bağlandı. Ekspresyonu doğrulanmış kalpler eksize edildi ve bir Langendorff sistemi dolaşımdaki Krebs-Henseleit solüsyonunda retrograd olarak perfüze edildi. Elektrokardiyogram (EKG), sıcaklık ve koroner akım hızı LabChart yazılımı kullanılarak kaydedildi. Kalp stabilize olduktan sonra, mikro LED sağ atriyuma yerleştirildi ve optimum kalp atış hızı yanıtı için test edildi. Bu yaklaşımın bir uygulaması, bir ChAT-ChR2 fare kalbinin optogenetik aktivasyonu sırasında kolinerjik nörotransmiterin (asetilkolin) içsel salınımını, perfüzata eklenen artan eksojen katekolaminerjik nörotransmitter (norepinefrin) ile aynı anda birleştirir. Eşzamanlı kolinerjik ve katekolaminerjik aktivasyon sırasında kalp atış hızında ortaya çıkan değişiklikler sunulmaktadır. Bu yöntem, perfüze kalplerde ani intrinsik otonomik nöron aktivasyonunun kinetiğini ve kardiyak kolinerjik ve katekolaminerjik aktivite arasındaki etkileşimleri araştırmak için değerli bir deneysel yaklaşımı tanımlar.
Giriş
Optogenetik, ışığa duyarlı proteinleri (opsinler) hedeflenen hücre popülasyonlarına sokmak için bir yöntemdir. Bu, elektriksel veya kimyasal araçlar kullanılarak elde edilemeyen belirli hücrelerin ve dokuların uzay-zamansal modülasyonunu sağlar1. Optogenetiğin kardiyak uygulamaları son 15 yılda giderek daha popüler hale gelmiştir2. Kardiyak miyositlerde veya nöronlarda bir katyon olan channelrhodopsin-2 (ChR2) gibi uyarıcı opsinlerin fotostimülasyonu, hücresel depolarizasyona neden olarak kalp ritminde değişikliklere neden olur3. Cre-lox yaklaşımını kullanarak hücre popülasyonlarında opsinleri seçici olarak ifade etmenin iki yolu vardır: viral transdüksiyon4 ve transgenik hayvanlarınmelezlenmesi 5. Spesifik otonomik nöronlarda ChR2'nin seçici ekspresyonu, hücreye özgü promotörler6 kullanılarak kolinerjik veya katekolaminerjik nöronlarda ChR2 eksprese eden yavrular oluşturmak için çapraz üreme ile gerçekleştirilebilir. Floklanmış bir ChR2 genine sahip bir ebeveyn, tirozin hidroksilaz (TH, katekolaminerjik nöronlar) veya kolin asetiltransferaz (ChAT, kolinerjik nöronlar) gibi bir promotörün kontrolü altında Cre rekombinaz eksprese eden bir ebeveyn ile eşleştirilebilir. Yavrular daha sonra vücut7 boyunca TH veya ChAT nöronlarında ChR2'yi eksprese eder.
Kalbin otonomik nöronların akut aktivasyonuna fonksiyonel tepkisi, örneğin kolinerjik veya katekolaminerjik nöronlar gibi spesifik nöronal popülasyonlar içinde ChR2'nin promotör güdümlü ekspresyonu kullanılarak araştırılabilir. Fotostimülasyon nabız aralığı ve yoğunluğu, nöral aktivasyon seviyelerinin kardiyak fonksiyonu nasıl modüle ettiğini incelemek için bu ChR2 eksprese eden nöronların depolarizasyon oranını kontrol etmek için değiştirilebilir8. Bu yöntem için nöronlar, basitlik için optogenetik olarak aktive edilen herhangi bir hücre gövdesine, aksonlara ve/veya aksonal projeksiyonlara atıfta bulunmak için kullanılacaktır. Kalp ritmi ve kasılma üzerindeki eşzamanlı etkileri sorgulamak için ilaçların veya nörotransmiterlerin eklenmesiyle fotostimülasyonu kimyasal aktivasyonla birleştirmek de mümkündür9. Örneğin, optogenetik kolinerjik stimülasyon, kalpteki eşzamanlı otonomik aktivasyonun etkisini incelemek için eksojen norepinefrin (NE) enjeksiyonu ile birleştirilebilir. İzole perfüze edilmiş kalpler kullanılarak bu tür çalışmaların yürütülmesi, fotoaktivasyonun neden olduğu fonksiyonel değişiklikleri incelemek için iyi kontrol edilen bir deneysel platform sağlama avantajına sahiptir10. EKG morfolojisi, kalp atış hızı ve koroner akış hızındaki değişiklikler sıcaklık, oksijenasyon ve perfüzyon basıncı sıkı bir şekilde kontrol edilirken izlenebilir.
Bu protokolün amacı, kalp atış hızındaki değişiklikleri incelemek için fare kalplerinde belirli bir otonomik nöron popülasyonunu aktive etmek için deneysel bir yaklaşım sunmaktır. Perfüze kalplerde optogenetik aktivasyon için bir mikro LED cihazının yapımı ve kullanımı da sunulmaktadır. Kolinerjik veya katekolaminerjik nöronlarda ChR2 eksprese eden farelerden alınan kalpler eksize edildi ve sabit basınçta oksijenli bir Krebs-Henseleit çözeltisi ile retrograd olarak perfüze edildi. Sağ atriyum (RA) nöronlarında eksprese edilen ChR2, 30 ms darbe genişliği ile 10 Hz'lik bir nabız hızında fotostimülasyon edildi. Anlık kalp atış hızı, RR aralığı kullanılarak hesaplandı ve fotostimülasyon sırasındaki değişiklikler için izlendi. Ekzojen norepinefrin kullanılarak beta-adrenerjik aktivasyon ile eş zamanlı olarak içsel optogenetik ChAT nöron fotostimülasyonu sırasında kalp atış hızı kinetiğini incelemek için örnek bir deney de açıklanmaktadır.
Protokol
Tüm hayvan protokolleri, George Washington Üniversitesi'nin Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı ve Ulusal Sağlık Enstitüsü'nün Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nu takip etti.
1. Mikro-LED ışık kaynağı yapısı
- İyi havalandırılan bir alanda diseksiyon mikroskobu altında, en az 20 cm uzunluğunda iki yalıtılmış bakır telin soyulmuş uçlarını 465 nm'lik bir mikro LED'in temas noktalarına lehimleyin (Şekil 1). LED'i bir güç kaynağına bağlayarak ve açarak lehimlemeyi test edin.
- 200 μL filtreli pipet ucunun altını 1 cm kesin. Küçük çaplı bir çubuk kullanarak filtreyi dışarı itin. Mikro LED'i, LED'in ucuyla aynı hizada olması için tellerle pipet ucuna yerleştirin. LED'i ve kabloları yerinde tutmak için pipet ucunun üst kısmındaki filtreyi yerine takın ve ardından LED'in kenarlarını pipet ucuna süper yapıştırın. Süper yapıştırıcının kurumasını bekleyin.
- Baz ve sertleştiriciyi 10:1 oranında birleştirerek silikon elastomeri hazırlayın ve iyice karıştırın. Bir vakum odası kullanarak veya santrifüjleyerek karışımdaki kabarcıkları çıkarın.
- 0,5 mL'lik bir santrifüj tüpü alın ve LED'in çıkarılmasını kolaylaştırmak için yanları çizin (istenirse burada tüpün içine yağlayıcı da eklenebilir). Sızıntı olmadığından emin olmak için tüpün dışını bantlayın. Silikon elastomer karışımından yaklaşık 0,2 mL tüpün içine dökün ve ardından mikro LED pipet ucunu, LED ile tüpün tabanı arasında en az 1 mm boşluk bırakarak tüpe yerleştirin. Kabarcıklar oluşmuşsa, bunları çıkarmak için santrifüj tüpünü sert bir yüzeye vurun.
NOT: LED'i yerleştirirken kabarcık oluşumunu azaltmak için pipet ucu önleyici olarak silikon elastomer ile kaplanabilir. - Santrifüj tüpü mikro LED'ini 50 °C'lik bir laboratuvar fırınına veya inkübatöre dik olarak yerleştirin ve en az 8 saat veya gece boyunca bırakın. Fırınla etkileşime girerken ısıya dayanıklı eldivenler giyin. Elastomer sertleştikten sonra LED'i santrifüj tüpünden çıkarın. Elastomer hala yapışkansa, tekrar fırına koyun.
- Tamamen sertleştikten sonra, LED'in ucundaki fazla elastomeri hassas bir maket bıçağıyla 1 mm'den fazla kalmayacak şekilde çıkarın. LED'in uygun şekilde kapsüllenmesi, fotostimülasyon sırasında dokunun ısınmasını en aza indirecektir.
- Bir optik güç ölçer kullanarak LED'in optik gücünü belirleyin. Güç ölçeri açın ve dalga boyu ayarlarını 465 nm okuyacak şekilde ayarlayın. LED'i bir fotodiyot güç sensörü ile aynı hizaya getirin ve LED'i fonksiyon üreteci ile açın. Optik güç ölçer watt cinsinden bir okuma üretecektir. Güç okumasını aydınlatılan yüzeyin alanına (0,88 mm2) bölerek ışınımı hesaplayın.
NOT: ChR2.4 2'nin uygun aktivasyonu için ideal ışınım yaklaşık2 mW/mm11 olmalıdır.
2. Deneysel hazırlık
- Kolinerjik nöronlarda (ChAT-ChR2) veya katekolaminerjik nöronlarda (TH-ChR2) ChR2'yi eksprese etmek için fareleri önceki yayına uygun olarak yetiştirin12 (Şekil 2). Daha önce tarif edildiği gibi bir genotipleme yaklaşımı kullanarak deneyler için kullanılan farelerde TH-Cre veya ChAT-Cre ekspresyonunu doğrulayın12.
- En az 225 mL Krebs-Henseleit (KH) çözeltisi hazırlayın (mM cinsinden: 118 NaCl, 4.7 KCl, 1.25 CaCl2, 0.57 MgSO4, 25 NaHCO3, 1.17 KH2PO4, 6 glikoz) ve 0.2 μm selüloz nitrat membran filtresi kullanarak süzün. %95O2 ve %5 CO2 kullanılarak oksijenlendiğinde pH'ı 7.4'e ayarlayın.
- Deneyden önce Langendorff perfüzyon sistemini arıtılmış su ile durulayın ve deneye başlamadan önce fazla suyu alın.
- Herhangi bir KH sirküle edilmeden önce sisteme 10 μm'lik bir membran filtre ekleyin. 2-5 mL/dk arasındaki akış hızlarında perfüzat sıcaklığını 37 °C'de tutacak şekilde ayarlanmış su banyolarını açın.
- Perfüzyon sistemine 175 mL KH ekleyin ve dolaşıma başlayın. Yeterli oksijenasyonu sağlamak için çözeltiyi% 95O2 /% 5 CO2 ile köpürtün.
NOT: KH sirkülasyon hacmi, boru ve rezervuar boyutlarına bağlı olarak sistemden sisteme değişecektir. - Perfüzyon sisteminden akışı bir musluk ile durdurarak ve akış ölçer üzerindeki Sıfır Düğmesine basarak akış ölçeri kalibre edin.
- 12 kanala sahip olmak için LabChart gibi bir fizyolojik veri toplama yazılımı hazırlayın: kalp banyosu sıcaklığı, aort perfüzat sıcaklığı, EKG kabloları I-III artı dört ek hesaplanmış kablo, kalp atış hızı hesaplaması, akış hızı ve LED darbelerini izlemek için fonksiyon üreteci çıkışı.
- Kalp atış hızı için ayrılmış kanalı kullanarak, Lead I'deki fare EKG'sini algılamak için ayarlanan döngüsel ölçümler özelliği ile LabChart'ta kalp atış hızını hesaplayın. LabChart'ın Kardiyak Eksen uzantısı, Lead III, aVR, aVL ve aVF'yi hesaplamak için Lead I ve Lead II'yi kullanır.
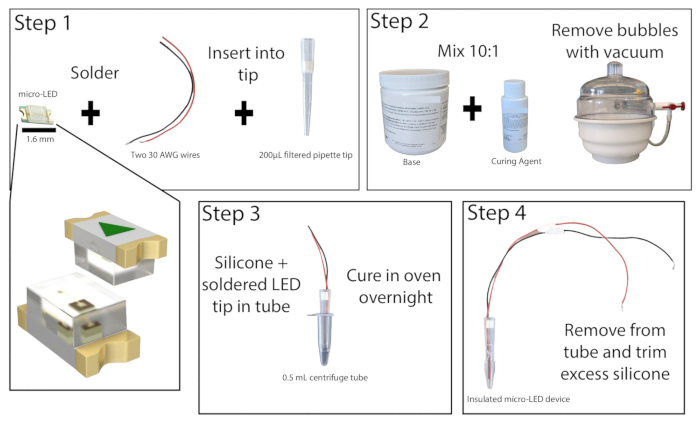
Şekil 1: Mikro LED yapı. Mikro LED ışık kaynağı oluşturma adımlarına basitleştirilmiş genel bakış. Mikro LED'e iki tel lehimlenir ve 200 μL'lik bir pipet ucuna yerleştirilir, ardından süper yapıştırılır (Adım 1). Silikon elastomer 10:1 oranında karıştırılır ve kabarcıkları çıkarmak için bir vakum odasına yerleştirilir (Adım 2). Silikon elastomer bir mikrosantrifüj tüpüne dökülür ve mikro LED pipet ucu yerleştirilir ve gece boyunca kürlenmesine izin verilir (Adım 3). Yalıtılmış mikro LED daha sonra tüpten çıkarılır ve fazla silikon kesilmelidir (Adım 4). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
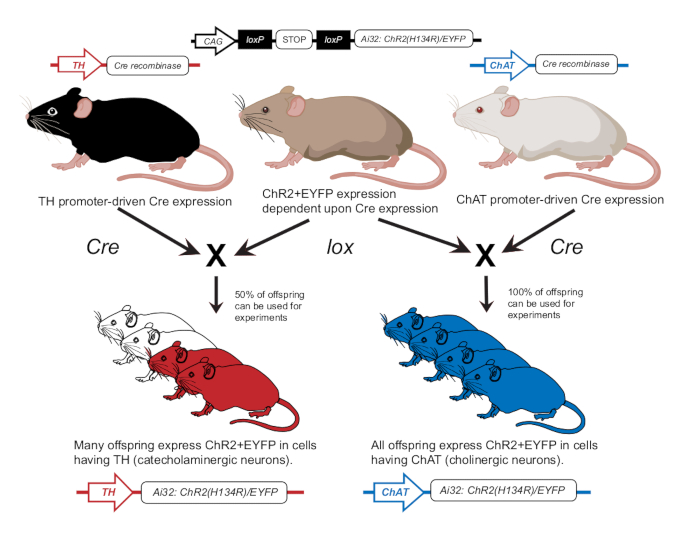
Şekil 2: Transgenik fare yetiştirme şeması. Lox'a bağımlı ChR2 genine sahip bir ebeveyn fare, Cre promotörüne sahip başka bir fare ile melezlenir. Tirozin hidroksilaz (TH) Cre promotörüne sahip bir ebeveyn fare, katekolaminerjik hücrelerde %50'sinin ChR2'yi eksprese edeceği heterozigot yavrular üretecektir. Kolin asetiltransferaz (ChAT) Cre promotörüne sahip bir ebeveyn fare, kolinerjik hücrelerde% 100 ChR2'yi eksprese edecek homozigot yavrular üretecektir. İfade genotipleme yoluyla doğrulanır. Bu rakam12'nin izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Kalp eksizyonu ve perfüzyonu
- Eksizyondan önce, 1 mL'lik bir şırınga kullanılarak intraperitoneal enjeksiyon ile 250 ünite heparin (yaklaşık 8 U / g) uygulayın. Ameliyattan önce en az 10 dakika bekleyin.
- Yetişkin bir fareyi anestezi indüksiyon odasına yerleştirin. ~% 4 izofluran uygulayın ve solunum hızı yavaşlayana ve derinleşene kadar bekleyin. Fareyi hazneden çıkarın ve servikal çıkık yapmadan önce ayak parmağınızı sıkıştırarak ağrı refleksinin durduğunu doğrulayın.
- Ksifoid işlemini bir çift forseps ile tutun ve cerrahi makas kullanarak karın boşluğuna kesin. Diyaframı dikkatlice keserek göğüs boşluğunu açın. Kalbi ve akciğerleri ortaya çıkarmak için kaburgaları kesin. Akciğerleri nazikçe tutun ve kalbi ve akciğerleri çıkarın.
- Kalbi heparinize edilmiş bir KH tabağına yerleştirin. Akciğerleri ve büyük yağ parçalarını çıkarın. Temizlenmiş kalbi, 2x büyütmeye ayarlanmış bir diseksiyon mikroskobu altında 2. bir heparinize KH kabına yerleştirin. Aortu bulun ve ince forseps kullanarak kanül üzerinde kaydırın. 4-0 ipek sütür kullanarak kalbi bir kanüle sabitleyin.
NOT: Kalbin metabolik aktivitesini azaltmak için buz üzerinden kanülasyon yapılabilir. - Perfüzyon sistemine yerleştirilmeden önce koronerlerden kanı çıkarmak için kanülden heparinize KH bolus enjeksiyonunu yıkayın.
- Kanüllü kalbi perfüzyon sistemine bağlayın ve perfüzatla doldurulmuş PDMS kabına yerleştirin. EKG iğne elektrotlarını Einthoven'ın üçgenine göre PDMS kabınayerleştirin 13. Kalbi en az 5 dakika boyunca alıştırın.
- Kalbi, sol atriyuma erişilebilecek şekilde döndürün ve bir çift mikro kendiliğinden açılan makasla sol atriyumda ~1 mm'lik bir delik açın. Bu dilimden 1 mm çapında bir tüp yerleştirin ve orada sıkışan perfüzatı serbest bırakın.
NOT: Kalbe bakmak için diseksiyon mikroskobuna sahip olmak bu adımın kolaylığını artırabilir. - Kalbi, RA yukarı bakacak ve sinoatriyal (SA) düğüm aydınlatma için erişilebilir olacak şekilde döndürün (Şekil 3).
- Sinyalleri uygun bir sinyal-gürültü oranıyla almak için elektrotları kalbe yaklaştırarak veya perfüzata batırarak EKG elektrotlarını gerektiği gibi ayarlayın. Ayarlar, EKG alımı, kullanılan donanım ve yazılıma bağlı olarak değişebilir. Bu yöntem, 2000 kazançlı ve 500 Hz kesme filtreli bir Einthoven Goldberger modülü kullandı ve yazılım ayarları bir şebeke filtresi ve 1000 Hz örnekleme frekansı içeriyordu.
4. Optogenetik aktivasyon
- Aşağıdaki parametrelerde darbe dalgaları üretmek için mikro LED cihazını bir fonksiyon jeneratör setine bağlayın: 10 Hz frekans, 30 ms darbe genişliği, 10Vpp genlik.
- Mikro LED'i yavaşça SA düğümüne yerleştirin. Kalp atış hızında ve işlevinde düşüşe neden olabileceğinden mikro LED ile çok sert bastırmaktan kaçının.
- Fonksiyon üretecini açın ve fotostimülasyondan kaynaklanan kalp atış hızındaki değişiklikleri ölçün. Kalp atış hızındaki ani değişiklikler etkili aktivasyonu gösterir. Katekolaminerjik aktivasyon, kalp atış hızında10 üstel bir artışa neden olurken, kolinerjik aktivasyon ani bir düşüşeneden olur 8.
- İşlev oluşturucuyu kapatın. Kalp atış hızının aktivasyon öncesi seviyelere dönmesine izin verin.
- Optogenetik aktivasyon 100 bpm'den daha az bir kalp atış hızı değişikliğine neden olursa, RA'nın nöronlarını daha iyi aydınlatmak için mikro LED'i yeniden konumlandırın. Gerektiği kadar tekrarlayın.
5. Deneysel prosedür ve veri analizi
- İçsel optogenetik kolinerjik stimülasyonun norepinefrin (NE) ile eksojen beta-adrenerjik aktivasyonu baskılayabileceği hipotezini test etmek için, bir dumanlı gıdada 10 μM ve 100 μM NE stok çözeltileri hazırlayın.
- Bir enjeksiyon portu ile perfüzyon sistemine bir bolus dozu NE ekleyin. Kalp atış hızı platolar arttığında, mikro LED'i ~ 10 saniye boyunca açın. Işığı kapatın ve kalp atış hızındaki değişiklikleri izleyin.
- Kalp atış hızı sinüs ritmine döndükten sonra, NE dozunu artırın ve optogenetik stimülasyonu tekrarlayın. Her NE dozu için devam edin.
- Çalışmanın sonunda, gaz kaynaklarını kapatın, kalbi sistemden çıkarın ve gerektiği gibi sabitleyici olarak saklayın.
- Perfüzyon sistemi rezervuarlarını ve borularını gerektiği gibi DI su veya deterjanla durulayın. Küflenmeyi önlemek için sistemi iyice kurulayın.
- LabChart dosyasını kaydedin. Çevrimdışı analiz ve grafik sunum için kalp atış hızı sinyalini ve EKG kanallarını dışa aktarın.
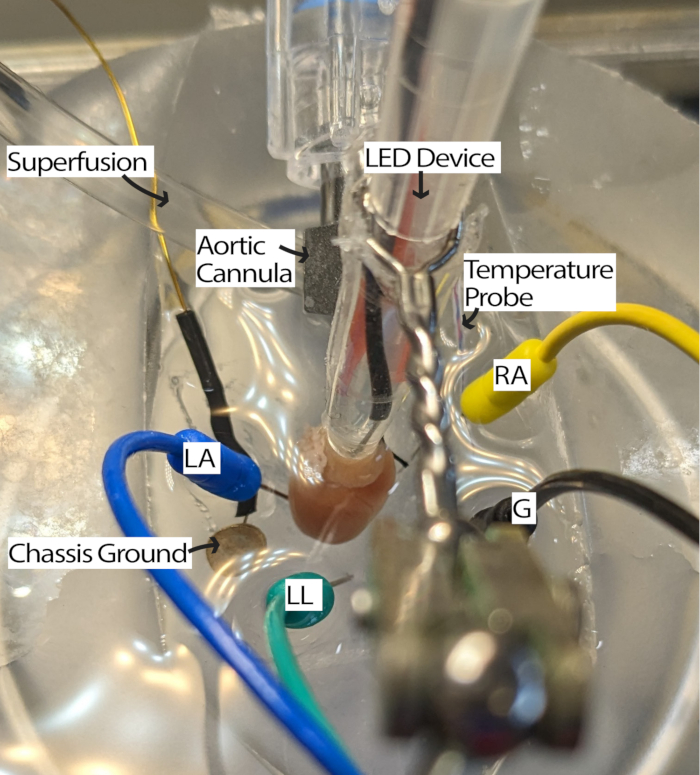
Şekil 3: Fare kalp banyosu konfigürasyonu. LED cihazının ve EKG elektrotlarının yerleşimini gösteren kanüllü bir fare kalbi. Çevredeki elektronik cihazlardan gelen gürültüyü azaltmak için bir şasi topraklaması mevcuttur. EKG iğne elektrotları Einthoven üçgenine göre yerleştirilir. Kısaltmalar: LA = sol kol; RA = sağ kol; LL = sol bacak; G = toprak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bir Langendorff sabit basınçlı perfüzyon sistemi (Şekil 4), uygun oksijenasyon, sıcaklık ve koroner akış sürdürülürse, fare kalp atış hızlarını bir saatten fazla bir süre boyunca en az 300 bpm'de tutabilmelidir. Bu kurulumla, aort perfüzat sıcaklığı koroner akışa dayanır, bu nedenle aort sıcaklığını 37 °C'de tutmak için akış hızı değiştikçe su banyosu sıcaklıklarının ayarlanması gerekebilir. Fare kalbi koroner akış hızları, kalbin boyutuna bağlı olarak tipik olarak 1.5-4.5 mL / dak arasında değişir. Akış hızı dalgalanmaları sırasında perfüzat sıcaklığının 37 °C'de tutulması, tutarlı kalp fonksiyonu için gereklidir ve özellikle sabit basınç perfüzyonu için önemlidir. Tarif edilen perfüzyon sistemi, perfüzat kolonu yüksekliği boyunca 70 mmHg'lik bir hidrostatik basıncı korumak için tasarlanmıştır. Bu, üst rezervuardan tutarlı bir taşma sağlayan bir pompa hızı ile gerçekleştirilir. Perfüzat, tam miyokardiyal oksijenasyonu sağlamak için normal veya supranormal koroner akışı iyileştirmek ve sürdürmek için 20 μM vazodilatör kromakalin ile desteklenebilir14.
ChAT-ChR2 fare kalplerinde 10 Hz ve 30 ms darbe genişliğinde kolinerjik nöronların fotostimülasyonu, kalp atış hızında neredeyse anlık bir düşüşe neden olmalıdır. Yeterince perfüze edilmiş kalplerde kolinerjik nöronların etkili fotostimülasyonu, kalp atış hızında en az 100 bpm'lik bir azalmaya yol açmalıdır. Şekil 5 , mikro LED açıldığında maksimum 75 bpm'lik bir düşüşe ulaşana kadar düşmeye devam eden 135 bpm'lik ani bir düşüşü göstermektedir. Mikro LED'i kapattıktan yarım saniye sonra, kalp atış hızı kademeli olarak ön stimülasyon seviyelerine dönmeden önce 175 bpm'ye yükselir. Stimülasyon öncesinde, sırasında ve sonrasında RR aralığındaki farklılıkları göstermek için altı derivasyonlu bir EKG sunulmaktadır (Şekil 5B). aVR, aVL ve aVF müşteri adayları, LabChart yazılımında Müşteri Adayları I ve II kullanılarak hesaplanır.
TH-ChR2 fare kalplerindeki katekolaminerjik nöronların fotostimülasyonu, kolinerjik nöronların fotostimülasyonuna kıyasla kalp hızında daha kademeli (üstel) bir değişikliğe neden olur. Bu muhtemelen, hedef proteinleri fosforile eden PKA'yı aktive eden cAMP aktive edici ikinci haberci sistemini gerektiren beta1-adrenerjik aktivasyondan kaynaklanırken, muskarinik aktivasyon yapmaz. Şekil 6 , 10 s boyunca 135 bpm kalp atış hızı artışını göstermektedir. Normal sinüs ritmine dönmek için ışık kapatıldıktan sonra 10 saniye daha gereklidir. Mikro LED uygun şekilde yalıtılmazsa kalbi ısıtarak kalp atış hızında artışa neden olabilir. Bu ısıtma tepkisi, TH-ChR2 stimülasyonundan daha az yoğundur; Bu nedenle, kalp atış hızındaki değişiklik daha az belirgindir.
Bu protokolün bir uygulaması, nöronları depolarize etmek için optogenetik stimülasyon kullanmaktır, bu da endojen nörotransmiterlerin salınmasına yol açarken aynı zamanda perfüsata ekzojen nörotransmiterler eklemektir. Şekil 7A, perfüzata eklenen bir bolus dozu NE ile bir ChAT-ChR2 fare kalbinden endojen asetilkolin salınımını göstermektedir. NE mevcut olmadan, fotostimülasyon kalp atış hızının 100 bpm'den fazla düşmesine neden oldu ve bu düşüşü stimülasyon süresi boyunca sürdürdü. Büyük bir NE dozu (2000 nM) ile birlikte, fotostimülasyon sırasında maksimum kalp atış hızı düşüşü 40 bpm idi. Kalp atış hızı hemen yükselmeye başladı ve ışık kapatılmadan önce neredeyse stimülasyon öncesi seviyelere ulaştı. Bu sonuç, ChAT nöron fotostimülasyonu ile kalp hızının optogenetik olarak baskılanmasının, yüksek doz NE'den kaynaklanan kalp hızındaki artışları tam olarak baskılayamadığını, kalp hızı baskılanmasının daha kısa süresine ve kalp hızında daha düşük düşüşlere neden olduğunu göstermektedir (Şekil 7B). Bu sonuçlar, eşzamanlı vagal sinir ve yıldız gangliyon stimülasyonu sırasında ilerleyici AV düğüm bloğu gösteren büyük hayvanlarda yapılan önceki çalışmalarla tutarlıdır 12,13.
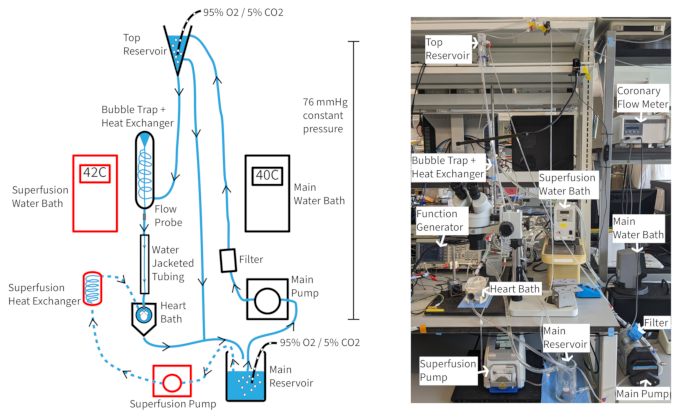
Şekil 4: Deney düzeneği. Perfüzyon sistemi şeması. Oklar perfüzatın yönünü gösterir. Süperfüzyon perfüzatı kesikli çizgilerle gösterilir ve bileşenler kırmızı ile özetlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
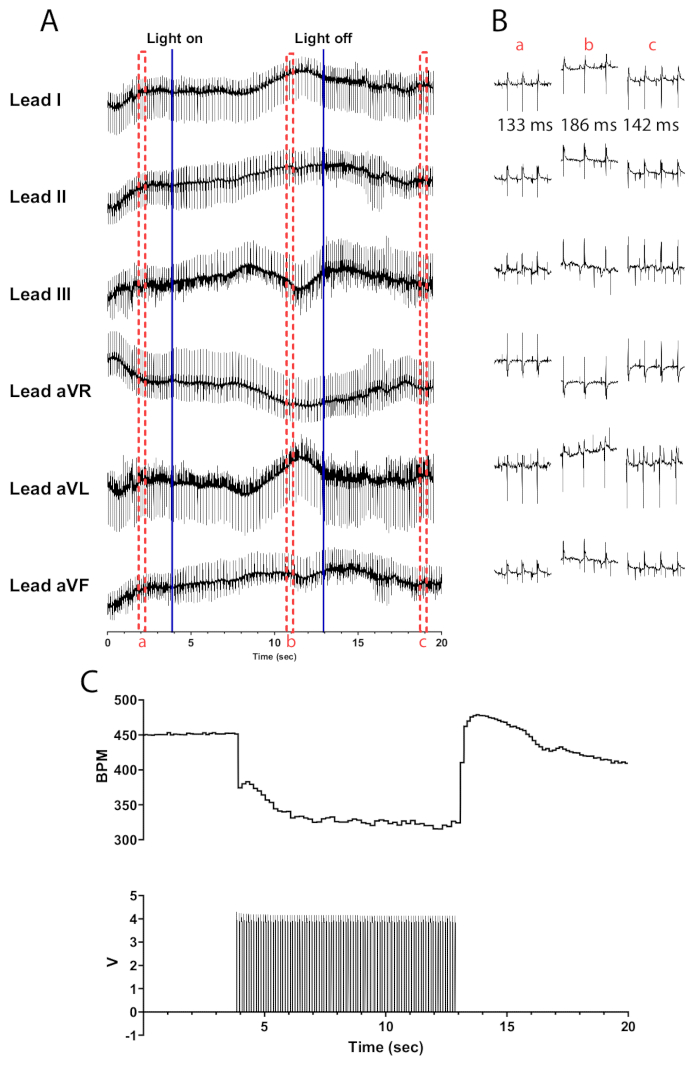
Şekil 5: Temsili kolinerjik fotostimülasyon yanıtı. (A) ChAT-ChR2 optogenetik aktivasyonu sırasında 6 derivasyonlu bir EKG. Sabit mavi çizgiler, mikro LED'in açılıp kapatıldığını gösterir. Kırmızı kesikli kutular (B) parçacıklarının zamanını gösterir. (B) (a) öncesinde, (b) sırasında ve fotostimülasyondan sonra (c) yarım saniyelik EKG sinyali parçacıkları. Her bölüm için RR aralığı gösterilir. (C) Kalp atış hızı (üstte), bir fonksiyon üretecinden (altta) gelen nabız dalgalarıyla birlikte gösterilir. Kalp atış hızı 450 bpm'de başlar ve 8 saniye fotostimülasyondan sonra 315 bpm'ye düşer ve fotostimülasyon bittikten 7 saniye sonra 410 bpm'ye döner. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
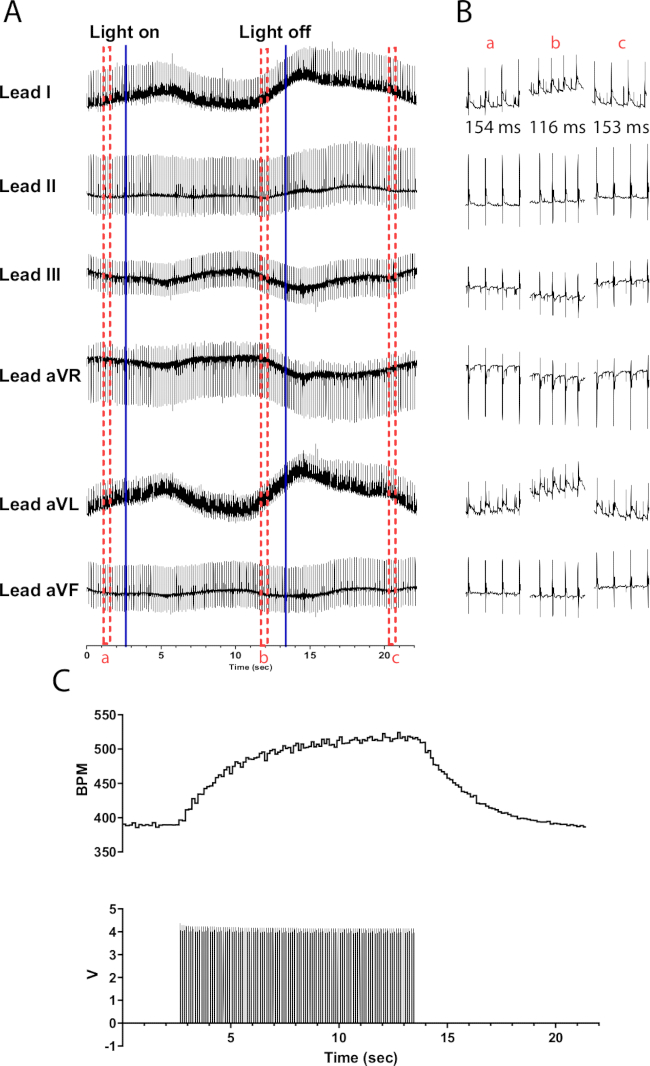
Şekil 6: Temsili katekolaminerjik fotostimülasyon yanıtı. (A) TH-ChR2 optogenetik aktivasyonu sırasında 6 derivasyonlu bir EKG. Sabit mavi çizgiler, mikro LED'in açılıp kapatıldığını gösterir. Kırmızı kesikli kutular (B) parçacıklarının zamanını gösterir. (B) (a) öncesinde, (b) sırasında ve fotostimülasyondan sonra (c) yarım saniyelik EKG sinyali parçacıkları. Her bölüm için RR aralığı gösterilir. (C) Kalp atış hızı (üstte), bir fonksiyon üretecinden (altta) gelen nabız dalgalarıyla birlikte gösterilir. Kalp atış hızı 390 bpm'de başlar ve fotostimülasyon bittikten 8 s sonra 390 bpm'ye dönmeden önce 10 sn fotostimülasyondan sonra 525 bpm'ye ulaşır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
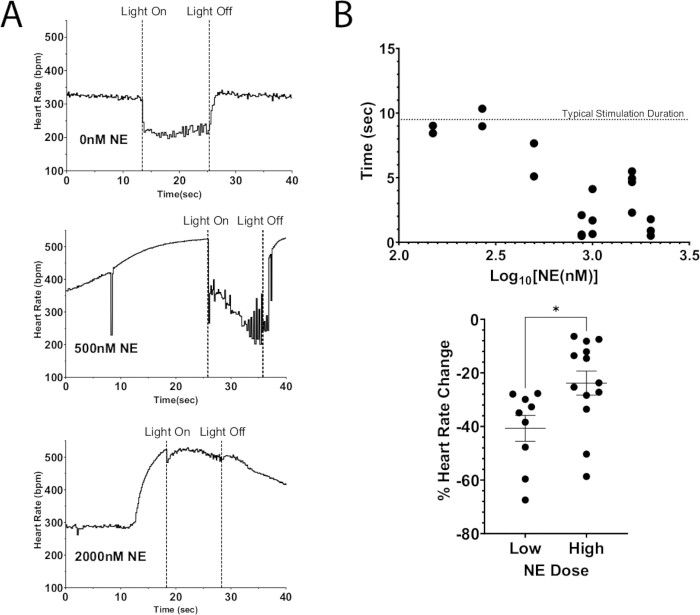
Şekil 7: Ekzojen NE ile kolinerjik fotostimülasyon. (A) ChAT-ChR2 fotostimülasyonu sırasında kalp atış hızı tepkisi, perfüzat için artan dozlarda NE eklenir. Kalp atış hızı NE nedeniyle maksimum artışa ulaştığında, mikro LED yaklaşık 10 saniye boyunca yandı. Yüksek dozlarda NE hızında kalp atış hızı baskılanması hala mümkündü, ancak doz arttıkça stimülasyon süresi azaldı. (B) Kalp atış hızının bastırılmış kaldığı süre. 10 saniyeye yakın süreler genellikle tüm stimülasyon süresi boyunca bastırılmış halde kalır. (C) Fotostimülasyon sırasında kalp atış hızındaki düşüş, daha yüksek NE dozlarında düşük dozlara göre daha az şiddetliydi. Düşük dozlar kalp atış hızında ortalama %40'lık bir düşüşe neden olurken, daha yüksek dozlar sadece %25 düştü. İstatistiksel anlamlılığı değerlendirmek için eşleşmemiş bir t-testi yapıldı. Ortalama * p < 0.05'in standart hatası olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İntrinsik kardiyak otonomik nöronların optogenetik stimülasyonu, vagus sinirinin veya yıldız gangliyonlarının elektriksel stimülasyonu ile karşılaştırılabilir seviyelerde kalp atış hızı yanıtı üretmiştir14,15. Bununla birlikte, eksize edilmiş perfüze kalplerin elektriksel stimülasyonu, belirli nöron popülasyonlarını kolayca hedefleyebilme avantajından yoksundur. Farmakolojik aktivasyon, spesifik reseptörleri hedefleme avantajı sunar, ancak mekansal özgüllüğü yoktur ve yanıt süresi koroner akış hızına bağlıdır. Optogenetik aktivasyon, neredeyse anlık yanıtın, nöronal popülasyonların hedeflenmesinin ve fotostimülasyon seviyesinin16 değiştirilmesinin faydasını sağlar. Bu protokolde, içsel kardiyak nöronları fotostimülasyon için basit, düşük maliyetli bir ışık kaynağının nasıl oluşturulacağını da açıkladık.
İntrakardiyak sinir sisteminin etkisinin daha iyi anlaşılması, kardiyovasküler hastalıkların daha iyi teşhis ve tedavisini kolaylaştıracaktır. ChR2'nin seçici ekspresyonu, hastalık sırasında belirli sinir popülasyonlarının aktivitesi ile ilgili yeni hipotezlerin test edilmesini sağlar. Kalpteki sinir popülasyonları, pulmoner venlerin etrafındaki veya ventriküller boyunca intrinsik kardiyak gangliyonlar gibi bu şekilde sorgulanabilir. Örneğin, miyokard enfarktüsünün fare modellerinde, içsel otonomik nöronların fotostimülasyonu, enfarktüs geliştikçe ve nöronlar transdiferansiyasyona uğradıkça sınır bölgesi dokusundaki elektrofizyolojik değişiklikleri sorgulamak için yararlı olabilir17. Bu protokolde, optogenetik ve farmakolojik ajanların kombinasyonunun benzersiz doz yanıtlarının incelenmesine izin verdiği, kolinerjik ve katekolaminerjik yolların eşzamanlı aktivasyonuna akut kardiyak yanıtların kontrollü deneylerini içeren başka bir örneği açıklıyoruz. Bu eşzamanlı aktivasyon, otonomik çatışma olarak bilinen ve henüz tam olarak aydınlatılamamış olan boğulma ile ilişkili bir olgudur18. Ek olarak, uygun ışık, boya ve filtre kombinasyonları verildiğinde, bu protokol, otonomik nöron stimülasyonunun kardiyak elektrofizyoloji ve nöro-kardiyak aritmi mekanizmaları üzerindeki akut etkilerini incelemek için kardiyak optik haritalama ile birleştirilebilir 19,20,21.
Eksize edilmiş perfüze kalplerde intrinsik kardiyak sinir sistemini incelemek için bu protokolü kullanırken göz önünde bulundurulması gereken birkaç önemli kavram vardır. Fare kalpleri, perfüzyon ortamındaki küçük değişikliklere karşı hassastır. Kalp atış hızının yakından izlenmesi, miyokardın düşük oksijenlenmesine, iskemiye ve zayıf kalp fonksiyonuna neden olabilecek koroner perfüzyon ile ilgili sorunları belirlemek için yararlıdır. Protokol, olası sorunları sınırlamak için perfüzatın hem ana hem de üst rezervuarda oksijenlendirilmesini önerir. Oksijenasyon tüpünün tamamen daldırılması, perfüzattaki optimum oksijen seviyelerinin garanti edilmesine yardımcı olur. Hipoksi/iskemiyi gösteren NADH floresansını ortaya çıkarmak için kalbe bir ultraviyole el feneri tutulabilir ve oksijenasyon buna göre ayarlanabilir19,20. Perfüzat sıcaklığı, sabit basınçlı perfüzyon sırasında koroner akış hızına bağlıdır. Koroner akış hızı düşerse, aort kanülünün proksimalindeki hortumdaki soğuma nedeniyle aort perfüzat sıcaklığı da düşebilir ve bu da daha düşük bir kalp atış hızına neden olabilir. Perfüzat su banyosu sıcaklığının arttırılması bu sorunu tersine çevirmeye yardımcı olabilir. Bu protokol ayrıca 37 °C'lik bir kalp banyosu sıcaklığını korumak için bir süper füzyon döngüsü kullanır. Kalp banyosu sıcaklığındaki düşüşler, süperfüzyon akış hızının arttırılmasını gerektirebilir. Mikro-LED, kalp sıcaklığındaki potansiyel değişikliklerin başka bir kaynağıdır, çünkü RA'nın sıcaklığı fotostimülasyon sırasında artabilir. Cihazı kaplayan silikon elastomer çok inceyse, mikro LED ısınabilir ve SA düğümünü ısıtabilir, bu da kalp atış hızında beklenmedik bir artışa neden olabilir. Mikro LED ışık kaynağını vahşi tip bir kalp üzerinde test etmek, ısıtma seviyelerini ölçmek için yararlı olabilir. Mikro LED, 10 saniye boyunca %30'dan fazla kalp atış hızı artışına neden olmamalıdır. Böyle bir durumda, silikon elastomer değiştirilmelidir.
Ex vivo perfüze kalp deneylerinin amacı, kontrol edilebilir değişkenlerle yakın fizyolojik koşulları yeniden yaratmaktır, ancak bunlar sınırlamalarla birlikte gelir22. Kristalloid perfüzat bu deneyler için standarttır; Bununla birlikte, yüksek stresli koşullar altında mitokondriye oksijen iletimini sınırlayabilir23,24. Ayrıca, perfüzat, in vivo olarak doğal olarak meydana gelecek dolaşımdaki hormonlardan yoksundur. Ek bir sınırlama, değişken ışık yoğunluğunun ve mikro LED'in yerleştirilmesinin, nöral stimülasyonda yerel eşitsizliklere neden olabilmesidir, bu nedenle, deneysel bir protokole başlamadan önce mikro LED'i kalbin üzerine konumlandırmada bazı ayarlamalar her zaman gereklidir.
Özetle, bu protokol, perfüze fare kalplerinde kardiyak nöronların spesifik optogenetik stimülasyonu için ex vivo bir yaklaşımı göstermektedir. Sağ atriyumun nöronlarını uyarmak için bir mikro-LED ışık kaynağı yapıldı. Bu yaklaşımın bir uygulaması, bir ChAT-ChR2 fare kalbinin optogenetik aktivasyonu sırasında asetilkolinin içsel salınımını, artan eksojen NE ile aynı anda birleştirdi. Eşzamanlı katekolaminerjik ve kolinerjik aktivasyon sırasında kalp hızında ortaya çıkan değişiklikler sunuldu. Bu protokol, perfüze kalplerde ani intrinsik otonomik nöron aktivasyonunun kinetiğini ve kardiyak kolinerjik ve katekolaminerjik aktivite arasındaki etkileşimleri araştırmak için değerli bir deneysel yaklaşımı tanımlar.
Açıklamalar
Beyan edilecek herhangi bir çıkar çatışması yok.
Teşekkürler
Bu çalışma, NIH R01 HL144157 MWK, NIH R01 HL144157 EE ve MWK ve NIH R01s HL147279 ve HL146169 MWK ve DM ve RR için Collins Seçkin Doktora Bursu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Referanslar
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır