Method Article
Ativação optogenética de neurônios autônomos cardíacos intrínsecos em corações de camundongos perfundidos excisados
Neste Artigo
Resumo
Este protocolo ilustra um método para estimulação optogenética de neurônios cardíacos intrínsecos em corações de camundongos transgênicos. A abordagem descrita é usada para investigar a cinética da ativação súbita de neurônios cardíacos em corações perfundidos ex vivo e as interações entre a atividade colinérgica e catecolaminérgica.
Resumo
Um equilíbrio de ativação colinérgica e catecolaminérgica é necessário para manter a saúde do coração. Interrogar a interação entre essas vias pode ser feito usando optogenética por meio da expressão seletiva de canalrodopsina-2 (ChR2) em neurônios autonômicos cardíacos. Tais aplicações cardíacas da optogenética permitem o estudo da liberação intrínseca de neurotransmissores de maneira espaço-temporal. Este método ilustra uma abordagem ex vivo para estimulação optogenética específica de neurônios cardíacos em corações de camundongos perfundidos. Camundongos transgênicos foram criados para expressar ChR2 em neurônios colina acetiltransferase (ChAT) ou tirosina hidroxilase (TH) em todo o corpo. Um micro-LED (465 nm) envolto em um elastômero de silicone foi preparado para estimular os neurônios do átrio direito que inervam o nó sinoatrial. O micro-LED foi conectado a um grupo gerador de funções para pulsar ondas a 10 Hz com largura de pulso de 30 ms. Corações com expressão confirmada foram excisados e perfundidos retrógradamente em um sistema de Langendorff circulando solução de Krebs-Henseleit. O eletrocardiograma (ECG), a temperatura e a taxa de fluxo coronariano foram registrados usando o software LabChart. Uma vez que o coração se estabilizou, o micro-LED foi colocado no átrio direito e testado para uma resposta ideal da frequência cardíaca. Uma aplicação dessa abordagem combina a liberação intrínseca de neurotransmissor colinérgico (acetilcolina) durante a ativação optogenética de um coração de camundongo ChAT-ChR2 simultaneamente com o aumento do neurotransmissor catecolaminérgico exógeno (norepinefrina) adicionado ao perfusato. As mudanças resultantes na frequência cardíaca durante a ativação colinérgica e catecolaminérgica simultânea são apresentadas. Este método descreve uma abordagem experimental valiosa para investigar a cinética da ativação súbita de neurônios autônomos intrínsecos em corações perfundidos e as interações entre a atividade colinérgica cardíaca e catecolaminérgica.
Introdução
A optogenética é um método para introduzir proteínas sensíveis à luz (opsinas) em populações de células alvo. Isso permite a modulação espaço-temporal de células e tecidos específicos que não podem ser alcançados por meios elétricos ou químicos1. As aplicações cardíacas da optogenética tornaram-se cada vez mais populares nos últimos 15 anos2. A fotoestimulação de opsinas excitatórias, como a canalrodopsina-2 (ChR2), um cátion, em miócitos ou neurônios cardíacos resulta em despolarização celular, causando alterações no ritmo cardíaco3. Existem duas maneiras de expressar seletivamente opsinas em populações de células usando a abordagem Cre-lox: transdução viral4 e cruzamento de animais transgênicos5. A expressão seletiva de ChR2 em neurônios autonômicos específicos pode ser realizada por cruzamento para criar descendentes que expressam ChR2 em neurônios colinérgicos ou catecolaminérgicos usando promotores específicos de células6. Um pai com um gene ChR2 floxed pode ser acasalado com um pai que expressa Cre recombinase sob o controle de um promotor como tirosina hidroxilase (TH, neurônios catecolaminérgicos) ou colina acetiltransferase (ChAT, neurônios colinérgicos). A prole então expressa ChR2 em neurônios TH ou ChAT em todo o corpo7.
A resposta funcional do coração à ativação aguda de neurônios autônomos pode ser investigada usando a expressão de ChR2 impulsionada por promotores em populações neuronais específicas, por exemplo, neurônios colinérgicos ou catecolaminérgicos. O intervalo e a intensidade do pulso de fotoestimulação podem ser variados para controlar a taxa de despolarização desses neurônios que expressam ChR2 para estudar como os níveis de ativação neural modulam a função cardíaca8. Para este método, os neurônios serão usados para se referir a quaisquer corpos celulares, axônios e/ou projeções axonais que são optogeneticamente ativados para simplificar. Também é possível combinar a fotoestimulação com a ativação química pela introdução de drogas ou neurotransmissores para interrogar efeitos simultâneos no ritmo cardíaco e na contratilidade9. Por exemplo, a estimulação colinérgica optogenética pode ser combinada com a injeção de norepinefrina exógena (NE) para examinar o impacto da ativação autonômica concomitante no coração. A realização de tais estudos usando corações perfundidos isolados tem a vantagem de fornecer uma plataforma experimental bem controlada para estudar as alterações funcionais causadas pela fotoativação10. Alterações na morfologia do ECG, frequência cardíaca e taxa de fluxo coronariano podem ser monitoradas enquanto a temperatura, a oxigenação e a pressão de perfusão são rigidamente controladas.
O objetivo deste protocolo é apresentar uma abordagem experimental para ativar uma população específica de neurônios autônomos em corações de camundongos para estudar mudanças na frequência cardíaca. A construção e o uso de um dispositivo micro-LED para ativação optogenética em corações perfundidos também são apresentados. Corações de camundongos que expressam ChR2 em neurônios colinérgicos ou catecolaminérgicos foram excisados e perfundidos retrógradamente com uma solução oxigenada de Krebs-Henseleit a pressão constante. ChR2 expressos nos neurônios do átrio direito (AR) foram fotoestimulados a uma taxa de pulso de 10 Hz com uma largura de pulso de 30 ms. A frequência cardíaca instantânea foi calculada usando o intervalo RR e monitorada quanto a alterações durante a fotoestimulação. Um exemplo de experimento para estudar a cinética da frequência cardíaca durante a fotoestimulação optogenética intrínseca do neurônio ChAT simultaneamente com a ativação beta-adrenérgica usando norepinefrina exógena também é descrito.
Protocolo
Todos os protocolos de animais foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade George Washington e seguiram o Guia do Instituto Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório.
1. Construção da fonte luminosa do Micro-diodo emissor de luz
- Sob um microscópio de dissecação em uma área bem ventilada, solde as extremidades descascadas de dois fios de cobre isolados, com pelo menos 20 cm de comprimento, aos pontos de contato de um micro-LED de 465 nm (Figura 1). Teste a solda conectando o LED a uma fonte de alimentação e ligando-o.
- Corte o fundo 1 cm de uma ponta de pipeta filtrada de 200 μL. Empurre o filtro para fora usando uma haste de pequeno diâmetro. Insira o micro-LED com fios na ponta da pipeta de forma que o LED fique nivelado com a extremidade da ponteira. Recoloque o filtro na parte superior da ponta da pipeta para manter o LED e os fios no lugar e, em seguida, cole as bordas do LED na ponta da pipeta. Deixe a supercola secar.
- Prepare o elastômero de silicone combinando a base e o agente de cura na proporção de 10:1 e misture bem. Remova quaisquer bolhas da mistura usando uma câmara de vácuo ou centrifugando.
- Pegue um tubo de centrífuga de 0,5 mL e marque as laterais para facilitar a remoção do LED (lubrificante também pode ser adicionado ao interior do tubo aqui, se desejado). Prenda a parte externa do tubo para garantir que não haja vazamentos. Despeje aproximadamente 0,2 mL da mistura de elastômero de silicone no tubo e, em seguida, coloque a ponta da pipeta micro-LED no tubo, deixando pelo menos 1 mm de espaço entre o LED e o fundo do tubo. Se houver formação de bolhas, bata o tubo da centrífuga em uma superfície dura para desalojá-las.
NOTA: A ponta da pipeta pode ser revestida preventivamente com elastômero de silicone para reduzir a formação de bolhas ao colocar o LED. - Coloque o micro-LED do tubo de centrífuga na vertical em um forno de laboratório ou incubadora a 50 °C e deixe por pelo menos 8 h ou durante a noite. Use luvas resistentes ao calor ao interagir com o forno. Assim que o elastômero estiver endurecido, remova o LED do tubo da centrífuga. Se o elastômero ainda estiver pegajoso, coloque-o de volta no forno.
- Depois de totalmente curado, remova qualquer excesso de elastômero da ponta do LED com um estilete de precisão, não deixando mais de 1 mm. O encapsulamento adequado do LED minimizará o aquecimento do tecido durante a fotoestimulação.
- Determine a potência óptica do LED usando um medidor de potência óptica. Ligue o medidor de potência e ajuste as configurações de comprimento de onda para ler 465 nm. Coloque o LED alinhado com um sensor de potência de fotodiodo e acenda o LED com o gerador de funções. O medidor de potência óptica produzirá uma leitura em watts. Calcule a irradiância dividindo a leitura de potência pela área da superfície iluminada (0,88 mm2).
NOTA: A irradiância ideal deve ser de aproximadamente 2.4 mW/mm2 para ativação apropriada de ChR211.
2. Preparação experimental
- Camundongos criados de acordo com a publicação anterior para expressar ChR2 em neurônios colinérgicos (ChAT-ChR2) ou neurônios catecolaminérgicos (TH-ChR2)12 (Figura 2). Confirmar a expressão de TH-Cre ou ChAT-Cre em camundongos usados para experimentos usando uma abordagem de genotipagem conforme descrito anteriormente12.
- Prepare pelo menos 225 mL de solução de Krebs-Henseleit (KH) (em mM: 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 glicose) e filtre usando um filtro de membrana de nitrato de celulose de 0,2 μm. Ajuste o pH para 7,4 quando oxigenado usando 95% O2 e 5% CO2.
- Enxágue o sistema de perfusão Langendorff com água purificada antes do experimento e remova o excesso de água antes de iniciar o experimento.
- Adicione um filtro de membrana de 10 μm ao sistema antes que qualquer KH circule. Ligue os banhos-maria configurados para manter a temperatura do perfusato a 37 °C em vazões entre 2-5 mL/min.
- Adicione 175 mL de KH ao sistema de perfusão e inicie a circulação. Borbulhe a solução com 95% de O2 / 5% de CO2 para fornecer oxigenação adequada.
NOTA: O volume circulante de KH varia de sistema para sistema, dependendo dos tamanhos da tubulação e do reservatório. - Calibre o medidor de vazão interrompendo o fluxo através do sistema de perfusão com uma torneira e pressionando o botão Zero no medidor de vazão.
- Prepare um software de aquisição de dados fisiológicos, como o LabChart, para ter 12 canais: temperatura do banho cardíaco, temperatura do perfusato aórtico, derivações de ECG I-III mais quatro derivações computadas adicionais, cálculo da frequência cardíaca, taxa de fluxo e saída do gerador de função para rastrear pulsos de LED.
- Usando o canal reservado para a frequência cardíaca, calcule a frequência cardíaca no LabChart com o recurso de medições cíclicas definido para detectar o ECG do camundongo na derivação I. A extensão do eixo cardíaco do LabChart usa a derivação I e a derivação II para calcular a derivação III, aVR, aVL e aVF.
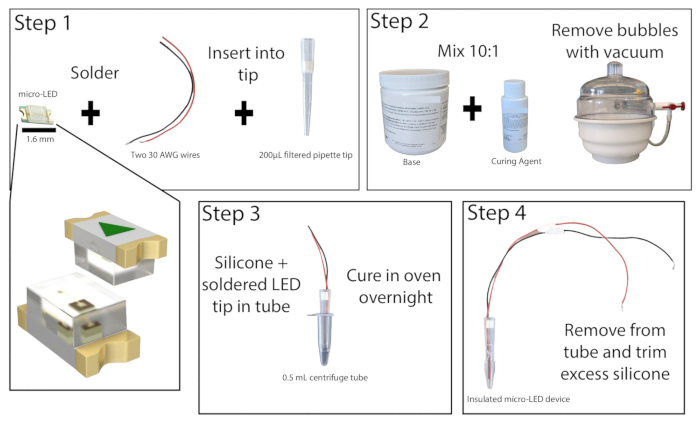
Figura 1: Construção Micro-LED. Visão geral simplificada das etapas para a construção de uma fonte de luz micro-LED. Dois fios são soldados ao micro-LED e inseridos em uma ponta de pipeta de 200 μL e, em seguida, colados (Etapa 1). O elastômero de silicone é misturado na proporção de 10:1 e colocado em uma câmara de vácuo para remover as bolhas (Etapa 2). O elastômero de silicone é derramado em um tubo de microcentrífuga e a ponta da pipeta micro-LED é inserida e deixada curar durante a noite (Etapa 3). O micro-LED isolado é então removido do tubo e o excesso de silicone deve ser aparado (Etapa 4). Clique aqui para ver uma versão maior desta figura.
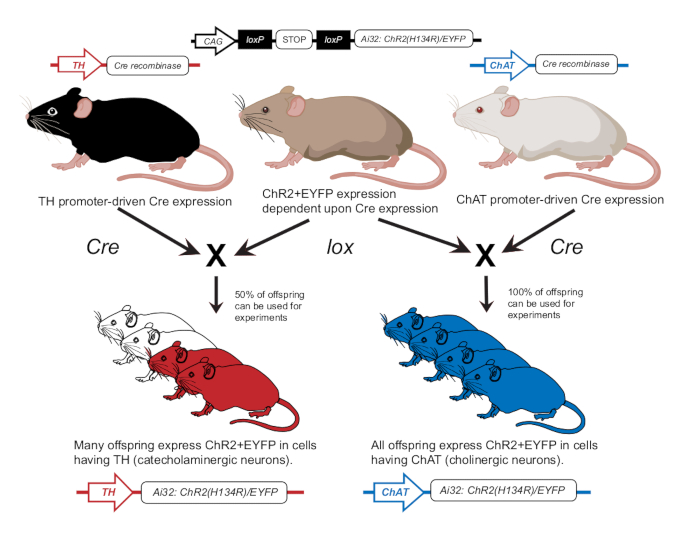
Figura 2: Esquema de reprodução de camundongos transgênicos. Um camundongo pai com o gene ChR2 dependente de lox é cruzado com outro camundongo com um promotor de Cre. Um camundongo pai com promotor de Tirosina Hidroxilase (TH) Cre produzirá descendentes heterozigotos, onde 50% expressarão ChR2 em células catecolaminérgicas. Um camundongo pai com promotor Cre da colina acetiltransferase (ChAT) produzirá descendentes homozigóticos onde 100% expressarão ChR2 em células colinérgicas. A expressão é confirmada por meio de genotipagem. Este número foi modificado com permissão de12. Clique aqui para ver uma versão maior desta figura.
3. Excisão e perfusão cardíaca
- Antes da excisão, administre 250 unidades de heparina (aproximadamente 8 U/g) por injeção intraperitoneal usando uma seringa de 1 mL. Aguarde pelo menos 10 minutos antes da cirurgia.
- Coloque um camundongo adulto em uma câmara de indução de anestesia. Administre ~ 4% de isoflurano e espere até que a taxa de respiração diminua e se aprofunde. Remova o mouse da câmara e verifique a cessação de um reflexo de dor por pinça do dedo do pé antes de realizar a luxação cervical.
- Segure o processo xifóide com uma pinça e corte a cavidade abdominal usando uma tesoura cirúrgica. Abra a cavidade torácica cortando cuidadosamente o diafragma. Corte as costelas para expor o coração e os pulmões. Agarre suavemente os pulmões e excise o coração e os pulmões.
- Coloque o coração em um prato de KH heparinizado. Remova os pulmões e quaisquer pedaços grandes de gordura. Coloque o coração limpo em um2º prato de KH heparinizado sob um microscópio de dissecação ajustado para ampliação de 2x. Localize a aorta e deslize-a sobre a cânula usando uma pinça fina. Prenda o coração a uma cânula usando sutura de seda 4-0.
NOTA: A canulação pode ser feita sobre gelo para reduzir a atividade metabólica do coração. - Lave uma injeção em bolus de KH heparinizado através da cânula para remover o sangue das coronárias antes de ser colocado no sistema de perfusão.
- Conecte o coração canulado ao sistema de perfusão e coloque-o no prato PDMS cheio de perfusato. Coloque os eletrodos de agulha de ECG no prato PDMS de acordo com o triângulo de Einthoven13. Aclimatar o coração por pelo menos 5 min.
- Gire o coração para que o átrio esquerdo fique acessível e faça um orifício de ~ 1 mm no átrio esquerdo com uma tesoura de micro abertura automática. Insira um tubo de 1 mm de diâmetro através desta fatia no ventrículo esquerdo para liberar o perfusato preso lá.
NOTA: Ter um microscópio de dissecação para examinar o coração pode melhorar a facilidade desta etapa. - Gire o coração de forma que o AR fique voltado para cima e o nó sinoatrial (SA) esteja acessível para iluminação (Figura 3).
- Ajuste os eletrodos de ECG conforme necessário, movendo os eletrodos para mais perto do coração ou submergindo-os em perfusato para receber os sinais com uma relação sinal-ruído adequada. As configurações podem variar de acordo com o hardware e o software de aquisição de ECG que estão sendo usados. Este método usou um módulo Einthoven Goldberger com um ganho de 2000 e um filtro de corte de 500 Hz, e as configurações de software incluíam um filtro de rede e uma frequência de amostragem de 1000 Hz.
4. Ativação optogenética
- Conecte o dispositivo micro-LED a um grupo gerador de funções para produzir ondas de pulso nos seguintes parâmetros: frequência de 10 Hz, largura de pulso de 30 ms, amplitude de 10 Vpp .
- Coloque o micro-LED suavemente no nó SA. Evite pressionar com muita força com o micro-LED, pois isso pode resultar em diminuição da frequência cardíaca e da função.
- Ligue o gerador de funções e avalie as alterações na frequência cardíaca a partir da fotoestimulação. Alterações imediatas na frequência cardíaca indicam ativação eficaz. A ativação catecolaminérgica causa um aumento exponencial da freqüência cardíaca10, enquanto a ativação colinérgica causa uma queda imediata8.
- Desligue o gerador de funções. Permita que a frequência cardíaca retorne aos níveis de pré-ativação.
- Se a ativação optogenética resultar em uma alteração da frequência cardíaca inferior a 100 bpm, reposicione o micro-LED para iluminar melhor os neurônios do AR. Repita conforme necessário.
5. Procedimento experimental e análise dos dados
- Para testar a hipótese de que a estimulação colinérgica optogenética intrínseca pode suprimir a ativação beta-adrenérgica exógena pela norepinefrina (NE), prepare soluções estoque de NE de 10 μM e 100 μM em um alimento fumegante.
- Adicione uma dose em bolus de NE ao sistema de perfusão por uma porta de injeção. Assim que a frequência cardíaca aumentar os platôs, ligue o micro-LED por ~ 10 s. Apague a luz e monitore as mudanças na frequência cardíaca.
- Depois que a frequência cardíaca retornar ao ritmo sinusal, aumente a dose de NE e repita a estimulação optogenética. Continue para cada dose de NE.
- Ao final do estudo, desligue o suprimento de gás, retire o coração do sistema e conserve-o no fixador, conforme necessário.
- Enxágue os reservatórios e a tubulação do sistema de perfusão com água DI ou detergente conforme necessário. Seque bem o sistema para evitar mofo.
- Salve o arquivo LabChart. Exporte o sinal de frequência cardíaca e os canais de ECG para análise offline e apresentação gráfica.
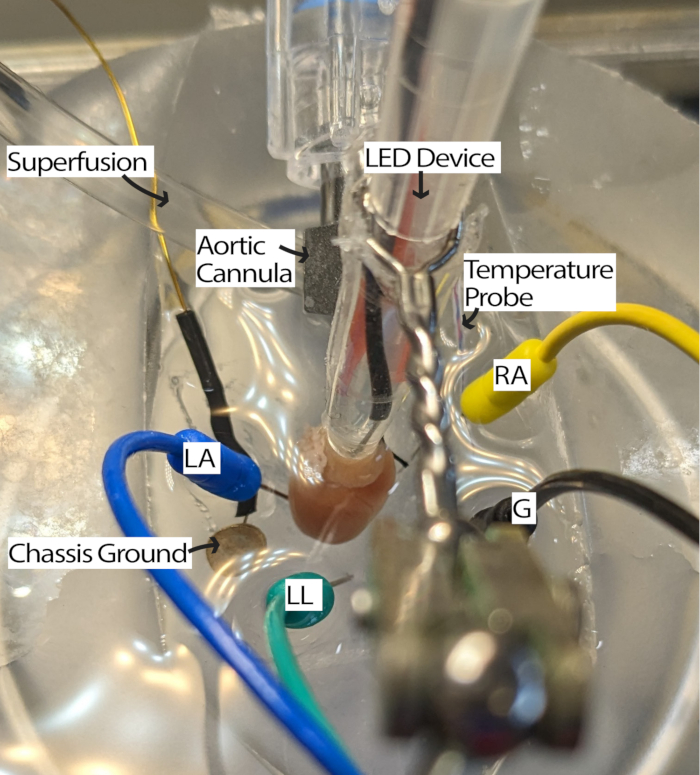
Figura 3: Configuração do banho de coração de camundongo. Um coração de camundongo canulado mostrando a colocação do dispositivo LED e eletrodos de ECG. Um aterramento do chassi está presente para reduzir o ruído dos componentes eletrônicos ao redor. Os eletrodos de agulha de ECG são colocados com base no triângulo de Einthoven. Abreviaturas: LA = braço esquerdo; AD = braço direito; LL = perna esquerda; G = terra. Clique aqui para ver uma versão maior desta figura.
Resultados
Um sistema de perfusão de pressão constante de Langendorff (Figura 4) deve ser capaz de manter a frequência cardíaca de camundongos de pelo menos 300 bpm por mais de uma hora se houver oxigenação, temperatura e fluxo coronário apropriados. Com essa configuração, a temperatura do perfusato aórtico depende do fluxo coronário, portanto, as temperaturas do banho-maria podem precisar ser ajustadas à medida que a taxa de fluxo muda para manter a temperatura aórtica em 37 °C. As taxas de fluxo coronário do coração de camundongos geralmente variam de 1,5 a 4,5 mL / min, dependendo do tamanho do coração. Manter a temperatura de perfusato a 37 °C durante as flutuações da taxa de fluxo é necessário para uma função cardíaca consistente e é especialmente importante para a perfusão de pressão constante. O sistema de perfusão descrito foi projetado para manter uma pressão hidrostática de 70 mmHg através da altura da coluna de perfusato. Isso é feito com uma taxa de bombeamento que fornece transbordamento consistente do reservatório superior. O perfusato pode ser suplementado com 20 μM do vasodilatador cromacalina para melhorar e manter o fluxo coronariano normal ou supranormal para garantir a oxigenação miocárdica completa14.
A fotoestimulação de neurônios colinérgicos em corações de camundongos ChAT-ChR2 a 10 Hz e largura de pulso de 30 ms deve resultar em uma queda quase instantânea na frequência cardíaca. A fotoestimulação eficiente de neurônios colinérgicos em corações adequadamente perfundidos deve levar a uma redução na frequência cardíaca de pelo menos 100 bpm. A Figura 5 mostra uma queda imediata de 75 bpm quando o micro-LED é ligado que continua a cair até atingir uma diminuição máxima de 135 bpm. Meio segundo após desligar o micro-LED, a frequência cardíaca aumenta para 175 bpm antes de retornar gradualmente aos níveis de pré-estimulação. Um ECG de seis derivações é apresentado para ilustrar as diferenças no intervalo RR antes, durante e após a estimulação (Figura 5B). As derivações aVR, aVL e aVF são calculadas no software LabChart usando as derivações I e II.
A fotoestimulação de neurônios catecolaminérgicos em corações de camundongos TH-ChR2 causa uma mudança mais gradual (exponencial) na frequência cardíaca em comparação com a fotoestimulação de neurônios colinérgicos. Isso provavelmente é causado pela ativação beta1-adrenérgica que requer o segundo sistema mensageiro de cAMP ativando PKA, que fosforila proteínas-alvo, enquanto a ativação muscarínica não. A Figura 6 demonstra um aumento de 135 bpm na frequência cardíaca ao longo de 10 s. São necessários 10 s adicionais após o desligamento da luz para retornar ao ritmo sinusal normal. Se o micro-LED não estiver devidamente isolado, pode aquecer o coração, causando um aumento na frequência cardíaca. Essa resposta de aquecimento é menos intensa do que a estimulação TH-ChR2; portanto, a mudança na frequência cardíaca é menos pronunciada.
Uma aplicação deste protocolo é usar estimulação optogenética para despolarizar neurônios, levando à liberação de neurotransmissores endógenos e, ao mesmo tempo, adicionando neurotransmissores exógenos ao perfusato. A Figura 7A ilustra a liberação endógena de acetilcolina de um coração de camundongo ChAT-ChR2 com uma dose em bolus de NE adicionada ao perfusato. Sem a presença de NE, a fotoestimulação fez com que a frequência cardíaca caísse mais de 100 bpm e manteve essa queda durante a estimulação. Já com uma grande dose de NE (2000 nM), a queda máxima da frequência cardíaca durante a fotoestimulação foi de 40 bpm. A frequência cardíaca imediatamente começou a subir, quase atingindo os níveis de pré-estimulação antes que a luz fosse desligada. Este resultado indica que a supressão optogenética da frequência cardíaca pela fotoestimulação do neurônio ChAT foi incapaz de suprimir totalmente os aumentos na frequência cardíaca resultantes de uma alta dose de NE, causando menor tempo de supressão da frequência cardíaca e menores diminuições na frequência cardíaca (Figura 7B). Esses resultados são consistentes com trabalhos anteriores em animais de grande porte que demonstraram bloqueio progressivo do nó AV durante a estimulação simultânea do nervo vago e dos gânglios estrelados12,13.
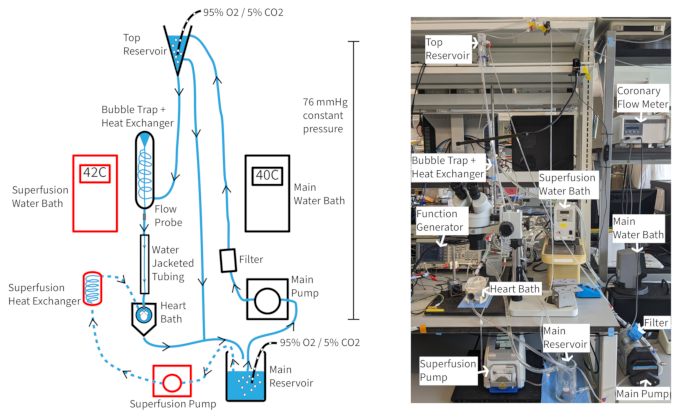
Figura 4: Configuração experimental. Diagrama do sistema de perfusão. As setas mostram a direção do perfusato. O perfusato de superfusão é indicado por linhas tracejadas e os componentes são contornados em vermelho. Clique aqui para ver uma versão maior desta figura.
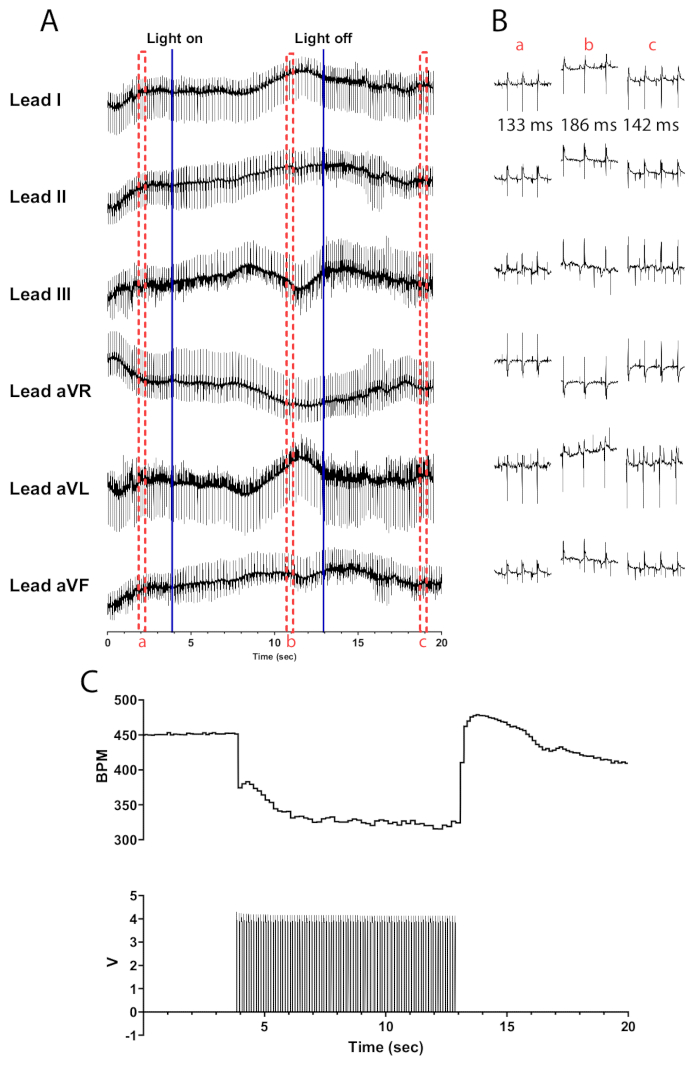
Figura 5: Resposta representativa de fotoestimulação colinérgica. (A) Um ECG de 6 derivações durante a ativação optogenética do ChAT-ChR2. Linhas azuis sólidas indicam que o micro-LED está sendo ligado/desligado. As caixas tracejadas vermelhas indicam o tempo para (B) snippets. (B) Trechos de meio segundo do sinal de ECG antes de (a), durante (b) e após a fotoestimulação (c). O intervalo RR é mostrado para cada seção. (C) A frequência cardíaca (superior) é mostrada junto com as ondas de pulso de um gerador de funções (inferior). A frequência cardíaca começa em 450 bpm e cai para 315 bpm após 8 s de fotoestimulação antes de retornar a 410 bpm 7 s após o término da fotoestimulação. Clique aqui para ver uma versão maior desta figura.
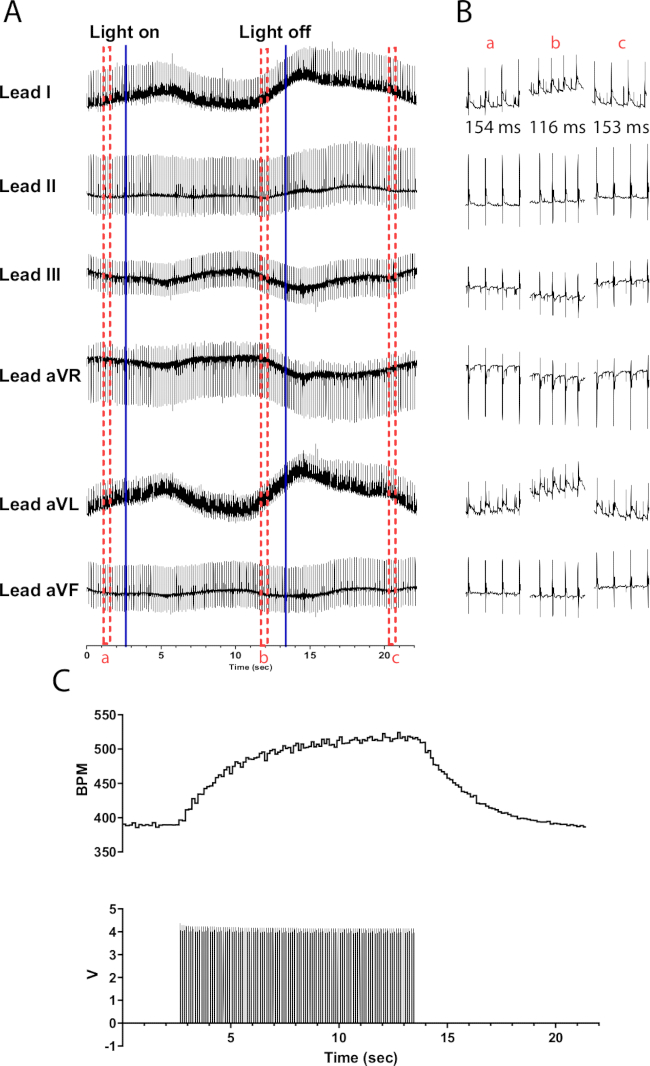
Figura 6: Resposta representativa de fotoestimulação catecolaminérgica. (A) Um ECG de 6 derivações durante a ativação optogenética TH-ChR2. Linhas azuis sólidas indicam que o micro-LED está sendo ligado/desligado. As caixas tracejadas vermelhas indicam o tempo para (B) snippets. (B) Trechos de meio segundo do sinal de ECG antes de (a), durante (b) e após a fotoestimulação (c). O intervalo RR é mostrado para cada seção. (C) A frequência cardíaca (superior) é mostrada junto com as ondas de pulso de um gerador de funções (inferior). A frequência cardíaca começa em 390 bpm e atinge o pico de 525 bpm após 10 s de fotoestimulação antes de retornar a 390 bpm 8 s após o término da fotoestimulação. Clique aqui para ver uma versão maior desta figura.
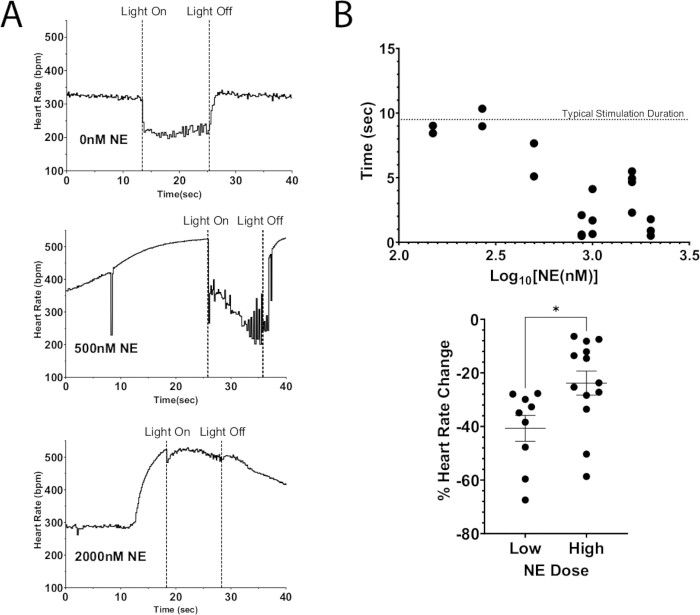
Figura 7: Fotoestimulação colinérgica com NE exógena. (A) Resposta da frequência cardíaca durante a fotoestimulação ChAT-ChR2 com doses crescentes de NE adicionadas ao perfusato. Uma vez que a frequência cardíaca atingiu um aumento máximo devido ao NE, o micro-LED foi ligado por aproximadamente 10 s. A supressão da frequência cardíaca ainda era possível em altas doses de NE, mas a duração da estimulação diminuiu à medida que a dose aumentava. (B) A quantidade de tempo que a frequência cardíaca permaneceu suprimida. Tempos mais próximos de 10 s geralmente permaneciam suprimidos durante toda a duração da estimulação. (C) A queda na frequência cardíaca durante a fotoestimulação foi menos grave em doses mais altas de NE do que em doses baixas. Doses baixas resultaram em uma diminuição média na frequência cardíaca de 40%, enquanto doses mais altas caíram apenas 25%. Um teste t não pareado foi realizado para avaliar a significância estatística. Apresentado como erro padrão da média * p < 0,05. Clique aqui para ver uma versão maior desta figura.
Discussão
A estimulação optogenética de neurônios autonômicos cardíacos intrínsecos produziu níveis comparáveis de resposta da frequência cardíaca como estimulação elétrica do nervo vago ou gânglios estrelados14,15. A estimulação elétrica de corações perfundidos excisados, no entanto, não tem a vantagem de ser capaz de atingir facilmente populações específicas de neurônios. A ativação farmacológica oferece o benefício de direcionar receptores específicos, mas não tem especificidade espacial, e o tempo de resposta depende da taxa de fluxo coronariano. A ativação optogenética fornece o benefício da resposta quase instantânea, o direcionamento de populações neuronais e a capacidade de alterar o nível de fotoestimulação16. Neste protocolo, também explicamos como construir uma fonte de luz simples e de baixo custo para fotoestimular os neurônios cardíacos intrínsecos.
O desenvolvimento de uma compreensão mais aprofundada do impacto do sistema nervoso intracardíaco facilitará um melhor diagnóstico e tratamento das doenças cardiovasculares. A expressão seletiva de ChR2 permite testar novas hipóteses relacionadas à atividade de populações nervosas específicas durante a doença. As populações nervosas em todo o coração podem ser interrogadas dessa maneira, como gânglios cardíacos intrínsecos ao redor das veias pulmonares ou ao longo dos ventrículos. Por exemplo, em modelos de camundongos de infarto do miocárdio, a fotoestimulação de neurônios autônomos intrínsecos pode ser útil para interrogar mudanças eletrofisiológicas no tecido da zona de borda à medida que o infarto evolui e os neurônios sofrem transdiferenciação17. Neste protocolo, descrevemos outro exemplo envolvendo experimentos controlados de respostas cardíacas agudas à ativação simultânea de vias colinérgicas e catecolaminérgicas, onde a combinação de agentes optogenéticos e farmacológicos permite que respostas únicas à dose sejam examinadas. Essa ativação concomitante é um fenômeno associado ao afogamento, conhecido como conflito autonômico, que ainda não foi totalmente elucidado18. Além disso, dadas as combinações apropriadas de luz, corante e filtro, este protocolo pode ser combinado com o mapeamento óptico cardíaco para estudar os efeitos agudos da estimulação de neurônios autônomos na eletrofisiologia cardíaca e nos mecanismos de arritmia neurocardíaca 19,20,21.
Existem vários conceitos importantes a serem considerados ao usar este protocolo para estudar o sistema nervoso cardíaco intrínseco em corações perfundidos excisados. Os corações dos camundongos são sensíveis a pequenas mudanças no ambiente de perfusão. O monitoramento rigoroso da frequência cardíaca é útil para identificar problemas com a perfusão coronariana que podem causar baixa oxigenação do miocárdio, isquemia e má função cardíaca. O protocolo recomenda oxigenar o perfusato no reservatório principal e superior para limitar possíveis problemas. A submersão total do tubo de oxigenação ajuda a garantir níveis ideais de oxigênio no perfusato. Uma lanterna ultravioleta pode ser apontada para o coração para revelar a fluorescência do NADH indicando hipóxia/isquemia, e a oxigenação pode ser ajustada de acordo19,20. A temperatura do perfusato depende da taxa de fluxo coronariano durante a perfusão de pressão constante. Se a taxa de fluxo coronário cair, a temperatura do perfusato aórtico também pode cair devido ao resfriamento no tubo proximal à cânula aórtica, resultando em uma frequência cardíaca mais baixa. Aumentar a temperatura do banho-maria de perfusato pode ajudar a reverter esse problema. Este protocolo também utiliza um loop de superfusão para manter uma temperatura de banho cardíaco de 37 °C. Quedas na temperatura do banho cardíaco podem exigir que a taxa de fluxo de superfusão seja aumentada. O micro-LED é outra fonte de possíveis mudanças na temperatura do coração, pois a temperatura do AR pode aumentar durante a fotoestimulação. Se o elastômero de silicone que envolve o dispositivo for muito fino, o micro-LED pode aquecer e aquecer o nó SA, resultando em um aumento inesperado na frequência cardíaca. Testar a fonte de luz micro-LED em um coração selvagem pode ser útil para medir os níveis de aquecimento. O micro-LED não deve causar um aumento da frequência cardíaca de mais de 10% em 30 s. Se isso ocorrer, o elastômero de silicone deve ser substituído.
O objetivo dos experimentos ex vivo com coração perfundido é recriar condições fisiológicas próximas com variáveis controláveis, mas elas apresentam limitações22. O perfusato cristalóide é o padrão para esses experimentos; no entanto, pode limitar o fornecimento de oxigênio às mitocôndrias sob condições de alto estresse23,24. Além disso, o perfusato não possui hormônios circulantes que ocorreriam naturalmente in vivo. Uma limitação adicional é que a intensidade variável da luz e o posicionamento do micro-LED podem resultar em disparidades locais na estimulação neural, portanto, alguns ajustes no posicionamento do micro-LED acima do coração são sempre necessários antes de iniciar um protocolo experimental.
Em resumo, este protocolo ilustra uma abordagem ex vivo para estimulação optogenética específica de neurônios cardíacos em corações de camundongos perfundidos. Uma fonte de luz micro-LED foi construída para estimular os neurônios do átrio direito. Uma aplicação dessa abordagem combinou a liberação intrínseca de acetilcolina durante a ativação optogenética de um coração de camundongo ChAT-ChR2 simultaneamente com o aumento do NE exógeno. As mudanças resultantes na freqüência cardíaca durante a ativação catecolaminérgica e colinérgica simultânea foram apresentadas. Este protocolo descreve uma abordagem experimental valiosa para investigar a cinética da ativação súbita de neurônios autônomos intrínsecos em corações perfundidos e as interações entre a atividade colinérgica cardíaca e catecolaminérgica.
Divulgações
Não há conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado pelo NIH R01 HL144157 para MWK, NIH R01 HL144157 para EE e MWK, e NIH R01s HL147279 e HL146169 para MWK e DM, e uma bolsa de doutorado distinta Collins para RR.
Materiais
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Referências
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados