Method Article
절제된 관류 마우스 심장에서 내재적 심장 자율 뉴런의 광유전학적 활성화(Optogenetic Activation of Intrinsic Cardiac Autonomic Neurons in Excised Perfused Mouse Hearts)
요약
이 프로토콜은 형질전환 마우스 심장에서 내재적 심장 뉴런의 광유전학적 자극 방법을 보여줍니다. 설명된 접근 방식은 생체 외 관류 심장에서 갑작스러운 심장 뉴런 활성화의 동역학과 콜린성 및 카테콜아민성 활성 간의 상호 작용을 조사하는 데 사용됩니다.
초록
콜린과 카테콜아민 활성화의 균형은 심장 건강을 유지하는 데 필요합니다. 이러한 경로 간의 상호 작용에 대한 조사는 심장 자율 뉴런에서 채널로돕신-2(ChR2)의 선택적 발현을 통해 광유전학을 사용하여 수행할 수 있습니다. 광유전학의 이러한 심장 응용은 시공간 방식으로 신경 전달 물질의 내재적 방출에 대한 연구를 가능하게 합니다. 이 방법은 관류된 마우스 심장에서 심장 뉴런의 특정 광유전학적 자극에 대한 생체 외 접근 방식을 보여줍니다. 형질전환 마우스는 몸 전체의 콜린 아세틸전이효소(ChAT) 또는 티로신 하이드록실라제(TH) 뉴런에서 ChR2를 발현하도록 사육되었습니다. 실리콘 엘라스토머로 둘러싸인 마이크로 LED(465nm)는 동방결절에 신경을 분포시키는 우심방의 뉴런을 자극하기 위해 준비되었습니다. 마이크로 LED는 30ms 펄스 폭으로 10Hz에서 맥파로 설정된 함수 발생기에 연결되었습니다. 발현이 확인된 심장을 절제하고 Krebs-Henseleit 용액을 순환하는 Langendorff 시스템에서 역행적으로 관류했습니다. 심전도(ECG), 온도 및 관상동맥 유속은 LabChart 소프트웨어를 사용하여 기록되었습니다. 심장이 안정되면 마이크로 LED를 우심방에 놓고 최적의 심박수 반응을 테스트했습니다. 이 접근법의 적용은 ChAT-ChR2 마우스 심장의 광유전학적 활성화 중 콜린성 신경전달물질(아세틸콜린)의 내인성 방출과 동시에 관류물에 첨가된 외인성 카테콜아민성 신경전달물질(노르에피네프린)의 증가를 결합합니다. 콜린과 카테콜아민이 동시에 활성화되는 동안 심박수의 결과적인 변화가 제시됩니다. 이 방법은 관류된 심장에서 갑작스런 내재적 자율 뉴런 활성화의 동역학과 심장 콜린성 및 카테콜아민성 활성 사이의 상호 작용을 조사하기 위한 귀중한 실험적 접근 방식을 설명합니다.
서문
광유전학(Optogenetics)은 빛에 민감한 단백질(opsin)을 표적 세포 집단에 도입하는 방법입니다. 이것은 전기적 또는 화학적 수단1을 사용하여 달성할 수 없는 특정 세포 및 조직의 시공간 조절을 가능하게 합니다. 광유전학의 심장 응용은 지난 15년 동안 점점 더 대중화되고 있습니다2. 심장 근세포나 뉴런에서 양이온인 채널로돕신-2(chR2)와 같은 흥분성 옵신의 광자극은 세포 탈분극을 일으켜 심장 박동에 변화를 일으킵니다3. Cre-lox 접근법을 사용하여 세포 집단에서 옵신을 선택적으로 발현하는 두 가지 방법이 있습니다: 바이러스 형질도입(viral transduction)4 및 형질전환 동물(transbreeding transgenic animals)5. 특정 자율 신경 세포에서 ChR2의 선택적 발현은 세포 특이적 프로모터를 사용하여 콜린성 또는 카테콜아민성 뉴런에서 ChR2를 발현하는 자손을 만들기 위해 교배를 통해 달성할 수 있습니다6. 플록스화된 ChR2 유전자를 가진 한 부모는 티로신 하이드록실라제(티로신 하이드록실라제, TH, 카테콜아민성 뉴런) 또는 콜린 아세틸전이효소(ChAT, 콜린성 뉴런)와 같은 프로모터의 제어 하에 Cre 재조합효소를 발현하는 부모와 짝짓기를 할 수 있습니다. 그런 다음 자손은 몸 전체의 TH 또는 ChAT 뉴런에서 ChR2를 발현합니다7.
자율신경 뉴런의 급성 활성화에 대한 심장의 기능적 반응은 특정 뉴런 집단, 예를 들어 콜린성 뉴런 또는 카테콜아민성 뉴런 내에서 ChR2의 프로모터 주도 발현을 사용하여 조사할 수 있습니다. 광자극, 펄스 간격 및 강도를 변경하여 ChR2 발현 뉴런의 탈분극 속도를 제어하여 신경 활성화 수준이 심장 기능을 조절하는 방법을 연구할 수 있습니다8. 이 방법의 경우, 뉴런은 단순화를 위해 광유전학적으로 활성화된 모든 세포체, 축삭 및/또는 축삭 돌기를 참조하는 데 사용됩니다. 또한 약물이나 신경전달물질의 도입을 통해 광자극과 화학적 활성화를 결합하여 심장 박동과 수축성에 대한 동시적 효과를 조사할 수 있다9. 예를 들어, 광유전학적 콜린성 자극은 외인성 노르에피네프린(NE) 주사와 결합하여 심장의 동시 자율신경 활성화의 영향을 조사할 수 있습니다. 분리된 관류 심장을 사용하여 이러한 연구를 수행하는 것은 광활성화로 인한 기능적 변화를 연구할 수 있는 잘 통제된 실험 플랫폼을 제공할 수 있는 이점이 있습니다10. ECG 형태, 심박수 및 관상 동맥 유량의 변화를 모니터링하면서 온도, 산소화 및 관류 압력을 엄격하게 제어할 수 있습니다.
이 프로토콜의 목적은 심박수의 변화를 연구하기 위해 마우스 심장에서 특정 자율 신경 세포 집단을 활성화하는 실험적 접근 방식을 제시하는 것입니다. 관류된 심장에서 광유전학적 활성화를 위한 마이크로 LED 장치의 구성 및 사용법도 제시됩니다. 콜린성 또는 카테콜아민성 뉴런에서 ChR2를 발현하는 마우스의 심장을 절제하고 일정한 압력에서 산소화된 Krebs-Henseleit 용액으로 역행적으로 관류했습니다. 우심방(RA)의 뉴런에서 발현된 ChR2를 30ms 펄스 폭으로 10Hz의 맥박수로 광자극했습니다. RR 간격을 사용하여 순간 심박수를 계산하고 광자극 중 변화를 모니터링했습니다. 외인성 노르에피네프린을 사용하여 베타 아드레날린 활성화와 동시에 내인성 광유전학 ChAT 뉴런 광자극 중 심박수 동역학을 연구하는 예시 실험도 설명됩니다.
프로토콜
모든 동물 프로토콜은 조지 워싱턴 대학의 동물 관리 및 사용 위원회의 승인을 받았으며 미국 국립보건원(National Institute of Health)의 실험실 동물 관리 및 사용 가이드를 따랐습니다.
1. 마이크로 LED 광원 건축
- 환기가 잘 되는 곳의 해부 현미경을 사용하여 길이가 20cm 이상인 두 개의 절연 구리선의 벗겨진 끝을 465nm 마이크로 LED의 접점에 납땜합니다(그림 1). LED를 전원에 연결하고 전원을 켜서 납땜을 테스트하십시오.
- 200μL 여과된 피펫 팁의 바닥을 1cm 자릅니다. 직경이 작은 막대를 사용하여 필터를 밀어냅니다. LED가 팁 끝과 같은 높이가 되도록 와이어가 있는 마이크로 LED를 피펫 팁에 삽입합니다. 피펫 팁 상단의 필터를 교체하여 LED와 전선을 제자리에 고정한 다음 LED 가장자리를 피펫 팁에 과접착합니다. 초강력 접착제를 건조시킵니다.
- 베이스와 경화제를 10:1의 비율로 결합하여 실리콘 엘라스토머를 준비하고 잘 혼합합니다. 진공 챔버를 사용하거나 원심분리를 통해 혼합물에서 기포를 제거합니다.
- 0.5mL 원심분리기 튜브를 사용하여 LED를 더 쉽게 제거할 수 있도록 측면에 점수를 매깁니다(원하는 경우 여기에서 튜브 내부에 윤활제를 추가할 수도 있음). 누출이 없도록 튜브 외부를 테이프로 감습니다. 약 0.2mL의 실리콘 엘라스토머 혼합물을 튜브에 붓고 마이크로 LED 피펫 팁을 튜브에 넣고 LED와 튜브 바닥 사이에 최소 1mm의 공간을 남겨둡니다. 거품이 형성되면 단단한 표면에 원심분리기 튜브를 두드려 거품을 제거합니다.
참고: 피펫 팁은 LED를 배치할 때 기포 형성을 줄이기 위해 실리콘 엘라스토머로 선제적으로 코팅할 수 있습니다. - 원심분리기 튜브 micro-LED를 50°C 실험실 오븐이나 인큐베이터에 똑바로 세우고 최소 8시간 또는 밤새 그대로 둡니다. 오븐과 상호 작용할 때는 내열 장갑을 착용하십시오. 엘라스토머가 굳어지면 원심분리기 튜브에서 LED를 제거합니다. 엘라스토머가 여전히 끈적거리면 오븐에 다시 넣으십시오.
- 완전히 경화되면 정밀 유틸리티 나이프로 LED 끝에서 여분의 엘라스토머를 제거하고 1mm 이하를 남겨둡니다. LED를 적절하게 캡슐화하면 광자극 중 조직의 가열을 최소화할 수 있습니다.
- 광 파워 미터를 사용하여 LED의 광 전력을 확인합니다. 파워 미터를 켜고 465nm를 읽도록 파장 설정을 조정합니다. LED를 포토다이오드 전력 센서와 나란히 놓고 함수 발생기로 LED를 켭니다. 광 파워 미터는 와트 단위의 판독값을 생성합니다. 전력 판독값을 조명된 표면의 면적(0.88mm2)으로 나누어 방사 조도를 계산합니다.
알림: 이상적인 방사 조도는 ChR211의 적절한 활성화를 위해 약 2.4mW/mm2여야 합니다.
2. 실험 준비
- 이전 간행물에 따라 콜린성 뉴런(ChAT-ChR2) 또는 카테콜아민성 뉴런(TH-ChR2)에서 ChR2를 발현하도록 마우스를 사육합니다(그림 2). 앞서 설명한 바와 같이 유전형 분석 접근법을 사용하여 실험에 사용된 마우스에서 TH-Cre 또는 ChAT-Cre의 발현을 확인합니다12.
- 최소 225mL의 Krebs-Henseleit(KH) 용액(mM: 118 NaCl, 4.7 KCl, 1.25 CaCl2, 0.57 MgSO4, 25 NaHCO3, 1.17 KH2PO4, 6 glucose)을 준비하고 0.2 μm 질산 셀룰로오스 멤브레인 필터를 사용하여 필터링합니다. 95% O2 및 5% CO2를 사용하여 산소화할 때 pH를 7.4로 조정합니다.
- 실험 전에 Langendorff 관류 시스템을 정제수로 헹구고 실험을 시작하기 전에 과도한 물을 제거하십시오.
- KH가 순환되기 전에 10μm 멤브레인 필터를 시스템에 추가합니다. 2-5mL/분 사이의 유속에서 37°C의 관류액 온도를 유지하도록 설정된 수조를 켭니다.
- 175mL의 KH를 관류 시스템에 추가하고 순환을 시작합니다. 용액을 95% O2 / 5% CO2 로 거품을 일으켜 적절한 산소화를 제공합니다.
알림: KH 순환량은 튜브 및 저장소 크기에 따라 시스템마다 다릅니다. - 스톱콕으로 관류 시스템을 통한 흐름을 중지하고 유량계의 Zero Button 을 눌러 유량계를 보정합니다.
- LabChart와 같은 생리학적 데이터 수집 소프트웨어를 준비하여 12개의 채널(심욕 온도, 대동맥 관류액 온도, ECG 리드 I-III과 4개의 추가 계산 리드, 심박수 계산, 유량 및 LED 펄스를 추적하기 위한 함수 발생기 출력)을 가질 수 있습니다.
- 심박수용으로 예약된 채널을 사용하여 리드 I에서 마우스 ECG를 감지하도록 설정된 순환 측정 기능으로 LabChart에서 심박수를 계산합니다. LabChart의 심장 축 확장은 리드 I과 리드 II를 사용하여 리드 III, aVR, aVL 및 aVF를 계산합니다.
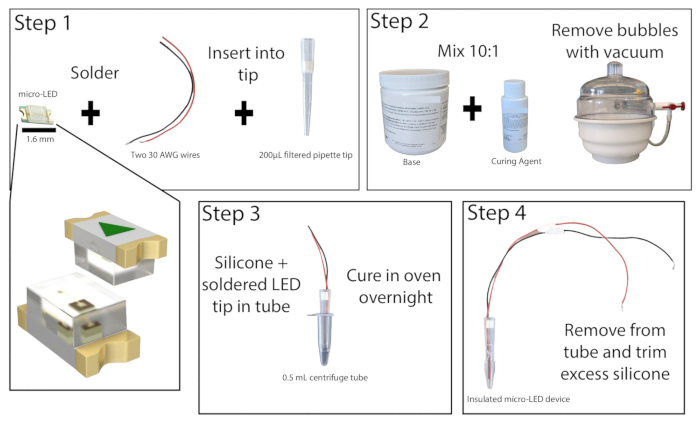
그림 1: 마이크로 LED 구조. 마이크로 LED 광원을 구성하기 위한 단계에 대한 단순화된 개요입니다. 두 개의 와이어를 마이크로 LED에 납땜하고 200μL 피펫 팁에 삽입한 다음 초접착합니다(1단계). 실리콘 엘라스토머를 10:1 비율로 혼합하고 진공 챔버에 넣어 기포를 제거합니다(2단계). 실리콘 엘라스토머를 마이크로 원심분리기 튜브에 붓고 마이크로 LED 피펫 팁을 삽입하여 밤새 경화시킵니다(3단계). 그런 다음 절연된 마이크로 LED를 튜브에서 제거하고 여분의 실리콘을 트리밍해야 합니다(4단계). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
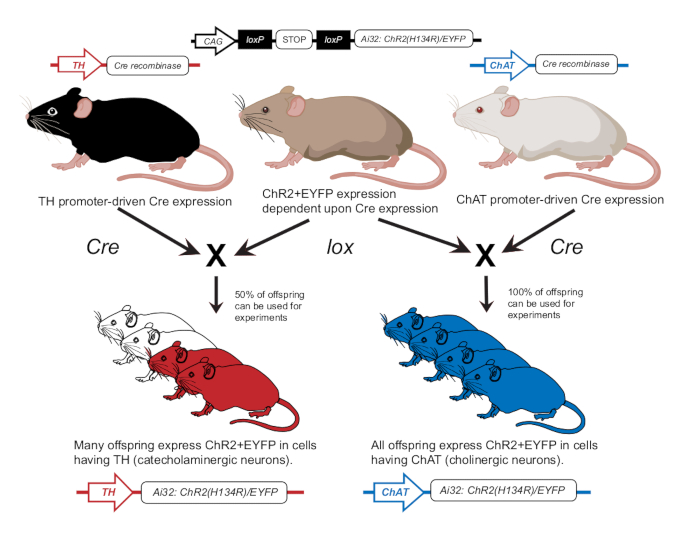
그림 2: 형질전환 마우스 육종 계획. lox-dependent ChR2 유전자를 가진 부모 마우스는 Cre promoter를 가진 다른 마우스와 교배됩니다. 티로신 하이드록실라제(TH) Cre 프로모터를 가진 부모 마우스는 이형접합 자손을 생산하며, 50%는 카테콜아민성 세포에서 ChR2를 발현합니다. 콜린 아세틸전이효소(ChAT) Cre 프로모터를 가진 부모 마우스는 콜린성 세포에서 ChR2를 100% 발현하는 동형접합 자손을 생산합니다. 발현은 유전형 분석을 통해 확인됩니다. 이 그림은12의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 심장 절제 및 관류
- 절제 전에 1mL 주사기를 사용하여 복강 내 주사로 헤파린 250단위(약 8U/g)를 투여합니다. 수술 10분 전에 최소 10분 정도 기다리세요.
- 성체 쥐를 마취 유도실에 넣습니다. ~4%의 이소플루란을 투여하고 호흡 수가 느려지고 깊어질 때까지 기다립니다. 챔버에서 마우스를 제거하고 경추 탈구를 수행하기 전에 발가락 꼬집기로 통증 반사가 중단되었는지 확인합니다.
- 한 쌍의 집게로 xiphoid 과정을 잡고 수술 용 가위를 사용하여 복강을 자릅니다. 횡격막을 조심스럽게 절단하여 흉강을 엽니다. 갈비뼈를 잘라 심장과 폐를 노출시킵니다. 부드럽게 폐를 잡고 심장과 폐를 절제합니다.
- 헤파린화된 KH 접시에 심장을 넣으십시오. 폐와 큰 지방 조각을 제거하십시오. 세척된 심장을 2배 배율로 설정된 해부 현미경 아래 헤파린화된 KH의2차 접시에 놓습니다. 대동맥을 찾아 가는 집게를 사용하여 캐뉼라 위로 밀어 넣습니다. 4-0 실크 봉합사를 사용하여 심장을 캐뉼라에 고정합니다.
참고: 캐뉼레이션은 심장의 신진대사 활동을 줄이기 위해 얼음 위에서 수행할 수 있습니다. - 관류 시스템에 놓이기 전에 관상 동맥에서 혈액을 제거하기 위해 캐뉼라를 통해 heparinized KH의 볼루스 주사를 플러시합니다.
- 캐뉼레이션된 심장을 관류 시스템에 연결하고 관류액으로 채워진 PDMS 접시에 넣습니다. 아인트호벤의 삼각형13에 따라 ECG 바늘 전극을 PDMS 접시에 넣습니다. 최소 5분 동안 심장에 적응시킵니다.
- 왼쪽 심방에 접근할 수 있도록 심장을 회전하고 마이크로 자동 개방 가위로 왼쪽 심방에 ~1mm 구멍을 자릅니다. 이 슬라이스를 통해 직경 1mm의 튜브를 좌심실에 삽입하여 거기에 갇힌 관류액을 방출합니다.
참고: 심장을 보기 위해 해부 현미경이 있으면 이 단계를 더 쉽게 수행할 수 있습니다. - RA가 위를 향하도록 심장을 회전하고 동방(SA) 노드에 조명을 위해 접근할 수 있습니다(그림 3).
- 전극을 심장에 더 가깝게 이동하거나 관류액에 담그면 적절한 신호 대 잡음비로 신호를 수신하여 필요에 따라 ECG 전극을 조정합니다. 설정은 사용 중인 ECG 획득 하드웨어 및 소프트웨어에 따라 달라질 수 있습니다. 이 방법은 게인이 2000이고 500Hz 차단 필터가 있는 Einthoven Goldberger 모듈을 사용했으며 소프트웨어 설정에는 주전원 필터와 1000Hz 샘플링 주파수가 포함되었습니다.
4. 광유전학적 활성화
- 마이크로 LED 장치를 10Hz 주파수, 30ms 펄스 폭, 10Vpp 진폭 매개변수에서 펄스파를 생성하도록 설정된 함수 발생기에 연결합니다.
- 마이크로 LED를 SA 노드에 부드럽게 놓습니다. 마이크로 LED를 너무 세게 누르면 심박수와 기능이 저하될 수 있으므로 피하십시오.
- 함수 생성기를 켜고 광자극으로 인한 심박수 변화를 측정합니다. 심박수의 즉각적인 변화는 효과적인 활성화를 나타냅니다. 카테콜아민성 활성화는 심박수를 기하급수적으로 증가시키고10, 콜린성 활성화는 즉각적인 심박수 저하를 유발한다8.
- 함수 생성기를 끕니다. 심박수가 활성화 이전 수준으로 돌아갈 수 있도록 합니다.
- 광유전학적 활성화로 인해 심박수 변화가 100bpm 미만인 경우 RA의 뉴런을 더 잘 비출 수 있도록 마이크로 LED의 위치를 조정하십시오. 필요에 따라 반복합니다.
5. 실험 절차 및 데이터 분석
- 내인성 광유전학적 콜린성 자극이 노르에피네프린(NE)에 의한 외인성 베타-아드레날린성 활성화를 억제할 수 있다는 가설을 테스트하기 위해 흄 식품에서 NE의 10μM 및 100μM 원액을 준비합니다.
- 주입 포트를 통해 관류 시스템에 NE의 볼루스 용량을 추가합니다. 심박수가 증가하면 마이크로 LED를 ~10초 동안 켭니다. 조명을 끄고 심박수 변화를 모니터링합니다.
- 심박수가 부비동 리듬으로 돌아온 후 NE 용량을 늘리고 광유전학적 자극을 반복합니다. NE의 각 용량에 대해 계속하십시오.
- 연구가 끝나면 가스 공급을 차단하고 시스템에서 심장을 제거한 다음 필요에 따라 고정 용액으로 보존합니다.
- 필요에 따라 관류 시스템 저장소와 튜브를 DI 물 또는 세제로 헹굽니다. 곰팡이를 방지하기 위해 시스템을 철저히 건조시키십시오.
- LabChart 파일을 저장합니다. 오프라인 분석 및 그래픽 표시를 위해 심박수 신호 및 ECG 채널을 내보냅니다.
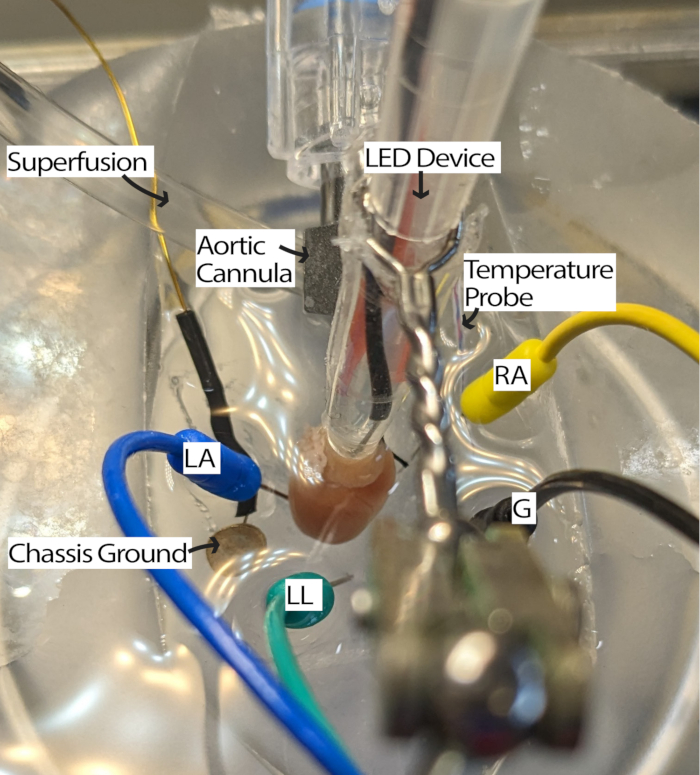
그림 3: 마우스 심장 수조 구성. LED 장치 및 ECG 전극의 배치를 보여주는 캐뉼레이트 마우스 심장. 주변 전자 장치의 소음을 줄이기 위해 섀시 접지가 있습니다. ECG 바늘 전극은 아인트호벤의 삼각형을 기반으로 배치됩니다. 약어: LA = 왼팔; RA = 오른팔; LL = 왼쪽 다리; G = 접지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
Langendorff 정압 관류 시스템 (그림 4) 은 적절한 산소 공급, 체온 및 관상 동맥 흐름이 유지되는 경우 한 시간 이상 마우스 심박수를 최소 300bpm으로 유지할 수 있어야 합니다. 이 설정을 사용하면 대동맥 관류액 온도가 관상동맥 흐름에 의존하므로 대동맥 온도를 37°C로 유지하기 위해 유속이 변함에 따라 수조 온도를 조정해야 할 수 있습니다. 쥐의 심장 관상동맥 유속은 일반적으로 심장의 크기에 따라 1.5-4.5mL/분 범위입니다. 유속 변동 시 관류액 온도를 37°C로 유지하는 것은 일관된 심장 기능을 위해 필요하며 일정한 압력 관류에 특히 중요합니다. 설명된 관류 시스템은 관류액 컬럼 높이를 통해 70mmHg의 정수압을 유지하도록 설계되었습니다. 이는 상단 저장소에서 일관된 오버플로를 제공하는 펌프 속도로 수행됩니다. 관류물은 20μM의 혈관 확장제 크로마칼린(cromakalin)으로 보충되어 정상 또는 초정상 관상동맥 흐름을 개선하고 유지하여 완전한 심근 산소화를 보장할 수 있습니다14.
10Hz 및 30ms 펄스 폭에서 ChAT-ChR2 마우스 심장의 콜린성 뉴런을 광자극하면 심박수가 거의 즉각적으로 떨어집니다. 적절하게 관류된 심장에서 콜린성 뉴런을 효율적으로 광자극하면 심박수가 최소 100bpm 감소해야 합니다. 그림 5 는 마이크로 LED가 켜지면 즉시 75bpm이 떨어지고 최대 135bpm의 감소에 도달할 때까지 계속 떨어지는 것을 보여줍니다. 마이크로 LED를 끈 후 30초 이내에 심박수가 175bpm으로 증가한 후 점차 자극 전 수준으로 돌아갑니다. 자극 전, 자극 중, 자극 후의 RR 간격의 차이를 설명하기 위해 6개 리드의 ECG가 제시됩니다(그림 5B). 리드 aVR, aVL 및 aVF는 리드 I 및 II를 사용하여 LabChart 소프트웨어에서 계산됩니다.
TH-ChR2 마우스 심장에서 카테콜아민성 뉴런의 광자극은 콜린성 뉴런의 광자극에 비해 심박수의 점진적(기하급수적) 변화를 일으킵니다. 이는 표적 단백질을 인산화하는 cAMP 활성화 PKA의 두 번째 메신저 시스템을 필요로 하는 beta1-아드레날린성 활성화에 의해 발생하는 것으로 보이며, 무스카린 활성화는 그렇지 않습니다. 그림 6 은 10초 동안 135bpm 심박수 증가를 보여줍니다. 조명을 끈 후 정상적인 부비동 리듬으로 돌아가기 위해 추가로 10초가 필요합니다. 마이크로 LED가 제대로 절연되지 않으면 심장을 가열하여 심박수를 증가시킬 수 있습니다. 이 가열 반응은 TH-ChR2 자극보다 덜 강합니다. 따라서 심박수의 변화가 덜 두드러집니다.
이 프로토콜의 한 가지 응용 분야는 광유전학적 자극을 사용하여 뉴런을 탈분극하여 내인성 신경전달물질의 방출로 이어지는 동시에 관류물에 외인성 신경전달물질을 추가하는 것입니다. 그림 7A는 ChAT-ChR2 마우스 심장에서 내인성 아세틸콜린이 방출되고 NE의 볼루스 용량이 관류물에 첨가된 것을 보여줍니다. NE가 없으면 광자극으로 인해 심박수가 100bpm 이상 떨어졌고 자극이 지속되는 동안 이 감소를 유지했습니다. 반면 많은 양의 NE(2000nM)를 투여한 경우 광자극 중 최대 심박수 강하는 40bpm이었습니다. 심장 박동수가 즉시 상승하기 시작했고, 조명이 꺼지기 전에 거의 자극 전 수준에 도달했습니다. 이 결과는 ChAT 뉴런 광자극에 의한 심박수의 광유전학적 억제가 고용량의 NE로 인한 심박수 증가를 완전히 억제할 수 없어 심박수 억제 시간이 짧아지고 심박수가 감소하는 원인이 되었음을 나타냅니다(그림 7B). 이러한 결과는 미주신경과 성상신경절 자극이 동시에 진행되는 동안 진행성 AV 노드 차단을 입증한 대형 동물을 대상으로 한 이전 연구와 일치합니다 12,13.
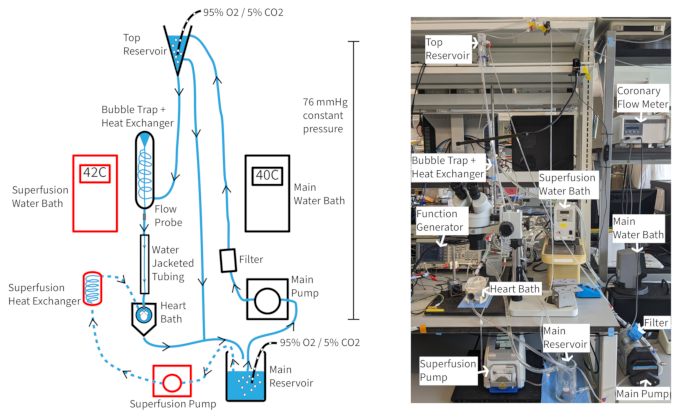
그림 4: 실험 설정. 관류 시스템의 다이어그램. 화살표는 관류물의 방향을 나타냅니다. Superfusion perfusate는 점선으로 표시되며 구성 요소는 빨간색으로 윤곽선이 그려져 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
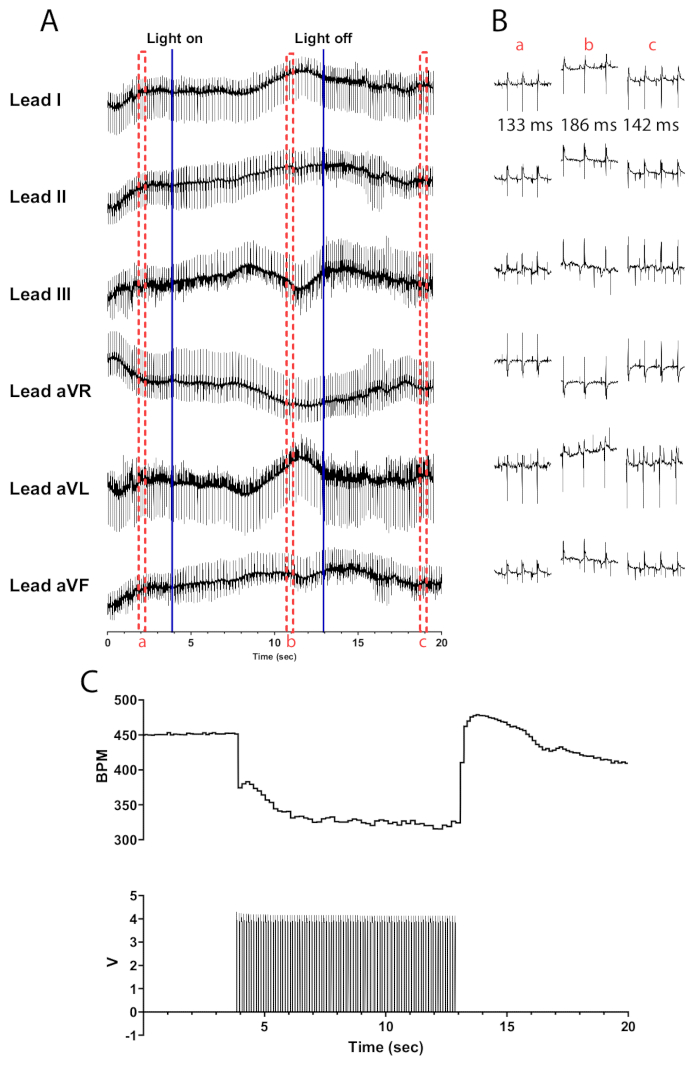
그림 5: 대표적인 콜린성 광자극 반응. (A) ChAT-ChR2 광유전학적 활성화 중 6 리드 ECG. 파란색 실선은 마이크로 LED가 켜지거나 꺼지고 있음을 나타냅니다. 빨간색 파선 상자는 (B) 스니펫의 시간을 나타냅니다. (B) 광자극 전(a), (b) 중, 광자극 후(c)의 30초 간격의 ECG 신호 발췌. 각 섹션에 대해 RR 간격이 표시됩니다. (C) 심박수(위)가 함수 발생기(아래)의 맥파와 함께 표시됩니다. 심박수는 450bpm에서 시작하여 광자극 8초 후 315bpm으로 떨어지고 광자극이 끝난 후 7초 후에 410bpm으로 돌아갑니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
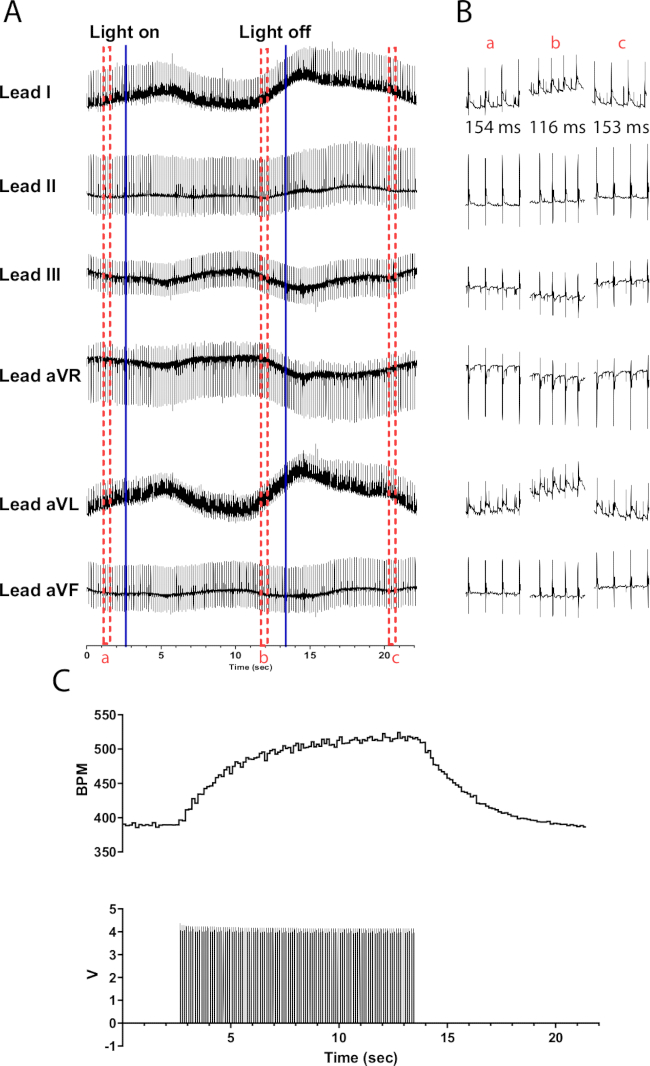
그림 6: 대표적인 카테콜아민성 광자극 반응. (A) TH-ChR2 광유전학적 활성화 중 6 리드 ECG. 파란색 실선은 마이크로 LED가 켜지거나 꺼지고 있음을 나타냅니다. 빨간색 파선 상자는 (B) 스니펫의 시간을 나타냅니다. (B) 광자극 전(a), (b) 중, 광자극 후(c)의 30초 간격의 ECG 신호 발췌. 각 섹션에 대해 RR 간격이 표시됩니다. (C) 심박수(위)가 함수 발생기(아래)의 맥파와 함께 표시됩니다. 심박수는 390bpm에서 시작하여 10초 광자극 후 525bpm으로 최고조에 달한 후 광자극이 끝난 후 8초 후에 390bpm으로 돌아갑니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
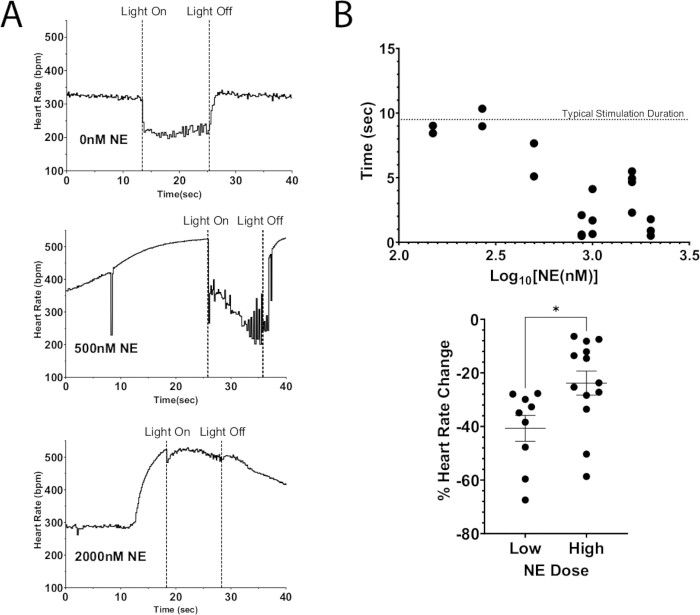
그림 7: 외인성 NE를 동반한 콜린성 광자극.(A) ChAT-ChR2 광자극 중 심박수 반응, 관류를 위해 NE의 용량 증가를 동반. NE로 인해 심박수가 최대 증가에 도달하면 마이크로 LED가 약 10초 동안 켜졌습니다. 고용량의 NE에서는 심박수 억제가 여전히 가능했지만, 용량이 증가함에 따라 자극의 지속 시간이 감소했다. (B) 심박수가 억제된 상태를 유지한 시간. 10초에 가까운 시간은 일반적으로 자극이 지속되는 동안 억제된 상태로 유지되었습니다. (C) 광자극 중 심박수 감소는 저용량보다 고용량의 NE에서 덜 심각했다. 저용량의 심박수는 평균 40%의 심박수 감소를 보인 반면, 높은 용량의 심박수는 25% 감소하는 데 그쳤습니다. 통계적 유의성을 평가하기 위해 쌍을 이루지 않은 t-검정을 수행했습니다. 평균 * p < 0.05의 표준 오차로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
내인성 심장 자율신경 뉴런의 광유전학적 자극은 미주신경 또는 성상신경절의 전기 자극과 유사한 수준의 심박수 반응을 일으켰다14,15. 그러나 절제된 관류 심장의 전기 자극은 특정 뉴런 집단을 쉽게 표적으로 삼을 수 있는 이점이 부족합니다. 약리학적 활성화는 특정 수용체를 표적으로 하는 이점을 제공하지만 공간적 특이성이 없으며 반응 시간은 관상동맥 유속에 따라 달라집니다. 광유전학적 활성화는 거의 즉각적인 반응, 신경 세포 집단의 표적화, 광자극 수준을 변화시킬 수 있는 능력의 이점을 제공한다16. 이 프로토콜에서는 고유한 심장 뉴런을 광자극하기 위한 간단하고 저렴한 광원을 구성하는 방법도 설명했습니다.
심장내 신경계의 영향에 대한 이해를 높이면 심혈관 질환을 더 잘 진단하고 치료할 수 있습니다. ChR2의 선택적 발현은 질병 중 특정 신경 집단의 활동과 관련된 새로운 가설을 테스트할 수 있게 합니다. 심장 전체의 신경 집단은 폐정맥 주위 또는 심실 전체의 내재적 심장 신경절과 같이 이러한 방식으로 조사할 수 있습니다. 예를 들어, 심근경색의 마우스 모델에서, 내재적 자율신경 뉴런의 광자극은 경색이 진화하고 뉴런이 전분화를 겪음에 따라 경계대 조직의 전기생리학적 변화를 조사하는 데 유용할 수 있습니다17. 이 프로토콜에서는 광유전학적 제제와 약리학적 제제의 조합으로 고유한 용량 반응을 검사할 수 있는 콜린성 및 카테콜아민성 경로의 동시 활성화에 대한 급성 심장 반응의 통제 실험과 관련된 또 다른 예를 설명합니다. 이러한 동시 활성화는 자율신경 갈등(autonomic conflict)으로 알려진 익사와 관련된 현상으로, 아직 완전히 밝혀지지 않았다18. 또한 적절한 빛, 염료 및 필터 조합이 주어지면 이 프로토콜을 심장 광학 매핑과 결합하여 심장 전기생리학 및 신경-심장 부정맥 메커니즘에 대한 자율 뉴런 자극의 급성 효과를 연구할 수 있습니다 19,20,21.
절제된 관류 심장의 내인성 심장 신경계를 연구하기 위해 이 프로토콜을 사용할 때 고려해야 할 몇 가지 중요한 개념이 있습니다. 쥐의 심장은 관류 환경의 미세한 변화에 민감합니다. 심박수를 면밀히 모니터링하면 심근의 산소 공급 저하, 허혈 및 심장 기능 저하를 유발할 수 있는 관상 동맥 관류 문제를 식별하는 데 유용합니다. 프로토콜은 잠재적인 문제를 제한하기 위해 주 저장소와 상단 저장소 모두에서 관류액에 산소를 공급할 것을 권장합니다. 산소화 튜브를 완전히 담그면 관류액의 최적 산소 수준을 보장하는 데 도움이 됩니다. 자외선 손전등을 심장에 비추어 저산소증/허혈을 나타내는 NADH 형광을 나타낼 수 있으며, 그에 따라 산소화를 조정할 수 있습니다19,20. 관류액 온도는 일정한 압력 관류 중 관상동맥 유량에 따라 달라집니다. 관상동맥 유량이 떨어지면 대동맥 캐뉼라 근위부의 냉각으로 인해 대동맥 관류액 온도도 떨어질 수 있으며, 이로 인해 심박수가 낮아질 수 있습니다. 관류액 수조 온도를 높이면 이 문제를 역전시키는 데 도움이 될 수 있습니다. 이 프로토콜은 또한 과융합 루프를 사용하여 심장 수조 온도를 37°C로 유지합니다. 심장 수조 온도가 떨어지면 과융합 유속을 증가시켜야 할 수 있습니다. 마이크로 LED는 광자극 중에 RA의 온도가 증가할 수 있기 때문에 심장 온도의 잠재적인 변화의 또 다른 원인입니다. 장치를 감싸고 있는 실리콘 엘라스토머가 너무 얇으면 마이크로 LED가 뜨거워지고 SA 노드가 가열되어 예기치 않은 심박수 증가가 발생할 수 있습니다. 야생형 심장에서 마이크로 LED 광원을 테스트하면 가열 수준을 측정하는 데 유용할 수 있습니다. 마이크로 LED는 10초 동안 30% 이상의 심박수 증가를 일으키지 않아야 합니다. 이 경우 실리콘 엘라스토머를 교체해야 합니다.
생체 외 관류 심장 실험의 목표는 제어 가능한 변수를 사용하여 생리학적 조건에 가까운 상태를 재현하는 것이지만 여기에는 한계가 있습니다22. 결정질 관류물은 이러한 실험의 표준입니다. 그러나 높은 스트레스 조건에서 미토콘드리아로의 산소 전달을 제한할 수 있습니다23,24. 또한, 퍼퓨세이트는 생체 내에서 자연적으로 발생하는 순환 호르몬이 부족합니다. 또 다른 제한 사항은 가변 광 강도와 마이크로 LED의 배치로 인해 신경 자극의 국부적 불균형이 발생할 수 있으므로 실험 프로토콜을 시작하기 전에 항상 마이크로 LED를 심장 위에 배치하는 데 약간의 조정이 필요하다는 것입니다.
요약하면, 이 프로토콜은 관류된 마우스 심장에서 심장 뉴런의 특정 광유전학적 자극에 대한 생체 외 접근 방식을 보여줍니다. 우심방의 뉴런을 자극하기 위해 마이크로 LED 광원이 구성되었습니다. 이 접근법의 적용은 ChAT-ChR2 마우스 심장의 광유전학적 활성화 중 아세틸콜린의 고유 방출과 동시에 증가하는 외인성 NE를 결합했습니다. 카테콜아민과 콜린이 동시에 활성화되는 동안 심박수의 결과적인 변화가 제시되었습니다. 이 프로토콜은 관류된 심장에서 갑작스러운 내재적 자율 뉴런 활성화의 동역학과 심장 콜린성 및 카테콜아민성 활성 간의 상호 작용을 조사하기 위한 귀중한 실험적 접근 방식을 설명합니다.
공개
선언할 이해 상충이 없습니다.
감사의 말
이 작업은 NIH R01 HL144157에서 MWK, NIH R01 HL144157에서 EE 및 MWK, NIH R01 HL147279 및 HL146169에서 MWK 및 DM으로, 그리고 RR에 대한 Collins Distinguished Doctoral Fellowship의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
참고문헌
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유