Method Article
Activation optogénétique des neurones autonomes cardiaques intrinsèques dans des cœurs de souris perfusés excisés
Dans cet article
Résumé
Ce protocole illustre une méthode de stimulation optogénétique des neurones cardiaques intrinsèques dans des cœurs de souris transgéniques. L’approche décrite est utilisée pour étudier la cinétique de l’activation soudaine des neurones cardiaques dans les cœurs perfusés ex vivo et les interactions entre l’activité cholinergique et catécholaminergique.
Résumé
Un équilibre entre l’activation cholinergique et catécholaminergique est nécessaire pour maintenir la santé cardiaque. L’interrogation de l’interaction entre ces voies peut être réalisée à l’aide de l’optogénétique par l’expression sélective de la channelrhodopsine-2 (ChR2) dans les neurones autonomes cardiaques. De telles applications cardiaques de l’optogénétique permettent d’étudier la libération intrinsèque de neurotransmetteurs de manière spatio-temporelle. Cette méthode illustre une approche ex vivo pour la stimulation optogénétique spécifique des neurones cardiaques dans des cœurs de souris perfusés. Des souris transgéniques ont été sélectionnées pour exprimer ChR2 dans les neurones choline acétyltransférase (ChAT) ou tyrosine hydroxylase (TH) dans tout le corps. Une micro-LED (465 nm) enfermée dans un élastomère de silicone a été préparée pour stimuler les neurones de l’oreillette droite qui innervent le nœud sino-auriculaire. La micro-LED a été connectée à un générateur de fonction réglé sur des ondes d’impulsion à 10 Hz avec une largeur d’impulsion de 30 ms. Les cœurs avec une expression confirmée ont été excisés et perfusés rétrogradement sur une solution de Krebs-Henseleit circulant dans un système de Langendorff. L’électrocardiogramme (ECG), la température et le débit coronaire ont été enregistrés à l’aide du logiciel LabChart. Une fois le cœur stabilisé, la micro-LED a été placée sur l’oreillette droite et testée pour une réponse optimale de la fréquence cardiaque. Une application de cette approche combine la libération intrinsèque d’un neurotransmetteur cholinergique (acétylcholine) lors de l’activation optogénétique d’un cœur de souris ChAT-ChR2 simultanément avec une augmentation du neurotransmetteur catécholaminergique exogène (noradrénaline) ajouté au perfusat. Les modifications résultantes de la fréquence cardiaque lors de l’activation cholinergique et catécholaminergique simultanée sont présentées. Cette méthode décrit une approche expérimentale précieuse pour étudier la cinétique de l’activation soudaine des neurones autonomes intrinsèques dans les cœurs perfusés et les interactions entre l’activité cholinergique cardiaque et catécholaminergique.
Introduction
L’optogénétique est une méthode permettant d’introduire des protéines sensibles à la lumière (opsines) dans des populations cellulaires ciblées. Cela permet une modulation spatio-temporelle de cellules et de tissus spécifiques qui ne peut pas être réalisée par des moyens électriques ou chimiques1. Les applications cardiaques de l’optogénétique sont devenues de plus en plus populaires au cours des 15 dernières années2. La photostimulation d’opsines excitatrices telles que la channelrhodopsine-2 (ChR2), un cation, dans les myocytes ou les neurones cardiaques entraîne une dépolarisation cellulaire, provoquant des modifications du rythme cardiaque3. Il existe deux façons d’exprimer sélectivement les opsines dans les populations cellulaires en utilisant l’approche Cre-lox : la transduction virale4 et le croisement d’animaux transgéniques5. L’expression sélective de ChR2 dans des neurones autonomes spécifiques peut être réalisée par croisement pour créer une progéniture qui exprime ChR2 dans les neurones cholinergiques ou catécholaminergiques à l’aide de promoteurs spécifiques aux cellules6. Un parent avec un gène ChR2 floxé peut être accouplé avec un parent qui exprime la Cre recombinase sous le contrôle d’un promoteur tel que la tyrosine hydroxylase (TH, neurones catécholaminergiques) ou la choline acétyltransférase (ChAT, neurones cholinergiques). La progéniture exprime ensuite ChR2 dans les neurones TH ou ChAT dans tout le corps7.
La réponse fonctionnelle du cœur à l’activation aiguë des neurones autonomes peut être étudiée à l’aide de l’expression de ChR2 par le promoteur au sein de populations neuronales spécifiques, par exemple les neurones cholinergiques ou catécholaminergiques. L’intervalle et l’intensité de l’impulsion de photostimulation peuvent être modifiés pour contrôler le taux de dépolarisation des neurones exprimant la ChR2 afin d’étudier comment les niveaux d’activation neuronale modulent la fonction cardiaque8. Pour cette méthode, les neurones seront utilisés pour faire référence à tous les corps cellulaires, axones et/ou projections axonales qui sont activés optogénétiquement pour plus de simplicité. Il est également possible de combiner la photostimulation avec l’activation chimique par l’introduction de médicaments ou de neurotransmetteurs pour interroger les effets simultanés sur le rythme cardiaque et la contractilité9. Par exemple, la stimulation cholinergique optogénétique peut être combinée à l’injection de noradrénaline exogène (NE) pour examiner l’impact de l’activation autonome concomitante dans le cœur. La réalisation de telles études à l’aide de cœurs perfusés isolés présente l’avantage de fournir une plate-forme expérimentale bien contrôlée pour étudier les changements fonctionnels causés par la photoactivation10. Les changements de morphologie de l’ECG, de fréquence cardiaque et de débit coronaire peuvent être surveillés tandis que la température, l’oxygénation et la pression de perfusion sont étroitement contrôlées.
L’objectif de ce protocole est de présenter une approche expérimentale pour activer une population spécifique de neurones autonomes dans des cœurs de souris afin d’étudier les changements de fréquence cardiaque. La construction et l’utilisation d’un dispositif micro-LED pour l’activation optogénétique dans les cœurs perfusés sont également présentées. Des cœurs de souris exprimant ChR2 dans les neurones cholinergiques ou catécholaminergiques ont été excisés et perfusés rétrogradement avec une solution oxygénée de Krebs-Henseleit à pression constante. ChR2 exprimée dans les neurones de l’oreillette droite (AR) a été photostimulée à une fréquence d’impulsion de 10 Hz avec une largeur d’impulsion de 30 ms. La fréquence cardiaque instantanée a été calculée à l’aide de l’intervalle RR et surveillée pour détecter les changements pendant la photostimulation. Un exemple d’expérience visant à étudier la cinétique de la fréquence cardiaque pendant la photostimulation optogénétique intrinsèque des neurones ChAT simultanément à l’activation bêta-adrénergique à l’aide de noradrénaline exogène est également décrit.
Protocole
Tous les protocoles pour les animaux ont été approuvés par le Comité de protection et d’utilisation des animaux de l’Université George Washington et ont suivi le Guide pour le soin et l’utilisation des animaux de laboratoire de l’Institut national de la santé.
1. Construction de la source lumineuse Micro-LED
- À l’aide d’un microscope à dissection dans un endroit bien ventilé, soudez les extrémités dénudées de deux fils de cuivre isolés, d’au moins 20 cm de longueur, aux points de contact d’une micro-LED de 465 nm (Figure 1). Testez la soudure en connectant la LED à une source d’alimentation et en l’allumant.
- Coupez le bas de 1 cm d’une pointe de pipette filtrée de 200 μL. Poussez le filtre à l’aide d’une tige de petit diamètre. Insérez la micro-LED avec des fils dans la pointe de la pipette de manière à ce que la LED affleure l’extrémité de la pointe. Replacez le filtre en haut de la pointe de la pipette pour maintenir la LED et les fils en place, puis supercollez les bords de la LED sur la pointe de la pipette. Laissez sécher la superglue.
- Préparez l’élastomère de silicone en combinant la base et l’agent de durcissement dans un rapport de 10:1 et mélangez bien. Éliminez les bulles du mélange à l’aide d’une chambre à vide ou par centrifugation.
- Prenez un tube à centrifuger de 0,5 ml et marquez les côtés pour faciliter le retrait de la LED (du lubrifiant peut également être ajouté à l’intérieur du tube ici si vous le souhaitez). Collez l’extérieur du tube pour éviter toute fuite. Versez environ 0,2 ml du mélange d’élastomère de silicium dans le tube, puis placez la pointe de la pipette à micro-LED dans le tube, en laissant au moins 1 mm d’espace entre la LED et le fond du tube. Si des bulles se sont formées, tapotez le tube de centrifugation sur une surface dure pour les déloger.
REMARQUE : La pointe de la pipette peut être recouverte de manière préventive d’un élastomère de silicone pour réduire la formation de bulles lors du placement de la LED. - Placez le tube de centrifugation micro-LED à la verticale dans un four de laboratoire ou un incubateur à 50 °C et laissez-le agir pendant au moins 8 h ou toute la nuit. Portez des gants résistants à la chaleur lorsque vous interagissez avec le four. Une fois l’élastomère durci, retirez la LED du tube de centrifugation. Si l’élastomère est encore collant, remettez-le au four.
- Une fois complètement durci, retirez tout excès d’élastomère de l’extrémité de la LED avec un couteau utilitaire de précision, en ne laissant pas plus de 1 mm. Une bonne encapsulation de la LED minimisera l’échauffement des tissus pendant la photostimulation.
- Déterminez la puissance optique de la LED à l’aide d’un wattmètre optique. Allumez le wattmètre et ajustez les paramètres de longueur d’onde pour lire 465 nm. Placez la LED dans l’alignement d’un capteur de puissance à photodiode et allumez la LED avec le générateur de fonctions. Le wattmètre optique produira une lecture en watts. Calculez l’irradiance en divisant la puissance mesurée par la surface de la surface éclairée (0,88 mm2).
REMARQUE : L’irradiance idéale doit être d’environ 2,4 mW/mm2 pour une activation appropriée de ChR211.
2. Préparation expérimentale
- Élever des souris conformément à une publication précédente pour exprimer ChR2 dans les neurones cholinergiques (ChAT-ChR2) ou les neurones catécholaminergiques (TH-ChR2)12 (Figure 2). Confirmer l’expression de TH-Cre ou de ChAT-Cre chez des souris utilisées pour des expériences en utilisant une approche de génotypage comme décrit précédemment12.
- Préparez au moins 225 mL de solution de Krebs-Henseleit (KH) (en mM : 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 glucose) et filtrez à l’aide d’un filtre à membrane en nitrate de cellulose de 0,2 μm. Ajustez le pH à 7,4 lorsqu’il est oxygéné en utilisant 95 % d’O2 et 5 % de CO2.
- Rincez le système de perfusion Langendorff avec de l’eau purifiée avant l’expérience et éliminez tout excès d’eau avant de commencer l’expérience.
- Ajoutez un filtre à membrane de 10 μm au système avant que tout KH ne circule. Allumez les bains-marie réglés pour maintenir la température de perfusat à 37 °C à des débits compris entre 2 et 5 mL/min.
- Ajouter 175 ml de KH dans le système de perfusion et commencer la circulation. Faites buliser la solution avec 95 % O2 / 5 % CO2 pour fournir une oxygénation adéquate.
REMARQUE : Le volume de circulation en KH varie d’un système à l’autre en fonction de la taille des tubes et des réservoirs. - Étalonnez le débitmètre en arrêtant le débit dans le système de perfusion à l’aide d’un robinet d’arrêt et en appuyant sur le bouton Zero du débitmètre.
- Préparez un logiciel d’acquisition de données physiologiques tel que LabChart pour avoir 12 canaux : température du bain cardiaque, température de perfusat aortique, dérivations ECG I-III plus quatre dérivations calculées supplémentaires, calcul de la fréquence cardiaque, débit et sortie du générateur de fonctions pour suivre les impulsions LED.
- À l’aide du canal réservé à la fréquence cardiaque, calculez la fréquence cardiaque dans LabChart avec la fonction de mesures cycliques définie pour détecter l’ECG de la souris sur la dérivation I. L’extension de l’axe cardiaque de LabChart utilise la dérivation I et la dérivation II pour calculer la dérivation III, l’aVR, l’aVL et l’aVF.
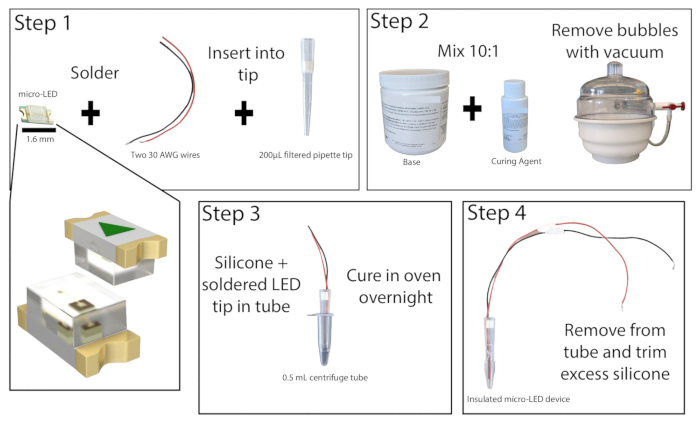
Figure 1 : Construction micro-LED. Vue d’ensemble simplifiée des étapes de construction d’une source lumineuse micro-LED. Deux fils sont soudés à la micro-LED et insérés dans une pointe de pipette de 200 μL, puis supercollés (étape 1). L’élastomère de silicone est mélangé dans un rapport de 10:1 et placé dans une chambre à vide pour éliminer les bulles (étape 2). L’élastomère de silicone est versé dans un tube de microcentrifugation, puis l’embout de la pipette à micro-LED est inséré et laissé durcir pendant la nuit (étape 3). La micro-LED isolée est ensuite retirée du tube et l’excès de silicone doit être coupé (étape 4). Veuillez cliquer ici pour voir une version agrandie de cette figure.
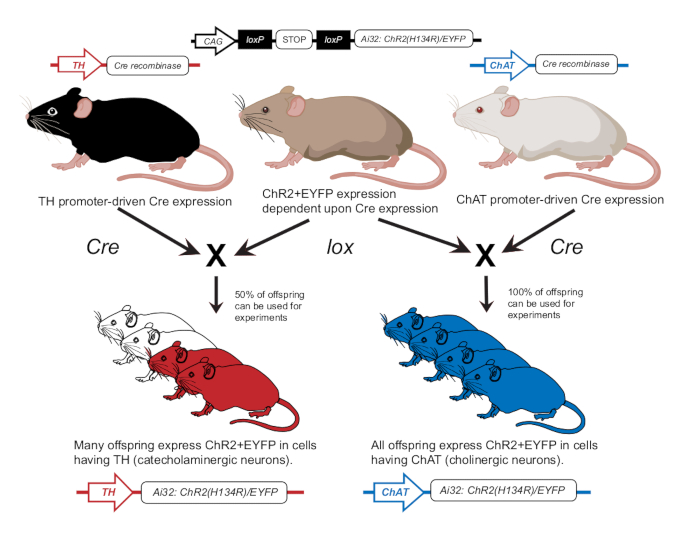
Figure 2 : Programme d’élevage de souris transgéniques. Une souris parentale avec le gène ChR2 dépendant de lox est croisée avec une autre souris avec un promoteur Cre. Une souris parentale avec le promoteur de la tyrosine hydroxylase (TH) Cre produira une progéniture hétérozygote où 50 % exprimera ChR2 dans les cellules catécholaminergiques. Une souris parentale avec un promoteur de choline acétyltransférase (ChAT) Cre produira une progéniture homozygote où 100 % exprimera ChR2 dans les cellules cholinergiques. L’expression est confirmée par génotypage. Ce chiffre a été modifié avec la permission de12. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Excision et perfusion cardiaque
- Avant l’excision, administrer 250 unités d’héparine (environ 8 U/g) par injection intrapéritonéale à l’aide d’une seringue de 1 mL. Attendez au moins 10 minutes avant la chirurgie.
- Placez une souris adulte dans une chambre d’induction d’anesthésie. Administrez ~4 % d’isoflurane et attendez que le rythme respiratoire ralentisse et s’approfondisse. Retirez la souris de la chambre et vérifiez la cessation d’un réflexe de douleur par pincement des orteils avant d’effectuer une luxation cervicale.
- Tenez l’apophyse xiphoïde à l’aide d’une paire de pinces et coupez dans la cavité abdominale à l’aide de ciseaux chirurgicaux. Ouvrez la cavité thoracique en coupant soigneusement le diaphragme. Coupez les côtes pour exposer le cœur et les poumons. Saisissez doucement les poumons et excisez le cœur et les poumons.
- Placez le cœur dans un plat de KH hépariné. Retirez les poumons et tous les gros morceaux de graisse. Placez le cœur nettoyé dans une 2èmeboîte de KH héparinée sous un microscope de dissection réglé sur un grossissement de 2x. Localisez l’aorte et faites-la glisser sur la canule à l’aide d’une pince fine. Fixez le cœur à une canule à l’aide d’une suture en soie 4-0.
REMARQUE : La canulation peut être effectuée sur de la glace pour réduire l’activité métabolique du cœur. - Rincez une injection en bolus de KH héparinée à travers la canule pour éliminer le sang des coronaires avant de le placer sur le système de perfusion.
- Connectez le cœur canulé au système de perfusion et placez-le dans la boîte PDMS remplie de perfusat. Placez les électrodes de l’aiguille ECG dans la boîte PDMS selon le triangle d’Einthoven13. Acclimater le cœur pendant au moins 5 min.
- Faites pivoter le cœur de manière à ce que l’oreillette gauche soit accessible et découpez un trou de ~1 mm dans l’oreillette gauche avec une paire de micro-ciseaux à ouverture automatique. Insérez un tube de 1 mm de diamètre à travers cette tranche dans le ventricule gauche pour libérer le perfusat qui y est coincé.
REMARQUE : Avoir un microscope de dissection pour regarder le cœur peut améliorer la facilité de cette étape. - Faites pivoter le cœur de manière à ce que l’AR soit orienté vers le haut et que le nœud sino-auriculaire (SA) soit accessible pour l’éclairage (Figure 3).
- Ajustez les électrodes ECG au besoin en rapprochant les électrodes du cœur ou en les immergeant dans du perfusat pour recevoir les signaux avec un rapport signal/bruit approprié. Les paramètres peuvent varier en fonction du matériel et du logiciel d’acquisition de l’ECG utilisés. Cette méthode utilisait un module Einthoven Goldberger avec un gain de 2000 et un filtre de coupure de 500 Hz, et les paramètres du logiciel incluaient un filtre secteur et une fréquence d’échantillonnage de 1000 Hz.
4. Activation optogénétique
- Connectez l’appareil micro-LED à un générateur de fonction pour produire des ondes d’impulsion aux paramètres suivants : fréquence de 10 Hz, largeur d’impulsion de 30 ms, amplitude de 10 Vpp .
- Placez délicatement la micro-LED sur le nœud SA. Évitez d’appuyer trop fort avec la micro-LED car cela pourrait entraîner une diminution de la fréquence cardiaque et de la fonction.
- Activez le générateur de fonctions et mesurez les changements de fréquence cardiaque dus à la photostimulation. Les changements immédiats de la fréquence cardiaque indiquent une activation efficace. L’activation catécholaminergique provoque une augmentation exponentielle de la fréquence cardiaque10, tandis que l’activation cholinergique provoque une chute immédiate8.
- Éteignez le générateur de fonctions. Permettez à la fréquence cardiaque de revenir aux niveaux d’avant l’activation.
- Si l’activation optogénétique entraîne un changement de fréquence cardiaque inférieur à 100 bpm, repositionnez la micro-LED pour mieux éclairer les neurones de la PR. Répétez l’opération si nécessaire.
5. Procédure expérimentale et analyse des données
- Pour tester l’hypothèse selon laquelle la stimulation cholinergique optogénétique intrinsèque peut supprimer l’activation bêta-adrénergique exogène par la noradrénaline (EN), préparez des solutions mères de 10 μM et 100 μM de NE dans un aliment fumé.
- Ajouter une dose bolus d’EN au système de perfusion par un orifice d’injection. Une fois que l’augmentation de la fréquence cardiaque plafonne, allumez la micro-LED pendant ~10 s. Éteignez la lumière et surveillez les changements de fréquence cardiaque.
- Une fois que la fréquence cardiaque est revenue au rythme sinusal, augmentez la dose d’EN et répétez la stimulation optogénétique. Continuer pour chaque dose d’EN.
- À la fin de l’étude, coupez l’alimentation en gaz, retirez le cœur du système et conservez-le dans un fixateur, si nécessaire.
- Rincez les réservoirs et les tubes du système de perfusion avec de l’eau DI ou un détergent au besoin. Séchez soigneusement le système pour éviter la moisissure.
- Enregistrez le fichier LabChart. Exportez le signal de fréquence cardiaque et les canaux ECG pour une analyse hors ligne et une présentation graphique.
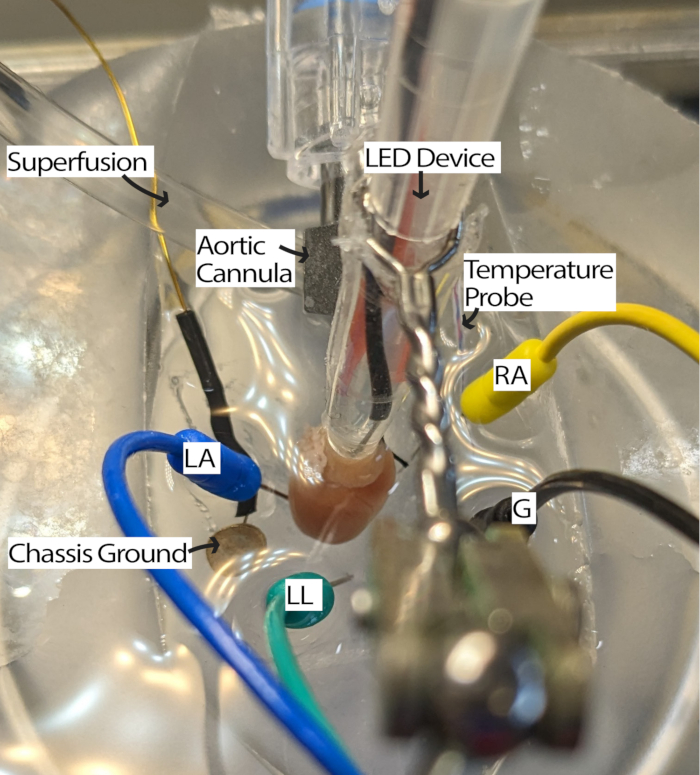
Figure 3 : Configuration du bain de cœur de souris. Un cœur de souris canulé montrant l’emplacement du dispositif LED et des électrodes ECG. Une masse de châssis est présente pour réduire le bruit de l’électronique environnante. Les électrodes à aiguille ECG sont placées sur la base du triangle d’Einthoven. Abréviations : LA = bras gauche ; RA = bras droit ; LL = jambe gauche ; G = sol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Un système de perfusion à pression constante de Langendorff (figure 4) devrait être capable de maintenir une fréquence cardiaque de souris d’au moins 300 bpm pendant plus d’une heure si l’oxygénation, la température et le débit coronaire sont appropriés. Avec cette configuration, la température du perfusat aortique dépend du flux coronaire, de sorte que la température du bain d’eau peut devoir être ajustée à mesure que le débit change pour maintenir la température aortique à 37 °C. Les débits coronaires du cœur de souris varient généralement de 1,5 à 4,5 ml / min, selon la taille du cœur. Le maintien de la température du perfusat à 37 °C pendant les fluctuations de débit est nécessaire pour une fonction cardiaque constante et est particulièrement important pour une perfusion à pression constante. Le système de perfusion décrit est conçu pour maintenir une pression hydrostatique de 70 mmHg à travers la hauteur de la colonne de perfusat. Ceci est accompli avec un débit de pompe qui fournit un trop-plein constant à partir du réservoir supérieur. Le perfusat peut être complété par 20 μM de cromakaline vasodilatateur pour améliorer et maintenir un débit coronaire normal ou supranormal afin d’assurer une oxygénation myocardique complète14.
La photostimulation des neurones cholinergiques dans les cœurs de souris ChAT-ChR2 à 10 Hz et à une largeur d’impulsion de 30 ms devrait entraîner une baisse presque instantanée de la fréquence cardiaque. Une photostimulation efficace des neurones cholinergiques dans les cœurs correctement irrigués devrait entraîner une réduction de la fréquence cardiaque d’au moins 100 bpm. La figure 5 montre une baisse immédiate de 75 bpm lorsque la micro-LED est allumée, qui continue à baisser jusqu’à ce qu’elle atteigne une diminution maximale de 135 bpm. Dans la demi-seconde qui suit l’extinction de la micro-LED, la fréquence cardiaque augmente jusqu’à 175 bpm avant de revenir progressivement aux niveaux d’avant la stimulation. Un ECG à six dérivations est présenté pour illustrer les différences d’intervalle RR avant, pendant et après la stimulation (Figure 5B). Les dérivations aVR, aVL et aVF sont calculées dans le logiciel LabChart à l’aide des dérivations I et II.
La photostimulation des neurones catécholaminergiques dans les cœurs de souris TH-ChR2 provoque un changement plus progressif (exponentiel) de la fréquence cardiaque par rapport à la photostimulation des neurones cholinergiques. Cela est probablement dû à l’activation bêta1-adrénergique nécessitant le deuxième système messager de l’AMPc activant la PKA, qui phosphoryle les protéines cibles, alors que l’activation muscarinique ne le fait pas. La figure 6 montre une augmentation de la fréquence cardiaque de 135 bpm sur une période de 10 s. 10 secondes supplémentaires sont nécessaires après l’extinction de la lumière pour revenir à un rythme sinusal normal. Si la micro-LED n’est pas correctement isolée, elle peut chauffer le cœur, provoquant une augmentation de la fréquence cardiaque. Cette réponse de chaleur est moins intense que la stimulation TH-ChR2 ; Par conséquent, le changement de fréquence cardiaque est moins prononcé.
L’une des applications de ce protocole consiste à utiliser la stimulation optogénétique pour dépolariser les neurones, ce qui entraîne la libération de neurotransmetteurs endogènes tout en ajoutant simultanément des neurotransmetteurs exogènes au perfusat. La figure 7A illustre la libération endogène d’acétylcholine à partir d’un cœur de souris ChAT-ChR2 avec une dose bolus d’EN ajoutée au perfusat. En l’absence d’EN, la photostimulation a fait chuter la fréquence cardiaque de plus de 100 bpm et a maintenu cette baisse pendant toute la durée de la stimulation. Alors qu’avec une forte dose d’EN, la baisse maximale de la fréquence cardiaque pendant la photostimulation était de 40 bpm. Le rythme cardiaque a immédiatement commencé à augmenter, atteignant presque les niveaux de pré-stimulation avant que la lumière ne s’éteigne. Ce résultat indique que la suppression optogénétique de la fréquence cardiaque par photostimulation neuronale ChAT n’a pas été en mesure de supprimer complètement les augmentations de la fréquence cardiaque résultant d’une forte dose d’EN, ce qui a entraîné une réduction de la durée de la suppression de la fréquence cardiaque et une diminution plus faible de la fréquence cardiaque (Figure 7B). Ces résultats sont cohérents avec des travaux antérieurs chez de grands animaux qui ont démontré un blocage progressif des ganglions AV lors de la stimulation simultanée du nerf vagal et des ganglions stellaires12,13.
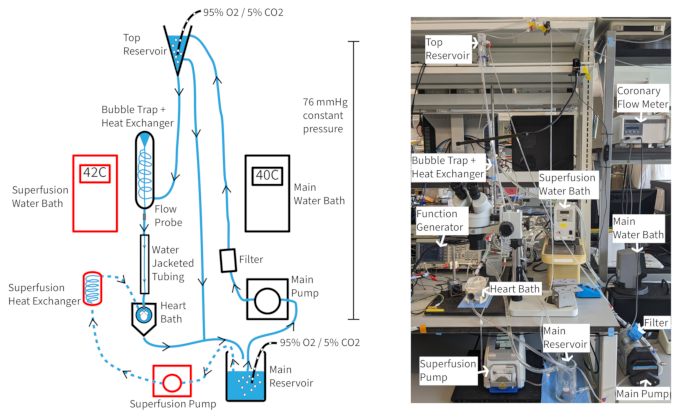
Figure 4 : Dispositif expérimental. Schéma du système de perfusion. Les flèches indiquent la direction du perfusat. Le perfusat de superfusion est indiqué par des lignes pointillées et les composants sont soulignés en rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
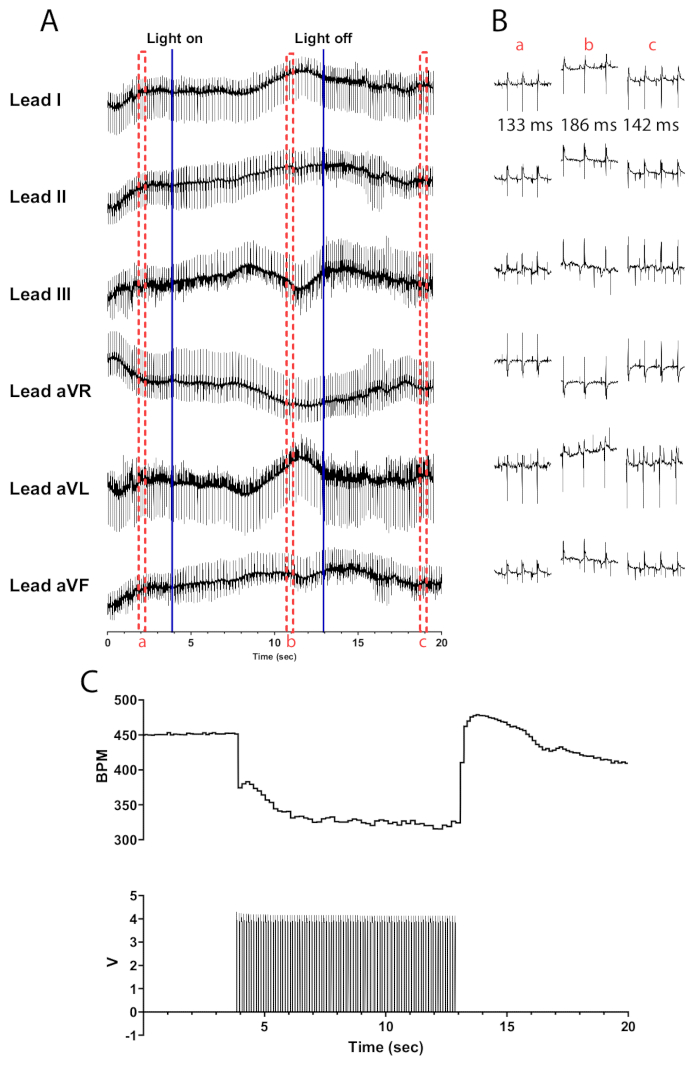
Figure 5 : Réponse représentative de la photostimulation cholinergique. (A) Un ECG à 6 dérivations pendant l’activation optogénétique de ChAT-ChR2. Les lignes bleues continues indiquent que la micro-LED est allumée/éteinte. Les cases pointillées rouges indiquent le temps consacré aux extraits (B). (B) Extraits d’une demi-seconde du signal ECG avant (a), pendant (b) et après la photostimulation (c). L’intervalle RR est indiqué pour chaque section. (C) La fréquence cardiaque (en haut) est affichée avec les ondes de pouls d’un générateur de fonctions (en bas). La fréquence cardiaque commence à 450 bpm et descend à 315 bpm après 8 s de photostimulation avant de revenir à 410 bpm 7 s après la fin de la photostimulation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
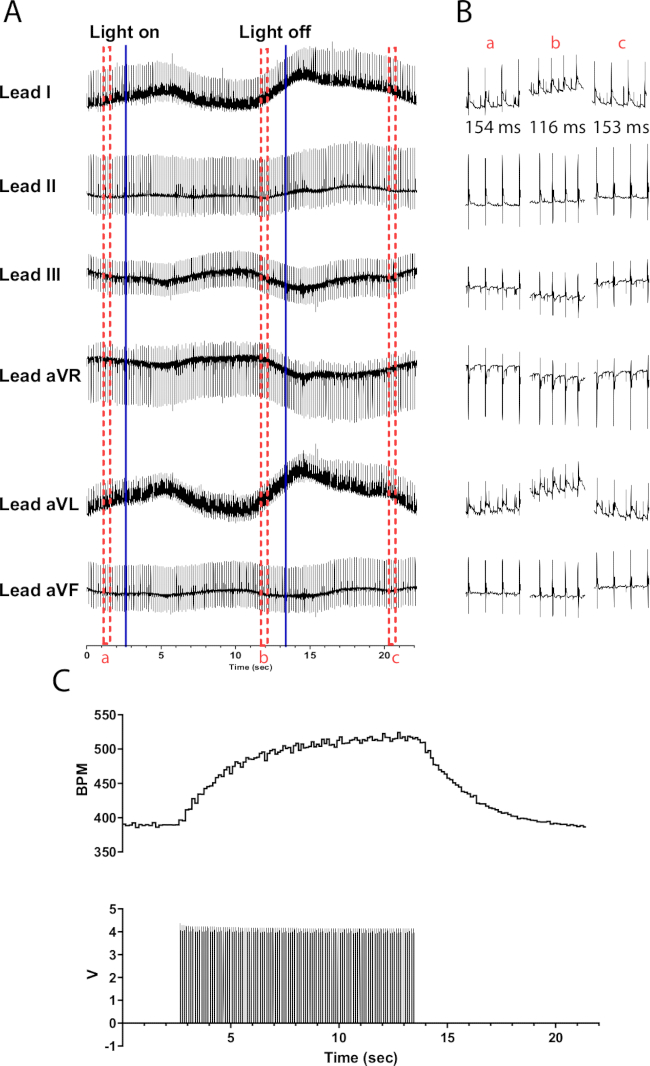
Figure 6 : Réponse représentative de la photostimulation catécholaminergique. (A) Un ECG à 6 dérivations pendant l’activation optogénétique TH-ChR2. Les lignes bleues continues indiquent que la micro-LED est allumée/éteinte. Les cases pointillées rouges indiquent le temps consacré aux extraits (B). (B) Extraits d’une demi-seconde du signal ECG avant (a), pendant (b) et après la photostimulation (c). L’intervalle RR est indiqué pour chaque section. (C) La fréquence cardiaque (en haut) est affichée avec les ondes de pouls d’un générateur de fonctions (en bas). La fréquence cardiaque commence à 390 bpm et culmine à 525 bpm après 10 s de photostimulation avant de revenir à 390 bpm 8 s après la fin de la photostimulation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
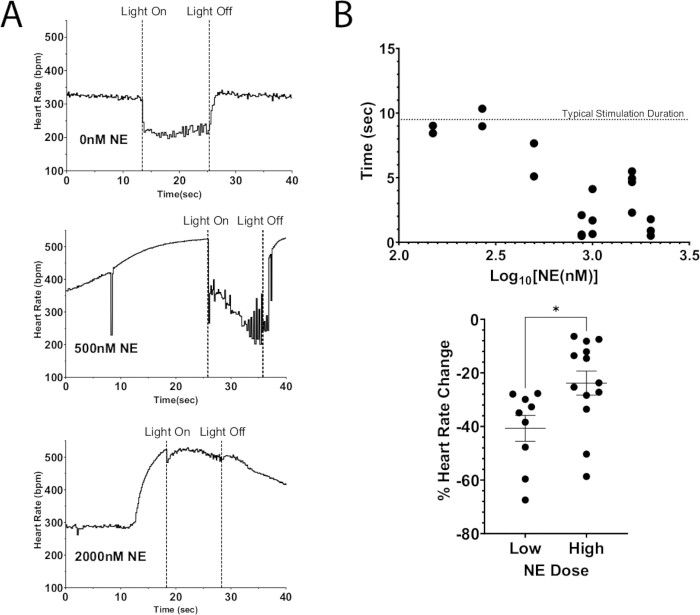
Figure 7 : Photostimulation cholinergique avec EN. (A) Réponse de la fréquence cardiaque pendant la photostimulation ChAT-ChR2 avec des doses croissantes d’EN. Une fois que la fréquence cardiaque a atteint une augmentation maximale due à l’EN, la micro-LED a été allumée pendant environ 10 s. La suppression de la fréquence cardiaque était toujours possible à des doses élevées d’EN, mais la durée de la stimulation diminuait à mesure que la dose augmentait. (B) La durée pendant laquelle la fréquence cardiaque est restée supprimée. Les périodes plus proches de 10 s sont généralement restées supprimées pendant toute la durée de la stimulation. (C) La baisse de la fréquence cardiaque pendant la photostimulation était moins sévère à des doses plus élevées d’EN qu’à de faibles doses. De faibles doses ont entraîné une diminution moyenne de la fréquence cardiaque de 40 %, tandis que des doses plus élevées n’ont chuté que de 25 %. Un test t non apparié a été effectué pour évaluer la signification statistique. Présenté sous forme d’erreur-type de la moyenne * p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La stimulation optogénétique des neurones autonomes cardiaques intrinsèques a produit des niveaux comparables de réponse à la fréquence cardiaque à ceux de la stimulation électrique du nerf vague ou des ganglions stellaires14,15. La stimulation électrique des cœurs perfusés excisés, cependant, n’a pas l’avantage de pouvoir cibler facilement des populations de neurones spécifiques. L’activation pharmacologique offre l’avantage de cibler des récepteurs spécifiques, mais n’a pas de spécificité spatiale, et le temps de réponse dépend du débit coronarien. L’activation optogénétique offre l’avantage d’une réponse quasi instantanée, du ciblage des populations neuronales et de la capacité de modifier le niveau de photostimulation16. Dans ce protocole, nous avons également expliqué comment construire une source lumineuse simple et peu coûteuse pour photostimuler les neurones cardiaques intrinsèques.
Une meilleure compréhension de l’impact du système nerveux intracardiaque facilitera l’amélioration du diagnostic et du traitement des maladies cardiovasculaires. L’expression sélective de ChR2 permet de tester de nouvelles hypothèses liées à l’activité de populations nerveuses spécifiques au cours de la maladie. Les populations nerveuses dans tout le cœur pourraient être interrogées de cette façon, comme les ganglions cardiaques intrinsèques autour des veines pulmonaires ou dans les ventricules. Par exemple, dans des modèles murins d’infarctus du myocarde, la photostimulation des neurones autonomes intrinsèques pourrait être utile pour interroger les changements électrophysiologiques dans les tissus de la zone frontalière à mesure que l’infarctus évolue et que les neurones subissent une transdifférenciation17. Dans ce protocole, nous décrivons un autre exemple impliquant des expériences contrôlées de réponses cardiaques aiguës à l’activation simultanée des voies cholinergiques et catécholaminergiques où la combinaison d’agents optogénétiques et pharmacologiques permet d’examiner des réponses à des doses uniques. Cette activation concomitante est un phénomène associé à la noyade, connu sous le nom de conflit autonome, qui n’a pas encore été entièrement élucidé18. De plus, avec des combinaisons appropriées de lumière, de colorant et de filtre, ce protocole peut être combiné à la cartographie optique cardiaque pour étudier les effets aigus de la stimulation neuronale autonome sur l’électrophysiologie cardiaque et les mécanismes d’arythmie neuro-cardiaque 19,20,21.
Il y a plusieurs concepts importants à prendre en compte lors de l’utilisation de ce protocole pour étudier le système nerveux cardiaque intrinsèque dans les cœurs perfusés excisés. Le cœur de souris est sensible aux légers changements dans l’environnement de perfusion. Une surveillance étroite de la fréquence cardiaque est utile pour identifier les problèmes de perfusion coronarienne qui peuvent entraîner une faible oxygénation du myocarde, une ischémie et une mauvaise fonction cardiaque. Le protocole recommande d’oxygéner le perfusat à la fois dans le réservoir principal et dans le réservoir supérieur pour limiter les problèmes potentiels. L’immersion complète de la tubulure d’oxygénation permet de garantir des niveaux d’oxygène optimaux dans le perfusat. Une lampe de poche ultraviolette peut être braquée sur le cœur pour révéler la fluorescence du NADH indiquant une hypoxie/ischémie, et l’oxygénation peut être ajustée en conséquence19,20. La température du perfusat dépend du débit coronaire lors de la perfusion à pression constante. Si le débit coronaire baisse, la température du perfusat aortique peut également chuter en raison du refroidissement de la tubulure proximale à la canule aortique, ce qui entraîne une baisse de la fréquence cardiaque. L’augmentation de la température du bain d’eau perfusée peut aider à inverser ce problème. Ce protocole utilise également une boucle de superfusion pour maintenir une température de bain cardiaque de 37 °C. Les baisses de température du bain cardiaque peuvent nécessiter une augmentation du débit de superfusion. La micro-LED est une autre source potentielle de changements de la température cardiaque, car la température de l’AR pourrait augmenter pendant la photostimulation. Si l’élastomère de silicone qui enveloppe l’appareil est trop fin, la micro-LED peut se réchauffer et chauffer le nœud SA, ce qui entraîne une augmentation inattendue de la fréquence cardiaque. Tester la source lumineuse micro-LED sur un cœur de type sauvage peut être utile pour évaluer les niveaux de chaleur. La micro-LED ne doit pas provoquer une augmentation de la fréquence cardiaque de plus de 10 % sur 30 s. Si cela se produit, l’élastomère de silicone doit être remplacé.
L’objectif des expériences cardiaques perfusées ex vivo est de recréer des conditions physiologiques proches avec des variables contrôlables, mais elles ont des limites22. Le perfusat cristalloïde est la norme pour ces expériences ; Cependant, il peut limiter l’apport d’oxygène aux mitochondries dans des conditions de stress élevé23,24. De plus, le perfusate manque d’hormones circulantes qui se produiraient naturellement in vivo. Une limitation supplémentaire est que l’intensité lumineuse variable et le placement de la micro-LED peuvent entraîner des disparités locales dans la stimulation neuronale, de sorte que certains ajustements dans le positionnement de la micro-LED au-dessus du cœur sont toujours nécessaires avant de commencer un protocole expérimental.
En résumé, ce protocole illustre une approche ex vivo pour la stimulation optogénétique spécifique des neurones cardiaques dans des cœurs de souris perfusés. Une source lumineuse micro-LED a été construite pour stimuler les neurones de l’oreillette droite. Une application de cette approche a combiné la libération intrinsèque d’acétylcholine lors de l’activation optogénétique d’un cœur de souris ChAT-ChR2 simultanément avec une augmentation de l’EN. Les changements résultants de la fréquence cardiaque lors de l’activation catécholaminergique et cholinergique simultanée ont été présentés. Ce protocole décrit une approche expérimentale précieuse pour étudier la cinétique de l’activation soudaine des neurones autonomes intrinsèques dans les cœurs perfusés et les interactions entre l’activité cholinergique cardiaque et catécholaminergique.
Déclarations de divulgation
Aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par le NIH R01 HL144157 à MWK, le NIH R01 HL144157 à EE et MWK, et le NIH R01s HL147279 et HL146169 à MWK et DM, ainsi qu’une bourse de doctorat distinguée Collins à RR.
matériels
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Références
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon