Method Article
Оптогенетическая активация собственных сердечных вегетативных нейронов в иссеченных перфузированных сердцах мышей
В этой статье
Резюме
Этот протокол иллюстрирует метод оптогенетической стимуляции внутренних сердечных нейронов в трансгенных сердцах мышей. Описанный подход используется для исследования кинетики внезапной активации сердечных нейронов в перфузированных сердцах ex vivo и взаимодействия между холинергической и катехоламинергической активностью.
Аннотация
Баланс холинергической и катехоламинергической активации необходим для поддержания здоровья сердца. Исследование взаимодействия между этими путями может быть проведено с помощью оптогенетики через селективную экспрессию каналродопсина-2 (ChR2) в сердечных вегетативных нейронах. Такие кардиологические приложения оптогенетики позволяют изучать собственное высвобождение нейротрансмиттеров в пространственно-временном пространстве. Этот метод иллюстрирует подход ex vivo к специфической оптогенетической стимуляции сердечных нейронов в перфузированных сердцах мышей. Трансгенные мыши были выведены для экспрессии ChR2 в нейронах холинацетилтрансферазы (ChAT) или тирозингидроксилазы (TH) по всему телу. Был получен микро-светодиод (465 нм), заключенный в силиконовый эластомер, для стимуляции нейронов правого предсердия, иннервирующих синоатриальный узел. Микро-светодиод был подключен к функциональному генератору, настроенному на импульсные волны с частотой 10 Гц и длительностью импульса 30 мс. Сердца с подтвержденной экспрессией были иссечены и ретроградно перфузированы на системе Лангендорфа с циркулирующим раствором Кребса-Хенселеита. Электрокардиограмма (ЭКГ), температура и скорость коронарного кровотока регистрировались с помощью программного обеспечения LabChart. Как только сердце стабилизировалось, микросветодиод был размещен в правом предсердии и проверен на оптимальную реакцию сердечного ритма. Применение этого подхода сочетает в себе собственное высвобождение холинергического нейромедиатора (ацетилхолина) во время оптогенетической активации сердца мыши ChAT-ChR2 одновременно с увеличением экзогенного катехоламинергического нейромедиатора (норадреналина), добавляемого в перфузат. Представлены результирующие изменения частоты сердечных сокращений при одновременной холинергической и катехоламинергической активации. Этот метод описывает ценный экспериментальный подход к исследованию кинетики внезапной активации внутренних вегетативных нейронов в перфузированных сердцах и взаимодействия между холинергической и катехоламинергической активностью сердца.
Введение
Оптогенетика — это метод введения светочувствительных белков (опсинов) в целевые клеточные популяции. Это обеспечивает пространственно-временную модуляцию конкретных клеток и тканей, которая не может быть достигнута с помощью электрических или химических средств1. Применение оптогенетики в кардиологии становится все более популярным в течение последних 15 лет2. Фотостимуляция возбуждающих опсинов, таких как канальный родопсин-2 (ChR2), катион, в сердечных миоцитах или нейронах приводит к клеточной деполяризации, вызывающей изменения сердечногоритма3. Существует два способа селективной экспрессии опсинов в клеточных популяциях с использованием подхода Cre-lox: вирусная трансдукция4 и скрещивание трансгенных животных5. Селективная экспрессия ChR2 в специфических вегетативных нейронах может быть достигнута путем скрещивания с целью создания потомства, экспрессирующего ChR2 в холинергических или катехоламинергических нейронах с использованием клеточно-специфическихпромоторов. Один родитель с флоксированным геном ChR2 может быть спарен с родителем, который экспрессирует Cre-рекомбиназу под контролем промотора, такого как тирозингидроксилаза (TH, катехоламинергические нейроны) или холинацетилтрансфераза (ChAT, холинергические нейроны). Затем потомство экспрессирует ChR2 в нейронах TH или ChAT повсему телу.
Функциональная реакция сердца на острую активацию вегетативных нейронов может быть исследована с использованием экспрессии ChR2, вызванной промоторами, в определенных нейронных популяциях, например, холинергических или катехоламинергических нейронах. Интервал и интенсивность импульсов фотостимуляции могут быть изменены для контроля скорости деполяризации нейронов, экспрессирующих ChR2, для изучения того, как уровни нейронной активации модулируют сердечную функцию. Для этого метода нейроны будут использоваться для обозначения любых клеточных тел, аксонов и/или аксональных проекций, которые оптогенетически активируются для простоты. Также можно сочетать фотостимуляцию с химической активацией путем введения лекарственных препаратов или нейротрансмиттеров для исследования одновременного воздействия на сердечный ритм и сократимость. Например, оптогенетическая холинергическая стимуляция может сочетаться с инъекцией экзогенного норадреналина (НЭ) для изучения влияния одновременной вегетативной активации в сердце. Проведение таких исследований с использованием изолированных перфузированных сердец имеет то преимущество, что обеспечивает хорошо контролируемую экспериментальную платформу для изучения функциональных изменений, вызванныхфотоактивацией. Изменения морфологии ЭКГ, частоты сердечных сокращений и скорости коронарного кровотока можно контролировать, при этом температура, оксигенация и перфузионное давление строго контролируются.
Целью данного протокола является представление экспериментального подхода к активации определенной популяции автономных нейронов в сердцах мышей для изучения изменений частоты сердечных сокращений. Также представлено создание и использование микро-светодиодного устройства для оптогенетической активации в перфузированных сердцах. Сердца мышей, экспрессирующих ChR2 в холинергических или катехоламинергических нейронах, были иссечены и ретроградно перфузированы кислородным раствором Кребса-Хенселеита при постоянном давлении. ChR2, экспрессируемый в нейронах правого предсердия (РА), фотостимулировали с частотой пульса 10 Гц и длительностью импульса 30 мс. Мгновенная частота сердечных сокращений рассчитывалась с использованием интервала RR и контролировалась на предмет изменений во время фотостимуляции. Также описан пример эксперимента по изучению кинетики сердечного ритма при собственной оптогенетической фотостимуляции нейронов ChAT одновременно с бета-адренергической активацией с использованием экзогенного норадреналина.
протокол
Все протоколы для животных были одобрены Комитетом по уходу за животными и их использованию Университета Джорджа Вашингтона и соответствовали Руководству Национального института здравоохранения по уходу и использованию лабораторных животных.
1. Конструкция микро-светодиодного источника света
- Под препарирующим микроскопом в хорошо проветриваемом помещении припаяйте зачищенные концы двух изолированных медных проводов, длиной не менее 20 см, к точкам контакта микросветодиода с длиной волны 465 нм (рис. 1). Проверьте пайку, подключив светодиод к источнику питания и включив его.
- Отрежьте дно на 1 см от отфильтрованного наконечника для пипетки объемом 200 мкл. Вытолкните фильтр с помощью стержня малого диаметра. Вставьте микросветодиод с проводами в наконечник пипетки так, чтобы светодиод находился на одном уровне с концом наконечника. Установите фильтр в верхней части наконечника дозатора, чтобы зафиксировать светодиод и провода на месте, а затем приклейте края светодиода к наконечнику пипетки. Дайте суперклею высохнуть.
- Приготовьте силиконовый эластомер, соединив основу и отвердитель в пропорции 10:1 и хорошо перемешайте. Удалите любые пузырьки из смеси с помощью вакуумной камеры или центрифугирования.
- Возьмите центрифужную пробирку объемом 0,5 мл и надрежьте боковые стороны, чтобы облегчить снятие светодиода (при желании смазку также можно добавить внутрь пробирки). Заклейте трубку скотчем снаружи, чтобы предотвратить утечку. Налейте в трубку примерно 0,2 мл смеси силиконовых эластомеров, а затем поместите наконечник пипетки micro-LED в трубку, оставив пространство не менее 1 мм между светодиодом и дном трубки. Если образовались пузырьки, постучите центрифужной трубкой по твердой поверхности, чтобы сместить их.
ПРИМЕЧАНИЕ: Наконечник пипетки может быть предварительно покрыт силиконовым эластомером для уменьшения образования пузырьков при размещении светодиода. - Поместите центрифужную трубку micro-LED вертикально в лабораторную печь или инкубатор при температуре 50 °C и оставьте минимум на 8 часов или на ночь. При взаимодействии с духовкой надевайте термостойкие перчатки. Как только эластомер затвердеет, снимите светодиод с центрифужной трубки. Если эластомер все еще липкий, поместите его обратно в духовку.
- После полного отверждения удалите излишки эластомера с кончика светодиода с помощью прецизионного канцелярского ножа, оставляя не более 1 мм. Правильная инкапсуляция светодиода сведет к минимуму нагрев ткани во время фотостимуляции.
- Определите оптическую мощность светодиода с помощью измерителя оптической мощности. Включите измеритель мощности и отрегулируйте настройки длины волны так, чтобы они показывали 465 нм. Поместите светодиод на одну линию с датчиком мощности фотодиода и включите светодиод с помощью функционального генератора. Измеритель оптической мощности будет выдавать показания в ваттах. Рассчитайте интенсивность излучения, разделив показания мощности на площадь освещаемой поверхности (0,88мм2).
ПРИМЕЧАНИЕ: Идеальная интенсивность излучения должна составлять примерно 2,4 мВт/мм2 для соответствующей активации ChR211.
2. Подготовка к эксперименту
- Разводить мышей в соответствии с предыдущей публикацией для экспрессии ChR2 либо в холинергических нейронах (ChAT-ChR2), либо в катехоламинергических нейронах (TH-ChR2)12 (рис. 2). Подтвердите экспрессию TH-Cre или ChAT-Cre у мышей, используемых для экспериментов с использованием подхода генотипирования, как описано ранее12.
- Приготовьте не менее 225 мл раствора Krebs-Henseleit (KH) (в мМ: 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 глюкозы) и отфильтруйте с помощью мембранного фильтра 0,2 мкм на основе нитрата целлюлозы. Отрегулируйте pH до 7,4 при насыщении кислородом с использованием 95%O2 и 5%CO2.
- Перед началом эксперимента промойте перфузионную систему Лангендорфа очищенной водой и удалите лишнюю воду перед началом эксперимента.
- Добавьте в систему мембранный фильтр 10 мкм перед циркуляцией KH. Включите водяные бани, настроенные на поддержание температуры перфузата на уровне 37 °C при скорости потока 2-5 мл/мин.
- Добавьте 175 мл KH в систему перфузии и начните циркуляцию. Пузырьки раствора с 95%O2 / 5% CO2 для обеспечения достаточного насыщения кислородом.
ПРИМЕЧАНИЕ: Циркулирующий объем KH будет варьироваться от системы к системе в зависимости от размеров трубок и резервуара. - Откалибруйте расходомер, остановив поток через систему перфузии с помощью запорного крана и нажав кнопку «Ноль » на расходомере.
- Подготовьте программное обеспечение для сбора физиологических данных, такое как LabChart, которое будет иметь 12 каналов: температура сердечной ванны, температура перфузата аорты, отведения ЭКГ I-III плюс четыре дополнительных вычислительных отведения, расчет частоты сердечных сокращений, скорость потока и выход генератора функций для отслеживания импульсов светодиодов.
- Используя канал, зарезервированный для частоты сердечных сокращений, рассчитайте частоту сердечных сокращений в LabChart с помощью функции циклических измерений, настроенной для определения ЭКГ мыши в отведении I. Расширение Cardiac Axis в LabChart использует отведения I и II для расчета отведений III, aVR, aVL и aVF.
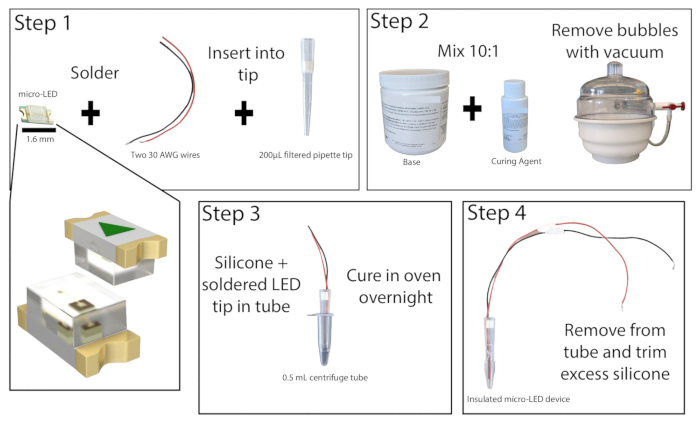
Рисунок 1: Конструкция Micro-LED. Упрощенный обзор этапов создания микро-светодиодного источника света. Два провода припаиваются к микросветодиоду и вставляются в наконечник пипетки объемом 200 мкл, а затем склеиваются суперклеем (шаг 1). Силиконовый эластомер смешивают в соотношении 10:1 и помещают в вакуумную камеру для удаления пузырьков (Шаг 2). Силиконовый эластомер заливают в микроцентрифужную пробирку, вставляют наконечник пипетки micro-LED и дают ему затвердеть в течение ночи (шаг 3). Затем изолированный микро-светодиод удаляется из трубки, а излишки силикона следует обрезать (шаг 4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
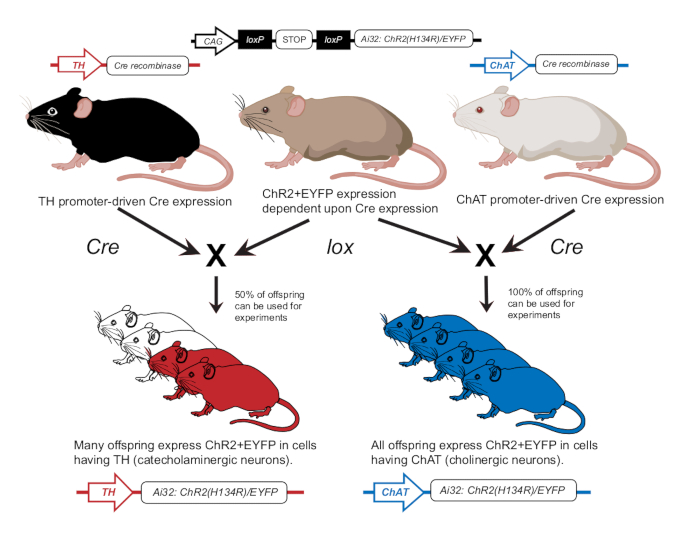
Рисунок 2: Схема разведения трансгенных мышей. Родительская мышь с lox-зависимым геном ChR2 скрещивается с другой мышью с промотором Cre. Родительская мышь с промотором Cre тирозингидроксилазы (TH) будет производить гетерозиготное потомство, где 50% будет экспрессировать ChR2 в катехоламинергических клетках. Родительская мышь с промотором Cre холинацетилтрансферазы (ChAT) произведет гомозиготное потомство, в котором 100% будет экспрессировать ChR2 в холинергических клетках. Экспрессия подтверждается с помощью генотипирования. Эта цифра была изменена с разрешенияот 12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Иссечение и перфузия сердца
- Перед иссечением введите 250 единиц гепарина (примерно 8 ЕД/г) путем внутрибрюшинной инъекции с помощью шприца объемом 1 мл. Подождите не менее 10 минут перед операцией.
- Поместите взрослую мышь в индукционную камеру для анестезии. Введите ~4% изофлуран и подождите, пока частота дыхания замедлится и углубится. Извлеките мышь из камеры и проверьте прекращение болевого рефлекса путем щипки пальца ноги перед выполнением шейного вывиха.
- Удерживайте мечевидный отросток парой щипцов и врежьте в брюшную полость с помощью хирургических ножниц. Откройте грудную полость, осторожно прорезав диафрагму. Разрежьте ребра, чтобы обнажить сердце и легкие. Аккуратно захватите легкие и иссеките сердце и легкие.
- Поместите сердце в чашку с гепаринизированным KH. Удалите легкие и любые крупные куски жира. Поместите очищенное сердце во2-ю чашку с гепаринизированным KH под препарирующим микроскопом, установленным на 2-кратное увеличение. Найдите аорту и наденьте ее на канюлю с помощью тонких щипцов. Закрепите сердце на канюле с помощью шелкового шва 4-0.
ПРИМЕЧАНИЕ: Канюляция может быть сделана над льдом, чтобы снизить метаболическую активность сердца. - Промывайте болюсную инъекцию гепаринизированной KH через канюлю для удаления крови из коронарных артерий перед установкой на перфузионную систему.
- Подключите канюлированное сердце к системе перфузии и поместите его в чашку PDMS, наполненную перфузатом. Поместите игольчатые электроды ЭКГ в чашку PDMS в соответствии с треугольником Эйнтховена13. Акклиматизируйте сердце не менее 5 минут.
- Поверните сердце так, чтобы левое предсердие было доступно, и прорежьте отверстие ~1 мм в левом предсердии с помощью микросамооткрывающихся ножниц. Вставьте трубку диаметром 1 мм через этот срез в левый желудочек, чтобы выпустить перфузат, попавший там.
ПРИМЕЧАНИЕ: Наличие препарирующего микроскопа для изучения сердца может облегчить этот этап. - Поверните сердце так, чтобы РА был обращен вверх, а синоатриальный (СА) узел был доступен для освещения (рисунок 3).
- При необходимости отрегулируйте электроды ЭКГ, переместив электроды ближе к сердцу или погрузив их в перфузат, чтобы получать сигналы с подходящим соотношением сигнал/шум. Настройки могут различаться в зависимости от используемого аппаратного и программного обеспечения для регистрации ЭКГ. В этом методе использовался модуль Айнтховена Гольдбергера с коэффициентом усиления 2000 и фильтром среза 500 Гц, а программные настройки включали сетевой фильтр и частоту дискретизации 1000 Гц.
4. Оптогенетическая активация
- Подключите устройство micro-LED к функциональному генератору для получения импульсных волн со следующими параметрами: частота 10 Гц, длительность импульса 30 мс, амплитуда 10 Вpp .
- Аккуратно поместите микросветодиод на узел SA. Избегайте слишком сильного нажатия на micro-LED, так как это может привести к снижению частоты сердечных сокращений и функции.
- Включите генератор функций и измерьте изменения частоты сердечных сокращений от фотостимуляции. Немедленные изменения частоты сердечных сокращений указывают на эффективную активацию. Катехоламинергическая активация вызывает экспоненциальное увеличение частоты сердечных сокращений10, в то время как холинергическая активация вызывает немедленное снижение8.
- Выключите генератор функций. Дайте частоте сердечных сокращений вернуться к уровням, предшествовавшим активации.
- Если оптогенетическая активация приводит к изменению частоты сердечных сокращений менее чем на 100 уд/мин, измените положение микросветодиода, чтобы лучше освещать нейроны РА. При необходимости повторите.
5. Методика эксперимента и анализ данных
- Чтобы проверить гипотезу о том, что собственная оптогенетическая холинергическая стимуляция может подавлять экзогенную бета-адренергическую активацию норадреналином (НЭ), приготовьте 10 мкМ и 100 мкМ исходных растворов НЭ в дымовой пище.
- Добавьте болюсную дозу НЭ в систему перфузии через инъекционный порт. Как только частота сердечных сокращений выйдет на плато, включите микро-светодиод на ~10 секунд. Выключите свет и следите за изменениями частоты сердечных сокращений.
- После того как частота сердечных сокращений вернется к синусовому ритму, увеличьте дозу НЭ и повторите оптогенетическую стимуляцию. Продолжайте прием каждой дозы НЭ.
- В конце исследования отключите подачу газа, извлеките сердце из системы и при необходимости сохраните его в фиксированном состоянии.
- При необходимости промойте резервуары и трубки перфузионной системы деионизионной водой или моющим средством. Тщательно просушите систему, чтобы предотвратить появление плесени.
- Сохраните файл LabChart. Экспортируйте сигнал сердечного ритма и каналы ЭКГ для автономного анализа и графического представления.
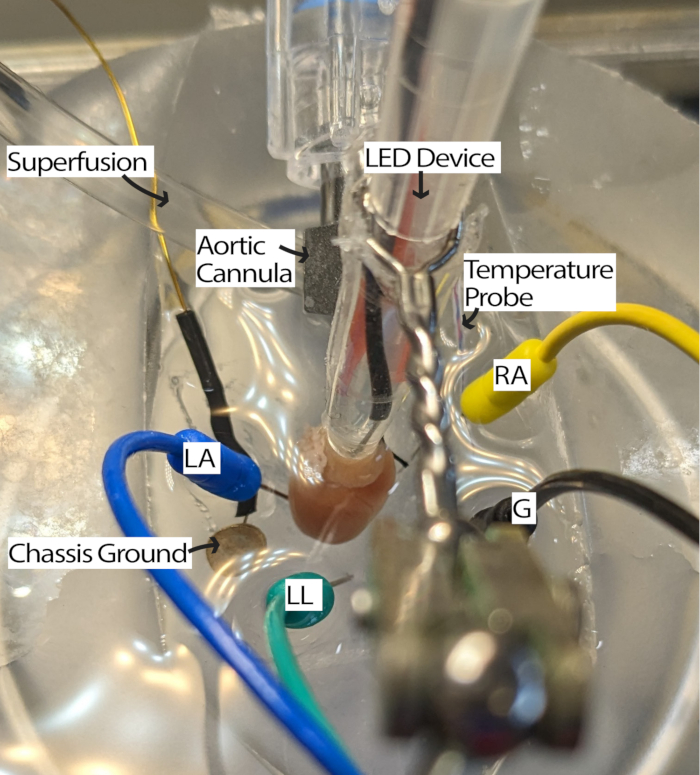
Рисунок 3: Конфигурация ванны для сердца мыши. Канюлированное сердце мыши, показывающее размещение светодиодного устройства и электродов ЭКГ. Для снижения шума от окружающей электроники имеется заземление корпуса. Игольчатые электроды ЭКГ размещаются на основе треугольника Эйнтховена. Сокращения: LA = левая рука; RA = правая рука; LL = левая нога; G = земля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Перфузионная система постоянного давления Лангендорфа (рис. 4) должна быть способна поддерживать частоту сердечных сокращений мышей не менее 300 уд/мин в течение более чем часа, если поддерживаются соответствующие оксигенация, температура и коронарный кровоток. При такой конфигурации температура перфузата аорты зависит от коронарного потока, поэтому может потребоваться корректировка температуры водяной бани по мере изменения скорости потока для поддержания температуры аорты на уровне 37 °C. Скорость коронарного кровотока в сердце мыши обычно колеблется от 1,5 до 4,5 мл/мин, в зависимости от размера сердца. Поддержание температуры перфузата на уровне 37 °C во время колебаний скорости потока необходимо для стабильной работы сердца и особенно важно для перфузии с постоянным давлением. Описанная перфузионная система предназначена для поддержания гидростатического давления 70 мм рт.ст. по высоте перфузатного столба. Это достигается за счет скорости насоса, которая обеспечивает постоянный перелив из верхнего резервуара. Перфузат может быть дополнен 20 мкМ сосудорасширяющего кромакалина для улучшения и поддержания нормального или наднормального коронарного кровотока для обеспечения полной оксигенации миокарда14.
Фотостимуляция холинергических нейронов в сердцах мышей ChAT-ChR2 с частотой 10 Гц и длительностью импульса 30 мс должна привести к почти мгновенному снижению частоты сердечных сокращений. Эффективная фотостимуляция холинергических нейронов в адекватно перфузированных сердцах должна приводить к снижению частоты сердечных сокращений не менее чем на 100 уд/мин. На рисунке 5 показано немедленное падение на 75 уд/мин при включении микро-светодиода, которое продолжает снижаться до тех пор, пока не достигнет максимального снижения в 135 уд/мин. В течение половины секунды после выключения микросветодиода частота сердечных сокращений увеличивается до 175 ударов в минуту, а затем постепенно возвращается к уровням, предшествовавшим стимуляции. ЭКГ в шести отведениях представлена для иллюстрации различий в интервале RR до, во время и после стимуляции (рисунок 5B). Отведения aVR, aVL и aVF рассчитываются в программном обеспечении LabChart с использованием отведений I и II.
Фотостимуляция катехоламинергических нейронов в сердцах мышей с TH-ChR2 вызывает более постепенное (экспоненциальное) изменение частоты сердечных сокращений по сравнению с фотостимуляцией холинергических нейронов. Вероятно, это вызвано бета1-адренергической активацией, требующей второго мессенджера цАМФ, активирующей PKA, которая фосфорилирует целевые белки, в то время как мускариновая активация этого не делает. На рисунке 6 показано увеличение частоты сердечных сокращений на 135 уд/мин в течение 10 секунд. После выключения света требуется еще 10 с, чтобы вернуться к нормальному синусовому ритму. Если микро-светодиод не изолирован должным образом, он может нагревать сердце, вызывая увеличение частоты сердечных сокращений. Эта реакция на нагрев менее интенсивна, чем стимуляция TH-ChR2; Поэтому изменение частоты сердечных сокращений менее выражено.
Одним из применений этого протокола является использование оптогенетической стимуляции для деполяризации нейронов, что приводит к высвобождению эндогенных нейротрансмиттеров при одновременном добавлении экзогенных нейротрансмиттеров к перфузату. На рисунке 7A показано эндогенное высвобождение ацетилхолина из сердца мыши ChAT-ChR2 при добавлении к перфузату болюсной дозы НЭ. Без присутствия НЭ фотостимуляция вызывала снижение частоты сердечных сокращений более чем на 100 уд/мин и поддерживала это падение в течение всего времени стимуляции. Тогда как при большой дозе НЭ (2000 нМ) максимальное падение частоты сердечных сокращений при фотостимуляции составило 40 уд/мин. Частота сердечных сокращений сразу же начала расти, почти достигнув уровня предварительной стимуляции еще до того, как свет был выключен. Этот результат указывает на то, что оптогенетическое подавление частоты сердечных сокращений с помощью фотостимуляции нейронов ChAT не смогло полностью подавить увеличение частоты сердечных сокращений в результате высокой дозы НЭ, что привело к сокращению времени подавления сердечного ритма и снижению частоты сердечных сокращений (рис. 7B). Эти результаты согласуются с предыдущими работами на крупных животных, которые продемонстрировали прогрессирующую блокаду АВ-узлов во время одновременной стимуляции блуждающего нерва и звездчатых ганглиев12,13.
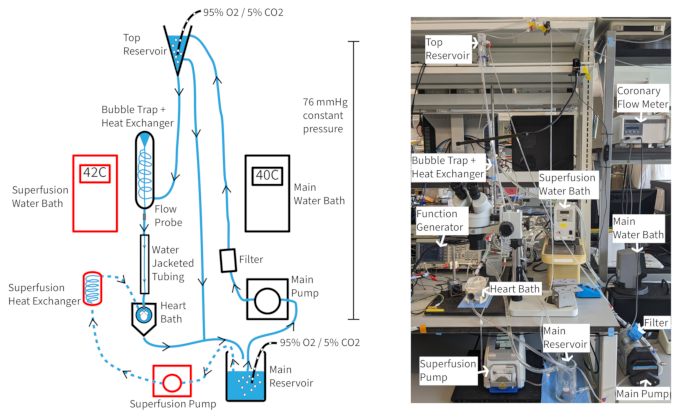
Рисунок 4: Экспериментальная установка. Схема перфузионной системы. Стрелками показано направление перфузата. Перфузат Superfusion обозначен пунктирными линиями, а компоненты обведены красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
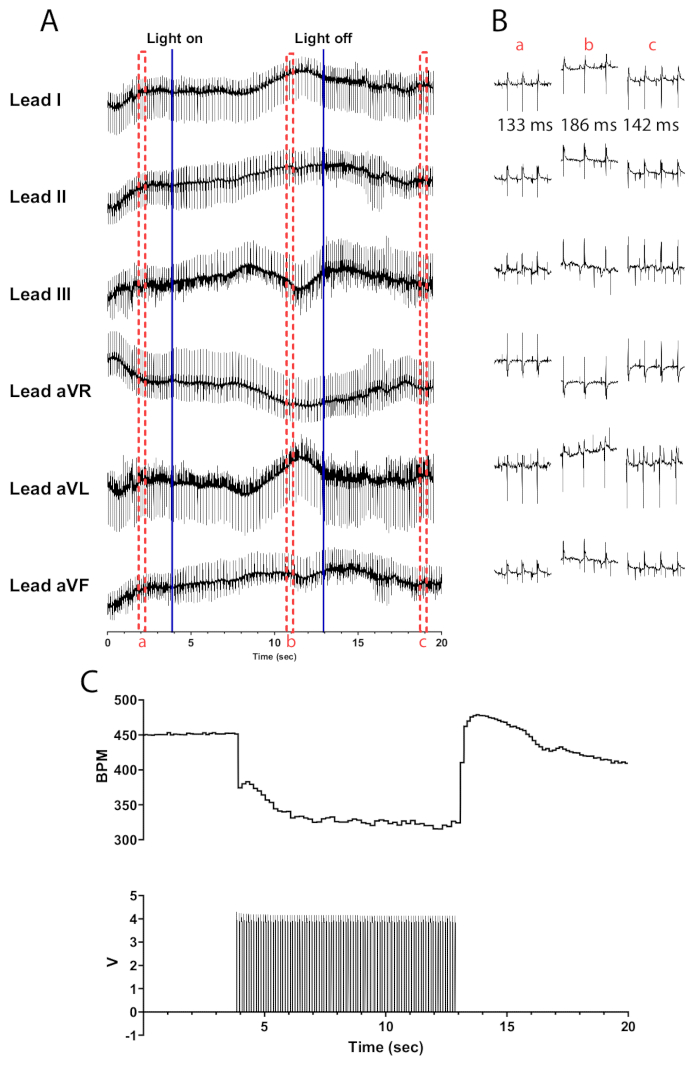
Рисунок 5: Репрезентативная реакция холинергической фотостимуляции. (A) ЭКГ в 6 отведениях во время оптогенетической активации ChAT-ChR2. Сплошные синие линии указывают на включение/выключение микросветодиода. Красными пунктирными полями обозначено время для (B) сниппетов. (B) Полусекундные фрагменты сигнала ЭКГ до (a), во время (b) и после фотостимуляции (c). Интервал RR отображается для каждого участка. (C) Частота сердечных сокращений (вверху) отображается вместе с пульсовыми волнами от функционального генератора (внизу). Частота сердечных сокращений начинается с 450 уд/мин и снижается до 315 уд/мин после 8 с фотостимуляции, прежде чем вернуться к 410 уд/мин через 7 с после окончания фотостимуляции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
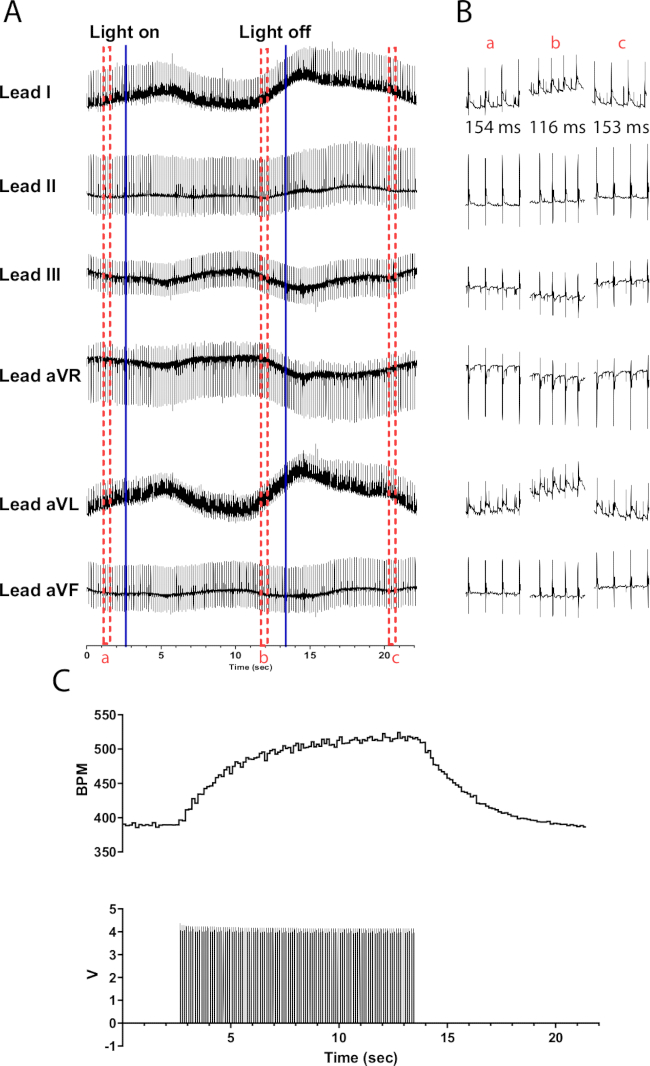
Рисунок 6: Репрезентативная реакция катехоламинергической фотостимуляции. (A) ЭКГ в 6 отведениях во время оптогенетической активации TH-ChR2. Сплошные синие линии указывают на включение/выключение микросветодиода. Красными пунктирными полями обозначено время для (B) сниппетов. (B) Полусекундные фрагменты сигнала ЭКГ до (a), во время (b) и после фотостимуляции (c). Интервал RR отображается для каждого участка. (C) Частота сердечных сокращений (вверху) отображается вместе с пульсовыми волнами от функционального генератора (внизу). Частота сердечных сокращений начинается с 390 уд/мин и достигает максимума до 525 уд/мин после 10 с фотостимуляции, прежде чем вернуться к 390 уд/мин через 8 с после окончания фотостимуляции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
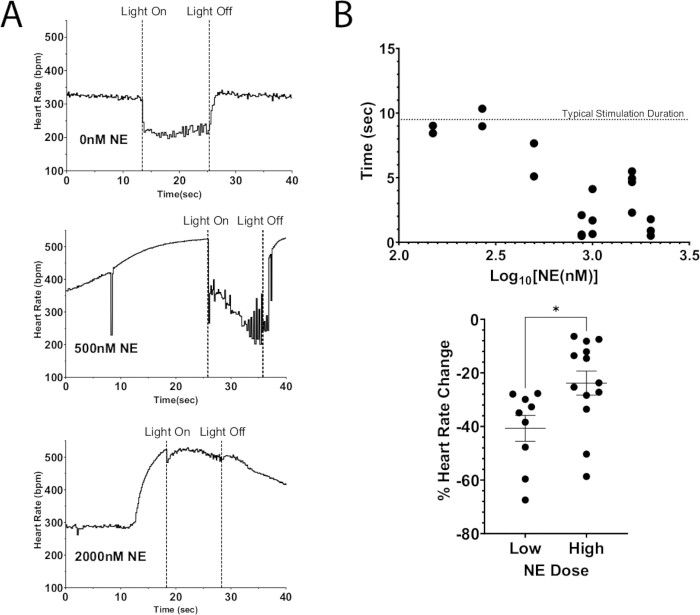
Рисунок 7: Холинергическая фотостимуляция экзогенным НЭ. (А) Реакция сердечного ритма во время фотостимуляции ChAT-ChR2 с увеличением дозы НЭ с добавлением перфузата. Как только частота сердечных сокращений достигала максимального увеличения из-за НЭ, микро-светодиод включался примерно на 10 секунд. Подавление сердечного ритма все еще было возможно при высоких дозах НЭ, но продолжительность стимуляции уменьшалась по мере увеличения дозы. (B) Количество времени, в течение которого частота сердечных сокращений оставалась подавленной. Время ближе к 10 с обычно оставалось подавленным в течение всей продолжительности стимуляции. (В) Снижение частоты сердечных сокращений во время фотостимуляции было менее выраженным при более высоких дозах НЭ, чем при низких. Низкие дозы приводили к снижению частоты сердечных сокращений в среднем на 40%, в то время как более высокие дозы снижались только на 25%. Для оценки статистической значимости был проведен непарный t-критерий. Представлена в виде стандартной погрешности среднего значения * p < 0,05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Оптогенетическая стимуляция внутренних сердечных вегетативных нейронов привела к уровням реакции сердечного ритма, сравнимым с электрической стимуляцией блуждающего нерва или звездчатых ганглиев14,15. Электрическая стимуляция иссеченных перфузированных сердец, однако, не имеет того преимущества, что она может легко воздействовать на определенные популяции нейронов. Фармакологическая активация дает преимущество в нацеливании на специфические рецепторы, но не имеет пространственной специфичности, а время реакции зависит от скорости коронарного кровотока. Оптогенетическая активация обеспечивает почти мгновенную реакцию, нацеливание на популяции нейронов и способность изменять уровень фотостимуляции. В этом протоколе мы также объяснили, как создать простой и недорогой источник света для фотостимуляции внутренних сердечных нейронов.
Дальнейшее понимание влияния внутрисердечной нервной системы будет способствовать лучшей диагностике и лечению сердечно-сосудистых заболеваний. Селективная экспрессия ChR2 позволяет проверить новые гипотезы, связанные с активностью конкретных нервных популяций во время заболевания. Таким образом можно исследовать нервные популяции по всему сердцу, такие как внутренние сердечные ганглии вокруг легочных вен или по всему желудочку. Например, на мышиных моделях инфаркта миокарда фотостимуляция внутренних вегетативных нейронов может быть полезна для изучения электрофизиологических изменений в тканях пограничной зоны по мере развития инфаркта и трансдифференцировки нейронов. В этом протоколе мы описываем еще один пример, включающий контролируемые эксперименты с острыми сердечными реакциями на одновременную активацию холинергических и катехоламинергических путей, где комбинация оптогенетических и фармакологических агентов позволяет исследовать уникальные дозовые реакции. Эта одновременная активация является явлением, связанным с утоплением, известным как вегетативный конфликт, который до сих пор полностью не выяснен. Кроме того, при наличии соответствующих комбинаций света, красителя и фильтра, этот протокол может быть объединен с сердечным оптическим картированием для изучения острого влияния стимуляции вегетативных нейронов на электрофизиологию сердца и механизмы нейросердечной аритмии 19,20,21.
Существует несколько важных концепций, которые следует учитывать при использовании этого протокола для изучения внутренней сердечной нервной системы в иссеченных перфузированных сердцах. Сердца мышей чувствительны к незначительным изменениям в перфузионной среде. Тщательный мониторинг частоты сердечных сокращений полезен для выявления проблем с коронарной перфузией, которые могут вызвать низкую оксигенацию миокарда, ишемию и плохую работу сердца. Протокол рекомендует насыщать перфузат кислородом как в основном, так и в верхнем резервуаре, чтобы ограничить потенциальные проблемы. Полное погружение трубки оксигенации помогает гарантировать оптимальный уровень кислорода в перфузате. Ультрафиолетовый фонарик может быть направлен на сердце, чтобы выявить флуоресценцию НАДН, указывающую на гипоксию/ишемию, и оксигенацию можно соответствующим образом отрегулировать19,20. Температура перфузата зависит от скорости коронарного кровотока при перфузии под постоянным давлением. Если скорость коронарного кровотока падает, температура перфузата аорты также может упасть из-за охлаждения трубки проксимальнее канюли аорты, что приводит к снижению частоты сердечных сокращений. Повышение температуры перфузатной водяной бани может помочь решить эту проблему. В этом протоколе также используется суперфузионная петля для поддержания температуры сердечной ванны на уровне 37 °C. Падение температуры сердечной ванны может потребовать увеличения скорости кровотока. Микро-светодиод является еще одним источником потенциальных изменений сердечной температуры, потому что температура РА может увеличиваться во время фотостимуляции. Если силиконовый эластомер, который обволакивает устройство, слишком тонкий, то micro-LED может нагреваться и нагревать узел SA, что приведет к неожиданному увеличению частоты сердечных сокращений. Тестирование микро-светодиодного источника света на сердце дикого типа может быть полезным для измерения уровня нагрева. Микросветодиод не должен вызывать увеличение частоты сердечных сокращений более чем на 10% в течение 30 секунд. В этом случае силиконовый эластомер следует заменить.
Цель экспериментов ex vivo с перфузированным сердцем состоит в том, чтобы воссоздать почти физиологические условия с контролируемыми переменными, но ониимеют ограничения. Кристаллоидный перфузат является стандартом для этих экспериментов; Тем не менее, он может ограничивать доставку кислорода к митохондриям в условиях высокого стресса23,24. Кроме того, в перфузате отсутствуют циркулирующие гормоны, которые естественным образом протекают in vivo. Дополнительным ограничением является то, что переменная интенсивность света и расположение микросветодиода могут привести к локальным различиям в нейронной стимуляции, поэтому перед началом экспериментального протокола всегда требуются некоторые корректировки в расположении микросветодиода над сердцем.
Таким образом, этот протокол иллюстрирует подход ex vivo к специфической оптогенетической стимуляции сердечных нейронов в перфузированных сердцах мышей. Был сконструирован микро-светодиодный источник света для стимуляции нейронов правого предсердия. Применение этого подхода сочетало собственное высвобождение ацетилхолина во время оптогенетической активации мышиного сердца ChAT-ChR2 одновременно с увеличением экзогенного НЭ. Представлены результирующие изменения частоты сердечных сокращений при одновременной катехоламинергической и холинергической активации. Этот протокол описывает ценный экспериментальный подход к исследованию кинетики внезапной активации внутренних вегетативных нейронов в перфузированных сердцах и взаимодействия между холинергической и катехоламинергической активностью сердца.
Раскрытие информации
Никаких конфликтов интересов, о которых можно было бы заявить.
Благодарности
Эта работа была поддержана NIH R01 HL144157 MWK, NIH R01 HL144157 EE и MWK, NIH R01s HL147279 и HL146169 MWK и DM, а также стипендией Collins Distinguished Doctoral Fellowship в RR.
Материалы
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Ссылки
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены