Method Article
切除灌流マウス心臓における内因性心臓自律神経ニューロンの光遺伝学的活性化
要約
このプロトコルは、トランスジェニックマウス心臓の内因性心臓ニューロンの光遺伝学的刺激の方法を示しています。記載されているアプローチは、 ex vivo 灌流された心臓における突然の心臓ニューロン活性化の動態、およびコリン作動性活性とカテコールアミン作動性活性との間の相互作用を調査するために使用されます。
要約
心臓の健康を維持するためには、コリン作動性とカテコールアミン作動性の活性化のバランスが必要です。これらの経路間の相互作用を調べるには、心自律神経ニューロンにおけるチャネルロドプシン-2(ChR2)の選択的発現によるオプトジェネティクスを用いて行うことができます。このようなオプトジェネティクスの心臓への応用により、神経伝達物質の内因性放出を時空間的に研究することが可能になる。この方法は、灌流マウス心臓における心臓ニューロンの特異的光遺伝学的刺激のための ex vivo アプローチを示しています。トランスジェニックマウスは、全身のコリンアセチルトランスフェラーゼ(ChAT)またはチロシンヒドロキシラーゼ(TH)ニューロンのいずれかでChR2を発現するように飼育されました。シリコーンエラストマーに包まれたマイクロLED(465nm)を調製し、洞房結節を神経支配する右心房のニューロンを刺激しました。マイクロLEDは、10Hzのパルス波と30msのパルス幅に設定された関数発生器に接続されました。発現が確認された心臓を切除し、クレブス・ヘンセライト溶液を循環するランゲンドルフ系で逆行性灌流しました。心電図(ECG)、体温、冠状動脈流量は、LabChartソフトウェアを使用して記録しました。心臓が安定したら、マイクロLEDを右心房に配置し、最適な心拍数反応をテストしました。このアプローチの応用は、ChAT-ChR2マウス心臓の光遺伝学的活性化中のコリン作動性神経伝達物質(アセチルコリン)の内因性放出と、灌流液に添加された外因性カテコールアミン作動性神経伝達物質(ノルエピネフリン)の増加を組み合わせたものです。コリン作動性およびカテコールアミン作動性同時活性化中の心拍数の結果として生じる変化が提示される。この方法は、灌流された心臓における突然の内因性自律神経ニューロン活性化の動力学と、心臓コリン作動性活性とカテコールアミン作動性活性との間の相互作用を調査するための貴重な実験的アプローチを示しています。
概要
オプトジェネティクスは、光感受性タンパク質(オプシン)を標的細胞集団に導入する方法です。これにより、電気的または化学的手段1では達成できない特定の細胞や組織の時空間的な調節が可能になります1。オプトジェネティクスの心臓への応用は、過去15年間でますます人気が高まっています2。心筋細胞またはニューロンにおけるチャネルロドプシン-2(ChR2)、陽イオンなどの興奮性オプシンの光刺激は、細胞の脱分極を引き起こし、心臓のリズムの変化を引き起こします3。Cre-loxアプローチを用いて細胞集団でオプシンを選択的に発現させるには、ウイルス形質導入4 とトランスジェニック動物5の交雑育種という2つの方法があります。特定の自律神経ニューロンにおけるChR2の選択的発現は、細胞特異的プロモーターを用いて、コリン作動性ニューロンまたはカテコールアミン作動性ニューロンのいずれかでChR2を発現する仔を作製するための交配によって達成することができる6。フロックス化されたChR2遺伝子を持つ片方の親は、チロシンヒドロキシラーゼ(TH、カテコールアミン作動性ニューロン)やコリンアセチルトランスフェラーゼ(ChAT、コリン作動性ニューロン)などのプロモーターの制御下でCreリコンビナーゼを発現する親と交配することができます。その後、子孫は全身のTHニューロンまたはChATニューロンのいずれかでChR2を発現する7。
自律神経ニューロンの急性活性化に対する心臓の機能的応答は、特定のニューロン集団(例えば、コリン作動性ニューロンまたはカテコールラミン作動性ニューロン)内でのChR2のプロモーター駆動型発現を用いて調べることができる。光刺激パルスの間隔と強度を変化させて、ChR2発現ニューロンの脱分極速度を制御し、神経活性化のレベルが心機能をどのように調節するかを研究することができる8。この方法では、ニューロンは、簡単にするために光遺伝学的に活性化される任意の細胞体、軸索、および/または軸索突起を指すために使用されます。また、薬物や神経伝達物質の導入により、光刺激と化学的活性化を組み合わせて、心臓のリズムと収縮性に対する同時の影響を調べることも可能である9。例えば、光遺伝学的コリン作動性刺激を外因性ノルエピネフリン(NE)の注射と組み合わせることで、心臓における自律神経活性化の同時性の影響を調べることができます。単離された灌流心臓を用いてこのような研究を行うことは、光活性化10によって引き起こされる機能変化を研究するための適切に制御された実験プラットフォームを提供するという利点を有する。ECGの形態、心拍数、冠状動脈流量の変化をモニタリングしながら、温度、酸素化、灌流圧を厳密に制御できます。
このプロトコルの目的は、マウスの心臓の自律神経ニューロンの特定の集団を活性化して心拍数の変化を研究するための実験的アプローチを提示することです。灌流された心臓における光遺伝学的活性化のためのマイクロLEDデバイスの構造と使用法も紹介されます。コリン作動性ニューロンまたはカテコールアミン作動性ニューロンでChR2を発現するマウスの心臓を切除し、酸素化されたクレブス・ヘンセライト溶液を一定の圧力で逆行性灌流した。右心房(RA)のニューロンに発現するChR2を、パルス幅30msで10Hzのパルスレートで光刺激した。瞬間心拍数はRR間隔を使用して計算され、光刺激中の変化について監視されました。外因性ノルエピネフリンを使用したベータアドレナリン作動性活性化と同時に、内因性光遺伝学的ChATニューロン光刺激中の心拍数動態を研究する実験例も記載されています。
プロトコル
すべての動物プロトコルは、ジョージワシントン大学の動物管理および使用委員会によって承認され、国立衛生研究所の実験動物の世話と使用に関するガイドに従っています。
1. マイクロLED光源の構造
- 換気の良い場所で、2本の絶縁銅線(長さ20cm以上)の剥がれた端を465nmのマイクロLEDの接点にはんだ付けします(図1)。LEDを電源に接続してオンにして、はんだ付けをテストします。
- 200 μLフィルター付きピペットチップの底を1 cmカットします。小径ロッドでフィルターを押し出します。ワイヤー付きのマイクロLEDをピペットチップに挿入して、LEDがチップの端と同じ高さになるようにします。ピペットチップの上部にあるフィルターを元に戻してLEDとワイヤーを所定の位置に保持し、LEDの端をピペットチップに瞬間接着します。瞬間接着剤を乾かします。
- ベースと硬化剤を10:1の割合で組み合わせてシリコーンエラストマーを調製し、よく混ぜます。真空チャンバーを使用するか、遠心分離機を使用して、混合物から気泡を取り除きます。
- 0.5 mLの遠心分離チューブを取り、LEDの取り外しを容易にするために側面にスコアを付けます(必要に応じて、ここでチューブの内側に潤滑剤を追加することもできます)。漏れないようにチューブの外側をテープで留めます。シリコンエラストマー混合物を約0.2mLチューブに注ぎ、次にマイクロLEDピペットチップをチューブに入れ、LEDとチューブの底部との間に少なくとも1mmのスペースを残します。気泡が発生した場合は、遠心分離管を硬い面で軽くたたいて気泡を取り除きます。
注:ピペットチップは、LEDを配置する際の気泡形成を減らすために、シリコンエラストマーで事前にコーティングできます。 - 遠心分離管のマイクロLEDを50°Cのラボオーブンまたはインキュベーターに直立させて置き、少なくとも8時間または一晩放置します。オーブンを操作するときは、耐熱手袋を着用してください。エラストマーが硬化したら、LEDを遠心分離管から取り外します。エラストマーがまだ粘着性がある場合は、オーブンに戻します。
- 完全に硬化したら、LEDの先端から余分なエラストマーを精密な万能ナイフで取り除き、1mm以下にします。LEDを適切にカプセル化することで、光刺激中の組織の加熱を最小限に抑えることができます。
- 光パワーメーターを使用して、LED の光パワーを決定します。パワーメーターの電源を入れ、波長設定を465nmに調整します。LEDをフォトダイオードパワーセンサーと一列に並べて配置し、ファンクションジェネレーターでLEDを点灯させます。光パワーメーターはワット単位の読み取り値を生成します。電力の読み取り値を照らされた表面の面積(0.88 mm2)で割って放射照度を計算します。
注:ChR211の適切な活性化のためには、理想的な放射照度は約2.4 mW / mm2である必要があります。
2. 実験の準備
- 以前の発表に従ってマウスを繁殖させ、コリン作動性ニューロン(ChAT-ChR2)またはカテコールアミン作動性ニューロン(TH-ChR2)12 (図2)のいずれかでChR2を発現させます。実験に用いたマウスにおけるTH-CreまたはChAT-Creの発現を、前述のジェノタイピングアプローチを用いて確認する12。
- 少なくとも225 mLのKrebs-Henseleit(KH)溶液(mM:118 NaCl、4.7 KCl、1.25 CaCl2、0.57 MgSO4、25 NaHCO3、1.17 KH2PO4、6グルコース)を調製し、0.2 μmの硝酸セルロースメンブレンフィルターを使用してろ過します。95%O2 および5%CO2を使用して酸素化する場合は、pHを7.4に調整します。
- 実験前にランゲンドルフ灌流システムを精製水ですすぎ、実験を開始する前に余分な水分を取り除いてください。
- KHを循環させる前に、10 μmのメンブレンフィルターをシステムに追加します。2〜5mL / minの流量で灌流液の温度を37°Cに維持するように設定されたウォーターバスをオンにします。
- 175 mLのKHを灌流システムに追加し、循環を開始します。.溶液を95%O2 / 5%CO2 で泡立てて、適切な酸素化を提供します。
注:KH循環量は、チューブとリザーバーのサイズに応じてシステムごとに異なります。 - ストップコックで灌流システムの流れを停止し、流量計の ゼロボタンを押して 、流量計を校正します。
- LabChartなどの生理学的データ収集ソフトウェアを準備して、12チャンネル(心臓浴温度、大動脈灌流温度、ECGリードI-IIIに加えて4つの計算リード、心拍数計算、流量、LEDパルスを追跡するための関数発生器出力)を用意します。
- 心拍数用に予約されたチャネルを使用して、LabChartで心拍数を計算し、リードI.LabChartの心臓軸拡張は、リードIとリードIIを使用してリードIII、aVR、aVL、およびaVFを計算します。
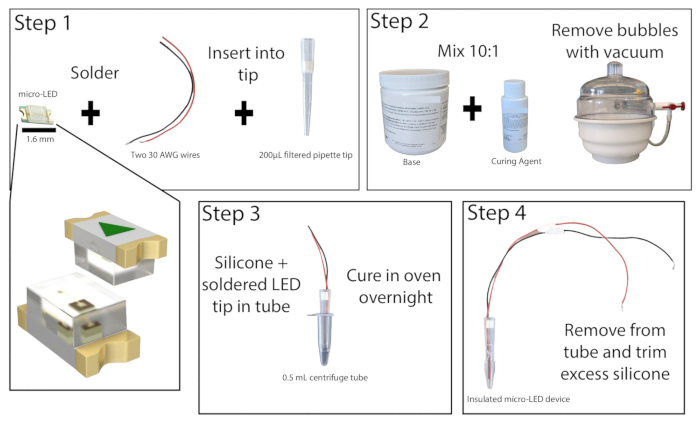
図1:マイクロLEDの構造。 マイクロLED光源の構築手順を簡略化しました。2本のワイヤーをマイクロLEDにはんだ付けし、200μLのピペットチップに挿入してから、瞬間接着剤で接着します(ステップ1)。シリコーンエラストマーを10:1の比率で混合し、真空チャンバーに入れて気泡を除去します(ステップ2)。シリコーンエラストマーを微量遠心チューブに注ぎ、マイクロLEDピペットチップを挿入して一晩硬化させます(ステップ3)。次に、絶縁されたマイクロLEDをチューブから取り外し、余分なシリコンをトリミングする必要があります(ステップ4)。 この図の拡大版を表示するには、ここをクリックしてください。
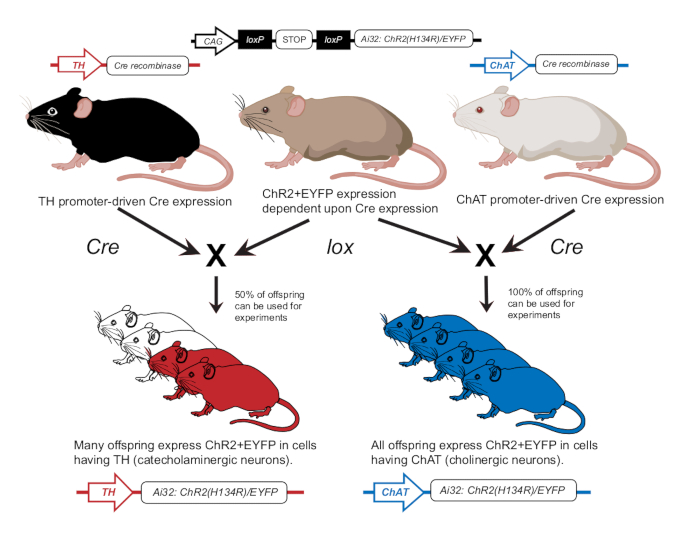
図2:トランスジェニックマウス育種スキーム。 lox依存性 ChR2 遺伝子を持つ親マウスを、Creプロモーターを持つ別のマウスと交配させます。チロシンヒドロキシラーゼ(TH)Creプロモーターを持つ親マウスは、カテコールアミン作動性細胞でChR2を50%発現するヘテロ接合性の子孫を産生します。コリンアセチルトランスフェラーゼ(ChAT)Creプロモーターを持つ親マウスは、コリン作動性細胞でChR2を100%発現するホモ接合性の子孫を産生します。発現はジェノタイピングによって確認されます。この図は12の許可を得て修正しています。 この図の拡大版を表示するには、ここをクリックしてください。
3.心臓の切除と灌流
- 切除前に、1 mLシリンジを使用した腹腔内注射により、250ユニットのヘパリン(約8 U / g)を投与します。.手術前に少なくとも10分待ちます。
- 成体マウスを麻酔誘導チャンバーに入れます。~4%のイソフルランを投与し、呼吸数が遅くなり深くなるまで待ちます。.マウスをチャンバーから取り出し、頚椎脱臼を行う前につま先をつまむことで疼痛反射の停止を確認します。
- 一対の鉗子で剣状突起を保持し、外科用ハサミを使用して腹腔内に切り込みます。横隔膜を慎重に切り開いて胸腔を開きます。肋骨を切って心臓と肺を露出させます。肺をそっとつかみ、心臓と肺を切除します。
- ヘパリン化KHの皿に心臓を置きます。肺と大きな脂肪片を取り除きます。洗浄した心臓をヘパリン処理されたKHの2番目の 皿に、2倍の倍率に設定された解剖顕微鏡下に置きます。大動脈の位置を特定し、細い鉗子を使用してカニューレの上をスライドさせます。4-0シルク縫合糸を使用して心臓をカニューレに固定します。
注:カニューレ挿入は、心臓の代謝活動を減らすために氷上で行うことができます。 - ヘパリン化KHのボーラス注射をカニューレを通して洗い流し、灌流システムに配置する前に冠状動脈から血液を取り除きます。
- カニューレを装着した心臓を灌流システムに接続し、灌流液を充填したPDMSディッシュに入れます。ECG針電極をアイントホーフェンの三角形13に従ってPDMSディッシュに配置します。少なくとも5分間心臓を順応させます。
- 左心房にアクセスできるように心臓を回転させ、マイクロ自己開放ハサミで左心房に~1mmの穴を開けます。このスライスから直径1mmのチューブを左心室に挿入し、そこに閉じ込められた灌流液を放出します。
注:心臓を見るために解剖顕微鏡を用意すると、このステップの容易さが向上する可能性があります。 - RAが上を向くように心臓を回転させ、洞房(SA)ノードに照明がアクセスできるようにします(図3)。
- 必要に応じて、電極を心臓に近づけるか、灌流液に浸してECG電極を調整し、適切な信号対雑音比で信号を受信します。設定は、使用しているECG取得ハードウェアとソフトウェアによって異なる場合があります。この方法では、ゲイン2000と500Hzのカットオフフィルターを備えたアイントホーフェン・ゴールドバーガーモジュールを使用し、ソフトウェア設定にはメインフィルターと1000Hzのサンプリング周波数が含まれていました。
4. オプトジェネティックな活性化
- マイクロLEDデバイスをファンクションジェネレータセットに接続して、10 Hz周波数、30 msパルス幅、10Vp 振幅のパラメータでパルス波を生成します。
- マイクロLEDをSAノードにそっと置きます。マイクロLEDを強く押しすぎると、心拍数や機能が低下する可能性があるため、避けてください。
- ファンクションジェネレーターをオンにして、光刺激による心拍数の変化を測定します。心拍数の即時の変化は、効果的な活性化を示します。カテコールアミン作動性の活性化は心拍数の指数関数的な上昇を引き起こします10、一方、コリン作動性の活性化は即時の低下8を引き起こします。
- 関数ジェネレータをオフにします。心拍数がアクティベーション前のレベルに戻るのを待ちます。
- 光遺伝学的活性化の結果、心拍数の変化が100 bpm未満の場合は、マイクロLEDの位置を変更して、RAのニューロンをよりよく照らします。必要に応じて繰り返します。
5. 実験手順とデータ解析
- 内因性光遺伝学的コリン作動性刺激がノルエピネフリン(NE)による外因性β-アドレナリン作動性活性化を抑制できるという仮説を検証するには、ヒュームフードにNEの10μMおよび100μMのストック溶液を準備します。
- 注入ポートによってNEのボーラス用量を灌流システムに追加します。.心拍数がプラトーに増加したら、マイクロLEDを~10秒間オンにします。ライトをオフにして、心拍数の変化を監視します。
- 心拍数が洞調律に戻ったら、NEの用量を増やし、光遺伝学的刺激を繰り返します。.NEの各用量について続行します。.
- 研究の最後に、ガス供給をオフにし、システムから心臓を取り外し、必要に応じて固定剤で保存します。
- 必要に応じて、灌流システムのリザーバーとチューブをDI水または洗剤ですすいでください。カビを防ぐために、システムを完全に乾かします。
- LabChart ファイルを保存します。心拍信号とECGチャンネルをエクスポートして、オフライン分析とグラフィカル表示を行います。
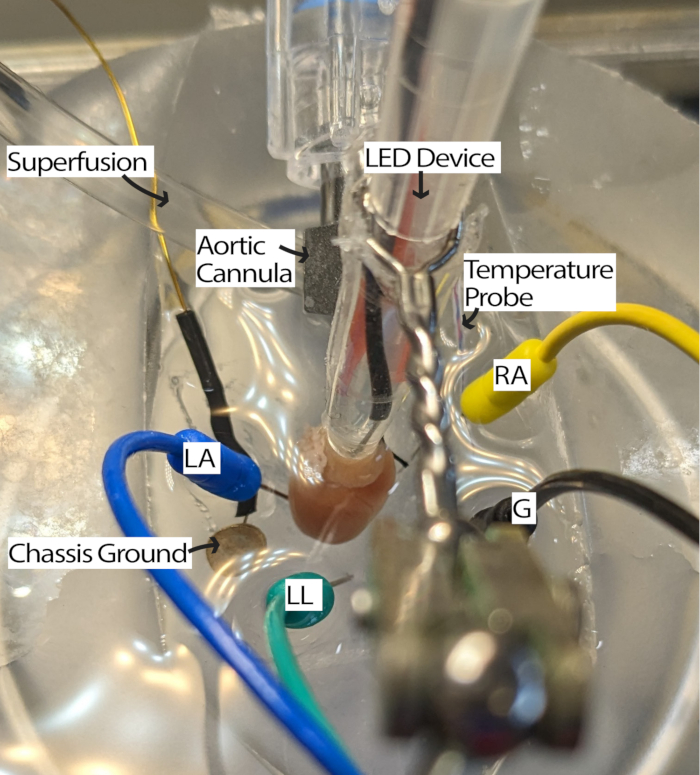
図3:マウスの心臓浴の構成。 LEDデバイスとECG電極の配置を示すマウスの心臓にカニューレを当てたもの。シャーシのグランドは、周囲の電子機器からのノイズを低減するために存在します。ECG針電極は、アイントホーフェンの三角形に基づいて配置されます。略語:LA =左腕;RA =右腕;LL =左脚;G = アース。 この図の拡大版を表示するには、ここをクリックしてください。
結果
ランゲンドルフ定圧灌流システム (図4) は、適切な酸素化、温度、および冠状動脈の流れが維持されれば、マウスの心拍数を少なくとも300 bpm以上1時間以上維持できるはずです。この設定では、大動脈灌流の温度は冠状動脈の流れに依存するため、大動脈温度を37°Cに維持するためには、流量が変化するとウォーターバスの温度を調整する必要がある場合があります。 マウス心臓の冠状動脈の流量は、心臓のサイズにもよりますが、通常1.5〜4.5mL/minの範囲です。流量変動時に灌流液の温度を37°Cに維持することは、一貫した心機能に必要であり、一定の圧力灌流には特に重要です。記載されている灌流システムは、灌流液カラムの高さを通じて70 mmHgの静水圧を維持するように設計されています。これは、上部リザーバーから一貫したオーバーフローを提供するポンプ速度で達成されます。灌流液には、20μMの血管拡張薬クロマカリンを補充して、正常なまたは正常な冠状動脈の流れを改善および維持し、完全な心筋酸素化を確保することができます14。
ChAT-ChR2マウス心臓のコリン作動性ニューロンを10Hzおよび30msのパルス幅で光刺激すると、心拍数がほぼ瞬時に低下するはずです。適切に灌流された心臓のコリン作動性ニューロンの効率的な光刺激は、心拍数の少なくとも100bpmの減少につながるはずです。. 図5 は、マイクロLEDがオンになるとすぐに75bpm低下し、最大135bpmの減少に達するまで低下し続けることを示しています。マイクロLEDをオフにしてから30秒以内に、心拍数は175 bpmに増加し、徐々に刺激前のレベルに戻ります。刺激前、刺激中、および刺激後のRR間隔の違いを示すために、6誘導心電図が示されています(図5B)。リードaVR、aVL、およびaVFは、LabChartソフトウェアでリードIおよびIIを使用して計算されます。
TH-ChR2マウス心臓のカテコールアミン作動性ニューロンの光刺激は、コリン作動性ニューロンの光刺激と比較して、心拍数のより緩やかな(指数関数的な)変化を引き起こします。これは、β1-アドレナリン作動性の活性化が、標的タンパク質をリン酸化するのに対し、ムスカリンの活性化はそうではないが、PKAを活性化するcAMPのセカンドメッセンジャーシステムを必要とすることが原因である可能性が高い。 図6 は、10秒間で135bpmの心拍数の増加を示している。ライトを消した後、正常な洞調律に戻るにはさらに10秒が必要です。マイクロLEDが適切に絶縁されていないと、心臓が加熱され、心拍数が増加する可能性があります。この加熱応答は、TH-ChR2刺激よりも強度が低くなります。したがって、心拍数の変化はそれほど顕著ではありません。
このプロトコルの1つの応用は、光遺伝学的刺激を使用してニューロンを脱分極させ、内因性神経伝達物質の放出をもたらすと同時に、外因性神経伝達物質を灌流液に加えることである。図7Aは、灌流液にNEのボーラス用量を添加したChAT-ChR2マウス心臓からの内因性アセチルコリン放出を示しています。NEが存在しない場合、光刺激により心拍数が100bpm以上低下し、刺激期間中はこの低下が維持されました。一方、NEを大量に投与した場合(2000 nM)、光刺激中の最大心拍数低下は40 bpmでした。心拍数はすぐに上昇し始め、ライトが消灯する前にほぼ刺激前のレベルに達しました。この結果は、ChATニューロン光刺激による心拍数の光遺伝学的抑制が、高用量のNEによる心拍数の増加を完全に抑制することができず、心拍数抑制の時間が短くなり、心拍数の低下が減少することを示しています(図7B)。これらの結果は、迷走神経と星状神経節の同時刺激中に進行性のAVリンパ節ブロックを示した大動物での以前の研究と一致しています12,13。
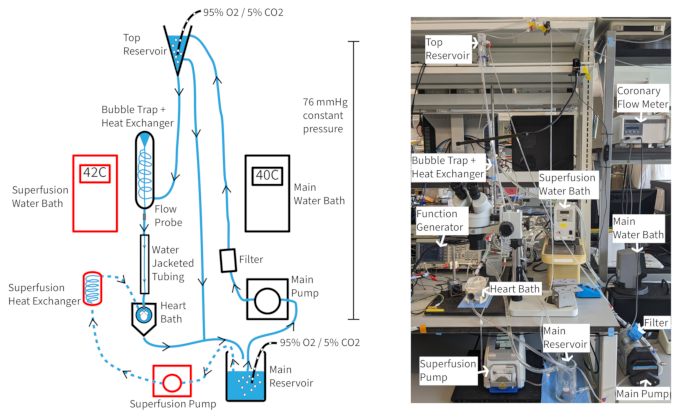
図4:実験のセットアップ。灌流システムの図。 矢印は灌流液の方向を示しています。スーパーフュージョン灌流液は破線で示され、成分は赤で囲まれています。 この図の拡大版を表示するには、ここをクリックしてください。
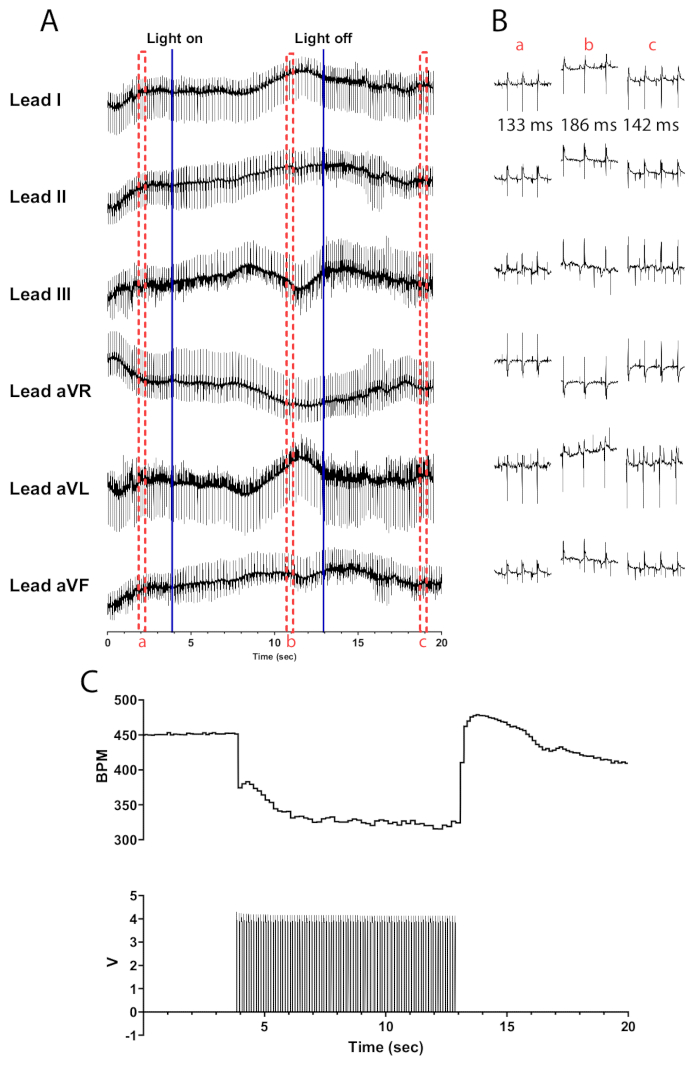
図5: 代表的なコリン作動性光刺激反応。(A) ChAT-ChR2光遺伝学的活性化中の6誘導心電図。青色の実線は、マイクロLEDがオン/オフされていることを示します。赤い破線のボックスは、(B) スニペットの時間を示します。 (b) 光刺激前(a)、(b)、および光刺激(c)後のECG信号の半秒の断片。RR 間隔はセクションごとに表示されます。 (C) 心拍数(上)と関数発生器からのパルス波(下)が表示されます。心拍数は450 bpmから始まり、光刺激の8秒後に315 bpmに低下し、光刺激の7秒後に410 bpmに戻ります。 この図の拡大版を表示するには、ここをクリックしてください。
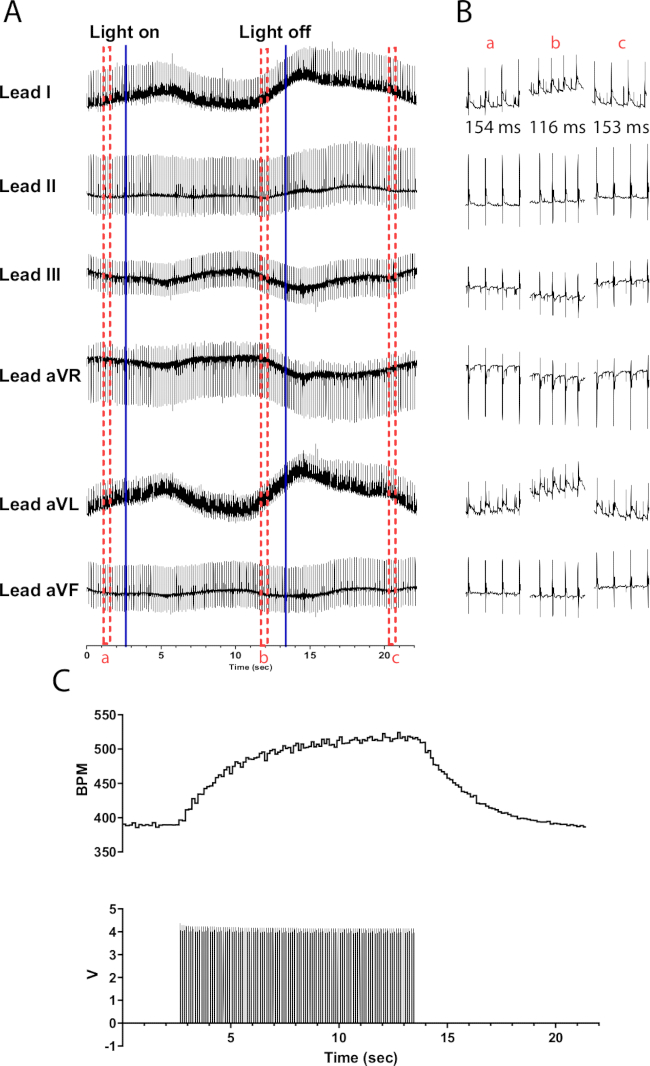
図6:代表的なカテコールアミン作動性光刺激応答。(A) TH-ChR2光遺伝学的活性化中の6誘導心電図。青色の実線は、マイクロLEDがオン/オフされていることを示します。赤い破線のボックスは、(B) スニペットの時間を示します。(b) 光刺激前(a)、(b)、および光刺激(c)後のECG信号の半秒の断片。RR 間隔はセクションごとに表示されます。 (C) 心拍数(上)と関数発生器からのパルス波(下)が表示されます。心拍数は390 bpmから始まり、光刺激の10秒後に525 bpmにピークに達し、光刺激の終了後に390 bpm 8秒に戻ります。 この図の拡大版を表示するには、ここをクリックしてください。
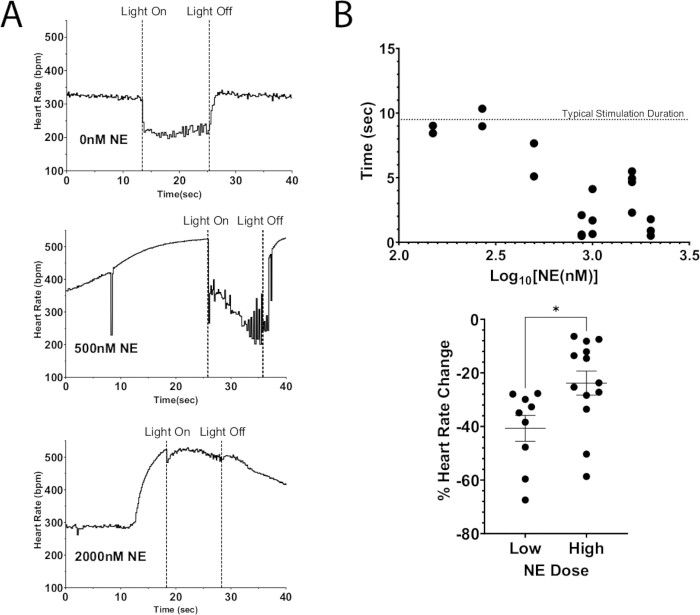
図7:外因性NEによるコリン作動性光刺激 (A) 灌流液にNEを添加した用量の増加によるChAT-ChR2光刺激中の心拍数反応。NEにより心拍数が最大増加に達すると、マイクロLEDを約10秒間点灯させました。高用量のNEでも心拍数の抑制は可能でしたが、用量が増加するにつれて刺激の持続時間は短くなりました。. (B) 心拍数が抑制されたままの時間。10秒に近い時間は、通常、刺激の全期間にわたって抑制されたままでした。 (C) 光刺激中の心拍数の低下は、低用量よりも高用量のNEでそれほど深刻ではありませんでした。.低用量では平均40%の心拍数低下が見られましたが、高用量では25%の減少にとどまりました。統計的有意性を評価するために、対応のないt検定を実行しました。平均 * p < 0.05 の標準誤差として表されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
内因性心臓自律神経ニューロンの光遺伝学的刺激は、迷走神経または星状神経節の電気刺激と同等のレベルの心拍数反応を引き起こした14,15。しかし、切除された灌流された心臓の電気刺激には、特定のニューロン集団を容易に標的にできるという利点がありません。薬理学的活性化には、特定の受容体を標的とする利点がありますが、空間特異性はなく、応答時間は冠状動脈の流量に依存します。光遺伝学的活性化は、ほぼ瞬時の応答、ニューロン集団の標的化、および光刺激のレベルを変える能力の利点を提供する16。このプロトコルでは、内因性心ニューロンを光刺激するためのシンプルで低コストの光源を構築する方法も説明しました。
心臓内神経系の影響についてさらに理解を深めることで、心血管疾患のより良い診断と治療が容易になります。ChR2の選択的発現により、疾患中の特定の神経集団の活動に関連する新しい仮説を検証できます。肺静脈の周りや心室全体の内因性心神経節など、心臓全体の神経集団をこの方法で調べることができます。例えば、心筋梗塞のマウスモデルでは、内因性自律神経ニューロンの光刺激は、梗塞が進行しニューロンが分化転換を受ける際の境界領域組織の電気生理学的変化を調べるのに有用である可能性がある17。このプロトコルでは、コリン作動性およびカテコールアミン作動性経路の同時活性化に対する急性心臓反応の制御実験を含む別の例について説明し、光遺伝学的および薬理学的薬剤の組み合わせにより、独自の用量反応を調べることができます。この同時活性化は、自律神経葛藤として知られる溺死に関連する現象であり、まだ完全には解明されていません18。さらに、適切な光、色素、およびフィルターの組み合わせが与えられると、このプロトコルを心臓光学マッピングと組み合わせて、自律神経ニューロン刺激が心臓電気生理学および神経心不整脈メカニズム19,20,21に及ぼす急性の影響を研究することができます。
このプロトコルを使用して、切除された灌流心臓の内因性心臓神経系を研究する際には、考慮すべきいくつかの重要な概念があります。マウスの心臓は、灌流環境のわずかな変化に敏感です。心拍数を綿密に監視することは、心筋の低酸素化、虚血、および心機能の低下を引き起こす可能性のある冠動脈灌流の問題を特定するのに役立ちます。このプロトコルでは、潜在的な問題を制限するために、メインリザーバーとトップリザーバーの両方で灌流液を酸素化することを推奨しています。酸素化チューブを完全に沈めると、灌流液中の最適な酸素レベルを確保するのに役立ちます。紫外線懐中電灯を心臓に当てると、低酸素症/虚血を示すNADH蛍光が現れ、それに応じて酸素化を調整できます19,20。灌流液の温度は、定圧灌流中の冠状動脈流量に依存します。冠状動脈の流量が低下すると、大動脈カニューレの近位にあるチューブの冷却により大動脈灌流液の温度も低下し、心拍数が低下する可能性があります。灌流水浴の温度を上げると、この問題を逆転させることができます。このプロトコルでは、スーパーフュージョンループを利用して、心臓浴の温度を37°Cに維持します。 心臓浴の温度が下がると、超融合流量を増やす必要がある場合があります。マイクロLEDは、光刺激中にRAの温度が上昇する可能性があるため、心臓の温度変化の潜在的な原因です。デバイスを包むシリコーンエラストマーが薄すぎると、マイクロLEDが暖かくなり、SAノードが加熱され、心拍数が予想外に増加する可能性があります。野生型の心臓でマイクロLED光源をテストすると、加熱レベルの測定に役立ちます。マイクロLEDは、30秒にわたって心拍数が10%以上増加してはなりません。これが発生した場合は、シリコーンエラストマーを交換する必要があります。
ex vivo灌流心臓実験の目標は、制御可能な変数を使用して生理学的に近い条件を再現することであるが、それらには制限が伴う22。クリスタロイド灌流液は、これらの実験の標準です。しかし、高ストレス条件下ではミトコンドリアへの酸素供給を制限することができる23,24。さらに、灌流液には、生体内で自然に発生する循環ホルモンが不足しています。さらに、マイクロLEDの光強度や配置が変化すると、神経刺激に局所的な格差が生じる可能性があるため、実験プロトコルを開始する前に、マイクロLEDを心臓の上に配置するための調整が常に必要となります。
要約すると、このプロトコルは、灌流マウス心臓の心臓ニューロンの特異的光遺伝学的刺激のための ex vivo アプローチを示しています。マイクロLED光源は、右心房のニューロンを刺激するために構築されました。このアプローチの適用は、ChAT-ChR2マウス心臓の光遺伝学的活性化中のアセチルコリンの内因性放出と、外因性NEの増加を同時に組み合わせました。カテコールアミン作動性およびコリン作動性同時活性化中の心拍数の結果として生じる変化が提示された。このプロトコルは、灌流された心臓における突然の内因性自律神経ニューロン活性化の動力学と、心臓コリン作動性およびカテコールアミン作動性活性との間の相互作用を調査するための貴重な実験的アプローチを説明しています。
開示事項
申告する利益相反はありません。
謝辞
この研究は、NIH R01 HL144157からMWK、NIH R01 HL144157からEEおよびMWK、NIH R01のHL147279およびHL146169からMWKおよびDM、およびRRにCollins Distinguished Doctoral Fellowshipによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
参考文献
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved