Method Article
Activación optogenética de neuronas autonómicas cardíacas intrínsecas en corazones de ratón perfundidos extirpados
En este artículo
Resumen
Este protocolo ilustra un método para la estimulación optogenética de neuronas cardíacas intrínsecas en corazones de ratones transgénicos. El enfoque descrito se utiliza para investigar la cinética de la activación súbita de las neuronas cardíacas en corazones perfundidos ex vivo y las interacciones entre la actividad colinérgica y catecolaminérgica.
Resumen
Es necesario un equilibrio entre la activación colinérgica y catecolaminérgica para mantener la salud del corazón. El estudio de la interacción entre estas vías se puede realizar mediante optogenética a través de la expresión selectiva de canalrodopsina-2 (ChR2) en neuronas autonómicas cardíacas. Estas aplicaciones cardíacas de la optogenética permiten el estudio de la liberación intrínseca de neurotransmisores de forma espacio-temporal. Este método ilustra un enfoque ex vivo para la estimulación optogenética específica de las neuronas cardíacas en corazones de ratón perfundidos. Los ratones transgénicos fueron criados para expresar ChR2 en neuronas de colina acetiltransferasa (ChAT) o tirosina hidroxilasa (TH) en todo el cuerpo. Se preparó un micro-LED (465 nm) encerrado en un elastómero de silicona para estimular las neuronas de la aurícula derecha que inervan el nódulo sinoauricular. El micro-LED se conectó a un generador de funciones para pulsar ondas a 10 Hz con un ancho de pulso de 30 ms. Los corazones con expresión confirmada fueron extirpados y perfundidos retrógradamente en una solución de Krebs-Henseleit circulante del sistema Langendorff. El electrocardiograma (ECG), la temperatura y la tasa de flujo coronario se registraron con el software LabChart. Una vez que el corazón se estabilizó, se colocó el micro-LED en la aurícula derecha y se probó para obtener una respuesta óptima de la frecuencia cardíaca. Una aplicación de este enfoque combina la liberación intrínseca de un neurotransmisor colinérgico (acetilcolina) durante la activación optogenética de un corazón de ratón ChAT-ChR2 simultáneamente con un aumento del neurotransmisor catecolaminérgico exógeno (norepinefrina) agregado a la perfusión. Se presentan los cambios resultantes en la frecuencia cardíaca durante la activación colinérgica y catecolaminérgica simultánea. Este método describe un valioso enfoque experimental para investigar la cinética de la activación súbita de las neuronas autonómicas intrínsecas en corazones perfundidos y las interacciones entre la actividad colinérgica y catecolaminérgica cardíaca.
Introducción
La optogenética es un método para introducir proteínas sensibles a la luz (opsinas) en poblaciones celulares específicas. Esto permite la modulación espacio-temporal de células y tejidos específicos que no se pueden lograr utilizando medios eléctricos o químicos1. Las aplicaciones cardíacas de la optogenética se han vuelto cada vez más populares en los últimos 15 años2. La fotoestimulación de opsinas excitadoras como la canalrodopsina-2 (ChR2), un catión, en los miocitos cardíacos o las neuronas da lugar a la despolarización celular, causando cambios en el ritmo cardíaco3. Existen dos formas de expresar selectivamente opsinas en poblaciones celulares utilizando el enfoque Cre-lox: la transducción viral4 y el cruzamiento de animales transgénicos5. La expresión selectiva de ChR2 en neuronas autonómicas específicas se puede lograr mediante cruzamiento para crear descendencia que exprese ChR2 en neuronas colinérgicas o catecolaminérgicas utilizando promotores específicos de la célula6. Un progenitor con un gen ChR2 floxado puede aparearse con un progenitor que expresa Cre recombinasa bajo el control de un promotor como la tirosina hidroxilasa (TH, neuronas catecolaminérgicas) o la colina acetiltransferasa (ChAT, neuronas colinérgicas). Luego, la descendencia expresa ChR2 en las neuronas TH o ChAT de todo el cuerpo7.
La respuesta funcional del corazón a la activación aguda de las neuronas autónomas puede investigarse utilizando la expresión de ChR2 impulsada por el promotor dentro de poblaciones neuronales específicas, por ejemplo, neuronas colinérgicas o catecolaminérgicas. Se puede variar el intervalo de pulso y la intensidad de la fotoestimulación para controlar la tasa de despolarización de las neuronas que expresan ChR2 y estudiar cómo los niveles de activación neuronal modulan la función cardíaca8. Para este método, las neuronas se utilizarán para referirse a cualquier cuerpo celular, axones y/o proyecciones axonales que se activen optogenéticamente para simplificar. También es posible combinar la fotoestimulación con la activación química mediante la introducción de fármacos o neurotransmisores para interrogar los efectos simultáneos sobre el ritmo cardíaco y la contractilidad9. Por ejemplo, la estimulación colinérgica optogenética puede combinarse con la inyección de norepinefrina (NE) exógena para examinar el impacto de la activación autonómica concurrente en el corazón. La realización de este tipo de estudios utilizando corazones perfundidos aislados tiene la ventaja de proporcionar una plataforma experimental bien controlada para estudiar los cambios funcionales causados por la fotoactivación10. Los cambios en la morfología del ECG, la frecuencia cardíaca y la tasa de flujo coronario se pueden monitorear mientras que la temperatura, la oxigenación y la presión de perfusión están estrictamente controladas.
El objetivo de este protocolo es presentar un enfoque experimental para activar una población específica de neuronas autónomas en corazones de ratón para estudiar los cambios en la frecuencia cardíaca. También se presenta la construcción y el uso de un dispositivo micro-LED para la activación optogenética en corazones perfundidos. Los corazones de ratones que expresaban ChR2 en neuronas colinérgicas o catecolaminérgicas se extirparon y se perfundieron retrógradamente con una solución oxigenada de Krebs-Henseleit a presión constante. La ChR2 expresada en las neuronas de la aurícula derecha (AR) se fotoestimularon a una frecuencia de pulso de 10 Hz con un ancho de pulso de 30 ms. La frecuencia cardíaca instantánea se calculó utilizando el intervalo RR y se monitorizó los cambios durante la fotoestimulación. También se describe un ejemplo de experimento para estudiar la cinética de la frecuencia cardíaca durante la fotoestimulación optogenética intrínseca de las neuronas ChAT simultáneamente con la activación beta-adrenérgica utilizando norepinefrina exógena.
Protocolo
Todos los protocolos para animales fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad George Washington y siguieron la Guía para el Cuidado y Uso de Animales de Laboratorio del Instituto Nacional de Salud.
1. Construcción de fuente de luz Micro-LED
- Bajo un microscopio de disección en un área bien ventilada, suelde los extremos pelados de dos cables de cobre aislados, de al menos 20 cm de longitud, a los puntos de contacto de un micro-LED de 465 nm (Figura 1). Pruebe la soldadura conectando el LED a una fuente de alimentación y encendiéndolo.
- Corta 1 cm la parte inferior de una punta de pipeta filtrada de 200 μL. Empuje el filtro hacia afuera con una varilla de diámetro pequeño. Inserte el micro-LED con cables en la punta de la pipeta para que el LED quede al ras con el extremo de la punta. Vuelva a colocar el filtro en la parte superior de la punta de la pipeta para mantener el LED y los cables en su lugar y, a continuación, pegue los bordes del LED a la punta de la pipeta. Deja que el superpegamento se seque.
- Prepare el elastómero de silicona combinando la base y el agente de curado en una proporción de 10:1 y mezcle bien. Elimine las burbujas de la mezcla utilizando una cámara de vacío o centrifugando.
- Tome un tubo de centrífuga de 0,5 ml y marque los lados para facilitar la extracción del LED (también se puede agregar lubricante al interior del tubo aquí si lo desea). Pega con cinta adhesiva la parte exterior del tubo para asegurarte de que no haya fugas. Vierta aproximadamente 0,2 ml de la mezcla de elastómero de silicona en el tubo y, a continuación, coloque la punta de la pipeta micro-LED en el tubo, dejando al menos 1 mm de espacio entre el LED y la parte inferior del tubo. Si se han formado burbujas, golpee el tubo de la centrífuga sobre una superficie dura para desalojarlas.
NOTA: La punta de la pipeta se puede recubrir preferentemente con elastómero de silicona para reducir la formación de burbujas al colocar el LED. - Coloque el tubo de centrífuga micro-LED en posición vertical en un horno de laboratorio o incubadora a 50 °C y déjelo actuar durante al menos 8 h o toda la noche. Use guantes resistentes al calor cuando interactúe con el horno. Una vez que el elastómero esté endurecido, retire el LED del tubo de centrífuga. Si el elastómero aún está pegajoso, vuelva a colocarlo en el horno.
- Una vez que esté completamente curado, elimine el exceso de elastómero de la punta del LED con una navaja multiusos de precisión, no dejando más de 1 mm. La encapsulación adecuada del LED minimizará el calentamiento del tejido durante la fotoestimulación.
- Determine la potencia óptica del LED utilizando un medidor de potencia óptica. Encienda el medidor de potencia y ajuste la configuración de longitud de onda para leer 465 nm. Coloque el LED en línea con un sensor de potencia de fotodiodo y encienda el LED con el generador de funciones. El medidor de potencia óptica producirá una lectura en vatios. Calcule la irradiancia dividiendo la lectura de potencia por el área de la superficie iluminada (0,88 mm2).
NOTA: La irradiancia ideal debe ser de aproximadamente 2,4 mW/mm2 para una activación adecuada de ChR211.
2. Preparación experimental
- Criar ratones de acuerdo con publicaciones previas para expresar ChR2 en neuronas colinérgicas (ChAT-ChR2) o neuronas catecolaminérgicas (TH-ChR2)12 (Figura 2). Confirmar la expresión de TH-Cre o ChAT-Cre en ratones utilizados para experimentos utilizando un enfoque de genotipado como se describió anteriormente12.
- Preparar al menos 225 mL de solución de Krebs-Henseleit (KH) (en mM: 118 NaCl, 4,7 KCl, 1,25 CaCl2, 0,57 MgSO4, 25 NaHCO3, 1,17 KH2PO4, 6 glucosa) y filtrar con un filtro de membrana de nitrato de celulosa de 0,2 μm. Ajuste el pH a 7.4 cuando se oxigena usando 95% deO2 y 5% de CO2.
- Enjuague el sistema de perfusión de Langendorff con agua purificada antes del experimento y elimine el exceso de agua antes de comenzar el experimento.
- Añada un filtro de membrana de 10 μm al sistema antes de que circule cualquier KH. Encienda los baños de agua configurados para mantener la temperatura de perfusión a 37 °C a caudales entre 2-5 mL/min.
- Añadir 175 mL de KH al sistema de perfusión e iniciar la circulación. Burbujear la solución con 95% de O2 / 5% de CO2 para proporcionar una oxigenación adecuada.
NOTA: El volumen circulante de KH variará de un sistema a otro dependiendo de los tamaños de las tuberías y los depósitos. - Calibre el medidor de flujo deteniendo el flujo a través del sistema de perfusión con una llave de paso y presionando el botón cero en el medidor de flujo.
- Prepare un software de adquisición de datos fisiológicos como LabChart para que tenga 12 canales: temperatura del baño cardíaco, temperatura de perfusión aórtica, derivaciones de ECG I-III más cuatro derivaciones computarizadas adicionales, cálculo de frecuencia cardíaca, frecuencia de flujo y salida del generador de funciones para rastrear los pulsos LED.
- Usando el canal reservado para la frecuencia cardíaca, calcule la frecuencia cardíaca en LabChart con la función de mediciones cíclicas configurada para detectar el ECG del ratón en la Derivación I. La extensión del Eje Cardíaco de LabChart utiliza la Derivación I y la Derivación II para calcular la Derivación III, aVR, aVL y aVF.
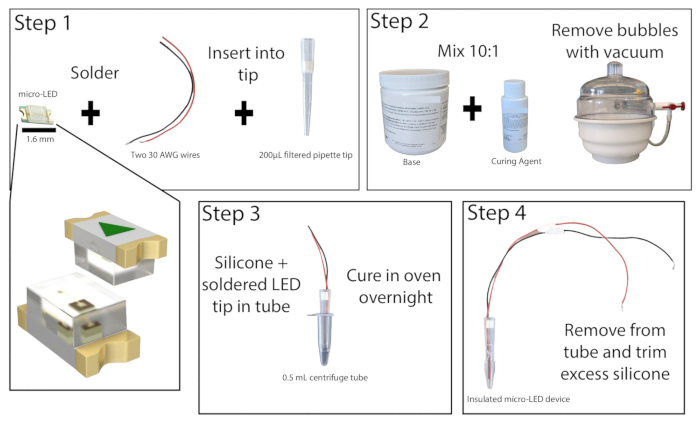
Figura 1: Construcción de Micro-LED. Descripción general simplificada de los pasos para construir una fuente de luz micro-LED. Se sueldan dos cables al micro-LED y se insertan en una punta de pipeta de 200 μL, luego se superpegan (Paso 1). El elastómero de silicona se mezcla en una proporción de 10:1 y se coloca en una cámara de vacío para eliminar las burbujas (Paso 2). El elastómero de silicona se vierte en un tubo de microcentrífuga y se inserta la punta de la pipeta micro-LED y se deja curar durante la noche (Paso 3). A continuación, se retira el micro-LED aislado del tubo y se debe recortar el exceso de silicona (Paso 4). Haga clic aquí para ver una versión más grande de esta figura.
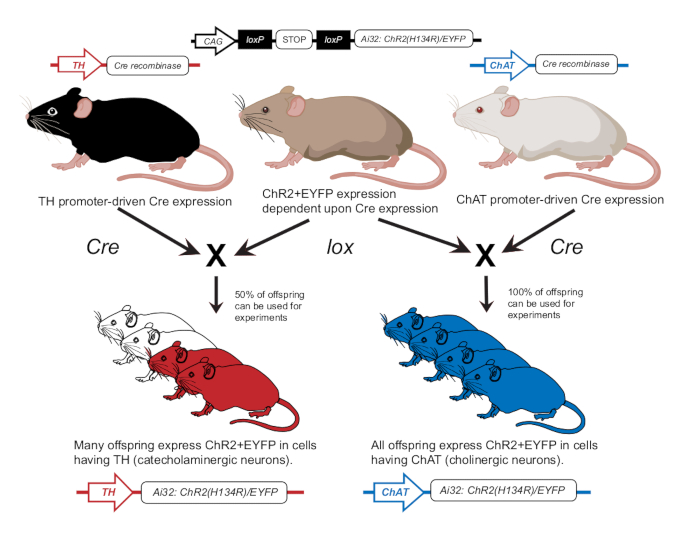
Figura 2: Esquema de cría de ratones transgénicos. Un ratón padre con el gen ChR2 dependiente de lox se cruza con otro ratón con un promotor Cre. Un ratón padre con promotor de la tirosina hidroxilasa (TH) Cre producirá descendencia heterocigota donde el 50% expresará ChR2 en células catecolaminérgicas. Un ratón padre con promotor de colina acetiltransferasa (ChAT) Cre producirá descendencia homocigota donde el 100% expresará ChR2 en células colinérgicas. La expresión se confirma mediante genotipado. Esta cifra ha sido modificada con permiso de12. Haga clic aquí para ver una versión más grande de esta figura.
3. Escisión y perfusión cardíaca
- Antes de la extirpación, administrar 250 unidades de heparina (aproximadamente 8 U/g) por inyección intraperitoneal con una jeringa de 1 mL. Espere al menos 10 minutos antes de la cirugía.
- Colocar un ratón adulto en una cámara de inducción de anestesia. Administre ~4% de isoflurano y espere hasta que la tasa de respiración disminuya y se profundice. Retire el ratón de la cámara y verifique el cese de un reflejo de dolor por pellizco del dedo del pie antes de realizar la luxación cervical.
- Sostenga la apófisis xifoides con un par de pinzas y corte en la cavidad abdominal con unas tijeras quirúrgicas. Abra la cavidad torácica cortando con cuidado el diafragma. Corta las costillas para exponer el corazón y los pulmones. Agarre suavemente los pulmones y extirpe el corazón y los pulmones.
- Coloque el corazón en un plato de KH heparinizado. Retire los pulmones y los trozos grandes de grasa. Coloque el corazón limpio en una2ª placa de KH heparinizado bajo un microscopio de disección ajustado a un aumento de 2x. Localice la aorta y deslícela sobre la cánula con pinzas finas. Asegure el corazón a una cánula con una sutura de seda 4-0.
NOTA: La canulación se puede realizar sobre hielo para reducir la actividad metabólica del corazón. - Enjuague una inyección en bolo de KH heparinizada a través de la cánula para eliminar la sangre de las coronarias antes de colocarla en el sistema de perfusión.
- Conecte el corazón canulado al sistema de perfusión y colóquelo en la placa de PDMS llena de perfusión. Coloque los electrodos de aguja de ECG en la placa PDMS de acuerdo con el triángulo13 de Einthoven. Aclimata el corazón durante al menos 5 min.
- Gire el corazón para que la aurícula izquierda sea accesible y corte un agujero de ~ 1 mm en la aurícula izquierda con un par de tijeras de micro apertura automática. Inserte un tubo de 1 mm de diámetro a través de esta incisión en el ventrículo izquierdo para liberar la perfusión atrapada allí.
NOTA: Tener un microscopio de disección para observar el corazón puede mejorar la facilidad de este paso. - Gire el corazón de modo que la AR quede hacia arriba y el nódulo sinoauricular (SA) sea accesible para la iluminación (Figura 3).
- Ajuste los electrodos de ECG según sea necesario acercando los electrodos al corazón o sumergiéndolos en perfusión para recibir las señales con una relación señal-ruido adecuada. Los ajustes pueden variar en función del hardware y el software de adquisición de ECG que se utilice. Este método utilizaba un módulo Einthoven Goldberger con una ganancia de 2000 y un filtro de corte de 500 Hz, y los ajustes del software incluían un filtro de red y una frecuencia de muestreo de 1000 Hz.
4. Activación optogenética
- Conecte el dispositivo micro-LED a un grupo electrógeno de funciones para producir ondas de pulso con los siguientes parámetros: frecuencia de 10 Hz, ancho de pulso de 30 ms, amplitud de 10 Vpp .
- Coloque el micro-LED suavemente en el nodo SA. Evite presionar demasiado fuerte con el micro-LED, ya que puede provocar disminuciones en la frecuencia cardíaca y la función.
- Encienda el generador de funciones y mida los cambios en la frecuencia cardíaca de la fotoestimulación. Los cambios inmediatos en la frecuencia cardíaca indican una activación efectiva. La activación catecolaminérgica provoca un aumento exponencial de la frecuencia cardíaca10, mientras que la activación colinérgica provoca una caída inmediata8.
- Apague el generador de funciones. Permita que la frecuencia cardíaca vuelva a los niveles previos a la activación.
- Si la activación optogenética da como resultado un cambio en la frecuencia cardíaca de menos de 100 lpm, cambie la posición del micro-LED para iluminar mejor las neuronas de la AR. Repita según sea necesario.
5. Procedimiento experimental y análisis de datos
- Para probar la hipótesis de que la estimulación colinérgica optogenética intrínseca puede suprimir la activación exógena beta-adrenérgica por norepinefrina (NE), prepare soluciones madre de 10 μM y 100 μM de NE en un alimento ahumado.
- Añadir una dosis en bolo de NE al sistema de perfusión mediante un puerto de inyección. Una vez que el aumento de la frecuencia cardíaca se estabilice, encienda el micro-LED durante ~ 10 s. Apague la luz y controle los cambios en la frecuencia cardíaca.
- Después de que la frecuencia cardíaca vuelva al ritmo sinusal, aumente la dosis de NE y repita la estimulación optogenética. Continúe con cada dosis de NE.
- Al final del estudio, cierre los suministros de gas, retire el corazón del sistema y consérvelo en un fijador, según sea necesario.
- Enjuague los depósitos y tubos del sistema de perfusión con agua desionizada o detergente, según sea necesario. Seque bien el sistema para evitar el moho.
- Guarde el archivo LabChart. Exporte la señal de frecuencia cardíaca y los canales de ECG para el análisis fuera de línea y la presentación gráfica.
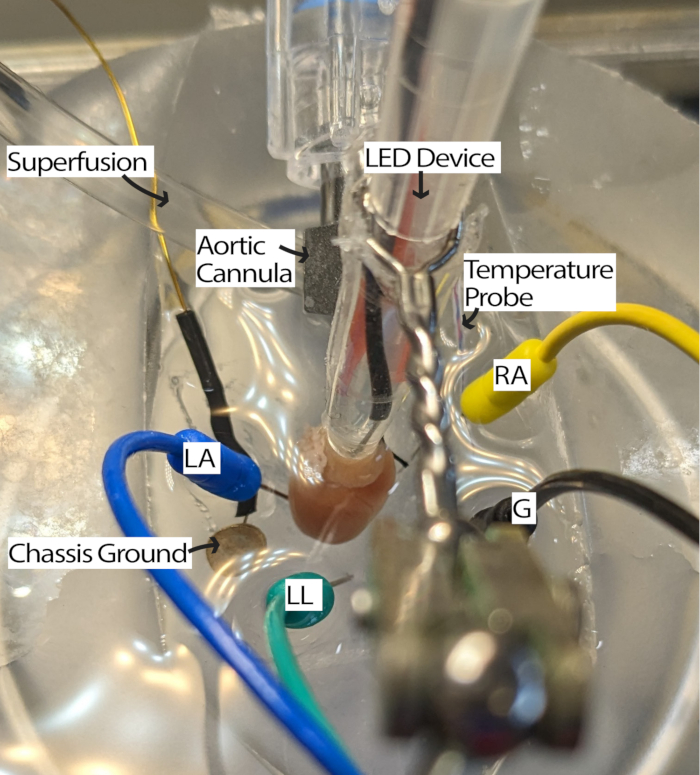
Figura 3: Configuración del baño de corazón del ratón. Un corazón de ratón canulado que muestra la ubicación del dispositivo LED y los electrodos de ECG. Hay una conexión a tierra del chasis para reducir el ruido de los componentes electrónicos circundantes. Los electrodos de aguja de ECG se colocan según el triángulo de Einthoven. Abreviaturas: LA = brazo izquierdo; RA = brazo derecho; LL = pierna izquierda; G = tierra. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Un sistema de perfusión de presión constante de Langendorff (Figura 4) debería ser capaz de mantener una frecuencia cardíaca de ratón de al menos 300 lpm durante más de una hora si se mantienen la oxigenación, la temperatura y el flujo coronario adecuados. Con esta configuración, la temperatura de la perfusión aórtica depende del flujo coronario, por lo que puede ser necesario ajustar las temperaturas del baño de agua a medida que cambia la tasa de flujo para mantener la temperatura aórtica a 37 °C. Las tasas de flujo coronario del corazón de ratón suelen oscilar entre 1,5 y 4,5 ml/min, dependiendo del tamaño del corazón. Mantener la temperatura del perfusor a 37 °C durante las fluctuaciones del caudal es necesario para una función cardíaca constante y es especialmente importante para la perfusión a presión constante. El sistema de perfusión descrito está diseñado para mantener una presión hidrostática de 70 mmHg a través de la altura de la columna de perfusión. Esto se logra con una tasa de bombeo que proporciona un desbordamiento constante desde el depósito superior. La perfusión puede ser suplementada con 20 μM del vasodilatador cromakalin para mejorar y mantener el flujo coronario normal o supranormal para asegurar una oxigenación miocárdica completa14.
La fotoestimulación de las neuronas colinérgicas en corazones de ratón ChAT-ChR2 a 10 Hz y 30 ms de ancho de pulso debería dar lugar a una caída casi instantánea de la frecuencia cardíaca. La fotoestimulación eficiente de las neuronas colinérgicas en corazones adecuadamente perfundidos debería conducir a una reducción de la frecuencia cardíaca de al menos 100 lpm. La Figura 5 muestra una caída inmediata de 75 bpm cuando se enciende el micro-LED que continúa cayendo hasta que alcanza una disminución máxima de 135 bpm. Medio segundo después de apagar el micro-LED, la frecuencia cardíaca aumenta a 175 lpm antes de volver gradualmente a los niveles previos a la estimulación. Se presenta un ECG de seis derivaciones para ilustrar las diferencias en el intervalo RR antes, durante y después de la estimulación (Figura 5B). Las derivaciones aVR, aVL y aVF se calculan en el software LabChart utilizando las derivaciones I y II.
La fotoestimulación de las neuronas catecolaminérgicas en corazones de ratón TH-ChR2 provoca un cambio más gradual (exponencial) en la frecuencia cardíaca en comparación con la fotoestimulación de las neuronas colinérgicas. Esto es probablemente causado por la activación beta1-adrenérgica que requiere el segundo sistema mensajero de AMPc que activa la PKA, que fosforila las proteínas objetivo, mientras que la activación muscarínica no lo hace. La figura 6 muestra un aumento de la frecuencia cardíaca de 135 lpm en el transcurso de 10 s. Se necesitan 10 segundos adicionales después de apagar la luz para volver al ritmo sinusal normal. Si el micro-LED no está debidamente aislado, puede calentar el corazón, causando un aumento de la frecuencia cardíaca. Esta respuesta de calentamiento es menos intensa que la estimulación TH-ChR2; Por lo tanto, el cambio en la frecuencia cardíaca es menos pronunciado.
Una aplicación de este protocolo es el uso de la estimulación optogenética para despolarizar las neuronas, lo que lleva a la liberación de neurotransmisores endógenos y, al mismo tiempo, agrega neurotransmisores exógenos a la perfusión. La figura 7A ilustra la liberación endógena de acetilcolina de un corazón de ratón ChAT-ChR2 con una dosis en bolo de NE añadida al perfusato. Sin NE presente, la fotoestimulación hizo que la frecuencia cardíaca cayera más de 100 lpm y mantuvo esta caída durante la duración de la estimulación. Mientras que con una dosis grande de NE (2000 nM), la caída máxima de la frecuencia cardíaca durante la fotoestimulación fue de 40 lpm. El ritmo cardíaco comenzó a aumentar de inmediato, casi alcanzando los niveles previos a la estimulación antes de que se apagara la luz. Este resultado indica que la supresión optogenética de la frecuencia cardíaca mediante la fotoestimulación de las neuronas ChAT no pudo suprimir completamente los aumentos en la frecuencia cardíaca resultantes de una dosis alta de NE, lo que provocó un menor tiempo de supresión de la frecuencia cardíaca y menores disminuciones de la frecuencia cardíaca (Figura 7B). Estos resultados son consistentes con trabajos previos en animales grandes que demostraron un bloqueo progresivo del nódulo AV durante la estimulación simultánea del nervio vago y los ganglios estrellados12,13.
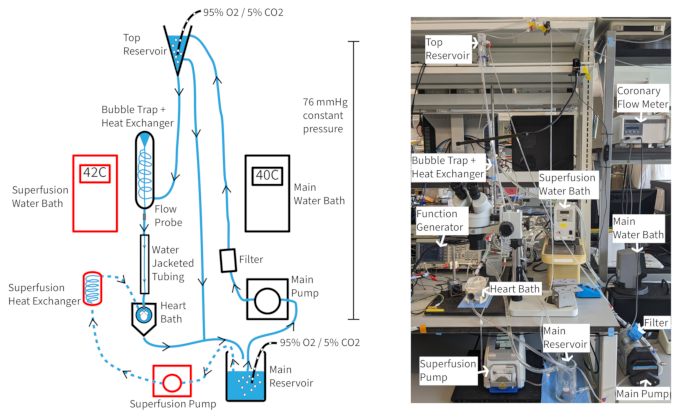
Figura 4: Configuración experimental. Diagrama del sistema de perfusión. Las flechas muestran la dirección de perfusión. La perfusión de superfusión se indica mediante líneas discontinuas y los componentes están delineados en rojo. Haga clic aquí para ver una versión más grande de esta figura.
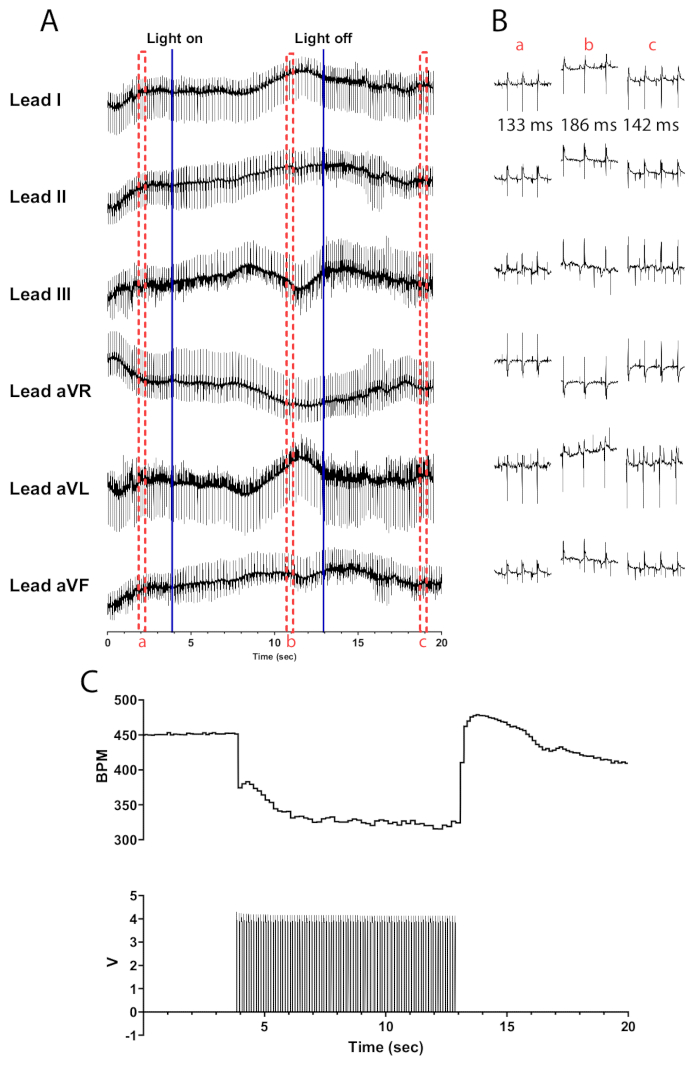
Figura 5: Respuesta representativa de la fotoestimulación colinérgica. (A) Un ECG de 6 derivaciones durante la activación optogenética de ChAT-ChR2. Las líneas azules continuas indican que el micro-LED se está encendiendo / apagando. Los cuadros discontinuos rojos indican la hora de los fragmentos (B). (B) Fragmentos de medio segundo de la señal de ECG antes (a), durante (b) y después de la fotoestimulación (c). Se muestra el intervalo RR para cada sección. (C) La frecuencia cardíaca (arriba) se muestra junto con las ondas de pulso de un generador de funciones (abajo). La frecuencia cardíaca comienza a 450 lpm y desciende a 315 lpm después de 8 s de fotoestimulación antes de volver a 410 lpm 7 s después de que finalice la fotoestimulación. Haga clic aquí para ver una versión más grande de esta figura.
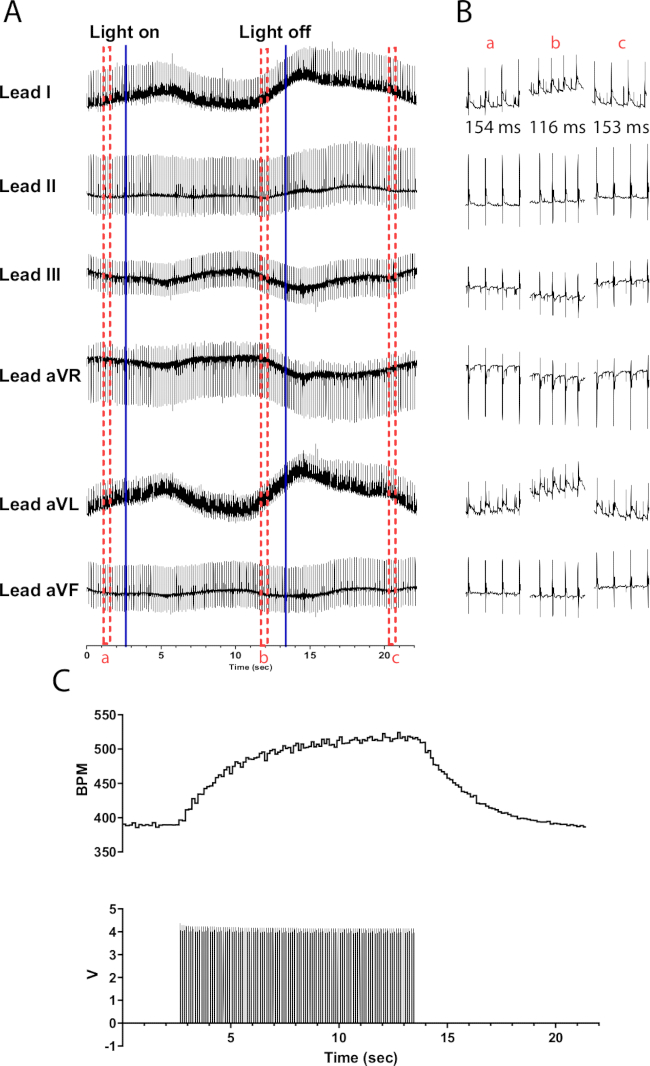
Figura 6: Respuesta representativa de la fotoestimulación catecolaminérgica. (A) Un ECG de 6 derivaciones durante la activación optogenética de TH-ChR2. Las líneas azules continuas indican que el micro-LED se está encendiendo / apagando. Los cuadros discontinuos rojos indican la hora de los fragmentos (B). (B) Fragmentos de medio segundo de la señal de ECG antes (a), durante (b) y después de la fotoestimulación (c). Se muestra el intervalo RR para cada sección. (C) La frecuencia cardíaca (arriba) se muestra junto con las ondas de pulso de un generador de funciones (abajo). La frecuencia cardíaca comienza a 390 lpm y alcanza un máximo de 525 lpm después de 10 s de fotoestimulación antes de volver a 390 lpm 8 s después de que finalice la fotoestimulación. Haga clic aquí para ver una versión más grande de esta figura.
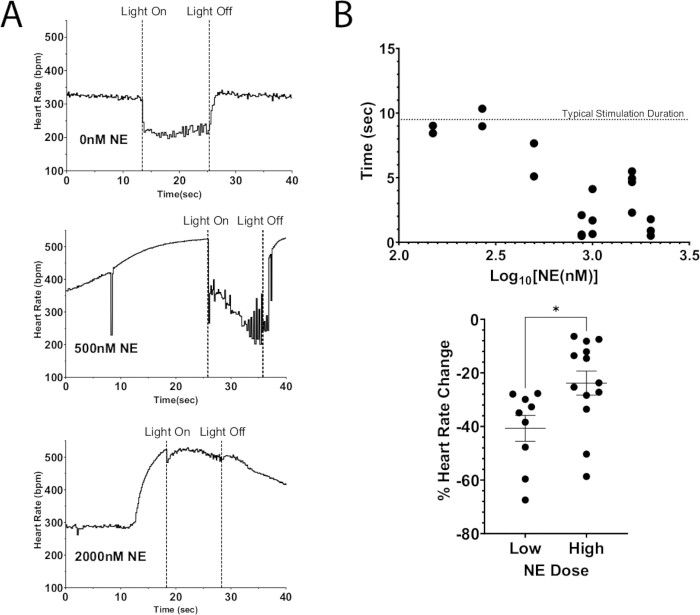
Figura 7: Fotoestimulación colinérgica con NE exógena. (A) Respuesta de la frecuencia cardíaca durante la fotoestimulación ChAT-ChR2 con dosis crecientes de NE añadidas a la perfusión. Una vez que la frecuencia cardíaca alcanzó un aumento máximo debido a NE, el micro-LED se encendió durante aproximadamente 10 s. La supresión de la frecuencia cardíaca todavía era posible con dosis altas de NE, pero la duración de la estimulación disminuyó a medida que aumentaba la dosis. (B) La cantidad de tiempo que la frecuencia cardíaca permaneció suprimida. Los tiempos más cercanos a los 10 s generalmente permanecieron suprimidos durante toda la duración de la estimulación. (C) La caída de la frecuencia cardíaca durante la fotoestimulación fue menos severa con dosis más altas de NE que con dosis bajas. Las dosis bajas resultaron en una disminución promedio de la frecuencia cardíaca del 40%, mientras que las dosis más altas solo disminuyeron un 25%. Se realizó una prueba t no apareada para evaluar la significación estadística. Se presenta como error estándar de la media* p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La estimulación optogenética de las neuronas autonómicas cardíacas intrínsecas produjo niveles comparables de respuesta a la frecuencia cardíaca que la estimulación eléctrica del nervio vago o de los ganglios estrellados14,15. Sin embargo, la estimulación eléctrica de corazones perfundidos extirpados carece de la ventaja de poder dirigirse fácilmente a poblaciones de neuronas específicas. La activación farmacológica ofrece el beneficio de dirigirse a receptores específicos, pero no tiene especificidad espacial, y el tiempo de respuesta depende de la tasa de flujo coronario. La activación optogenética proporciona el beneficio de una respuesta casi instantánea, la focalización de poblaciones neuronales y la capacidad de cambiar el nivel de fotoestimulación16. En este protocolo, también hemos explicado cómo construir una fuente de luz sencilla y de bajo coste para la fotoestimulación de las neuronas cardíacas intrínsecas.
Desarrollar una mayor comprensión del impacto del sistema nervioso intracardíaco facilitará un mejor diagnóstico y tratamiento de las enfermedades cardiovasculares. La expresión selectiva de ChR2 permite probar nuevas hipótesis relacionadas con la actividad de poblaciones nerviosas específicas durante la enfermedad. Las poblaciones nerviosas en todo el corazón podrían interrogarse de esta manera, como los ganglios cardíacos intrínsecos alrededor de las venas pulmonares o a través de los ventrículos. Por ejemplo, en modelos murinos de infarto de miocardio, la fotoestimulación de las neuronas autonómicas intrínsecas podría ser útil para interrogar los cambios electrofisiológicos en el tejido de la zona fronteriza a medida que el infarto evoluciona y las neuronas experimentan transdiferenciación17. En este protocolo, describimos otro ejemplo que involucra experimentos controlados de respuestas cardíacas agudas a la activación simultánea de vías colinérgicas y catecolaminérgicas donde la combinación de agentes optogenéticos y farmacológicos permite examinar respuestas a dosis únicas. Esta activación concurrente es un fenómeno asociado al ahogamiento, conocido como conflicto autonómico, que aún no ha sido completamente dilucidado18. Además, si se utilizan las combinaciones adecuadas de luz, tinte y filtro, este protocolo puede combinarse con el mapeo óptico cardíaco para estudiar los efectos agudos de la estimulación de las neuronas autónomas sobre la electrofisiología cardíaca y los mecanismos de arritmia neurocardíaca 19,20,21.
Hay varios conceptos importantes que se deben tener en cuenta al utilizar este protocolo para estudiar el sistema nervioso cardíaco intrínseco en corazones perfundidos extirpados. Los corazones de ratón son sensibles a ligeros cambios en el entorno de perfusión. La monitorización estrecha de la frecuencia cardíaca es útil para identificar problemas de perfusión coronaria que pueden causar baja oxigenación del miocardio, isquemia y mala función cardíaca. El protocolo recomienda oxigenar la perfusión tanto en el depósito principal como en el superior para limitar los posibles problemas. La inmersión completa del tubo de oxigenación ayuda a garantizar niveles óptimos de oxígeno en la perfusión. Se puede iluminar el corazón con una linterna ultravioleta para revelar la fluorescencia de NADH que indica hipoxia/isquemia, y la oxigenación se puede ajustar en consecuencia19,20. La temperatura de perfusión depende del caudal coronario durante la perfusión a presión constante. Si la tasa de flujo coronario disminuye, la temperatura de la perfusión aórtica también puede disminuir debido al enfriamiento en el tubo proximal a la cánula aórtica, lo que resulta en una frecuencia cardíaca más baja. Aumentar la temperatura del baño de agua perfusiva puede ayudar a revertir este problema. Este protocolo también utiliza un circuito de superfusión para mantener una temperatura de baño cardíaco de 37 °C. Las caídas en la temperatura del baño cardíaco pueden requerir que se aumente la tasa de flujo de superfusión. El micro-LED es otra fuente de posibles cambios en la temperatura del corazón, ya que la temperatura de la AR podría aumentar durante la fotoestimulación. Si el elastómero de silicona que recubre el dispositivo es demasiado delgado, el micro-LED puede calentarse y calentar el nodo SA, lo que resulta en un aumento inesperado de la frecuencia cardíaca. Probar la fuente de luz micro-LED en un corazón de tipo salvaje puede ser útil para medir los niveles de calentamiento. El micro-LED no debe causar un aumento de la frecuencia cardíaca de más del 10% durante 30 s. Si esto ocurre, se debe reemplazar el elastómero de silicona.
El objetivo de los experimentos ex vivo con corazón perfundido es recrear condiciones fisiológicas cercanas con variables controlables, pero tienen limitaciones22. La perfusión cristaloide es el estándar para estos experimentos; sin embargo, puede limitar el suministro de oxígeno a las mitocondrias en condiciones de alto estrés23,24. Además, la perfusión carece de hormonas circulantes que se producirían de forma natural in vivo. Una limitación adicional es que la intensidad variable de la luz y la ubicación del micro-LED pueden dar lugar a disparidades locales en la estimulación neuronal, por lo que siempre se requieren algunos ajustes en la posición del micro-LED sobre el corazón antes de comenzar un protocolo experimental.
En resumen, este protocolo ilustra un enfoque ex vivo para la estimulación optogenética específica de las neuronas cardíacas en corazones de ratón perfundidos. Se construyó una fuente de luz micro-LED para estimular las neuronas de la aurícula derecha. Una aplicación de este enfoque combinó la liberación intrínseca de acetilcolina durante la activación optogenética de un corazón de ratón ChAT-ChR2 simultáneamente con un aumento de la NE exógena. Se presentaron los cambios resultantes en la frecuencia cardíaca durante la activación catecolaminérgica y colinérgica simultánea. Este protocolo describe un valioso enfoque experimental para investigar la cinética de la activación súbita de las neuronas autónomas intrínsecas en corazones perfundidos y las interacciones entre la actividad colinérgica cardíaca y catecolaminérgica.
Divulgaciones
No hay conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por NIH R01 HL144157 a MWK, NIH R01 HL144157 a EE y MWK, y NIH R01 HL147279 y HL146169 a MWK y DM, y una beca Collins Distinguished Doctoral Fellowship para RR.
Materiales
| Name | Company | Catalog Number | Comments |
| #3c Forceps (x2) | Dumont | 11231-20 | |
| 0.2 μm Cellulose Nitrate Membrane Filter | Whatman | 7182-004 | For filtering KH |
| 0.5 ml, Microcentrifuge Tube | Ultra Cruz | sc-200269 | |
| 10 μm Nuclepore Membrane Filter | Whatman | 111115 | For system filter |
| Analog Incubator | Qunicy Labs | 12-140 | |
| Aortic Cannula | Harvard Apparatus | 73-2798 | |
| Arbitrary Function Generator | Tektronix | AFG3021B | |
| Braided Silk Suture 4-0 | Surgical Specialties Look | SP116 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved Hemostat | Ted Pella | 53065 | |
| Einthoven Goldberger Module | Hugo Sachs Elektronik | 73-1778 | |
| Flexible Silicone Wire 30AWG | BNTECHGO | 619317716902 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Heavy Curved Iris Forceps | Aesculap | OC022R | |
| Heparin Sodium Injection | Sagent | 400-30 | |
| Iris Scissors | Ted Pella | 13215 | |
| Isoflurane Solution | Covetrus | 029405 | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P9791 | |
| LabChart 8 | ADInstruments | Data acquisition software | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Microdissecting Scissors | WPI | 504520 | |
| Micro-LED | Dialight | 598-8091-107F | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Optical Power Meter | Thorlabs | PM100D | |
| PowerLab 8/35 | ADInstruments | PL3508 | |
| Self-opening Precision Scissors | Excelta | 366 | |
| Single Animal Anesthesia Machine | E-Z Systems | EZ-108SA | |
| Soldering Station | Weller | WES51 | |
| SureOne Filter Pipette Tips | Fisherbrand | 02-707-478 | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 04019862 | |
| Tissue Forceps | Ted Pella | 13220 | |
| Tubing Flow System | Transonic | TS410 |
Referencias
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci. 26 (41), 10380-10386 (2006).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nat Rev Cardiol. 18, 349-367 (2021).
- Ambrosi, C. M., Klimas, A., Yu, J., Entcheva, E. Cardiac applications of optogenetics. Prog Biophys Mol Biol. 115 (2-3), 294-304 (2014).
- Pinol, R. A., Bateman, R., Mendelowitz, D. Optogenetic approaches to characterize the long-range synaptic pathways from the hypothalamus to brain stem autonomic nuclei. J Neurosci Meth. 210 (2), 238-246 (2012).
- Zeng, H., Madisen, L. Mouse transgenic approaches in optogenetics. Prog Brain Res. 196, 193-213 (2012).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods. 14 (4), 381-392 (1998).
- Hedrick, T., et al. Characterization of channelrhodopsin and archaerhodopsin in cholinergic neurons of Cre-lox transgenic mice. PLoS One. 11 (5), 1-15 (2016).
- Moreno, A., et al. Sudden heart rate reduction upon optogenetic release of acetylcholine from cardiac parasympathetic neurons in perfused hearts. Front Physiol. 10, 1-11 (2019).
- Habecker, B. A., et al. Molecular and cellular neurocardiology in heart disease. J Physiol. , (2024).
- Wengrowski, A. M., et al. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovas Res. 105 (2), 143-150 (2015).
- Williams, J. C., et al. Computational optogenetics: empirically-derived voltage- and light-sensitive channelrhodopsin-2 model. PLoS Comput Biol. 9 (9), e1003220 (2013).
- Moreno, A., Kowalik, G., Mendelowitz, D., Kay, M. W. Optogenetic control of cardiac autonomic neurons in transgenic mice. Meth Mol Biol. 2191, 309-321 (2021).
- Einthoven, W., Fahr, G., de Waart, A. On the direction and manifest size of the variations of potential in the human heart and on the influence of the position of the heart on the form of the electrocardiogram. Am Heart J. 40 (2), 163-211 (1950).
- Giles, A. V., et al. Paradoxical arteriole constriction compromises cytosolic and mitochondrial oxygen delivery in the isolated saline-perfused heart. Am J Physiol Heart Circ Physiol. 315 (6), H1791-H1804 (2018).
- Wallick, D. W., Martin, P. J., Masuda, Y., Levy, M. N. Effects of autonomic activity and changes in heart rate on atrioventricular conduction. Am J Physiol. 243 (4), H523-H527 (1982).
- Entcheva, E. Cardiac optogenetics. Am J Physiol Heart Circ Physiol. 304 (9), H1179-H1191 (2013).
- Wang, L., et al. Cardiac sympathetic nerve transdifferentiation reduces action potential heterogeneity after myocardial infarction. Am J Physiol Heart Circ Physiol. 318 (3), H558-H565 (2020).
- Shattock, M. J., Tipton, M. J. Autonomic conflict: a different way to die during cold water immersion. J Physiol. 590 (14), 3219-3230 (2012).
- Sacconi, L., et al. KHz-rate volumetric voltage imaging of the whole Zebrafish heart. Biophys Rep. 2 (1), 100046 (2022).
- Asfour, H., Swift, L. M., Sarvazyan, N., Doroslovacki, M., Kay, M. W. Signal decomposition of transmembrane voltage-sensitive dye fluorescence using a multiresolution wavelet analysis. IEEE Trans Biomed Eng. 58 (7), 2083-2093 (2011).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. Eur Heart J. 38 (27), 2132-2136 (2017).
- Ripplinger, C. M., et al. Guidelines for assessment of cardiac electrophysiology and arrhythmias in small animals. Am J Physiol Heart Circ Physiol. 323 (6), H1137-H1166 (2022).
- Swift, L. M., Kay, M. W., Ripplinger, C. M., Posnack, N. G. Stop the beat to see the rhythm: excitation-contraction uncoupling in cardiac research. Am J Physiol Heart Circ Physiol. 321 (6), H1005-H1013 (2021).
- Asfour, H., et al. NADH fluorescence imaging of isolated biventricular working rabbit hearts. J Vis Exp. (65), e4115 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados