Method Article
عزل الكائنات الحية الدقيقة في التربة باستخدام تقنية iChip
In This Article
Summary
تستخدم تقنية iChip جهاز عزل غير مكلف وبسيط في الموقع يزيد من معدلات اكتشاف الكائنات الحية الدقيقة الجديدة من التربة. يمكن استخدام الكائنات الحية الدقيقة الجديدة لمزيد من الدراسة المتعلقة بميكروبيوم التربة أو اكتشاف المنتجات الطبيعية ، من بين تطبيقات أخرى.
Abstract
تستخدم تقنية عزل iChip جهاز عزل في الموقع يزيد من قابلية زراعة الكائنات الحية الدقيقة غير القابلة للزراعة سابقا. الكائنات الحية الدقيقة هي مصدر مهم للكيمياء الجديدة والجزيئات النشطة بيولوجيا. ومع ذلك ، يمكن استزراع 1٪ فقط من الكائنات الحية الدقيقة البيئية باستخدام الطرق المختبرية التقليدية. مع ارتفاع مقاومة مضادات الميكروبات ، فإن العثور على أدوية جديدة لمكافحة العدوى والأمراض أمر في غاية الأهمية ، والطريقة الحاسمة لاكتشاف جزيئات جديدة هي اكتشاف كائنات دقيقة جديدة. من خلال احتضان مستعمرات الكائنات الحية الدقيقة في التربة في آبار صفيحة مكونة من 96 بئرا ، مختومة بغشاء شبه منفذ ومحضنة فوق التربة ، تكون الميكروبات على اتصال بالمياه وعوامل النمو من التربة ، مما يسمح بعزل الميكروبات الجديدة في بيئة معملية. بعد فترة من التدجين في iChip ، يمكن زراعة الكائنات الحية الدقيقة على الوسائط التقليدية واستخدامها لمزيد من الدراسة. هذا الجهاز ذو قيمة لاكتشاف الجزيئات النشطة بيولوجيا وأبحاث ميكروبيوم التربة وقد تم استخدامه سابقا في كلا التطبيقين.
Introduction
البكتيريا البيئية هي مصدر غني للمنتجات الطبيعية (NPs)1. هذه المستقلبات ليست حيوية لبقاء الكائنات الحية الدقيقة ولكن بدلا من ذلك يتم إنتاجها لتسهيل استعمارها من خلال التغلب على الكائنات الحية الدقيقة الأخرى في محيطها2. قام التطور بضبط الهياكل الكيميائية وأنشطة NPs ، مما يجعلها عوامل فعالة مضادة للميكروبات. مثل هذا المثال هو دابتومايسين ، وهو مضاد حيوي وافقت عليه إدارة الغذاء والدواء الأمريكية في عام 20033. في السنوات الأخيرة ، زادت مقاومة الميكروبات من حيث الحدوث والشدة ، وتعتبر الأدوية الجديدة مثل دابتومايسين علاجات الخط الأخير ضد العدوى التي طورت مقاومة للمضادات الحيويةالقديمة 4. يعد تطوير مضادات حيوية جديدة وأدوية أخرى أمرا ضروريا للحفاظ على قابلية علاج العدوى والأمراض الشائعة.
على الرغم من أن NPs غالبا ما تصنع خيوطا دوائية جيدة ، إلا أن صناعة الأدوية تحولت إلى طرق اصطناعية لاكتشاف الأدوية بعد العصر الذهبي للمضادات الحيوية في الخمسينيات إلى الستينيات5. بحلول السبعينيات ، استمرت نفس الكائنات الحية الدقيقة والمستقلبات المضادة للميكروبات في إعادة عزلها بشكل متكرر ، مع اكتشاف عدد أقل وأقل من الأدوية الجديدة المرشحة1،6. يحتوي ميكروبيوم التربة على تنوع ميكروبي كبير ، ولكن لا يمكن عزل سوى عدد قليل من الكائنات الحية الدقيقة في ظل ظروف المختبر التقليدية. لا يتم ملاحظة الغالبية العظمى من الكائنات الحية الدقيقة في التربة من الكائنات الحية الدقيقة التي تم اكتشافها بواسطة علم الجينوم عند استزراعها باستخدام طرق الاستزراع التقليدية ، مما يؤدي إلى صياغة المشكلة "شذوذ عدد الصفائح العظيمة"7. تسمى هذه الميكروبات غير القابلة للزراعة بالمادة المظلمة الميكروبية كما هو معروف بوجودها ولكن لا يمكن دراستها في المختبر حتى يمكن عزلها كثقافات نقية. من المحتمل أن تنتج هذه الكائنات الحية الدقيقة غير القابلة للزراعة ثروة من الأدوية المرشحة ، وهو أمر ذو أهمية كبيرة في عصر المقاومة الميكروبية.
تقنية iChip هي إحدى الطرق التي يمكن استخدامها لزيادة استعادة الكائنات الحية الدقيقة الجديدة من البيئة8،9. تساعد هذه التقنية في محاكاة البيئة الطبيعية للبكتيريا أثناء الحضانة ، وبالتالي زيادة قابلية زراعة الكائنات الحية الدقيقة التي لا يمكنها البقاء على قيد الحياة في ظروف المختبر التقليدية10. تم بالفعل تطوير رقائق iChips المعدلة واستخدامها لعزل الكائنات الحية الدقيقة من العديد من المصادر المختلفة ، مثل التربة والرواسب والبيئات البحرية وأمعاء11،12،13،14،15،16. ربما كانت الحالة الأكثر تأثيرا لاستخدام هذه التكنولوجيا هي من قبل NovoBiotic Pharmaceuticals ، حيث تم اكتشاف بكتيريا جديدة ، Eleftheria terrae ، 17. تم العثور على هذه الكائنات الحية الدقيقة لإنتاج Teixobactin ، وهو مضاد حيوي من فئة جديدة ، والذي يثبط العديد من الأنواع البكتيرية المقاومة ذات الصلة بصحة الإنسان دون اكتشاف تطورالمقاومة 5،18. كان هذا اكتشافا مؤثرا لأن Teixobactin هو أول فئة جديدة من المضادات الحيوية التي تم اكتشافها منذ عقود وهي علامة على أن هذه التقنية هي طريق واعد لاكتشافات الأدوية الجديدة والتغلب على شذوذ عدد الصفائحالكبير 19. هنا ، يتم تقديم iChip معدل بناء على منشور سابق من قبل Berdy et al. تم تقديمه والذي تم تحسينه لسهولة الاستخدام ومنع التلوث9.
Protocol
1. إعداد وتعقيم الوسائط
- تحضير وتعقيم وسائط الأملاح السكسينات الدنيا (SMS) ، والتي تتكون من 0.1 غرام من نشا البطاطس ، و 1 غرام من أحماض الكازامينات ، و 0.125 غرام من هضم الكازين ، و 15 جم من الأجار البكتريولوجي أو التقني في 1 لتر من الماء.
- تعقيم الأوتوكلاف الوسائط و 100 مل من الماء الجزيئي باستخدام دورة سائلة مدتها 20 دقيقة و 121 درجة مئوية.
ملاحظة: تأكد من شراء جميع العناصر الأخرى التي ستلامس خليط خلايا الأجار معقمة، بما في ذلك أطراف الماصة وأنابيب الطرد المركزي، وإلا فقم بالتعقيم أيضا.
2. تعديل بناء iChip
- قم بإزالة قيعان الآبار في أربعة ألواح سعة 96 بئرا باستخدام أداة ثقب أجار 5 مم.
- قطع أغشية البولي كربونات 0.05 ميكرومتر إلى مستطيلات 7.6 سم × 11 سم ، أو تساوي أبعاد الجزء السفلي من اللوحة المكونة من 96 بئر.
- باستخدام مادة مانعة للتسرب من السيليكون ، قم بلصق أغشية البولي كربونات 0.05 ميكرومتر في قاع الألواح المكونة من 96 بئرا ، مما يضمن أن المادة اللاصقة تغلق الآبار ، ولكنها لا تغطي فتحات الآبار بالكامل. اتركه يجف لمدة 24 ساعة على الأقل أو باتباع التعليمات الموجودة على المادة اللاصقة.
ملاحظة: يجب أن يكون مانع التسرب مقاوما للماء وغير سام وسيليكون بنسبة 100٪. ستعمل معظم مانعات التسرب لأحواض السمك بشكل جيد.
3. تحضير معلقات الخلية
- قم بتسمية أربعة أنابيب طرد مركزي سعة 15 مل من A-D وأربعة أنابيب طرد مركزي سعة 50 مل EH وأضف 4.5 مل من الماء المعقم إلى كل منها.
- قم بقياس 1 جم من التربة في أنبوب طرد مركزي سعة 50 مل ، وأضف 10 مل من الماء المعقم ، ودوامة لمدة 10 دقائق.
- دع تعليق التربة يستقر لمدة 10 دقائق.
- ماصة 0.5 مل من الخلايا الطافية المحتوية على التربة في الأنبوب A وتخلط جيدا.
- أضف 0.5 مل من تعليق الخلية في الأنبوب A إلى الأنبوب B واخلطه جيدا. انقل 0.5 مل من المحلول B إلى الأنبوب C واخلطه جيدا. كرر هذا مع جميع أنابيب الطرد المركزي المتبقية ، مع استكمال سلسلة من التخفيفات بمقدار 10 أضعاف عبر أنابيب أجهزة الطرد المركزي الثمانية.
- قم بإزالة 0.5 مل من الأنبوب H ليكون حجمه متساويا في جميع الأنابيب.
ملاحظة: تم تحسين هذه التركيزات للتربة المحلية. عند محاولة هذا الإجراء لأول مرة ، قم بإجراء مجموعة أكبر من التخفيفات للعثور على تركيز العينة المناسب.
4. تعديل تلقيح iChip
- اغمر iChips تماما في 95٪ من الإيثانول لمدة 15 دقيقة على الأقل.
- قم بإزالة الأطباق من الإيثانول وضعها على منشفة ورقية معقمة. أثناء السماح للإيثانول بالتبخر ، قم بتشغيل معقم الأشعة فوق البنفسجية في غطاء التدفق الرقائقي لمدة 15 دقيقة لتعقيمها بشكل أكبر.
- ماصة 360 ميكرولتر من وسائط الرسائل القصيرة المعقمة في العمود الأول من اللوحة لتكون بمثابة آبار تحكم.
- أضف 45 مل من الرسائل القصيرة المبردة إلى 50 درجة مئوية إلى تعليق الخلية في الأنبوب E واخلطها جيدا لدمج تعليق الخلية والأجار.
- الماصة 360 ميكرولتر من خليط خلايا الأجار من الخطوة 4.4 إلى جميع الآبار الأخرى في الصفيحة المكونة من 96 بئرا.
ملاحظة: يوصى باستخدام ماصة متعددة القنوات حيث يتجمد أجار بسرعة. لا ينصح بإعادة تسخين خليط خلايا الأجار بمجرد خلطه بسبب خطر قتل الكائنات الحية الدقيقة. - بمجرد ضبط الوسائط ، أغلق الجزء العلوي من الألواح بغطاء لوحة PCR.
- كرر الخطوات من 3.3 إلى 3.6 باستخدام أنابيب FH لملء ما مجموعه أربع رقائق iChips باختلافات عشرة أضعاف في التركيزات.
ملاحظة: يمكن تسخين الوسائط في الميكروويف لمدة 30 ثانية بغطاء مفكك عند الحاجة أو حفظها في حمام ماء ساخن 60 درجة مئوية بين الألواح لضمان بقائها منصهرة لكل منها.
5. الحضانة
- ضع الألواح في صندوق يحتوي على ما يقرب من بوصة واحدة من التربة المستخدمة في الخطوة 3.2 ، بحيث يكون جانب الغشاء لأسفل وضع الغطاء.
- احتضان الألواح في الحاوية المغطاة في مكان مظلم عند 25 درجة مئوية.
ملاحظة: بعد أسبوع واحد ، افحص محتويات iChips المعدلة للتأكد من عدم حدوث تلوث أثناء الإعداد. يشار إلى التلوث من خلال فرط نمو كائنات دقيقة واحدة أو عدد قليل منها في جميع آبار اللوحة. - بعد 6 أسابيع ، افحص iChips. استخدم الألواح التي تحتوي على نمو في أقل من 25٪ من الآبار لعزل المستعمرة.
6. عزلة المستعمرة
- اشطف رقائق iChips المعدلة 3x بالماء المعقم لإزالة جميع جزيئات التربة.
- امسح الجزء العلوي والجوانب من اللوحة بنسبة 95٪ من الإيثانول ، وتجنب الجانب الذي يحتوي على الغشاء شبه النفاذ.
- باستخدام شفرة معقمة ، قم بقطع غطاء اللوحة حول بئر واحد يحتوي على مستعمرة.
- باستخدام أداة خطوط معقمة ، اخترق المستعمرة وخطها على أجار SMS في ألواح 100 × 15 مم باستخدام طريقة الأرباع.
- كرر ذلك لجميع المستعمرات الأخرى في iChips التي تنمو مستعمرة واحدة لكل بئر.
ملاحظة: بالنسبة للمستعمرات الصغيرة ، يمكن إعادة وضع اللوحة مرة أخرى على التربة وتحضينها حتى تصبح كبيرة بما يكفي للزراعة الفرعية طالما لم تتم إزالة غطاء الصفيحة حول البئر. - احتضان لوحات الرسائل القصيرة عند 25 درجة مئوية ومراقبة النمو.
- افحص المستعمرات للتأكد من عزل الثقافات المحورية.
7. تحديد الكائنات الحية الدقيقة
- تسلسل جينومات العزلات تعافى20.
- قم بتقييم الجينومات باستخدام JSpeciesWS أو منصة تعريف أخرى قائمة على الجينوم لتحديد درجة تشابه كل عزلة مع الكائنات الحية الدقيقة المعروفة في GenomesDB.
- تصنيف العزلات تحت العتبات المقبولة من المجتمع لتحديد الأنواع على أنها جديدة مفترضة.
النتائج
تظهر نظرة عامة مرئية على البروتوكول في الشكل 1. ينتج عن تجربة iChip المعدلة الناجحة صفيحة واحدة على الأقل تحتوي على نمو في أقل من 25٪ من الآبار ، مع عدم حدوث نمو في آبار التحكم. يضمن هذا العدد من الآبار ذات النمو بشكل عام عزل المستعمرات الفردية في الآبار. بالإضافة إلى ذلك ، يجب أن ينخفض عدد المستعمرات ، أو عدد الآبار التي تحتوي على مستعمرات ، عشرة أضعاف مع كل صفيحة لاحقة محضرة من سلسلة التخفيفات. النتائج التمثيلية موضحة في الشكل 2. حيث تكون الألواح 7 و 8 من رقائق iChips ناجحة حيث تحتوي على نمو في أقل من 25٪ من الآبار ، وتقل نسبة الآبار التي تحتوي على مستعمرات مع كل لوحة ، كما هو موضح في الجدول 1. إذا كانت جميع الصفائح في التجربة تحتوي على أكثر من مستعمرة واحدة لكل بئر أو لا توجد مستعمرات في أي آبار ، فهذا يشكل نتيجة سلبية.
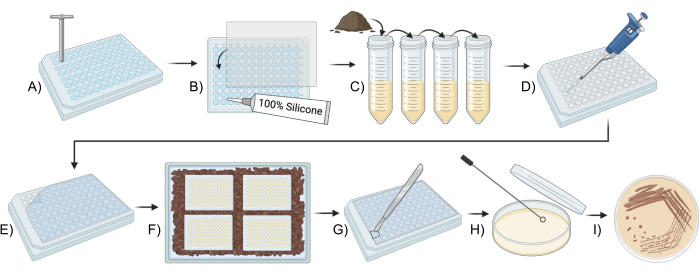
الشكل 1: نظرة عامة تخطيطية لاستخدام iChip معدل لزراعة ميكروبات التربة. (أ ، ب) بناء اللوحة (الخطوة 2). (ج) تحضير اللقاح (الخطوة 3). (D,E) إعداد iChip (الخطوة 4). (و) حضانة iChip (الخطوة 5). (G-I) نقل العزلات إلى الوسائط التقليدية (الخطوة 6). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| إيتشيب | تركيز التربة في تعليق أجار | آبار مع مستعمرات | وحدات تشكيل المستعمرات |
| E | 5.0 × 10-6 جم / مل | كل | كثيرة جدا لا يمكن عدها |
| F | 5.0 × 10-7 جم / مل | كل | كثيرة جدا لا يمكن عدها |
| G | 5.0 × 10-8 جم / مل | 22 | 22 |
| H | 5.0 × 10-9 جم / مل | 6 | 6 |
الجدول 1: بيانات تمثيلية من تجربة iChip ناجحة حيث يتناقص عدد الآبار التي تحتوي على مستعمرات مع كل تخفيف في سلسلة.
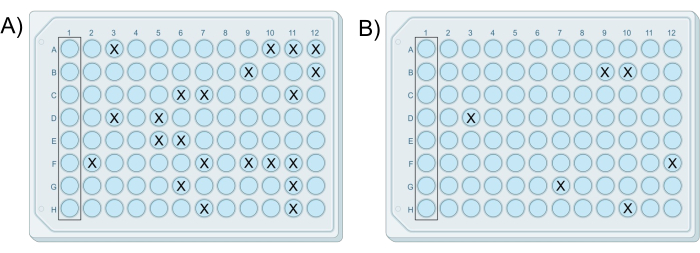
الشكل 2: نتائج نموذجية لاثنين من رقائق iChips المعدلة الناجحة. كانت iChips من نفس التجربة التي (أ) تحتوي اللوحة المحضرة من خليط الخلية والخلية G على 22 مستعمرة ، و (ب) تحتوي اللوحة المحضرة من خليط الخلية وأغار H على ست مستعمرات ، بما يتفق مع فرق التخفيف البالغ 10 أضعاف بين المخاليط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن للمرء أن يتخيل المستعمرات بالعين المجردة أو الفحص المجهري ، كما هو موضح في الشكل 3A-G. قد تنمو المستعمرات على سطح الأجار ، كما هو موضح في الشكل 3 ب أو مدمجة في الأجار ، مثل المستعمرة في الشكل 3F. قد تكون هناك حالات يوجد فيها مستعمرتان في نفس البئر في رقاقة iChip معدلة ناجحة ، كما هو الحال في الشكل 3G. في بعض الحالات ، تكون المستعمرات متباعدة بما يكفي بحيث يمكن ثقبها بإبرة بشكل منفصل ومستقرة فرعية. ومع ذلك ، فمن غير المحتمل أن يتم استزراع تلك الموجودة في الشكل 3G بسهولة ككائنات دقيقة محورية. يتم عرض أمثلة على المستعمرات المنقولة من iChip إلى وسائط الرسائل القصيرة التقليدية في الشكل 4.
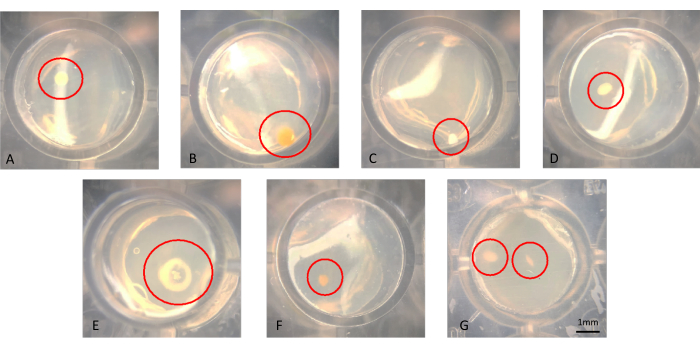
الشكل 3: منظر مجهري تمثيلي للمستعمرات التي تنمو في iChip بعد 6 أسابيع من الحضانة. (A-F) لوحظت مستعمرات مفردة ، والتي يجب أن يتم زراعتها من ، وفي (G) لوحظت مستعمرتين على مقربة ، والتي يصعب الحصول عليها كثقافات محورية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
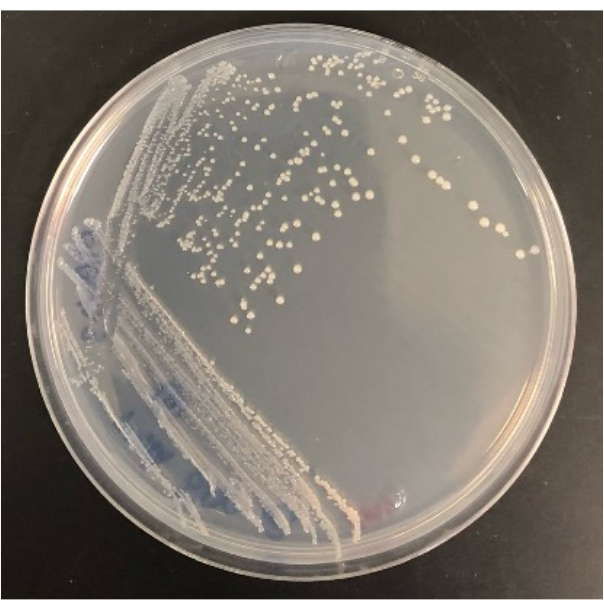
الشكل 4: نتيجة تمثيلية لبكتيريا معزولة من iChip المعدلة بمجرد نموها على لوحة أجار SMS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحدد القدرة على عزل المستعمرات من iChip المعدلة على ألواح الأجار التقليدية أيضا نجاح التجربة. لن تنجو جميع المستعمرات التي تنمو في iChip المعدلة من الانتقال إلى الألواح التقليدية. في iChip ، تتعرض المستعمرات لعوامل النمو ومغذيات التربة ، مما يزيد من قابليتها للزراعة. بالنسبة لبعض الكائنات الحية الدقيقة ، لا تكفي فترة التدجين لجعلها قابلة للزراعة في الظروف التقليدية. يختلف معدل استرداد المستعمرات من iChip إلى الألواح من تجربة إلى أخرى ، ولكن يجب أن ينمو بعضها في لوحات لأن هذه الطريقة ستزرع أيضا الكائنات الحية الدقيقة القابلة للزراعة بسهولة. على سبيل المثال ، احتوت iChips المعدلة في الشكل 2 على 28 مستعمرة في المجموع ، وكان عدد المستعمرات التي نمت على ألواح أجار بعد الزراعة الفرعية 16 مستعمرة ، بينما لم تنجو 12 من النقل. يمكن تحديد العزلات واستخدامها لمزيد من الدراسة بمجرد زراعتها على ألواح أجار كاملة الحجم ، كما هو موضح في الشكل 4.
يجب أن تؤدي تجربة iChip المعدلة الناجحة إلى عزل الكائنات الحية الدقيقة التي تختلف عن الكائنات الحية الدقيقة المعروفة على مستوى الأنواع. تم العثور على درجة تشابه كل عزلة مع الكائنات الحية الدقيقة المعروفة من خلال مقارنة الحمض النووي المعزول بجينومات الكائنات الحية الدقيقة المعروفة. تصف درجات tetra Z لأقرب الكائنات الحية الدقيقة ذات الصلة بكل عزلة النسبة المئوية للتشابه. يوضح الشكل 5 أنه من بين البكتيريا الاثني عشر المعزولة ، كانت أربعة أنواع جديدة أو أعلى ، ومن المحتمل أن تكون اثنتان سلالات جديدة ، وستة كائنات دقيقة معروفة. يتوافق استرداد العديد من الأنواع أو السلالات الجديدة مع تجارب iChip المنشورة سابقا ، مما يشير إلى أن بناء iChip المعدل هذا لا يعيق الزيادة في استعادة الأنواع الجديدة11.
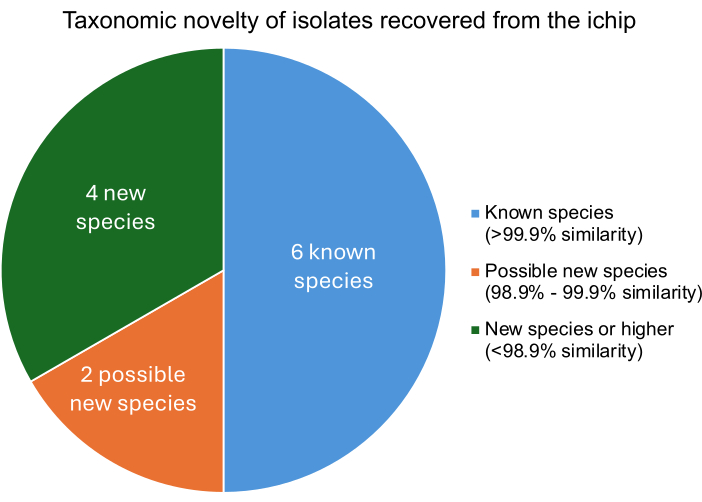
الشكل 5: مستوى التصنيف التصنيفي للعزلات المستردة من تجربة iChip. تم تحديد التشابه بنسبة مئوية بناء على درجات tetra Z ، والتي تصف تشابه العزلات مع البكتيريا المعروفة حيث يشير التشابه >99.9٪ إلى تطابق الأنواع ، ويشير التشابه بنسبة 98.9٪ -99.9٪ إلى نوع جديد محتمل ، ويشير التشابه <98.9٪ إلى نوع جديد أو أعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
سهلت العديد من الطرق ، مثل تعدين الجينوم وفحص مسارات التخليق الحيوي الصامتة ، اكتشاف مواد كيميائية نشطة بيولوجيا جديدة في السنوات الأخيرة21،22. ومع ذلك ، فإن NPs المكتشفة باستخدام مثل هذه الأساليب غالبا ما تظهر تشابها هيكليا كبيرا مع المركبات المعروفة. سيؤدي الوصول إلى الكائنات الحية الدقيقة غير المستزرعة سابقا إلى فتح قدر أكبر من التنوع الكيميائي و NPs بطرق عمل جديدة يمكن أن تساعد بشكل أفضل في مكافحة المقاومة الميكروبية. لقد ثبت أن تقنية عزل iChip تزيد من قابلية زراعة الكائنات الحية الدقيقة الجديدة ، والتي يمكن استخدامها لبناء مكتبات من الكائنات الحية الدقيقة لاكتشاف NPs الجديدة.
تم نشر أقدم تصور ل iChip في عام 2002 ، والذي يتكون من حلقات معدنية مفردة تحتوي على خليط خلية أجار مختوم بأغشية شبه منفذة ومحتضن في الموقع23. تم تكراره لاحقا في عام 2010 لاحتواء شريحة صغيرة بها العديد من الآبار11 ، تلاه تطوير iChip غير مكلف تم إنشاؤه من مواد مختبرية شائعة في منشور بروتوكولات الطبيعة المؤثر في عام 20179. تم إجراء العديد من التعديلات على بروتوكول Nature في هذا المنشور لتحسين عمليته وسهولة استخدامه. يتضمن بروتوكول Nature لصق غشاء شبه منفذ على جانبي الشريحة مقارنة بهذه الطريقة ، والتي تستخدم غطاء لوحة لاصقة على جانب واحد. قد تنشأ مشكلات عند استخدام غراء السيليكون لربط الغشاء بعد تحميل iChip. على حد علمنا ، تنبعث جميع المواد اللاصقة المصنوعة من السيليكون غير السامة حمض الأسيتيك عند ضبطها ، مما قد يؤثر على بقاء الخلية24. يقلل البروتوكول الموضح في هذا الفيديو أيضا بشكل كبير من مقدار المعالجة المطلوبة بعد التلقيح باستخدام غطاء لوحة PCR لإغلاق اللوحة المملوءة ، مما يضمن العقم ويقلل من وقت الإعداد. بناء على تحديد العديد من العزلات الجديدة من هذه التجربة ، فإن استخدام غشاء واحد فقط شبه منفذ يمنع الزيادة في معدلات اكتشاف الكائنات الحية الجديدة التي تم الإبلاغ عنها ل iChips التي تم إنشاؤها باستخدام غشاءين شبه منفذين. ومع ذلك ، ستكون هناك حاجة إلى مزيد من التجارب بحجم عينة أكبر لتحديد التأثير.
تعديل طريقة أخرى هو الاستزراع الفرعي فقط من رقائق iChips المعدلة التي تحتوي على نمو في أقل من 25٪ من الآبار. إذا نمت المستعمرات في غالبية آبار الصفيحة ، فمن المحتمل أن تكون هناك بعض الآبار التي تحتوي على كائنات دقيقة متعددة ، حتى لو لم تكن مرئية بسهولة. أثناء تطوير الطريقة ، وجد أنه كان من المستحيل إلى حد كبير الحصول على ثقافات محورية عند الزراعة الفرعية من الآبار التي تحتوي على أكثر من مستعمرة واحدة. يمثل عزل الثقافات غير المحورية مشكلات كبيرة في اتجاه مجرى النهر من حيث فحوصات النشاط الحيوي وتحديده. وبالتالي ، من أجل البساطة ، يوصى فقط بزراعة رقائق iChips المعدلة مع المستعمرات التي تنمو في جزء من الآبار.
أهم مشكلة يمكن أن تنشأ مع طرق iChip هي تلوث الآبار أو رقائق iChip بأكملها بالكائنات الحية الدقيقة الأخرى. يشار إلى التلوث من خلال المستعمرات التي تنمو في آبار التحكم ، أو نفس الكائنات الحية الدقيقة التي تنمو عبر عدة آبار أو منطقة كاملة من iChip المعدلة. قد يكون مصدر التلوث بسبب التعقيم غير الكافي للمواد أثناء الإعداد ، أو تقنية التعقيم غير المناسبة. في مثل هذه الحالات ، تأكد من تعقيم جميع المواد المستخدمة بالأوتوكلاف أو الإيثانول كما هو موضح في الطريقة ، وتأكد من عدم حدوث أي اتصال بين أي عناصر غير معقمة و iChip المعدل بخلاف خليط خلايا أجار. إذا لوحظ فرط نمو كائنات دقيقة واحدة في أسفل أو أعلى آبار iChip المعدلة المتعددة ، فمن المرجح أن يكون ذلك نتيجة لختم غير مكتمل بين الآبار والغشاء. في هذه الحالة ، تأكد من أن المادة اللاصقة المستخدمة مصنوعة من السيليكون بنسبة 100٪ ، والتي لا تتحلل في الإيثانول ، وتأكد من إغلاق الغشاء شبه المنفذ وغطاء لوحة PCR تماما حول كل بئر أثناء البناء.
يجب أن توفر سلسلة التخفيف المستخدمة في البروتوكول الحالي تخفيفا مناسبا لمعظم أنواع التربة مع فترة تخزين أقل من أسبوع واحد لأنها تتضمن مجموعة من التخفيفات ألف ضعف. ومع ذلك ، يمكن أن يكون هناك تباين كبير في عدد الكائنات الحية الدقيقة بين أنواع التربة. إذا لم تحتوي آبار التحكم على نمو ولكن تنمو مستعمرات متعددة في كل بئر من جميع رقائق iChips الأربعة المعدلة ، فإن تركيزات الخلايا المستخدمة لم تكن منخفضة بما فيه الكفاية. يجب تعديل سلسلة التخفيف للوصول إلى تركيزات أقل للخلايا في مخاليط الوسائط الخلوية المستخدمة لإعداد iChips المعدلة. وبالمثل ، إذا لم يلاحظ أي نمو في أي من هذه الألواح ، فيجب زيادة التركيزات المستخدمة في مخاليط وسائط الخلية. بدلا من ذلك ، من الممكن أن تكون درجة حرارة الوسائط المستخدمة مرتفعة جدا لبقاء الكائنات الحية الدقيقة. في مثل هذه الحالة ، يجب السماح للوسائط بالتبريد قدر الإمكان دون التصلب قبل إضافتها إلى تعليق الخلية المخفف.
تعد التكنولوجيا تقدما مهما نحو التغلب على شذوذ عدد الألواح الكبير. ومع ذلك ، فإنه لا يزال محدودا بسبب عدم ملاءمة تقنيات الاستزراع التقليدية ، كما يتضح من عدد الكائنات الحية الدقيقة التي لا تنجو من النقل من iChip المعدلة إلى ألواح الأجار التقليدية. ذكرت المنشورات السابقة أن جولات متعددة من الزراعة الفرعية والحضانة في iChips تزيد من قابلية زراعة الكائنات الحية الدقيقة. يزيد وقت التدجين الممتد والتعرض لعوامل نمو التربة أثناء التواجد في أجار في iChip من فرص نمو المستعمرة على الأجار وحده. ومع ذلك ، لم يتم الإبلاغ عن هذا النهج لإنتاج احتمالية أكبر للكائنات الحية الدقيقة الجديدة من حضانة iChipواحدة 25،26.
يتم استكشاف العديد من التكتيكات الأخرى وتعديلها لزيادة قابلية زراعة الكائنات الحية الدقيقة الجديدة. على سبيل المثال ، تم اقتراح صنع جهاز iChip كامل من مادة شبه منفذة لتسهيل الزراعة المشتركة للكائنات الحية الدقيقة في الآبار المجاورة27. ومع ذلك ، فإن ميزة البناء الموضحة في هذا المنشور هي تكلفته المنخفضة حيث تبلغ تكلفة بناء لوحة واحدة ما يقرب من 12 دولارا (4 دولارات لكل لوحة 96 بئرا ، و 8 دولارات لكل غشاء ، و 2 دولار لكل غطاء PCR). علاوة على ذلك ، فإن بنائها البسيط يجعلها أداة غير معقدة عند استخدامها كما هو موضح وتوفر العديد من الاحتمالات للتخصيص. على الرغم من أن هذا البروتوكول يستخدم وسيطا انتقائيا للبكتيريا ، إلا أنه يمكن نظريا ضبط الإعداد التجريبي لاستهداف مجموعة ميكروبية مطلوبة عن طريق تعديل الوسيط المستخدم ، مثل استخدام وسائط قمع البكتيريا لاستهداف الفطريات ، أو أجار منخفض المغذيات لتكاثر الكائنات الحية الدقيقة.
Disclosures
أعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نعرب عن امتناننا لتمويل قاعدة J (J-001757 ، J-001842) المقدم من خلال الزراعة والأغذية الزراعية الكندية ، مما جعل هذا المشروع ممكنا. نشكر بريت فان هاينينجن على تصوير محتوى الفيديو لهذا البروتوكول. نود أيضا أن نشكر Ron Matters على جمع عينات التربة المستخدمة في التجارب الموضحة في هذا المنشور.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1-20 µL pipette tips | VWR | 76322-158 | Pack of 768 |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0337 | Case of 1000 |
| 0.5-5 mL single channel pipette | VWR | CA11020-004 | |
| 1 L glass bottle | Millipore Sigma | CLS13951L | Must be autoclaveable. |
| 100 x 15 mm Petri plates | VWR | 25384-342 | Case of 500 |
| 100% Silicone sealant | Marineland | 31003 | |
| 1000 µL multichannel pipette tips | ThermoFisher Scientific | 9401113 | Case of 960 |
| 100-1000 µL pipette tips | VWR | 76322-164 | Pack of 768 |
| 100-1000 µL single channel pipette | VWR | 76169-240 | |
| 100-1200 µL multichannel pippette | ThermoFisher Scientific | 46300800 | Must have 360 µL volume capacity. |
| 1-10 µL single channel pipette | VWR | 76169-232 | |
| 1-5 mL pipette tips | VWR | CA11020-008 | Pack of 500 |
| 15 mL sterile centrifuge tubes | VWR | CA21008-918 | Case of 500 |
| 16s rRNA-F primer (AGAGTTTGATCCTGGCTCAG) – 10mM | Integrated DNA Technologies | 51-01-19-06 | 10 µg |
| 16s rRNA-R primer (ACGGCTACCTTGTTACGACTT) – 10mM | Integrated DNA Technologies | 51-01-19-07 | 10 µg |
| 4 mm cork borer | VWR | 470121-860 | |
| 50 mL sterile centrifuge tubes | VWR | CA21008-940 | Case of 500 |
| 95% ethanol | Thermo Fisher Scientific | A412-500 | 500 mL |
| 96-well plate | VWR | 10062-900 | Case of 100 |
| Autoclave | Cole-Parmer | UZ-01850-34 | 8 L, 115 VAC |
| Bacteriological agar | ThermoFisher Scientific | 443570010 | 1 kg |
| bin | Thomas Scientific | 1216H91 | 5 bins per pack |
| Casamino acids | ThermoFisher Scientific | 223120 | 500 g |
| Casein digest | ThermoFisher Scientific | 211610 | 500 g |
| Electrofluoresis grade agarose | Thermo Fisher Scientific | J66501.30 | 250 g |
| iBright FL1500 Imaging System | ThermoFisher Scientific | A44115 | |
| Laminar flow hood | CleanTech | 1000-6-A | |
| Minion Nanopore Sequencer | Oxford Nanopore Technologies | MinIon Mk1C | |
| NanoDrop One/One Microvolume UV-Vis Spectrophotometer | ThermoFisher Scientific | ND-ONE-W | |
| Nuclease Free Water | Thermo Fisher Scientific | AM9937 | 10 x 50 mL |
| Nucleobond HMW DNA kit | Takara | 740160.2 | |
| Paper towel | VWR | 89402-824 | |
| Phusion Green Hot Start II High-Fidelity PCR Master Mix | Thermo Fisher Scientific | F566L | 500 Reactions |
| Potato starch | ThermoFisher Scientific | 419690025 | 2.5 kg |
| QIAGEN CLC Genomics Workbench Software or similar | Qiagen | ||
| Rapid Barcoding 24 Kit | Oxford Nanopore Technologies | SQK-RBK114.24 | |
| SimpliAmp thermal cycler | Applied Biosystems | A24811 | |
| Sterile Inoculation loops with needle | VVWR | 76534-512 | Case of 1000 |
| Sterile surgical blade | VWR | 76457-444 | |
| SYBR Safe, or simmilar | ThermoFisher Scientific | S33101 | |
| UltraPure Agarose | ThermoFisher Scientific | 16500-500 | |
| Vortex | VWR | 76549-928 | Must accomadate 15 and 50 mL centrifuge tubes |
| VWR Stereo Zoom Trinocular Microscope | VWR | 89404-476 | |
| Whatman Nuclepore Track-Etched Membranes | Millipore Sigma | WHA113502 | L x W 8 in. x 10 in., pore size 0.03 μm |
References
- Newman, D. J., Cragg, G. M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 83 (3), 770-803 (2020).
- Fouillaud, M., Dufosse, L. Microbial secondary metabolism and biotechnology. Microorganisms. 10 (1), 123 (2022).
- Rizzetto, G., et al. Role of daptomycin in cutaneous wound healing: A narrative review. Antibiotics. 11 (7), 944 (2022).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Gunjal, V., Thakare, R., Chopra, S., Reddy, D. S. Teixobactin: A paving stone toward a new class of antibiotics. J Med Chem. 63, 12171-12195 (2020).
- Atanasov, A. G., Zotchev, S. B., Dirsch, V. M., Supuran, C. T. Natural products in drug discovery: Advances and opportunities. Nat Rev Drug Discov. 20 (3), 200-216 (2021).
- Epstein, S. S. The phenomenon of microbial uncultivability. Curr Opin Microbiol. 16 (5), 636-642 (2013).
- Wright, G. An irresistible newcomer. Nature. 517, 422-444 (2015).
- Berdy, B., Spoering, A., Ling, L., Epstein, S. In situ cultivation of previously uncultivable microorganisms using the ichip. Nat Protoc. 12 (10), 2232-2242 (2017).
- Jung, D., et al. Triggering growth via growth initiation factors in nature: A putative mechanism for in situ cultivation of previously uncultivated microorganisms. Front Microbiol. 12, 537194 (2021).
- Nichols, D., et al. Use of ichip for high-throughput in situ cultivation of "uncultivable" microbial species. Appl Environ Microbiol. 76 (8), 2445-2450 (2010).
- Megaw, J., Kelly, S. A., Thompson, T. P., Skvortsov, T., Gilmore, B. F. Profiling the microbial community of a triassic halite deposit in Northern Ireland: An environment with significant potential for biodiscovery. FEMS Microbiol Lett. 366 (22), fnz242 (2019).
- Vitorino, I., et al. Novel and conventional isolation techniques to obtain planctomycetes from marine environments. Microorganisms. 9 (10), 2078 (2021).
- Moote, P., Polo, R. O., Uwiera, R. R. E., Inglis, G. D. Comparison of strategies for isolation anaerobic bacteria from the porcine intestine. Appl Environ Microbiol. 87 (9), e00088-e00121 (2021).
- Vitorino, I. R., et al. Rhodopirellula aestuarii sp. Nov., a novel member of the genus rhodopirellula isolated from brackish sediments collected in the tagus river estuary, Portugal. Syst Appl Microbiol. 45 (6), 126360 (2022).
- Ding, H., et al. Hanstruepera marina sp. Nov. and Hanstruepera flava sp. Nov., two novel species in the family flavobacteriaceae isolated by a modified in situ cultivation technique from marine sediment. Front Microbiol. 13, 957397 (2022).
- Ling, L. L., et al. A new antibiotic kills pathogens without detectable resistance. Nature. 517 (7535), 455-459 (2015).
- Qi, Y. K., et al. Discovery, synthesis, and optimization of teixobactin, a novel antibiotic without detectable bacterial resistance. J Pept Sci. 28 (11), e3428 (2022).
- Piddock, L. J. Teixobactin, the first of a new class of antibiotics discovered by ichip technology. J of Antimicrob Chemother. 70 (10), 2679-2680 (2015).
- Gong, L., Wong, C. H., Idol, J., Ngan, C. Y., Wei, C. L. Ultra-long read sequencing for whole genomic DNA analysis. J Vis Exp. (145), e58954 (2019).
- Covington, B. C., Xu, F., Seyedsayamdost, M. R. A natural product chemist's guide to unlocking silent biosynthetic gene clusters. Annu Rev Biochem. 90, 763-788 (2021).
- Lee, N., et al. Mini review: Genome mining approaches for the identification of secondary metabolite biosynthetic gene clusters in Streptomyces. Comput Mol Biol. 18, 1548-1556 (2020).
- Kaeverlein, T., Lewis, K., Epstein, S. S. Isolating "uncultivable" microorganisms in pure culture in a simulated natural environment. Science. 296 (5570), 1127-1129 (2002).
- Trcek, J., Mira, N. P., Jarboe, L. R. Adaptation and tolerance of bacteria against acetic acid. Appl Microbiol Biotechnol. 99 (15), 6215-6229 (2015).
- Kurm, V., Van Der Putten, W. H., Hol, W. H. G. Cultivation-success of rare soil bacteria is not influenced by incubation time and growth medium. PLOS One. 14 (1), e0210073 (2019).
- Buerger, S., et al. Microbial scout hypothesis and microbial discovery. Appl Environ Microbiol. 78 (9), 3229-3233 (2012).
- Lodhi, A. F., Zhang, Y., Adil, M., Deng, Y. Antibiotic discovery: Combining isolation chip (ichip) technology and co-culture technique. Appl Microbiol Biotechnol. 102 (17), 7333-7341 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved